SKRIPSI
PENGARUH KOPIGMENTASI PEWARNA ALAMI ANTOSIANIN DARI ROSELA (Hibiscus sabdariffa L.) DENGAN BRAZILEIN DARI KAYU SECANG (Caesalpinia sappan L.) TERHADAP STABILITAS WARNA PADA
MODEL MINUMAN RINGAN
I PUTU GEDE ARYA DHARMAWAN F24052828
2009
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PENGARUH KOPIGMENTASI PEWARNA ALAMI ANTOSIANIN DARI ROSELA (Hibiscus sabdariffa L.) DENGAN BRAZILEIN DARI KAYU SECANG (Caesalpinia sappan L.) TERHADAP STABILITAS WARNA PADA
MODEL MINUMAN RINGAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh:
I PUTU GEDE ARYA DHARMAWAN F24052828
2009
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
I Putu Gede Arya Dharmawan. F24052828. Pengaruh Kopigmentasi Pewarna Alami Antosianin dari Rosela (Hibiscus sabdariffa L.) dengan Brazilein dari Kayu Secang (Caesalpinia sappan L.) terhadap Stabilitas Warna pada Model Minuman Ringan. Di bawah bimbingan Tien R. Muchtadi dan Dede R. Adawiyah. 2009.
RINGKASAN
Pewarna memegang peranan penting dalam meningkatkan daya tarik suatu produk pangan. Penggunaan pewarna sintetis sering kali menimbulkan masalah kesehatan. Keadaan ini menimbulkan keinginan orang-orang untuk kemabli menggunakan pewarna alami yang relatif aman.
Pewarna alami yang potensial dikembangkan adalah antosianin dan brazilein. Kelopak bunga rosela (Hibiscus sabdariffa L.) merupakan sumber pigmen antosianin yang cukup potensial. Menurut (Rayner, 1993) antosianin stabil pada pH 2-5, sehingga aplikasi antosianin sebagai pewarna makanan dan minuman baik digunakan pada pH rendah. Pigmen brazilein merupakan pigmen yang berasal dari kayu secang (Caesalpinia sappan L.). Brazilein merupakan hasil oksidasi dari brazilin. Menurut Adawiyah et al. (2008) pigmen brazilein dari kayu secang memiliki kestabilan warna merah pada pH netral 6-7. Warna merah dari antosianin sangat mudah mengalami degradasi. Kestabilan warna merah dari antosianin dapat dipertahankan dengan kopigmentasi. Kopigmentasi merupakan suatu fenomena yang menyebabkan warna pigmen antosianin menjadi lebih merah, lebih terang, dan lebih stabil. Pada penelitian ini digunakan brazilein sebagai senyawa kopigmen.
Tujuan penelitian ini adalah mempelajari pengaruh kopigmentasi pewarna alami antosianin dari rosela dengan brazilein dari kayu secang terhadap kualitas dan stabilitas warna merah pada model minuman ringan. Penelitian ini terbagi menjadi beberapa tahap meliputi persiapan sampel, pembuatan model minuman ringan, dan pengujian stabilitas warna model minuman ringan terhadap suhu dan sinar UV.
Ekstraksi antosianin dari rosela menggunakan pelarut aquades. Ekstrak yang dihasilkan berwarna merah keunguan. Rendemen ekstrak sebesar 30.84%. Total padatan terlarut ekstrak padat sebesar 72.26% dan ekstrak cair sebesar 22.43%. Total antosianin ekstrak padat sebesar 3.4822 mg/g dan ekstrak cair sebesar 1.4861 mg/ml. Nilai ohue ekstrak 328.69o dengan kisaran warna ekstrak merah ungu dengan pH ekstrak yaitu 2.41.
Ekstraksi brazilein dari kayu secang menggunakan pelarut etanol 50%. Ekstrak diperoleh dengan warna merah kecoklatan. Rendemen ekstrak yang didapat sebesar 8.15% (b/b). Kadar air ekstrak yaitu 8.33% (bb) atau 9.09% (bk), total brazilein sebesar 0.5919 mg/mg ekstrak, dan pH ketika dilarutkan ke dalam aquades 5.41. Nilai ohue ekstrak sebesar 32.36o dengan kisaran warna ekstrak merah
Konsentrasi antosianin yang ditambahkan dalam model minuman adalah 5.82x10-5M. Model minuman antosianin dan kopigmentasi antosianin-brazilein dibuat dengan perbandingan molar. Perbandingan molar antara antosianin dan brazilein yaitu 1:3, 1:4, 1:5, 1:6, dan 1:7.
Model minuman antosianin dan kopigmentasi antosianin-brazilein dilakukan pengujian terhadap stabilitas proses pemanasan dan penyinaran dengan UV. Stabilitas suhu pemanasan meliputi 40oC, 50oC, 60oC, 70oC, dan 80oC. Pengukuran absorbansi dilakukan λ 520 nm untuk model minuman antosianin dan 515 nm untuk model minuman kopigmentasi antosianin-brazilein. Pengukuran warna dengan chromameter CR 310 untuk melihat nilai L, a, b, ∆E, dan ohue.
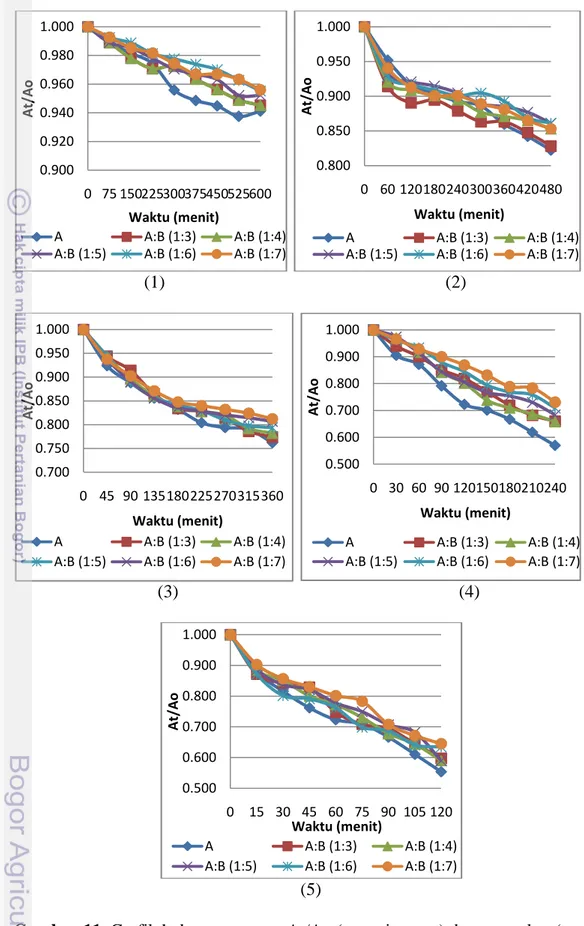
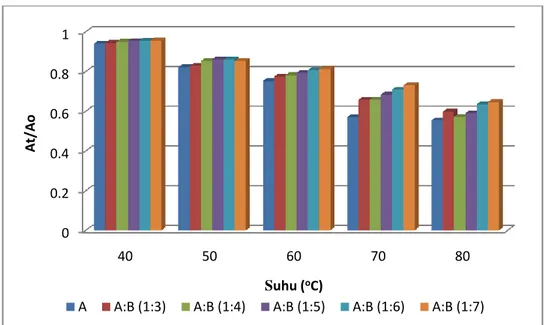
Pengukuran dengan spektrofotometer menunjukkan semakin meningkatnya suhu dan waktu pemanasan maka nilai retensi warna semakin menurun sedangkan nilai k semakin meningkat. Model minuman antosianin:brazilein (1:6) memiliki nilai retensi warna yang paling besar dibandingkan dengan formula lainnya. Nilai retensi warna pemanasan 80oC selama 2 jam memiliki nilai terendah yaitu 0.554-0.664.
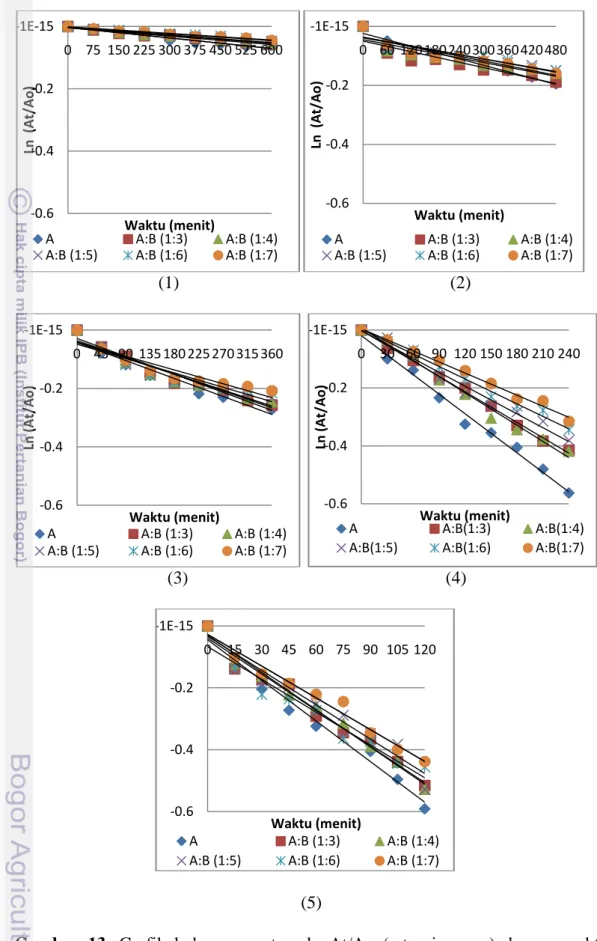
Nilai konstanta laju degradasi antosianin (k) model minuman adalah 7.0x10-5 -4.4x10-3 menit-1 memberikan nilai R2 0.8105-0.9940. Nilai energi aktivasi model minuman yaitu 84.74-90.35 kJ/mol. Model minuman antosianin:brazilein (1:6) memiliki nilai enegi aktivasi paling baik dibandingkan model minuman antosianin, antosianin:brazilein (1:3), (1:4), (1:5), dan (1:7).
Pengukuran menggunakan chromameter menunjukkan dengan semakin meningkatnya suhu dan waktu pemanasan maka nilai L akan meningkat, a akan menurun, ∆E akan semakin meningkat, o
hue juga semakin meningkat sedangkan nilai b memiliki beberapa kecenderungan bergantung suhu dan model minuman. Nilai ∆L, ∆a, dan ∆E terendah pada model minuman antosianin:brazilein (1:6).
Nilai ohue model minuman pada suhu 40oC, 50oC, dan 60oC tidak menyebabkan pergeseran warna pada akhir proses pemanasan. Nilai ohue pemanasan 70oC selama 4 jam warna menyebabkan pergeseran warna menjadi merah kuning pada model minuman antosianin:brazilein (1:7). Pemanasan 80oC selama 2 jam mengalami pergesaran warna menjadi warna merah kuning untuk semua model minuman kecuali model minuman antosianin:brazilein (1:6).
Nilai retensi warna model minuman dengan penyinaran sinar UV adalah 0.822-0.865. Nilai terendah pada model minuman antosianin dan tertinggi pada model minuman antosianin:brazilein (1:5). Nilai konstanta laju degradasi antosianin (k) pada penyinaran sinar UV sebesar 1.2x10-3-1.3x10-3 jam-1 memberikan nilai R2 (koefisien determinasi) 0.7763-0.9593. Nilai waktu paruh model minuman sebesar 516.98-606.88 jam. Pengukuran menggunakan chromameter menunjukkan dengan semakin lamanya waktu penyinaran nilai L, ∆E, dan ohue akan meningkat sedangkan nilai a akan menurun untuk semua model minuman. Nilai b mengalami peningkatan pada model minuman antosianin, antosianin:brazilein (1:3), dan (1:4), sedangkan nilai b mengalami penurunan pada model minuman antosianin:brazilein (1:5), (1:6), dan (1:7) dengan bertambahnya waktu penyinaran dengan UV.
Nilai ohue model minuman penyinaran dengan UV selama 144 jam menyebabkan pergeseran warna menjadi merah kuning pada semua model minuman. Model minuman antosianin:brazilein (1:4), (1:5), dan (1:6) mengalami pergesaran warna menjadi merah-kuning pada penyinaran selama 120 jam. Sedangkan model minuman antosianin:brazilein (1:7) mengalami pergeseran warna pada penyinaran 72 jam.
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
PENGARUH KOPIGMENTASI PEWARNA ALAMI ANTOSIANIN DARI ROSELA (Hibiscus sabdariffa L. ) DENGAN BRAZILEIN DARI KAYU SECANG (Caesalpinia sappan L.) TERHADAP STABILITAS WARNA PADA
MODEL MINUMAN RINGAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh :
I PUTU GEDE ARYA DHARMAWAN F24052828
Dilahirkan pada tanggal 28 Juli 1987 di Tabanan Bali
Menyetujui,
Bogor, Desember 2009
Prof. Dr. Ir. Tien R. Muchtadi, MS Dr. Ir. Dede R. Adawiyah, M.Si Dosen Pembimbing I Dosen Pembimbing II
Mengetahui,
Dr. Ir. Dahrul Syah
vi RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 28 Juli 1987 di Tabanan Bali. Penulis adalah putra pertama dari pasangan Bapak I Nengah Kumbayadnya dan Ibu Desak Ketut Tridarwati. Penulis merupakan anak pertama dari dua bersaudara.
Penulis menempuh pendidikan di TK Katolik Swastiastu Tabanan pada tahun 1992-1993, pendidikan sekolah dasar di SD Negeri 7 Banjar Anyar pada tahun 1993-1999, pendidikan sekolah lanjutan tingkat pertama di SLTP Negeri 1 Tabanan Bali pada tahun 1999-2002, dan pendidikan sekolah lanjutan tingkat atas di SMA Negeri 1 Tabanan Bali pada tahun 2002-2005. Pada tahun 2005, penulis melanjutkan pendidikan di Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB). Pada tahun 2006 penulis diterima di Departemen Ilmu dan Teknologi, Pangan, Fakultas Teknologi Pertanian IPB.
Selama kuliah di Departemen Ilmu dan Teknologi Pangan, penulis sempat menjadi Ketua UKM KMHD (Kesatuan Mahasiswa Hindu Dharma) tahun 2007-2008. Penulis terlibat dalam beberapa kepanitiaan seperti Open House KMHD 2006, Penerimaan Masa Anggota Baru Brahmacarya 2006, Genus Bali 2007, Lomba Cepat Tepat Ilmu Pangan XV, dan Masa Perkenalan Departemen. Penulis sempat mengikuti pelatihan seperti HACCP, Sistem Manajemen Halal, dll. Penulis terlibat dalam kompetisi Agroindustry Product Design di Universitas Brawijaya Malang. Penulis juga sempat menjadi Asisten Praktikum Kimia Dasar TPB tahun 2008 dan Asisten Praktikum Teknologi Pengolahan Pangan tahun 2009. Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian, penulis menyusun skripsi setelah melakukan penelitian dengan judul “Pengaruh Kopigmentasi Pewarna Alami Antosianin dari Rosela (Hibiscus sabdariffa L.) dengan Brazilein dari Kayu Secang (Caesalpinia Sappan L.) terhadap Stabilitas Warna pada Model Minuman Ringan”. Di bawah bimbingan Tien R. Muchtadi dan Dede R. Adawiyah.
vii KATA PENGANTAR
Puji syukur kehadapan Ida Sang Hyang Widhi Wasa. Penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh Kopigmentasi Pewarna Alami Antosianin dari Rosela (Hibiscus sabdariffa L.) dengan Brazilein dari Kayu Secang (Caesalpinia sappan L.) terhadap Stabilitas Warna pada Model Minuman Ringan”. Tulisan ini merupakan laporan penelitian yang telah dilakukan penulis Laboratorium Departemen Ilmu dan Teknologi Pangan dan Seafast Center, Institut Pertanian Bogor.
Penulisan skripsi ini tidak terlepas dari bantuan banyak pihak. Oleh karena itu, penulis ingin menyampaikan terima kasih yang sebesar-besarnya kepada : 1. Keluargaku tercinta: Bapak Kumbayadnya, Ibu Tridarwati dan adikku Dewi
yang selalu memberikan doa, kasih sayang, nasihat, dan motivasi tiada henti. 2. Prof. Dr. Ir. Tien R. Muchtadi, MS selaku dosen pembimbing akademik yang
telah memberi bimbingan, serta nasihat kepada penulis selama perkuliahan, penelitian, dan penyelesaian tugas akhir.
3. Dr. Ir. Dede R. Adawiyah, M.Si selaku dosen pembimbing yang telah membimbing penulis dalam pelaksanaan penelitian dan penulisan.
4. Dr. Ir. Sukarno, M.Sc atas saran yang membangun dan kesediannya menjadi dosen penguji.
5. LPPM IPB atas bantuan dana penelitian yang diberikan.
6. Seluruh Staf Pengajar di Departemen Ilmu dan Teknologi Pangan IPB yang telah membagi ilmunya kepada penulis, semoga ilmu yang diberikan menjadi ilmu yang bermanfaat.
7. Semua teknisi dan laboran Departemen ITP: Pak Wahid, Pak Gatot, Pak Rojak, Pak Sobirin, Bu Rubiah, Ibu Antin, Mas Edi, Pak Yahya, Pak Iyas, dan Pak Nur terima kasih atas bantuan, saran, dan kerja samanya selama penulis melakukan penelitian.
8. Seluruh pustakawan PITP, PAU, dan LSI yang telah membantu penulis dalam mencari sumber pustaka.
9. Semua Guru dari TK sampai SMA yang telah memberi ilmu yang bermanfaat bagi penulis.
viii 10.Sri Dia Utari yang selalu mendampingi, membantu, dan menyemangati
penulis.
11.Keluarga Pak Tut Alit, Tante Kadek, Restu, dan Dek Sari terima kasih atas semangat dan kasih sayang kepada penulis.
12.Keluarga Bapak dan Ibu Dewa Ketut Mertha, Ayu Tara, Dea, dan Bagus. Terima kasih atas kasih sayang, semangat, dan motivasi yang diberikan kepada penulis.
13.Keluarga Om Supartagama, Tante Rumini, Kak Wulan, dan Yoga. Terima kasih telah menjadi keluarga kedua bagi penulis.
14.Teman-teman Penelitian Rosela dan Secang : Galih Ika, Galih Eka, Santy, dan Ola. Terima kasih telah membantu penulis dalam penelitian dan tugas akhir. 15.My best friend Dedy, Adiarnata, Rahadi, Dhika, Yusi, Asep, Adi, Melissa, dan
Abi terima kasih atas persahabatan yang diberikan.
16.Teman-teman satu bimbingan Marina, Deni, dan Ikhwan terima kasih atas kebersamaan selama ini.
17.Mbok Widya, Mbok Indi, Mbok Bungker, Mbok Puris, Mbok Lengut, dan Bli Bungkak terima kasih sudah menjadi kakak yang baik bagi penulis.
18.Teman–teman KMHD 42 : Ayu Tara, Stefi, Kade, Ria, Kaler, Konyer, dll terima kasih atas persahabatan dan saran yang diberikan kepada penulis selama ini.
19.Adik-adik KMHD dan Brahmacarya 43-45 : Kadek, Yoga, Yudha, Joni, Dewa, Wira, Jering, Mayun, Putri, Debby, Sindra, Keswari, Lunas, Petruk, Dolar, Nobiceu, Ateng, Casun, Potter, Penjor, Bracuk, Wenes, Ita, Fera, Aria, Sukma, Cok, Angie, Lilik, Mitha, Kartika,dll. Terima kasih atas persaudaraan yang diberikan.
20.Teman-teman lab biokimia Tuti, Yuni, Yupi, Riska, Beli, Atus, Hesti, Haris Nanda, Nina, Wahyu, Gia, Indri, Dila, Rika, Ari, Irene, Chacha, Ester, Dina, Cath dll.
21.Teman-teman yang menunggu pada saat sidang: Yusi, Catrien, Melissa, Dion, Riska, Adi, Asep, Eping, Galih Eka, Santhi,dll. Terima kasih atas dukungan dan semangat yang diberikan
ix 22.ITP 42 Golden Generation Tjan, Nanda, Harist, Glenn, Anggun, Dion, Ike, Adi Woko, Suhe, Muji, Harist, Marcel, Midun, Fera, dan semuanya yang penulis tidak bisa sebutkan satu persatu, penulis bangga bisa menjadi bagian dari kalian.
23.Keluarga besar ITP angkatan 40, 41, 42, 43, dan 44 atas kebersamaannya
selama ini.
Penulis menyadari bahwa skripsi ini memiliki banyak kekurangan. Oleh karena itu, penulis mengharapkan saran dan kritik bagi perbaikan selanjutnya.
Bogor, Desember 2009
( Penulis )
x KATA PENGANTAR………. DAFTAR ISI………...
vii x
DAFTAR TABEL………... xii
DAFTAR GAMBAR………... xiii
DAFTAR LAMPIRAN……….. xv
I. PENDAHULUAN……….. 1
A. LATAR BELAKANG………. 1
B. TUJUAN……….2
C. MANFAAT………...3
II.TINJAUAN PUSTAKA………. 4
A. ROSELA……… .... 4 B. KAYU SECANG………... 6 C. ANTOSIANIN……….... 7 D. BRAZILEIN……… …... 11 E. KOPIGMENTASI……….. 12 F. MINUMAN RINGAN………..…. 15
III.METODOLOGI PENELITIAN………... 18
A. BAHAN DAN ALAT………... 18
B. METODE PENELITIAN……… 18
1. Ekstraksi Pigmen………... 18
a. Ekstraksi Antosianin………. 19
b. Ekstraksi Brazilein………... 19
2. Pengujian Stabilitas Antosianin dan Kopigmentasi ………. 20
a. Pembuatan Model Minuman dan Kopigmentasi……….. 20
b. Stabilitas Warna terhadap Suhu Pemanasan……… 21
c. Stabilitas Warna terhadap Sinar UV………. 21
C. METODE ANALISIS………... 22
1. Penentuan Rendemen Ekstrak……….. 22
2. Analisis Total Padatan Terlarut………. 22
3. Analisis Kadar Air………..
4. Analisis Total Antosianin………..
5. Analisis Total Brazilein………..
6. Pengamatan Warna Metode Chromameter……….
7. Analisis Stabilitas Model Minuman……….
23 23 24 24 26
IV.HASIL DAN PEMBAHASAN………....
A. EKSTRAKSI DAN KARAKTERISASI PIGMEN………
1. Ektraksi dan Karakterisasi Antosianin………...
2. Ektraksi dan Karakterisasi Brazilein……….
28 28 28 31 Halaman DAFTAR ISI
xi
B. PEMBUATAN MODEL MINUMAN DAN KOPIGMENTASI……...
C. STABILITAS MODEL MINUMAN TERHADAP PEMANASAN….…..
1. Pengamatan Spektrofotometer………... a. Retensi Warna……….. b. Nilai k………... c. Waktu Paruh……….… d. Energi Aktivasi……… 33 34 34 34 38 42 44 2. Pengamatan Chromameter……….... a. Nilai L………... b. Nilai a……….. c. Nilai b……….. d. Nilai ∆E……… e. Nilai ohue………...
D. STABILITAS MODEL MINUMAN TERHADAP SINAR UV…………..
1. Pengamatan Spektrofotometer………..
a. Retensi Warna……….
b. Nilai k dan Waktu Paruh………..
2. Pengamatan Chromameter……… a. Nilai L……….. b. Nilai a………... c. Nilai b……….. d. Nilai ∆E……… e. Nilai ohue………..
V. KESIMPULAN DAN SARAN……….
A. KESIMPULAN ………. B. SARAN……….. DAFTAR PUSTAKA ………. LAMPIRAN……… 46 47 50 53 55 58 62 62 62 63 65 65 67 68 69 70 72 72 73 74 78
xii Tabel 1. Perbedaan letak gugus tersubtitusi dari enam gugus antosianidin………. Tabel 2. Jumlah antoisianin dan brazilein yang ditambahkan pada model
minuman………. Tabel 3. Nilai hue dan daerah kisaran warna warna kromatis……….. Tabel 4. Karakteristik ektstrak antosianin rosela……….. Tabel 5. Karakteristik ektstrak brazilein kayu secang……….. Tabel 6. Kisaran warna model minuman pemanasan 40oC……….. Tabel 7. Kisaran warna model minuman pemanasan 50oC……….. Tabel 8. Kisaran warna model minuman pemanasan 60oC……….. Tabel 9. Kisaran warna model minuman pemanasan 70oC……….. Tabel 10. Kisaran warna model minuman pemanasan 80oC……….. Tabel 11. Nilai k dan waktu paruh model minuman penyinaran dengan UV……... Tabel 12. Kisaran warna model minuman penyinaran dengan UV………
8 21 26 29 32 59 59 59 60 60 65 71 Halaman DAFTAR TABEL
xiii
Gambar 1. Tanaman rosela………..
Gambar 2. Tanaman secang………. Gambar 3. Struktur kimia antosianidin……… Gambar 4. Struktur antosianidin pada berbagai pH………. Gambar 5. Struktur kimia brazilin dan brazilein………. Gambar 6. Mekanisme reaksi kopigmentasi pada antosianin………..
Gambar 7. Charge transfer antosianin dengan senyawa fenolik………. Gambar 8. Lingkaran warna kromatis………. Gambar 9. Ekstrak antosianin padat dan cair………..
Gambar 10. Ekstrak brazilein……… Gambar 11. Grafik antara hubungan At/Ao (retensi warna) dengan waktu (menit)
model minuman suhu 40oC, 50oC, 60oC, 70oC, dan 80oC……… ……. Gambar 12. Diagram hubungan antara At/Ao (retensi warna) dengan suhu (oC)
model minuman ………. Gambar 13. Grafik hubungan ln At/Ao (retensi warna) dengan waktu (menit)
model minuman suhu 40oC, 50oC, 60oC, 70oC, dan 80oC……… Gambar 14. Nilai konstanta laju degradasi antosianin (menit-1) pada model
minuman suhu 40oC, 50oC, 60oC, 70oC, dan 80oC ………... Gambar 15. Diagram hubungan antara waktu paruh dengan waktu (jam) pada
model minuman suhu 40oC, 50oC, 60oC,70oC, dan 80oC………... Gambar 16. Grafik hubungan ln k (menit-1) dengan 1/T (K-1) model minuman…. Gambar 17. Nilai energi aktivasi model minuman………... Gambar 18. Grafik hubungan antara nilai L (lightness) dengan waktu (menit)
model minuman suhu 40oC, 50oC, 60oC, 70oC, dan 80oC ……… Gambar 19. Diagram hubungan antara nilai ∆L (perubahan nilai lightness)
dengan suhu (oC)………
Gambar 20. Grafik hubungan antara nilai a (derajat merah) dengan waktu (menit)
model minuman suhu40oC, 50oC, 60oC, 70oC, dan 80oC………. Gambar 21. Diagram hubungan antara nilai ∆a (perubahan derajat merah)
dengan suhu (oC)………...
Gambar 22. Grafik hubungan antara nilai b (derajat kuning) dengan waktu (menit) model minuman suhu 40oC, 50oC, 60oC, 70oC, dan 80oC………. Gambar 23. Diagram hubungan antara nilai ∆b (perubahan derajat kuning)
dengan suhu (oC) ………...
Gambar 24. Grafik hubungan antara nilai ∆E (perubahan warna keseluruhan) dengan waktu (menit) model minuman suhu 40oC, 50oC, 60oC, 70oC,
dan 80oC……….
Gambar 25. Diagram hubungan antara nilai ∆E (perubahan warna keseluruhan)
dengan suhu (oC)……….
Gambar 26. Penampakan visual model minuman tanpa dan akhir pemanasan suhu
40oC, 50oC, 60oC, 70oC, dan 80oC……… Gambar 27. Grafik hubungan anatra At/Ao (retensi warna) dengan waktu (jam)
model minuman penyinaran UV………. Gambar 28. Grafik hubungan antara ln At/Ao (retensi warna) dengan waktu (jam)
model minuman penyinaran UV……….………... 4 6 8 10 12 13 15 25 31 32 35 37 39 41 43 45 46 48 49 51 52 54 55 56 57 61 63 64 DAFTAR GAMBAR Halaman
xiv Gambar 30. Grafik hubungan antra nilai L (lightness) dengan waktu (jam) model
minuman penyinaran UV ………. ………... Gambar 31. Grafik hubungan antara nilai a (derjat merah) dengan waktu (jam)
model minuman penyinaran UV……… Gambar 32. Grafik hubungan antara nilai b (derajat kuning) dengan waktu (jam)
model minuman penyinaran UV……….. Gambar 33. Grafik hubungan antara nilai ∆E (perubahan warna) dengan waktu
(jam) model minuman penyinaran UV……….. Gambar 34. Penampakan visual model minuman tanpa penyinaran dan akhir
proses penyinaran dengan UV……… 66 68 69 70 71
xv Lampiran 1. Karakterisasi ekstrak antosianin dari rosela……… Lampiran 2. Karakterisasi ekstrak brazileindari secang……….. Lampiran 3. Pencampuran antosianin dan brazilein pada model minuman………
Lampiran 4. Grafik degradasi model minuman masing-masing suhu………
Lampiran 5. Nilai k dan waktu paruh model minuman……….. Lampiran 6a. Nilai Ea/R masing-masing model minuman………...
Lampiran 6b. Nilai Eamasing-masing model minuman………... Lampiran 7. Nilai L, a, b, ∆E, dan ohue model minuman masing-masing suhu….
Lampiran 8. Grafik degradasi model minuman penyinaran dengan UV………… Lampiran 9. Nilai L, a, b, ∆E, dan ohue penyinaran UV ……… Lampiran 10. Nilai k penyinaran UV………... 79 81 84 85 115 116 116 117 127 131 133 DAFTAR LAMPIRAN Halaman
1 I PENDAHULUAN
A. LATAR BELAKANG
Pewarna memegang peranan penting dalam meningkatkan daya tarik suatu produk pangan. Pewarna merupakan ingridient penting dalam beberapa jenis makanan seperi confectionary, dessert, snack, dan minuman ringan. Zat warna makanan dapat dibagi menjadi tiga golongan yaitu zat warna alami, zat warna identik, dan zat pewarna sintetik (Henry, 1996).
Zat warna sintetik umumnya bersifat lebih stabil, lebih cerah, dan lebih bervariasi. Sebaliknya zat pewarna alami memiliki sifat yang kurang stabil, kurang cerah, dan kurang bervariasi. Sampai saat ini penggunaan pewarna sintetis begitu pesat digunakan pada makanan. Penggunaan pewarna ini sering kali menimbulkan masalah kesehatan. Penyalahgunaan pewarna sintetis dapat menyebabkan kanker, stroke, dan penyakit jantung (Enie, 1986). Keadaan ini menimbulkan keinginan orang-orang untuk menggunakan pewarna alami yang relatif aman.
Sejalan dengan meningkatnya pengetahuan masyarakat dan trend kembali ke alam maka pewarna alami semakin diminati. Pewarna alami dapat ditemui pada berbagai jenis tanaman dan hampir tidak membahayakan kesehatan. Bagian tanaman yang memiliki pigmen dan bisa dimanfaatkan sebagai pewarna makanan adalah bagian daun, bunga, dan batang. Selain berfungsi mewarnai produk, pewarna alami ini juga berfungsi sebagai flavour, antioksidan, antimikroba, dan fungsi-fungsi lainnya (Winarno, 1992). Tanaman yang potensial dimanfaatkan sebagai pewarna alami adalah rosela (Hibiscus sabdariffa L.) dan kayu secang (Caesalpinia sappan L.).
Kelopak bunga rosela (Hibiscus sabdariffa L.) mengandung pigmen antosianin. Warna merah antosianin stabil pada pH 2-5 (Reyner, 1993). Aplikasi antosianin sebagai pewarna pangan dapat dilakukan pada pH rendah seperti minuman ringan, minuman beralkohol, manisan, saus, pikel, dan yoghurt.
Pigmen brazilein merupakan pigmen yang berasal dari kayu secang (Caesalpinia sappan L.). Pigmen ini sangat berpotensi digunakan sebagai pewarna alami. Brazilein merupakan hasil oksidasi dari brazilin. Menurut
2 Adawiyah et al. (2008) pigmen brazilein dari kayu secang memiliki kestabilan warna merah pada pH netral 6-7, bergeser ke arah merah keunguan pada pH lebih tinggi 8 dan kuning pada pH yang lebih rendah 2-5.
Antosianin mudah mengalami degradasi warna yang mengakibatkan warna menjadi lebih pudar. Degradasi antosianin dapat disebabkan oleh suhu, sinar UV, dan pH. Degradasi antosianin dapat dikurangi dengan adanya kopigmentasi. Fenomena kopigmentasi dapat teramati sebagai pergeseran panjang gelombang maksimum yang dikenal dengan nama efek bathokromik (Δλmax). Pada antosianin teramati pergeseran warna dari merah menjadi merah kebiruan (bluing effect) akibat adanya kopigmentasi. Efek lain yang teramati adalah efek hiperkromik (ΔA) yaitu terjadinya peningkatan intensitas warna setelah kopigmentasi. Jenis senyawa kopigmen yang digunakan adalah flavonoid, alkaloid, asam amino, asam organik, dan polifenol lain (Markakis, 1982). Brazilein merupakan senyawa flavonoid yang potensial ditambahkan sebagai kopigmen. Adanya kopigmentasi antosianin dengan brazilein diharapkan mampu meningkatkan stabilitas warna antosianin.
Peningkatan kestabilan warna dapat terlihat dari penurunan laju degradasi warna antosianin dan meningkatnya energi aktivasi akibat reaksi kopigmentasi. Penambahan kopigmen brazilein diharapkan mampu menurunkan laju degradasi dan meningkatkan energi aktivasi. Energi aktivasi adalah energi minimal yang dibutuhkan suatu reaksi agar dapat berlangsung. Semakin rendah energi aktivasi maka semakin mudah antosianin mengalami degradasi. Penambahan brazilein sebagai senyawa kopigmen diharapkan mampu meningkatkan energi aktivasi reaksi degradasi antosianin.
B. TUJUAN
Penelitian ini bertujuan :
1. Mempelajari pengaruh proses kopigmentasi pewarna alami antosianin rosela dengan brazilein kayu secang terhadap kualitas dan stabilitas warna merah yang dihasilkan dengan menggunakan model minuman ringan.
3 2. Memperoleh campuran yang tepat untuk kopigmentasi antosianin-brazilein
yang mampu menurunkan laju degradasi antosianin dan meningkatkan energi aktivasi (Ea) pada model minuman ringan terhadap pengaruh pemanasan serta penyinaran dengan UV.
C. MANFAAT
Manfaat dari penelitian ini adalah mendapatkan alternatif pewarna merah alami yang relatif aman bila dibandingkan dengan pewarna sintesis dan memiliki stabilitas yang baik untuk diaplikasikan pada produk pangan.
4 II. TINJAUAN PUSTAKA
A. ROSELA (Hibiscus sabdariffa L. )
Gambar 1. Tanaman rosela (Jauhari, 2007) Divisi : Spermatophyta
Sub Divisi : Angiospermae Kelas : Dicotyledonae Bangsa : Malvales
Suku : Malvaceae
Marga : Hibiscus
Jenis : Hibiscus sabdariffa L
Rosela merupakan anggota famili malvaceae yang tumbuh pada iklim tropis dan subtropis. Tanaman ini dikenal dengan nama asam susur di Malaysia, di Thailand disebut dengan kachieb priew, zuring merupakan sebutan Belanda, di Senegal dikenal dengan nama bisap, dan utara carcade sebutan rosela di Afrika Selatan (Maryani, 2005).
Rosela adalah tumbuhan yang berasal dari India yang memiliki nama latin Hibiscus sabdariffa L. Pada awalnya tumbuhan ini dikenal sebagai penghasil serat yang dimanfaatkan untuk membuat karung goni. Rosela merupakan tumbuhan semak yang tingginya dapat mencapai 3 m. Tumbuhan rosela memiliki batang yang bulat, tegak, memiliki kambium, dan berwarna merah. Daunnya tunggal berbentuk bulat seperti telur. Tipe tulang daun menjari, ujung daun tumpul, tepinya beringgit, dan memiliki pangkal yang berlekuk. Panjang daun rosela sekitar 6-15 cm dan lebarnya 5-8 cm. Panjang tangkai daun 4-7 cm dengan penampang bulat dan warna
5 hijau (Maryani dan Kristiana, 2005).
Budidaya rosela dapat dilakukan di segala macam tanah tetapi paling cocok pada tanah yang subur dan gembur. Tumbuhan ini dapat tumbuh di daerah pantai sampai daerah dengan ketinggian 900 m di atas permukaan laut. Curah hujan yang dibutuhkan adalah 180 mm/bulan. Jika curah hujan mencukupi dan irigasi yang memadai akan memberikan hasil yang baik (Maryani dan Kristiana, 2005).
Kelopak kering bunga rosela yang direbus dalam air panas akan menghasilkan minuman yang berwarna merah. Warna merah ini dapat dimanfaatkan sebagai pewarna alami pada berbagai produk pangan. Komponen yang berperan menghasilkan warna merah pada hasil ekstraksi rosela adalah antosianin. Komponen antosianidin yang terdapat dalam rosela antara lain delphinidin dan cyanidin. Selain itu rosela juga mengandung komponen fenolik yang memiliki aktivitas antioksidan seperti gossipetin (hydroxyflavone), hibiscin, quercetin, dan kaempferol (Maryani dan Kristiana, 2005).
Kelopak kering rosela mengandung vitamin C, vitamin A, dan 18 jenis asam amino. Kandungan asam lemak yang banyak terdapat pada kelopak rosela diantaranya asam lemak miristat, palmitat, stearat, oleat, dan linoleat (Maryani, 2005).
Kelopak kering bunga rosela sejak lama telah digunakan sebagai obat tradisional. Kelopak kering rosela berkhasiat sebagai antiseptik, diuretik, pelarut, sedatif, dan tonik (Maryani dan Kristiana, 2005).
Di Indonesia, penggunaan rosela mulai banyak dikenal sebagai minuman kesehatan. Daun atau kelopak kering yang direbus berkhasiat sebagai peluruh kencing, merangsang keluarnya empedu dari hati, menurunkan tekanan darah, mengurangi kekentalan darah dan meningkatkan peritaltik usus. Khasiat lain rosela yang telah diketahui diantaranya sebagai antikejang, mengobati cacingan dan antibakteri. Ektstrak air dan zat warna yang terkandung dalam tanaman rosela mempunyai efek letal terhadap Mycobacterium tuberculosis penyebab terjadinya TBC (Maryani dan Kritiana, 2005).
6 B. KAYU SECANG (Caesalpinia sappan L.)
Gambar 2. Tumbuhan secang (Anonima, 2009) Divisi : Spermatophyta
Sub Divisi : Angiospermae Kelas : Dicotyledonae Bangsa : Rosales
Suku : Leguminose
Marga : Caesalpinia
Jenis : Caesalpania sappan L.
Secang (Caesalpinia sappan L.) termasuk famili leguminoseae yang merupakan tanaman perdu, berduri banyak, dan tingginya dapat mencapai 5-10 meter. Akarnya berserabut dan berwarna gelap, sedangkan bagian batang berwarna coklat keabuan (Heyne, 1987). Kayu secang kebanyakan tumbuh di daerah yang berbukit pada tanah liat dan tanah kapur di dataran rendah dan dataran sedang. Tanaman ini tidak toleran terhadap kondisi tanah yang basah. Tanaman ini lebih menyukai daerah dengan curah hujan 700-4300 mm, suhu 24-27.5oC serta pH tanah 5-7.5. Tanaman secang ditanam sebagai tanaman pagar. Bagian tanaman yang digunakan adalah kayu potongan atau serutan kayu. Karakteristik serutan kayu dapat berbentuk potongan atau kepingan dengan ukuran yang sangat bervariasi. Kayu secang memiliki karakter fisik yang keras, padat, dan berwarna merah (Heyne,1987).
Kayu secang mengandung komponen resin, tannin, asam tanat, brazilin, dan asam galat (Lemmens, 1992). Menurut Pawar et al. (2008) kayu secang mengandung komponen fenolik seperti flavonoid, asam
7 fenolik, lignin, quinon, dan curcuminoid.
Secang dapat dimanfaatkan sebagai sumber zat warna alami karena mengandung brazilein yang berwarna merah. Pigmen brazilein bersifat larut dalam air panas. Pigmen merah biasanya digunakan untuk minuman rempah tradisional asal betawi yaitu bir pletok. Kayu secang telah lama digunakan sebagai obat tradisional untuk menyembuhkan muntah darah, berak darah, dan luka berdarah. Di Korea dan China, kayu ini digunakan sebagai obat analgesik dan mengatasi gangguan menstruasi. Pemanfaatan kayu secang di India sebagai obat diare dan disentri. Kayu secang juga digunakan pewarna makanan merah cokelat di Kalimantan (Maharani, 2003).
C. ANTOSIANIN
Antosianin merupakan salah satu bagian penting dalam pigmen setelah klorofil. Antosianin berasal dari bahasa Yunani yaitu anthos yang berarti bunga dan kyanos yang berarti biru gelap. Antosianin merupakan pigmen yang larut dalam air. Pigmen antosianin menghasilkan warna merah sampai biru yang tersebar luas dalam bunga dan daun (Jackman dan Smith, 1996). Antosianin umumnya ditemukan pada buah-buahan, sayur-sayuran, dan bunga. Antosianin biasanya ditemukan pada anggur, strawbery, raspbery, cherry, dan apel.
Antosianin merupakan senyawa flavonoid yang secara alami berbentuk glikosida dari flavilium atau 2-fenil benzopirilium. Zat pewarna alami antosianin tergolong ke dalam turunan benzopiran. Struktur utama turunan benzopiran ditandai dengan adanya dua cincin aromatik benzena (C6H6) yang dihubungkan dengan tiga atom karbon yang membentuk cincin. Antosianin merupakan suatu gugus glikosida yang dibentuk dari gugus aglikon dan glikon (Markakis, 1982). Apabila gugus glikon dihilangkan melalui proses hidrolisis maka akan dihasilkan antosianidin yang terlihat pada Gambar 3. Gugus gula yang umum berikatan dengan antosianidin yaitu glukosa, galaktosa, dan ramnosa.
8 Gambar 3. Struktur kimia antosianidin (Giusti dan Wrolstad, 2003)
Jumlah antosianin di alam yang berhasil diisolasi sebanyak 539 jenis tetapi hanya 6 yang ada di bahan pangan seperti pelargonidin, cyanidin, peonidin, delphinidin, petunidin, dan malvidin (Mateus dan Freitas, 2009). Pengaruh perbedaan letak dan jumlah gugus tersubstitusi pada antosianidin terhadap warna antosianin dapat dilihat pada Tabel 1. Tabel 1. Perbedaan letak gugus tersubstitusi dari enam antosianidin
(Jackman dan Smith, 1996)
Antosianidin Gugus yang tersubstitusi Warna
3 5 6 7 3’ 5’ Pelargonidin Cyanidin Delphinidin Peonidin Petunidin Malvidin OH OH OH OH OH OH OH OH OH OH OH OH H H H H H H OH OH OH OH OH OH H OH OH OMe OMe Ome H H OH H OH Ome Orange Merah-Orange Merah-Biru Merah-Orange Merah-Biru Merah-Biru Ada beberapa factor yang dapat mempengaruhi kestabilan warna antosianin antara lain secara enzimatis dan non enzimatis. Faktor-faktor yang mempengaruhi kestabilan antosianin secara non enzimatis adalah pH, cahaya, oksigen, gula, dan suhu (Jackman dan Smith, 1996).
Menurut Rein (2005) beberapa enzim dapat berperan dalam proses degradasi antosianin misalnya glukosidase dan PPO (Polipenol Oksidase). Enzim glukosidase mampu menstimulasi terjadinya hidrolisis pada ikatan gula antara gugus aglikon dengan gugus glikon. Hidrolisis tersebut menyebabkan terbentuknya cincin aromatik yang membentuk senyawa kalkon (Markakis, 1982). Menurut Jackman dan Smith (1996), adanya
9 enzim glukosidase yang sengaja ditambahkan pada jus blueberry yang mengandung sianidin 3-glukosida akan menyebabkan pemudaran warna akibat hidrolisis ikatan glikosidik.
Enzim PPO banyak terdapat pada jaringan tanaman (Jackman dan Smith, 1996). Secara umum enzim PPO tidak langsung mendegradasi antosianin. Namun enzim tersebut mampu mengoksidasi senyawa fenolik menjadi o-benzoquinon. Hasil oksidasi senyawa fenolik mampu mengalami kondensasi dengan antosianin yang terdegradasi membentuk senyawa tidak berwarna seperti kalkon (Markakis, 1982).
Antosianin umumnya lebih stabil pada larutan asam apabila dibandingkan dengan larutan netral atau alkali. Antosianin memiliki struktur kimia yang berbeda tergantung dari pH larutan. Pada pH 1 antosianin berbentuk kation flavinium yang memberikan warna merah. Pada pH 2-4 antosianin berbentuk campuran kation flavinium dan quinoidal. Pada pH yang lebih tinggi yaitu 5-6 terdapat dua senyawa yang tidak berwarna yaitu karbinol pseudobasa dan kalkon (Ovando et al., 2009). Struktur antosianin pada berbagai macam pH dapat dilihat pada Gambar 4. Kestabilan antosianin pada pH asam mengakibatkan antosianin lebih banyak digunakan pada makanan asam seperti jus, minuman ringan, pikel, acar, pudding, dan yoghurt.
Cahaya merupakan faktor yang berperan dalam proses degradasi antosianin. Cahaya memiliki energi tertentu yang mampu menstimulasi terjadinya fotokimia dalam molekul antosianin (Jackman dan Smith, 1996). Reaksi fotokimia dalam molekul antosianin menyebabkan pembukaan cincin karbon no 2. Pada akhirnya reaksi fotokimia mampu membentuk senyawa tidak berwarna seperti kalkon sebagai indikator degradasi antosianin (Markakis, 1982). Degradasi lanjutan dapat membentuk senyawa turunan lain yang tidak berwarna seperti 2,4,6 trihidroksibenzaldehid dan asam benzoat yang tersubtitusi (Jackman dan Smith, 1996).
10 Gambar 4. Struktur antosianin pada berbagai pH (Mateus dan Freitas,
2009)
Oksigen dapat menstimulasi terjadinya proses degradasi antosianin secara langsung dan tidak langsung. Secara langsung oksigen mampu menyebabkan oksidasi antosianin menjadi senywa yang tidak berwarna dan menurunkan stabilitas antosianin (Rein, 2005). Secara tidak langsung beberapa senyawa hidroksiradikal mampu menyebabkan oksidasi pada struktur antosianin sehingga membentuk senyawa tidak berwarna seperti kalkon yang merupakan indikator degradasi warna antosianin.
Gula merupakan faktor yang mempengaruhi kestabilan antosianin. Sukrosa merupakan jenis gula yang memiliki efek protektif terhadap antosianin dibandingkan dengan fruktosa dan laktosa (Markakis, 1982). Penambahan 10% sukrosa pada model minuman ekstrak bayam merah terbukti memiliki efek protektif terhadap zat pewarna alami (Cai dan Corke, 1999). Penambahan sukrosa berlebihan (>13%) pada minuman
11 ekstrak bayam merah cendrung menstimulasi proses degradasi zat pewarna alami.
Suhu merupakan faktor yang mempengaruhi kestabilan antosianin. Peningkatan suhu pengolahan hingga penyimpanan dapat menimbulkan kerusakan dan perubahan antosianin yang dapat terjadi secara cepat melalui tahapan:
1. Hidrolisis pada ikatan glikosidik antosianin dan menghasilkan aglikon-aglikon yang labil.
2. Terbukanya cincin aglikon sehingga terbentuk gugus karbinol
dan kalkon yang tidak berwarna.
Senyawa kalkon mampu terdegradasi membentuk senyawa yang tidak berwarna yang lebih sederhana yaitu asam karboksilat seperti asam benzoat yang tersubtitusi dan senyawa karboksil aldehid yaitu 2,4,6-trihidroksibenzaldehid (Jackman dan Smith, 1996).
D. BRAZILEIN
Senyawa brazilein merupakan pigmen yang berwarna merah kecoklatan dan larut dalam air. Senyawa Brazilein (C16H13O5) merupakan hasil oksidasi dari brazilin (C16H14O5) yang berbentuk kristal berwarna kuning sulfur. Brazilin dalam bentuk murni dapat dikristalkan, larut air, larutannya jernih mendekati tak berwarna, dan terasa manis. Asam tidak mempengaruhi larutan brazilin tetapi alkali membuatnya bertambah merah. Rumus struktur brazilin dan brazilein bisa terlihat pada Gambar 5.
Brazilein termasuk golongan flavonoid sebagai isoflavonoid. Senyawa isoflavonoid merupakan golongan yang mempunyai kerangka C3-C6-C3. Brazilein dalam tumbuhan umumnya terikat dengan gula
membentuk glikosida. Untuk membebaskan gula dan aglikonnya maka perlu dihidrolisis dengan asam. Flavonoid mempunyai gugus hidroksil atau suatu gula. Aglikon flavonoid adalah polifenol yang mempunyai sifat kimia senyawa fenol (Brouillard, 1982).
12 a b
Gambar 5. Struktur kimia (a) brazilin dan (b) brazilein (Oliveira et al., 2002)
Stabilitas pigmen brazilein dipengaruhi oleh beberapa faktor antara lain pH, pemanasan, sinar ultraviolet, oksidator, reduktor, dan metal. Kondisi keasaman atau pH larutan sangat mempengaruhi stabilitas warna pigmen brazilein. Pada pH 2–5 pigmen brazilein berwarna kuning, pH 6–7 berwana merah, dan pH 8 ke atas berwarna merah keunguan (Adawiyah et al., 2008). Menurut Maharani (2003) pemanasan, sinar ultraviolet, oksidator, reduktor, serta penambahan metal akan mempengaruhi stabilitas dan mengakibatkan terjadinya degradasi pada pigmen brazilein.
Selain sebagai pewarna, brazilein juga mempunyai beberapa sifat fungsional. Menurut Pawal et al. (2008) brazilein yang berasal dari kayu secang memiliki sifat fungsional seperti antioksidan, anti kanker, anti inflammtori, dan anti diabetes. Selain itu brazilein dari kayu secang dapat berfungsi sebagai antimikroba seperti Staphylococcus aureus.
E. KOPIGMENTASI
Fenomena kopigmentasi pertama kali teramati pada tahun 1916 oleh Willstätter dan Zollinger yang mengamati perubahan warna pigmen anggur menjadi merah kebiruan dengan penambahan asam tanat dan asam galat.
Menurut Castenada et al. (2009) kopigmentasi dapat terjadi melalui beberapa interaksi diantaranya self association(a), intramolecular
copigmentation(b), metal complexation(c), dan intermolecular copigmentation (d). Mekanisme kopigmentasi bisa terlihat pada Gambar 6.
13
Gambar 6. Mekanisme reaksi kopigmentasi pada antosianin (Castenada et al., 2009)
Mekanisme dari self association dapat dianalogikan sebagai interaksi antar molekul antosianin yang saling bertumpuk (stacking-like interaction). Self association terjadi pada saat pembuatan wine. Interaksi ini berkontribusi terhadap warna wine (Rein, 2005).
Intramolecular copigmentation merupakan mekanisme dari kopigmentasi dimana kopigmen merupakan bagian dari molekul antosianin (Brouilard, 1982). Interaksi ini terjadi secara kovalen asilasi molekul antosianin. Asil grup yang berupa komponen aromatik berinteraksi dengan kation flavinium yang reaktif pada C-2 dan C-4 dengan reaktan nukleofilik. Intramolecular copigmentation diaplikasikan pada ekstrak black carrot yang banyak mengandung antosianin yang mengalami asilasi.
Beberapa logam dapat membentuk komplek dengan antosianin adalah Sn, Cu, Fe, Al, Mg, dan K (Markakis, 1982). Sianidin, delphinidin,
14 dan petunidin memiliki lebih dari 1 grup hidroksil yang mampu mengkelat logam. Interaksi antosianin dengan logam jarang diaplikasikan karena bisa mengakibatkan aroma yang menyimpang pada produk (Castenada et al., 2009).
Senyawa kopigmen dapat berupa flavonoid, alkaloid, asam amino, asam organik, nukleotida, polisakarida, dan antosianin jenis lain. Ketika kopigmen merupakan senyawa fenolik maka terjadi transisi ikatan kimia. Fenomena ini dikenal dengan istilah charge transfer complex atau interkasi π-π. Mekanisme yang dapat terjadi yaitu kation flavinium yang bermuatan positif (kekurangan elektron), sedangkan senyawa kopigmen memiliki kelebihan elektron akan mentransfer elektron sehingga terjadi kesetimbangan elektron (Castenada et al., 2009). Interaksi π- π dapat terlihat pada Gambar 7.
Reaksi kopigmentasi dipengaruhi oleh pH, suhu, dan konsentrasi (Brouillard dan Dangels, 1994). Pada pH rendah molekul antosianin berbentuk kation flavinium yang berwarna merah, sedangkan pH yang lebih tinggi akan berbentuk karbinol pseudobase yang berwarna lebih pudar.
Meningkatnya suhu akan menyebabkan kopigmentasi yang terjadi semakin tidak stabil. Hal ini terjadi karena kerusakan parsial pada ikatan hidrogen. Konsentrasi kopigmen yang ditambahkan akan berpengaruh terhadap proses kopigmentasi. Jumlahs kopigmen yang ditambahkan harus lebih banyak dibandingkan dengan antosianin. Konsentrasi rasio pigmen dan kopigmen dinyatakan dalam molar.
Fenomena kopigmentasi teramati sebagai pergeseran panjang gelombang maksimum yang dikenal dengan nama efek batokromik (Δλmax). Pada antosianin teramati pergeseran warna dari merah menjadi merah kebiruan (bluing effect). Efek lain yang teramati adalah efek hiperkromik (ΔA) yaitu terjadinya peningkatan intensitas warna setelah kopigmentasi (Rein, 2005).
15 Gambar 7. Charge transfer complex antosianin dengan senyawa fenolik
(Castenada et al., 2009)
Dari berbagai jenis flavonol, rutin adalah kopigmen yang dapat menghasilkan kopigmentasi kuat. Rutin dapat menginduksi pergeseran batokromik 30 nm dan quercetin 28 nm terhadap malvidin 3,5-diglukosida pada pH 3.2 (Chen and Hrazdina, 1981). Jenis kopigmen lain yang sudah banyak diteliti adalah asam fenolat. Rein dan Heinohen (2004) menggunakan ferulic acid, sinapic acid, dan rosmarinic acid untuk memperbaiki kualitas juice berry.
F. MINUMAN RINGAN
Minuman ringan didefinisikan sebagai minuman tidak beralkohol yang mengandung sirup, esense, atau konsentrat buah yang dicampur dengan air atau air karbonat (carbonated water) dengan proporsi tertentu (Thorner dan Herzberg, 1978). Sedangkan Vernam dan Sutherland (1994) mendefinisikan segala minuman yang diperuntukkan bagi konsumsi, baik tanpa maupun dengan pengenceran selain air, jus buah, susu, teh, kopi,
16 coklat, produk telur, daging, ragi, ekstrak sayuran, sup, jus sayuran, dan minuman keras yang memabukkan.
Menurut Green (1981) menggolongkan minuman ringan menjadi tiga kategori yaitu minuman berkarbonat baik mengandung asam maupun tidak seperti cola, minuman berflavor buah atau tidak, golongan yang mencakup sari buah seperti air soda. Persyaratan minuman ringan menurut Green (1981) antara lain :
1. Campuran minuman yang tidak menimbulkan after taste yang kurang disukai.
2. Menggunakan air yang memenuhi standar. 3. Disuguhkan dalam keadaan yang cukup dingin.
4. Jika digunakan es sebagai pendingin maka es yang digunakan tidak mudah mencair.
5. Karbonasi yang cukup bisa memberikan efek yang menyegarkan. 6. Wadah yang jernih dan bersih.
Bahan-bahan penyusun minuman ringan antara lain air, pemanis, asam, pewarna, dan flavor.Persentase air dalam minuman ringan bisa mencapai 90% sehingga kualitas air yang digunakan dalam industri minuman ringan harus terkontrol (Hougton dan Mc Donald, 1978). Air yang digunakan untuk minuman ringan harus melalui test potability sehingga dapat diminum dan bebas dari kontaminan.
Air yang digunakan dalam industri minuman ringan biasanya telah melalui tahapan yang meliputi penghilangan kesadahan, penghilangan koloid, penghilangan warna, rasa serta bau yang menyimpang, pengurangan alkalinitas, dan telah mengalami sterilisasi (Hougton dan Mc Donald, 1978).
Pemanis berperanan terhadap cita rasa minuman ringan. Pemanis bertindak sebagai pengikat komponen flavor (Potty, 1979). Pemanis yang digunakan untuk minuman ringan dapat berupa gula atau pemanis buatan. Menurut Soft Drink Regulation (Green, 1981), gula diartikan sebagai pemanis yang berasal dari karbohidrat. Gula yang digunakan untuk minunan ringan antara lain gula kristral, gula invert, maupun gula cair
17 (Woodroof dan Philips, 1981). Pemanis alami yang paling banyak digunakan dalam industri minuman ringan adalah sukrosa yang berupa sirup dengan konsentrasi yang tinggi. Konsentrasi akhir pemanis dalam minuman ringan mencapai 8-14% (Thorner dan Hezberg, 1978).
Asam merupakan komponen penting ketiga setelah air dan gula (Indriani, 2003). Keasaman dapat meningkatkan cita rasa dan juga bertindak sebagai pengawet. Penambahan asam dapat menurunkan nilai pH. Penurunan nilai pH dapat menghambat pertumbuhan mikroba (Potty, 1979). Asam yang umumnya digunakan dalam minuman ringan adalah asam sitrat.
Asam sitrat merupakan pemberi derajat keasaman yang cukup baik karena kelarutannya dalam air. Asam sitrat bersifat sebagai chelating agent yaitu senyawa yang dapat mengikat logam-logam divalen seperti Mn, Mg, dan Fe. Logam tersebut banyak dibutuhkan sebagai katalisator dalam reaksi biologis. Reaksi-reaksi biologis dapat dihambat dengan penambahan asam sitrat. Asam sitrat banyak digunakan dalam industri minuman ringan sebagai flavor enhnacer, pengawet, pencegah rusaknya warna dan aroma (Kapoor et al., 1982).
Penambahan pewarna dalam pembuatan minuman ringan bertujuan untuk meningkatkan daya tarik konsumen terhadap suatu produk. Pewarna yang ditambahkan dalam minuman ringan sebaiknya memiliki stabilitas yang baik terhadap pengaruh komponen seperti gula, asam, dan flavor. Zat pewarna alami cenderung lebih aman dibandingkan pewarna sintetis. Harga pewarna sintetis lebih ekonomis dibandingkan pewarna alami. Beberapa pewarna alami yang sering digunakan adalah antosianin, karoten, dan krolofil. Sedangkan pewarna sintetik yang digunakan misalnya FD&C (Food and Drugs Colourant) dalam berbagai jenis warna (Winarno, 1992).
18 III. METODELOGI PENELITIAN
A. BAHAN DAN ALAT 1. Bahan
Bahan baku yang digunakan adalah kelopak kering bunga rosela (Hibiscus sabdariffa L.) yang berasal dari petani di Dramaga dan kayu
secang (Caesalpinia sappan L.) yang diperoleh dari pasar Bogor. Bahan baku pembuatan model minuman terdiri dari sukrosa dan air minum dalam kemasan. Bahan-bahan yang diperlukan untuk analisis dan ekstraksi antara lain metanol 24.6 M, HCl 1 N, etanol 95%, etanol 50%, aquades, standar brazilein, dan kertas saring Whatman No 1.
2. Alat
Alat yang digunakan pada penelitian ini adalah blender, disc mill, penyaring vakum, vaccum evaporator, water bath, refrigerator, neraca analitik, chromameter, spektrofotometer, termometer, alat-alat gelas, botol bening, dan botol gelap.
B. METODE PENELITIAN
Penelitian ini terbagi menjadi beberapa tahap penelitian yang meliputi ekstraksi sampel dan pengujian stabilitas warna model minuman ringan terhadap suhu dan sinar UV.
1. Ekstraksi Pigmen
Pada tahap ini dilakukan ekstraksi senyawa pigmen yaitu antosianin dari kelopak kering bunga rosela dan brazilein dari kayu secang. Senyawa yang dihasilkan merupakan bahan utama yang dijadikan sebagai subyek pada tahap penelitian selanjutnya.
19 a. Ekstraksi Antosianin (Adawiyah et al., 2008)
Sebanyak 50 gram kelopak bunga rosela diekstraksi dengan 500 ml aquades. Kelopak bunga rosela kering dihancurkan menggunakan blender dengan menambahkan 250 ml aquades. Setelah itu, hancuran rosela dipindahkan ke dalam gelas piala dan sisa larutan pengekstrak yaitu 250 ml ditambahkan ke dalam hancuran rosela. Kemudian dilakukan proses maserasi pada suhu ruang dan ruang gelap selama 24 jam. Selanjutnya dilakukan proses penyaringan dengan menggunakan kain saring. Penyaringan bertujuan untuk memisahkan filtrat dan ampas rosela. Filtrat hasil penyaringan ditambahkan etanol 95% sebanyak setengah volume filtrat. Ekstrak disaring dengan penyaring vakum yang telah dilapisi kertas Whatman No.1. Ekstrak yang diperoleh selanjutnya dipekatkan dengan vaccum evaporator pada suhu 40oC untuk menghilangkan sisa pelarut sehingga diperoleh rendemen berupa ekstrak antosianin.
Ekstrak antosianin yang diperoleh dilakukan karakterisasi meliputi rendemen ekstrak, total antosianin, total padatan terlarut ekstrak, dan pH ekstrak. Selain itu dilakukan pengukuran dengan menggunakan chromameter sebagai sumber data objektif untuk melihat nilai L, a, dan b.
b. Ekstraksi Brazilein ( Ye Min et al., 2006)
Kayu secang kering digiling menggunakan disc mill untuk memperkecil ukuran. Sebanyak 100 gram kayu secang diekstrak dengan 1000 ml etanol 50% sebanyak 3x30 menit pada suhu 800C. Filtrat dan ampas kayu kemudian dipisahkan dengan saringan. Filtrat yang didapat kemudian disaring dengan penyaring vakum yang telah dilapisi kertas Whatman No.1. Ekstrak yang diperoleh selanjutnya dipekatkan dengan vaccum evaporator pada suhu 40oC untuk menghilangkan sisa pelarut sehingga diperoleh rendemen berupa bubuk brazilein kering.
20 Ekstrak brazilein yang diperoleh dilakukan karakterisasi meliputi rendemen ekstrak, total brazilein, kadar air, dan pH ekstrak. Selain itu dilakukan pengukuran dengan menggunakan chromameter sebagai sumber data objektif untuk melihat nilai L, a, dan b.
2. Pengujian Stabilitas Antosianin dan Kopigmentasi Antosianin-Brazilein
Pada tahap ini dilakukan pembuatan model minuman yang terdiri dari model minuman antosianin dan kopigmentasi antosianin-brazilein. Selanjutnya dilakukan pengujian stabilitas terhadap pemanasan dan sinar UV.
a. Pembuatan Model Minuman dan Kopigmentasi
Model minuman merupakan media yang digunakan untuk mengetahui kestabilan antosianin dan kopigmentasi antosisnin-brazilein. Model minuman ringan terdiri dari air minum dalam kemasan, sukrosa 10 % , ekstrak antosianin, dan brazilein. Model minuman yang dibuat merupakan model pangan memiliki pH rendah. Model minuman yang dibuat terdiri dari model minuman antosianin dan model minuman kopigmentasi antosianin-brazilein Penambahan antosianin dan brazilein pada model minuman berdasarkan perbandingan molar. Jumlah antosianin dan brazilein yang ditambahkan dapat terlihat pada Tabel 2.
Antosianin dari rosela dinyatakan sebagai delpinidin 3-glukosida dengan massa molekul relatif 501 gr/mol, sedangkan massa molekul relatif brazilein 284.3 gr/mol. Model minuman yang diperoleh dilakukan pengukuran terhadap serapan panjang gelombang maksimal.
Model minuman diperoleh selanjutnya dilakukan pengujian terhadap stabilitas pemanasan dan penyinaran dengan UV. Model minuman yang dilakukan pengujian stabilitas pemanasan sebelumnya tidak dilakukan proses pemanasan. Sedangkan model minuman yang
21 akan diuji stabilitas penyinaran dengan UV dilakukan pemanasan karena penyimpanan pada suhu ruang.
Tabel 2. Jumlah antoisianin dan brazilein yang ditambahkan pada model minuman Jumlah antosianin (ml) Jumlah brazilein (mg) Konsentrasi antosianin (M) Konsentrasi brazilein (M) Perbandingan antosianin: brazilen 1 0 5.82x10-5 0 1:0 1 4.5 5.82x10-5 1.74 x10-4 1:3 1 6.0 5.82x10-5 2.32 x10-4 1:4 1 7.6 5.82x10-5 2.91 x10-4 1:5 1 9.1 5.82x10-5 3.50 x10-4 1:6 1 10.6 5.82x10-5 4.07 x10-4 1:7
b. Stabilitas Warna terhadap Suhu Pemanasan
Sebanyak 10 ml model minuman yang telah ditambahkan dengan pigmen antosianin dan kopigmentasi antosianin-brazilein dimasukkan ke dalam botol gelap. Model minuman dipanaskan pada suhu 40oC, 50oC, 60oC, 70oC, dan 80oC. Pengukuran stabilitas dilakukan setiap 15 menit untuk suhu 80oC selama 2 jam, 30 menit untuk suhu 70oC selama 4 jam, 45 menit untuk suhu 60oC selama 6 jam, 60 menit untuk suhu 50oC selama 8 jam, 75 menit untuk suhu 40oC selama 10 jam.
c. Stabilitas Warna terhadap Sinar UV
Sebanyak 10 ml model minuman yang telah ditambahkan dengan pigmen antosianin dan kopigmen brazilein dimasukkan ke dalam botol bening. Sebelum dilakukan penyinaran UV, model minuman dilakukan pasteurisasi pada suhu 85oC selama 15 menit. Selanjutnya model minuman diletakkan di bawah lampu dengan panjang gelombang pendek (UV) 20 watt selama 6 hari. Sampel diletakkan dalam aquarium kaca dengan ukuran 90x60x45 cm. Jarak antara lampu dengan model minuman adalah 30 cm.
22 Pengukuran intensitas warna dilakukan setiap hari. Pengukuran dilakukan untuk mengetahui stabilitas warna karena pengaruh sinar UV. Stabilitas warna diukur dengan menggunakan spektrofotometer pada panjang gelombang 520 nm untuk model minuman antosianin dan 515 nm untuk model minuman kopigmentasi antosianin-brazilein untuk melihat nilai absorbansi. Selain itu pengukuran juga dilakukan dengan chromameter untuk melihat nilai L, a, dan b.
C. METODE ANALISIS
1. Penentuan Rendemen Ekstrak
Rendemen ekstrak dihitung dalam persen yang menyatakan banyaknya ekstrak yang terdapat di dalam sampel berdasarkan berat sampel. Rendemen ekstrak dapat dilihat pada rumus :
Rendemen ekstrak = x 100 %
2. Analisis Total Padatan Terlarut (AOAC, 1995)
Sebanyak 1-2 gram ekstrak rosela cair ditimbang dan diletakkan dalam cawan petri kemudian diuapkan menggunakan penangas selama 30 menit. Setelah itu dimasukkan ke dalam oven selama 3.5 jam pada suhu 100-105°C.
Setelah dingin cawan ditimbang dan kemudian dimasukkan kembali ke dalam oven beberapa menit. Setelah itu, dimasukan ke dalam desikator untuk didinginkan kemudian ditimbang. Tahap ini dilakukan berulang sampai didapatkan berat yang konstan dari sampel.
Keterangan :
a = berat awal sampel
23 3. Analisis Kadar Air (SNI 01-2891-1992)
Penentuan kadar air ini didasarkan atas perbedaan berat sampel sebelum dengan setelah dikeringkan dengan oven. Cawan aluminium dikeringkan pada suhu 100-105°C selama 15 menit kemudian didinginkan dalam desikator. Sebanyak 1-2 gram brazilein ditimbang dan dimasukkan ke dalam cawan aluminium yang telah dikeringkan. Sampel beserta cawan dikeringkan dalam oven selama 3 jam pada suhu 100-105°C dan didinginkan dengan cara memasukkannya dalam
desikator.
Setelah dingin cawan ditimbang kemudian dimasukkan kembali ke dalam oven selama beberapa menit. Sampel dimasukan kembali ke dalam desikator untuk didinginkan selanjutnya ditimbang. Tahap ini dilakukan berulang sampai didapatkan berat yang konstan dari sampel. Kadar air sampel dihitung dengan rumus berikut :
Keterangan :
a = berat awal sampel
b = berat sampel setelah dikeringkan
4. Analisis Spektrofotometri Total Antosianin (Modifikasi Igelias et al., 2008)
Sebanyak 0.1 ml ekstrak antosianin ditepatkan sampai volume 50 ml dengan modifikasi pelarut yang metanol 24.6 M dan HCl 1N dengan perbandingan 98:2. Sampel yang telah terekstrak disimpan dalam ruang gelap yang ditutup dengan aluminium foil selama 1 malam pada suhu 40C. Ekstrak antosianin diukur dengan spektrofotometer pada panjang gelombang 543 nm. Perhitungan total antosianin dapat dihitung dengan rumus:
A= εxbxc Jumlah antosianin (mg/ml sampel) =
24 Keterangan : A = absorbansi ε = emisifitas antosianin (2.9 x 104 liter/mol) b = lebar kuvet (1.1cm)
c = konsentrasi ekstrak (mol/liter)
BM = massa molekul relatif delphinidin 3-glukosida (501 gr/mol)
5. Analisis Spektrofotometri Total Brazilein
Analisis total brazilein dilakukan dengan menggunakan kurva standar. Larutan stok brazilein murni dibuat dengan melarutkan 1 mg/ml etanol 95%, selanjutnya dilakukan beberapa seri pengenceran yaitu 0.05, 0.06, 0.07, 0.08, 0.09, 0.10, dan 0.11 mg/ml. Pengukuran absorbansi dilakukan dengan spektrofotometer dengan panjang gelombang 445 nm. Sebanyak 5 mg ekstrak dilarutkan dengan 10 ml etanol 95 % kemudian diukur pada absoransi 445 nm. Penghitungan total brazilein dilakukan dengan rumus:
Jumlah brazilein (mg/mg sampel) = Keterangan:
c = konsentrasi ekstrak yang didapat dari kurva standar
(mg/ml)
FP = faktor pengenceran
6. Pengamatan Warna Metode Chromameter (Hutching, 1999)
Pengukuran warna dilakukan dengan Minolta Chroma Meters CR-310. Prinsip dari Minolta Chroma Meters adalah pengukuran perbedaan warna melalui pantulan cahaya oleh permukaan sampel. Chromameter adalah suatu instrument untuk analisis warna secara terstimulus untuk mengukur warna yang dipantulkan suatu permukaan. Data pengukuran yang diperoleh dapat berupa nilai absolut maupun nilai selisih dengan warna standar.
Sistem warna Hunter Lab memiliki tiga atribut yaitu L, a, dan b. Nilai L menunjukkan kecerahan sampel, memiliki skala dari 0 sampai 100 dimana 0 menyatakan sampel sangat gelap dan 100 menyatakan
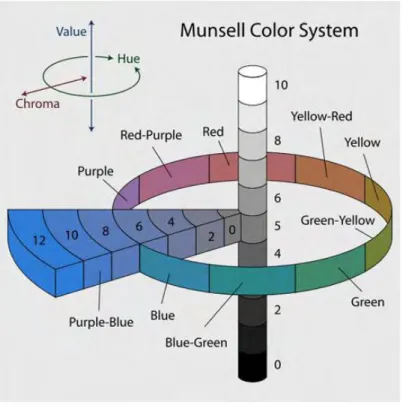
25 sampel sangat cerah. Nilai a menunjukkan derajat merah atau hijau sampel. Nilai a positif menunjukkan warna merah dan a negatif menunjukkan warna hijau. Nilai a memiliki skala dari -80 sampai 100. Nilai b menunjukkan derajat kuning atau biru. Nilai b positif menunjukkan warna kuning dan b negatif menunjukkan warna biru. Nilai b memiliki skala dari -70 sampai 70. Pengukuran juga dilakukan terhadap nilai ohue dan ∆E. Nilai ohue menggambarkan kisaran warna kromatis yang dapat dilihat pada Tabel 3. Nilai ∆E menggambarkan perubahan warna yang terjadi secara keseluruhan. Sebelum digunakan chromameter harus dilakukan kalibrasi. Kalibrasi menggunakan plat putih dengan nilai Y = 92,89, x = 0.3178, dan y = 0.3338.
o
hue = tan-1(b/a) ∆E=[(∆L)2+(∆a)2+(∆b)2]1/2
Daerah warna suatu bahan dapat diketahui melalui nilai ohue seperti Gambar 8.
26 Tabel 3. Nilai ohue dan daerah kisaran warna kromatis
Nilai ohue Daerah kisaran warna
342o-18o Merah-Ungu 18o-54o Merah 54o-90o Kuning-Merah 90o-126o Kuning 126o-162o Kuning-Hijau 162o-198o Hijau 198o-234o Biru-Hijau 234o-270o Biru 270o-306o Biru-Ungu 306o-342o Ungu
7. Analisis Stabilitas Model Minuman (Gradinaru et al., 2002)
Laju degradasi pigmen diperoleh dengan menghubungkan nilai retensi warna dengan waktu. Kinetika laju degradasi mengikuti persamaan Arhenius orde satu.
Pengamatan kinetika degradasi antosianin dilakukan melalui persamaan matematis yang diinterpretasikan sebagai berikut :
=
ln At-ln Ao = - kt + C ln At/Ao= -kt + C dimana:
At = konsentrasi pigmen pada waktu tertentu Ao = konsentrasi awal pigmen
k = konstanta laju reaksi (menit-1) t = waktu (menit)
Berdasarkan nilai k yang bisa dihitung waktu paruh (t 1/2). Waktu paruh (t1/2) bisa dihitung dengan persamaan :
t ½ dimana:
k = konstanta laju reaksi (menit-1) t = waktu (menit)
27 Setelah nilai k didapat dari masing-masing suhu. Selanjutnya dibuat grafik hubungan antara 1/T (K-1) dengan ln k (menit-1) yang dapat dihitung dengan persamaan:
k = ko e-Ea/RT ln k = ln ko – Ea/RT dimana :
k = tetapan laju reaksi ko = faktor frekwensi
Ea = energi aktivasi (kal atau Joule)
R = tetapan gas (1.987 kal/mol K atau 8.3145 J/mol K) T = suhu mutlak (K)
28 IV. HASIL DAN PEMBAHASAN
A. EKSTRAKSI DAN KARAKTERISASI PIGMEN
Ekstraksi adalah proses penarikan komponen dari suatu sampel dengan menggunakan pelarut tertentu. Pada umumnya ekstraksi zat warna dari bagian tanaman merupakan ekstraksi yang sederhana. Polaritas merupakan hal yang penting diperhatikan dalam proses ekstraksi. Senyawa polar hanya dapat larut dalam pelarut polar. Antosianin dan brazilein merupakan flavonoid yang bersifat polar sehingga akan lebih mudah larut pada pelarut yang bersifat polar (Markakis, 1982).
Jenis pelarut yang digunakan dalam proses ekstraksi harus dapat mendenaturasi membran sel serta melarutkan pigmen (Elbe dan Schwartz, 1996). Menurut Amr dan Al-Tamimi (2007) ekstraksi dengan metanol yang diasamkan lebih efektif dibandingkan dengan etanol dan aquades. Namun metanol bersifat toksik sehingga penggunaan pada bahan pangan jarang digunakan.
1. Ekstraksi dan Karakterisasi Antosianin
Ekstraksi antosianin dilakukan dengan menggunakan pelarut aquades. Aquades digunakan karena bersifat polar dan tidak bersifat toksik. Menurut Kristie (2008) ekstrak antosianin dengan menggunakan aquades memiliki warna yang lebih cerah dibandingkan dengan ekstrak menggunakan etanol 95%. Pada penelitian ini tidak digunakan aquades yang diasamkan karena rosela secara alami sudah mengandung asam sitrat dan malat (Maryani dan Kristina, 2005). Penambahan asam akan meningkatkan rasa asam dari ekstrak antosianin yang akan berpengaruh pada cita rasa asam yang dihasilkan.
Penambahan etanol 95% sebanyak setengah dari filtrat rosela bertujuan melarutkan gum dan gula pada ekstrak. Gum dan gula yang terdapat pada ekstrak akan menyebabkan ekstrak menjadi lengket ketika dikeringkan dengan vaccum evaporator.
29 Proses pemekatan atau penguapan pelarut dilakukan pada suhu 40°C. Hal ini bertujuan untuk mengurangi kerusakan pigmen antosianin akibat panas yang berlebihan. Penguapan terjadi pada ruangan vakum bertekanan tinggi sehingga dibutuhkan suhu yang relatif rendah.
Penggunaan etanol pada penelitian ini kurang efektif untuk melarutkan gula dan gum. Hal ini dapat terlihat dari ekstrak yang dihasilkan masih lengket. Untuk menghindari hal tersebut sebaiknya ekstrak rosela tidak dipekatkan sampai kering tetapi sampai menjadi konsentrat dengan konsentrasi tertentu.
Rendemen ekstrak dihitung dalam persen yang menyatakan banyaknya ekstrak yang terdapat di dalam sampel berdasarkan berat basah. Rendemen ekstrak antosianin yang diperoleh sebesar 30.84% (b/b). Ekstrak antosianin dari rosela yang diperoleh, selanjutnya diencerkan 2 kali dengan air untuk memudahkan dalam proses pencampuran selanjutnya. Ekstrak antosianin dilakukan karakterisasi yang meliputi total padatan terlarut, total antosianin, dan pH. Karakteristik ekstrak antosianin dari rosela dapat dilihat pada Lampiran 1 dan Tabel 4.
Tabel 4. Karakteristik ekstrak antosianin rosela Karakteristik ekstrak Nilai Total padatan terlarut
Ekstrak padat(%) 72.26+ 0.39 Ekstrak cair(%) 22,43 + 0.11 Total antosianin Ekstrak padat 3.4822+0.00 (mg/g ekstrak) Ekstrak cair 1.4861+0.00 (mg/ml ekstrak)
Warna ekstrak cair
L 22.16
a 1.71
b -1.04
o
30 Total padatan terlarut ekstrak padat sebesar 72.26%, ketika ekstrak diencerkan dengan aquades menjadi 22.43%. Total antosianin ekstrak padat sebesar 3.4822 mg/g ekstrak, dan ketika ekstrak diencerkan menjadi 1.4861 mg/ml (Lampiran 1 dan Tabel 4).
Analisis karakteristik ekstrak antosianin yang diperoleh bertujuan untuk mengetahui jumlah antosianin yang perlu ditambahkan pada tahap penelitian selanjutnya yaitu pembuatan model minuman dan kopigmentasi.
Pengukuran total antosianin kelopak kering bunga rosela diperoleh sebesar 0.4567 mg/g kelopak kering. Kandungan antosianin plum sebesar 0.25 mg/g, chery 0.02 mg/g, dan strawberi 0.15 mg/g (Mateus dan Freitas, 2009). Berdasarkan data diatas terlihat bahwa kandungan antosianin plum, chery, dan strawberi lebih sedikit dibandingkan dengan antosianin rosela. Bisa dikatakan rosela potensial dikembangkan sebagai sumber pigmen alami antosianin.
Nilai L ekstrak antosianin dari rosela sebesar 22.16 pada skala 1-100. Nilai L menggambarkan kecerahan dimana semakin kecil nilai L maka nilai kecerahan semakin rendah sedangkan semakin tinggi nilai L maka kecerahan semakin tinggi. Berdasarkan hasil tersebut dapat diketahui bahwa ekstrak antosianin memiliki kecerahan yang rendah (gelap). Ekstrak rosela dapat terlihat pada Gambar 9.
Nilai a merupakan koordinat kromatis yang menggambarkan nilai merah atau hijau dengan skala -80 sampai 100. Nilai a positif menunjukkan derajat kemerahan sampel, sedangkan nilai a negatif menggambarkan derajat kehijauan sampel. Nilai a ekstrak yang diperoleh sebesar 1.71 menunjukkan ekstrak memiliki derajat kemerahan.
Nilai b menggambarkan warna kromatis biru dan kuning. Nilai b berada pada skala -70 sampai 70. Nilai b positif menunjukkan derajat warna kuning sampel sedangkan nilai b negatif menggambarkan derajat biru sampel. Nilai b ekstrak sebesar -1.04 yang menunjukkan bahwa ekstrak memiliki derajat warna biru.
Nilai ohue ekstrak yaitu 328.69o dengan kisaran warna ekstrak yaitu merah ungu. Nilai pH ekstrak yang diperoleh sebesar 2.41. Menurut