I. PENGENALAN MIKROSKOP DAN SEL Tujuan Percobaan
1 Mengenal bagian-bagian dari suatu mikroskop serta fungsi dari masing-masing bagian tersebut
2 Menggunakan mikroskop secara baik dan benar 3 Mengetahui cara-cara pemeliharaan mikroskop 4 Membuat preparat basah tumbuhan dan hewan Latar Belakang
Mikroskop merupakan alat utama yang digunakan dilaboratorium. Mikroskop merupakan alat bantu yang memungkinkan kita untuk mengamati objek yang berukuran sangat kecil. Hal ini membantu memecahkan persoalan manusia tentang organisme yang berukuran kecil. Sel adalah unit terkecil yang menunjukkan semua sifat yang dihubungkan dengan kehidupan.
Dasar Teori
Penemuan lensa yang dapat memperbesar bayangan sesuatu obyek sampai beberapa kali lipat telah membuka kesempatan bagi para biologiwan untuk mengamati jasad renik atau bagian-bagian organisme yang tak dapat dilihat dengan mata telanjang. Alat pembesar yang paling sederhana adalah kaca pembesar (loupe) atau surya kanta. Mikroskop banyak jenisnya diantaranya mikroskop lensa tunggal, mikroskop optik dan mikroskop elektron.
a. Mikroskop lensa tunggal
Mikroskop ini merupakan mikroskop yang paling sederhana. Cara penggunaan mikroskop ini adalah dengan meletakkan obyek yang diperiksa pada ujung jarum dan sisi lain lensa di bawa ke dekat mata. Dengan menekan atau mengendorkan jarum di depan lensa, akan diperoleh titik fokusnya. Kaca pembesar jaman sekarang bentuknya sangat praktis, hanya berupa lensa yang diberi tangkai pemegang.
Mikroskop ini menggunakan lensa dari gelas dan cahaya matahari atau lampu sebagai sumber penyinaran. Cahaya dari luar yang dikumpulkan dan dipantulkan oleh cermin, akan mengenai spesimen sehingga menghasilkan bayangan dari spesimen yang akan diperbesar oleh lensa dan kemudian diterima oleh mata. Mikroskop optik yang banyak digunakan sekarang tersusun atas dua lensa atas dua lensa yaitu lensa okuler (occult=mata) yang dekat dengan mata dan lensa obyektif yang dekat obyek. Maisingmasing jenis lensa ini di dalamnya berisi beberapa lensa dengan susunan tertentu. Perbesaran yan dapat diperoleh dari masing-masing jenis lensa ditentukan oleh susunan dari lensanya dan biasanya ditulis pada bagian luar lensa dan perbesaran total mikroskop merupakan perkalian dari perbesaran masing-masing lensa. Beberapa mikroskop optik mempunyai satu lensa okuler dan mikroskop jenis dinamakan mikroskop okuler.
c. Mikroskop Elektron
Karena keterbatasan cahaya dan sulitnya membuat lensa yang sangat tipis maka sangat sulit untuk mendapatkan perbesaran yang lebih tinggi dari 2000 x dengan mikroskop monokuler. Untuk mengamati bagian-bagian sel yang sangat halus digunakan mikroskop elektron yang menggunakan magnit sebagai pengganti lensa, dan elektron sebagai pengganti cahaya. Elektron mempunyai panjang gelombang yang lebih pendek daripada cahaya putih sehingga mempunyai daya tembus yang lebih besar. Ada dua jenis mikroskop elektron yaitu: mikroskop elektron transmisi (TEM = Transmission Electron Microscope) dan mikroskop elektron skening (SEM = Scanning Electron Microscope). Pada mikroskop elektron transmisi, elektron menembus spesimen akan oleh medan magnit sehingga perbesarannya dapat sampai 1 juta kali ukuran obyeknya.
Pada kegiatan praktikum ini dipelajari bagian-bagian dari mikroskop optik yang terdiri atas:
1. Bagian Optik
a. Cermin, digunakan untuk menerima cahaya matahari atau lampu dan memantulkannya ke dalam kondensor.
b. Kondensor, terdiri atas lensa kompleks dan digunakan untuk mengumpulkan cahaya yang terpantul atau terbias dari cermin. Di dalam kondensor terdapat diafragma yang berfungsi untuk mengatur banyaknya cahaya mengenai spesimen.
c. Obyektif, terdiri atas lensa kompleks dan menerima cahaya setelah menembus spesimen yang diamati, sehingga terbentuk bayangan dari materi tersebut. d. Okuler, terdiri atas lensa kompleks, menerima bayangan semu dan terbalik.
2. Bagian Mekanis
a. Kaki dan tangkai mikroskop: sebagai penyangga bagian optik. Pada beberapa mikroskop monokuler tangaki mikroskop ini dapat digerakkan sehingga teropong dapat dibuat dalam posisi tegak atau membentuk sudut dengan bidang horizontal.
b. Knop penggerak bagian optik (teropong), yang terdiri atas dua jenis yaitu knop penggerak kasar(makrometer) digunakan untuk menggerakkan teropong dan mengatur fokus, dan knop penggerak halus (mikrometer) digunakan untuk mempertajam fokus, pada beberapa model pengaturan fokus dilakukan dengan menaik-turunkan meja benda.
c. Meja benda : terletak diantara kondensor dan obyektif, serta merupakan tempat untuk sediaan yang diamati. Pada meja benda ini terdapat penjepit sediaan atau alat pemegang sediaan sehingga dapat digeser ke kiri dan ke kanan dengan memutar knop yang ada.
d. Pembawa obyektif : terletak pada ujung teropong, dan digunakan untuk memutar dan tempat lensa obyektif.
Pemeliharaan Mikroskop
Kebersihan mikroskop sebelum dan setelah digunakan sangat penting karena adanya debu, kotoran atau bekas minyak, terutama yang melekat pada lensa akan mengganggu pengamatan yang akan dilakukan. Tetapi untuk membersihkan lensa tidak boleh menggunakan sembarang kain pembersih/lap.
Sel Hewan dan Sel Tumbuhan
Seperti telah kita ketahui bahwa salah satu ciri yang membedakan antara sel hewan dan sel tumbuhan dapat dilihat secara struktural yaitu melalui pengamatan secara mikroskopis. Pada umumnya sel hewan maupun sel tumbuhan mempunyai ukuran 30µ - 50µ. Dalam sayatan segar yang diamati di bawah mikroskop biologi, sel tersebut terlihat sangat transparan. Biasanya yang dapat kita lihat dengan cukup jelas adalah dinding sel, sitoplasma, inti atau nukleus dan kadang-kadang butir-butir inti atau nukleolus dan vakuola. Untuk dapat mengamatistruktur sel yang lebih jelas, maka sel tersebut harus difiksasi dan diwarnai terlebih dahulu. Fiksasi disini bertujuan untuk mematikan sel secara cepat sehingga menjaga agar strukturnya sedapat mungkin tidak berubah. Sedangkan tujuan pewarnaan adalah agar dapat dibedakan dengan jelas struktur bagian-bagiannya.
Langkah-langkah yang perlu dilakukan adalah (Non-Virtual):
a. Keluarkan mikroskop dari kotaknya dan letakkan di atas meja praktikum b. Bersihkan bagian luar mikroskop dengan kain lap yang bersih
c. Bersihkan lensa okuler dan obyektif dengan kain flanel atau kertas pembersih lensa yang tersedia. Dengan melihat melalui okuler dan tanpa ada sediaan pada meja benda, uji apakah lensanya sudah cukup bersih
d. Hindarkan lensa terkena air atau zat kimia lainnya. Bila hal ini terjadi, segera bersihkan dengan pembersih lensa
e. Apabila pengamatan telah selesai, bersihkan lensa dan bagian luar mikroskop seperti pada waktu akan memakai
f. Sebelum dimasukkan kotak, uji apakah di dalam kotak tersedia bahan pengering (silica gel), bila belum ada, mintalah kepada laboran atau asisten.
Cara Penggunaan Mikroskop (Non-Virtual):
a. Letakkan mikroskop pada meja yang datar dan kokoh
b. Putarlah pembawa obyektif, sehigga obyektif yang perbesarannya yang paling tepat di atas kondensor
c. Putarlah knop makrometer, sehingga teropong terangkat (kira-kira 5 mm) dari meja benda, atau turunkan meja bendanya apabila makrometernya pada meja benda
d. Bukalah difragma sampai maksimum
e. Dengan melihat ke dalam okuler, aturlah cermin sedemikian rupa sehingga didapat lingkaran pandang yang terang
f. Letakkan sediaan yang akan dimati pada meja benda, kemudian turunkan teropong dengan hati-hati sampai ujung lensa obyektif hampir menyentuh permukaan sediaan atau naikkan meja benda apabila makrometernya pada meja benda
g. Dengan melihat ke dalam okuler putarlah mikrometer dengan perlahan-lahan sehingga spesimen pada sediaan nampak jelas
h. Untuk mencari bagian spesimen yang diinginkan, geser sediaan hingga ketemu dan kemudian jepitlah sediaan hingga tidak bergeser-geser
i. Pertajam fokus spesimen dengan perlahan-lahan memutar knop mikrometer j. Apabila bayangan nampak terlalu terang, kurangi pembukaan diafragma sedikti
demi sediktit, hingga lensa obyektif yang dikehendaki tepat di atas speseimen Pada waktu mengganti lensa, jangan sampai ujung lensa menyentuk permukaan gelas penutup, karena geseran itu akan menggores pada lensa obyektif
k. Untuk perbesaran lensa obyektif yang paling kuat (1000 x), sebelu mengganti lensa obyektif teteskan minyak imersi pada permukaan gelas penutup lebih dahulu.
Cara Penggunaan Mikroskop (Virtual): Penjelasan Model
1. Dengan menggunakan browser Mozilla buka halaman
http://www1.udel.edu/biology/ketcham/microscope/scope.html 2. Klik “Start Tour”.
3. Simak penjelasan dari video tersebut.
4. Arahkan kursor laptop pada bagian kiri bawah tombol ON-OFF mikroskop hingga kalimat “light on” pada bagian terceklis
5. Putar pengatur cahaya yang berada di samping tombol ON-OFF sampai menunjukkan angka 10 dan pada bagian “rheostat at 10” terceklis.
6. Pilih preparat yang akan anda amati. Preparat telah tersedia pada bagian kanan atas. Preparat terdiri dari: preparat huruf e, preparat ujung akar bawang, preparat bakteri, preparat mukosa
7. Atur perbesaran lensa pada perbesaran 4X dengan cara menekan tahan dan menggeser kursor pada bagian lensa sehingga kalimat “Scanning (4X) lens in place” terceklis.
8. Klik makrometer horizontal dan mikrometer horizontal pada bagian sebelah kanan meja preparat hingga preparat berada di tengah. Hal ini ditandai dengan tercentangnya “specimen centered (open iris temporarily to do this)“ pada bagian checklist.
9. Putar knop makrometer vertikal dengan cara tekan dan tahan kursor pada knop makrometer vertikal sampai meja mikroskop telah berada di posisi tepat di bawah lensa objektif. Hal ini ditandai dengan tercentangnya bagian “start stage at top position” di checklist.
11. Atur lensa binokuler sampai terbentuk satu lingkaran dan bayangan preparat dapat diamati dengan cara menekan tahan lensa binokuler pada bagian kanan dan digeser ke bagian kiri. Hal ini ditandai dengan tercentangnya “adjust ocular” pada checklist.
12. Atur mikroskop sampai bayangan terlihat jelas dengan mengatur “coarse focus” dengan mengeklik knop makrometer vertikal.
13. Atur iris diafragma dengan menggeser tangkai diafragma hingga “adjust iris diaphragm” pada checklist tercentang.
14. Atur “fine focus” dengan mengeklik knop mikrometer vertikal.
15. Atur “center image” dengan menekan makrometer horizontal dan mikrometer horizontal di sebelah kanan meja preparat.
16. Apabila pada bagian checklist telah tercentang semua lampirkan bukti anda telah melakukan pengamatan dengan benar berupa foto.
Preparat Bakeri Preparat Ujung Akar Bawang
II. PENGAMATAN MIKROSKOPIS MIKROORGANISME Tujuan Percobaan
Mengamati morfologi berbagai macam organisme tingkat rendah (ganggang atau protozoa) dan cara penyiapan preparatnya.
Latar Belakang
Mikroorganisme adalah organisme yang berukuran sangat kecil (biasanya kurang dari 1 mm) sehingga untuk mengamatinya diperlukan alat bantuan mikroskop. Mikroorganisme seringkali bersel tunggal (uniselular) meskipun beberapa protista bersel tunggal masih terlihat oleh mata telanjang dan ada beberapa spesies multisel tidak terlihat mata telanjang. Ilmu yangmempelajari mikroorganisme disebut mikrobiologi.
Dasar Teori
Dalam praktikum ini anda akan mempelajari cara penyiapan preparat basah untuk mengamati mikroorganisme dalam keadaan hidup. Teknik yang dapat digunakan adalah teknik lekapan basah. Preparat yang bersifat basah yang anda siapkan memungkinkan anda mengamati bentuk dan ukuran mikroorganisme secara individu, dan motilitasnya dalam keadaan alamiah. Anda dapat membedakan motilitas mikroorganisme yang anda amati dengan gerak Brown.
Pergerakan secja (motilitas) biasanya sangat cepat dan terarah. Sedangkan gerak Brown merupakan gerakan menggetar partikel-partikel dalam varian secara acak atau tidak terarah dan terus-menerus. Hal ini menyebabkan mikroorganisme motil dan non motil berubah posisinya dan terlihat seperti bergerak. Dalam pengamatan ini, anda harus juga membedakan pergerakan sejati dengan pergerakan yang disebabkan oleh arus vairan. Keadaan ini disebabkan karena preparat bsah yang anda buat mengandung gelembung udara atau tidak tersegel dengan baik, sehingga timbul arus udara yang menyebabkan mikroorganisme yang anda amati bergerak mengalir mengikuti arus cairan tersebut.
Pergerakan sejati mikroorganisme disebabkan karena adanya flagella (bakteri, beberapa ganggang dan protozoa), adanya silia atau pseudopodia (pergerakan amuboid) pada beberapa protozoa. Flagella mungkin sukar untuk
diamati dengan mikroskop cahaya. Pewarnaan khusus atau pengamatan dengan menggunakan mikroskop elektron, flagella ini akan mudah diamati.
Alat Dan Bahan
Adapun alat dan bahan yang digunakan dalam praktikum ini adalah 1. Mikroskop
2. Lampu spritus
3. Air rendaman jerami umur 2-3 hari 4. Gelas benda dan gelas penutup 5. Vaselin
6. Kertas lensa/tisue 7. Air kolam
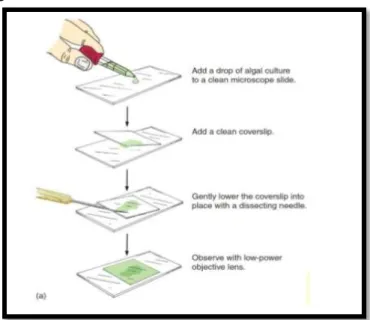
Prosedur Kerja (Non-Virtual):
1. Ambilah setetes air rendaman jerami/air kolam dan letakkan diatas obyek glass 2. Usapkan sedikit vaselin di ujung jari tangan kiri anda sehingga membentuk
lapisan tipis. Sentuhkan vaselin tersebut pada keempat sisi gelas penutup 3. Arahkan muka kaca penutup yang telah bervaselin menghadap ke arah obyek
gelas, secara perlahan letakkan kaca penutup dalam media dan tekan perlahan sehingga tersegel baik.
Gambar 3. Cara meletakkan cover glass di atas obyek (air kolam atau preparat basah yang lain) di atas obyek glass.
5. Amati apakah ada pergerakan dan gambar serta beri keterangan tentang mikroorganisme yang anda amati dan cantumkan pula perbesarannya
6. Gambar spesimen yang anda amati dan beri keterangan seperlunya pada buku laporan
7. Bersihkan lensa mikroskop secara hati-hati dengan menggunakan kertas lensa setelah selesai pengamatan.
Prosedur Kerja (Virtual): Penjelasan Model
1. Dengan menggunakan browser Mozilla buka halaman
http://www1.udel.edu/biology/ketcham/microscope/scope.html 2. Klik “Start Tour”
3. Simak penjelasan dari video tersebut.
4. Arahkan kursor laptop pada bagian kiri bawah tombol ON-OFF mikroskop hingga kalimat “light on” hingga pada tabel terceklis
5. Putar pengatur cahaya yang berada di samping tombol ON-OFF sampai menunjukkan angka 10 dan pada bagian “rheostat at 10” terceklis
6. Pilih preparat yang akan anda amati. Preparat telah tersedia pada bagian kanan atas. Preparat terdiri dari: preparat huruf e, preparat ujung akar bawang, preparat bakteri, preparat mukosa
7. Atur perbesaran lensa pada perbesaran 4X dengan cara menekan tahan dan menggeser kursor pada bagian lensa sehingga kalimat “Scanning (4X) lens in place” terceklis.
8. Klik makrometer horizontal dan mikrometer horizontal pada bagian sebelah kanan meja preparat hingga preparat berada di tengah. Hal ini ditandai dengan tercentangnya “specimen centered (open iris temporarily to do this)“ terceklis.
9. Putar knop makrometer vertikal dengan cara tekan dan tahan kursor pada knop makrometer vertikal sampai meja mikroskop telah berada di posisi tepat di bawah lensa objektif. Hal ini ditandai dengan tercentangnya bagian “start stage at top position” di checklist.
11. Atur lensa binokuler sampai terbentuk satu lingkaran dan bayangan preparat dapat diamati dengan cara menekan tahan lensa binokuler pada bagian kanan dan digeser ke bagian kiri. Hal ini ditandai dengan terceklisnya “adjust ocular”.
12. Atur mikroskop sampai bayangan terlihat jelas dengan mengatur “coarse focus” dengan mengeklik knop makrometer vertikal.
13. Atur iris diafragma dengan menggeser tangkai diafragma hingga “adjust iris diaphragm” pada checklist tercentang.
14. Atur “fine focus” dengan mengeklik knop mikrometer vertikal.
15. Atur “center image” dengan menekan makrometer horizontal dan mikrometer horizontal di sebelah kanan meja preparat.
16. Apabila pada bagian checklist telah tercentang semua lampirkan bukti anda telah melakukan pengamatan dengan benar berupa foto.
Preparat Bakeri Preparat Ujung Akar Bawang
III. MIKROBIOLOGI TANAH “Identifikasi Bakteri Tanah”
Tujuan: Mahasiswa dapat mengidentifikasi jenis bakteri dari berbagai macam jensi tanah.
Landasan Teori
Tanah merupakan habitat dari makhluk hidup baik yang berada di atas tanah maupun di dalam tanah. Di dalam tanah, bakteri memegang peran penting dalam merombak bahan organik atau serasah-serasah daun yang telah membusuk. Identifikasi bakteri yang dilakukan bertujuan untuk pengelompokkan dan pengklasifikasian bakteri apa saja yang bersimbiosis pada tanah tersebut. Bakteri taanh dapat dikelompokkan dalam beberapa karakteristik, antara lain berdasarkan sumber makanan, kebutuhan oksigen, dan penyediaan hara bagi tanaman.
A. STERILISASI
1. Alat dan Bahan a) Alat 1. Autoklaf 2. Cawan petri 3. Tabung reaksi 4. Pipet tetes 5. Labu erlenmeyer 6. Gelas ukur b) Bahan 7. Koran 8. Kapas 9. Perban 10. Akuades 2. Prosedur Kerja
b) Alat yang terbuat dari bahan kaca diberi penutup dengan menggunakan kapas yang dibalut kasa dan dilapisi koran pada seluruh permukaan alat tersebut
c) Dimasukkan alat dan bahan yang akan disterilisasi ke dalam keranjang autoklaf
d) Dilakukan cek kelengkapan perangkat sterilasi dengan menggunakan autoklaf
e) Dimasukkan keranjang beserta alat dan bahan yang disterilisasi ke dalam autoklaf tutup autoklaf sesuai dengan prosedur penggunaan dan atur tekanan 1 atm suhu 121 dan waktu 1 menit
f) Setelah sterilisasi selesai, tunggu uap dalam autoklaf habis, dan dibukalah autoklaf sesuai dengan prosedur dan diangkatlah keranjang autoklaf dan dikeluarkan alat bahan yang telah disterilkan
B. PENGENCERAN 1. Alat dan Bahan
a) Alat
1. Breker glass 2. Tabung reaksi 3. Rak tabung reaksi 4. Pipet tetes
5. Batang pengaduk b) Bahan
1. Larutan NaCl 0,9 %
2. Tanah perkebunan kacang panjang 3. Tanah pembakaran sampah
2. Prosedur Kerja
a) Disiapkan alat dan bahan yang diperlukan
b) Diambil sampel tanah dari kacang perkebunan kacang panjang dan tanah pembakaran sampah sedalam 20 cm dengan menggunakan
pipa paralon bersih sehingga tidak terjadi kontaminasi dengan bakteri lainnya
c) Disiapkan larutan NaCl 0,9 % sebanyak 250 ml ke dalam gelas ukur
d) Disiapkan tabung rekasi sebanyak 10 buah dan masukkan 9 ml larutan NaCl 0,9 % ke dalam masing-masing 10 tabung reaksi e) Dilakukan pengenceran dasar masing-masing 1 gram tanah sampel
tanah ke dalam 9 ml larutan NaCl 0,9 % tabung pertama
f) Selanjutnya, dilakukan penghomogenan larutan dan sampel dengan cara diaduk menggunakan batang pengaduk atau cara penghomogenan lainnya
g) Dilakukan pengenceran pertama dengan cara mengambil 1 ml larutan dari tabung reaksi pertama ke dalam tabung reaksi kedua dan dihomogenkan
h) Dilakukan pengenceran selanjutnya seperti cara yang dilakukan dari langkah percobaan ke- 6 hingga pengenceran selesai
C. SCREENING BAKTERI 1. Alat dan Bahan
a) Alat Tabung Reaksi Jarum ose Bunsen Spirtus Alumunium Foil Kapas Kasa Benang 2. Prosedur Kerja
a) Dibuat media NA dengan bahan NA 5 gr, bacto agar 2 gram dan 250 ml aquades
b) Diaduk hingga mendidih
b) Bahan Media NA Suspensi
c) Disiapkan beberapaa tabung reaksi yang telah steril
d) Dimasukkan media NA kurang lebih sebanyak 4 ml kesetiap tabung reaksi
e) Diletakkan tabung reaksi dalam keadaan miring f) Didiamkan hingga dingin atau media telah padat
g) Diambil suspensi bakteri tanah dari cawan petri secara aseptik menggunakan jarum ose yang telah dipijarkan diatas api bunsen h) Distreak bakteri tersebut pada media miring dalam tabung reaksi
secara zig-zag, tanmpa menyentuh dinding tabung dan tidak merusak media NA, proses penyestreakan dilakukan dekat api bunsen
i) Ditutup tabung reaksi menggunakan kapas dan kasa yang telah dibentuk sebagai penutup tabung
j) Dibungkus menggunakan alumunium foil pada bagian atas tabung reaksi
k) Dilakukan inkubasi hingga biakan murni tumbuh (±24 jam) l) Diamati setelah 24 jam
m) Dituliskan hasil morfologi yang terlihat padaa media miring tersebut.
D. PEWARNAAN GRAM 1. Alat dan Bahan
a. Alat Pipet tetes Kaca objek Mikroskop Cover glass Jarum ose Bunsen spirtus 2. Prosedur Kerja
a) Diambil suspensi baakteri menggunakan jarum ose yang steril dan kerjanya secara aseptik
b) Diletakkan suspensi diatas kacaa obje
b. Bahan Suspensi Bakteri Tanah Aquadest Mikroskop Jarum Ose Bunsen Spirtus
c) Diteteskan aquades keatass kacaa object
d) Difiksasi kacaa objek yang telah berada koloni di tengahnya e) Diteteskan larutan pewarna kristal violet hingga menutupi seluruh
permukaan bakteri selama 1 menit
f) Dibilas seluruh permukaan kaca objek menggunakan aquades g) Diteteskan kemballi menggunakan larutan iodin yang akan di
ddiamkan selama ±1 menit
h) Dibilas menggunakan larutan alkohol 70% selama ±20 detik i) Ditetesi kambali dengan larutan pewarna sekunder yaitu safranin j) Dibilas larutan menggunakan aquades
k) Dikeringkan nian kaca objek menggunakan tisu, tetapi jangan sampai tisu dan kacaa objek bersentuhan
l) Diamati dibawah miroskop
m) Diamati apa saja warma yang terlihat, anatomin bentuk selnyaa dll.
E. UJI BIOKIMIA
1. UJI KATALASE 1.1. Alat dan Bahan
a) Alat Jarum Ose Kaca Objek Bunsen Incase b) Bahan Larutan H2O2 Kultur Bakteri 1.2. Prosedur Kerja
a) Diambil suspensi bakteri dari kultuir bakteri menggunakan jarum ose secara aseptic di dalam incase
c) Diteteskan larutan H2O2 pada kaca objek
d) Diamati pembentukan gelembung pada koloni bakteri 2. UJI KOH
2.1. Alat dan Bahan a) Alat Kaca objek Jarum ose Bunsen incase b) Bahan Larutan KOH 3% Kultur bakteri 2.2. Prosedur Kerja
a) Diambil suspensi bakteri dari kultuir bakteri menggunakan jarum ose secara aseptic di dalam incase
b) Distreak koloni bakteri pada kaca objek
c) Diteteskan larutan KOH 3% di atas koloni bakteri hingga semua koloni tertutupi
d) Diratakan KOH 3% pada koloni bakteri
e) Ditarik-tarik koloni bakteri menggunakan jarum ose secara perlahan-lahan.
f) Diamati perubahan yang terjadi pada bakteri. 3. UJI HIDROLISIS PATI
3.1. Alat dan Bahan a) Alat
Cawan petri Jarum ose Incase
Incubator Pipet tetes b) Bahan Starch agar Kultur bakteri Iodin 3.2. Prosedur Kerja
a) Dimasukkan starch agar ke dalam cawan petri hingga menutupi seluruh permukaan cawan peti, ditunggu hingga mengeras b) Diinokulasikan kultur bakteri pada bagian tengah media
menggunakan jarum ose
c) Diinkubasi dalam incubator selama 24-48 jam pada suhu 37 oC d) Ditambahkan beberapa tetes larutan iodin di atas permukaan
koloni isolate bakteri yang tumbuh. Uji positif apabila di sekeliling koloni terbentuk zona bening yang menandakan terjadinya hidrolisis pati dan uji bernilai negative jika di sekeliling koloni bakteri terbentuk warna biru kehitaman
4. UJI BTB
4.1. Alat dan Bahan a) Alat
Hot plate (kompor listrik) Labu erlenmeyer Autoclave Cawan petri Jarum ose Bunsen incase b) Bahan
Bacto agar aquades Kultur bakteri 4.2. Prosedur Kerja
a) Dimasukkan NA sebanyak 5 gram, bacto agar sebanyak 2 gram serta BTB sebanyak 0,1 gram di dalam labu Erlenmeyer yang berisi aquades 250 ml.
b) Dipanaskan media di atas hot plate hingga mendidih.
c) Disterilisasi media yang sudah jadi pada autoclave suhu 121 oC tekanan 15 LBS atau 1 atm selama 15 menit.
d) Dituangkan media ke dalam cawan petri secara aseptis di dalam incase, ditunggu hingga mengeras.
e) Disterak kultur bakteri mengunakan jarum ose pada agar NA+BTB selanjutnya diinkubasi di dalam incubator pada suhu 30 oC selama 4 jam.
IV. MIKROBIOLOGI KESEHATAN
“Pengaruh Jenis Tumbuhan Obat Terhadap Bakteri Penyebab Jerawat (Propionibacterium acnes)”
Tujuan: Mahasiswa dapat mengetahui Ekstrak yang digunakan terhadap pertumbuhan bakteri.
Landasan Teori
Pada tahun 1880, Koch memanfaatkan kemajuan metoda laboratorium dan menentukan kriteria yang diperlukan untuk membuktikan bahwa mikroba spesifik merupakan penyebab penyakit tertentu. Kriteria ini dikenal dengan postulat Koch yaitu:
1. Mikroorganisma tertentu selalu ditemukan berasosiasi dengan penyakit yang ditimbulkan.
2. Mikroorganisma dapat diisolasi dan ditumbuhkan sebagai biakan murni di laboratorium.
3. Biakan murni tersebut bila diinjeksikan pada binatang yang sesuai dapat menimbulkan penyakit.
4. Mikroorganisma tersebut dapat diisolasi kembali dari hewan yang telah terinfeksi tersebut.
Adanya kriteria tersebut menjadi jalan ditemukannya berbagai bakteri penyebab berbagai penyakit dalam waktu yang cukup singkat (kurang dari 30 tahun). Penemuan virus, adanya bakteri yang dapat menimbulkan berbagai penyakit serta adanya penyakit tertentu yang ditimbulkan oleh lebih dari 1 mikroorganisma memerlukan modifikasi dari postulat Koch.
Pada tahun 1892 Dimitri Ivanovski menunjukkan bahwa agen yang menyebabkan penyakit mosaik pada tembakau dapat ditularkan melalui ekstrak tanaman yang sakit. Ekstrak terebut disaring dengan filter yang ditemukan oleh kawan-kawan Pasteur dimana filter tersebut diketahui dapat menyaring bakteri. Penelitian selanjutnya menunjukkan bahwa agen tersebut mempunyai ukuran
yang jauh lebih kecil dari bakteri. Yellow fever merupakan penyakit pertama pada manusia yang diketahui disebabkan oleh virus.
Pada tahun 1900 seorang ahli bedah bernama Walter reed (1851-1902) dengan menggunakan manusia sebagai volunteer membuktikan bahwa virus tersebut dibawa oleh nyamuk tertentu lainnya membawa protozoa penyebab malaria. Salah satu cara penting untuk mencegah penyakit tersebut adalah mengurus air yang tergenang yang digunakan nyamuk untuk tempat berkembang biak.
Alat dan Bahan Alat 1. Botol uji 2. Kertas cakram 3. Pinset 4. Cawan Petri Prosedur Kerja
1. Disiapkan alat dan bahan yang dibutuhkan
2. Dimasukkan setiap jenis ekstrak ke dalam botol uji dengan ekstrak bawang putih sebagai P1, ekstrak jeruk nipis sebagai P2, ekstrak belimbing wuluh
sebagai P3, dan methanol 2% sebagai P0 atau kontrol.
3. Dimasukkan kertas cakram ke dalam masing-masing ekstrak. 4. Dibiarkan hingga beberapa saat
5. Diletakkan kedalam media yang berisi isolat bakteri Propionibacterium acnes
6. Dilihat zona halo yang terbentuk 7. Dicatat hasil yang didapatkan
Bahan
1. Isolat bakteri
2. Ekstrak bawang putih 3. Ekstrak jeruk nipis 4. Ekstrak belimbing
V. MIKROBIOLOGI MAKANAN “Pembuatan Nata De Coco”
Tujuan: Mahasiswa dapat Membuat Makanan fermentasi dengan baktuan mikroorganisme.
Landasan Teori
Nata de coco merupakan produk hasil proses fermentasi air kelapa dengan bantuan aktivitas Acetobacter xylinum. Nata berasal dari bahasa spanyol yang artinya terapung. Ini sesuai dengan sifatnya yaitu sejak diamati dari proses awal terbentuknya nata merupakan suatu lapisan tipis yang terapung pada permukaan yang semakin lama akan semakin tebal.
Bibit nata adalah bakteri Acetobacter xylinum yang akan dapat membentuk serat nata jika ditumbuhkan dalam air kelapa yang sudah diperkaya dengan karbon dan nitrogen melalui proses yang terkontrol. Dalam kondisi demikian, bakteri tersebut akan menghasilkan enzim yang dapat menyusun zat gula (glukosa) menjadi ribuan rantai serat atau selulosa. Dari jutaan renik yang tumbuh pada air kelapa tersebut, akan dihasilkan jutaan lembar benang-benang selulosa yang akhirnya nampak padat berwarna putih hingga transparan, yang disebut sebagai nata.
Acetobacter Xylinum dapat tumbuh pada pH 3,5 – 7,5, namun akan tumbuh optimal bila pH nya 4,3, sedangkan suhu ideal bagi pertumbuhan bakteri Acetobacter Xylinum pada suhu 28°– 31 °C. Bakteri ini sangat memerlukan oksigen.
Acetobacter xylinum dalam pertumbuhan dan aktivitasnya membentuk nata memerlukan suatu media yang tepat sehingga produksi nata yang dihasilkan dapat secara optimal. Sebagai media dalam pembentukan nata dan media yang di guna kan haruslah memiliki kandungan komponen - komponen yang dibutuhkan oleh mikroorganisme yang dalam hal ini yaitu Acetobacter xylinum. Komponen media nata yang dibutuhkan sebagai syarat media nata antara lain memiliki sumber karbon dapat berupa gula dan sumber nitrogen dapat berupa penambahan urea dan mineral serta vitamin yang mendukung pertumbuhan bakteri Acetobacter xylinum.
Alat dan Bahan Alat :
1. Panci 4.Loyang atau baskom
2. Spatula atau pengaduk 5. Koran dan karet 3. Kompor gas 6. Cetakan dan saringan
Bahan :
1. Buah kelapa (ambil air kelapa 1 liter) 2. Bakteri starter Acetobacter xylinum 3. Asam cuka
4. Gula 100 gram 5. Urea 1 gram
Prosedur kerja :
1 Air kelapa disaring dan disiapkan sebanyak 1 liter
2 Rebus air kelapa dalam panci selama 3 menit (dalam keadaan mendidih) 3 Tuangkan gula pasir kedalam air kelapa yang mendidih
4 Matikan kompor dan biarkan air kelapa menjadi dingin
5 Selanjutnya tuangkan asam cuka sekitar 10 ml kedalam larutan air kelapa hingga kadar ke asaman sekitar 4,5. Pengukuran Ph bisa menggunakan kertas lakmus.
6 Tambahkan strater bakteri Acetobacter Xylinum kedalam larutan, aduk-aduk hingga merata
7 Tuangkan adonan ke dalam Cetakan.
8 Tutup bahan nata de coco dengan koran dan ikat dengan karet.
9 Simpan dan taroh di dalam rak-rak yang stabil, tidak mudah goyang. dan hindari goncangan.
10 Tunggu hingga kurang lebih 14 hari agar menjadi nata.
11 Nata De Coco yang jadi, akan membentuk jadi keras, mengikuti pola loyang.
12 Selanjutnya nata de coco yang telah jadi di cuci dengan air dan rendam hingga 2-3 hari
13 Setelah di rendam, kemudian lakukan perebusan dengan air dan gula, tujuannya agar mengenyal dan manis
14 Potong nata de coco sesuai selera menggunakan pisau dapur atau jika ingin lebih praktis dan usahanya menjadi besar gunakan Mesin Nata De Coco dan siap untuk di konsumsi
15 Setelah nata de coco sudah jadi, bisa juga dimasukkan ke dalam sirup yang tentunya sesuai selera kita
VI. MIKROBIOLOGI AIR “Uji Kualitas Air”
Tujuan: Mahasiswa dapat menguji Kualitas air dan melihan mikroorganisme yang ada di dalam air tersebut serta menghitung jumlahnya.
Landasan Teori
Air merupakan materi esensial bagi kehidupan makhluk hidup, karena makhluk hidup memerlukan air untuk mempertahankan kelangsungan hidupnya. Secara umum fungsi air dalam tubuh setiap mikroorganisme adalah untuk melarutkan senyawa organik, menstabilkan suhu tubuh dan melangsungkan berbagai reaksi kimia tingkat seluler
Pemeriksaan air secara mikrobiologi sangat penting dilakukan karena air merupakan substansi yang sangat penting dalam menunjang kehidupan mikroorganisme yang meliputi pemeriksaan secara mikrobiologi baik secara kualitatif maupun kuantitatif dapat dipakai sebagai pengukuran derajat pencemaran
Kualitas air didasarkan pada pengujian ada tidaknya coliform dalam air. Keberadaan bakteri coli merupakan parameter yang dapat digunakan untuk menentukan kualitas air yang aman, dimana kehadirannya dapat dijadikan indikator pencemaraan air. Ciri-ciri bakteri coliform adalah bersifat gram negatif, bentuk morfologi batang pendek, dan dapat memfermentasi medium laktosa cair dengan membentuk asam dan gas
Uji kualitas air dilakukan untuk mengetahui kualitas dari air yang akan kita analisis. Metode yang digunakan ialah MPN (Most Probable Number) atau APN (Angka Paling Mungkin). MPN merupakan metode yang paling sederhana yang digunakan untuk menguji kualitas air. Uji kualitas air terdiri dari beberapa uji yakni uji penduga, uji penguat dan uji pelengkap. Air sangat perlu untuk duji sebelum dikonsumsi atau diminum karena air dapat menjadi sumber penyebaran penyakit (Fardiaz, 1989).
1. Uji pendugaan (presumptive test)
Merupakan tes pendahuluan tentang ada tidaknya kehadiran bakteri koliform berdasarkan terbentuknya asam dan gas disebabkan oleh fermentasi laktosa oleh bakteri golongan koli. Terbentuknya asam dilihat dari kekeruhan pada media laktosa, dan gas yang dihasilkan dapat dilihat dalam tabung Durham berupa gelembung udara
Uji penduga merupakan uji positif untuk menentukan bakteri koliform. Media yang digunakan ialah media lactose broth. Bakteri dapat menggunakan laktosa sebagai sumber karbon, namun ada pula sebagian bakteri enteric yang tidak dapat melakukannya.
Uji dilakukan dalam medium fermentasi kaldu laktosa (laktosa broth) yang berisi tabung Durham. Uji dinyatakan positif bila terbentuk gas pada tabung Durham, karena bakteri koli mampu memfermentasikan laktosa dengan menghasilkan gas yang merupakan khasnya. Uji pendugaan dapat menunjukkan kuantitas mikroorganisme koli yang merupakan jumlah perkiraan trdekat (MPN : Most Probable Number).
2. Uji penguat
Hasil uji dugaan dilanjutkan dengan uji ketetapan. Dari tabung yang positif terbentuk asam dan gas terutama pada masa inkubasi 1 x 24 jam, suspensi ditanamkan pada media Eosin Methylen Biru Agar ( EMBA ) secara aseptik dengan menggunakan jarum inokulasi. Koloni bakteri Escherichia coli tumbuh berwarna kehijauan dengan kilat metalik atau koloni berwarna merah muda dengan lendir untuk kelompok koliform lainnya.
Konfirmasi dari uji pendugaan perlu dilakukan, karena nilai positif (gas) dari uji pertama dapat juga merupakan reaksi dari bakteri non koli yang bukan indicator pencemar fekal. Uji penentu memrlukan medium selektif atau
diferensisal. Bila pada tahap ini di dalam kultur uji masih terbentuk gas, maka sampel air dinyatakan tidak layak minum
3. Uji pelengkap
Uji ini merupakan analisis akhir dari sampel air untuk mendeteksi keberadaan bakteri koli fekal. Metode yang digunakan adalah pengecatan Gram terhadap bakteri yang muncul atau tumbuh pada media EMB agar pada uji penentu. Bila karakter koloni berwarna hijau metalik dan hasil pengamatan dengan mikroskop menunjukkan bakteri berbentuk batang tersebut adalah E. coli dan uji pelengkap bernilai positif
Alat dan Bahan: A. Alat 1. Tabung reaksi 2. Tabung durham 3. Pipet ukur 4. Bunsen 5. Cawan petri 6. Rak tabung reaksi 7. Tabung durham 8. pH meter 9. Pipet tetes B. Bahan
1. Air mineral merk Aqua 2. Air mineral merk Club 3. Media Lactose Borth (LB)
4. Media Brilliant Green Lactase Bilebroth (BGBL) 5. Media Losin Methelin Blue (EMB)
Prosedur Kerja: A. Uji Pendugaan
1. Siapkan 9 tabung kultur yang masing-masing berisi 10 ml media cair kaldu lactose steril yang sudah dilengkapi dengan tabung durham. Aturlah letaknya pada rak tabung dan masing-masing beri kode (A1, A2, A3, B1, B2, B3, C1, C2, C3)
2. Tuangkan air sampel menggunakan pipet steril masing-masing sebanyak 10 ml ke dalam tabung kultur yang berkode A1, A2, A3. 3. Tuangkan air sampel mengunakan pipet steril masing-masing
sebanyak 1 ml ke dalam tabung kultur yang berkode B1, B2, B3. 4. Tuangkan air sampel mengunakan pipet steril masing-masing
sebanyak 0,01 ml ke dalam tabung kultur yang berkode C1, C2, C3.
5. Inkubasi 9 tabung kultur yang sudah diperlukan pada suhu 34C selama 1×24 jam
B. Uji Penegasan
1. Siapkan tabung kultur yang masing-masing berisi 10 ml media cair BGLB steril yang sudah dilengkapi dengan tabung durham. Aturlah letaknya pada rak dengan tabung dan masing-masing beri kode yang sesui dengan kode tabung yang positif pada uji pendugaan misalnya A1, A2, A3, B1, B2, B3, C1, C2, C3 sehingga jumlahnya sama dengan jumlah tabung yang positif saja. 2. Tuangkan air sampel yang sudah diinkubasi dalam media kultur laktosa menggunakan pipet steril masing-masing sebanyak 1 ml ke dalam tabung yang positif.
3. Inkubasi tabung kultur yang sudah diperlukan pada suhu 34C selama 1x24 jam.
4. Amati adanya gelembung udara di dalam tabung durham. Catatlah code tabung yang positif mengeluarkan gas. Mikroba penghasil gas yang tumbuh pada tabung adalah kelompok mikroba yang mampu memfermentasikan laktosa dan tahan terhadap suhu tinggi C), mikroba ini disebut kelompok bakteri coliform fekal.
C. Uji Penguat
1. Inokulasi sampel perlakukan dari tabung yang positif pad uji penegasan pada sebanyak satu ose ke permukaan media EMB secara zig zag inkubasi 37 C selam 1×24 jam.
2. Amati pertumbuhan koloni pada media EMB. Koloni yang menampakkan adanya kilau metalik adalah koloni bakteri E.coli 3. Selanjutnya dapat dipastika lagi dengan cara mengamati inolkulum
dari koloni tersebut secara langsung dengan mikroscop.
4. Buatlah sedian yang diwarnai secara gram, kemudian namati di bawah mikroskop. Bakteri E.coli akan memperlihatkan sebagai bakteri berbentuk batang, gram negative.
5. Setelah semau pengujian selesai tentukanlah nilai MPN. Coliformnya verdasarkan table MPN pada lampiran. Nilai MPNditentukan berdasarkan jumlah tabung yang positif dari perlakuan, dan dihitung = MPN table x 1/pengenceran tengah.