Tentang
Tentang
TERMOKIMIA
TERMOKIMIA
Disusun oleh:
Disusun oleh:
DEDE ADI NUGRAHA
DEDE ADI NUGRAHA
( xDLMx_dhansheiA3 )
( xDLMx_dhansheiA3 )
PEMERINTAH KABUPATEN MAJALENGKA PEMERINTAH KABUPATEN MAJALENGKA
DINAS PENDIDIKAN
DINAS PENDIDIKAN
SMA NEGERI 1 SUKAHAJI
SMA NEGERI 1 SUKAHAJI
Tahun Pelajaran 2012-2013
Tahun Pelajaran 2012-2013
KATA PENGANTAR
KATA PENGANTAR
Puji syukur yang dalam saya sampaikan ke hadirat Allah SWT Yang
Puji syukur yang dalam saya sampaikan ke hadirat Allah SWT Yang
Maha Pemurah, karena berkat kemurahanNya Makalah ini dapat saya
Maha Pemurah, karena berkat kemurahanNya Makalah ini dapat saya
selesaikan sesuai yang diharapkan. Sebagaimana telah diberikan tugas
selesaikan sesuai yang diharapkan. Sebagaimana telah diberikan tugas
kepada saya untuk membuat Makalah tentang Termokimia.
kepada saya untuk membuat Makalah tentang Termokimia.
Dalam penyusunan makalah ini, tidak sedikit hambatan yang saya
Dalam penyusunan makalah ini, tidak sedikit hambatan yang saya
hadapi. Namun saya menyadari bahwa kelancaran dalam penyusunan materi
hadapi. Namun saya menyadari bahwa kelancaran dalam penyusunan materi
ini tidak lain berkat bantuan, dorongan dan bimbingan orang tua, sehingga
ini tidak lain berkat bantuan, dorongan dan bimbingan orang tua, sehingga
kendala-kendal
kendala-kendala
a yang kami hadapi teratasi.
yang kami hadapi teratasi.
Oleh karena itu kami mengucapkan terima kasih kepada :
Oleh karena itu kami mengucapkan terima kasih kepada :
1.
1. Orang Tua saya yang selalu memberikan fasilitas dan dorongan untuk
Orang Tua saya yang selalu memberikan fasilitas dan dorongan untuk
bisa membuat kliping
bisa membuat kliping/kumpulan arti
/kumpulan artikel-artikel ini.
kel-artikel ini.
2.2.
Narasumber
Narasumber terpecaya
terpecaya dalam
dalam pengerjaan
pengerjaan ini
ini yang
yang sudah
sudah banyak
banyak
membantu.
membantu.
Terima kasih atas semuanya. Saya sadar, sebagai seorang pelajar
Terima kasih atas semuanya. Saya sadar, sebagai seorang pelajar
yang masih dalam proses pembelajaran, penulisan makalah ini masih banyak
yang masih dalam proses pembelajaran, penulisan makalah ini masih banyak
kekurangannya. Oleh karena itu, kami sangat mengharapkan ada nya kritik
kekurangannya. Oleh karena itu, kami sangat mengharapkan ada nya kritik
dan saran yang bersifat positif, guna penulisan makalah yang lebih baik lagi
dan saran yang bersifat positif, guna penulisan makalah yang lebih baik lagi
di masa yang akan datang. Harapan saya, semoga makalah yang sederhana
di masa yang akan datang. Harapan saya, semoga makalah yang sederhana
ini, dapat memberi kesadaran tersendiri bagi generasi muda tentang
ini, dapat memberi kesadaran tersendiri bagi generasi muda tentang
Ketenagak
Ketenagakerjaan di I
erjaan di Indonesia.
ndonesia.
Semoga dengan saya membuat makalah ini dapat bermanfaat dan
Semoga dengan saya membuat makalah ini dapat bermanfaat dan
memberikan m
memberikan motivasi bagi
otivasi bagi para pembacanya, khu
para pembacanya, khususnya
susnya bagi saya dan
bagi saya dan bagi
bagi
para generasi mu
para generasi muda yang akan dating.
da yang akan dating.
Penyusun,
Penyusun,
SISTEMATIKA PENULISAN
SISTEMATIKA PENULISAN
KATA PENGANTAR
KATA PENGANTAR
SISTEMATIKA PENULISAN
SISTEMATIKA PENULISAN
BAB I PENDAHULUAN
BAB I PENDAHULUAN
1.
1. Latar Belakang
Latar Belakang
2.
2. Tujuan Penulisan
Tujuan Penulisan
3.
3. Metode Penulisan
Metode Penulisan
4.
4. Sistematika Penulisan
Sistematika Penulisan
BAB II PEMBAHASAN
BAB II PEMBAHASAN
1.
1. Konsep Dasar
Konsep Dasar
2.
2. Temodinamika I
Temodinamika I
3.
3. Kalor Reaksi
Kalor Reaksi
4.
4. Kerja
Kerja
5.
5. Entalpi
Entalpi
6.
6. Kalorimeter
Kalorimeter
7.
7. Hukum Hess
Hukum Hess
8.
8. Penentuan
Penentuan ∆
∆H reaksi
H reaksi
9.
9. Energi Ikatan
Energi Ikatan
10.
10.Jenis-jenis kalor
Jenis-jenis kalor
BAB III PENUTUP
BAB III PENUTUP
Kesimpulan
Kesimpulan
Saran
Saran
DAFTAR PUSTAKA
DAFTAR PUSTAKA
BAB I
BAB I
PENDAHULUAN
PENDAHULUAN
1.
1. Latar BelakangLatar Belakang
Dalam makalah ini, saya mengambil tema tentang Termokimia. Saya memilih Dalam makalah ini, saya mengambil tema tentang Termokimia. Saya memilih tema ini karena kami rasa materi ini sangat penting untuk dipelajari karena termokimia tema ini karena kami rasa materi ini sangat penting untuk dipelajari karena termokimia ini merupakan salah satu materi dasar dalam kimia yang
ini merupakan salah satu materi dasar dalam kimia yang harus dikuasai.harus dikuasai.
Di dalam makalah ini saya membahas tentang konsep dasar dari termokimia yang Di dalam makalah ini saya membahas tentang konsep dasar dari termokimia yang kami sajikan pada bagian awal dari isi makalah. Hal ini saya lakukan karena saya menilai kami sajikan pada bagian awal dari isi makalah. Hal ini saya lakukan karena saya menilai untuk memahami suatu materi, kita harus tahu konsep dasarnya terlebih dahulu, setelah untuk memahami suatu materi, kita harus tahu konsep dasarnya terlebih dahulu, setelah itu baru masuk ke inti materinya.
itu baru masuk ke inti materinya.
Termokimia merupakan materi yang harus dipahami dengan baik karena di Termokimia merupakan materi yang harus dipahami dengan baik karena di dalamnya mencakup cukup banyak materi lainnya, seperti termodinamika I, kalor reaksi, dalamnya mencakup cukup banyak materi lainnya, seperti termodinamika I, kalor reaksi, kerja, entalpi, kalorimeter, hukum Hess, penentuan
kerja, entalpi, kalorimeter, hukum Hess, penentuanH reaksi, energi ikatan, dan jenis-H reaksi, energi ikatan, dan jenis- jenis
jenis kalor. kalor. Maka Maka dari dari itu,saya itu,saya berusaha berusaha untuk untuk membuat membuat materi materi termokimia termokimia dalamdalam makalah ini menjadi ringkas dan mudah d
makalah ini menjadi ringkas dan mudah dipahami.ipahami.
2.
2. Tujuan PenulisanTujuan Penulisan
1.
1. untuk mempelajari konsep dasar untuk mempelajari konsep dasar termokimiatermokimia
2.
2. untuk mempelajari materi-materi yang terkauntuk mempelajari materi-materi yang terka it dengan termokimiait dengan termokimia 3.
3. memahami tentang termokimia dengan baikmemahami tentang termokimia dengan baik
3.
3. Metode PenulisanMetode Penulisan
Dalam menulis makalah ini, saya memperoleh kajian materi dari beberapa Dalam menulis makalah ini, saya memperoleh kajian materi dari beberapa sumber, yaitu studi literatur dari buku-buku yang terkait dengan topik dan berbagai sumber, yaitu studi literatur dari buku-buku yang terkait dengan topik dan berbagai artikel dari internet.
BAB II
BAB II
PEMBAHASAN
PEMBAHASAN
1.
1. Konsep DasarKonsep Dasar
Termokimia adalah ilmu yang mempelajari hubungan antara energi panas Termokimia adalah ilmu yang mempelajari hubungan antara energi panas dan energi kimia. Sedangkan energi kimia didefinisikan sebagai energi yang dan energi kimia. Sedangkan energi kimia didefinisikan sebagai energi yang dikandung setiap unsur atau senyawa. Energi kimia yang terkandung dalam suatu dikandung setiap unsur atau senyawa. Energi kimia yang terkandung dalam suatu zat adalah semacam energi potensial zat tersebut. Energi potensial kimia yang zat adalah semacam energi potensial zat tersebut. Energi potensial kimia yang terkandung dalam suatu zat disebut panas dalam atauentalpi dan dinyatakan terkandung dalam suatu zat disebut panas dalam atauentalpi dan dinyatakan dengan simbol H. Selisih antara entalpi reaktan dan entalpi hasil pada suatu reaksi dengan simbol H. Selisih antara entalpi reaktan dan entalpi hasil pada suatu reaksi disebut perubahan entalpi reaksi.
disebut perubahan entalpi reaksi. Perubahan entalpi reaksi diberi simbol ΔH.Perubahan entalpi reaksi diberi simbol ΔH.
Bagian dari ilmu kimia yang mempelajari perubahan kalor atau panas suatu Bagian dari ilmu kimia yang mempelajari perubahan kalor atau panas suatu zat yang menyertai suatu reaksi atau proses kimia dan fisika disebut termokimia. zat yang menyertai suatu reaksi atau proses kimia dan fisika disebut termokimia. Secara operasional termokimia berkaitan dengan pengukuran dan pernafsiran Secara operasional termokimia berkaitan dengan pengukuran dan pernafsiran perubahan
perubahan kalor kalor yang yang menyertai menyertai reaksi reaksi kimia, kimia, perubahan perubahan keadaan, keadaan, dandan pembentukan larutan.
pembentukan larutan.
Termokimia merupakan pengetahuan dasar yang perlu diberikan atau yang Termokimia merupakan pengetahuan dasar yang perlu diberikan atau yang dapat diperoleh dari reaksi-reaksi kimia, tetapi juga perlu sebagai pengetahuan dapat diperoleh dari reaksi-reaksi kimia, tetapi juga perlu sebagai pengetahuan dasar untuk pengkajian teori ikatan kimia dan struktur kimia. Fokus bahasan dasar untuk pengkajian teori ikatan kimia dan struktur kimia. Fokus bahasan dalam termokimia adalah tentang jumlah kalor yang dapat dihasilkan oleh dalam termokimia adalah tentang jumlah kalor yang dapat dihasilkan oleh sejumlah tertentu pereaksi serta cara pengukuran kalor reaksi.
sejumlah tertentu pereaksi serta cara pengukuran kalor reaksi.
Termokimia merupakan penerapan hukum pertama termodinamika terhadap Termokimia merupakan penerapan hukum pertama termodinamika terhadap peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia.
peristiwa kimia yang membahas tentang kalor yang menyertai reaksi kimia.
2.
2. Termodinamika ITermodinamika I
Termodinamika kimia dapat didefenisikan sebagai cabang kimia yang Termodinamika kimia dapat didefenisikan sebagai cabang kimia yang menangani hubungan kalor, kerja dan bentuk lain energy, dengan kesetimbangan menangani hubungan kalor, kerja dan bentuk lain energy, dengan kesetimbangan dalam reaksi kimia dan dalam perubahan keadaan. Termokimia erat kaitannya dalam reaksi kimia dan dalam perubahan keadaan. Termokimia erat kaitannya dengan termodinamika, karena termokimia menangani pengukuran dan penafsiran dengan termodinamika, karena termokimia menangani pengukuran dan penafsiran perubahan
perubahan kalor kalor yang yang menyertai menyertai reaksi reaksi kimia, kimia, perubahan perubahan keadaan keadaan dandan pembentukan larutan.
pembentukan larutan.
Penerapan hukum termodinamika pertama dalam bidang kimia merupakan Penerapan hukum termodinamika pertama dalam bidang kimia merupakan bahan
bahan kajian darkajian dari i termokimia.”termokimia.” Energi Energi tidak tidak dapat dapat diciptakan diciptakan atau atau dimusnahkan,dimusnahkan, tetapi dapat diubah dari satu bentuk ke bentuk yang lain, atau energi alam tetapi dapat diubah dari satu bentuk ke bentuk yang lain, atau energi alam semesta adalah konstan.”
semesta adalah konstan.” hukum termodinamika 1hukum termodinamika 1 Perubahan kalor pada tekanan konstan:
Perubahan kalor pada tekanan konstan:
H =H =
E + PE + P
VV W= PW= P
VV
3.
3.
Kalor Reaksi
Kalor Reaksi
Perubahan energi dalam reaksi kimia selalu dapat dibuat sebagai panas, Perubahan energi dalam reaksi kimia selalu dapat dibuat sebagai panas, sebab itu lebih tepat bila
sebab itu lebih tepat bila istilahnya disebut panas reaksi.istilahnya disebut panas reaksi.
Kebanyakan, reaksi kimia tidaklah terututup dari dunia luar. Bila Kebanyakan, reaksi kimia tidaklah terututup dari dunia luar. Bila temperatur dari campuran reaksi naik dan energi potensial dari zat-zat kimia yang temperatur dari campuran reaksi naik dan energi potensial dari zat-zat kimia yang bersangkutan turun,
bersangkutan turun, maka disebut maka disebut sebagai reasebagai reaksi eksoterm. ksi eksoterm. Namun bila Namun bila pada ppada padaada suatu reaksi temperatur dari campuran turun dan energi potensial dari zat-zat yang suatu reaksi temperatur dari campuran turun dan energi potensial dari zat-zat yang ikut dalam reaksi naik, maka disebut sebagai reaksi endoterm.
ikut dalam reaksi naik, maka disebut sebagai reaksi endoterm.
Ada beberapa macam jenis perubahan pada suatu sistim. Salah satunya Ada beberapa macam jenis perubahan pada suatu sistim. Salah satunya adalah sistim terbuka, yaitu ketika massa, panas, dan kerja, dapat berubah-ubah. adalah sistim terbuka, yaitu ketika massa, panas, dan kerja, dapat berubah-ubah. Ada juga sistim tertutup, dimana tidak ada perubahan massa, tetapi hanya panas Ada juga sistim tertutup, dimana tidak ada perubahan massa, tetapi hanya panas dan kerja saja. Sementara, perubahan adiabatis merupakan suatu keadaan dimana dan kerja saja. Sementara, perubahan adiabatis merupakan suatu keadaan dimana sistim diisolasi dari lingkungan sehingga tidak ada panas yang dapat mengalir. sistim diisolasi dari lingkungan sehingga tidak ada panas yang dapat mengalir. Kemudian, ada pula perubahan yang terjadi pada temperature tetap, yang Kemudian, ada pula perubahan yang terjadi pada temperature tetap, yang dinamakan perubahan isotermik.
dinamakan perubahan isotermik.
Pada perubahan suhu, ditandai dengan ∆t (t menunjukkan temperatur), Pada perubahan suhu, ditandai dengan ∆t (t menunjukkan temperatur), dihitung dengan cara mengurangi temperatur akhir dengan temperatur mula-mula. dihitung dengan cara mengurangi temperatur akhir dengan temperatur mula-mula. ∆t = t
∆t = takhir akhir – – t tmula-mulamula-mula
Demikian juga, perubahan energi potensial; Demikian juga, perubahan energi potensial; ∆(E.P) = (E.P)
∆(E.P) = (E.P)akhir akhir – – (E.P) (E.P)mula-mulamula-mula
Dari definisi ini didapat suatu kesepakatan dalam tanda aljabar untuk Dari definisi ini didapat suatu kesepakatan dalam tanda aljabar untuk perubahan eksoterm
perubahan eksoterm dan endoterm. dan endoterm. Dalam perDalam perubahan eksotermik, ubahan eksotermik, energi potensialenergi potensial dari hasil reaksi lebih rendah dari energi potensial pereaksi, berarti EP
dari hasil reaksi lebih rendah dari energi potensial pereaksi, berarti EP akhirakhirlebihlebih rendah dari EP
rendah dari EPmula-mulamula-mula. Sehingga harga ∆(E.P) mempunyai harga negatif. Pada. Sehingga harga ∆(E.P) mempunyai harga negatif. Pada
reaksi endoterm, terjadi kebalikannya sehingga harga ∆(E.P) adalah positif. reaksi endoterm, terjadi kebalikannya sehingga harga ∆(E.P) adalah positif.
Pada suatu reaksi, reaksi pembentukannya didefinisikan sebagai reaksi Pada suatu reaksi, reaksi pembentukannya didefinisikan sebagai reaksi yang membentuk senyawa tunggal dari unsur-unsur penyusunnya (contoh: yang membentuk senyawa tunggal dari unsur-unsur penyusunnya (contoh: C C ++ ½O
½O22 + 2H + 2H22 → CH→ CH33OH). Sementara panas pembentukannya didasarkan pada 1 molOH). Sementara panas pembentukannya didasarkan pada 1 mol
senyawa terbentuk. Panas pembentukan standar yaitu 298.15 K (∆H° senyawa terbentuk. Panas pembentukan standar yaitu 298.15 K (∆H°f298f298).). Panas standar adalah pada 25°C, seperti contoh reaksi
Panas standar adalah pada 25°C, seperti contoh reaksi
4HCl4HCl(g)(g) → 2H→ 2H2(g)2(g) + 2Cl + 2Cl2(g)2(g) ∆H°∆H°298298 = (4)(92307) = (4)(92307) 2H2H2(g)2(g)+ O+ O2(g)2(g) → 2H→ 2H22OO(g)(g) ∆H°∆H°298298 = (2)(-241818) = (2)(-241818)
Sementara, panas reaksi pada temperatur tidak standar Sementara, panas reaksi pada temperatur tidak standar
HHOOTT = =
HH00298298 + +
TT298298
Cp dT Cp dT 4.4.
Kerja
Kerja
Ketika kayu atau minyak tanah dibakar, dihasilkan sejumlah kalor. Kalor Ketika kayu atau minyak tanah dibakar, dihasilkan sejumlah kalor. Kalor yang dihasilkan kayu atau minyak tanah yang terbakar mengakibatkan keadaan yang dihasilkan kayu atau minyak tanah yang terbakar mengakibatkan keadaan sekitarnya menjadi panas. Namun, ketika api sudah padam, keadaan akan menjadi sekitarnya menjadi panas. Namun, ketika api sudah padam, keadaan akan menjadi normal kembali. Azas kekekalan energi menyatakan bhawa energi tidak dapat normal kembali. Azas kekekalan energi menyatakan bhawa energi tidak dapat diciptakan atau dimusnahkan, tetapi dapat diubah dari satu bentuk ke bentuk lain. diciptakan atau dimusnahkan, tetapi dapat diubah dari satu bentuk ke bentuk lain. Jadi, kalor yang dihasilkan pada pembakaran kayu atau minyak tanah diserap oleh Jadi, kalor yang dihasilkan pada pembakaran kayu atau minyak tanah diserap oleh molekul-molekul udara atau benda-benda lain di sekitarnya dan diubah menjadi molekul-molekul udara atau benda-benda lain di sekitarnya dan diubah menjadi bentuk energi lain, misalnya
bentuk energi lain, misalnya menjadi energi kinetik. Demenjadi energi kinetik. Demikian juga halnya denganmikian juga halnya dengan sumber kalor yang dihasilkan ketika kayu atau minyak tanah terbakar, bukanlah sumber kalor yang dihasilkan ketika kayu atau minyak tanah terbakar, bukanlah sesuatu yang tercipta, melainkan hanya perubahan bentuk energi. Kayu dan sesuatu yang tercipta, melainkan hanya perubahan bentuk energi. Kayu dan
minyak tanah menyimpan sejumlah energi, yang disebut energi kimia. Ketika minyak tanah menyimpan sejumlah energi, yang disebut energi kimia. Ketika bahan-bahan
bahan-bahan tiu tiu terbakar, terbakar, sebagian sebagian energi energi kimia kimia yang yang tersimpan tersimpan di di dalamnyadalamnya berubah
berubah menjadi menjadi kalor. kalor. Azas Azas kekekalan kekekalan energi energi disebu disebu juga juga HukumHukum Termodinamika I.
Termodinamika I.
Dalam termokimia ada dua hal yang perlu diperhatikan yang menyangkut Dalam termokimia ada dua hal yang perlu diperhatikan yang menyangkut perpindahan
perpindahan energi, energi, yaituyaitu sistem sistem dandanlingkunganlingkungan. Segala sesuatu yang menjadi. Segala sesuatu yang menjadi pusat
pusat perhatian perhatian dalam dalam mempelajari mempelajari perubahan perubahan energi energi disebut disebut sistem, sistem, sedangkansedangkan hal-hal yang membatasi sistem dan dapat mempengaruhi sistem disebut hal-hal yang membatasi sistem dan dapat mempengaruhi sistem disebut lingkungan.
lingkungan.
Berdasarkan interaksinya dengan lingkungan, sistem dibedakan menjadi Berdasarkan interaksinya dengan lingkungan, sistem dibedakan menjadi tiga macam, yaitu :
tiga macam, yaitu :
Sistem TerbukaSistem Terbuka
Sistem terbuka adalah suatu sistem yang memungkinkan terjadi perpindahan Sistem terbuka adalah suatu sistem yang memungkinkan terjadi perpindahan energi dan zat (materi) antara lingkungan dengan sistem. Pertukaran materi artinya energi dan zat (materi) antara lingkungan dengan sistem. Pertukaran materi artinya ada hasil reaksi yang dapat meninggalkan sistem (wadah reaksi), misalnya gas, ada hasil reaksi yang dapat meninggalkan sistem (wadah reaksi), misalnya gas, atau ada sesuatu dari lingkungan yang dapat memasuki sistem.
atau ada sesuatu dari lingkungan yang dapat memasuki sistem.
Sistem TertutupSistem Tertutup
Suatu sistem yang antara sistem dan lingkungan dapat terjadi perpindahan energi, Suatu sistem yang antara sistem dan lingkungan dapat terjadi perpindahan energi, tetapi tidak dapat terjadi pertukaran materi dise
tetapi tidak dapat terjadi pertukaran materi dise but sistem tertutup.but sistem tertutup.
Sistem TerisolasiSistem Terisolasi
Sistem terisolasi merupakan sistem yang tidak memungkinkan terjadinya Sistem terisolasi merupakan sistem yang tidak memungkinkan terjadinya perpindahan energi dan materi antara sistem dengan lingkungan.
perpindahan energi dan materi antara sistem dengan lingkungan. Energi adalah kapasitas untuk melakukan kerja (
Energi adalah kapasitas untuk melakukan kerja (ww) atau menghasilkan) atau menghasilkan panas
panas ((kalor=qkalor=q). Pertukaran energi antara sistem dan lingkungan dapat berupa). Pertukaran energi antara sistem dan lingkungan dapat berupa kalor (
kalor (qq) atau bentuk energi lainnya yang secara kolektif kita sebut kerja () atau bentuk energi lainnya yang secara kolektif kita sebut kerja ( ww).). Energi yang dipindahkan dalam bentuk kerja atau dalam bentuk kalor yang Energi yang dipindahkan dalam bentuk kerja atau dalam bentuk kalor yang memengaruhi jumlah total energi yang terdapat dalam sistem disebut energi dalam memengaruhi jumlah total energi yang terdapat dalam sistem disebut energi dalam ((internal energyinternal energy). Kerja adalah suatu bentuk pertukaran energi antara sistem dan). Kerja adalah suatu bentuk pertukaran energi antara sistem dan lingkungan di luar kalor. Salah satu bentuk kerja yang sering menyertai reaksi lingkungan di luar kalor. Salah satu bentuk kerja yang sering menyertai reaksi kimia adalah kerja tekanan-volum, yaitu kerja yang berkaitan dengan pertambahan kimia adalah kerja tekanan-volum, yaitu kerja yang berkaitan dengan pertambahan atau pengurangan volum sistem.
atau pengurangan volum sistem.
5.
5.
Entalpi
Entalpi
Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Energi potensial berkaitan dengan wujud zat, volume, dan tekanan. Energi kinetik Energi potensial berkaitan dengan wujud zat, volume, dan tekanan. Energi kinetik ditimbulkan karena atom
ditimbulkan karena atom – – atom dan molekul-molekul dalam zat bergerak secara atom dan molekul-molekul dalam zat bergerak secara acak. Jumlah total dari semua bentuk energi itu
acak. Jumlah total dari semua bentuk energi itu disebut entalpi (H)disebut entalpi (H) . Entalpi akan. Entalpi akan tetap konstan selama tidak ada energi yang masuk atau keluar dari zat.
tetap konstan selama tidak ada energi yang masuk atau keluar dari zat. .. MisalnyaMisalnya entalpi untuk air dapat d
entalpi untuk air dapat ditulis H H20 (l) dan unitulis H H20 (l) dan untuk es ditulis tuk es ditulis H HH H220 (s).0 (s).
Entalpi (H) suatu zat ditentukan oleh jumlah energi dan semua bentuk Entalpi (H) suatu zat ditentukan oleh jumlah energi dan semua bentuk energi yang dimiliki zat yang jumlahnya tidak dapat diukur. Perubahan kalor atau energi yang dimiliki zat yang jumlahnya tidak dapat diukur. Perubahan kalor atau entalpi yang terjadi selama proses penerimaan atau pelepasan kalor dinyatakan entalpi yang terjadi selama proses penerimaan atau pelepasan kalor dinyatakan dengan
dengan ” perubahan entalpi” perubahan entalpi (Δ(Δ H) H) ”” . Misalnya pada perubahan es menjadi air,. Misalnya pada perubahan es menjadi air, maka dapat ditulis sebagai berikut:
maka dapat ditulis sebagai berikut: Δ H = H H
Apabila kita amati reaksi pembakaran bensin di dalam mesin motor. Apabila kita amati reaksi pembakaran bensin di dalam mesin motor. Sebagian energi kimia yang dikandung bensin, ketika bensin terbakar, diubah Sebagian energi kimia yang dikandung bensin, ketika bensin terbakar, diubah menjadi energi panas dan energi mekanik untuk menggerakkan motor. Demikian menjadi energi panas dan energi mekanik untuk menggerakkan motor. Demikian juga pada
juga pada mekanisme mekanisme kerja sel kerja sel aki. Pada aki. Pada saat saat sel sel aki bekerja, aki bekerja, energi energi kimia diubahkimia diubah menjadi energi listrik, energi panas yang dipakai untuk membakar bensin dan menjadi energi listrik, energi panas yang dipakai untuk membakar bensin dan reaksi pembakaran bensin menghasilkan gas, menggerakkan piston sehingga reaksi pembakaran bensin menghasilkan gas, menggerakkan piston sehingga menggerakkan roda motor.
menggerakkan roda motor.
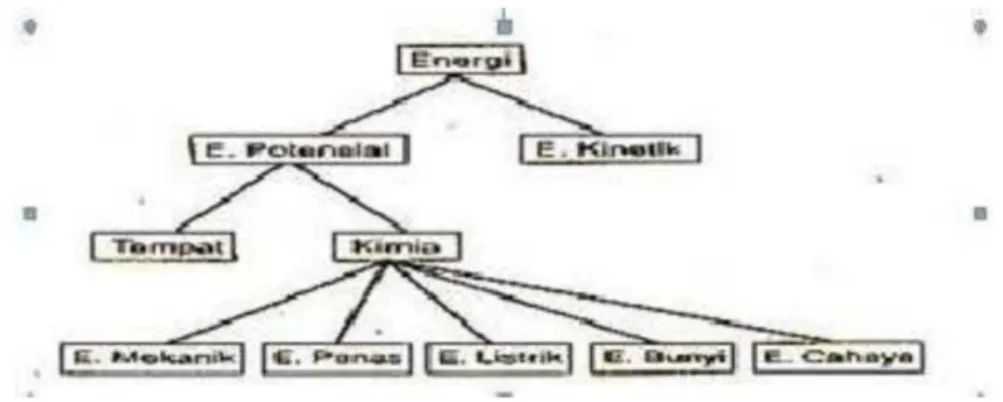
Gambar berikut ini menunjukkan diagram perubahan energi kimia menjadi Gambar berikut ini menunjukkan diagram perubahan energi kimia menjadi berbagai bentuk energi lainnya.
berbagai bentuk energi lainnya.
Harga entalpi zat sebenarnya tidak dapat ditentukan atau diukur. Tetapi Harga entalpi zat sebenarnya tidak dapat ditentukan atau diukur. Tetapi ΔHΔH dapat ditentukan dengan cara mengukur jumlah kalor yang diserap sistem. dapat ditentukan dengan cara mengukur jumlah kalor yang diserap sistem. Misalnya pada perubahan es menjadi air, yaitu 89 kalori/gram. Pada perubahan es Misalnya pada perubahan es menjadi air, yaitu 89 kalori/gram. Pada perubahan es menjadi air,
menjadi air, ΔH adalah positif, karena entalpiΔH adalah positif, karena entalpi hasil perubahan, entalpi air lebih hasil perubahan, entalpi air lebih besar dari pada entalpi es.
besar dari pada entalpi es.
Termokimia merupakan bagian dari ilmu kimia yang Termokimia merupakan bagian dari ilmu kimia yang mempelajari
mempelajari perubahan entalpi perubahan entalpi yang menyertai suatu reaksi. Pada perubahan kimiayang menyertai suatu reaksi. Pada perubahan kimia selalu terjadi perubahan entalpi. Besarnya perubahan entalpi adalah sama besar selalu terjadi perubahan entalpi. Besarnya perubahan entalpi adalah sama besar dengan selisih antara entalpi hasil rea
dengan selisih antara entalpi hasil rea ksi dam jumlah entalpi pereaksi.ksi dam jumlah entalpi pereaksi.
Pada reaksi endoterm, entalpi sesudah reaksi menjadi lebih besar, Pada reaksi endoterm, entalpi sesudah reaksi menjadi lebih besar, sehingga
sehingga ΔH positif. Sedangkan pada reaksi eksoterm, entalpi sesudah reaksiΔH positif. Sedangkan pada reaksi eksoterm, entalpi sesudah reaksi menjadi lebih kecil, sehingga
menjadi lebih kecil, sehingga ΔH negatif. Perubahan entalpi pada suatu reaksiΔH negatif. Perubahan entalpi pada suatu reaksi disebut
disebut kalor reaksikalor reaksi. Kalor reaksi untuk reaksi-reaksi yang khas disebut dengan. Kalor reaksi untuk reaksi-reaksi yang khas disebut dengan nama yang khas pula, misalnya kalor pembentukan,kalor penguraian, kalor nama yang khas pula, misalnya kalor pembentukan,kalor penguraian, kalor pembakaran, kalor pelarutan dan sebagainya.
pembakaran, kalor pelarutan dan sebagainya.
5.1.
5.1. Entalpi Pembentukan Standar (ΔHEntalpi Pembentukan Standar (ΔH◦◦f f ))
Entalpi pembentukan standar suatu senyawa menyatakan jumlah kalor Entalpi pembentukan standar suatu senyawa menyatakan jumlah kalor yang diperlukan atau dibebaskan untuk proses pembentukan 1 mol senyawa dari yang diperlukan atau dibebaskan untuk proses pembentukan 1 mol senyawa dari unsur-unsurnya yang stabil pada keadaan standar (STP). Entalpi pembentukan unsur-unsurnya yang stabil pada keadaan standar (STP). Entalpi pembentukan standar diberi simbol (ΔH
standar diberi simbol (ΔH◦◦f f ), simbol f berasal dari kata formation yang berarti), simbol f berasal dari kata formation yang berarti pembentukan.
pembentukan. Contoh Contoh unsur-unsur unsur-unsur yang yang stabil stabil pada pada keadaan keadaan standar, standar, yaitu yaitu :: H
H22,O,O22,C,N,C,N22,Ag,Cl,Ag,Cl22,Br ,Br 22,S,Na,Ca, dan Hg.,S,Na,Ca, dan Hg.
5.2. Entalpi Penguraian Standar (ΔH 5.2. Entalpi Penguraian Standar (ΔH◦◦dd))
Entalpi penguraian standar suatu senyawa menyatakan jumlah kalor yang Entalpi penguraian standar suatu senyawa menyatakan jumlah kalor yang diperlukan atau dibebaskan untuk proses penguraian 1 mol senyawa dari diperlukan atau dibebaskan untuk proses penguraian 1 mol senyawa dari unsure-unsurnya yang stabil pada keadaan standar (STP). Entalpi penguraian standar unsurnya yang stabil pada keadaan standar (STP). Entalpi penguraian standar diberi simbol (ΔH
diberi simbol (ΔH◦◦dd) simbol d berasal dari kata decomposition yang berarti) simbol d berasal dari kata decomposition yang berarti
penguraian. penguraian.
Menurut Hukum Laplace, jumlah kalor yang dibebaskan pada pembentukan Menurut Hukum Laplace, jumlah kalor yang dibebaskan pada pembentukan senyawa dari unsur-unsurnya sama dengan jumlah kalor yang diperlukan pada senyawa dari unsur-unsurnya sama dengan jumlah kalor yang diperlukan pada penguraian
penguraian senyawa senyawa tersebut tersebut menjadi menjadi unsur-unsurnya. unsur-unsurnya. Jadi, Jadi, entalpi entalpi penguraianpenguraian merupakan kebalikan dari entalpi pembentukan senyawa yang sama. Dengan merupakan kebalikan dari entalpi pembentukan senyawa yang sama. Dengan demikian jumlah kalornya sama tetapi tandanya berlawanan karena reaksinya demikian jumlah kalornya sama tetapi tandanya berlawanan karena reaksinya berlawanan arah.
berlawanan arah.
5.3. Entalpi Pembakaran Standar (ΔH
5.3. Entalpi Pembakaran Standar (ΔH
◦◦cc))
Entalpi pembakaran standar suatu senyawa menyatakan jumlah kalor yang Entalpi pembakaran standar suatu senyawa menyatakan jumlah kalor yang diperlukan atau dibebaskan untuk proses pembakaran 1 mol senyawa dari diperlukan atau dibebaskan untuk proses pembakaran 1 mol senyawa dari unsur-unsurnya yang stabil pada keadaan standar (STP). Entalpi penguraian standar unsurnya yang stabil pada keadaan standar (STP). Entalpi penguraian standar diberi simbol (ΔH
diberi simbol (ΔH◦◦cc) simbol d berasal dari kata combustion yang berarti) simbol d berasal dari kata combustion yang berarti
pembakaran. pembakaran.
Pembakaran selalu membebaskan kalor sehingga nilai entalpipembakaran Pembakaran selalu membebaskan kalor sehingga nilai entalpipembakaran selallu negatif (eksoterm)
selallu negatif (eksoterm)
5.4. Entalpi Pelarutan Standar (ΔH
5.4. Entalpi Pelarutan Standar (ΔH
◦◦ss))
Entalpi pelarutan standar menyatakan jumlah kalor yang diperlukan atau Entalpi pelarutan standar menyatakan jumlah kalor yang diperlukan atau dibebaskan untuk melarutkan 1 mol zat pada keadaan standar (STP). Entalpi dibebaskan untuk melarutkan 1 mol zat pada keadaan standar (STP). Entalpi penguraian standar
penguraian standar diberi diberi simbol simbol (ΔH(ΔH◦◦ss) simbol s berasal dari kata solvation yang) simbol s berasal dari kata solvation yang berarti pelarutan.
berarti pelarutan.
6.
6.
Kalorimeter
Kalorimeter
Kalorimeter adalah alat yang digunakan untuk mengukur jumlah
Kalorimeter adalah alat yang digunakan untuk mengukur jumlah kalor kalor yangyang terlibat dalam suatu perubahan atau
terlibat dalam suatu perubahan ataureaksi kimia.reaksi kimia. Kalorimeter terbagi menjadi dua, Kalorimeter terbagi menjadi dua, yaitu kalorimeter larutan
yaitu kalorimeter larutan dan kalorimeter bdan kalorimeter bom. om. Jika dua Jika dua buah zat abuah zat atau lebihtau lebih dicampur menjadi satu maka zat yang suhunya tinggi akan melepaskan kalor dicampur menjadi satu maka zat yang suhunya tinggi akan melepaskan kalor sedangkan zat yang suhunya rendah akan menerima kalor, sampai tercapai sedangkan zat yang suhunya rendah akan menerima kalor, sampai tercapai kesetimbangan termal.
kesetimbangan termal.
Menurut azas Black : Kalor yang dilepas = kalor yang diterima Menurut azas Black : Kalor yang dilepas = kalor yang diterima
Kalor jenis suatu benda tidak tergantung dari massa benda, tetapi Kalor jenis suatu benda tidak tergantung dari massa benda, tetapi tergantung pada sifat dan jenis benda tersebut. Jika kalor jenis suatu benda adalah tergantung pada sifat dan jenis benda tersebut. Jika kalor jenis suatu benda adalah kecil maka kenaikan suhu benda tersebut akan cepat bila dipanaskan.
kecil maka kenaikan suhu benda tersebut akan cepat bila dipanaskan. Kapasitas kalor air = 4.200 J/kg °C
6
6
.1.
.1. Kalorimeter
Kalorimeter Bom
Bom
Kalorimeter bom adalah alat yang digunakan untuk mengukur jumlah kalor Kalorimeter bom adalah alat yang digunakan untuk mengukur jumlah kalor (nilai kalori) yang dibebaskan pada pembakaran sempurna (dalam O
(nilai kalori) yang dibebaskan pada pembakaran sempurna (dalam O22 berlebih) berlebih)
suatu
suatu senyawa, senyawa, bahan bahan makanan, makanan, bahan bakar. Sejumlah sampel ditempatkan pada bahan bakar. Sejumlah sampel ditempatkan pada tabung be
tabung beroksigenroksigen yang tercelup dalam medium penyerap kalor (kalorimeter), danyang tercelup dalam medium penyerap kalor (kalorimeter), dan sampel akan terbakar oleh ap
sampel akan terbakar oleh apilistrikilistrik dari kawatdari kawat logam logam terpasang dalam tabung.terpasang dalam tabung. Contoh kalorimeter bom adalah kalorimeter makanan.
Contoh kalorimeter bom adalah kalorimeter makanan.
6.2.
6.2. Kalorimeter
Kalorimeter makanan.
makanan.
Kalorimeter makanan
Kalorimeter makanan adalah adalah alat alat untuk untuk mmenentukanenentukan nilai
nilai kalorkalor zatzat makananmakanan karbohidratkarbohidrat,, proteinprotein,, atau atau lemaklemak..Alat ini terdiri dariAlat ini terdiri dari sebuah tabung
sebuah tabung kacakaca yang tingginya kurang lebih 19 cm dan garis menengahnyayang tingginya kurang lebih 19 cm dan garis menengahnya kurang lebih 7,5 cm. Bagian dasarnya melengkung ke atas membentuk sebuah kurang lebih 7,5 cm. Bagian dasarnya melengkung ke atas membentuk sebuah penyungkup.
penyungkup. Penyungkup Penyungkup ini ini disumbat disumbat dengan dengan sebuah sebuah sumbasumbattkaretkaret yang yangyang yang berlubang
berlubang di di bagian bagian tengah. tengah. Bagian Bagian atas atas tabung tabung kaca kaca ini ini ditutup ditutup dengandengan lempeng
lempeng ebonitebonit yang bundar. Di dalam tabung kaca itu terdapat sebuah pengaduk,yang bundar. Di dalam tabung kaca itu terdapat sebuah pengaduk, yang tangkainya menembus tutup ebonit, juga terdapat sebuah yang tangkainya menembus tutup ebonit, juga terdapat sebuah pipa
pipa spiralspiraldaridari tembagatembaga.. Ujung bawah pipa spiral itu menembus lubang sumbat Ujung bawah pipa spiral itu menembus lubang sumbat karet pada penyungkup dan ujung atasnya menembus tutup ebonit bagian tengah. karet pada penyungkup dan ujung atasnya menembus tutup ebonit bagian tengah. Pada tutup ebonit itu masih terdapat lagi sebuah lubang, tempat untuk Pada tutup ebonit itu masih terdapat lagi sebuah lubang, tempat untuk memasukkan sebuah termometer ke dalam tabung kaca. Tabung kaca itu memasukkan sebuah termometer ke dalam tabung kaca. Tabung kaca itu diletakkan di atas sebuah keping
diletakkan di atas sebuah keping asbesasbes dan ditahan oleh 3 buah keping. Kepingdan ditahan oleh 3 buah keping. Keping itu berbentuk
itu berbentuk bujur sangkarbujur sangkar yang sisinya kurang lebih 9,5 cm. Di bawah kepingyang sisinya kurang lebih 9,5 cm. Di bawah keping asbes itu terdapat kabel
asbes itu terdapat kabel listriklistrikyang akan dihubungkan denganyang akan dihubungkan dengan sumber listriksumber listrik bila bila digunakan. Di atas keping asbes itu terdapat sebuah cawan
digunakan. Di atas keping asbes itu terdapat sebuah cawan aluminiumaluminium.. Di atas Di atas cawan itu tergantung sebuah kawat
cawan itu tergantung sebuah kawat nikelinnikelin yang berhubungan denganyang berhubungan dengan kabelkabel listriklistrik di bawah keping asbes. Kawat nikelin itulah yang akan menyalakan makanan di bawah keping asbes. Kawat nikelin itulah yang akan menyalakan makanan dalam cawan bila berpijar oleh arus listrik. Dekat cawan terdapat pipa
dalam cawan bila berpijar oleh arus listrik. Dekat cawan terdapat pipa logamlogamuntukuntuk mengalirkan
mengalirkan oksigenoksigen..
6.3.
6.3. Kalorimeter
Kalorimeter larutan
larutan
Kalorimeter
Kalorimeter larutan larutan adalah adalah alat alat yang yang digunakan digunakan untuk untuk mengukurmengukur jumlah
jumlah kalor kalor yang terlibat padayang terlibat pada reaksi kimia reaksi kimia dalam sistemdalam sistemlarutan.larutan. Pada dasarnya, Pada dasarnya, kalor yang dibebaskan/diserap menyebabkan perubahan
kalor yang dibebaskan/diserap menyebabkan perubahan suhu suhu pada pada kalorimeter.kalorimeter. Berdasarkan perubahan suhu per kuantitas pereaksi kemudian dihitung kalor Berdasarkan perubahan suhu per kuantitas pereaksi kemudian dihitung kalor
reaksi dari reaksi sistem larutan tersebut. Kini kalorimeter larutan dengan reaksi dari reaksi sistem larutan tersebut. Kini kalorimeter larutan dengan ketelitian cukup tinggi dapat diperoleh dipasaran.
ketelitian cukup tinggi dapat diperoleh dipasaran. Dalam menentukan entalpi berlaku persamaan Dalam menentukan entalpi berlaku persamaan Qreaksi = - (Qlarutan + Q kalorimeter ) Qreaksi = - (Qlarutan + Q kalorimeter ) Q reaksi =
-Q reaksi = - (m.c.∆T + c.∆T)(m.c.∆T + c.∆T)
Jika kapasitas kalori dalam kalorimeter diabaikan, maka Jika kapasitas kalori dalam kalorimeter diabaikan, maka
Qreaksi =
-Qreaksi = - (m.c.∆T)(m.c.∆T) Keterangan :
Keterangan : m
m = = massa massa zat zat (kg) (kg) c c = = kalor kalor jenis jenis (J/kg(J/kg⁰⁰C)C)
∆t = perubahan suhu (Celcius) ∆t = perubahan suhu (Celcius)
7.
7.
Hukum Hess
Hukum Hess
Gambaran visual dari hukum Hess dalam reaksi. Gambaran visual dari hukum Hess dalam reaksi.
Menurut hukum Hess, karena
Menurut hukum Hess, karena entalpientalpi adalahadalah fungsi keadaanfungsi keadaan,, perubahanperubahan entalpi
entalpi dari suatudari suatu reaksi kimiareaksi kimiaaadalah sama, walaupun langkah-langkah yangdalah sama, walaupun langkah-langkah yang digunakan untuk memperoleh
digunakan untuk memperoleh produkproduk berbeda. berbeda. Dengan Dengan kata kata lain,lain, hanya keadaanhanya keadaan awal dan akhir yang berpengaruh terhadap perubahan entalpi, bukan awal dan akhir yang berpengaruh terhadap perubahan entalpi, bukan langkah-langkah yang dilakukan untuk mencapainya
langkah yang dilakukan untuk mencapainya ..
Hal ini menyebabkan perubahan entalpi suatu reaksi dapat dihitung Hal ini menyebabkan perubahan entalpi suatu reaksi dapat dihitung sekalipun tidak dapat diukur secara langsung. Caranya adalah dengan sekalipun tidak dapat diukur secara langsung. Caranya adalah dengan melakukan
melakukan operasi operasi aritmatikaaritmatika pada pada beberapabeberapa persamaan persamaan reaksireaksi yangyang perubahan
perubahan entalpinya entalpinya diketahui. diketahui. Persamaan-persaPersamaan-persamaan maan reaksi reaksi tersebut tersebut diaturdiatur sedemikian rupa sehingga penjumlahan semua persamaan akan menghasilkan sedemikian rupa sehingga penjumlahan semua persamaan akan menghasilkan reaksi yang kita inginkan. Jika suatu persamaan reaksi dikalikan (atau dibagi) reaksi yang kita inginkan. Jika suatu persamaan reaksi dikalikan (atau dibagi) dengan suatu angka, perubahan entalpinya juga harus dikali (dibagi). Jika dengan suatu angka, perubahan entalpinya juga harus dikali (dibagi). Jika persamaan
persamaan itu itu dibalik, dibalik, maka maka tanda tanda perubahan perubahan entalpi entalpi harus harus dibalik dibalik pula pula (yaitu(yaitu menjadi
-menjadi -ΔH).ΔH).
Selain itu, dengan
Selain itu, dengan menggunakan hukum Hess, nilai ΔH juga dapatmenggunakan hukum Hess, nilai ΔH juga dapat diketahui dengan pengurangan
diketahui dengan pengurangan entalpi pembentukanentalpi pembentukan produk-produk produk-produk dikurangidikurangi entalpi pembentukan
entalpi pembentukan reaktanreaktan.. Secara matematis Secara matematis .. Untuk reaksi-reaksi lainnya secara umum
Untuk reaksi-reaksi lainnya secara umum
Kegunaan Kegunaan
Dengan mengetahui ΔH
Dengan mengetahui ΔHf f (perubahan (perubahan entalpi entalpi pembentukan) dapembentukan) dari ri reaktan reaktan dandan produknya, dapat diramalkan perubahan entalpi reaksi apapun, dengan rumus
ΔH=ΔH
ΔH=ΔHf f P-P-ΔHΔH f f R R
Perubahan entalpi suatu reaksi juga dapat diramalkan dari perubahan Perubahan entalpi suatu reaksi juga dapat diramalkan dari perubahan entalpi
entalpi pembakaranpembakaran reaktan dan produk, dengan rumusreaktan dan produk, dengan rumus ΔH=
ΔH=--ΔHΔHccP+ΔHP+ΔHccR R
Konsep dari hukum Hess juga dapat diperluas untuk menghitung perubahan fungsi Konsep dari hukum Hess juga dapat diperluas untuk menghitung perubahan fungsi keadaan lainnya, seperti
keadaan lainnya, seperti entropientropi dandanenergi bebasenergi bebas.. Kedua aplikasi ini amat Kedua aplikasi ini amat berguna
berguna karena karena besaran-besaran besaran-besaran tersebut tersebut sulit sulit atau atau tidak tidak bisa bisa diukur diukur secarasecara langsung, sehingga perhitungan dengan hukum Hess digunakan sebagai salah satu langsung, sehingga perhitungan dengan hukum Hess digunakan sebagai salah satu cara menentukannya.
cara menentukannya. Untuk perubahan entropi: Untuk perubahan entropi:
ΔSΔSoo = Σ(ΔS= Σ(ΔSf f oo produk produk ) -) - Σ(ΔSΣ(ΔSf f ooreaktanreaktan)) ΔS = Σ(ΔSΔS = Σ(ΔSoo produk produk ) -) - Σ(ΔSΣ(ΔSooreaktanreaktan).).
Untuk perubahan energi bebas: Untuk perubahan energi bebas:
ΔGΔGoo = Σ(ΔG= Σ(ΔGf f oo produk produk ) -) - Σ(ΔGΣ(ΔGf f ooreaktanreaktan)) ΔG = Σ(ΔGΔG = Σ(ΔGoo produk produk ) -) - Σ(ΔGΣ(ΔGooreaktanreaktan))
8.
8.
Penentuan ΔH Reaksi
Penentuan ΔH Reaksi
Hukum Hess menyatakan bahwa perubahan entalpi tidak tergantung pada Hukum Hess menyatakan bahwa perubahan entalpi tidak tergantung pada berapa
berapa banyak banyak tahapan tahapan reaksi, reaksi, tetapi tetapi tergantung tergantung pada pada keadaan keadaan awal awal dan dan akhir.akhir. Dengan kata lain, untuk suatu reaksi keseluruhan tertentu, perubahan entalpi selalu Dengan kata lain, untuk suatu reaksi keseluruhan tertentu, perubahan entalpi selalu sama, tak peduli apakah reaksi itu dilaksanakan secara langsung ataukah secara tak sama, tak peduli apakah reaksi itu dilaksanakan secara langsung ataukah secara tak langsung dan lewat tahap-tahap yan
langsung dan lewat tahap-tahap yang berlainan. Rumus yang dapat dipakai yaitu:g berlainan. Rumus yang dapat dipakai yaitu:
Ada tiga cara yang dapat digunakan untuk mencari ΔH
Ada tiga cara yang dapat digunakan untuk mencari ΔHreaksireaksidengan hukumdengan hukum Hess ini, yaitu cara diagram, siklus, dan cara persamaan reaksi.
Hess ini, yaitu cara diagram, siklus, dan cara persamaan reaksi.
DiagramDiagram
Perhitungan dengan cara diagram adalah dengan memperhatikan keadaan awal, Perhitungan dengan cara diagram adalah dengan memperhatikan keadaan awal, keadaan akhir, dan tanda panah reaksi (atas atau bawah).
keadaan akhir, dan tanda panah reaksi (atas atau bawah).
SiklusSiklusCara siklus hampir sama dengan cara diagram, namun bentuknya lebih fleksibel Cara siklus hampir sama dengan cara diagram, namun bentuknya lebih fleksibel dibandingkan diagram.
Cara Persamaan ReaksiCara Persamaan ReaksiCara ini dapat dipakai jika diagram atau siklusnya tidak diketahui. Penentuan cara Cara ini dapat dipakai jika diagram atau siklusnya tidak diketahui. Penentuan cara ini memerlukan ketelitian dalam menentukan apakah suatu reaksi tetap, dibalik, ini memerlukan ketelitian dalam menentukan apakah suatu reaksi tetap, dibalik, atau dikalikan karena akan mempengaruhi hasilnya.
atau dikalikan karena akan mempengaruhi hasilnya. Ada cara lain untuk menentukan ΔH
Ada cara lain untuk menentukan ΔHreaksireaksidengan menghitung energi ikatandengan menghitung energi ikatan
rata-ratanya. Energi ikatan rata-rata adalah energi rata-rata yang diperlukan untuk rata-ratanya. Energi ikatan rata-rata adalah energi rata-rata yang diperlukan untuk memutuskan satu mol ikatan antar atom dalam fase gas.
memutuskan satu mol ikatan antar atom dalam fase gas.
Data energi ikatan rata-rata: Data energi ikatan rata-rata: C-H
C-H = = 410 410 kJ/mol kJ/mol C-O C-O = = 351 351 kJ/molkJ/mol O-H
O-H = = 460 460 kJ/mol kJ/mol C=C C=C = = 607 607 kJ/molkJ/mol C-C
C-C = = 343 343 kJ/molkJ/mol
Perubahan entalpi yang dikaitkan dengan reaksi pembentukan satu mol Perubahan entalpi yang dikaitkan dengan reaksi pembentukan satu mol senyawa disebut entalpi pembentukan standar ΔH°
senyawa disebut entalpi pembentukan standar ΔH°ff
9.
9.
Energi Ikatan
Energi Ikatan
Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan kimia Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan kimia dalam 1 mol suatu molekul / senyawa berwujud gas menjadi atom-atomnya. dalam 1 mol suatu molekul / senyawa berwujud gas menjadi atom-atomnya. Lambang energi ikatan = D
Lambang energi ikatan = D Suatu reaksi yang
Suatu reaksi yang
HH – – nya ditentukan dengan menggunakan energi ikatan,nya ditentukan dengan menggunakan energi ikatan, maka atom-atom yang terlibat dalam reaksi harus berwujud gas.maka atom-atom yang terlibat dalam reaksi harus berwujud gas.
Berdasarkan jenis dan letak atom terhadap atom-atom lain dalam Berdasarkan jenis dan letak atom terhadap atom-atom lain dalam molekulnya, dikenal 3 jenis energi ikatan yaitu :
molekulnya, dikenal 3 jenis energi ikatan yaitu :
a.
a. Energi Atomisasi.Energi Atomisasi.
Adalah energi yang diperlukan untuk memutuskan semua ikatan 1 mol Adalah energi yang diperlukan untuk memutuskan semua ikatan 1 mol molekul menjadi atom-atom bebas dalam keadaan gas.
molekul menjadi atom-atom bebas dalam keadaan gas.
Energi atomisasi = jumlah seluruh ikatan atom-atom dalam 1 mol senyawa. Energi atomisasi = jumlah seluruh ikatan atom-atom dalam 1 mol senyawa.
b.
b. Energi Disosiasi Ikatan.Energi Disosiasi Ikatan.
Adalah energi yang diperlukan untuk memutuskan salah 1 ikatan yang Adalah energi yang diperlukan untuk memutuskan salah 1 ikatan yang terdapat pada suatu molekul atau senyawa dalam keadaan gas.
terdapat pada suatu molekul atau senyawa dalam keadaan gas.
c.
c. Energi Ikatan Rata-Rata.Energi Ikatan Rata-Rata.
Adalah energi rerata yang diperlukan untuk memutuskan ikatan atom-atom Adalah energi rerata yang diperlukan untuk memutuskan ikatan atom-atom pada suatu senyawa
pada suatu senyawa ( notasinya = ( notasinya = D ). Energi iD ). Energi ikatan suatu katan suatu molekul yang berwujudmolekul yang berwujud gas dapat ditentukan dari data entalpi pembentukan standar (
gas dapat ditentukan dari data entalpi pembentukan standar (
Hf ) dan energi ikatHf ) dan energi ikat unsur-unsurnya. Prosesnya melalui 2 tahap yaitu :unsur-unsurnya. Prosesnya melalui 2 tahap yaitu :
o
o Penguraian senyawa menjadi unsur-unsurnya.Penguraian senyawa menjadi unsur-unsurnya. o
o Pengubahan unsur menjadi atom gas.Pengubahan unsur menjadi atom gas.
Reaksi kimia pada dasarnya terdiri dari 2 proses : Reaksi kimia pada dasarnya terdiri dari 2 proses :
o
o Pemutusan ikatan pada pereaksi.Pemutusan ikatan pada pereaksi. o
Pada
Pada proses proses pemutusan pemutusan ikatan ikatan = = memerlukan memerlukan energi.energi. Pada proses pembentukan ikatan = membebaskan energi Pada proses pembentukan ikatan = membebaskan energi
10.
10.
Jenis-Jenis Kalor
Jenis-Jenis Kalor
Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Setiap sistem atau zat mempunyai energi yang tersimpan didalamnya. Energi potensial berkaitan dengan wujud zat, volume, dan tekanan. Energi kinetik Energi potensial berkaitan dengan wujud zat, volume, dan tekanan. Energi kinetik ditimbulkan karena atom
ditimbulkan karena atom – – atom dan molekul-molekul dalam zat bergerak secaraatom dan molekul-molekul dalam zat bergerak secara acak. Jumlah total dari semua bentuk energi itu
acak. Jumlah total dari semua bentuk energi itu disebutdisebut entalpientalpi (H)
(H).. Sedangkan kalor adalah bentuk energi yang berpindah dari suhu tinggi ke Sedangkan kalor adalah bentuk energi yang berpindah dari suhu tinggi ke suhu rendah. Jika suatu benda menerima / melepaskan kalor maka suhu benda itu suhu rendah. Jika suatu benda menerima / melepaskan kalor maka suhu benda itu akan naik/turun atau wujud benda berubah.
akan naik/turun atau wujud benda berubah. Kalor jenis (c)
Kalor jenis (c) adalah banyaknya kalor yang dibutuadalah banyaknya kalor yang dibutuhkan untuk menaikkanhkan untuk menaikkan 1 gram atau 1 kg zat sebesar 1ºC (satuan kalori/gram.ºC atau kkal/kg ºC).
1 gram atau 1 kg zat sebesar 1ºC (satuan kalori/gram.ºC atau kkal/kg ºC).
Kalor yang digunakan untuk menaikkan/menurunkan suhu tanpa mengubah wujud Kalor yang digunakan untuk menaikkan/menurunkan suhu tanpa mengubah wujud zat:
zat:
Q = kalor yang di lepas/diterima Q = kalor yang di lepas/diterima H = kapasitas kalor H = kapasitas kalor Dt = kenaikan/penurunan suhu Dt = kenaikan/penurunan suhu m = massa benda m = massa benda c= kalor jenis c= kalor jenis
Kalor yang diserap/dilepaskan (Q) dalam proses perubahan wujud benda: Kalor yang diserap/dilepaskan (Q) dalam proses perubahan wujud benda: Q = m . L
Q = m . L
m = massa benda (kg) m = massa benda (kg)
L = kalor laten (kalor lebur,
L = kalor laten (kalor lebur, kalor beku. kalor uap,kalor embun, kalor sublim, kalor beku. kalor uap,kalor embun, kalor sublim, kalorkalor lenyap)
lenyap)
Jadi kalor yang diserap atau yang dilepas pada saat terjadi perubahan wujud benda Jadi kalor yang diserap atau yang dilepas pada saat terjadi perubahan wujud benda tidak menyebabkan perubahan suhu benda (suhu benda konstan ).
tidak menyebabkan perubahan suhu benda (suhu benda konstan ).
10.1. Kalor Pembentukan Standar
10.1. Kalor Pembentukan Standar
Adalah nama lain dari perubahan entalpi yang terjadi pada pembentukan 1 Adalah nama lain dari perubahan entalpi yang terjadi pada pembentukan 1 mol senyawa dari unsur-unsurnya pada suhu dan tekanan standar ( 25
mol senyawa dari unsur-unsurnya pada suhu dan tekanan standar ( 25 ooC, 1 atm ).C, 1 atm ). Entalpinya
Entalpinya bisa bisa dilepaskan dilepaskan maupun maupun diserap. diserap. Satuannya Satuannya adalah adalah kJ kJ / / mol. mol. BentukBentuk standar
standar dari suatu unsur adalah dari suatu unsur adalah bentuk yang palinbentuk yang paling stabil dari unsur g stabil dari unsur itu padaitu pada keadaan standar ( 298 K, 1 atm ). Jika perubahan entalpi pembentukan tidak keadaan standar ( 298 K, 1 atm ). Jika perubahan entalpi pembentukan tidak diukur pada keadaan standar maka dinotasikan dengan
diukur pada keadaan standar maka dinotasikan dengan HHff.. Catatan :
Catatan : o
o Hf unsuHf unsur bebas r bebas = nol= nol o
o Dalam entalpi pembentukan, jumlah zat yang dihasilkan adalah 1 mol.Dalam entalpi pembentukan, jumlah zat yang dihasilkan adalah 1 mol. o
o Dibentuk dari unsur-unsurnya dalam bentuk standar.Dibentuk dari unsur-unsurnya dalam bentuk standar.
10.2. Kalor Penguraian Standar
10.2. Kalor Penguraian Standar
Adalah nama lain dari perubahan entalpi yang terjadi pada penguraian 1 Adalah nama lain dari perubahan entalpi yang terjadi pada penguraian 1 mol senyawa menjadi unsur-unsur penyusunnya pada keadaan standar. Jika mol senyawa menjadi unsur-unsur penyusunnya pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan sta
pengukuran tidak dilakukan pada keadaan standar, maka dinotasikandar, maka dinotasikan dengann dengan HHdd.. Satuannya = kJ / mol. Perubahan entalpi penguraian standar Satuannya = kJ / mol. Perubahan entalpi penguraian standar
merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tanda.
pun akan berlawanan tanda.
Menurut Marquis de Laplace, “
Menurut Marquis de Laplace, “ jumlah jumlah kalor kalor yang yang dilepaskan dilepaskan padapada pembentukan
pembentukan senyawa senyawa dari dari unsur-unsur unsur-unsur penyusunnya penyusunnya = = jumlah jumlah kalor kalor yangyang diperlukan pada penguraian senyawa tersebut menjadi unsur-unsur penyusunnya diperlukan pada penguraian senyawa tersebut menjadi unsur-unsur penyusunnya .. “ Pernyataan ini disebut Hukum Laplace.
“ Pernyataan ini disebut Hukum Laplace.
10.3. Kalor Pembakaran Standar
10.3. Kalor Pembakaran Standar
Adalah nama lain dari perubahan entalpi yang terjadi pada pembakaran 1 Adalah nama lain dari perubahan entalpi yang terjadi pada pembakaran 1 mol suatu zat secara sempurna pada keadaan standar. Jika pengukuran tidak mol suatu zat secara sempurna pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan
dilakukan pada keadaan standar, maka dinotasikan dengan Hc. SHc. Satuannyatuannya = ka = kJ /J / mol.
mol.
10.4. Kalor Netralisasi Standar
10.4. Kalor Netralisasi Standar
Adalah nama lain dari perubahan entalpi yang terjadi pada penetralan 1 mol Adalah nama lain dari perubahan entalpi yang terjadi pada penetralan 1 mol asam oleh basa atau 1 mol basa oleh asam pada keadaan standar. Jika pengukuran asam oleh basa atau 1 mol basa oleh asam pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan
tidak dilakukan pada keadaan standar, maka dinotasikan dengan Hn. SaHn. Satuatuannynnyaa = kJ / mol.
= kJ / mol.
10.5. Kalor Penguapan Standar
10.5. Kalor Penguapan Standar
Adalah nama lain dari perubahan entalpi yang terjadi pada penguapan 1 Adalah nama lain dari perubahan entalpi yang terjadi pada penguapan 1 mol zat dalam fase cair menjadi fase gas pada keadaan standar. Jika pengukuran mol zat dalam fase cair menjadi fase gas pada keadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan
tidak dilakukan pada keadaan standar, maka dinotasikan dengan HvHvapap.. Satuannya = kJ / mol.
Satuannya = kJ / mol.
10.6. Kalor Peleburan Standar
10.6. Kalor Peleburan Standar
Adalah nama lain dari perubahan entalpi yang terjadi pada pencairan / Adalah nama lain dari perubahan entalpi yang terjadi pada pencairan / peleburan
peleburan 1 1 mol mol zat zat dalam dalam fase fase padat padat menjadi menjadi zat zat dalam dalam fase fase cair cair pada pada keadaankeadaan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan standar. Jika pengukuran tidak dilakukan pada keadaan standar, maka dinotasikan dengan
dengan Hfus. SHfus. Satuannatuannya = kJ / mol.ya = kJ / mol.
10.7. Kalor Sublimasi Standar
10.7. Kalor Sublimasi Standar
Adalah perubahan entalpi yang terjadi pada sublimasi 1 mol zat dalam fase Adalah perubahan entalpi yang terjadi pada sublimasi 1 mol zat dalam fase padat
padat menjadi menjadi zat zat dalam dalam fase fase gas gas pada pada keadaan keadaan standar. standar. Jika Jika pengukuran pengukuran tidaktidak dilakukan pada keadaan standar, maka dinotasikan dengan
dilakukan pada keadaan standar, maka dinotasikan dengan Hsub. Hsub. SatuSatuannya = annya = kJkJ / mol.
/ mol.
10.8. Kalor Pelarutan Standar
10.8. Kalor Pelarutan Standar
Adalah nama lain dari perubahan entalpi yang terjadi ketika 1 mol zat Adalah nama lain dari perubahan entalpi yang terjadi ketika 1 mol zat melarut dalam suatu pelarut ( umumnya air ) pada keadaan standar. Jika melarut dalam suatu pelarut ( umumnya air ) pada keadaan standar. Jika pengukuran
pengukuran tidak tidak dilakukan dilakukan pada pada keadaan keadaan standar, standar, maka maka dinotasikandinotasikan dengan
BAB III
BAB III
PENUTUP
PENUTUP
1. 1. KesimpulanKesimpulanSingkatnya, materi pembelajaran pada termokimia ini merupakan materi Singkatnya, materi pembelajaran pada termokimia ini merupakan materi dasar yang wajib untuk dipelajari dan dipahami secara mendalam. Materi yang dasar yang wajib untuk dipelajari dan dipahami secara mendalam. Materi yang secara umum mencakup termodinamika I, kalor reaksi, kerja, entalpi, kalorimeter, secara umum mencakup termodinamika I, kalor reaksi, kerja, entalpi, kalorimeter, hukum Hess, penentuan
hukum Hess, penentuan H reaksi, enH reaksi, energi ikatanergi ikatan, dan jenis, dan jenis-jenis kalor merupakan-jenis kalor merupakan materi-materi dasar dalam pelajaran kimia yang berguna untuk mempelajari materi materi-materi dasar dalam pelajaran kimia yang berguna untuk mempelajari materi selanjutnya yang tentu saja lebih rumit. Dalam makalah ini materi duraikan secara selanjutnya yang tentu saja lebih rumit. Dalam makalah ini materi duraikan secara singkat agar para pembaca lebih mudah memahaminya.
singkat agar para pembaca lebih mudah memahaminya. 2.
2. SaranSaran
Dengan adanya makalah sederhana ini, penyusun mengharapkan agar para Dengan adanya makalah sederhana ini, penyusun mengharapkan agar para pembaca
pembaca dapat dapat memahami memahami materi materi termokimia termokimia ini ini dengan dengan mudah. mudah. Saran Saran daridari penyusun
penyusun agar agar para para pembaca pembaca dapat dapat menguasai menguasai materi materi singkat singkat dalam dalam makalah makalah iniini dengan baik, kemudian dilanjutkan dengan pelatihan soal sesuai materi yang dengan baik, kemudian dilanjutkan dengan pelatihan soal sesuai materi yang berhubungan agar semakin menguasai materi.