i
SURUHAN (
Peperomia pellucida L.
)
TERHADAP PERTUMBUHAN
Escherichia coli
DAN
Bacillus cereus
SECARA IN-VITRO SERTA
KAITANNYA DENGAN PEMBELAJARAN BIOLOGI SMA KELAS X
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Pendidikan
Program Studi Pendidikan Biologi
Oleh :
M.I Karenina Ully Kristanti
NIM: 101434012
PROGRAM STUDI PENDIDIKAN BIOLOGI
JURUSAN PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“Tetapi aku tidak menghiraukan nyawaku sedikitpun, asal saja aku dapat mencapai garis akhir dan menyelesaikan pelayanan yang ditugaskan oleh
Tuhan Yesus kepadaku untuk memberi kesaksian tentang Injil Kasih Karunia Allah”
(Kisah Para Rasul 20:24-25)
vii
ABSTRAK
“UJI AKTIVITAS ANTIBAKTERI DARI EKSTRAK TANAMAN SURUHAN (Peperomia pellucida L.)TERHADAP PERTUMBUHAN
Escherichia coli DAN Bacillus cereus SECARA IN-VITRO SERTA
KAITANNYA DENGAN PEMBELAJARAN BIOLOGI SMA KELAS X”
M.I. Karenina Ully Kristanti Universitas Sanata Dharma
2014
Penyakit infeksi merupakan permasalahan yang membutuhkan perhatian besar dalam bidang kesehatan. Mikroorganisme yang dapat menyebabkan infeksi dan menimbulkan penyakit adalah mikroorganisme yang mempunyai daya patogenitas yang tinggi, salah satunya adalah bakteri. Tujuan penelitian ini adalah untuk mengetahui aktivitas antibakteri dari ekstrak rebus dan ekstrak tumbuk tanaman suruhan (Peperomia pellucida L.) dengan konsentrasi 35%, 40% dan 45% terhadap pertumbuhan Escherichia coli dan Bacillus cereus.
Penelitian ini merupakan eksperimental laboratorium menggunakan desain penelitian Rancangan Acak Lengkap (RAL) dengan perlakuan variasi sampel, variasi populasi, dan konsentrasi ekstrak. Sampel tanaman suruhan diambil di Kebun Obat Kampus III Universitas Sanata Dharma Yogyakarta. Biakan murni
Escherichia coli dan Bacillus cereus diperoleh dari Laboratorium Bioteknologi Pascasarjana Universitas Gadjah Mada. Pengujian dilakukan dengan mengukur diameter daerah hambat di sekitar cakram kertas yang telah diberi ekstrak tanaman suruhan dengan konsentrasi tertentu. Data yang diperoleh diolah dengan uji Anova dua arah.
Hasil analisis Anova dua arah menunjukkan ada perbedaan bermakna
(α<0,05) antara perlakuan ekstrak rebus dan ekstrak tumbuk terhadap pertumbuhan Escherichia coli maupun Bacillus cereus. Kesimpulan pada penelitian ini adalah ekstrak tanaman suruhan memiliki aktivitas antibakteri terhadap pertumbuhan Escherichia coli dan Bacillus cereus. Ekstrak tanaman suruhan yang ditumbuk lebih efektif menghambat pertumbuhan Escherichia coli
dan Bacillus cereus dibanding ekstrak yang direbus. Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) terhadap Escherichia coli dari ekstrak rebus adalah 39% dan ekstrak tumbuk 37%. Sedangkan KHM dan KBM terhadap Bacillus cereus dari ekstrak rebus adalah 38% dan ekstrak tumbuk 37%.
viii
ABSTRACT
THE ANTIBACTERIA ACTIVITY TEST FROM EXTRACT OF SURUHAN PLANT (Peperomia pellucida L.) TOWARDS THE GROWTH
OF Escherichia coli AND Bacillus cereus THROUGH IN-VITRO MECHANISM AND THE IMPLEMENTATION IN BIOLOGY
EDUCATION
M. I. Karenina Ully Kristanti Sanata Dharma University
2014
Infection is a set of problem that needs a big attention in the field of health. Microorganism that can cause infection and make something to come to dishes is a microoorganism which has highly pathogenicity such as bacteria. The purpose of this research is to get to know the activity of antibacteria from boiled extract
and pounded extract of “suruhan” plant (Peperomia pellucida L.) within 35%, 40%, 45% concentration toward the growth of Escherichia coli and Bacillus cereus.
This research was a laboratory experimental research used Completely Randomized Design (CRD) method with sample of treatment variation, population variation and extract concentration. The sample of “suruhan” plant was took in Kebun Obat Kampus III Universitas Sanata Dharma Yogyakarta. Pure isolation of Escherichia coli and Bacillus cereus was gotten from Post Graduate Biotechnology Laboratory of Universitas Gadjah Mada. The experiment was done by measuring the diameter of resistant area surrounding the paper disk which has
given by the extract of “suruhan” plant with specific concentration. Obtained data
is processed which Two Way Annova test.
The result of Two Way Annova analisis showed that there were significant different (α<0,05) between the treatment of boiled extract and pounded extract to the growth of Escherichia coli and Bacillus cereus. The conclusion on this research is “suruhan” plant extract has the antibacteria activity towards the growth of Escherichia coli and Bacillus cereus. Pounded “suruhan” plant extract is more
effective to obstruct the Escherichia coli and Bacillus cereus than the boiled extract. The Minimum Inhibitory Concetration (MIC) and Minimum Bactericidal Concentration (MBC) to the Escherichia coli from boiled extract is 39% and pounded extract is 37%. While MIC and MBC in Bacillus cereus from boiled extract is 38% and pounded extract is 37%.
ix
KATA PENGANTAR
Puji syukur dan terimakasih penulis ucapkan kepada Tuhan Yesus Kristus
yang telah memberkati dan melimpahkan kasih karuniaNya sehingga penulis
dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Antibakteri dari Ekstrak
Tanaman Suruhan (Peperomia pellucida L.) terhadap Pertumbuhan Escherichia coli dan Bacillus cereus secara In-Vitro serta Kaitannya dengan Pembelajaran
Biologi SMA Kelas X”.
Penyusunan skripsi ini dapat berjalan lancar dengan bantuan, bimbingan
dan arahan berbagai pihak. Seiring dengan selesainya skripsi ini penulis ingin
mengucapkan terimakasih kepada:
1. Rohandi, Ph,D. selaku Dekan Fakultas Keguruan dan Ilmu Pengetahuan
Universitas Sanata Dharma Yogyakarta yang telah menyetujui dan
mengesahkan skripsi ini.
2. Drs. Antonius Tri Priantoro, M.For.Sc. selaku Ketua Program Studi
Pendidikan Biologi Univestitas Sanata Dharma Yogyakarta
3. Chatarina Retno H, S.si. M.Biotech. selaku dosen pembimbing yang telah
memberikan semangat dalam membimbing penulis, bersedia meluangkan
waktu, tenaga, dan pikiran, serta memberikan saran yang membangun bagi
penyusunan skripsi.
4. Dosen penguji skripsi yang telah memberikan masukan kepada penulis dan
bersedia membimbing penulis dalam menyempurnakan naskah skripsi.
5. Segenap Dosen dan Staf Sekretariat Jurusan Pendidikan Matematika dan Ilmu
Pengetahuan Alam yang telah banyak membantu selama kuliah dan penelitian
berlangsung
6. Mas Agus, selaku Laboran di Laboratorium Pendidikan Biologi Universitas
Sanata Dharma yang selalu memberikan waktu dan tenaga selama penelitian
berlangsung.
7. Bapak dan Ibu tercinta yang selalu mendoakan dan memberi dukungan, serta
x
8. Hendy Suprapto Schultz sebagai teman istimewa untuk berbagi, berkeluh, dan
menemani perjuanganku menyelesaikan tulisan ini.
9. Teman-teman angkatan 2010 yang telah membantu dan menemani selama
penelitian, terimakasih atas segala dukungannya.
10. Putri Setyarini, Rita Hesti, Dominica Ria, Fani Herdioktavi, Maria Endah,
Richardus Hugo, Resi Mandalia, Citra Ayu, Dwi Pasinggi, yang ikut
mendukung penelitian ini.
11. Semua pihak yang tidak dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa dalam penyusunan skripsi ini memiliki banyak
kekurangan. Namun demikian penulis berharap agar skripsi ini dapat memberikan
sumbangan yang berarti bagi perkembangan ilmu pengetahuan. Terimakasih yang
setulus-tulusnya penulis ucapkan kepada semua pihak yang telah membantu
penulis dalam penyelesaian skripsi ini dan penulis sungguh mengharapkan kritik
maupun saran yang bersifat membangun dari para pembaca.
Yogyakarta, 22 Juli 2014
xi
DAFTAR ISI
Halaman
HALAMAN JUDUL ...i
HALAMAN PERSETUJUAN PEMBIMBING ...ii
HALAMAN PENGESAHAN ...iii
HALAMAN PERSEMBAHAN ...iv
HALAMAN PERNYATAAN KEASLIAN PENELITIAN ...v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ...vi
ABSTRAK ...vii
ABSTRACT ...viii
KATA PENGANTAR ...ix
DAFTAR ISI ...xi
DAFTAR TABEL ...xiii
DAFTAR GAMBAR ...xiv
DAFTAR LAMPIRAN ...xvi
BAB I. PENDAHULUAN ...1
A.Latar Belakang Masalah...1
B.Rumusan Masalah ...4
C.Batasan Masalah ...5
D.Hipotesis ...5
E. Tujuan Penelitian ...6
F. Manfaat Penelitian ...6
BAB II. DASAR TEORI ...7
A.Suruhan Liar (Peperomia pellucida L.) ...7
B.Bakteri ... 9
C.Bacillus cereus ...15
D.Escherichia coli ...16
E. Media ... 17
F. Sterilisasi ...18
G.Antibakteri ...20
xii
BAB III. METODOLOGI PENELITIAN ...28
A.Jenis Penelitian ...28
B.Sampel dan Populasi ...28
C.Tempat da Waktu Penelitian ...29
D.Desain Penelitian ...29
E. Teknik Pengumpulan Data ... 29
1.Tahap Persiapan ...29
2.Tahap Pelaksanaan ...30
3.Tahap Perlakuan...36
F. Analisa Data ...38
G.Instrumen Penelitian ...39
H.Variabel Penelitian ...39
BAB IV. HASIL DAN PEMBAHASAN ...40
A.Identifikasi Tanaman Suruhan (Peperomia pellucida L.) ...40
B.Uji Kemurnian Bakteri Uji ... 40
C.Aktivitas Antibakteri ...42
D.Kadar Hambat Minimum (MIC/Minimum Inhibitory Concentration) ...52
E. Kadar Bunuh Minimum (MBC/Minimum Bactericidal Concentration) ...56
BAB V. KAITAN ANTARA HASIL PENELITIAN DAN PENDIDIKAN ...59
BAB VI. KESIMPULAN DAN SARAN...60
A.Kesimpulan ...60
B.Saran ...60
DAFTAR PUSTAKA ...62
xiii
DAFTAR TABEL
Halaman
Tabel 3.1 Variasi Konsentrasi Ekstrak untuk Membuat Stok Perlakuan ...31
Tabel 4.1 Hasil Uji Kemurnian Escherichia coli ...41
Tabel 4.2 Hasil Uji Kemurnian Bacillus cereus ...42
Tabel 4.3 Diameter Daerah Hambat Ekstrak Antibakteri terhadap Pertumbuhan Escherichia coli ...43
Tabel 4.4 Diameter Daerah Hambat Ekstrak Antibakteri terhadap Pertumbuhan Bacillus cereus ...45
Tabel 4.5 Hasil Uji KHM/MIC Ekstrak Antibakteri terhadap Escherichia coli dan Bacillus cereus ...52
Tabel 4.6 Hasil Uji KBM/MBC Ekstrak Antibakteri terhadap Escherichia coli dan Bacillus cereus ...57
Tabel 7.1 Diameter Daerah Hambat Ekstrak Antibakteri terhadap Pertumbuhan Escherichia coli dan Bacillus cereus ...67
Tabel 7.2 Hasil Uji Normalitas Kolmogorov-Smirnov terhadap
Escherichia coli ...68
Tabel 7.3 Hasil Uji Homogenitas Ekstrak Antibakteri terhadap Pertumbuhan Escherichia coli ...68
Tabel 7.4 Hasil Uji Two Way Annova (Varian Dua Faktor) terhadap
Escherichia coli ...69
Tabel 7.5 Hasil Uji Tukey Post Hoc terhadap Escherichia coli ...69
Tabel 7.6 Hasil Uji Normalitas Kolmogorov-Smirnov terhadap Bacillus cereus ...70
Tabel 7.7 Hasil Uji Homogenitas terhadap Pertumbuhan Bacillus cereus ...70
Tabel 7.8 Hasil Uji Two Way Annova (Varian Dua Faktor) terhadap
Bacillus cereus ...71
xiv
DAFTAR GAMBAR
Halaman
Gambar 2.1 Tanaman Suruhan (Peperomia pellucida L.) ... 7
Gambar 2.2 B. cereus pada Media Luria Agar (LA), Inkubasi Suhu Kamar selama 24 jam ...15
Gambar 2.3. E. coli pada Media Luria Agar (LA), Inkubasi Suhu Kamar selama 24 jam ...16
Gambar 2.4. Kerangka Pemikiran ...27
Gambar 3.1. Bagan Alir Proses Pengujian Aktivitas Antibakteri ...37
Gambar 4.1 Diameter Daerah Hambat pada Perlakuan Ekstrak Rebus dan Ekstrak Tumbuk terhadap Escherichia coli ...44
Gambar 4.2 Diameter Daerah Hambat pada Perlakuan Ekstrak Rebus dan Ekstrak Tumbuk terhadap Bacillus cereus ...46
Gambar 7.1 Hasil Pengecatan Negatif Escherichia coli ...72
Gambar 7.2 Hasil Pengecatan Gram Escherichia coli ...72
Gambar 7.3 Hasil Uji Morfologi Koloni Escherichia coli ... 72
Gambar 7.4 Hasil Pengecatan Negatif Bacillus cereus ...73
Gambar 7.5 Hasil Pengecatan Gram Bacillus cereus ...73
Gambar 7.6 Hasil Uji Morfologi Koloni Bacillus cereus ...73
Gambar 7.7 Aktivitas Ekstrak Antibakteri dengan Perlakuan Rebus (kiri) dan Tumbuk (kanan) pada Konsentrasi 35%, 40%, dan 45% terhadap Escherichia coli ...74
Gambar 7.8 Aktivitas Kontrol Negatif dan Kontrol Positif terhadap Escherichia coli ...74
Gambar 7.9 Aktivitas Ekstrak Antibakteri dengan Perlakuan Rebus (kiri) dan Tumbuk (kanan) pada Konsentrasi 35%, 40% dan 45% terhadap Bacillus cereus ... 75
xv
Gambar 7.11 Hasil Uji Kadar Hambat Minimum Ekstrak Rebus Antibakteri terhadap Escherichia coli ...76
Gambar 7.12 Hasil Uji Kadar Hambat Minimum Ekstrak Tumbuk Antibakteri terhadap Escherichia coli ...76
Gambar 7.13 Hasil Uji Kadar Hambat Minimum Ekstrak Rebus Antibakteri terhadap Bacillus cereus ... 77
Gambar 7.14 Hasil Uji Kadar Hambat Minimum Ekstrak Tumbuk Antibakteri terhadap Bacillus cereus ...77
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil Pengukuran Daerah Hambat Aktivitas Antibakteri ...67
Lampiran 2. Hasil Analisis SPSS pada Aktivitas Antibakteri terhadap Pertumbuhan Escherichia coli ...68
Lampiran 3. Hasil Analisis SPSS pada Aktivitas Antibakteri terhadap Pertumbuhan Bacillus cereus ...70
Lampiran 4. Dokumentasi Hasil Uji Kemurnian Escherichia coli ...72
Lampiran 5. Dokumentasi Hasil Uji Kemurnian Bacillus cereus ...73
Lampiran 6. Dokumentasi Hasil Uji Aktivitas Ekstrak Antibakteri terhadap Pertumbuhan Escherichia coli ...74
Lampiran 7. Dokumentasi Hasil Uji Aktivitas Ekstrak Antibakteri terhadap Pertumbuhan Bacillus cereus ...75
Lampiran 8. Dokumentasi Uji Kadar Hambat Minimum (KHM) terhadap
Escherichia coli ...76
Lampiran 9. Dokumentasi Uji Kadar Hambat Minimum (KHM) terhadap
Bacillus cereus ...77
Lampiran 10. Dokumentasi Uji Kadar Bunuh Minimum (KBM) terhadap
Escherichia coli dan Bacillus cereus ...78
1 BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Penyakit infeksi masih merupakan permasalahan yang memerlukan
perhatian besar dalam bidang kesehatan. Infeksi merupakan keadaan
masuknya mikroorganisme ke dalam tubuh, kemudian berkembang biak dan
menimbulkan penyakit (Tan dan Raharjo, 2002). Mikroorganisme yang dapat
menyebabkan infeksi dan menimbulkan penyakit adalah mikroorganisme
yang mempunyai daya patogenitas yang tinggi. Bakteri merupakan
mikroorganisme yang dapat menyebabkan infeksi (Rostinawati, 2009).
Penyakit yang disebabkan oleh bakteri antara lain infeksi saluran pernafasan
oleh bakteri Staphylococcus aureus, keracunan makanan oleh bakteri Bacillus
cereus, infeksi kulit oleh bakteri Streptococcus pyogenes, infeksi saluran
kemih dan diare oleh bakteri Escherichia coli (Anonim, 2014).
Bakteri dibagi dalam golongan gram positif dan gram negatif
berdasarkan reaksinya terhadap pewarnaan gram. Perbedaan antara bakteri
gram positif dan gram negatif terdapat pada dinding sel bakteri (Yani, 2010).
Beberapa bakteri merugikan yang dapat mewakili bakteri gram positif adalah
Bacillus cereus sedangkan bakteri gram negatif adalah Escherichia coli.
Patogenitas Escherichia coli dan Bacillus cereus sebagai salah satu penyebab
diare dapat mengganggu proses biologis organ pencernaan. Menurut Staf
banyak ditemukan di dalam usus besar manusia sebagai flora normal.
Escherichia coli dalam usus besar bersifat patogen apabila melebihi dari
jumlah normalnya. Galur-galur tertentu mampu menyebabkan peradangan
selaput perut dan usus. Apabila bakteri ini hidup di luar usus seperti pada
saluran kemih, dapat mengakibatkan peradangan selaput lendir . Bacillus
cereus memiliki kemampuan untuk menghancurkan sel darah merah
(hemolytic). Bakteri ini dapat menyebabkan keracunan makanan. Ada dua
tipe penyakit yang diakibatkannya, yaitu tipe emetik dan tipe diare. Tipe
emetik ditandai dengan mual dan muntah yang muncul setelah masa inkubasi
sekitar 1-6 jam. Tipe diare ditandai dengan rasa sakit perut dan buang air
besar yang muncul setelah masa inkubasi sekitar 6-24 jam (Brooks dkk,
2004).
Pencegahan dan pengobatan infeksi dapat dilakukan dengan
mengetahui penyebabnya serta mengerti cara melakukan penanganannya.
Pengelolaan infeksi yang benar dapat mengurangi angka kematian sampai
95% (Widodo dan Sutoto, 1998). Penelitian terkait pemanfaatan bahan-bahan
alam untuk menangani permasalahan infeksi bakteri telah banyak dilakukan.
Adanya perhatian pada bahan dari alam yang dikenal dengan istilah back to
nature ini dianggap sebagai hal yang bermanfaat karena sejak dahulu kala
masyarakat telah percaya bahwa bahan alam mampu mengobati berbagai
macam penyakit. Selain itu, pemanfaatan bahan alam yang digunakan sebagai
obat jarang menimbulkan efek samping yang merugikan dibandingkan obat
Tanaman suruhan (Peperomia pellucida L.) merupakan tanaman yang
secara tradisional telah dimanfaatkan dalam pengobatan beberapa penyakit,
seperti abses (penimbunan nanah), bisul, jerawat, radang kulit, penyakit
ginjal, dan sakit perut (Hariana, 2006). Hal tersebut senada dengan
pernyataan Heyne (1987), bahwa tumbuhan ini memiliki khasiat obat. Daun
yang diremas-remas dapat digunakan sebagai obat luar untuk mengobati sakit
kepala dan cairan hasil perasan dapat diminum untuk pengobatan penyakit
perut. Menurut Dalimartha (2006), tumbuhan ini mengandung saponin, tanin,
alkaloid, kalsium oksalat, lemak dan minyak atsiri. Sedangkan berdasarkan
penelitian yang dilakukan oleh Majumder dkk (2011), hasil uji fitokimia daun
tumbuhan ini juga mengandung alkaloid, flavonoid, steroid, saponin, tanin,
triterpenoid, dan karbohidrat. Tanin dan flavonoid mempunyai aktivitas
sebagai antiseptik dan antibakteri. Flavonoid terutama berupa senyawa yang
larut dalam air (Harbone, 1987).
Brooks dkk (2004), mengatakan bahwa antibakteri adalah bahan atau
senyawa yang khusus digunakan untuk kelompok bakteri. Antibakteri dapat
dibedakan berdasarkan mekanisme kerjanya, yaitu:
1. antibakteri yang menghambat pertumbuhan dinding sel,
2. antibakteri yang mengakibatkan perubahan permeabilitas membran sel
atau menghambat pengangkutan aktif melalui membran sel,
3. antibakteri yang menghambat sintesis protein, dan
Aktivitas antibakteri dibedakan menjadi dua yaitu aktivitas
bakteriostatik dan aktivitas bakterisidal. Pengertian aktivitas bakteriostatik
adalah kemampuan menghambat pertumbuhan tetapi tidak membunuh
patogen. Sedangkan pengertian aktivitas bakterisidal adalah dapat membunuh
patogen dalam kisaran luas. Hingga saat ini belum diperoleh informasi
mengenai aktivitas antibakteri dari ekstrak tanaman suruhan dalam bentuk
ekstrak rebus dan ekstrak tumbuk. Informasi ini dibutuhkan karena dalam
pemanfaatan tanaman suruhan sering dikonsumsi oleh masyarakat dengan
meminum cairan hasil remasan untuk mengobati diare (Heyne, 1987).
B. Rumusan Masalah
Dalam upaya pemanfaatan ekstrak tanaman suruhan (Peperomia
pellucida L.) sebagai antibakteri terhadap Escherichia coli dan Bacillus
cereus, maka permasalahan yang perlu dikaji adalah:
1. Apakah ekstrak tanaman suruhan memiliki aktivitas antibakteri terhadap
Escherichia coli dan Bacillus cereus?
2. Apakah ada perbedaan aktivitas antibakteri antara ekstrak tanaman
suruhan yang direbus dan ditumbuk terhadap Escherichia coli dan Bacillus
cereus?
3. Berapa konsentrasi minimum ekstrak tanaman suruhan yang mampu
C. Batasan Masalah
Batasan masalah dalam penelitian ini adalah:
1. Ekstrak yang digunakan berasal dari seluruh bagian tanaman suruhan
(akar, batang, daun dan buah) yang segar, berwarna hijau dan diberi dua
perlakuan yaitu ekstrak rebus dan ekstrak tumbuk.
2. Parameter dalam penelitian ini adalah diameter daerah hambat di sekitar
kertas cakram pada media kultur dengan satuan milimeter.
3. Media kultur yang digunakan adalah media NA dalam cawan petri dengan
volume 25 ml.
4. Metode yang digunakan dalam pengujian aktivitas antibakteri adalah
metode difusi Kirby-Bauer dengan menggunakan cakram kertas untuk
membantu mengetahui daerah hambat yang terbentuk pada media dengan
satuan milimeter.
5. Metode yang digunakan dalam menentukan Kadar Hambat Minimum
(KHM) dan Kadar Bunuh Minimum (KBM) adalah metode dilusi padat
dengan parameter media kultur yang telah diinkubasi tidak ditumbuhi
bakteri.
D. Hipotesis
Tanaman suruhan (Peperomia pellucida L.) berupa ekstrak rebus dan
ekstrak tumbuk memiliki aktivitas antibakteri terhadap Escherichia coli dan
Bacillus cereus secara in vitro dan terdapat perbedaan aktivitas antibakteri
E. Tujuan Penelitian
Penelitian ini bertujuan sebagai berikut:
1. Mengetahui ada atau tidaknya aktivitas antibakteri dari ekstrak tanaman
suruhan (Peperomia pellucida L.) terhadap Escherichia coli dan Bacillus
cereus
2. Mengetahui perbedaan aktivitas antibakteri ekstrak tanaman suruhan yang
direbus dan ditumbuk terhadap aktivitas Escherichia coli dan Bacillus
cereus
3. Mengetahui konsentrasi minimum ekstrak tanaman suruhan yang mampu
menghambat dan membunuh Escherichia coli dan Bacillus cereus
F. Manfaat Penelitian
Penelitian ini secara umum diharapkan dapat memberikan informasi
ilmiah mengenai potensi tanaman suruhan (Peperomia pellucida L.) sebagai
antibakteri dalam menghambat pertumbuhan Escherichia coli dan Bacillus
cereus. Hasil penelitian ini secara khusus diharapkan mampu memberikan
informasi ilmiah, terutama kepada para pendidik agar dapat mengaplikasikan
penelitian ilmiah dalam proses pembelajaran mengenai faktor-faktor yang
mempengaruhi pertumbuhan bakteri yang termasuk dalam pembelajaran
Biologi SMA pada Kompetensi Dasar 3.4. dan 4.4 dengan materi pokok
7
BAB II
DASAR TEORI
A. Suruhan Liar (Peperomia pellucida L.)
1. Klasifikasi
Kingdom : Plantae
Divisio : Spermatophyta
Classis : Dycotyledoneae
Ordo : Piperales
Familia : Piperaceae
Genus : Peperomia
Species : Peperomia pellucida (L.)
HB.K.
(Faiyah, 2013)
Gambar 2.1. Tanaman Suruhan (Peperomia pellucida L.) (Anonim, 2008)
2. Nama Daerah
Suruhan; Sladanan; Rangu-rangu (Jawa), Saladaan (Sunda),
Ketumpangan ayer (Sumatera), Gofu doroho (Ternate) (Heyne, 1987).
3. Morfologi dan Fisiologi
Peperomia pellucida L. termasuk tanaman herba dengan tinggi
10-20 cm. Batang tegak, lunak dan berwarna hijau muda. Daun tunggal
dengan kedudukan spiral, bentuk lonjong, panjang 1-4 cm, lebar 1,5-2 cm,
permukaan licin, lunak dan berwarna hijau. Bunga majemuk, berbentuk
bulir, terletak di ujung batang atau di ketiak daun, panjang bulir 2-3 cm,
tangkai lunak, berwarna putih kekuningan. Buah bulat, kecil, berwarna
hijau. Biji bulat, kecil, berwarna hitam. Akar serabut, putih dan perakaran
tidak dalam (Heyne, 1987).
4. Habitat
Tanaman suruhan (Peperomia pellucida L.) berasal dari Amerika
Serikat tetapi tumbuh liar dan mudah didapatkan Indonesia. Sekarang
tanaman suruhan tumbuh di Jawa mulai dari dataran rendah sampai kurang
lebih 1000 m di atas permukaan laut. Tanaman suruhan mampu tumbuh
pada daerah yang tidak begitu kering. Umumnya di daerah yang tidak
subur misalnya pada batu karang, tembok yang lembab, di ladang dan di
pekarangan (Heyne, 1987).
5. Kandungan Kimia dan Manfaat
Seluruh bagian tanaman Peperomia pellucida (L.) mengandung
saponin, tannin, alkaloid, kalsium oksalat, lemak dan minyak atsiri
(Dalimartha, 2006). Berdasarkan penelitian yang dilakukan oleh
Majumder, dkk (2011) menemukan bahwa hasil uji fitokimia daun
tumbuhan ini juga mengandung steroid, flavonoid, triterpenoid, dan
karbohidrat. Tanin dan flavonoid mempunyai aktivitas sebagai antiseptik
dan antibakteri (Harbone, 1987). Menurut Syarfati (2011), tanin dapat
menghambat pertumbuhan bakteri. Mekanisme tanin sebagai zat
dinding sel, dan merusak membran sel (Maryani 2013). Sedangkan
menurut Sirait (2007), flavonoid terdapat pada seluruh bagian tanaman,
termasuk pada buah, tepung sari dan akar. Mekanisme kerja flavonoid
adalah mengganggu aktivitas transpeptidase peptidoglikan sehingga
pembentukan dinding sel terganggu dan sel mengalami lisis (Cowan,
1999).
Tanaman suruhan banyak dimanfaatkan dalam kehidupan
masyarakat. Tanaman suruhan dipercaya mampu mengobati asam urat dan
menyembuhkan luka bakar (Mappa dkk, 2013). Masyarakat memilih
mengkonsumsi suruhan dengan cara direbus karena lebih bersih dan
mudah dikonsumsi dari pada ditumbuk.
B. Bakteri
Bakteri adalah mikroorganisme bersel satu, berkembang biak dengan
cara membelah diri, hanya dapat dilihat dengan menggunakan mikroskop
(Dwijoseputro, 1998).
Berdasarkan morfologinya bakteri dapat dibedakan atas tiga bagian
yaitu:
1. Bentuk silindris (batang), dibedakan atas:
a. Basil tunggal, berupa batang tunggal.
b. Diplobasil, berbentuk batang bergandeng dua.
2. Bentuk bulat (coccus)
a. Monokokus, bentuk bulat satu-satu.
b. Diplokokus, bentuk bulat bergandeng dua.
c. Streptokokus, bentuk bulat bergandeng seperti rantai
d. Tetrakokus, bentuk bulat terdiri 4 sel tersusun dalam bentuk segi empat.
e. Sarkina, bentuk bulat terdiri atas 8 sel, tersusun dalam bentuk kubus.
f. Stafilokokus, bentuk bulat tersusun seperti kelompok buah anggur.
3. Bentuk spiral
a. Berbentuk spiral (tunggal, spirilum, jamak, spirila) terdapat secara
terpisah-pisah (tunggal) tetapi spesies berbeda panjang, jumlah dan
amplitude spiralnya.
b. Bentuk koma atau vibrio adalah bakteri yang ukurannya pendek dengan
spiral yang tidak lengkap (Dwidjoseputro, 1998)
Berdasarkan reaksi terhadap pewarnaan gram, maka bakteri dapat
dibedakan menjadi dua bagian yaitu:
1. Bakteri Gram Positif
Bakteri gram positif adalah bakteri yang dapat mengikat zat warna
pertama yaitu kristal violet. Dinding sel bakteri gram positif seperti bakteri
Stapylococcus aureus dan Sterptococcus sp tersusun atas lapisan sederhana
yang terdiri atas beberapa lapisan peptidoglikan yang membentuk suatu
struktur yang tebal dan kaku. Kekakuan pada dinding sel bakteri yang
membuat bakteri gram positif resisten terhadap lisis osmotik (Brooks,
2004).
Golongan ini memiliki peptidoglikan setebal 20-80 nm dengan
komposisi terbesar teichoic, asam teichuroni, dan berbagai macam
polisakarida. Asam teikoat berfungsi sebagai antigen permukaan pada
bakteri gram positif. Letaknya berada antara lapisan membran sitoplasma
dan lapisan peptidoglikan. Selain itu golongan ini memiliki 40 lembar
peptidoglikan pada dinding selnya, yang merupakan 50% dari seluruh
komponen penyusun dinding sel. Polisakarida dan asam amino pada
lembar peptidoglikan bersifat sangat polar, sehingga pada bakteri gram
positif yang memiliki dinding sel yang sangat tebal dapat bertahan dari
aktivitas cairan empedu di dalam usus. Sebaliknya, lembar peptidoglikan
rentan terhadap lisozim sehingga dapat dirusak oleh senyawa bakterisidal
(Prasetyo, 2009).
2. Bakteri Gram Negatif
Bakteri gram negatit adalah bakteri yang dapat mengikat zat warna
kedua yaitu safranin. Bakteri gram negatif seperti Escherichia coli
memiliki lapisan peptidoglikan yang tipis (5-10 nm) pada dinding selnya
dengan komposisi utama lipoprotein, membran luar, dan lipopolisakarida.
Selain itu dinding sel bakteri gram negatif ini tidak mengandung asam
teikoat tetapi mengandung sejumlah polisakarida dan lebih rentan terhadap
Membran luar pada bakteri gram negatif juga memiliki sifat
hidrofilik. Namun komponen lipid pada dinding selnya memberikan sifat
hidrofobik. Selain itu terdapat saluran khusus yang terbuat dari protein
yang disebut porins yang berfungsi sebagai tempat masuknya komponen
hidrofilik seperti gula dan asam amino yang penting untuk kebutuhan
nutrisi bakteri. Lipoprotein merupakan komponen yang mendominasi
dinding sel bakteri gram negatif dan berfungsi menjaga stabilitas membran
luar dan tempat perlekatan pada lapisan peptidoglikan. Membran luar
bakteri gram negatif merupakan struktur bilayer, yaitu komposisi lembar
dalamnya mirip dengan membran sitoplasma, hanya saja fospolipid pada
lapisan luarnya diganti dengan molekul lipopolisakarida (LPS). Selain itu
terdapat ruang antara membran dalam dengan membran luarnya yang
disebut ruang periplasma, terdiri dari lapisan murein dan larutan protein
mirip gel (protein pengikat substrat tertentu, enzim hidrolitik, dan enzim
detoksifikasi) (Prasetyo, 2009).
Faktor-faktor yang dapat mempengaruhi pertumbuhan bakteri adalah:
1. Nutrisi
Nutrisi dalam media perbenihan harus mengandung seluruh elemen
yang penting untuk sumber energi dan pertumbuhan selnya. Unsur-unsur
tersebut adalah karbon, nitrogen, sulfur, fosfor dan mineral. Kekurangan
sumber-sumber nutrisi ini dapat mempengaruhi pertumbuhan mikroba
2. Suhu
Bakteri seperti halnya makhluk hidup lainnya dalam
pertumbuhannya perlu suhu tertentu. Berdasarkan suhu yang diperlukan
untuk tumbuh, bakteri dapat dibagi dalam beberapa golongan, yaitu:
a. Psikrofil (cold loving bacteria), yaitu bakteri yang tumbuh antara suhu
(0-20)˚C. Contohnya Pseudomonas, Flavobacterium, Alcaligenes dan
Achromobacter.
b. Mesofil (moderate temperature loving bacteria), yaitu bakteri yang
tumbuh antara suhu (30-37)˚C dengan suhu optimal 37˚C, misalnya
golongan bakteri pathogen yang menyebabkan penyakit infeksi pada
manusia. Contoh bakteri mesofil antara lain Escherichia dan Bacillus.
c. Termofil (heat loving bacteria), yaitu bakteri yang tumbuh antara suhu
(50-60)˚C. Contoh bakteri termofil adalah Thermus aquaticus,
Sulfolobus acidocaldarius, dan Chloroflexus.
Suhu terendah dimana bakteri dapat tumbuh disebut minimum
growth temperature. Sedangkan suhu tertinggi dimana bakteri dapat
tumbuh dengan baik disebut maximum growth temperature. Suhu dimana
bakteri dapat tumbuh dengan sempurna di antara kedua suhu tersebut
disebut suhu optimum (Brooks dkk, 2004).
3. pH
Bakteri dalam pertumbuhannya juga memerlukan pH tertentu.
Namun pada umumnya bakteri memiliki jarak pH yang sempit yaitu
hidup di bawah pH 4, contohnya Bakteri Asam Laktat. Tetapi juga ada
bakteri yang dapat hidup atau tumbuh pada pH alkalis, contohnya Bakteri
Metanogen (Brooks dkk, 2004).
4. Tekanan Osmosis
Medium yang paling tepat bagi kehidupan bakteri ialah medium
yang isotonik terhadap isi sel bakteri. Jika bakteri ditempatkan di dalam
suatu larutan yang hipertonik terhadap isi sel, maka bakteri akan
mengalami plasmolisis. Sebaliknya bila bakteri ditempatkan pada larutan
hipotonis, maka dapat menyebabkan pecahnya sel bakteri akibat cairan
masuk ke dalam sel bakteri tersebut (Dwidjoseputro, 1998).
5. Oksigen
Berdasarkan kebutuhan terhadap oksigen, bakteri dapat dibagi
dalam beberapa golongan, sebagai berikut:
a. Bakteri aerob, yaitu bakteri yang dalam pertumbuhannya memerlukan
adanya oksigen contohnya Nitrosomonas.
b. Bakteri anaerob, yaitu bakteri yang hidup bila tidak ada oksigen
contohnya Clostridium.
c. Bakteri aerob fakultatif, yaitu bakteri yang dapat tumbuh baik ada
oksigen maupun tanpa adanya oksigen contohnya Cyanobacteria.
d. Bakteri mikroaerofilik, yaitu bakteri yang dapat tumbuh apabila ada
oksigen dalam jumlah kecil contohnya Helicobacter (Brooks dkk,
C. Bacillus cereus
Kingdom : Prokaryota
Divisio : Firmicutes
Class : Bacili
Ordo : Bacillales
Family : Bacillaceae
Genus : Bacillus
Spesies : Bacillus cereus
(Todar, 2008).
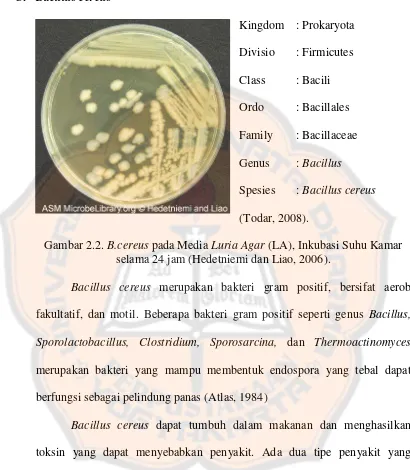
Gambar 2.2. B.cereus pada Media Luria Agar (LA), Inkubasi Suhu Kamar selama 24 jam (Hedetniemi dan Liao, 2006).
Bacillus cereus merupakan bakteri gram positif, bersifat aerob
fakultatif, dan motil. Beberapa bakteri gram positif seperti genus Bacillus,
Sporolactobacillus, Clostridium, Sporosarcina, dan Thermoactinomyces
merupakan bakteri yang mampu membentuk endospora yang tebal dapat
berfungsi sebagai pelindung panas (Atlas, 1984)
Bacillus cereus dapat tumbuh dalam makanan dan menghasilkan
toksin yang dapat menyebabkan penyakit. Ada dua tipe penyakit yang
diakibatkannya, yaitu tipe emetik dan tipe diare. Tipe emetik ditandai dengan
mual dan muntah, muncul gejala setelah masa inkubasi sekitar 1-5 jam. Tipe
diare ditandai dengan rasa sakit perut dan buang air besar, muncul gejala
D. Escherichia coli
Kingdom : Prokaryota
Divisio : Shizophyta
Class : Schizomycetes
Ordo : Eubacteriales
Family : Enterobacteriaceae
Genus : Escherichia
Spesies : Escherichia coli
(Dwidjoseputro, 1998)
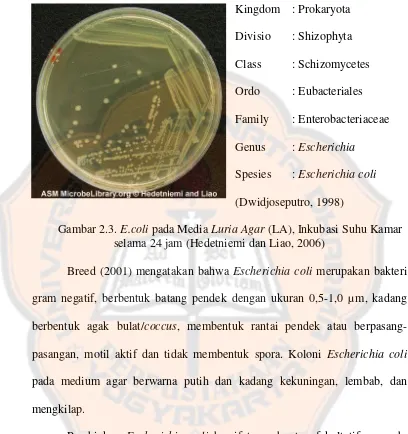
Gambar 2.3. E.coli pada Media Luria Agar (LA), Inkubasi Suhu Kamar selama 24 jam (Hedetniemi dan Liao, 2006)
Breed (2001) mengatakan bahwa Escherichia coli merupakan bakteri
gram negatif, berbentuk batang pendek dengan ukuran 0,5-1,0 µm, kadang
berbentuk agak bulat/coccus, membentuk rantai pendek atau
berpasang-pasangan, motil aktif dan tidak membentuk spora. Koloni Escherichia coli
pada medium agar berwarna putih dan kadang kekuningan, lembab, dan
mengkilap.
Pembiakan Escherichia coli bersifat aerob atau fakultatif anaerob,
pertumbuhan optimum pada suhu 37˚C. Escherichia coli merupakan bakteri
penghuni saluran pencernaan manusia dan hewan berdarah panas lainnya,
biasanya tidak bersifat patogen. Walaupun Escherichia coli merupakan
bagian dari mikroflora normal di dalam saluran pencernaan, galur-galur
gastroenteritis taraf sedang hingga parah pada manusia dan hewan (Pelczar
dan Chan, 1986).
Escherichia coli yang menyebabkan diare diklasifikasikan
berdasarkan karakteristik sifat virulensinya, dan masing-masing kelompok
menyebabkan penyakit melalui mekanisme yang berbeda yaitu E. coli
Enteropatogenik (EPEC), yang menyebabkan diare pada bayi terutama di
negara berkembang, E. coli Enterotoksigenik (ETEC), yang menyebabkan
diare wisatawan dan E. coli Enterohemoragik (EHEK), yang menimbulkan
diare berat (Brooks dkk, 2004).
E. Media
Pembiakan mikroba di laboratorium memerlukan media yang berisi
zat hara serta lingkungan pertumbuhan yang sesuai bagi mikroba. Media
adalah suatu bahan yang digunakan untuk menumbuhkan mikroba yang
terdiri atas campuran nutrisi atau zat-zat makanan. Selain untuk
menumbuhkan mikroba, media dapat juga digunakan untuk isolasi,
memperbanyak, pengujian sifat-sifat fisiologis dan perhitungan jumlah
mikroba (Jutono dkk, 1980).
Brooks dkk (2004) mengatakan syarat media yang baik untuk
pertumbuhan mikroba adalah lingkungan kehidupannya harus sesuai dengan
lingkungan pertumbuhan mikroba tersebut, yaitu susunan nutrisinya, tekanan
osmosis yaitu harus isotonik, derajat keasaman umumnya netral, temperatur
untuk pertumbuhan mikroba, yaitu sumber energi, sumber nitrogen, dan
kebutuhan yang khusus seperti vitamin.
Berdasarkan komposisi kimianya, media dapat dibedakan menjadi
dua, yaitu:
1. Media sintetik yaitu media yang susunan kimianya diketahui dengan pasti.
Media ini biasanya digunakan untuk mempelajari kebutuhan makanan
mikroba.
2. Media non sintetik (kompleks) yaitu media yang susunan kimianya tidak
dapat diketahui dengan pasti. Media ini digunakan untuk menumbuhkan
dan mempelajari taksonomi mikroba.
Sedangkan berdasarkan konsistensinya media dapat dibedakan
menjadi media cair, media padat dan media padat yang dapat dicairkan (Lay,
1994).
F. Sterilisasi
Sterilisasi adalah suatu usaha untuk membebaskan alat-alat atau bahan
dari segala macam bentuk kehidupan terutama mikroba (termasuk spora
mikroba). Penyelidikan suatu spesies mikroba selalu didasarkan atas
penyelidikan sifat biakan murni spesies tersebut. Oleh karena itu, untuk
memelihara biakan murni diperlukan alat-alat dan media yang steril. Suatu
benda atau substansi hanya dapat steril, tidak akan pernah mungkin setengah
steril atau hampir steril (Volk dan Wheeler, 1993).
1. Sterilisasi secara Fisik
a. Sterilisasi dengan pemijaran, cara ini dipakai untuk sterilisasi kawat
inokulasi (jarum ose) yang terbuat dari platinum atau nikron. Caranya
dengan membakar alat tersebut di atas lampu spiritus sampai pijar.
b. Sterilisasi dengan udara panas (kering), cara ini dipakai untuk
mensterilkan peralatan gelas. Alat yang digunakan adalah oven dengan
suhu 170˚C-180˚C selama 2 jam.
c. Sterilisasi dengan menggunakan uap panas bertekanan, cara ini dipakai
untuk sterilisasi alat-alat dan bahan-bahan yang tahan terhadap suhu
dan tekanan tinggi. Alat yang digunakan adalah autoklaf. Pada autoklaf
terdapat penunjuk suhu, penunjuk tekanan serta pengatur uap atau udara
(Lay, 1994)
2. Sterilisasi secara Kimia
Bahan-bahan yang mudah rusak bila disterilkan pada suhu tinggi
(dari plastik) dapat disterilkan secara kimiawi dengan menggunakan bahan
kimia, gas, atau radiasi. Bahan kimia ialah suatu substansi (padat, cair atau
gas) yang dicirikan oleh komposisi molekuler yang pasti dan
menyebabkan terjadinya reaksi, contohnya senyawa fenolik, alkohol, klor,
iodium, dan etilen oksida. Beberapa bahan kimia yang dapat digunakan
untuk sterilisasi gas yaitu etilen oksida, asam perasetat, formal dehida dan
glutaral dehida alkalin (Pelczar dan Chan, 1986; 327 dan Volk dan
G. Antibakteri
Antibakteri adalah senyawa biologis atau kimia yang dapat
mengganggu pertumbuhan dan aktivitas bakteri, terutama bakteri penyebab
infeksi. Zat yang digunakan harus bersifat toksisitas selektif, yaitu suatu obat
yang berbahaya bagi parasit tetapi tidak membahayakan inang. Toksisitas
selektif bersifat relatif, artinya suatu obat yang pada kondisi tertentu dapat
ditoleransi oleh inang, dapat merusak parasit (Brooks dkk, 2004).
Pemakaian bahan antibakteri merupakan suatu usaha untuk
mengendalikan bakteri merugikan. Pengendalian adalah segala kegiatan yang
dapat menghambat, membasmi atau menyingkirkan mikroorganisme. Tujuan
utama pengendalian adalah mencegah penyakit dan infeksi, membasmi
bakteri pada inang yang terinfeksi, dan mencegak pembusukan dan kerusakan
bahan oleh mikroorganisme (Pelczar dan Chan, 1988).
Brooks, dkk (2004) menambahkan aktivitas antibakteri terbagi
menjadi dua, yaitu bakteriostatik (menghambat pertumbuhan bakteri) dan
bakterisid (membunuh bakteri). Konsentrasi minimal yang diperlukan untuk
menghambat pertumbuhan bakteri dikenal sebagai Kadar Hambat Minimal
(KHM), sedangkan konsentrasi minimal yang diperlukan untuk membunuh
mikroba disebut dengan Kadar Bunuh Minimal (KBM).
Mekanisme kerja zat antibakteri harus dapat mempengaruhi
bagian-bagian vital sel seperti membran sel, enzim-enzim dan protein struktural.
Pelczar dan Chan (1988) menyatakan bahwa mekanisme kerja zat antibakteri
1. Merusak Dinding Sel
Pada umumnya bakteri memiliki lapisan luar yang kaku disebut
dinding sel (peptidoglikan). Sintesis dinding sel melibatkan sejumlah
langkah enzimatik yang banyak dihalangi oleh antimikroba. Rusaknya
dinding sel bakteri misalnya karena pemberian enzim lisosim atau
hambatan pembentukannya oleh karena zat antimikroba, dapat
menyebabkan sel bakteri lisis. Kerusakan dinding sel akan berakibat
terjadinya perubahan-perubahan yang mengarah pada kematian sel karena
dinding sel berfungsi sebagai pengatur pertukaran zat-zat dari luar ke
dalam sel serta memberi bentuk sel.
2. Mengubah Permeabilitas Membran Sel
Sitoplasma semua sel hidup dibatasi oleh selaput yang disebut
membran sel yang mempunyai permeabilitas selektif. Membran sel
tersusun atas fosfolipid dan protein. Membran sel berfungsi mengatur
keluar masuknya zat antar sel dengan lingkungan luar, melakukan
pengangkutan zat-zat yang diperlukan aktif dan mengendalikan susunan
dalam diri sel. Proses pengangkutan zat-zat yang diperlukan baik ke dalam
maupun ke luar sel dimungkinkan karena di dalam membran sel terdapat
enzim protein untuk mensintesis peptidoglikan komponen membran luar.
Rusaknya dinding sel bakteri, secara otomatis akan berpengaruh
pada membran sitoplasma. Beberapa bahan antimikroba seperti fenol,
kresol, detergen dan beberapa antibiotik dapat menyebabkan kerusakan
membran sel sehingga fungsi semi permeabilitas membran mengalami
kerusakan. Kerusakan pada membran sel akan mengakibatkan kematian
sel.
3. Kerusakan Sitoplasma
Sitoplasma atau cairan sel terdiri atas 80% air, asam nukleat,
protein, karbohidrat, lipid, ion anorganik dan berbagai senyawa dengan
bobot molekul rendah. Kehidupan suatu sel tergantung pada terpeliharanya
molekul-molekul protein dan asam nukleat dalam keadaan alamiahnya.
Konsentrasi tinggi beberapa zat kimia dapat mengakibatkan koagulasi dan
denaturasi komponen-komponen seluler yang vital.
4. Menghambat Kerja Enzim
Di dalam sel terdapat enzim dan protein yang membantu
kelangsungan proses-proses metabolism. Banyak zat kimia telah diketahui
dapat mengganggu reaksi biokimia misalnya logam-logam berat, golongan
tembaga, perak, air raksa, dan senyawa logam berat lainnya umumnya
efektif sebagai bahan antimikroba pada konsentrasi relatif rendah.
Logam-logam ini akan mengikat gugus enzim sulfihidril yang berakibat terhadap
perubahan protein yang terbentuk. Penghambatan ini dapat mengakibatkan
terganggunya metabolisme atau matinya sel.
5. Menghambat Sintesis Asam Nukleat dan Protein
DNA, RNA, dan protein memegang peranan penting dalam sel.
Beberapa bahan antimikroba dalam bentuk antibiotik misalnya
Sedangkan sintesis asam nukleat dapat dihambat oleh senyawa antibiotik
misalnya mitosimin. Bila terjadi gangguan pada pembentukan atau pada
fungsi zat-zat tersebut dapat mengakibatkan kerusakan total pada sel.
Banyak faktor dan keadaan yang mempengaruhi kerja zat antibakteri
dalam menghambat atau membasmi bakteri patogen. Seluruh aspek harus
dikendalikan agar zat antibakteri dapat bekerja secara efektif. Beberapa hal
yang dapat mempengaruhi kerja zat antibakteri menurut Wattimena, dkk
(1981) adalah sebagai berikut:
1. Konsentrasi atau Intensitas Zat Antibakteri
Semakin tinggi konsentrasi suatu zat antibakteri semakin tinggi
daya antibakterinya, artinya banyak bakteri akan terbunuh lebih cepat bila
konsentrasi zat tersebut lebih tinggi.
2. Jumlah Organisme
Ukuran inokulum merupakan faktor terpenting yang mempengaruhi
lebar daerah hambat, jumlah inokulum yang lebih sedikit menyebabkan
obat dapat berdifusi lebih jauh, sehingga daerah yang dihasilkan lebih
besar, sedangkan jika jumlah inokulum lebih besar maka daerah hambat
kecil.
3. Ketebalan Medium Agar
Ketebalan medium agar berpengaruh dalam mendapatkan
sensivitas yang optimal. Perbedaan ketebalan media agar mempengaruhi
hambat. Makin tebal media yang digunakan akan makin kecil diameter
hambat yang terjadi.
4. Komposisi Media Agar
Perubahan komposisi media dapat merubah sifat media sehingga
jarak difusi berubah. Media agar berpengaruh terhadap ukuran daerah
hambat dalam hal mempengaruhi aktivitas beberapa bakteri,
mempengaruhi kecepatan difusi antibakteri dan mempengaruhi kecepatan
pertumbuhan antibakteri.
5. Waktu Inkubasi
Waktu inkubasi disesuaikan dengan pertumbuhan bakteri, karena
luas daerah hambat ditentukan beberapa jam pertama setelah
diinokulasikan pada media agar, maka daerah hambat dapat diamati segera
setelah adanya pertumbuhan bakteri.
6. Suhu
Kenaikan suhu dapat meningkatkan keefektifan suatu disinfektan
atau bahan mikrobial. Hal ini disebabkan zat kimia merusak
mikroorganisme melalui reaksi kimia. Reaksi kimia bisa dipercepat
dengan meninggikan suhu. Kebanyakan bakteri tumbuh baik pada suhu
37˚C
7. Spesies Mikroorganisme
Spesies mikroorganisme menunjukkan ketahanan yang
8. Keasaman (pH)
Mikroorganisme yang hidup pada pH asam akan lebih mudah
dibasmi pada suhu rendah dan dalam waktu yang singkat bila
dibandingkan dengan mikroorganisme yang hidup pada pH basa.
Uji aktivitas antibakteri dapat dilakukan dengan metode difusi dan
metode pengenceran. Disc diffusion test atau uji difusi disk dilakukan dengan
mengukur zona bening (clear zone) yang merupakan petunjuk adanya respon
penghambatan pertumbuhan bakteri oleh suatu senyawa antibakteri dalam
ekstrak. Syarat jumlah bakteri untuk uji kepekaan/sensivitas yaitu 105-108
cfu/ml (Carter and Cole, 1990)
Metode difusi merupakan salah satu metode yang sering digunakan.
Metode difusi dapat dilakukan dengan 3 cara yaitu metode silinder, metode
lubang/sumuran dan metode cakram kertas. Metode cakram kertas dilakukan
dengan cara merendam cakram kertas steril ke dalam zat antibakteri selama
kurun waktu tertentu dan diletakkan pada media agar padat yang telah
diinokulasi dengan mikroba uji kemudian diinkubasipada suhu 37˚ C selama
18-24 jam. Selanjutnya diamati adanya daerah (zona) bening di sekitar
cakram kertas yang menunjukkan tidak adanya pertumbuhan mikroba (Dzen,
2003)
Menurut Davis dan Stout (1971), ketentuan kekuatan antibiotik dan
antibakteri dapat digolongkan dalam kriteria sebagai berikut: daerah
hambatan 20 mm atau lebih berarti berdaya hambat sangat kuat, daerah
berdaya hambat sedang, dan daerah hambatan 5 mm atau kurang berdaya
hambat lemah.
Prinsip metode pourplate adalah masing-masing konsentrasi senyawa
antibakteri ditambahkan suspensi bakteri uji dalam media NA dengan suhu
45˚ C. Perlakuan tersebut akan diinkubasi dan diamati ada atau tidaknyya
pertumbuhan bakteri dalam media. Media uji senyawa antibakteri pada kadar
terkecil yang terlihat bening tanpa adanya pertumbuhan bakteri uji, ditetapkan
sebagai Kadar Hambat Minimal (KHM). Media uji yang ditetapkan sebagai
KHM tersebut selanjutnya dikultur ulang pada media padat tanpa
penambahan bakteri uji ataupun senyawa antibakteri, dan diinkubasi selama
18-24 jam. Media padat yang tetap terlihat bening setelah inkubasi ditetapkan
H. Kerangka Pemikiran
Berdasarkan latar belakang dapat disusun suatu kerangka pemikiran yang
disajikan dalam bentuk bagan pada gambar berikut:
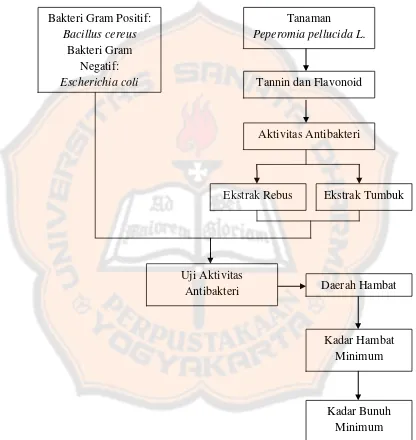
Gambar 2.4. Kerangka pemikiran Bakteri Gram Positif:
Bacillus cereus
Bakteri Gram Negatif:
Escherichia coli
Kadar Hambat Minimum
Kadar Bunuh Minimum Tannin dan Flavonoid
Tanaman
Peperomia pellucida L.
Aktivitas Antibakteri
Ekstrak Rebus Ekstrak Tumbuk
Uji Aktivitas
28
BAB III
METODOLOGI PENELITIAN
A. Jenis Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorium
dengan melakukan percobaan aktivitas antibakteri terhadap pertumbuhan
mikroorganisme.
B. Sampel dan Populasi
Sampel yang digunakan adalah tanaman suruhan (Peperomia
pellucida L.) yang diambil secara acak di Kebun Obat Kampus III Universitas
Sanata Dharma Yogyakarta. Ekstrak tanaman suruhan adalah hasil ekstraksi
seluruh bagian tanaman suruhan (akar, batang, daun, dan buah) sehingga
menghasilkan ekstrak tumbuk dan ekstrak rebus.
Populasi dari penelitian ini adalah bakteri Escherichia coli yang
mewakili bakteri Gram negatif dan Bacillus cereus yang mewakili bakteri
Gram positif diperoleh dari biakan di Laboratorium Bioteknologi
Pascasarjana Universitas Gadjah Mada. Bakteri diidentifikasi terlebih dahulu
dengan pengamatan morfologi koloni, pengamatan morfologi sel dan
C. Tempat dan Waktu Penelitian
Penelitian ini dilakukan pada bulan Februari hingga Mei 2014 di
Laboratorium Biologi, Program Studi Pendidikan Biologi, Jurusan
Pendidikan Matematika dan Ilmu Pengetahuan Alam, Fakultas Keguruan dan
Ilmu Pendidikan, Universitas Sanata Dharma Yogyakarta.
D. Desain Penelitian
Penelitian menggunakan Completely Randomized Design (CRD)
dengan perlakuan variasi sampel, variasi populasi dan konsentrasi ekstrak,
dengan tiga kali ulangan pada setiap perlakuan.
E. Teknik Pengumpulan Data
Penelitian ini terdiri dari beberapa tahapan penelitian, yaitu tahap
persiapan, tahap pelaksanaan yang terdiri dari pembuatan ekstrak tanaman
suruhan (Peperomia pellucida L.), pembuatan media uji Nutrient Agar (NA),
sterilisasi alat dan media, penyiapan mikroorganisme uji, uji kemurnian
mikroorganisme uji dan tahap perlakuan yang terdiri atas uji aktivitas
antibakteri, uji Kadar Hambat Minimum (KHM) dan uji Kadar Bunuh
Minimum (KBM). Berikut ini adalah tahapan yang dilakukan dalam
penelitian:
1. Tahap Persiapan
Pada tahap ini peneliti melakukan inventaris alat dan bahan yang
obat Kampus III Universitas Sanata Dharma Yogyakarta dalam kondisi
yang baik untuk digunakan dalam penelitian. Populasi mikroorganisme uji
yang didapatkan dari Laboratorium Bioteknologi Pascasarjana Universitas
Gadjah Mada dilakukan kultur ulang terlebih dahulu untuk memperbanyak
populasi mikroorganisme uji. Langkah kerja yang dilakukan adalah
menyiapkan media NA miring steril dalam tabung reaksi. Bakteri uji
digoreskan secara zig-zag pada media NA miring steril. Hasil perbanyakan
kultur bakteri dapat diamati setelah inkubasi selama 24 jam pada suhu
37˚C (Dwidjoseputro, 1990).
2. Tahap Pelaksanaan
a. Pembuatan Ekstrak Tanaman Suruhan
Tanaman suruhan dicuci bersih menggunakan air mengalir dan
disortir (dipisahkan antara tanaman suruhan yang baik dan yang rusak).
Kriteria baik adalah tanaman segar, daun berwarna hijau (tidak terdapat
bercak), batang tegak berwarna hijau pucat, dan akar berwarna putih.
Sedangkan kriteria rusak adalah tanaman layu, terdapat bercak pada
bagian tanaman, dan diserang hama. Tanaman suruhan dengan kriteria
baik disterilkan secara kimia. Sterilisasi dilakukan dengan melarutkan
10 ml Natrium hipoklorit dalam 3 liter akuades. Tanaman suruhan
direndam selama 15 menit, kemudian dibilas menggunakan aquades
steril.
Ekstrak diperoleh dengan melakukan dua metode ekstraksi
suruhan dihancurkan atau ditumbuk menggunakan mortar dan stamper
yang sudah disterilkan kemudian disaring menggunakan kertas saring
steril sehingga diperoleh stok ekstrak tumbuk tanaman suruhan.
Perlakuan kedua, sampel ditimbang sebanyak 100 gram dan
dimasukkan dalam 100 ml aquades, kemudian direbus hingga
mendidih. Ekstrak hasil rebusan disaring sehingga mendapatkan stok
ekstrak rebus 100%.
Setelah diperoleh stok ekstrak dengan konsentrasi 100%, ekstrak
rebus dan ekstrak tumbuk diencerkan untuk mendapatkan konsentrasi
masing-masing ekstrak sebesar 35%, 40%, dan 45% dengan
menambahkan aquades steril. Hasil pengenceran ekstrak dapat
digunakan dalam uji aktivitas antibakteri. Variasi konsentrasi ekstrak
pada tiap perlakuan dapat dilihat pada tabel 3.1
Tabel 3.1 Variasi Konsentrasi Ekstrak pada tiap Perlakuan
Perlakuan Variasi Konsentrasi (%)
Jumlah sampel (ml)
Pelarut aquades (ml)
1Bca 35 3,5 6,5
1Bcb 40 4 6
1Bcc 45 4,5 5.5
2Bca 35 3,5 6,5
2Bcb 40 4 6
2Bcc 45 4,5 5.5
1Eca 35 3,5 6,5
1Ecb 40 4 6
1 Ecc 45 4,5 5.5
2Eca 35 3,5 6,5
2Ecb 40 4 6
Keterangan:
1 : Ekstrak rebus 2 : Ekstrak tumbuk Bc : Bacilus cereus
Ec : Escherichia coli
a : Konsentrasi 1 b : Konsentrasi 2 c : Konsentrasi 3
b. Pembuatan Media Uji Nutrient Agar (NA)
NA sebanyak 2,8 gram dilarutkan ke dalam 100 ml aquades,
kemudian dipanaskan hingga larut. Bahan yang telah homogen
kemudian dibagi ke dalam tabung reaksi sebanyak 5-10 ml (ketika
untuk perbanyakan bakteri) dan dapat dibagi ke dalam erlenmeyer
sebagai stok, lalu disterilisasi menggunakan autoklaf pada suhu 121˚C
dan tekanan sebesar 1 atm selama 10 menit (Jutono dkk, 1980).
c. Sterilisasi Alat dan Media
Alat dan media yang digunakan dalam penelitian harus
disterilkan terlebih dahulu dengan tujuan memperkecil peluang
kontaminasi. Sterilisasi panas basah dilakukan pada alat-alat berbahan
kaca menggunakan autoclave. Sterilisasi alat dilakukan pada tekanan 1
atm dan suhu 121˚C selama 15 menit. Media NA dan ekstrak sampel
akan dapat digunakan apabila sedang berada dalam kondisi yang steril,
caranya sama dengan sterilisasi alat namun waktu yang diperlukan
hanya 10 menit. Alat-alat yang tidak tahan panas dapat disterilisasi
dengan pemberian alkohol atau pembakaran dalam api bunsen (Jutono
d. Penyiapan Mikroorganisme Uji
Mikroorganisme uji yang telah diperoleh dilakukan perbanyakan
kultur murni. Kultur murni bakteri Escherichia coli dan Bacillus cereus
diambil sedikit menggunakan jarum ose, kemudian digoreskan di atas
permukaan media NA miring secara aseptis. Setelah itu dilakukan
inkubasi pada suhu 37˚C selama 24 jam (Jutono dkk, 1980).
Mikroorganisme uji yang akan digunakan dalam uji aktivitas
antibakteri dilakukan pengenceran bertingkat terlebih dahulu untuk
mengendalikan populasi bakteri. Satu ose biakan murni disuspensikan
dengan 10 ml aquades steril pada tabung reaksi. Tabung kedua berisi 9
ml aquades steril dan 1 ml suspensi yang diambil dari tabung pertama.
Begitu seterusnya hingga pengenceran 10-5 yang setara dengan 3.108
cfu/ml Nefelometer McFarland. Suspensi bakteri pada pengenceran 10-5
diinokulasikan dalam media NA padat dengan metode spread plate.
Sebanyak 0,1 ml suspensi bakteri diteteskan ke dalam cawan petri berisi
media NA, dan diratakan menggunakan trigalski.
e. Uji Kemurnian Mikroorganisme Uji
Mikroorganisme uji yang digunakan di dalam penelitian ini
adalah Escherichia coli dan Bacillus cereus. Pada uji kemurnian
mikroorganisme uji, dilakukan langkah-langkah sebagai berikut:
1) Pengamatan Morfologi Koloni
Mikroorganisme uji diambil sebanyak satu ose, kemudian
Setelah itu, kultur diinkubasikan pada suhu 35˚C selama 24 jam.
Selanjutnya, dilakukan pengamatan morfologi koloni
mikroorganisme uji yang meliputi bentuk dan warna koloni
(Alexander dkk, 2003)
2) Pengamatan Morfologi Sel
Mikroorganisme uji diambil sebanyak satu ose, kemudian
diinokulasikan secara goresan pada medis NA miring dan diinkubasi
pada suhu 30˚C selama 24 jam. Morfologi sel mikroorganisme uji
diamati dengan menggunakan pengecatan negatif. Langkah kerjanya
yaitu gelas benda dan gelas penutup dibersihkan dengan alkohol,
selanjutnya biakan mikroorganisme uji diambil secara aseptis
sebanyak 1 ose dan diletakkan di atas gelas benda. Tinta cina
diambil dan diteteskan pada salah satu ujung gelas benda, kemudian
gelas benda yang lain diletakkan di atas suspensi dengan kemiringan
45˚ lalu ditarik permukaannya dari ujung satu ke ujung lain hingga
cat menjadi rata, sehingga menjadi lapisan tipis. Selanjutnya diamati
di bawah mikroskop dengan perbesaran 10 x 100 dan dilakukan
pengambilan gambar menggunakan kamera mikro (Alexander dkk,
2003).
3) Pengecatan Gram
Pengecatan gram dilakukan untuk mengetahui sifat Gram
mikroorganisme uji. Langkah-langkah yang dilakukan yaitu gelas
spiritus sampai kering. Setelah itu, satu lup suspensi bakteri
diambil menggunakan ose secara aseptis dan diratakan seluas ± 1
cm pada gelas benda kemudian difiksasi dengan cara diletakkan di
atas lampu bunsen yang menyala.
Objek yang sudah difiksasi kemudian ditetesi cat Gram A
(kristal violet) pada permukaan lapisan bakteri dan didiamkan
selama 60 detik. Hasil pengecatan cat Gram A dicuci dengan air
mengalir selama 5 detik dan dikeringkan. Setelah kering, cat Gram
B (iodine) diteteskan dan didiamkan selama 60 detik, kemudian
dicuci dengan air mengalir selama 5 detik dan dikeringkan.
Selanjutnya objek diberi cat Gram C (alkohol) dan didiamkan
selama 30 detik. Sisanya dicuci dengan air mengalir selama 5 detik
dan dikeringkan. Kemudian, objek ditetesi dengan cat Gram D
(safranin) dan didiamkan selama 60 detik. Setelah itu dicuci dengan
air mengalir dan dikeringkan.
Hasil ditutup dengan gelas penutup dan ditetesi dengan
minyak imersi kemudian diamati di bawah mikroskop dengan
perbesaran 10 x 100, kemudian dilakukan pengambilan gambar
menggunakan kamera mikro Jika sel berwarna biru, berarti bakteri
tersebut bersifat Gram-positif dan jika berwarna merah, berarti
3. Tahap Perlakuan
a. Uji Aktivitas Antibakteri
Pada penelitian ini, uji aktivitas antibakteri dilakukan
menggunakan metode cakram kertas. Cakram kertas steril dengan
diameter 0,5 cm dicelupkan dalam variasi konsentrasi ekstrak selama
30 menit kemudian diletakkan pada media yang berisi bakteri uji.
Masing-masing perlakuan variasi konsentrasi ekstrak yaitu sebesar
35%, 40%, 45% dibuat pengulangan sebanyak 3 kali serta aquades
steril sebagai kontrol negatif dan formalin sebagai kontrol positif.
Media diinkubasi selama 24 jam pada suhu 37˚C.
Keekfetifan ekstrak dilihat dari daerah hambat yang didapat.
Daerah hambat biasanya terlihat lebih bening daripada daerah
sekitarnya. Daerah hambat diukur menggunakan jangka sorong. Daerah
hambat diukur dengan cara meletakkan jangka sorong pada batas luar
cakram kertas sampai dengan batas terpanjang dan batas terpendek
daerah hambat yang terbentuk sehingga diperoleh jari-jari daerah
hambat terpanjang dan jari-jari daerah hambat terpendek. Parameter
untuk menilai efektivitas ekstrak terhadap bakteri Escherichia coli dan
Bacillus cereus melalui diameter daerah penghambatan ekstrak dengan
menggunakan rumus sebagai berikut (Rumahlewang, 2001):
Dimana
R : Diameter zona penghambatan (mm)
b. Uji Kadar Hambat Minimal (KHM)
Konsentrasi minimal yang didapatkan dari uji aktivitas
antibakteri digunakan sebagai acuan dalam menentukan konsentrasi
sampel pada pengujian nilai Kadar Hambat Minimal (KHM).
Pengujian dilakukan dengan metode dilusi padat. Metode ini
dilakukan dengan penanaman bakteri secara pourplate. Langkah
kerjanya yaitu media NA dengan suhu 45˚C dituangkan ke dalam
cawan petri yang sudah berisi mikroorganisme uji dan sampel ekstrak.
Jumlah media kultur yang digunakan sebanyak 10 ml. Mikroorganisme
uji pada pengenceran 10-5 yang divortex dahulu sebelum digunakan
sebanyak 0,5 ml. Sampel ekstrak sebanyak 0,5 ml. Hasil pourplate diinkubasi selama 24 jam pada suhu 37˚C. Penentuan nilai KHM dilihat
dari konsentrasi terendah pada media yang tidak ditumbuhi bakteri.
c. Uji Kadar Bunuh Minimal (KBM)
Hasil yang diperoleh dari uji KHM dapat dilanjutkan dalam
pengujian Kadar Bunuh Minimal (KBM) dengan metode streak plate.
Kultur ulang ini dilakukan dengan cara menggoreskan hasil yang
ditetapkan sebagai KHM menggunakan cotton bud steril pada media
padat NA steril (tanpa penambahan bakteri uji ataupun senyawa
antibakteri). Kultur diinkubasi selama 24 jam pada suhu 37˚C. Media
kultur NA yang tetap terlihat jernih setelah diinkubasi ditetapkan
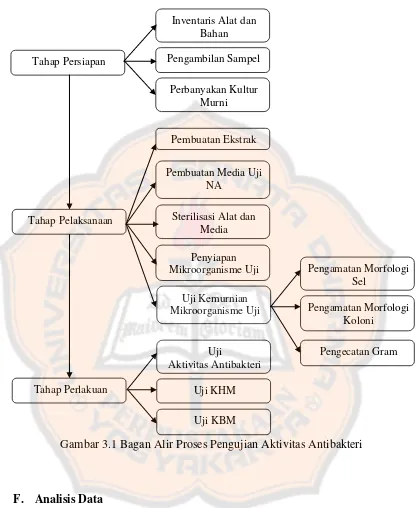
Gambar 3.1 Bagan Alir Proses Pengujian Aktivitas Antibakteri
F. Analisis Data
Analisis data yang digunakan untuk mengetahui aktivitas ekstrak
tanaman suruhan (Peperomia pellucida L.) dengan pertumbuhan koloni
Escherichia coli dan Bacilus cereus dilakukan uji statistik Two Way ANOVA
dengan tingkat kepercayaan 95 %. Pengitungan dilakukan dengan program
SPSS versi 16.
Tahap Perlakuan
Uji KBM Uji KHM
Uji
Aktivitas Antibakteri Tahap Persiapan
Perbanyakan Kultur Murni Pengambilan Sampel
Inventaris Alat dan Bahan
Tahap Pelaksanaan Sterilisasi Alat dan Media
Pembuatan Media Uji NA
Pembuatan Ekstrak
Penyiapan Mikroorganisme Uji
Uji Kemurnian Mikroorganisme Uji
Pengecatan Gram Pengamatan Morfologi
Koloni
G. Instrumen Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah erlenmeyer,
refrigerator, tabung reaksi, rak tabung reaksi, hot plate stirrer, magnetic
stirrer, mortar, stamper, cawan petri, gelas ukur, jarum inokulum, pembakar
bunsen, penjepit, termometer, autoklaf, pipet volume, vortex mixer, pH meter,
mistar geser, trigalski, inkubator, timbangan analitik, gelas beker, labu ukur,
corong gelas, kertas saring, pinset, gelas benda, gelas penutup, mikroskop
binokuler, kamera mikro, kertas payung, alumunium foil, dan karet.
Bahan-bahan yang digunakan dalam penelitian ini adalah biakan
murni Escherichia coli dan Bacillus cereus yang diperoleh dari Laboratorium
Mikrobiologi Universitas Gajah Mada (UGM), media Nutrient Agar (NA),
aquades steril, cat gram A (kristal violet), cat gram B (iodine), cat gram C
(alkohol), cat gram D (safranin), tinta cina, alkohol, dan tanaman suruhan
(Peperomia pellucida L.).
H. Variabel Penelitian
1. Variabel bebas : Ekstrak tanaman suruhan (Peperomia pellucida L.)
2. Variabel terikat : Daya hambat dan daya bunuh Escherichia coli dan
Bacillus cereus
3. Variabel kendali : Suhu inkubasi, waktu inkubasi, media inkubasi, dan