BAB II
TINJAUAN PUSTAKA
2.1 Siklus Nitrogen
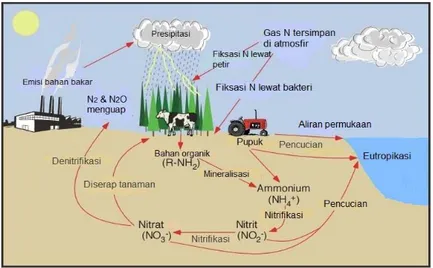
Sumber utama nitrogen didalam tanah berasal dari berbagai sumber. Sumber utama adalah dari nitrogen bebas di atmosfir, hasil dekomposisi bahan organik, loncatan listrik di udara (petir) dan pupuk buatan dan pupuk organik (Damanik, dkk., 2010).
Nitrogen yang terdapat di atmosfer bumi jumlahnya sangat banyak, namun ketersediaannya untuk organisme terutama tumbuhan sering kurang karena hanya mikroorganisme tertentu saja yang mampu mengikat molekul nitrogen dan mengubahnya menjadi bentuk yang dapat digunakan tumbuhan. Nitrogen yang terdapat dalam tanah sebagian besar berupa organik hasil pembusukan organisme, sedangkan lainnya berasal dari pelarutan bantuan air hujan (dalam bentuk nitrat dan ammonia) serta aktivitas gunung berapi (Harahap, 2012).
Nitrogen bebas di atmosfir menempati 78% dari volume atmosfir. Namun dalam bentuk unsur tidak dapat langung digunakan. Nitrogen harus diubah dulu menjadi bentuk ammonium atau nitrat melalui proses-proses tertentu. Cara utama nitrogen bebas masuk kedalam tanah melalui kegiatan-kegiatan jasad renik mengikat nitrogen dari udara, baik yang bebas atau yang bersimbiosis dengan tanaman seperti bintil akar tanaman leguminosa dengan bakteri rhizobium, kemudian nitrogen yang diikat digunakan dalam sintesa asam amino dan protein oleh tanaman induk. Jika tanaman atau jasad pengikat nitrogen mati, bakteri-bakteri pembusuk membebaskan asam amino dari protein. Bakteri amonifikasi
membebaskan ammonium dari gugus amino, yang kemudian dilarutkan dalam larutan tanah (Damanik, dkk., 2010). Siklus nitrogen di dalam tanah dapat dilihat pada Gambar 2.1.
Gambar 2.1 Siklus Nitrogen (Pidwirny, 2014)
2.2 Tranformasi Nitrogen
Transformasi utama nitrogen yaitu fiksasi nitrogen, nitrifikasi, denitrifikasi, asimilasi dan amoninifikasi. Transformasi nitrogen adalah kunci untuk produktivitas dalam biosfer dan sangat tergantung pada kegiatan kumpulan beragam mikroorganisme, seperti bakteri, archaea, dan jamur (Bernhard, 2010).
Fiksasi nitrogen adalah suatu proses mengubah gas Nitrogen menjadi nitrogen biologis yang tersedia disebut fiksasi nitrogen. Gas nitrogen adalah senyawa yang sangat stabil karena kekuatan ikatan rangkap tiga antara atom nitrogen, dan membutuhkan energi yang cukup besar untuk memecah ikatan ini. Sebagian besar fiksasi nitrogen dilakukan oleh bakteri pengikat nitrogen seperti rhizobium, azotobacter dan Frankia (Bernhard, 2010).
Amoniafikasi suatu organisme mengeluarkan limbah atau mati, nitrogen dalam jaringan adalah berupa nitrogen organik (asam amino misalnya, DNA).
Berbagai jamur dan prokariota kemudian membusuk di jaringan dan melepaskan nitrogen anorganik kembali ke dalam ekosistem sebagai ammonia (Bernhard, 2010).
Nitrifikasi adalah proses yang mengubah amonia menjadi nitrit dan kemudian menjadi nitrat dan merupakan langkah penting dalam siklus nitrogen global. Kebanyakan nitrifikasi terjadi aerobik dan dilakukan secara eksklusif oleh prokariota. Ada dua langkah yang berbeda dari nitrifikasi yang dilakukan oleh jenis yang berbeda dari mikroorganisme (Bernhard, 2010).
Denitrifikasi adalah proses yang mengubah nitrat menjadi gas nitrogen, sehingga menghilangkan nitrogen dan kembali ke atmosfer. Gas dinitrogen (N) adalah produk akhir utama dari denitrifikasi (Bernhard, 2010).
2.3 Nitrat dan Nitrit
Nitrat dan nitrit adalah senyawa alami yang ditemukan dalam lingkungan yang sering dikonsumsi oleh manusia melalui sayuran, daging dan air minum.Nitrat dan nitrit terjadi secara alami dalam sayuran sebagai bagian dari siklus nitrogen (Maynard, dkk., 1976).
Kalium/natrium nitrit dan kalium/natrium nitrat telah digunakan dalam daging olahan (curing) sebagai bahan tambahan makanan dalamdaging yang diawetkan selama bertahun-tahun terutama untuk mencegah pertumbuhan dan produksi racun Clostridium botulinum (Silalahi, 2005).
Nitrat memegang peranan penting dalam nutrisi dan fungsi tanaman karena potensinya untuk terakumulasi. konsentrasi nitrat dalam tanaman dipengaruhi olehkelembaban tanah, intensitas cahaya suhu udara, pupuk, varietas
tanaman, dan strategi proteksi tanaman. Nitrat umumnya ditemukan di sel vakuola dan dibawa ke dalam xilem. Xilem membawa air dan nutrisi dari akar ke daun, kemudian floem membawa produk fotosintesis daridaun pertumbuhan tanaman (EFSA, 2008).
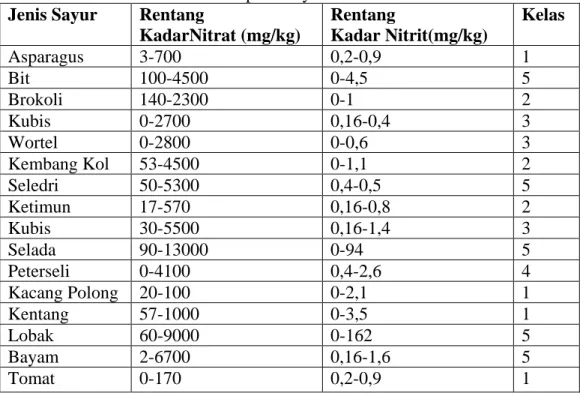
Nitrat ditemukan dalam jumlah yang besar pada sayuran, yaitu berkisar 70-90% dari asupan nitrat. Diantara sayuran, daun hijau mengandung kadar nitrat yang sangat tinggi. Bayam adalah salah satu dari sayuran yang ditunjukkan dari beberapa penelitian mengandung kadar nitrat yang tinggi, dibandingkan dengan sayuran yang lain. Jumlahnya bisa mencapai 5 gram nitrat per kilogram pada bayam segar (Keshavarz, dkk., 2015). klasifikasi kadar nitrat yang terkandung pada sayuran dapat dilihat pada Tabel 2.1.
Tabel 2.1 Klasifikasi Kadar Nitrat pada Sayuran Jenis Sayur Rentang
KadarNitrat (mg/kg) Rentang Kadar Nitrit(mg/kg) Kelas Asparagus 3-700 0,2-0,9 1 Bit 100-4500 0-4,5 5 Brokoli 140-2300 0-1 2 Kubis 0-2700 0,16-0,4 3 Wortel 0-2800 0-0,6 3 Kembang Kol 53-4500 0-1,1 2 Seledri 50-5300 0,4-0,5 5 Ketimun 17-570 0,16-0,8 2 Kubis 30-5500 0,16-1,4 3 Selada 90-13000 0-94 5 Peterseli 0-4100 0,4-2,6 4 Kacang Polong 20-100 0-2,1 1 Kentang 57-1000 0-3,5 1 Lobak 60-9000 0-162 5 Bayam 2-6700 0,16-1,6 5 Tomat 0-170 0,2-0,9 1 Sumber: (Walters, 1996)
2.4 Efek Toksik Nitrat dan Nitrit
Nitrit dapat bereaksi dengan zat-zat yang ada dalam saluran pencernaan. Nitrit juga dapat terbentuk melalui reduksi nitrat oleh bakteri pada infeksi kelenjar kemih. Sintesa nitrit dan nitrat juga terjadi di dalam jaringan tubuh mamalia oleh bakteri heterotrop. Jika pH lambung meningkat, bakteri akan berkembang yang kemudian dapat mereduksi nitrat menjadi nitrit. Nitrat diabsorbsi dengan cepat pada saluran pencernaan bagian atas, dan sebagian besar dikeluarkan melalui urin. Pengeluaran melalui urin mempunyai waktu paruh sekitar 5 jam. Sebagian nitrat yang diangkut dalam darah dikeluarkan melalui kelenjar ludah. Nitrat yang berada dalam rongga mulut dapat direduksi menjadi nitrit oleh mikroba rongga mulut dan kemudian tertelan. Sebanyak 25% dari asupan nitrat dikeluarkan melalui kelenjar ludah. Sekitar 20% dari nitrat dalam kelenjar ludah direduksi menjadi nitrit, dengan demikian sekitar 5% dari seluruh asupan nitrat akan direduksi menjadi nitrit dalam ludah dan tertelan kembali (Silalahi, 2005).
Methaemoglobin adalah hemoglobin yang di dalamnya ferro (Fe2+) telah diubah menjadi ferri (Fe3+) dan kemampuannya untuk mengangkut oksigen telah berkurang dan menyebabkan warna darah menjadi coklat. Methaemoglobin dapat terjadi jika hemoglobin terpapar terhadap oksidator, termasuk nitrit. Sebenarnya darah manusia secara normal mengandung methaemoglobin pada konsentrasi tidak melebihi 2%. Tetapi, jika kadarnya meningkat menjadi 20% dapat menyebabkan gangguan pada pengangkutan oksigen yang nyata, namun masih dapat ditoleransi. Darah yang mengandung methaemoglobin yang tinggi disebut methaemoglobinemia, terjadi gejala kulit biru (sianosis), sesak napas, mual dan
muntah, serta shock. Kematian dapat terjadi jika kadar methaemoglobin mencapai 70% (Silalahi, 2005).
2.5 Fotosintesis
Proses sintesis karbohidrat dari bahan-bahan anorganik (CO2 dan H2O)
pada tumbuhan berpigmen dengan bantuan energi cahaya matahari disebut fotosintesis dengan persamaan reaksi kimia berikut ini.
cahaya matahari
6 CO2+ 6 H2O C6H12O6 + 6 O2
pigmen fotosintesis
Berdasarkan reaksi fotosintesis di atas, CO2 dan H2O merupakan substrat
dalam reaksi fotosintesis dan dengan bantuan cahaya matahari dan pigmen fotosintesis (berupa klorofil dan pigemen-pigmen lainnya) akan menghasilkan karbohidrat dan melepaskan oksigen. Cahaya matahari meliputi semua warna dari spektrum tampak dari merah hingga ungu, tetapi tidak semua panjang gelombang dari spektrum tampak diserap (diabsorpsi) oleh pigmen fotosintesis. Atom O pada karbohidrat berasal dari CO2 dan atom H pada karbohidrat berasal dari H2O
(Fitriana, 2008).
2.6 Tanaman Bayam
Bayam merupakan tanaman sayuran yang dikenal dengan nama ilmiah Amaranthus spp. Kata amaranth dalam bahasa yunani berarti everlasting (abadi). Tanaman bayam berasal dari daerah Amerika tropis. Tanaman bayam semula
dikenal sebagai tumbuhan hias. Dalam perkembangan selanjutnya, tanaman bayam dipromosikan sebagai bahan pangan sumber protein, terutama untuk Negara-negara berkembang. Diduga tanaman bayam masuk keindonesia pada abad XIX, ketika lalu lintas perdagangan orang luar negeri masuk ke wilayah Indonesia (Ramdani, 2013).
2.6.1 Klasifikasi Bayam
Menurut Herbarium Medanese (2016), klasifikasi taksonomi tanaman bayam yaitu: Kerajaan : Plantae Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotiledonae Ordo : Caryophyllales Famili : Amaranthaceae Genus : Amaranthus
Spesies : Amaranthus tricolor L. 2.6.2 Jenis-Jenis Bayam
Menurut Bandini dan Azis (1997), bayam terdiri atas dua jenis yaitu bayam liar dan bayam dan bayam budidaya.
a. Bayam Liar
Bayam liar dapat dijumpai pada lahan-lahan kosong tidak terurus sebagai gulma di lahan pertanian, atau di tempat-tempat lembab. Bayam ini dapat dikonsumsi, tetapi rasanya agak getir (Bandini dan Azis, 1997).Jenis bayam liar diantaranya sebagai berikut:
1. Bayam tanah (Amaranthus blitum L.)
Ciri utamanya terletak pada batang yang berwarna merah dan berduri. Daunnya berbentuk lancip dan kecil, rasanya agak keras dan kasar (Bandini dan Azis, 1997).
2. Bayam berduri (Amaranthus spinosus L.)
Ciri-ciri bayam tanah hampir sama dengan bayam tanah , yaitu daun kecil dan daun berwarna merah dan keras, namun pada batangnya terdapat duri yang keluar dari buku-bukunya (Bandini dan Azis, 1997).
b. Bayam Budidaya
Bayam ini sengaja di budidayakan untuk di konsumsi karena rasa daunnya yang enak dan mempunyai kandungan gizi yang tinggi (Bandini dan Azis, 1997). Jenis bayam budidaya diantaranya sebagai berikut:
1. Bayam cabut (Amaranthus tricolor L.)
Bayam cabut disebut juga bayam sekul atau bayam putih. Cirinya, daun agak bulat dengan daging yang tebal dan lemas. Bunga keluar dari bagian ketiak cabang. Batang berwarna hijau keputih-putihan sampai merah. Dari warna batang dan daun dikenal jenis bayam putih dan bayam merah (Bandini dan Azis, 1997).
2. Bayam petik atau bayam tahunan (Amaranthus hybridus L.)
Tanaman ini tumbuh besar dan tingginya dapat mencapai 2 m. Tanaman berdaun lebar, berbatang tegap, rasanya getir dan agak keras. Bijinya berwarna hitam sampai putih. Daunnya diambil dengan cara dipetik atau dipangkas cabang atau daunnya yang masih muda secara terus menerus.
Pemetikan ini dapat berlangsung hingga tahunan sehingga disebut bayam tahunan (Bandini dan Azis, 1997).
2.6.3 Manfaat dan Kandungan Gizi Bayam
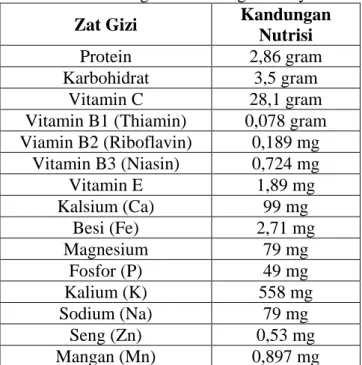
Ditinjau dari kandungan gizinya, bayam merupakan jenis sayuran hijau yang banyak manfaatnya bagi kesehatan dan pertumbuhan badan, terutama bagi anak-anak dan para ibu yang sedang hamil. Didalam daun bayam terdapat cukup banyak kandungan protein, mineral, kalsium, zat besi, dan vitamin yang dibutuhkan oleh tubuh manusia (Bandini dan Azis, 1997). Pada Tabel 2.2 diuraikan mengenai komposisi gizi selengkapnya yang terkandung dalam daun bayam.
Tabel 2.2 Kandungan Gizi 100 gram Bayam
Zat Gizi Kandungan
Nutrisi
Protein 2,86 gram
Karbohidrat 3,5 gram Vitamin C 28,1 gram Vitamin B1 (Thiamin) 0,078 gram Viamin B2 (Riboflavin) 0,189 mg Vitamin B3 (Niasin) 0,724 mg Vitamin E 1,89 mg Kalsium (Ca) 99 mg Besi (Fe) 2,71 mg Magnesium 79 mg Fosfor (P) 49 mg Kalium (K) 558 mg Sodium (Na) 79 mg Seng (Zn) 0,53 mg Mangan (Mn) 0,897 mg (Sumber : Kaleka, 2013)
2.6.4 Syarat Tumbuh Tanaman Bayam
Untuk memperoleh hasil yang berkualitas tinggi, suatu usaha tani perlu memperhatikan syarat tumbuh tanaman yang akan mendukung pertumbuhan dan hasil. Bayam dapat tumbuh pada berbagai jenis tanah dan ketinggian tempat,mulai
dari dataran rendah hingga tinggi, tetapi bayam dapat tumbuh optimal pada ketinggian 300-700 m dpl. Bayam dapat tumbuh dengan baik pada tanah dengan pH 6-7, tanah yang gembur dan banyak mengandung bahan organik. Bayam toleran terhadap kekeringan, tetapi agak rentan terhadap kondisi drainase yang buruk(Tafajani, 2011).
2.7 Penetapan Kadar Nitrat dan Nitrit dalam Makanan 2.7.1 Kromatografi Cair Kinerja Tinggi (KCKT)
Penggunaan KCKT untuk analisa nitrit dan nitrat telah berkembang. Kedua anion dapat dianalisa dalam waktu yang bersamaan. Metode KCKT telah dilaporkan untuk pengukuran kadar nitrat dan nitrit pada daging, sayuran dan air (Massey, 1996).
Penetapan Kadar nitrat dan nitrit dengan KCKT menggunakan kolom C18 Water Spherisorb® (250 x 4,6) mm dengan fase gerak oktilamin 0,015 M pH 6,5 didalam methanol 30%. Laju alir optimal 0,8 mL/menit, volume injeksi 0,5 µL kemudian dideteksi dengan UV 213 nm (Keshavarz, dkk.,2015).
Batas deteksi nitrat dan nitrit dengan metode KCKT berada pada kisaran 0,01 - 0,1 mg/L untuk air dan antara 0,1 – 1,0 mg/Kg untuk makanan. Pada prakteknya batas deteksi tergantung pada reagen blanko (Massey, 1996).
2.7.2 Kromatografi Gas
Kromatografi merupakan teknik pemisahan yang mana solute yang mudah menguap bermigrasi melalui kolom yang mengandung fase diam dengan suatu kecepatan yang tergantung pada rasio distribusinya. Fase gerak yang berupa gas akan mengelusi solute dari ujung kolom menghantarkannya ke detektor.
Penggunaan suhu yang meningkat bertujuan untuk menjamin bahwa solute akan menguap dan terelusi (Gandjar dan Rohman, 2009).
Metode kromatografi gas telah digunakan untuk pengujian nitrat dan nitrit pada air dan makanan. Prosedur ini melibatkan pembentukan derivatif volatile, ekstraksi dengan pelarut organik dan pengukuran oleh kromatografi gas dengan menggunakan detektor selektif. Pengukuran dengan kromatografi gas dilakukan dengan metode nitrasi dari benzen dalam kondisi asam untuk nitrat pada daging (Hill, 1996). Reaksi nitrasi dari benzen dapat dilihat pada Gambar 2.2.
Gambar 2.2 Reaksi Nitrasi dari Benzen (Sumber : McMurry, 2008)
Pengembangan metode kromatografi gas untuk pengukuran kadar nitrit telah dilakukan. Cara yang dilakukan adalah mereaksikan pentaflourobenzil dengan nitrit sehingga diperoleh derivatif volatile, sedangkan pengukuran kadar nitrat dilakukan terlebih dahulu dengan mereduksi nitrat menjadi nitrit, kemudian diukur sebagai nitrit. Pengukuran kadar nitrat dan nitrit dengan kromatografi gas menggunakan fase gerak Helium dengan tekanan 50 kPa, fused-sillica capillary
coloum (OV1701, 25 m x 0,36 mm) yang dikondisikan pada suhu 60oC selama 2 menit kemudian suhu dinaikkan sampai 100oC dengan laju 5oC per menit dan suhu dinaikkan kembali sampai 250oC dengan laju 30oC per menit (Tsikas, dkk.,1994).
2.7.3 Spektrofotometri Sinar Tampak
Radiasi elektromagnetik, yang mana sinar ultraviolet dan sinar tampak merupakan salah satunya, dapat dianggap sebagai energi yang merambat dalam bentuk gelombang (Gandjar dan Rohman, 2012). Radiasi di daerah UV/visibel diserap melalui eksitasi elektron-elektron yang terlibat dalam ikatan-ikatan antara atom-atom pembentuk molekul sehingga awan elektron menahan atom bersama-sama mendistribusikan kembali atom-atom itu sendiri dan orbital yang ditempati oleh elektron-elektron pengikat tidak lagi bertumpang tindih (Watson, 2010).
Prinsip pengukuran kadar nitrit berdasarkan pembentukan warna kemerah-merahan yang terjadi bila mereaksikan nitrit dengan asam sulfanilat dan N-(1-naftil) etilendiamin dihidroklorida pada pH 2,0 sampai pH 5,2 kemudian diukur pada panjang gelombang 540 nm (SNI, 2006). Reaksi pembentukan garam diazo dan reaksi pengkoplingan dengan NED dapat dilihat pada Gambar 2.3.
Reaksi Diazotasi
HSO3 NH2+HNO2+ HCl HSO3 N + + Cl- + 2H2O
N
HSO3 N+ + Cl + NHCH2CH2NH2
N
Garam diazonium NED
HSO3 N = N NHCH2CH2NH2 + HCl
Senyawa azo (merah)
Gambar 2.3Reaksi antara nitrit dengan asam sulfanilat dan NED (Roth dan Gottfried, 1998).
Pengukuran nitrit dengan cara mereaksikan nitrit dengan asam sulfanilat dalam suasanan asam sehingga terbentuk garam diazo, kemudian dikopling dengan NED sehingga membentuk larutan yang berwarna. Larutan berwarna inilah yang diukur secara spektrofotometri sinar tampak pada panjang gelombang 540 nm (Gandjar dan Rohman, 2009).
Kebanyakan metode dikembangkan berdasarkan prosedur diazotasi Griess. Prosedur ini terjadi pembentukan garam diazo antara nitrit dan sulfanilat. Kemudian diazo direaksikan dengan senyawa amin aromatis atau fenol aromatis membentuk senyawa berwarna. Penentuan kadar nitrat dilakukan terlebih dahulu mereduksinya menjadi nitrit, kemudian diukur sebagai nitrit. Jika didalam sampel juga terdapat nitrit maka kadar nitrat dikurangkan dari kadar nitrit yang ditentukan sebelum direduksi (Silalahi, dkk., 2007).
2.8 Validasi Metode
Validasi adalah suatu tindakan penilaian terhadap parameter tertentu pada prosedur penetapan yang dipakai untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Proses validasi dimulai dengan perangkat lunak yang tervalidasi dan sistem yang terjamin, lalu metode yang divalidasi menggunakan sistem yang terjamin dikembangkan. Akhirnya, validasi total diperoleh dengan melakukan kesesuaian sistem. Masing-masing tahap dalam proses validasi inimerupakan suatu proses yang secara keseluruhan bertujuan untuk mencapai kesuksesan validasi (Gandjar dan Rohman, 2009).
2.8.1 Ketepatan (Akurasi)
Akurasi merupakan ketelitian metode analisis atau kedekatan antara nilai terukur dengan nilai yang diterima baik nilai konvensi, nilai sebenarnya atau nilai rujukan. Akurasi diukur sebagai banyaknya analit yang diperoleh kembali pada suatu pengukuran dengan melakukan spiking pada suatu sampel (Gandjar dan Rohman, 2009).
Menurut Harmita (2004) persen perolehan kembali dapat dihitung dengan rumus sebagai berikut:
% perolehan kembali = 𝐶𝐶𝐶𝐶−𝐶𝐶𝐶𝐶
𝐶𝐶∗𝐶𝐶 x 100 %
Keterangan:
CF = konsentrasi analit dalam sampel setelah penambahan baku
CA = konsentrasi analit dalam sampel sebelum penambahan baku
2.8.2 Presisi
Presisi merupakan ukuran keterulangan metode analisis dan biasanya diekspresikan sebagai simpangan baku relatif dari sejumlah sampel yang berbeda signifikan secara statistik (Gandjar dan Rohman, 2009).
2.8.3 Batas Deteksi dan Batas Kuantitasi
Batas deteksi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang masih dapat dideteksi, meskipun tidak selalu dapat dikuantifikasi. Sedangkan batas kuantitasi didefinisikan sebagai konsentrasi analit terendah dalam sampel yang dapat ditentukan dengan presisi dan akurasi yang dapat diterima pada kondisi operasional metode yang digunakan (Gandjar dan Rohman, 2009).