BAB II
TINJAUAN PUSTAKA 2.1 Kecombrang
Menurut Adliani, dkk. (2012), kedudukan kecombrang dalam taksonomi tumbuhan diklasifikasikan sebagai berikut:
Kingdom : Plantae Divisi : Spermatophyta Kelas : Dicotyledonae Ordo : Zingiberales Famili : Zingiberaceae Genus : Etlingera
Spesies : Etlingera elatior Jack.
Kecombrang merupakan tanaman asli pulau Sumatera dan Jawa. Tanaman ini tersebar di Pulau Jawa dan Sumatera terutama di daerah pegunungan tumbuhnya di hutan. Bunga dan buah dikumpulkan dari hutan, di dekat permukiman, dibudidayakan di pekarangan yang tanahnya tanpa persiapan penggarapan tanah terlebih dahulu atau tanpa pemeliharaan. Kecombrang diperbanyak dengan rimpang. Pada umur 2 tahun, kecombrang akan berbunga dan berbuah (Heyne, 1913).
Tanaman kecombrang merupakan tanaman tahunan yang mempunyai batang semu, tegak, berpelepah, membentuk rimpang, dan berwarna hijau. Daunnya tunggal, panjang daun sekitar 20-30 cm dan lebar daun 5-10 cm, pertulangan daun menyirip, dan berwarna hijau. Bunga kecombrang berbentuk bongkol dengan panjang tangkai 40-80 cm dengan mahkota berwarna merah.
Akarnya berbentuk tunggang dan berwarna kuning gelap (Tampubolon, dkk., 1983).
Bunga Kecombrang sering ditambahkan pada masakan khas suku Batak, yaitu arsik ikan mas, masakan pucuk ubi tumbuk, dan juga digunakan sebagai peredam bau amis pada ikan (Heyne, 1913).
Kecombrang memiliki beberapa nama sinonim antara lain Nicolaia elatior Jack, Phaeomeria speciosa, dan Phaeomeria magnifika. Penyebaran kecombrang di Indonesia sangat luas dengan berbagai nama pada masing-masing daerah seperti kecombrang (Jawa), terpuk (Gayo), combrang (Sunda), kincung (Melayu), honje (Sunda), atimengo (Gorontalo), puwar kijung (Minangkabau), Katimbang (Makasar), Salahawa (Seram), dan kantan (Malaysia) (Tampubolon, dkk., 1983).
Bunga kecombrang mempunyai kandungan zat kimia antara lain: karbohidrat, serat pangan, lemak, protein, air, kalsium, tembaga, besi, magnesium, mangan, seng, natrium, kalium, sulfur, fosfor, boron, fluor, selenium, kobalt, krom, dan molibdenum (Wijekoon, et al., 2011).
Menurut Adliani, dkk. (2012), bunga kecombrang juga mengandung senyawa alkaloid, flavonoid, polifenol, steroid, saponin, dan minyak atsiri. Rimpang kecombrang biasanya digunakan sebagai pewarna kuning untuk anyaman atau kerajinan tangan dan batang kecombrang sebagai bahan dasar pembuatan kertas. Daun kecombrang yang muda maupun tua dapat dimasak menjadi sayur asam. Daunnya juga berguna untuk menutupi bau badan dan untuk pewangi dalam air pencuci mayat. Bunga kecombrang banyak bermanfaat di antaranya adalah menghilangkan bau badan, menyembuhkan penyakit kulit.
Kalium yang terkandung dalam bunga kecombrang bermanfaat untuk melancarkan air seni, mengobati penyakit ginjal (Heyne, 1913).
2.2 Mineral
Menurut Poedjiadi (1994), mineral adalah unsur-unsur yang berada dalam bentuk sederhana, sedangkan dalam ilmu gizi biasanya disebut unsur-unsur mineral atau nutrien/zat gizi anorganik. Mineral merupakan kebutuhan tubuh manusia yang mempunyai peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Mineral digolongkan ke dalammineral makro dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg sehari, sedangkan mineral mikro dibutuhkan kurang dari 100 mg sehari. Yang termasuk mineral makro antara lain: natrium, klorida, kalium, kalsium, fosfor, dan magnesium, sedangkan yang termasuk mineral mikro antara lain: besi, mangan, dan tembaga (Almatsier, 2004).
Secara tidak langsung, mineral banyak yang berperan dalam proses pertumbuhan. Peran mineral dalam tubuh kita berkaitan satu sama lainnya, dan kekurangan atau kelebihan salah satu mineral akan berpengaruh terhadap kerja mineral lainnya (Almatsier, 2004).
2.2.1 Besi
Besi merupakan mineral mikro yang paling banyak terdapat di dalam tubuh manusia dan hewan. Besi mempunyai beberapa fungsi di dalam tubuh sebagai alat angkut oksigen dari paru-paru ke jaringan tubuh, sebagai alat angkut elektron di dalam sel, dan sebagai bagian terpadu berbagai reaksi enzim di dalam jaringan tubuh (Almatsier, 2004).
Kebutuhan akan zat besi untuk berbagai jenis kelamin dan golongan usia adalah sebagai berikut: untuk laki-laki dewasa 10 mg/ hari, wanita yang mengalami haid 12 mg/hari, dan anak-anak 8-15 mg/hari. Zat besi yang tidak mencukupi bagi pembentukan sel darah, akan mengakibatkan anemia, menurunkan kekebalan tubuh, sehingga sangat peka terhadap serangan penyakit (Budianto, 2009).
Beberapa faktor diet menghindari penyerapan zat besi sedangkan yang lain membantunya. Makanan yang tinggi kadar Vitamin C-nya meningkatkan penyerapan baik zat besi heme maupun non-heme. Namun demikian, dimasukkannya teh hitam atau etylenediaminetetraacetic acid (EDTA) pada makanan dapat mengurangi ketersediaan zat besi non-heme sebesar 50%. Telur, produk-produk kedelai, dan kopi pun menghambat penyerapan zat besi (Tan, 1996).
Sumber besi dari hewani adalah daging, udang, hati sapi, ayam, ikan, dan telur. Sedangkan sumber dari nabati adalah kacang-kacangan dan sayuran hijau. Di samping kadar besi, perlu diperhatikan juga kualitas besi di dalam makanan yang dinamakan ketersediaan biologik. Pada umumnya besi yang berada dalam daging, hati sapi, ayam, dan ikan mempunyai ketersediaan biologik yang tinggi, besi yang berada di dalam kacang-kacangan mempunyai ketersediaan biologik yang sedang, dan besi dalam sebagian besar sayuran, seperti bayam mempunyai ketersediaan biologik yang rendah (Almatsier, 2004).
2.2.2 Kalium
Kalium terutama terdapat di dalam sel, sebanyak 95% kalium berada di dalam cairan intraseluler. Kalium memegang peranan dalam pemeliharaan
keseimbangan cairan dan elektrolit serta keseimbangan asam basa serta isotonis sel, selain itu kalium juga mengaktivasi banyak reaksi enzim dan proses fisiologi, seperti transmisi impuls di saraf dan otot, kontraksi otot dan metabolisme karbohidrat (Almatsier, 2004; Tan dan Rahardja, 2007).
Kekurangan kalium dapat terjadi karena kebanyakan kehilangan melalui saluran cerna dan ginjal. Kekurangan kalium menyebabkan lemah, lesu, kehilangan nafsu makan dan konstipasi. Kelebihan kalium akut dapat terjadi bila konsumsi tanpa diimbangi oleh kenaikan ekskresi (Winarno, 1992).
Kalium terdapat di dalam semua makanan yang berasal dari tumbuhan dan hewan. Sumber utama kalium adalah makanan mentah/segar, terutama buah, sayuran, dan kacang-kacangan. Kebutuhan minimum akan kalium ditaksir sebanyak 2000 mg sehari (Almatsier, 2004).
2.2.3 Kalsium
Kalsium merupakan mineral yang paling banyak terdapat di dalam tubuh, yaitu 1,5-2 % dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg. Dari jumlah ini, sebanyak 99% berada di dalam jaringan keras, yaitu tulang dan gigi, selebihnya tersebar luas di dalam tubuh. Di dalam cairan ekstraselular dan intraselular, kalsium memegang peranan penting dalam mengatur fungsi sel, seperti untuk transmisi impuls di saraf, kontraksi otot, penggumpalan darah, dan menjaga permeabilitas membran sel (Almatsier, 2004).
Kalsium diekskresikan lewat urin serta feses dan untuk mencegah kehilangan ini diperlukan kalsium melalui makanan. Kalsium tambahan diperlukan dalam keadaan tertentu seperti pada masa pertumbuhan mulai dari
anak-anak hingga usia remaja dan pada saat hamil untuk memenuhi kebutuhan janin (Budianto, 2009).
Angka kecukupan rata-rata sehari untuk kalsium bagi orang Indonesia yang ditetapkan adalah 300 – 400 mg pada bayi, 500 mg pada anak-anak, 600 – 700 mg pada remaja, 500 – 800 mg pada orang dewasa, serta lebih besar 400 mg dari kebutuhan orang dewasa pada ibu hamil dan menyusui. Kekurangan kalsium pada masa pertumbuhan dapat menyebabkan gangguan pertumbuhan seperti tulang kurang kuat, mudah bengkok, dan rapuh (Almatsier, 2004).
Sumber kalsium utama adalah susu dan hasil olahan susu seperti keju. Ikan yang dimakan dengan tulang, termasuk ikan kering merupakan sumber kalsium yang baik. Sereal, kacang-kacangan dan hasil olahan kacang-kacangan, tahu, tempe, serta sayuran hijau merupakan sumber kalsium yang baik (Almatsier, 2004).
2.2.4 Magnesium
Magnesium adalah kation nomor dua paling banyak setelah natrium di dalam cairan ekstraseluler. Magnesium di alam merupakan bagian dari klorofil daun. Magnesium memegang peranan penting dalam lebih dari tiga ratus jenis enzim di dalam tubuh. Magnesium bertindak di dalam semua jaringan lunak sebagai katalisator dalam reaksi-reaksi biologik termasuk reaksi yang berkaitan dengan metabolisme energi, karbohidrat, lipid, protein, dan asam nukleat. Di dalam cairan ekstraseluler, magnesium berperan dalam transmisi saraf, kontraksi otot, dan pembekuan darah. Magnesium mencegah kerusakan gigi dengan cara menahan kalsium di dalam email gigi (Almatsier, 2004).
Menurut Montgomery, et al. (1993), kebanyakan pangan terutama pangan nabati seperti kentang, padi-padian, dan buah-buahan, mengandung magnesium. Magnesium juga esensial dalam metabolisme terutama reaksi yang melibatkan Adenosine Triphosphate (ATP). Magnesium adalah salah satu mineral terbanyak di dalam tubuh. Sekitar 50% dari magnesium total yang terdapat dalam tubuh berada dalam tulang. Sisanya terdapat dalam sel-sel jaringan dan organ. Hanya 1% magnesium tubuh yang berada dalam darah. Tubuh kita selalu bekerja keras untuk mempertahankan kadar magnesium yang konstan (Almatsier, 2004).
Tubuh manusia mengandung kurang lebih 25 gram magnesium, 50 – 60 % daripadanya terdapat dalam kerangka, sedangkan sisanya terdapat dalam cairan intraseluler, juga sebagai ko-faktor enzim yang menghasilkan energi. Fungsi magnesium adalah memegang peranan penting pada relaksasi otot, mungkin juga untuk myocard, pada otot jantung orang yang meninggal ditemukan kadar magnesium dan kalium yang rendah. Oleh karena itu, magnesium digu nakan untuk terapi infark jantung (Tan dan Rahardja, 2007).
2.3 Penetapan Kadar Besi, Kalium, Kalsium, dan Magnesium pada Bunga Kecombrang
Menurut Wijekoon, et al. (2011), penetapan kadar besi, kalium, kalsium, magnesium, ataupun mineral lain (baik mineral maupun logam berat) dapat dilakukan dengan Inductively Coupled Plasma Optical Emission Spectrophotometer (ICP - OES). Sampel yang digunakan adalah bunga kecombrang yang segar, kuncup, dan memiliki keseragaman warna (merah) tanpa kerusakan fisik. Sampel kemudian dicuci bersih dengan air mengalir. Setelah itu, sampel diproses secara freezedrying selama 48 jam dan digiling menjadi serbuk
halus (ukuran mesh 30) menggunakan blender. Serbuk sampel kemudian disimpan pada suhu 4°C. Sampel yang telah dikeringkan (masing-masing ditimbang 1 g pada setiap tiga kali pengulangan) didestruksi dengan asam nitrat 70% dan dibiarkan hingga dingin sebelum diencerkan hingga 50 ml dengan air deionisasi. Larutan kemudian disaring dengan kertas Whatmann no. 4 dan diinjeksikan pada ICP – OES.
Dari hasil penelitian Wijekoon, et al. (2011), diperoleh kadar besi, kalium, kalsium, dan magnesium dari bunga kecombrang yang berasal dari Penang, Malaysia adalah 2,4 mg/ 100 g, 541 mg/ 100 g, 775,3 mg/ 100 g, dan 327,1 mg/ 100 g secara berturut-turut. Sedangkan untuk mineral lain yang dianalisis seperti sulfur, natrium, fluor, seng, tembaga, mangan, dan fosfor diperoleh hasil yaitu 4,5 mg/ 100 g, 166,6 mg/ 100 g, 1,4 mg/ 100 g, 2,8 mg/ 100 g, 0,6 mg/ 100 g, 8,3 mg/ 100 g, dan 286 mg/ 100 g secara berturut-turut. Untuk mineral selenium, kobalt, krom, dan molibdenum diperoleh hasil < 0,1 mg/ 100 g.
2.4 Spektrofotometri Serapan Atom
Spektrofotometri serapan atom lebih cenderung digunakan untuk pengujian kuantitatif dibandingkan kualitatif. Panjang gelombang dibaca melalui rentang yang diinginkan dan spektrum yang tercatat. Panjang gelombang yang absortif dibandingkan dengan nilai panjang gelombang yang diketahui untuk elemen – elemen yang diperkirakan (Braun, 1982).
Spektrofotometri serapan atom digunakan untuk analisis kuantitatif unsur-unsur logam. Cara analisis ini memberikan kadar total unsur-unsur logam dalam suatu sampel dan tidak tergantung pada bentuk molekul dari logam dalam sampel tersebut. Cara ini cocok untuk analisis logam karena mempunyai kepekaan yang
tinggi (batas deteksi kurang dari 1 ppm), pelaksanaannya relatif sederhana. Spektrofotometri serapan atom didasarkan pada penyerapan energi sinar oleh atom-atom netral dan sinar yang diserap biasanya sinar tampak atau ultraviolet. Dalam garis besarnya prinsip spektrofotometri serapan atom sama saja dengan spektrofotometri sinar tampak dan ultraviolet. Perbedaannya terletak pada bentuk spektrum, cara pengerjaan sampel dan peralatannya. Metode spektrofotometri serapan atom mendasarkan pada prinsip absorbsi cahaya oleh atom. Atom-atom akan menyerap cahaya pada panjang gelombang tertentu, tergantung pada sifat unsurnya (Rohman, 2007).
Jika suatu larutan yang mengandung suatu garam logam (atau suatu senyawa logam) dialirkan ke dalam suatu nyala maka terbentuklah uap yang mengandung atom-atom logam itu. Atom logam bentuk gas tersebut tetap berada dalam keadaan tak tereksitasi atau dalam keadaan dasar. Jika cahaya dengan panjang gelombang yang khas dengan logam tersebut dilewatkan pada nyala yang mengandung atom yang bersangkutan, maka sebagian cahaya tersebut akan diserap dan penyerapan tersebut menyebabkan elektron tereksitasi ke tingkat yang lebih tinggi. Inilah asas yang mendasari spektrofotometri serapan atom (Rohman, 2007).
Teknik ini digunakan untuk menetapkan kadar ion logam dan mineral tertentu dengan jalan mengukur intensitas emisi atau serapan cahaya pada panjang gelombang tertentu oleh uap atom unsur yang ditimbulkan dari bahan, misalnya dengan mengalirkan larutan zat ke dalam api (Ditjen POM, 1995).
Menurut Fifield dan Kealey (2000), pembentukan atom – atom logam dan mineral dalam nyala dapat terjadi bila suatu larutan sampel yang mengandung
logam dan mineral dimasukkan ke dalam nyala. Menurut Basset, et al. (1994), peristiwa yang terjadi secara singkat setelah sampel dimasukkan ke dalam nyala adalah:
1. Penguapan pelarut yang meninggalkan residu
2. Penguapan zat padat dengan dissosiasi menjadi atom – atom penyusunnya, yang mula – mula akan berada dalam keadaan dasar.
3. Beberapa atom dapat tereksitasi oleh energi panas nyala ke tingkatan-tingkatan energi yang lebih tinggi, dan mencapai kondisi dimana atom-atom tersebut akan memancarkan energi,
2.4.1 Instrumentasi Spektrofotometri Serapan Atom
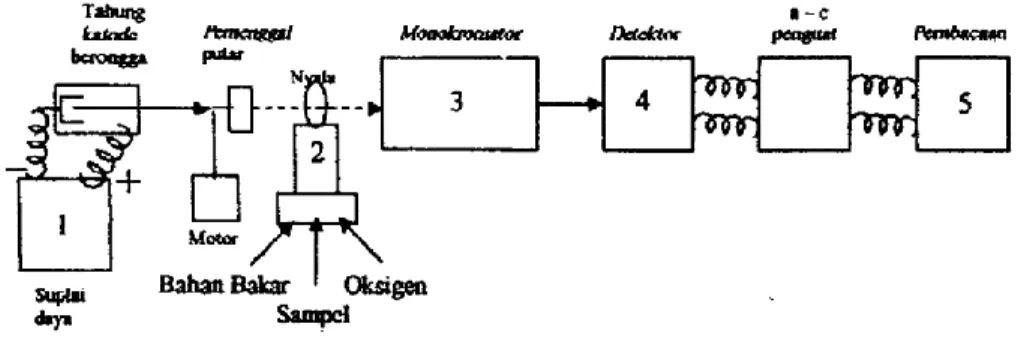
Sistem peralatan spektrofotometer serapan atom dapat dilihat pada gambar di bawah ini:
Gambar 2.1.Komponen Spektrofotometer Serapan Atom (Basset, et al., 1994) Menurut Rohman (2007), bagian-bagian dari spektrofotometer serapan atom adalah sebagai berikut:
a. Sumber Sinar
Sumber sinar yang lazim dipakai adalah lampu katoda berongga (hollow cathode lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung
suatu katoda dan anoda. Katoda berbentuk silinder berongga yang dilapisi dengan logam tertentu.
b. Tempat Sampel
Sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan azas. Ada berbagai macam alat yang digunakan untuk mengubah sampel menjadi uap atom-atomnya, yaitu:
1. Dengan Nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa cairan menjadi bentuk uap atomnya dan untuk proses atomisasi. Suhu yang dapat dicapai oleh nyala tergantung pada gas yang digunakan, misalnya untuk gas asetilen – udara suhunya sebesar 2200°C.
2. Tanpa Nyala (Flameless)
Pengatoman dilakukan dalam tungku dari grafit. Sejumlah sampel diambil sedikit (hanya beberapa µl), lalu diletakkan dalam tabung grafit, kemudian tabung tersebut dipanaskan dengan sistem elektris dengan cara melewatkan arus listrik pada grafit. Akibat pemanasan ini, maka zat yang akan dianalisis berubah menjadi atom – atom netral dan pada fraksi atom ini dilewatkan suatu sinar yang berasal dari lampu katoda sehingga terjadilah proses penyerapan energi sinar yang memenuhi kaidah analisis kuantitatif.
c. Monokromator
Monokromator merupakan alat untuk memisahkan dan memilih spektrum sesuai dengan panjang gelombang yang digunakan dalam analisis dari sekian banyak spektrum yang dihasilkan lampu katoda.
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman.
e. Amplifier
Amplifier merupakan suatu alat untuk memperkuat signal yang diterima dari detektor sehingga dapat dibaca sebagai alat pencatat hasil (Readout).
f. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai pencatat hasil. Hasil pembacaan dapat berupa angka atau berupa kurva yang menggambarkan absorbansi atau intensitas emisi.
Fungsi nyala adalah untuk memproduksi atom-atom yang dapat mengabsorpsi radiasi yang dipancarkan oleh lampu katoda tabung. Pada umumnya, peralatan yang digunakan untuk mengalirkan sampel menuju nyala adalah nebulizer yang dihubungkan dengan pembakar (burner). Sebelum menuju nyala, sampel mengalir melalui pipa kapiler dan menghasilkan aerosol oleh aliran gas pengoksidasi. Kemudian, aerosol yang terbentuk bercampur dengan bahan bakar menuju ke burner. Sampel yang menuju ke burner hanya berkisar 5 – 10 % sedangkan sisanya (90 – 95 %) menuju ke tempat pembuangan. Sampel yang berada pada nyala lalu diatomisasi dan cahaya dari lampu katoda tabung dilewatkan melalui nyala. Sampel yang berada pada nyala akan menyerap cahaya tersebut (Rohman, 2007).
Menurut Rohman (2007), terdapat 3 jenis nyala dalam spektrofotometri serapan atom yaitu:
Jenis nyala ini relatif lebih dingin (1800°C) dibandingkan jenis nyala lainnya. Nyala ini akan menghasilkan sensitifitas yang baik jika elemen yang akan diukur mudah terdisosiasi seperti Na, K, Cu.
2. Asetilen – Udara
Jenis nyala ini adalah yang paling umum digunakan dalam spektrofotometri serapan atom. Nyala ini menghasilkan temperatur sekitar 2200°C yang dapat mengatomisasi hampir semua elemen.
3. Asetilen – Dinitrogen oksida
Jenis nyala ini paling panas (3000°C) dan sangat baik digunakan pada spektrofotometri serapan atom untuk menganalisis sampel yang membentuk oksida yang sangat stabil dan sukar diatomkan pada suhu rendah seperti Al, Si, Ti. 2.4.2 Gangguan-gangguan pada Spektrofotometri Serapan Atom
Menurut Rohman (2007), gangguan-gangguan (interference) pada SSA adalah peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel. Gangguan-gangguan yang dapat terjadi pada SSA adalah sebagai berikut:
a. Gangguan oleh penyerapan non-atomik (non atomic absorption)
Gangguan ini terjadi akibat penyerapan cahaya dari sumber sinar yang bukan berasal dari atom-atom yang akan dianalisis. Penyerapan non-atomik dapat disebabkan adanya penyerapan cahaya oleh partikel-partikel pengganggu yang berada di dalam nyala. Cara mengatasi penyerapan non-atomik ini adalah bekerja pada panjang gelombang yang lebih besar atau pada suhu yang lebih tinggi (Rohman, 2007).
b. Gangguan kimia yang dapat mempengaruhi banyaknya atom dalam nyala Menurut Rohman (2007), pembentukan atom-atom netral yang masih dalam keadaan asas di dalam nyala sering terganggu oleh dua peristiwa kimia, yaitu:
1. Disosiasi senyawa-senyawa yang tidak sempurna
Disosiasi ini disebabkan oleh terbentuknya senyawa refraktorik (sukar diuraikan dalam api), sehingga akan mengurangi jumlah atom netral yang ada di dalam nyala.
2. Ionisasi atom-atom di dalam nyala
Ionisasi terjadi akibat suhu yang digunakan terlalu tinggi. Prinsip analisis dengan spektrofotometri serapan atom adalah mengukur absorbansi atom-atom netral yang berada dalam keadaan asas. Jika terbentuk ion maka akan mengganggu pengukuran absorbansi atom netral karena spektrum absorbansi atom-atom yang mengalami ionisasi tidak sama dengan spektrum atom dalam keadaan netral.
c. Gangguan spektrum
Gangguan spektrum dalam spektrofotometri serapan atom timbul akibat terjadinya tumpang tindih antara frekuensi-frekuensi garis resonansi unsur yang dianalisis dengan garis-garis yang dipancarkan oleh unsur lain. Hal ini disebabkan karena rendahnya resolusi monokromator pada spektrofotometri serapan atom. d. Gangguan yang berasal dari matriks sampel yang dapat mempengaruhi
Sifat-sifat matriks sampel yang dapat mengganggu analisis adalah yang mempengaruhi laju aliran bahan bakar/gas pengoksidasi. Sifat-sifat tersebut adalah viskositas dan berat jenis (Rohman, 2007).
2.5 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu, berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis adalah sebagai berikut:
1. Kecermatan (accuracy)
Menurut Harmita (2004), kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan. Kecermatan hasil analisis sangat tergantung kepada sebaran galat sistematik di dalam keseluruhan tahapan analisis. Oleh karena itu, untuk mencapai kecermatan yang tinggi hanya dapat dilakukan dengan cara mengurangi galat sistematik tersebut seperti menggunakan peralatan yang dikalibrasi, menggunakan pereaksi dan pelarut yang baik, pengontrolan suhu, dan pelaksanaannya yang cermat, taat asas sesuai prosedur. Kecermatan dapat ditentukan dengan dua cara yaitu:
a. Metode simulasi (spiked-placebo recovery)
Dalam metode simulasi, sejumlah analit bahan murni ditambahkan ke dalam campuran bahan pembawa sediaan farmasi (plasebo) lalu campuran
tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya) (Harmita, 2004).
b. Metode penambahan baku (standard addition method)
Dalam metode penambahan baku, sampel dianalisis lalu sejumlah tertentu analit yang diperiksa ditambahkan ke dalam sampel lalu dicampur dan dianalisis lagi. Selisih kedua hasil dibandingkan dengan kadar yang sebenarnya (hasil yang diharapkan) (Harmita, 2004).
Dalam kedua metode tersebut, persen perolehan kembali dinyatakan sebagai rasio antara hasil yang diperoleh dengan hasil yang sebenarnya. Persen perolehan kembali dapat ditentukan dengan cara membuat sampel plasebo (eksipien obat, cairan biologis) kemudian ditambah analit dengan konsentrasi tertentu (biasanya 80 % sampai 120 % dari kadar analit yang diperkirakan), kemudian dianalisis dengan metode yang akan divalidasi. Tetapi bila tidak memungkinkan membuat sampel plasebo karena matriksnya tidak diketahui seperti obat-obatan paten, atau karena analitnya berupa suatu senyawa endogen misalnya metabolit sekunder pada kultur halus, maka dapat digunakan metode adisi. Metode adisi dapat dilakukan dengan menambahkan sejumlah analit dengan konsentrasi tertentu pada sampel yang diperiksa, lalu dianalisis dengan metode tersebut. Persen perolehan kembali ditentukan dengan menentukan berapa persen analit yang ditambahkan tadi dapat ditemukan (Harmita, 2004).
2. Keseksamaan / Ketelitian (precision)
Ketelitian adalah ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran hasil individual dari rata – rata jika prosedur ditetapkan secara berulang-ulang pada sampel-sampel yang diambil dari
campuran yang homogen. Ketelitian diukur sebagai keterulangan (repeatability) atau ketertiruan (reproducibility). Keterulangan adalah ketelitian metode jika dilakukan berulang kali oleh analisis yag sama pada kondisi yang sama dan dalam waktu interval yang pendek (Harmita, 2004).
3. Selektivitas (Spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya komponen lain yang mungkin ada dalam matriks sampel. Selektivitas seringkali dapat dinyatakan sebagai derajat penyimpangan metode yang dilakukan terhadap sampel yang mengandung bahan yang ditambahkan berupa cemaran, hasil urai, senyawa sejenis, senyawa asing lainnya, dan dibandingkan terhadap hasil a nalisis sampel yang tidak mengandung bahan lain yang ditambahkan (Harmita, 2004). 4. Linearitas dan Rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon yang secara langsung atau dengan bantuan transformasi matematik yang baik, proporsional terhadap konsentrasi analit dalam sampel. Rentang metode adalah pernyataan batas terendah dan tertinggi analit yang sudah ditunjukkan dapat ditetapkan dengan kecermatan, keseksamaan, dan linearitas yang dapat diterima (Harmita, 2004).
5. Batas Deteksi dan Batas Kuantitasi
Batas deteksi adalah jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan dibandingkan dengan blanko. Batas kuantitasi merupakan kuantitasi terkecil analit dalam sampel yang masih memenuhi kriteria cermat dan seksama (Harmita, 2004).