Biofilm formation properties of Methicillin
resistant
Staphylococcus aureus (MRSA)
strains isolated in Microbiology Laboratory,
Faculty of Medicine, UGM, Yogyakarta
Titik Nuryastuti, Praseno, Muchammad Mustafa Department of Microbiology, Faculty of Medicine,
Universitas Gadjah Mada, Yogyakarta Email : t.nuryastuti@ugm.ac.id Abstract
Today, Staphylococcus aureus, especially MRSA isolates, developed into a major pathogenic agent of nosocomial infection and sepsis worldwide. Infections caused by these bacteria are oftenly difficult to treat due to the development of antibiotic resistance. Biofilm formation is an important factor in the pathogenicity of Staphylococcus infections, where bacteria can attach to and colonizes the biomaterial devices. Biofilms also one of the factors of antibiotic therapy failure. In this study, the ability of 14 clinical isolates of MRSA to produce biofilm forming were studied in vitro using Congo Red Agar (CRA) inoculation and microtiter plate assay. The results showed that 12 out of 14 (85.8 %) MRSA isolates tested are not able to form biofilms, and 2 of them (14.2 %) is a weak biofilm-forming isolates. There is no difference result of biofilm forming between CRA and microtiter plate assay. Key words : biofilm formation, MRSA
Intisari
Dewasa ini, Staphylococcus aureus, terutama isolat MRSA, berkembang menjadi agen patogen utama pada infeksi nosokomial
dan sepsis di seluruh dunia. Infeksi yang disebabkan oleh bakteri ini seringkali sangat berat dan sulit diterapi karena perkembangan resistensi antibiotik yang sangat cepat dan luas. Pembentukan biofilm merupakan faktor penting dalam patogenitas infeksi Staphylococcus, dimana bakteri bisa menempel dan berkolonisasi pada alat-alat biomaterial. Biofilm juga merupakan salah satu faktor gagalnya terapi antibiotik. Dalam penelitian ini, kemampuan 14 isolat klinik MRSA dalam membentuk biofilm diteliti dengan menginokulasikan isolat ke dalam media congo red agar dan uji plate mikrotiter. Hasil penelitian ini menunjukkan bahwa 12 dari 14 (85.8%) isolat MRSA tidak mampu membentuk biofilm, dan 2 diantaranya (14.2%) merupakan isolat pembentuk biofilm yang lemah. Tidak ada perbedaan hasil antara uji biofilm menggunakan CRA dan uji mikrotiter plate.
Kata kunci : pembentukan biofilm, MRSA Latar Belakang
Munculnya strain bakteri yang resisten terhadap banyak antibiotik termasuk bakteri Staphylococcus aureus, merupakan masalah yang serius, apalagi didukung kemampuan bakteri ini dalam membentuk biofilm sehingga menyebabkan agen antimikroba dan sistem imun tidak efektif dalam mengeliminasi sel biofilm. Di Yogyakarta, prevalensi isolat methicillin resistance Staphylococus aureus (MRSA) pada tahun 2008 sebesar 31 % (Dewi Santosaningsih et al. 2008), dan merupakan bakteri Gram positip yang sering terlibat dalam berbagai macam infeksi mulai dari foliculitis sampai pneumonia, osteomyelitis dan endokarditis. Berbagai infeksi tersebut diperantarai oleh kemampuan
S. aureus untuk melekat dan berkolonisasi membentuk biofilm pada
bahan organik atau anorganik, termasuk alat-alat biomedis. Biofilm juga merupakan salah satu faktor gagalnya terapi antibiotik, karena hal-hal sebagai berikut: a) terhambatnya penetrasi antibiotik; b) bakteri ada dalam keadaan pertumbuhan yang lambat (slow growth), dan c)
adanya ekspresi gen-gen resisten (Kim Lewis 2001). Pembentukan biofilm ini juga dapat menyebabkan bakteri terlindungi dalam suatu matriks polisakarida sehingga tidak dapat dicapai oleh sistem imun hospes (fagositosis).
Kemampuan bakteri dalam memproduksi biofilm merupakan salah satu faktor virulensi dari S. aureus yang akan mempersulit manajemen pengobatan (Kim Lewis 2001). Menurut data yang diumumkan WHO, lebih dari 60 % infeksi mikroba disebabkan oleh biofilm (NIH 2002). Produksi biofilm pada S. aureus difasilitasi oleh adanya gen ica, yang merupakan suatu gen operon terdiri atas ica A, B, C dan D (O’Neil E et al.
2007).
Banyak kasus sederhana yang disebabkan biofilm seperti infeksi saluran kencing (ISK), ISK pada pemakai kateter (sering disebabkan E.
coli, S. aureus), infeksi telinga tengah (penyebab terbanyak P. aeruginosa),
plak gigi/caries dental, ginggivitis. Kasus-kasus ini sulit diobati dan sering menimbulkan kekambuhan. Infeksi yang lebih serius oleh karena biofilm dapat terjadi pada pasien yang memakai alat-alat biomaterial/ protesa misalnya protesa sendi, katub jantung, kateter, lensa kontak dan alat hemodialisa/ambulatoir (Reig G 1999). Tingginya resistensi dan penyebaran infeksi sel biofilm bakteri dari tempat infeksi ke seluruh sistem tubuh merupakan masalah serius dalam manajemen infeksi biofilm.
Berdasarkan uraian di atas, perlu dilakukan penelitian untuk menganalisa kemampuan pembentukan biofilm pada isolat S. aureus, terutama isolat resisten methicillin yang diisolasi dari spesimen klinik dari beberapa rumah sakit di Yogyakarta. Penelitian ini diarahkan untuk memperoleh gambaran tentang patogenesis dan faktor virulensi pembentukan biofilm pada S. aureus, sehinggga diharapkan dapat menambah wawasan dalam manajemen penyakit infeksi nosokomial dan penyakit infeksi yang terkait dengan S. aureus.
Metode
Penelitian ini merupakan penelitian observasional untuk mengetahui kemampuan pembentukan biofilm pada 14 isolat MRSA
yang dikumpulkan di Laboratorium Mikrobiologi FK UGM dalam kurun waktu 1 tahun (Januari 2012-Januari 2013). Uji pembentukan biofilm pada penelitian ini dilakukan dengan mengamati karakteristik fenotip bakteri pada media Congo Red Agar (CRA, terdiri dari 0,8 g Congo Red; 30 g sakarosa ditambahkan BHI agar sampai volume1 liter) setelah diinkubasi selama 24 jam pada suhu 370C dan dibiarkan pada suhu kamar selama 24 jam (T Mathur et al. 2006, Titik Nuryastuti et al. 2008). Pada media ini strain yang mampu membentuk biofilm akan memberikan gambaran koloni berwarna hitam, sedangkan strain yang tidak mampu membentuk biofilm akan nampak sebagai koloni berwarna merah.
Untuk mendapatkan data kuantitatif kemampuan pembentukan biofilm pada S. aurues dilakukan uji kuantitatif adherencemenggunakan uji plate mikrotiter dengan cara sebagai berikut : bakteri ditumbuhkan dalam media Trypticase Soy Broth selama 24 jam pada 370C, kemudian 2 ml suspensi bakteri dimasukkan ke dalam sumuran (microtiter
polystirene plate) yang telah diisi dengan 198 media TSB ml,
diinkubasikan 370C selama 90 menit. Selanjutnya sumuran dicuci 2x dengan PBS 200 ml, Sel yang adherent dicat dengan 0,1 % crystal violet, dicuci dengan akuades, dan diresuspensi dengan 200 ml acid isopropanol 5%, dan selanjutnya absorbansi diamati pada l 595 nm
Sebagai kontrol positip digunakan S. epidermidis RP62A (ATCC 35954) yang merupakan strain pembentuk biofilm, dan kontrol negatipnya digunakan S. carnosus TM 300. Sel bakteri dikatakan mampu membentuk biofilm dengan sangat kuat (strongly biofilm positive) bila OD (Optical Density) 595 ³ 1; mampu membentuk biofilm tetapi lemah kapasitasnya bila 0,1 £ OD 595 < 1 (low grade biofilm positive); dan tidak mampu membentuk biofilm (biofilm negative) bila OD 595 < 0,1(Annet E.J.van Merode 2006) .
Hasil
Karakteristik pembentukan biofilm diteliti dengan menggunakan uji mikrotiter plate dan inokulasi pada media CRA. Penanaman koloni
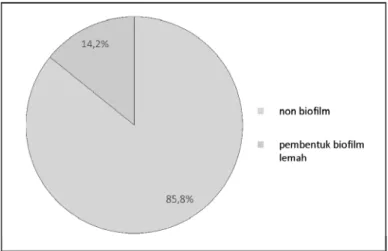
bakteri ke dalam media CRA menunjukkan hasil bahwa hanya 2 dari 14 (14.2 %) isolat MRSA yang mempunyai kemampuan membentuk biofilm, hal ini diamati dari pertumbuhan koloni pada media CRA yang tampak sebagai koloni berwarna hitam dengan permukaan kasar. Dua belas dari 14 isolat (85.8 %) menghasilkan koloni yang berwarna merah dengan permukaan halus (Gambar 1).
Gambar 1. Gambaran koloni dari beberapa isolat MRSA pada media CRA yang diinkubasi selama 2x24jam. Koloni dengan tanda panah
menunjukkan isolat yang mampu membentuk biofilm.
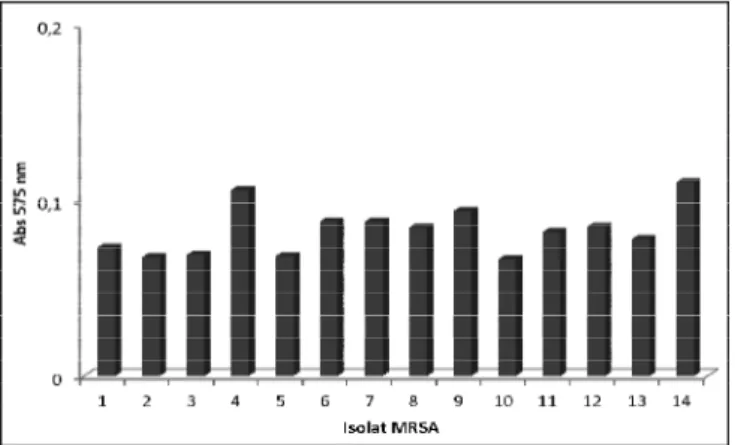
Selanjutnya uji mikrotiter plate digunakan untuk mengamati karakteristik pembentukan biofilm pada kedua kelompok isolat ini, sebagaimana yang disampaikan oleh Afrenish et albahwa uji mikrotiter plate lebih terpercaya dan dianggap sebagai tes standar untuk deteksi pembentukan biofilm. Dengan uji miktotiter plate, didapatkan hasil bahwa 85,8 % isolat MRSA yang diuji pada penelitian ini (12 dari 14 isolat) mempunyai nilai absorbansi yang sangat rendah (kurang dari 0,1) dan menunjukkan bahwa sebagian besar isolat MRSA tidak membentuk biofilm, hanya 2 isolat (14.2 %) yang mampu membentuk biofilm.
Gambar 2. Hasil uji mikrotiter plate pada isolat MRSA dengan pewarnaan kristal violet 1%. Data ini merupakan hasil rata-rata 9 sumuran dari tiga kali pengulangan. Sumbu X mewakili isolat MRSA
yang diuji, Sumbu Y merupakan nilai absorbansi pada panjang gelombang 575nm.
Dari penelitian ini juga diperoleh data, bahwa terdapat kesesuaian hasil dalam hal penentuan pembentukan biofilm pada isolat MRSA dengan menggunakan uji inokulasi pada media CRA dan uji mikrotiter plate (Gambar 3). Korelasi kesesuaian antara kedua uji ini masih diperdebatkan, dilaporkan bahwa metode CRA mempunyai kelemahan karena hanya mendeteksi matriks biofilm yang berupa amyloid atau polisakarida saja yang mampu berikatan dengan congo red, sementara itu apabila matriks biofilm tersusun atas protein atau ekstraseluler DNA yang dominan, maka CRA tidak akan dapat mendeteksi pembentukan biofilm (Stepanovic S et al. 2000, Hannig C et al. 2010, F.Pantanella et al. 2013). Meskipun begitu, beberapa peneliti juga melaporkan bahwa CRA merupakan uji deteksi awal pembentukan biofilm yang cukup sederhana, murah dan mudah dikerjakan (N.S.Mariana et al. 2009, Peterson SB et al. 2011)
Gambar 3. Distribusi isolat MRSA dalam pembentukan biofilm berdasarkan uji CRA dan uji mikrotiter plate.
Pembahasan
S. aureus memiliki beragam faktor virulensi, termasuk produk toksin
ekstraseluler dan protein permukaan yang memfasilitasi kolonisasi jaringan, penghindaran dari sistem imunitas, dan kerusakan jaringan. Produksi dari banyak faktor ini dikendalikan oleh alur jaringan pengaturan dari gen regulator, seperti Agr dan Sar a, yang mengkoordinasikan ekspresi gen yang tepat untuk berbagai tahap infeksi (Gordon RJ and Lowy FD 2008). Selain penyakit akut, S. aureus dapat menyebabkan infeksi kronis, terutama yang dimediasi oleh kemampuan patogen ini untuk melekat pada peralatan medis dan membentuk biofilm. Pertumbuhan S. aureus dalam biofilm membutuhkan respon adaptif oleh organisme (Gordon RJ and Lowy FD 2008).
Kapasitas pembentukan biofilm diakui merupakan faktor virulensi penting dalam menentukan infeksi Staphylococi terkait peralatan medis (O’gara JP 2007). Produksi polisakarida adhesin, atau sering disebut polisakarida interseluler adhesin (PIA) atau polimer N-asetil-glukosamin (PNAG) pada Staphylococcus oleh enzim yang sintesisnya dikode ica
operon, saat ini merupakan mekanisme yang banyak dipahami sebagai dasar terbentuknya biofilm (O’gara JP 2007). Beberapa penelitian melaporkan bahwa frekuensi isolat MRSA yang mempunyai kemampuan membentuk biofilm sangat bervariasi. Studi di Scotlandia (Smith K et
al., 2008) menyatakan bahwa 74% isolat MRSA mampu membentuk
biofilm. Sementara itu laporan lain menyatakan bahwa dalam kondisi laboratorium standar menggunakan medium BHI, hanya 8% dari 114 MRSA yang mampu membentuk biofilm. Dari penelitian menggunakan isolat MRSA ini, hanya 12% isolat MRSA mampu membentuk biofilm. Berbagai sinyal dari lingkungan eksternal, seperti kadar CO2, kondisi anaerob, kadar glukosa, dan stres osmotik, dapat mengubah regulasi ekspresi gen pembentukan biofilm (Rachid O et al., 2000, O’gara JP, 2007, Nuryastuti T et al., 2009, Nuryastuti T et al. 2011).
Karakteristik resistensi terhadap methicilin pada S. aureus, disebabkan oleh keberadaan gen mecA pada kromosom bakteri yang merupakan bagian dari Staphylococcal cassette chromosome mec (SCCmec), suatu elemen DNA yang mudah berpindah, dan panjangnya kurang lebih 21-60 Kbp (Rice L.B, 2006). Tingginya tingkat resistensi MRSA terhadap banyak antibiotik ini dimungkinkan karena di dalam
SSC mec terdapat suatu sekuen yang disebut regio J, yang merupakan
tempat insersi gen penyandi resistensi antibiotik yang lain, termasuk transposon, plasmid dan kaset kromosom rekombinanase (ccr); sehingga memudahkan isolat MRSA membawa sifat resistensi terhadap berbagai golongan antibiotik (Henry F Chambers, 1997, Rice L.B, 2006). Kesimpulan
Data penelitian ini mendukung teori yang dikemukan oleh peneliti sebelumnya (Clarissa Pozzi et al., 2012) bahwa sifat resistensi terhadap antibiotik yang disebabkan keberadaan gen mecA, akan memperlemah virulensi S. aureus (MRSA) dalam perlekatannnya terhadap sel inang atau permukaan biomaterial, dalam hal ini berkaitan dengan pembentukan biofilm. Keadaan ini akan memberikan manfaat bagi MRSA untuk beradaptasi dalam situasi klinis dimana paparan antibiotik
sangat tinggi dan bakteri MRSA harus memperhitungkan energi untuk metabolisme dan memilih jalur adaptasi yang harus diutamakan untuk bertahan dalam situasi yang mengancam (O’Neil E et al., 2007, Clarissa Pozzi et al., 2012).
Daftar Pustaka
Annet E.J.van Merode.2006. Role of surface charge heterogeneity in
Enterococcus faecalis adhesion and biofilm formation.
Rijksuniversiteit Groningen.
Clarissa Pozzi, Elaine M.Waters, Justine K.Rudkin, Schaeffer CR, Lohan AJ, Pin Tong, Loftus BJ, Pier GB, Paul D.Fey, Massey R.C, and James P.O’gara. 2012. Methicillin Resistance Alters the Biofilm Phenotype and Attenuates Virulence in Staphylococcus aureus Device-Associated Infections. PLoS Pathogens 8:1-15.
Dewi Santosaningsih, H.A.Verbreugh, Anis Kurniawati, and Titik Nuryastuti. 2008. The first multicenter study of methicillin resistance Staphylococus aureus in Indonesian hospitals. 1:1-2.
F.Pantanella, P.Valenti, T.Natalizi, D.Passeri, and F.Berlutti. 2013. Analytical techniques to study microbial biofilm on abiotic surfaces: pros and cons of the main techniques currently in use. Ann Ig 25:31-42. Gordon RJ, and Lowy FD. 2008. Pathogenesis of Methicillin-Resistant
Staphylococcus aureus Infection. Clinical Infectious Diseases
46:50-59.
Hannig C, Follo M, Hellwig E, and Al-Ahmad A. 2010. Visualization of adherent micro-organisms using different techniques. J of Med Microb 59:1-7.
Henry F Chambers. 1997. Methicillin Resistance in Staphylococci: Molecular and Biochemical Basis and Clinical Implications. Clin Microb Rev 10:781-791.
Kim Lewis. 2001. Riddle of Biofilm Resistance. Antimicrob Agents and Chemother 45:1007.
N.S.Mariana, S.A.Salman, V.Neela, and S.Zamberi. 2009. Evaluation of modified Congo red agar for detection of biofilm produced by
clinical isolates of methicillin-resistance Staphylococcus aureus. African Journal of Microbiology Research 3:330-338.
NIH, N. H. L. a. B. I.2002. Research on microbial biofilms.
O’gara JP. 2007. ica and beyond:mmechanisms and regulation in
Staphylococcus epidermidis and Staphylococcus aureus. FEMS
Microbiol Lett 270:179-188.
O’Neil E, Pozzi C, Houston P, Smyth D, Humphreys H Robinson A, and O’gara JP. 2007. Association between Methicillin Susceptibility and Biofilm Regulation in Staphylococcus aureus Isolates from Device-Related Infections. J of Clin Microb 45:1379-1388.
Peterson SB, Irie Y, Borlee BR, Murakami K, Harrison JJ, Colvin KM, and Parsek MR. 2011. Different Methods for Culturing Biofilms In Vitro, p. 251-266. In Bjamsholt T, Moser C, Jensen PO, and Hoiby N [eds.], Biofilm Infections. Springer Publisher, Denmark.
Rachid O, Ohlsen K, Witte W, Hacker J, and Ziebuhr W. 2000. Effect of subinhibitory antibiotic concentrations on polysaccharide intercellular adhesin expression in biofilm-forming Staphylococcus
epidermidis. Antimicrob Agent Chemother 44:3357-3363.
Reig G. 1999. Biofilms in infectious disease and on medical devices. Int J Antimirob Agent 11:223-226.
Rice L.B. 2006. Antimicrobial resistance in Gram-positive bacteria. Am J Med 119:S11-S19.
Smith K, Perez A, Ramage G, Lappin D, Gemmell CG, and Sue Lang. 2008. Biofilm formation by Scottish clinical isolates of Staphylococcus
aureus. J of Med Microb 57:1018-1023.
Stepanovic S, Vukovic D, Dakic I, Savic B, and Svabic-Vlahovic M.A. 2000. A modified microtiter-plate test for quantification of staphylococcal biofilm formation. J Microbiol Methods 40:179. T Mathur, S Singhal, S Khan, DJ Upadhyay, T Fatma, and A Rattan.
2006. Detection of biofilm formation among the clinical isolates of staphylococci: An evaluation of three different screening methods. Indian Journal of Medical Microbiology 24:25-29. Titik Nuryastuti, Bastiaan P.Krom, Abu T.Aman, Henk J.Busscher, and
susceptibility of Staphylococcus epidermidis biofilm on orthopedic implant biomaterials. J Biomed Mater Res Part A 96A:365-371. Titik Nuryastuti, Bastiaan P.Krom, Abu T.Aman, Henk J.Busscher, and
Henny C.van der Mei. 2009. Effect of Cinnamon Oil on icaA Expression and Biofilm Formation by Staphylococcus epidermidis. Appl and Environment Microb 75:6850-6855.
Titik Nuryastuti, Henny C van der Mei, Henk J Busscher, Roel Kuijer, Abu T Aman, and Bastiaan P Krom. 2008. recA mediated spontaneous deletions of the icaADBC operon of clinical Staphylococcus epidermidis isolates: a new mechanism of phenotypic variations. Antonie van Leeuwenhoek 94:317-328.