SUMBER DANA DIPA UNPAD
PATOGENISITAS JAMUR ENTOMOPATOGEN Metarhizium anisopliae TERHADAP Crocidolomia pavonana Fab. DALAM KEGIATAN STUDI
PENGENDALIAN HAMA TERPADU TANAMAN KUBIS DENGAN MENGGUNAKAN AGENSIA HAYATI
Oleh :
Mia Miranti Rustama Melanie Budi Irawan
Dibiayai oleh Dana DIPA Universitas Padjadjaran Tahun Anggaran 2008
Berdasarkan SPK No. 394/H6.26/LP/PL/2008 Tanggal 16 April 2008
LEMBAGA PENELITIAN UNIVERSITAS PADJADJARAN
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Padjadjaran
LAPORAN AKHIR PENELITIAN PENELITI MUDA (LITMUD) UNPAD SUMBER DANA DIPA UNPAD
TAHUN ANGGARAN 2008
1.a.Judul penelitian : Patogenisitas jamur entomopatogen Metarhizium anisopliae terhadap Crocidolomia pavonana Fab. dalam
c.Pangkat/Gol/NIP : Penata/IIIc/132145898 d.Jabatan fungsional : Lektor
e.Fakultas/Jurusan : MIPA/Biologi
f.Bidang ilmu yang diteliti : Mikrobiologi dan Entomologi 3. Jumlah Tim Peneliti : 3 Orang
4. Lokasi Penelitian : Lab. Mikrobiologi dan Lab. Invertebrata, Jur. Biologi, FMIPA-UNPAD
5. Jangka waktu penelitian : 8 bulan
6. Biaya penelitian : Rp. 6.125.000,00 (enam juta seratus duapuluh limaribu )
Bandung, 14 November 2008
Crocidolomia pavonana Fab. dalam kegiatan studi pengendalian hama terpadu tanaman kubis dengan menggunakan agensia hayati
ABSTRAK
Penelitian tentang patogenisitas jamur entomopatogen Metarhizium anisopliae terhadap Crocidolomia pavonana Fab. dalam kegiatan studi pengendalian hama terpadu tanaman kubis dengan menggunakan agensia hayati telah dilakukan. Aplikasi infeksi spora jamur M. anisopliae dilakukan dengan metode tetes langsung ke atas permukaan kutikula larva. Metode penelitian yang digunakan adalah eksperimental dengan rancangan penelitian menggunakan rancangan acak lengkap factor tunggal (konsentrasi spora) dengan 6 taraf (0 spora/ml, 105 spora/ml, 106 spora/ml, 107 spora/ml, 108 spora/ml, 109 spora/ml) dan 4 ulangan. Hasil penelitian menunjukkan bahwa infeksi spora jamur dengan berbagai konsentrasi sangat berpengaruh terhadap tingkat dan waktu kematian larva yang diinfeksi, tetapi tidak berpengaruh terhadap berat badan dan konsumsi pakan larva. Infeksi spora jamur 109 spora/ml menyebabkan tingkat kematian larva mencapai 95%, dan waktu kematian tercepat yaitu 4,66 hari.
Kata Kunci : Metarhizium anisopliae, Crocidolomia pavonana Fab., metode tetes langsung.
ABSTRACT
The research against the pathogenity of entomopathogen fungi Metharizium anisopliae concerning Crocidolomia pavonana Fab. on Integrated Pest Management study in cabbage plantation use by biological agent has been done. The application of M. anisopliae spores infection use direct drop methode on surface of the larvae cuticle. For the study were carried out experimentally in the laboratorium and the data were analysed descriptively and for some parameters were analysed statistically using randomyzed block design with six levels of spore concentration (0 spores/ml, 105 spores/ml, 106 spores/ml, 107 spores/ml, 108 spores/ml, 109 spores/ml) and 4 replication respectively. The concentration 109 spores/ml of infection of fungus spores tends to increase the mortality of larval until 95 % and fastest lethal time of larval in 4.66 days.
Puji syukur kehadirat Allah SWT, karena berkat rahmatNya, penelitian dan
laporan ini dapat diselesaikan. Penelitian ini mencoba memanfaatkan jamur Metarhizium
anisopliae sebagai agensia biologis dalam mengendalikan populasi larva Crocidolomia
pavonana Fab. yang merupakan serangga hama yang paling merusak pada tanaman
kubis.
Ucapan terima kasih diucapkan pada Rektor Universitas Padjadjaran dan
Lembaga penelitian Universitas Padjadjaran yang telah memfasilitasi hingga penelitian
ini dapat terlaksana dengan bantuan dana dari Dana Penelitian Peneliti Muda UNPAD.
Selanjutnya, ucapan terima kasih juga kami sampaikan pada Dekan FMIPA, Dr. Wawan
Hermawan, MS, Ketua Jurusan Biologi, Drs Hikmat Kasmara, MS, Rekan-Rekan Dosen
di Lab. Mikrobiologi dan Lab. Invertebrata, Dr. Ratu Safitri, MS, Dr. Nia Rossiana, MS
dan Dra. Ida Indrawati, M.Si, dan Melanie, S.Si, M.Si atas bantuan dan dukungan dalam
penggunaan laboratorium sebagai tempat penelitian ini. Juga terima kasih pada Melanie,
S.Si, M.Si, Budi Irawan, S.Si, M.Si dan Siti Hazar S.Si, sebagai rekan kerja, sehingga
penelitian ini dapat diselesaikan.
Akhir kata semoga hasil penelitian ini dapat memberikan informasi dan manfaat
bagi pembacanya.
Bandung, November 2008
Halaman
BAB III TUJUAN DAN MANFAAT PENELITIAN 3.1 Tujuan Penelitian 14
4.3.2 Perbanyakan Jamur Metarhizium anisopliae dalam Medium PDA 18 4.3.3 Perbanyakan Jamur Metarhizium anisopliae dalam Medium Beras Jagung 19
5.2 Waktu Kematian Larva Crocidolomia pavonana Fabricius 31
5.3 Berat Badan Maksimum Larva Crocidolomia pavonana Fabricius 33
5.4 Konsumsi Pakan Larva Crocidolomia pavonana Fabricius yang Diinfeksi Spora Jamur Metarhizium anisopliae 35
5.5 Konsumsi Pakan Relatif Larva Crocidolomia pavonana Fabricius 40
BAB VI KESIMPULAN DAN SARAN 6.1 Kesimpulan 43
6.2 Saran 44
DAFTAR PUSTAKA 45
Tabel Halaman
1 Data Pengamatan Tiap Parameter Pelakuan 16 2 Sidik Ragam Konsentrasi Terhadap Tiap Variabel Uji 17 3 Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur M. anisopliae
Menurut Konsentrasi Terhadap Mortalitas Larva C. pavonana Fab. 26 4 Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur
M. anisopliae Menurut Konsentrasi Terhadap Waktu Kematian Larva C. pavonana Fab. 31 5 Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur M. anisopliae
Menurut Konsentrasi Terhadap Berat Badan Maksimum Larva
C. pavonana Fab. 34 6 Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur M. anisopliae
Menurut Konsentrasi Terhadap Konsumsi Pakan Total Larva
C. pavonana Fab. 37 7 Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur M. anisopliae
Menurut Konsentrasi Terhadap Konsumsi Makanan Relatif Larva
Gambar Halaman
1 Larva C. pavonana Fab. 8 2 Serangga Dewasa C. pavonana Fab., Betina dan Jantan 8 3 Mekanisme Infeksi Jamur M. anisopliae Pada Tubuh Serangga 12 4 Diagram persentase mortalitas larva C. pavonana Fab. akibat
infeksi spora jamur M. anisopliae pada berbagai tingkat konsentrasi 27 5 Diagram rata-rata waktu kematian larva C. pavonana Fab. yang
diinfeksi oleh spora jamur M. anisopliae pada berbagai
tingkat konsentrasi 32 6 Diagram berat badan maksimum larva C. pavonana Fab. yang
diinfeksi spora jamur M. anisopliae pada berbagai tingkat konsentrasi 34 7 Diagram rata-rata konsumsi pakan larva C. pavonana Fab.
yang diinfeksi spora jamur M. Anisopliae 36 8 Diagram rata-rata konsumsi pakan total larva C. pavonana Fab.
yang diinfeksi spora jamur M. anisopliae pada berbagai
tingkat konsentrasi 38 9 Diagram persentase peningkatan konsumsi makanan larva C. pavonana Fab. yang diinfeksi spora jamur M. anisopliae
terhadap larva normal 39 10 Diagram rata-rata konsumsi makanan relatif larva
C. pavonana Fab. yang diinfeksi spora jamur M. anisopliae
BAB I PENDAHULUAN
1.1. Latar Belakang
Crocidolomia pavonana Fab. merupakan serangga hama perusak utama tanaman
kubis (Brasicca oleracea var. capitata L.). Serangga hama ini paling menimbulkan
kerusakan pada tanaman kubis saat stadium larva instar tiga, yang merupakan stadium
aktif makan. Bagian kubis yang dirusak adalah titik tumbuh yang menyebabkan
pembentukan krop pada tanaman kubis tidak terjadi. Tanaman kubis yang dirusak dapat
mencapai 100% tidak layak jual, sehingga merugikan petani kubis (Sastrosiswojo, 1981).
Pengendalian populasi serangga hama ini dengan menggunakan insektisida
sintetik tidak selalu dapat diatasi, karena aktivitas larva yang menjadi sasaran insektisida
sintetik lebih banyak berada dalam jantung kubis. Selanjutnya penggunaan insektisida
sintetik yang berkelanjutan akan menyebabkan serangga hama sasaran menjadi resisten
terhadap insektisida sintetik tersebut dan residu insektisida sintetik akan terakumulasi di
lingkungan dan organisme lain non target (Oka, 1998 ; Subagiya, 2002).
Salah satu alternatif untuk mengurangi penggunaan insektisida sintetik dalam
mengendalikan populasi serangga hama adalah menggunakan agensia hayati yang berupa
entomopatogen yang bersifat patogen hanya pada serangga sasaran. Entomopatogen
tersebut adalah jamur entomopatogen. Jamur ini dapat menyebabkan penyakit bila
terinfeksi pada serangga, sehingga dapat menurunkan populasi serangga hama dalam
suatu areal pertanian (Gopalakrishnan, 2001).
Sekitar 700 spesies jamur entomopatogen dari kelas deuteuromycetes diketahui
entomopatogen yang telah digunakan sebagai pengendali populasi serangga hama antara
lain Metarhizium, Beauveria, Aspergillus dan Verticillium (Ihara, et al., 2003). Kelebihan
penggunaan jamur entomopatogen sebagai pengendali populasi serangga hama adalah
mempunyai kapasitas produksi yang tinggi, siklus hidup relatif pendek dan mampu
membentuk spora yang tahan terhadap pengaruh lingkungan (Zimmermann, 1993), serta
sangat kecil kemungkinan menimbulkan resistensi pada serangga hama sasaran (Hall,
1973 dalam Prayogo, et al., 2005).
Metarhizium anisopliae merupakan pilihan dalam mengendalikan populasi
serangga hama karena menyebabkan penyakit “green muscardin fungus” yang patogen
terhadap serangga sasaran. Spora jamur yang melekat pada permukaan kutikula larva
akan membentuk hifa yang memasuki jaringan internal larva melalui interaksi biokimia
yang kompleks antara inang dan jamur. Selanjutnya, enzim yang dihasilkan jamur
berfungsi mendegradasi kutikula larva serangga, hifa jamur akan tumbuh ke dalam sel-sel
tubuh serangga, dan menyerap cairan tubuh serangga. Hal ini akan mengakibatkan
serangga mati dalam keadaan tubuh yang mengeras seperti mumi (Tanada dan Kaya,
1993).
Serangga yang terinfeksi jamur entomopatogen ditandai dengan pertumbuhan hifa
berwarna putih pada permukaan kutikula tubuh, dan memasuki hemocoel. Di dalam
hemocoel, hifa akan membentuk “yeastlike hyphal bodies” (blastopora), yang
memperbanyak diri dengan cara pembentukkan tunas. Blastopora tumbuh dan
berkembang di dalam hemocoel dengan menyerap cairan hemolimpf. Selain itu infeksi
jamur ini menghasilkan enzim dekstruksin yang bersifat toksik dan menimbulkan
Beberapa hasil penelitian menunjukkan bahwa M. anisopliae efektif dalam
mengendalikan populasi serangga dari ordo Lepidoptera. Prayogo dan Tengkano, (2004),
menemukan bahwa larva Spodoptera litura (Lepidoptera)yang diinfeksi spora jamur
dengan konsentrasi 104 spora/ml hingga 108 spora/ml, menyebabkan kematian larva
S. litura hingga mencapai 83% pada hari ke12 setelah infeksi spora jamur. Selanjutnya,
Gopalakrishnan dan Narayanan, (1988), menemukan bahwa infeksi spora jamur
M. anisopliae dengan konsentrasi 1,8 X 109 sel/ml dapat menyebabkan tingkat mortalitas
larva Helicoverpa armigera (Lepidoptera) hingga mencapai 80-100%.
Penggunaan jamur ini juga telah dicoba untuk mengendalikan populasi serangga
dari ordo diptera. Widiyanti dan Muyadihardja, (2004), menginfeksi larva Aedes aegypti
dengan spora jamur pada konsentrasi 107 sel/ml, menyebabkan tingkat kematian larva
mencapai 91,1 %.
Pada dasarnya, semakin tinggi tingkat dosis yang diinfeksikan pada serangga
sasaran, maka kemungkinan untuk kontak antara inang dan patogen akan semakin tinggi
(Boucias dan Pendland, 1998). Serangga yang terinfeksi jamur ini akan menunjukkan
gejala-gejala gelisah, kurang aktif bergerak, aktivitas makan menurun dan kehilangan
kemampuan koordinasi dengan lingkungan (Tanada dan Kaya, 1993)
Pada penelitian ini akan dilakukan percobaan mengenai pengaruh konsentrasi
spora jamur M. anisopliae terhadap pengendalian populasi serangga hama C. pavonana
1.2. Identifikasi masalah
Berdasarkan uraian pada latar belakang, dapat diperoleh identifikasi masalah sebagai
berikut :
1. Apakah tingkat konsentrasi spora jamur M. anisopliae, berpengaruh terhadap
tingkat kematian dan waktu kematian larva C. pavonana?
2. Apakah tingkat konsentrasi spora jamur M. anisopliae, berpengaruh terhadap
BAB II TINJAUAN PUSTAKA
2.1. Jamur Metarhizium anisopliae
Metarhizium anisopliae adalah jamur yang dikelompokkan ke dalam division
Amastigomycotina (Tanada dan Kaya, 1993 ; Alexopoulus, et al., 1996). Jamur ini
merupakan jamur tanah bila dalam keadaan saprofit, tetapi memiliki kemampuan sebagai
pathogen pada beberapa ordo serangga seperti Lepidoptera, Coleoptera, Hymenoptera,
Orthoptera, Hemiptera dan Isoptera (Gabriel dan Riyanto, 1989 ; Baehaki dan Noviyanti,
1993 ; Prayogo, et al., 2005).
Sebanyak 204 isolat M. anisopliae berhasil diisolasi dari tanah (Yip, et al., 1992).
Selanjutnya, Burgner, (1998), menemukan bahwa suhu optimum pertumbuhan jamur ini
adalah 25oC. Kisaran pH untuk pertumbuhan jamu ini antara 3,3-8,5. Miselium jamur ini
bersekat, diameter 1,98-2,97m, konidiofor bersusun tegak, berlapis dan bercabang yang
dipenuhi konidia. Konidia bersel satu dan berbentuk bulat silinder dengan ukuran
9,94x3,96 m. Pada awal pertumbuhan koloni jamur ini berwarna putih, kemudian akan
berubah menjadi warna hijau gelap saat konidia matang dan dilanjutkan dengan
pembentukan spora. Spora yang berwarna hijau ini yang memberi istilah green muscardin
Klasifikasi jamur M. anisopliae menurut Alexopoulus, et al., (1996), adalah
sebagai berikut :
Kingdom Mycetes
Division Amastigomycotina
Classis Deuteromycetes
Ordo Moniliales
Familia Moniliaceae
Genus Metarhizium
Species Metarhizium anisopliae
Metabolit sekunder yang dihasilkan jamur ini adalah mikotoksin yang disebut
destruksin, yang merupakan siklodepsipeptide dengan lima asam amino (Brousseau et al.,
1996). Kelompok depsipeptide ini disebut destruksin A,B,C,D, dan E. Destruksin
berpengaruh terhadap organel sel target (mitokondria, retikulum endoplasma dan
membran nukleus), menyebabkan paralysis sel. Selain itu juga berpengaruh terhadap
kelainan fungsi lambung tengah, tubulus malfigi, hemosit dan jaringan otot larva (Tanada
dan Kaya, 1993 ; Widiyanti dan Muyadihardja, 2004). Patogenisitas jamur terhadap inang
target akan meningkat bila kelembaban udara mencapai 100% (Milner, et al., 1997 ;
Prayogo, et al., 2005).
2.2. Serangga Crocidolomia pavonana Fabricius
Serangga Crocidolomia pavonana merupakan serangga hama utama (key pest)
pada tanaman kubis-kubisan (famili cruciferae). Siklus hidup serangga ini metamorfosis
generasi serangga ini berlangsung antara 22-32 hari, bergantung pada ketinggian tempat
di atas permukaan laut (Sastrosiswojo dan Setiawati, 1993).
Klasifikasi serangga C. pavonana Fab. menurut Kalshoven, (1981), dan Sabado,
et al., (2004), adalah sebagai berikut :
Kingdom Animalia
Phylum Arthropoda
Classis Insecta
Ordo Lepidoptera
Familia Pyralidae
Genus Crocidolomia
Species Crocidolomia pavonana Fabricius. (Sinonim : C. binotalis Zeller)
Siklus hidup C. pavonana dimulai dari telur yang berwarna hijau terang dan
diletakan dalam kelompok-kelompok secara berlapis antara 9-120 butir telur pada bagian
bawah daun kubis. Ukuran kelompok telur berkisar antara 1,0x2,0 mm hingga 3,5x6,0
mm (rata-rata 2,6x4,3 mm). Sebelum menetas, telur matang akan berubah warna menjadi
oranye, kuning kecoklatan atau coklat tua. Periode inkubasi telur antara 3-6 hari pada
suhu 26,0-33,2oC. Rata-rata telur menetas sebanyak 92,4% (Othman, 1982 dalam
Sastrosiswojo dan Setiawati, 1993).
Stadium larva C. pavonana terdiri dari lima instar dan hidup secara berkelompok
serta tidak menyukai sinar matahari. Setiap fase instar berkisar antara 1-7 hari.
Keseluruhan fase instar stadium larva berlangsung antara 11-17 hari, pada suhu
26,0-33,2oC dan kelembaban 54,1-87,8%. Warna larva hijau terang dengan bintik-bintik gelap,
buah di bagian dorsal dan masing-masing satu buah pada bagian lateral. Panjang tubuh
larva yang telah tumbuh sempurna berkisar antara 15-21 mm (Othman, 1982 dalam
Sastrosiswojo dan Setiawati, 1993).
Gambar 1. Larva C. pavonana Fab. Sumber : Lynn dan Finn, 2004.
Stadium pupa C. pavonana berlangsung di bawah tanah. Warna pupa coklat
kekuningan dengan lebar sekitar 3 mm dan panjang 10 mm. fase pupa berlangsung
sekitar 9-13 hari pada suhu26 -33,2oC dan kelembaban 54,1-87,8 (Othman, 1982 dalam
Sastrosiswojo dan Setiawati, 1993).
Gambar 2. Serangga dewasa C. pavonana Fab., betina kiri dan jantan kanan
Stadium imago dari C. pavonana hanya berlangsung sekitar 3-6 hari. Ngengat
betina berukuran sekitar 9,6 mm, lebih kecil daripada ngengat jantan yang berukuran
sekitar 11,4 mm. Ngengat C. pavonana aktif pada malam hari (nocturnal), sehingga pada
siang hari akan bersembunyi di bawah daun kubis. Jika diganggu, ngengat akan terbang
seketika (Sastrosiswojo dan Setiawati, 1993).
Populasi larva tertinggi terjadi antara bulan Maret, Juni dan Agustus. Populasi
larva akan menurun bila curah hujan tinggi. Selama 90 hari periode penanaman kubis,
populasi larva C. pavonana cenderung meningkat dimulai dua minggu setelah
penanaman kubis. Populasi larva tertinggi terjadi pada minggu keenam hingga kedelapan
setelah penanaman kubis, dan akan menurun setelah waktu panen kubis (Sastrosiswojo
dan Setiawati, 1993).
Penyebaran serangga hama C. pavonana di daerah tropis dan subtropis mulai dari
Asia Selatan, Asia Tenggara, Australia, Afrika Selatan, Tanzania dan Kepulauan Pasifik
(Kalshoven, 1981).
2.3. Mekanisme infeksi jamur M. anisoliae pada larva serangga
Mekanisme penetrasi jamur ini ke dalam tubuh serangga sangat dipengaruhi oleh
struktur kutikula yaitu ketebalan, sklerotisasi, kandungan zat antijamur, dan substansi
nutrisi (Charnley, 1984). Larva yang baru mengalami penggantian kulit dan larva yang
baru membentuk pupa lebih mudah diinfeksi dibandingkan dengan kutikula yang telah
mengalami pengerasan. Selain infeksi melalui kutikula, jamur juga dapat menginfeksi
serangga melalui Buccal cavity, spirakel, dan bukaan eksternal lain yang terdapat pada
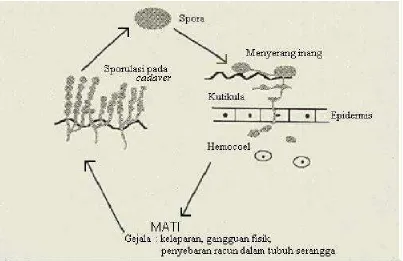
Perkembangan mikosis terbagi dalam tiga fase, yaitu penempelan dan
perkecambahan spora pada kutikula serangga, penetrasi dan perkembangan jamur di
dalam hemocoel rongga tubuh, serta kematian serangga. Perkecambahan spora
umumnya bergantung pada kelembaban dan suhu lingkungan, kondisi cahaya dan nutrisi
di lingkungan. Karakteristik dan struktur spora juga mempengaruhi perkecambahan
spora. Spora yang berkecambah menyerang inang membentuk tabung perkecambahan
yang berperan sebagai hifa penetrasi. Selain terbentuk tabung perkecambahan, terbentuk
pula apresorium. Struktur perkecambahan ini memperkuat saat penempelan jamur
Tanada dan Kaya, 1993. Apresorium jamur M. anisopliae dapat tumbuh optimal pada
suhu 25 – 30oC dan pada kisaran pH 5 – 8. Apresorium tidak akan terbentuk pada suhu
dibawah 19oC atau di atas 33oC Boucias dan Pendland, 1998.
Penempelan spora pada kutikula serangga merupakan mekanisme pasif yang
melibatkan bahan-bahan mucilagenous dan struktur permukaan spora Tanada dan Kaya,
1993. Pada beberapa kasus, penempelan spora berkorelasi dengan tingkat keagresifan
atau spesifitas inang dari spesies jamur, seperti misalnya M. anisopliae dengan
Scarabidae ColeopteraTanada dan Kaya, 1993.
Proses penetrasi melalui integumen serangga oleh hifa yang berkecambah dari
spora melibatkan proses kimia enzimatis dan kekuatan fisik. Enzim yang terdeteksi pada
hifa penetrasi adalah protease, aminopeptidase, lipase, esterase dan N-asetilglusaminase
kitinase (Prayogo, et al., 2005). Protease merupakan enzim pendegradasi kutikula
paling utama dan aktivitas enzim ini merangsang kehadiran enzim kitinase. Aktivitas
enzim kitinase berlangsung umumnya pada awal pertumbuhan jamur, pembentukkan
1993. Tingkat virulensi strain jamur dapat menghasilkan enzim ekstraseluler dalam
jumlah besar seperti lipase, estererase, protease, dan -glukanase Tanada dan Kaya,
1993.
Prayogo dan Suharsono, 2005, menyatakan bahwa terdapat empat tahap
terjadinya penyakit serangga yang disebabkan oleh jamur. Tahap pertama adalah
inokulasi, yaitu kontak antara propagul jamur dengan tubuh serangga inang. Selain
konidia, organ lain seperti hifa juga berfungsi sebagai alat infeksi pada serangga inang.
Pada proses tersebut senyawa mukopolisakarida memegang peranan sangat penting.
Tahap kedua yaitu proses penempelan dan perkecambahan propagul jamur pada
integumen serangga. Kelembaban yang tinggi dan bahkan kadang-kadang air sangat
diperlukan untuk perkecambahan propagul jamur Silva dan Messias, 1985; Chamdler et
al., 1993; Glare et al., 1995 dalam Prayogo dan Suharsono, 2005. Pada tahap ini,
konidia jamur akan memanfaatkan senyawa-senyawa yang terdapat pada lapisan
integumen serangga. Tahap ketiga yaitu penetrasi dan invasi pada tubuh serangga.
Penembusan dilakukan secara mekanis atau kimiawi dengan mengeluarkan enzim atau
toksin. Tahap keempat adalah destruksi atau penghancuran pada titik penetrasi dan
terbentuk yeastlike hiphal bodies blastospora yang kemudian beredar ke dalam
hemolimfa dan membentuk hifa sekunder untuk menyerang jaringan lain Tanada dan
Gambar 3. Mekanisme infeksi jamur M. anisopliae pada tubuh serangga (Charnley, 2006).
2.4 Tanda-Tanda Larva Terinfeksi Jamur Metarhizium anisopliae
Pada stadium awal infeksi oleh jamur, serangga atau larva serangga yang
terinfeksi tidak memperlihatkan gejala. Gejala yang terlihat hanya tampak beberapa titik
nekrotik pada lokasi penetrasi hifa. Pada fase selanjutnya, larva menunjukkan gejala
terserang infeksi. Gejala tersebut antara lain larva menjadi gelisah, kurang aktif, aktivitas
makan menurun dan kehilangan kemampuan koordinasi. Di lapangan, serangga yang
telah terinfeksi seringkali bergerak ke tempat yang lebih tinggi menjauhi permukaan
tanah. Perilaku seperti ini diduga untuk melindungi kelompoknya agar tidak terserang
jamur. Larva dari lepidoptera yang terinfeksi oleh jamur menjadi lunak karena
Pada umumnya, semua jaringan dalam tubuh serangga dan cairan tubuh habis
digunakan oleh jamur, sehingga serangga mati dengan tubuh yang mengeras seperti
mumi Prayogo dan Suharsono, 2005. Pertumbuhan jamur diikuti dengan pengeluaran
pigmen atau toksin yang dapat melindungi serangga dari serangan mikroorganisme lain,
terutama bakteri. Pertumbuhan jamur tidak selalu menembus ke luar jaringan integumen
serangga. Apabila keadaan kurang mendukung perkembangan saprofit maka
pertumbuhan hanya berlangsung di dalam tubuh serangga. Oleh karena itu, jamur
membentuk struktur khusus yang dapat bertahan, yaitu arthrospora Ferron, 1985 dalam
BAB III TUJUAN DAN MANFAAT PENELITIAN
3.1. Tujuan Penelitian
Tujuan dari penelitian ini adalah memanfaatkan kemampuan jamur Metarhizium
anisopliae dalam beberapa konsentrasi infeksi, untuk mengendalikan populasi larva
Crocidolomia pavonana Fabricius instar tiga yang diberi pakan kubis di laboratorium.
3.2. Manfaat Penelitian
Manfaat dari penelitian ini adalah mendapatkan konsentrasi efektif spora jamur
Metarhizium anisopliae yang dapat digunakan untuk mengendalikan populasi larva
serangga hama Crocidolomia pavonana Fabricius, yang ditentukan berdasarkan tingkat
BAB IV METODE PENELITIAN
4.1. Bahan dan alat penelitian
Bahan yang digunakan adalah biakan murni jamur M. anisopliae yang didapat
dari Balai Proteksi Tanaman Perkebunan Bandung, larva C. pavonana Fab. instar tiga
dengan induk didapat dari kebun kubis di Desa Palintang, daun kubis (B. oleracea),
medium agar Potato Dextrose Agar, beras jagung, alkohol 70%, madu, minyak goreng,
spiritus, kertas tisu, kain kasa halus, kapas, aluminium foil, plastik wrap, plastik bening
tahan panas.
Alat yang digunakan adalah kotak pemeliharaan larva berukuran
20 x 15x 5 cm3, kotak pemeliharaan imago berukuran 40 x 25 x 25 cm3, kotak perlakuan
berukuran ø 7cm dan tinggi 4 cm, cawan petri, tabung reaksi, rak tabung reaksi, sumbat
tabung, volume pipet 10 ml, volume pipet 1 ml, volume pipet 0,1ml, pipet tetes,
haemositometer, autoklaf, pembakar bunsen, ose, timbangan analitik, pinset, spatula,
mikroskop, beaker glass, gelas ukur, erlenmeyer, batang pengaduk, termometer ruangan,
kamera digital, dan vorteks.
4.2. Metode Penelitian
Penelitian ini dilakukan dengan menggunakan metode eksperimental di
laboratorium. Rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap
RAL dengan faktor tunggal. Faktor perlakuan yang diujikan adalah konsentrasi spora
k jamur M. anisopliae yang terdiri dari enam taraf, sebagai berikut :
k1 : 105 spora/ml
k2 : 106 spora/ml
k3 : 107 spora/ml
k4 : 108 spora/ml
k5 : 109 spora/ml
Setiap perlakuan diulang (r) empat kali, sehingga jumlah keseluruhan satuan
percobaan adalah 24 plot percobaan. Setiap plot percobaan terdiri dari lima ekor larva
yang dipelihara secara berkelompok di dalam kotak perlakuan. Jumlah keseluruhan larva
yang diuji adalah 120 ekor. Parameter yang diukur adalah kematian (mortalitas dan
waktu kematian), berat badan (berat badan maksimum) dan konsumsi pakan larva
(konsumsi makanan total, dan konsumsi makanan relatif). Susunan kombinasi perlakuan
tertera pada Tabel 1.
Tabel 1. Data Pengamatan Tiap Parameter Perlakuan Perlakuan
Ulangan
k0 k1 k2 k3 k4 k5
Total
R1 r1 k0 r1 k1 r1 k2 r1 k3 r1 k4 r1 k5
R2 r2 k0 r2 k1 r2 k2 r2 k3 r2 k4 r2 k5
R3 r3 k0 r3 k1 r3 k2 r3 k3 r3 k4 r3 k5
R4 r4 k0 r4 k1 r4 k2 r4 k3 r4 k4 r4 k5
Total
N 4 4 4 4 4 4 24
Rata-rata
(Sumber : Sudjana, 1994)
n : banyak pengulangan
Tabel 2. Sidik Ragam Konsentrasi Terhadap Variabel Uji
Pengaruh perlakuan yang diberikan terhadap larva diketahui engan d
menggunakan uji F. Hipotesis dalam uji F adalah sebagai berikut :
Ho : Perlakuan tidak memberikan berpengaruh terhadap larva C. pavonana Fab.
H1 : Perlakuan memberikan pengaruh terhadap larva C. pavonana Fabricius.
Pengambilan keputusan terhadap uji F adalah sebagai berikut :
Jika F hit F tabel, maka Ho diterima
Jika F hit F tabel, maka H1 diterima
Selanjutnya bila dari uji F tersebut terdapat pengaruh yang nyata dari perlakuan yang
diberikan, maka dilakukan uji beda rata-rata dengan menggunakan Uji Jarak Berganda
Duncan.
4.3. Prosedur Penelitian
Prosedur penelitian meliputi pemeliharaan larva C. pavonana Fab., perbanyakan
jamur dalam medium PDA dan dalam medium beras jagung, serta pembuatan suspensi
4.3.1. Pemeliharaan Crocidolomia pavonana Fabricius
Larva C. pavonana Fab. didapat dari kebun kubis yang terdapat di Desa
Palintang, Kabupaten Bandung. Larva ini kemudian dipelihara hingga menjadi imago
dan dibiakkan dalam sebuah kotak kaca berukuran 40 x 25 x 25 cm3 yang di dalamnya
telah disediakan daun kubis yang ditaruh di dalam wadah berisi air untuk menjaga agar
daun tetap segar. Daun tersebut berfungsi sebagai tempat ngengat dewasa menyimpan
telur di bagian bawah daun. Pemberian pakan ngengat dewasa berupa madu dengan
konsentrasi 10% yang dibasahi pada kapas dan digantungkan di dalam kotak.
Setelah terlihat kelompok-kelompok telur pada permukaan daun, daun-daun
tersebut dipindahkan ke kotak plastik terpisah yang berukuran 20 x 15 x 5 cm3 dan diberi
alas kertas tisu. Setelah telur menetas, makanan larva selalu diperiksa dan diganti tiap
hari atau pada saat alas tisu pada tempat pemeliharaan telah lembab. Setiap instar
diletakkan pada tempat yang berbeda. Larva stadium pre pupa akan menghentikan
aktivitas makan dan bersiap-siap untuk membentuk pupa. Pupa berwarna coklat
kekuning-kuningan dan pada tahap akhir berwarna coklat tua. Pupa yang telah terbentuk
dipindahkan ke dalam kotak yang disiapkan untuk imago atau ngengat dewasa.
4.3.2. Perbanyakan Jamur Metarhizium anisopliae dalam Medium PDA
Isolat murni jamur M. anisopliae diperoleh dari Balai Proteksi Tanaman
Perkebunan, Bandung. Isolat murni jamur ini kemudian ditumbuhkan pada medium PDA
(Potato Dextrose Agar) dalam bentuk agar plat sebagai sediaan jamur dan diinkubasikan
terhadap pertumbuhan jamur dalam medium PDA dimulai dari muncul hifa hingga
terbentuk spora. Pengamatan dilakukan setiap 24 jam sekali.
4.3.3. Perbanyakan Jamur Metarhizium anisopliae dalam Medium Beras Jagung
Isolat murni jamur M. anisopliae diperoleh dari Balai Proteksi Tanaman
Perkebunan, Bandung. Isolat jamur tersebut diperbanyak dalam medium beras jagung.
Beras jagung dibersihkan dari kotoran dan ampas, kemudian dicuci bersih. Beras jagung
yang telah dibersihkan, dimasak atau dikukus hingga lunak, kurang lebih selama 20
menit. Setelah masak, beras jagung tersebut didinginkan, kemudian dimasukkan ke
dalam kantung plastik tahan panas sebanyak 100 g. Beras jagung dalam kantung plastik
tersebut kemudian disterilkan di dalam autoklaf pada suhu 121oC selama 20 menit.
Setelah dibiarkan dingin, kurang lebih selama 24 jam, isolat jamur ditanamkan pada
medium beras jagung tersebut, kemudian pertumbuhan jamur dalam medium diamati
setiap hari hingga terbentuk spora. Koloni jamur akan tumbuh dua minggu setelah
inokulasi. Pada hari keenam akan tumbuh hifa berwarna putih, selanjutnya pada hari
ke-14 mulai tumbuh spora berwarna hijau. Setelah spora berwarna hijau terbentuk, jamur
siap digunakan untuk pengujian terhadap larva serangga Debora, 2005.
4.3.4. Pembuatan Suspensi Spora Metarhizium anisopliae
Pembuatan suspensi spora jamur M. anisopliae dilakukan dengan menimbang 1 g
medium beras jagung yang telah ditumbuhi spora jamur, lalu ditambahkan minyak
goreng hingga mencapai volume 5ml. Medium beras jagung berspora tersebut harus
sehingga agar spora dapat tersuspensi dengan baik dan melekat kuat maka digunakan
minyak goreng sebagai pelarut. Metode pelarutan menggunakan minyak mengacu
kepada penelitian yang dilakukan oleh Devi dan Prasad, (1996), yang menggunakan
minyak dari ekstrak beberapa jenis tumbuhan. Campuran jagung dan minyak tersebut
diputar dengan menggunakan vorteks agar spora jamur terlepas dari jagung. Selanjutnya
dilakukan pengenceran suspensi spora sampai tingkat pengenceran mencapai 10-3.
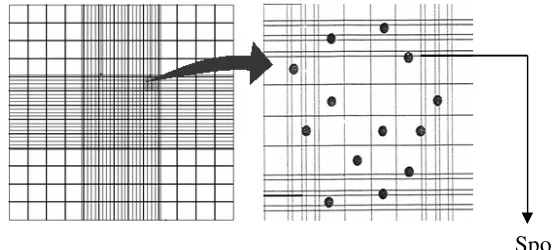
Penghitungan spora dilakukan dengan menggunakan haemositometer di bawah
mikroskop binokuler dengan perbesaran 400 kali Debora, 2005.
S adalah jumlah spora yang dihitung, t adalah jumlah spora yang diketahui, d adalah tingkat pengenceran, n adalah jumlah kotak yang dihitung dan 0,25 adalah tingkat korelasi.
Gambar 3. (a) Kamar hitung pada hemositometer dan (b) Satu buah kamar hitung pada hemositometer (Caprette, 2006).
n d t S
25 , 0
106
Suspensi spora yang telah diketahui jumlahnya kemudian distandarisasi agar
memiliki konsentrasi 1 x 109 spora/ml. Larutan ini disebut sebagai larutan stok yang
digunakan pada seluruh penelitian. Standarisasi dilakukan dengan menggunakan rumus :
K adalah volume konsentrasi spora yang dibutuhkan (ml), P adalah volume pelarut yang ditambahkan (ml), a adalah konsentrasi lautan stok dan b adalah jumlah spora yang diinginkan (109 spora/ml).
Tingkat konsentrasi lain yang digunakan dalam penelitian yaitu
105 spora/ml, 106 spora/ml, 107 spora/ml, 108 spora/ml diperoleh dengan mengencerkan
larutan stok. Pengenceran dilakukan menggunakan rumus :
V1 adalah volume larutan stok (ml), N1 adalah konsentrasi larutan stok (spora/ml), V2 adalah volume larutan yang diharapkan (ml) dan N2 adalah konsentrasi larutan yang diharapkan (spora/ml).
4.4. Pelaksanaan Penelitian
Hal yang pertama dilakukan adalah menyiapkan tempat perlakuan berupa kotak
pada larva C. pavonana Fab. dengan cara diteteskan langsung ke atas tubuh larva.
Metode tetes langsung ini merupakan modifikasi dari metode yang digunakan Milner,
(1994). Suspensi spora diteteskan dengan menggunakaan volume pipet berukuran 1 ml.
Masing-masing larva ditetesi 0,05 ml suspensi spora. Larva C. pavonana Fab. tersebut
diamati sampai mati atau menjadi imago. Masing-masing perlakuan menggunakan lima
ekor larva instar tiga dan dilakukan empat kali ulangan. Pengukuran parameter fisik
meliputi suhu tempat perlakuan. Pengamatan terhadap larva C. pavonana Fab. yang
diinfeksi oleh berbagai konsentrasi spora jamur M. anisopliae dilakukan setiap hari.
4.5. Parameter yang Diukur
Parameter yang diukur pada penelitian ini adalah kematian, berat badan dan
konsumsi pakan larva C. pavonana Fab. yang diuraikan pada subbab berikut.
4.5.1 Kematian Larva Crocidolomia pavonana Fabricius
Pengamatan terhadap kematian larva C. pavonana Fab. meliputi mortalitas dan
waktu kematian larva. Mortalitas merupakan parameter pengukuran terhadap banyaknya
larva C. pavonana Fab. yang mati akibat infeksi oleh jamur M. anisopliae. Mortalitas
juga dapat digunakan untuk mengetahui efektivitas jamur ini dalam mengendalikan
serangga hama C. pavonana Fab. Larva yang mati akibat terinfeksi jamur M. anisopliae
memperlihatkan tanda berupa tubuh larva ditumbuhi oleh hifa jamur berwarna putih yang
diikuti dengan tumbuhnya spora jamur berwarna hijau. Hifa tersebut membungkus tubuh
Persentase mortalitas larva C. pavonana Fab. dihitung dengan menggunakan
rumus perhitungan sebagai berikut :
M adalah mortalitas (%), n adalah jumlah larva yang mati karena jamur (ekor), dan N adalah jumlah larva yang diuji (ekor).
Pengamatan terhadap waktu kematian larva dilakukan dengan menghitung jumlah
larva yang mati setiap hari pengamatan. Perhitungan waktu kematian menggunakan
rumus sebagai berikut :
W adalah waktu kematian, a adalah banyaknya larva yang mati pada hari infeksi, b adalah hari pada saat larva mati, dan n adalah banyaknya larva yang mati tiap
perlakuan.
4.5.2. Berat Badan Larva Crocidolomia pavonana Fabricius
Pengamatan terhadap berat badan larva bertujuan untuk mengetahui pertumbuhan larva
C. pavonana Fab., meliputi pengamatan terhadap berat badan maksimum. Pengamatan
dilakukan dengan cara menimbang larva C. pavonana Fab. setiap hari, dari saat larva diinfeksi hingga larva mati atau menjadi pupa. Larva C pavonana Fab. ditimbang dengan
Fab. dilakukan dengan merata-ratakan berat badan maksimum larva uji pada setiap
konsentrasi.
4.5.3. Konsumsi Pakan Larva Crocidolomia pavonana Fabricius
Pengamatan terhadap konsumsi pakan bertujuan untuk mengetahui jumlah pakan
yang dikonsumsi oleh larva C. pavonana Fab. normal dan larva yang diinfeksi spora
jamur. Pengamatan terhadap konsumsi pakan larva C. pavonana Fab. meliputi konsumsi
pakan total dan konsumsi pakan relatif.
Konsumsi pakan larva C. pavonana Fab. yang telah diinfeksi dihitung
berdasarkan berat kering pakan, untuk menghindari perbedaan kadar air. Berat kering
makanan diperoleh dengan cara membuat potongan daun kubis berjumlah 50 potongan
yang diberi nomor berurutan. Kemudian masing-masing potongan daun kubis tersebut
ditimbang dan diperoleh data berat basah awal. Setelah ditimbang, potongan daun-daun
tersebut dikeringkan di dalam oven dengan suhu 75oC selama 72 jam. Daun yang telah
dikeringkan tersebut ditimbang kembali dan diperoleh berat kering daun. Dari data yang
diperoleh, dapat dihitung kadar berat kering PBK dengan menggunakan rumus sebagai
berikut :
PBK adalah persentase berat kering pakan (%), BK adalah berat kering pakan (g) dan BB adalah berat basah pakan (g).
Tata kerja perhitungan konsumsi pakan adalah potongan daun kubis yang akan
diberikan pada larva C. pavonana Fab. yang telah diinfeksi oleh jamur M. anisopliae %
100 BB BK
ditimbang untuk diperoleh berat basah awal. Satu hari setelah pemberian pakan 24 jam,
sisa daun kubis yang tidak dimakan oleh larva C. pavonana Fab. ditimbang. Dari data
berat daun kubis tersebut kemudian dihitung konsumsi pakan larva C. pavonana Fab.
dengan cara :
KMT adalahkonsumsi pakan total (g BK/ekor), BBi adalah berat basah pakan pada hari
ke-i (g), % BK adalah persentase berat kering pakan, dan BKS adalahberat kering pakan sisa (g).
KMReladalah konsumsi pakan relatif (g BK/g berat badan/hari), dan j adalah jumlah hari.
BAB V HASIL PEMBAHASAN
5.1. Tingkat Kematian Larva Crocidolomia pavonana Fabricius
Tingkat kematian larva C. pavonana Fab. merupakan parameter pengukuran
terhadap jumlah larva uji yang mati akibat infeksi jamur M. anisopliae. Hasil perhitungan
tingkat kematian larva dapat digunakan untuk mengetahui efektivitas jamur M. anisopliae
dalam mengendalikan populasi serangga hama C. pavonana Fab. Pada penelitian ini
beberapa tingkat konsentrasi spora jamur M. anisopliae diinfeksikan pada larva serangga
C. pavonana Fab. instar tiga. Konsentrasi spora yang digunakan adalah 105 spora/ml, 106
spora/ml, 107 spora/ml, 108 spora/ml dan 109 spora/ml. Hasil penelitian menunjukkan
bahwa infeksi spora jamur M. anisopliae pada berbagai konsentrasi tersebut
menyebabkan mortalitas pada larva C. pavonana Fab. dengan rentang 75% – 95%.
Hasil uji statistik (Sidik Ragam) menunjukkan bahwa infeksi dengan rentang
konsentrasi 105 – 109 spora/ml berpengaruh terhadap mortalitas larva C. pavonana Fab.
Adapun untuk mengetahui perbedaan persentase mortalitas antara larva normal dan larva
yang diinfeksi, maka dilakukan analisis Sidik Ragam yang ditampilkan pada Tabel 3.
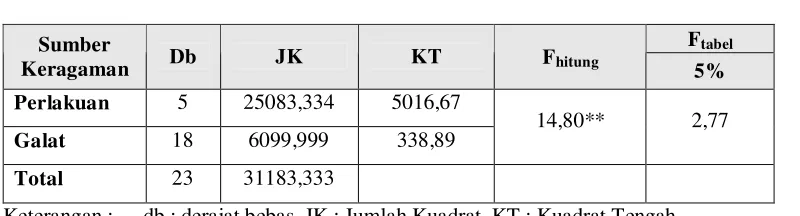
Tabel 3. Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur M. anisopliae Menurut Konsentrasi Terhadap Mortalitas Larva C. pavonana Fab.
Ftabel
Sumber
Keragaman Db JK KT Fhitung 5%
Perlakuan 5 25083,334 5016,67
Galat 18 6099,999 338,89 14,80** 2,77
Total 23 31183,333
Keterangan : db : derajat bebas, JK : Jumlah Kuadrat, KT : Kuadrat Tengah, * : berbeda nyata pada α 5%, ** : berbeda sangat nyata pada α 5%,
tn
Meskipun terdapat perbedaan yang nyata antara persentase mortalitas larva
normal dan larva yang diinfeksi spora jamur, namun hasil uji jarak berganda Duncan
(pada taraf nyata 5%) menunjukkan tidak ada pengaruh dari tiap-tiap konsentrasi yang
diinfeksikan terhadap mortalitas larva. Data penelitian tentang pengaruh infeksi spora
jamur terhadap larva C. pavonana Fab. pada berbagai tingkat konsentrasi dapat dilihat
pada Gambar 4.
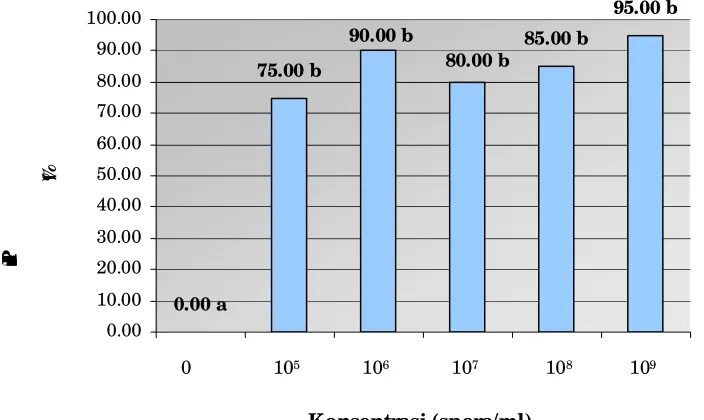
Gambar 4. Diagram persentase mortalitas larva C. pavonana Fab. akibat infeksi spora jamur M. anisopliae pada berbagai tingkat konsentrasi
Pada Gambar 4, terlihat bahwa persentase mortalitas tertinggi larva C. pavonana
Fab. yang diinfeksi spora jamur M. anisopliae adalah pada konsentrasi 109 spora/ml,
yaitu sebesar 95%. Nilai persentase mortalitas ini paling tinggi dibandingkan dengan
Banyaknya jumlah spora yang menginfeksi mengakibatkan tubuh larva tidak
mampu bertahan dari serangan patogen. Semakin banyak spora yang melekat pada
kutikula larva serangga, maka semakin banyak pula spora yang melakukan penetrasi
terhadap kutikula tersebut. Semakin banyak larva yang mati, maka akan meningkatkan
persentase tingkat kematian.
Hasil penelitian ini memperlihatkan bahwa terjadi kenaikan mortalitas larva yang
diinfeksi spora jamur seiring dengan semakin tinggi tingkat konsentrasi spora. Hal ini
sejalan dengan penelitian yang dilakukan oleh Prayogo dan Tengkano, (2004), terhadap
Spodoptera litura. Konsentrasi spora jamur yang digunakan adalah 104 – 108 spora/ml
dengan mortalitas larva berturut-turut pada hari kedelapan setelah aplikasi adalah
44,33%, 54%, 60%, 79% dan 70,67%. Pada penelitian tersebut diketahui bahwa
semakin tinggi konsentrasi spora jamur M. anisopliae yang diinfeksikan, maka semakin
tinggi pula mortalitas S. litura.
Pada stadium pre pupa, larva yang diinfeksi spora jamur banyak yang mengalami
kematian. Hal ini diperjelas oleh data pengamatan rata-rata waktu kematian larva yang
diinfeksi spora jamur. Banyak larva yang mati pada saat pre pupa dikarenakan pada
stadium ini pertahanan larva terhadap serangan jamur cenderung rendah, selain itu pada
masa ini pula spora jamur yang telah berhasil melakukan penetrasi mulai berkembang di
dalam tubuh larva. Akibatnya banyak larva yang mati pada stadium pre pupa dan
meskipun larva tersebut berhasil menjadi pupa, maka pupa yang terbentuk pun tidak akan
membentuk imago. Pupa yang tidak berhasil menjadi imago berwarna coklat gelap,
keriput dan kering. Ada pula larva yang terinfeksi yang berhasil membentuk pupa dan
Keberhasilan proses infeksi bergantung pada kondisi lingkungan, seperti
kelembaban dan suhu. Suhu pada waktu infeksi berkisar antara 23oC – 25oC. Kisaran
suhu ini masih berada pada kisaran suhu optimum pertumbuhan jamur M. anisopliae
yaitu pada suhu 22oC – 27oC (Prayogo, et al., 2005; Burgner, 1998). Selain itu, faktor
lain yang berpengaruh adalah faktor ganti kulit (molting) pada serangga (Prayogo, et al.,
2005).
Larva serangga C. pavonana Fab. yang mati disebabkan oleh jamur ditandai
dengan tubuh lunak dan memiliki integumen yang rapuh. Hal ini disebabkan spora jamur
yang melekat pada kutikula larva telah berhasil melakukan penetrasi. Spora yang melekat
pada kutikula berkecambah membentuk hifa penetrasi. Hifa penetrasi menghasilkan
sejumlah enzim diantaranya, enzim lipase, protease dan kitinase yang mampu
mendegradasai kutikula. Selanjutnya, spora akan berkembang di dalam hemocoel dengan
menyerap hemolimf dan menghasilkan destruksin yang dapat mengakibatkan kematian
larva. Beberapa hari setelah larva mati, tubuh larva mulai mengeras dan kaku. Hal ini
dikarenakan seluruh tubuh larva diselimuti oleh miselium (Prayogo, et al., 2005).
Selain mengeras, tubuh larva juga berubah menjadi hitam. Perubahan warna
hitam yang terjadi pada tubuh larva disebabkan oleh proses melanisasi yang merupakan
suatu bentuk pertahanan tubuh serangga melawan patogen (Boucias dan Pendland, 1998).
Perubahan warna hitam atau melanisasi tersebut akibat dari aktivitas enzim
phenoloksidase. Enzim ini diketahui berperan dalam proses penyembuhan luka,
sklerotisasi kutikula, dan berperan dalam proses melanisasi terhadap benda asing yang
Mekanisme melanisasi diawali dengan hemosit mengenali benda asing berupa sel
jamur yang masuk ke dalam hemocoel. Hemosit secara aktif berkumpul dan mengelilingi
permukaan sel jamur membentuk kapsul (proses ini disebut enkapsulasi). Kapsul
tersebut menghambat pertumbuhan dan pergerakan sel jamur, serta mengisolasi sel jamur
tersebut agar tidak menginfeksi jaringan lain. Sel jamur yang masuk ke dalam hemocoel
sekaligus mengaktifkan prophenoloksidase (proPO). Prophenoloksidase (proPO)
membentuk phenoloksidase yang merupakan katalis dalam pembentukan melanin.
Melanin yang dibentuk bersifat racun bagi sel jamur, sehingga menghambat
perkembangan sel jamur. Saat proses melanisasi, terjadi reaksi oksidasi yang
menyebabkan sel jamur mati. Namun demikian, jamur juga memiliki pertahanan
tersendiri untuk melawan sistem pertahanan serangga. Pertahanan jamur dilakukan
dengan membentuk blastospora yang dapat bermultiplikasi dan menyebar dengan cepat
ke seluruh tubuh larva (Tanada dan Kaya, 1993). Hal tersebut tidak dapat diantisipasi
oleh sistem pertahanan tubuh larva, sehingga larva tetap mengalami kematian.
Pada hari ketiga setelah larva mati, dari tubuh larva tersebut muncul hifa
berwarna putih membentuk jalinan hifa yang disebut miselium. Selanjutnya, sekitar tiga
hari setelah muncul hifa, tumbuh spora berwarna hijau menutupi permukan tubuh larva.
Boucias dan Pendland, (1998), menyatakan bahwa pada rayap, proses penetrasi hifa
hanya memerlukan waktu 48 jam (2 hari). Hifa mulai menyerang badan lemak sekitar 72
jam (3 hari) setelah serangga mati. Sekitar 96 jam (4 hari), padatan hifa atau miselium
berkembang melalui lubang tubuh dan mulai tumbuh pada permukaan serangga. Pada
umumnya hifa tumbuh ke luar permukaan serangga melalui spirakel, mulut dan membran
5.2.Waktu Kematian Larva Crocidolomia pavonana Fabricius
Waktu kematian merupakan waktu yang menunjukkan saat larva yang diinfeksi
jamur mati. Pengamatan dilakukan dengan menjumlahkan hari yang terdapat larva mati
dibagi dengan jumlah total larva yang mati. Pengamatan terhadap waktu kematian
digunakan untuk mengetahui tingkat virulensi jamur M. anisopliae yang dapat
membunuh larva C. pavonana Fab.
Hasil uji statistik (Sidik Ragam) menunjukkan bahwa konsentrasi spora jamur
yang diinfeksikan memberikan pengaruh terhadap rata-rata waktu kematian larva. Hal ini
berarti bahwa infeksi spora jamur terhadap larva C. pavonana Fab. dapat mempercepat
waktu kematian larva dibandingkan dengan larva normal. Akan tetapi, pemberian
konsentrasi spora pada rentang 105 – 109 spora/ml tidak berpengaruh terhadap rata-rata
waktu kematian. Analisis statistik (Sidik Ragam) mengenai pengaruh infeksi konsentrasi
spora jamur terhadap waktu kematian larva dapat dilihat pada Tabel 4.
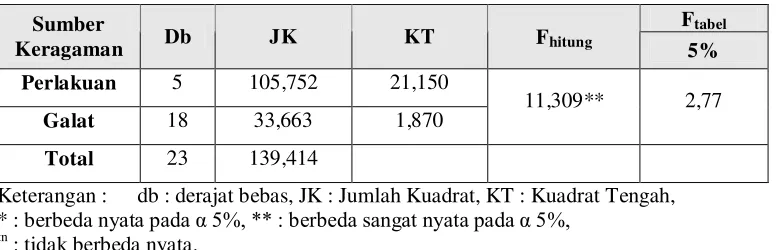
Tabel 4. Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur M. anisopliae Menurut Konsentrasi Terhadap Waktu Kematian Larva C. pavonana Fab.
Meskipun terdapat perbedaan yang nyata antara waktu kematian larva normal dan
4,66
nyata 5%) menunjukkan tidak ada pengaruh dari tiap-tiap konsentrasi yang diinfeksikan
terhadap waktu kematian larva. Data hasil perhitungan waktu kematian larva
C. pavonana Fab. akibat infeksi spora jamur M. anisopliae dapat dilihat pada Gambar 5.
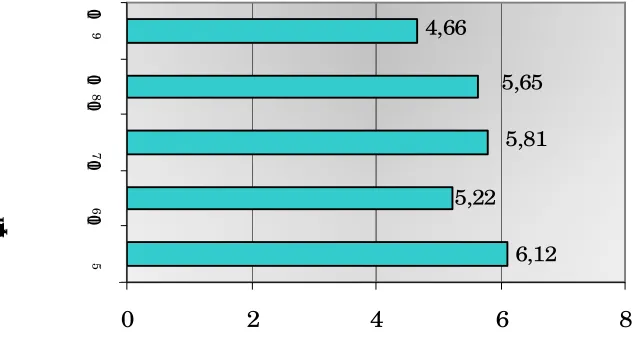
Gambar 5. Diagram rata-rata waktu kematian larva C. pavonana Fab. yang diinfeksi oleh spora jamur M. anisopliae pada berbagai tingkat konsentrasi
Secara keseluruhan, rata-rata waktu kematian larva yang diinfeksi spora jamur adalah
antara hari keempat hingga hari keenam setelah infeksi.
Hasil pengamatan memperlihatkan bahwa infeksi spora jamur M. anisopliae dapat
jamur memiliki tingkat virulensi yang tinggi sehingga menyebabkan kematian pada larva.
Semakin tinggi konsentrasi yang diinfeksikan akan lebih mempercepat waktu kematian.
Hal ini sesuai dengan penelitian Boucias dan Pendland, (1998), yang menyatakan bahwa
semakin tinggi konsentrasi spora yang diinfeksikan, maka semakin tinggi peluang kontak
antara patogen dengan inang. Semakin tinggi serangan tersebut, maka proses kematian
larva yang terinfeksi akan semakin cepat. Kecepatan kematian larva juga disebabkan
oleh kerusakan pada usus akibat toksin yang dikeluarkan oleh jamur (Brousseau et al.,
1996).
Konsentrasi antara 105 – 108 spora/ml, mengakibatkan rata-rata waktu kematian
yang hampir sama. Hal ini dapat disebabkan tingkat virulensi spora pada masing-masing
konsentrasi relatif sama. Waktu kematian juga bergantung pada tingkat konsentrasi spora
jamur yang diinfeksikan. Menurut Kershaw et al., (1999), pada konsentrasi yang relatif
rendah, serangga yang terinfeksi dapat bertahan hidup, namum gagal mengalami
pembentukkan pupa dan secara perlahan mengalami kematian.
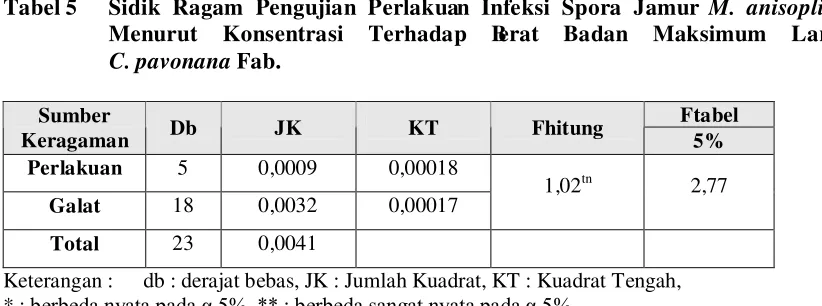
5.3. Berat Badan Maksimum Larva Crocidolomia pavonana Fabricius
Pengamatan terhadap berat badan larva dilakukan untuk mengetahui pola
pertumbuhan larva C. pavonana Fab. normal dan yang diinfeksi, meliputi pengamatan
terhadap berat badan maksimum larva. Berat badan maksimum merupakan rata-rata berat
badan tertinggi larva selama waktu setelah infeksi hingga larva membentuk pupa atau
larva mati. Hasil uji statistik menunjukkan bahwa infeksi spora jamur M. anisopliae
0.059 0.054
Analisis statistik mengenai pengaruh infeksi konsentrasi spora jamur terhadap berat
badan maksimum larva dapat dilihat pada Tabel 5.
Tabel 5 Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur M. anisopliae
Hasil perhitungan menunjukkan bahwa berat badan maksimum larva yang
diinfeksi lebih rendah daripada berat badan maksimum larva normal. Data hasil
perhitungan dapat dilihat pada Gambar 6.
Pada Gambar 6, berat badan maksimum larva C. pavonana Fab. normal lebih
tinggi dibandingkan dengan larva yang diinfeksi spora jamur, yaitu sebesar 0,059 g.
Larva yang diinfeksi spora jamur dengan rentang konsentrasi 105 – 109 spora/ml,
menghasilkan berat badan maksimum berturut-turut sebesar 0,045 g, 0,040 g, 0,047 g,
0,049 g, dan 0,054 g. Hasil pengamatan ini menunjukkan bahwa berat badan maksimum
larva C. pavonana Fab. yang diinfeksi spora jamur lebih rendah dibanding dengan larva
normal. Hal ini disebabkan jamur yang menginfeksi tubuh larva telah berkembang di
dalam tubuh larva dengan menyerap hemolimf (Prayogo, et al., 2005). Pada larva
normal, berat badan maksimum terjadi pada hari keempat, sedangkan rata-rata berat
badan maksimum larva yang diinfeksi terjadi pada hari kelima dan keenam setelah
infeksi.
Jamur yang berada di dalam tubuh larva mulai melakukan invasi dengan
menyerap cairan tubuh serangga atau hemolimf yang digunakan untuk perkembangan
jamur. Selain itu, hifa jamur yang telah mencapai hemocoel mengeluarkan suatu toksin
yaitu destruksin yang dapat menyebabkan kerusakan jaringan tubuh larva antara lain
kerusakan pada jaringan usus (Kershaw et. al., 1999).
5.4. Konsumsi Pakan Larva Crocidolomia pavonana Fabricius yang Diinfeksi Spora Jamur Metarhizium anisopliae
Makanan yang dikonsumsi berperan penting bagi pertumbuhan dan
perkembangan larva. Pada penelitian ini, larva yang diinfeksi spora jamur tetap
melakukan aktivitas makan. Pengamatan terhadap konsumsi pakan meliputi konsumsi
berat kering pakan sisa setiap hari. Pola konsumsi pakan larva C. pavonana Fab. normal
dan yang diinfeksi spora jamur M. anisopliae dapat dilihat pada Gambar 7.
Gambar 7. Diagram rata-rata konsumsi pakan larva C. pavonana Fab. yang diinfeksi spora jamur M. anisopliae.
Pada Gambar 7, terlihat bahwa pola konsumsi pakan larva C. pavonana Fab.
normal meningkat sejalan dengan pertambahan usia larva dan mengalami penurunan
ketika larva memasuki stadium pre pupa. Konsumsi pakan larva C. pavonana Fab.
normal pada awal instar tiga adalah 0,0049 g. Konsumsi pakan larva akan mengalami
peningkatan hingga hari ketiga dan menurun pada hari keempat. Pada hari kelima, larva
sudah tidak melakukan aktivitas makan karena larva telah memasuki stadium pre pupa.
Pada larva yang diinfeksi spora jamur M. anisopliae, pola konsumsi pakan larva
hampir sama dengan pola konsumsi makanan larva normal. Rata-rata konsumsi pakan
awal larva yang diinfeksi spora jamur lebih tinggi dibandingkan dengan konsumsi pakan
diinfeksi spora dengan konsentrasi 108 dan 109 spora/ml, peningkatan konsumsi pakan
terjadi hingga hari ketiga dan mulai mengalami penurunan pada hari keempat.
Larva normal mulai menghentikan aktivitas makan pada hari keenam, karena
pada hari tersebut larva telah memasuki stadium pre pupa. Larva yang diinfeksi spora
jamur mengalami waktu hidup larva yang lebih lama. Larva-larva tersebut menghentikan
aktivitas makan pada hari kedelapan dan hari kesembilan. Waktu hidup larva yang lebih
lama mengakibatkan konsumsi pakan larva yang diinfeksi spora jamur lebih tinggi
dibandingkan dengan konsumsi pakan larva normal.
Konsumsi pakan total adalah jumlah pakan yang dikonsumsi oleh larva sepanjang
hidupnya. Pada penelitian ini, pengamatan konsumsi pakan total dilakukan saat setelah
infeksi hingga larva membentuk pupa atau larva mati. Hasil uji statistik (Sidik Ragam),
menunjukkan bahwa konsentrasi spora yang diinfeksikan pada tubuh larva tidak
berpengaruh terhadap konsumsi pakan total. Analisis statistik (Sidik Ragam) mengenai
pengaruh infeksi konsentrasi spora jamur terhadap konsumsi pakan total larva dapat
0.038
Meskipun hasil analisis statistik pada Tabel 6., menunjukkan tidak adanya
pengaruh infeksi apora jamur terhadap konsumsi pakan total larva, namun hasil
perhitungan menunjukkan bahwa konsumsi pakan total larva C. pavonana Fab. yang
diinfeksi spora jamur lebih tinggi dibandingkan dengan larva normal. Pengamatan
terhadap konsumsi pakan total larva C. pavonana Fab. dapat dilihat pada Gambar 8.
Gambar 8. Diagram rata-rata konsumsi pakan total larva C. pavonana Fab. yang diinfeksi spora jamur M. anisopliae pada berbagai tingkat konsentrasi.
Gambar 8, memperlihatkan bahwa larva yang diinfeksi spora jamur mengalami
peningkatan aktivitas makan dibandingkan dengan larva normal. Konsumsi pakan total
larva C. pavonana Fab. normal sebesar 0,038 g BK/ekor, sedangkan konsumsi pakan
total larva yang diinfeksi spora jamur dengan rentang konsentrasi 105 – 109 spora/ml
masing-masing sebesar 0,063 g BK/ekor, 0,051 g BK/ekor, 0,068 g BK/ekor, 0,075 g
BK/ekor, dan 0,061 g BK/ekor. Peningkatan konsumsi pakan total disebabkan larva yang
diinfeksi spora jamur mengalami masa hidup yang lebih lama dibandingkan dengan larva
konsumsi pakan larva yang diinfeksi spora jamur lebih tinggi. Lama hidup larva normal
dari awal instar tiga hingga prepupa sekitar empat sampai lima hari, sedangkan lama
hidup larva yang diinfeksi dari awal instar tiga hingga prepupa berlangsung sekitar lima
sampai enam hari.
Pada larva normal, konsumsi pakan bertujuan untuk mengumpulkan energi bagi
larva menuju stadium pembentukkan pupa. Pada larva yang diinfeksi, konsumsi pakan
larva lebih tinggi dibandingkan konsumsi pakan larva normal. Hal ini disebabkan nutrisi
yang didapat dari makanan seharusnya digunakan untuk pertumbuhan larva, namun
digunakan oleh jamur untuk melakukan perkembangan di dalam tubuh larva.
Peningkatan konsumsi pakan dapat pula diindikasikan sebagai usaha larva tersebut
melawan patogen dengan cara meningkatkan konsumsi pakan untuk menambah jumlah
hemolimf dalam tubuh yang berperan dalam sistem pertahanan tubuh larva. Peningkatan
konsumsi pakan larva secara lebih jelas dihitung dalam bentuk persentase seperti dapat
dilihat pada Gambar 9.
Gambar 9. Diagram persentase peningkatan konsumsi pakan larva C. pavonana Fab. yang diinfeksi spora jamur M. anisopliae terhadap larva normal.
Pada Gambar 9, terlihat bahwa konsumsi pakan larva C. pavonana Fab. yang
diinfeksi spora jamur dengan rentang konsentrasi 105 – 109 spora/ml mengalami
peningkatan berturut-turut sebesar 39,81%, 25,91%, 43,92%, 49,66% dan 37,63%.
Persentase peningkatan konsumsi pakan tertinggi terjadi pada larva yang diinfeksi spora
jamur dengan konsentrasi 108 spora/ml, yaitu sebesar 49,66%.
5.5. Konsumsi Pakan Relatif Larva Crocidolomia pavonana Fabricius
Konsumsi pakan relatif adalah jumlah bahan kering pakan yang dikonsumsi tiap
berat badan individu hewan percobaan. Uji statistik (Sidik Ragam) menunjukkan infeksi
spora jamur M. anisopliae tidak berpengaruh terhadap konsumsi pakan relatif larva
C. pavonana Fab. Analisis statistik mengenai pengaruh infeksi konsentrasi spora jamur
terhadap konsumsi makanan relatif larva dapat dilihat pada Tabel 7.
Tabel 7. Sidik Ragam Pengujian Perlakuan Infeksi Spora Jamur M. anisopliae
Meskipun hasil analisis statistik pada Tabel 7 menunjukkan tidak adanya
pengaruh infeksi apora jamur terhadap konsumsi pakan relatif larva, namun hasil
0.305
diinfeksi spora jamur lebih tinggi dibandingkan dengan larva normal. Hasil perhitungan
konsumsi pakan relatif dapat dilihat pada Gambar 10.
Gambar 10. Diagram rata-rata konsumsi pakan relatif larva C. pavonana Fab. yang diinfeksi spora jamur M. anisopliae pada berbagai tingkat konsentrasi
Pada Gambar 10, terlihat bahwa larva C. pavonana Fab. yang diinfeksi spora
jamur M. anisopliae menunjukkan konsumsi pakan relatif yang lebih tinggi dibandingkan
dengan larva normal. Konsumsi pakan relatif larva normal sebesar 0,144 gBK/g Berat
Badan/ekor, sedangkan konsumsi pakan relatif pada larva yang diinfeksi spora jamur
dengan rentang konsentrasi 105 – 109 spora/ml masing-masingsebesar 0,321 gBK/ gBerat
Badan/ekor, 0,0300 gBK/gBerat Badan/ekor, 0,304 gBK/gBerat Badan/ekor,
0,314 gBK/gBerat Badan/ekor, dan 0,305 gBK/gBerat Badan/ekor.
Peningkatan konsumsi pakan relatif larva yang diinfeksi diduga disebabkan oleh
menurunnya pertambahan berat badan larva yang diinfeksi spora jamur M. anisopliae.
akan semakin tinggi. Hal ini terlihat jelas pada hasil pengamatan. Pertambahan berat
badan larva yang diinfeksi lebih rendah dibandingkan dengan berat badan larva normal,
sehingga berpengaruh pada nilai konsumsi pakan relatif larva. Oleh karena itu, konsumsi
pakan larva yang diinfeksi lebih tinggi dibanding dengan larva yang tidak diinfeksi.
Hasil penelitian ini berbeda dengan pernyataan Tanada dan Kaya, (1993), yang
BAB VI KESIMPULAN DAN SARAN
6.1. Kesimpulan
Berdasarkan hasil penelitian, dapat ditarik kesimpulan sebagai berikut :
1. Hasil uji statistik (Sidik Ragam) menunjukkan bahwa infeksi spora jamur
M. anisopliae berpengaruh terhadap mortalitas dan waktu kematian larva. Mortalitas
larva yang diinfeksi spora jamur pada rentang konsentrasi 105 – 109 spora/ml adalah
75% – 95%, sedangkan waktu kematian larva yang diinfeksi berkisar antara 4,66 –
6,13 hari.
2. Hasil uji statistik (Sidik Ragam) menunjukkan bahwa infeksi spora jamur
M. anisopliae tidak berpengaruh terhadap berat badan larva C. pavonana Fab. Berat
badan maksimum larva C. pavonana Fab. normal sebesar 0,059 g, sedangkan berat
badan maksimum larva yang diinfeksi spora jamur dengan rentang konsentrasi
konsentrasi 105 - 109 spora/ml, berturut-turut sebesar 0,045 g, 0,040 g, 0,047 g, 0,049
g, dan 0,054 g.
3. Hasil uji statistik (Sidik Ragam) menunjukkan bahwa infeksi spora jamur
M. anisopliae tidak berpengaruh terhadap konsumsi pakan larva C. pavonana Fab.
Konsumsi pakan total larva C. pavonana Fab. normal sebesar 0,038 g BK/ekor,
sedangkan konsumsi pakan total larva yang diinfeksi spora jamur dengan rentang
konsentrasi 105 – 109 spora/ml masing-masing sebesar 0,063 g BK/ekor, 0,051 g
6.2. Saran
Berdasarkan penelitian ini, perlu dilakukan penelitian lebih lanjut terhadap larva
yang berhasil lolos membentuk imago atau pada generasi berikut. Aplikasi spora jamur
M. anisopliae terhadap larva C. pavonana Fab. di lapangan juga perlu diteliti lebih lanjut.
Perlu dilakukan penelitian mengenai LC50 untuk mengetahui rentang konsentrasi yang
akan digunakan dalam uji. Perlu dilakukan pula aplikasi spora jamur terhadap berbagai
umur larva. Selain itu juga perlu dilakukan analisis mengenai dampak penggunaan spora
DAFTAR PUSTAKA
Alexopoulous, C.J., C.W. Mims, and M. Blackwel. 1996. Introductory Mycology. Jhon Willey & Sons Inc. New York.
Baehaki, S.E. dan Noviyanti. 1993. Pengaruh umur biakan Metarhizium anisopliae strain lokal Sukamandi terhadap perkembangan wereng coklat. hlm.113−124. Dalam E. Martono, E. Mahrub, N.S. Putra, dan Y. Trisetyawati (Ed.). Simposium Patologi Serangga I. Universitas Gadjah Mada, Yogyakarta, 12−13 Oktober 1993.
Boucias, D. G. and J. C. Pendland. 1998. Principles of Insect Pathology. Kluwer Academic Publisher. London.
Brousseau, C, G. Charpentier, and S. Belloncik. 1996. Susseptibility of Spruce Budworm, Choristoneura fumiferana Clemens, to Destruxins, Cyclodepsipeptidic Mycotoxin of Metarhizium anisopliae. Journal of Invertebrata Pathology 68 : 180-182.
Burgner, D., G. Eagles., M. Burgess, P. Procopis, M. Rogers, D. Muir, R. Pritchard, A. Hocking and M. Priest. 1998. Disseminated Invasive Infection Due to Metarrhizium anisopliae in an Immunocompromised Child. Journal of Clinical Microbiology. 1146-1150.
Caprette, D.R. 2007. Using a Counting Chamber. http://www.ruf.rice.edu/~ bioslabs/methods/microscopy/cellcounting.html. Diakses 25 Februari 2007.
Chamdler, D., J.B. Heale, and A.T. Gillespie. 1993. Germination of entomopathogenic fungus Verticillium lecanii on scales of the glasshouse whitefly Trialeurodes vaporariorum. Biology Science Technology 3 : 161−164.
Charnley, Keith. 2006. Fungal pathogens of insects: from mechanisms of pathogenicity to host defense. Departement of Biologi and Biochemistry. www.bath.ac.uk/bio-sci/charn2.htm-19Mei07_files\charn2.htm
Fuxa, 1991. Insect Control with Baculoviuses. Biotechnology Advance 9 : 425-442.
Gabriel, B. P. dan Riyanto. 1989. Metarhizium anisopliae Metsch. Sor. Taksonomi, Patologi dan Aplikasinya. Proyek Pengembangan Perlindungan Tanaman Perkebunan, Departemen Pertanian. Jakarta. 25 hlm.
Nomuraea rileyi Farlow Samson on Heliothis armigera Hubner Lepidoptera : Noctuidae. Current science 57 : 867 – 868.
Gopalakrishnan, C. 2001. Fungal Pathogens as Components in Integrated Pest Management of Horticultural Crops. Integrated Pest Management in
Horticultural Ecosystems. Capital Publishing Company. New Delhi. 122 –132.
Hung, S. Y. and D. G. Boucias. 1996. Phenoloksidase Activity in Hemolymph of Naïve and Beauveria bassiana-Infected Spodoptera exigua Larvae. Academic Press, Inc. Florida.
Ihara, F., M. Toyama and T. Sato. 2003. Pathogenicity of Metarhizium anisopliae to the chestnut weevil larvae under laboratory and field conditions. Applied Entomology Zoology 38 (4): 461– 465.
Kalshoven, L.G.E. 1981. Pests of crops in Indonesia. Revised and translated by P.A. van der Laan, Univ. of Amsterdam with the assistance of G.H.L. Rothschild. P. T. Ichtiar Baru - van Hoeve. Jakarta.
Kershaw, M. J., E. R. Moorhouse, R. Bateman, S. E. Reynolds, and A. K. Charnley. 1999. The Role of Destruxin in the Pathogenecity of Metarhizium anisopliar for Three Species of Insect. Journal of Invertebrate Pathology 74 : 213 – 223.
Lee, P.C. and R.F. Hou. 2003. Pathogenesis of Metarhizium anisopliae var. anisopliae in the smaller brown planthopper Laodelphax striatellus. Chinese Journal Entomology 9 : 13 − 19.
Lynn and G. Finn. 2004.www.linus.socs.uts.edu.au/~don/larvae/faqs/eggs.html. Diakses pada tanggal 21 April 2007.
Milner, R. J. 1994. Future Prospect for Fungal Biopesticides. Proceeding of the 1st Brisbane Symposium Biopesticides Opportunities for Australian Industry. CSIRO – Australia. Brisbane.
Milner, R. J., J. A. Staplex, and G. G. Lutton. 1997. The Effect of Humidity on Germination and Infection of Termites by the Hypomycetes, Metarhizium anisopliae. Journal Invertebrata Pathology 69 : 64 – 69.
Oka, Ida Nyoman. 1998. Pengendalian Hama Terpadu dan Implementasinya Di Indonesia. Gajah Mada University Press. Yogyakarta.