PENGARUH BIOPESTISIDA BIO-LC4 TERHADAP POPULASI Xanthomonas campestris pv. acaciae DALAM MEDIA TANAM AKASIA (Acacia crassicarpa
Cunn ex. Benth)
RATRI KURNIA HADI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR
2008 ABSTRAK
RATRI KURNIA HADI. Pengaruh Biopestisida Bio-LC4 terhadap Populasi Xanthomonas campestris pv.
acaciae dalam Media Tanam Akasia (Acacia crassicarpa Cunn. ex Benth). Dibimbing oleh LISDAR A.
MANAF dan HAMIM.
Penyakit hawar bakteri merupakan salah satu penyakit yang menyerang tanaman akasia terutama A.
crassicarpa pada saat di persemaian. Penyakit ini disebabkan oleh bakteri X. campestris pv. acaciae.
Penelitian ini bertujuan untuk mempelajari pengaruh formula Bio -LC4 terhadap populasi bakteri tersebut di media persemaian akasia. Media tanam yang digunakan adalah campura n dari tanah, pasir dan kompos serta ditambah pupuk TSP. Media ini diberi dua perlakuan yaitu media tidak disterilisasi (Mts) dan media disterilisasi (Ms). Setelah itu, media diberi formula Bio-LC4 dengan konsentrasi 0% (F0), 10% (F10), 20%
(F20) dan 30% (F30). Campuran tersebut kemudian diberi dua perlakuan yaitu diintroduksi X. campestris pv. acaciae (MtsX, MsX) dan tidak diintroduksi bakteri tersebut (Mts, Ms). Setiap minggu selama lima minggu jumlah koloni bakteri X. campestris pv. acaciae dan jumlah total koloni semua bakteri dihitung dengan metode cawan tuang. Bakteri X. campestris p v . acaciae yang diisolasi dari perlakuan diatas kemudian diu ji secara in vitro terhadap ekstrak Bio-LC4 dengan metode cakram kertas. Jumlah koloni X.
campestris pv. acaciae dan jumlah total koloni semua bakteri mengalami penurunan pada semua perlakuan Mts X, MsX, Mts dan Ms, tetapi pengaruh formula tidak terlihat karena jumlah bakteri pada media kontrol juga mengalami penurunan walaupun tidak diberi formula. Uji in vitro menunjukkan bahwa bakteri X.
campestris pv. acaciae yang diisolasi dari perlakuan pada penelitian ini masih dapat dihambat pertumbuhannya oleh ekstrak formula Bio-LC4. Penelitian selanjutnya perlu dilakukan untuk mengetahui pengaruh formula Bio-LC4 terhadap X. campestris pv. acaciae pada media yang sesuai untuk perkembangan bakteri tersebut.
ABSTRACT
RATRI KURNIA HADI. The influence of biopesticide Bio-LC4 on X. campestris pv. acaciae population in acacia’s seedling media. Supervised by LISDAR A. MANAF and HAMIM.
Bacteria blight disease is one of the disease which attack acacia plant espesially A. crassicarpa in seedling. The disease is caused by X. campestris pv. acaciae. The research aimed know how the influence of Bio-LC4 formule on X. campestris pv. acaciae population in acacia seedling media. The seedling media was the mixture of soil, sand, compost and TSP fertilizer. There were two treatment, sterile media (Ms) and non sterile media (Mts). Then, the media mixed with Bio-LC4 formule with concentration of 0% (F0), 10% (F10), 20% (F20) and 30% (F30) respectively. There were two mixtures of media introduced with X.
campestris pv. acaciae (MtsX, MsX) and without introducing with X. campestris pv. acaciae (Mts, Ms).
The colony numbers of X. campestris pv. acaciae and total colony of bacteria were counted every week during five weeks by dilution method. The isolated X. campestris pv. acaciae from the treatment media was then tested in vitro with Bio-LC4 formule extract by paper disc method. The colony number of X.
campestris pv. acaciae and the total colony number of bacteria were decrease in all treatment media of Mts X, MsX, Mts and Ms respectively, but there was no effect of Bio-LC4 formule indicates by the decrease of colony number at control media. In vitro testing showed that the X. campestris pv. acaciae’s from the treatment media inhibited by Bio-LC4 formule extract. The future research is needed to observe formula’s influence to X. campestris pv. acaciae in a suitable media for the growth of bacteria.
PENGARUH BIOPESTISIDA BIO-LC4 TERHADAP POPULASI Xanthomonas campestris pv. acaciae DALAM MEDIA TANAM AKASIA (Acacia crassicarpa
Cunn ex. Benth)
RATRI KURNIA HADI
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Sains pada
Program Studi Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR
2008
Judul : Pengaruh Biopestisida Bio-LC4 terhadap Populasi Xanthomonas campestris pv. acaciae dalam Media Tanam Akasia (Acacia crassicarpa Cunn. ex Benth) Nama : Ratri Kurnia Hadi
NRP : G34103045
Menyetujui,
Pembimbing I , Pembimbing II,
Dr. Ir. Lisdar A. Manaf Dr.Ir. Hamim, M. Si.
NIP 131404219 NIP 131878946
Mengetahui,
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Dr. Drh. Hasim, DEA NIP 131578806
Tanggal Lulus:
KATA PENGANTAR
Puji syukur kehadirat Allah SWT atas rahmat dan karuniaNya sehingga penulis dapat menyelesaikan laporan karya ilmiah dengan judul: Pengaruh biopestisida Bio-LC4 terhadap populasi Xanthomonas campestris pv. acaciae dalam media tanam akasia (Acacia crassicarpa Cunn. ex Benth). Penelitian ini dilakukan sejak Februari 2007 sampai Juli 2008 di laboratorium Mikrobiologi dan Biokimia, Pusat Penelitian Studi Hayati dan Bioteknologi (PPSHB), IPB Dramaga Bogor.
Ucapan terima kasih penulis sampaikan kepada Dr. Ir. Lisdar A. Manaf dan Dr. Ir. Hamim selaku pembimbing atas segala bantuan, saran dan bimbingannya sejak awal hingga penulisan skripsi ini. Terima kasih yang tak terhingga juga penulis sampaikan kepada ibu, bapak, kakak dan adik serta seluruh keluarga atas segala doa dan dukungannya. Penulis juga mengucapkan terima kasih kepada Pak Iwa selaku teknisi di Lab. PAU yang telah memberikan bantuan selama penelitian, Bapak Samingan dan Ibu Ni Made Laksmi Ernawati atas segala saran dan masukannya dan tidak lupa juga kepada teman seperjuangan Isyana Kuncoro Dewi dan keluarga besar Bio 40.
Terima kasih .
Bogor, September 2008
Ratri Kurnia Hadi
RIWAYAT HIDUP
Ratri Kurnia Hadi dilahirkan di Bogor pada tanggal 19 Juni 1984 sebagai anak ke-3 dari 4 bersaudara dari pasangan Leto Haryanto dan Pasiyem.
Setelah menyelesaikan pendidikan dari SMU Negeri 4 Bogor pada tahun 2003, penulis melanjutkan pendidikan di Institut Pertanian Bogor melalui jalur USMI pada Jurusan Biologi Fakultas Matematika dan Ilmu Pengetahuan A lam.
Selama mengikuti perkuliahan, penulis menjadi asisten pelatihan budidaya jamur, menjadi pengurus Dewan Perwakilan Mahasiswa (DPM) Tingkat Persiapan Bersama (TPB) IPB, pengurus Himabio, pengurus wahana muslim himabia (WMH), menjadi koordinator rohis Bio 40, pengurus Badan Kerohaniaan Islam Mahasiswa (BKIM) IPB dan melakukan praktek lapangan dengan judul Pengelolaan Tanaman Obat di kebun percontohan tanaman obat Taman Sringganis.
DAFTAR ISI
Halaman
DAFTAR TABEL...vii
DAFTAR GAMBAR...viii
PENDAHULUAN...1
Latar Belakang...1
Waktu dan tempat...2
BAHAN DAN METODE...2
Bahan dan Alat...2
Metode...2
Peremajaan isolat bakteri...2
Pembuatan media tanam, perlakuan dan pemeliharaannya...2
Penghitungan jumlah koloni bakteri...2
Uji in vitro formula Bio-LC4...3
HASIL...3
Hasil Penghitungan Jumlah Koloni Bakteri X. campestris pv. acaciae...3
Hasil Penghitungan Jumlah TotalKoloni Semua Bakteri...5
Uji in vitro Ekstrak Formula Bio-LC4...7
PEMBAHASAN...7
SIMPULAN.
...
10SARAN
...
10DAFTAR PUSTAKA...10
DAFTAR TABEL
Halaman Komposisi mdia tanam dan formula yang dengan dan tanpa baktri X. campestris pv. acaciae pada masing-masing perlakuan...3 Hasil rata-rata jumlah koloni X. campestris pv. acaciae ...5 Hasil rata-rata jumlah total koloni semua bakteri...6
DAFTAR GAMBAR
Halaman
1. Koloni X. campestris pv. acaciae pada media PSA...3
2. Jumlah koloni X. campestris pv. acaciae pada media tidak steril yang diintroduksi X. campestris pv. acaciae (MtsX) pada minggu ke-0 sampai minggu ke-5...4
3. Jumlah koloni X. campestris pv. acaciae pada media steril yang diintroduksi X. campestris pv. acaciae (MsX) pada minggu ke-0 sampai minggu ke-5...4
4. Jumlah total koloni semua bakteri pada Mts yang diintroduksi X. campestris pv. acaciae pada minggu ke-0 sampai minggu ke-5...5
5. Jumlah total koloni semua bakteri pada Ms yang diintroduksi X. campestris pv. acaciae pada minggu ke-0 sampai minggu ke-5...6
6. Jumlah total koloni semua bakteri pada Mts tanpa introduksi X. campestris pv. acaciae...6
7. Jumlah total koloni semua bakteri pada Ms tanpa introduksi X. campestris pv. acaciae...7
8. Zona hambatan pertumbuhan X. campestris pv. acaciae oleh ekstrak Bio-LC4...7
9. Jumlah koloni X. campestris pv. acaciae pada media tidak steril yang diintroduksi X. campestris pv. acaciae (MtsX) pada minggu ke-0 sampai minggu ke-5...9
10.Jumlah koloni X. campestris pv. acaciae pada media steril yang diintroduksi X. campestris pv. acaciae (MsX) pada minggu ke-0 sampai minggu ke-5...9
10.Media tanam akasia tidak steril dengan konsentrasi formula...10
10. Media tanam akasia steril dengan konsentrasi formula ...10
PENDAHULUAN
Latar Belakang
Acacia spp. merupakan genus yang termasuk suku Leguminosae, memiliki lebih dari 1300 spesies dan terdistribusi di daerah tropik dan subtropik. Kayu akasia banyak digunakan untuk funitur dan perabot rumah tangga, seperti pintu dan bingkai jendela; pada pembuatan kapal;
sebagai tangkai peralatan; dibuat papan, lapisan kayu halus dan kayu lapis; sebagai pulp dan kertas (Prosea 1995). Beberapa jenis akasia yang paling banyak ditanam di wilayah asia adalah Acacia auriculiformis Cunn. ex Benth., A. mangium Willd., A. crassicarpa Cunn. ex Benth. dan A.
aulacocarpa Cunn. ex Benth. (Old et. al 2000).
Area perkebunan akasia banyak ditemukan di Indonesia, Malaysia, Papua Nugini, India, Sri Lanka dan Thailand (Prosea 1995).
Salah satu hambatan rendahnya produksi akasia di daerah tropis disebabkan oleh penyakit karat daun, embun tepung, rebah semai, kanker tunas dan busuk akar (Old et. al 2000). Pada saat di persemaian, tanaman akasia terutama A.
crassicarpa juga dapat terserang penyakit hawar daun bakteri. Penyakit ini disebabkan oleh bakteri Xanthomonas campestris pv. acaciae. Penyakit ini merupakan penyakit baru pada pembibitan tanaman A. crassicarpa di Indonesia (khususnya ditemukan di pembibitan tanaman akasia di Riau) karena belum dilaporkan keberadaannya baik di Indnesia maupun di negara lain yang menanam tanaman akasia (Ernawati 2008). Gejala awal dari penyakit hawar daun bakteri pada bibit tanaman A.
crassicarpa muncul pada bibit berumur lebih kurang 5-6 minggu setelah disemaikan (sudah memiliki 3-4 filodia). Gejala awal berupa garis berwarna merah berukuran kurang lebih 1-3 mm pada bagian ujung, tengah dan pangkal daun atau variasinya. Perkembangan gejala selanjutnya adalah garis berkembang memanjang sejajar dengan tulang daun dan berubah warna menjadi merah kecoklatan. Garis selanjutnya berubah menjadi coklat tua dan berwarna kuning disekitarnya. Pada perkembangan tahap akhir garis dapat menyatu dan kering sehingga berbentuk hawar (Ernawati 2008).
Beberapa usaha pengendalian terhadap penayakit hawar daun bakteri sudah dilakukan di pembibitan tanaman A. crassicarpa di Riau diantaranya penjarangan (spacing), perlakuan benih, penggunaan bakterisida, sanitasi lingkungan, penggunaan mikrob antagonis Pseudomonas fluorescens, Trichoderma spp. dan Bacillus subtilis. Usaha tersebut belum mampu menekan perkembangan penyakit hawar daun
bakteri (Ernawati 2008). Oleh karena itu, diperlukan suatu alternatif yang berpotensia mengendalikan penyakit tersebut. Salah satu cara yang mungkin bisa digunakan yaitu dengan biopestisida yang diperoleh dari bahan hayati seperti jamur.
Lentinus spp. merupakan jamur yang termasuk ke dalam kelas Basidiomycetes, ordo Polyporales, dan famili Lentinaceae (Pegler 1983). Jamur ini dapat dimanfaatkan sebagai sumber makanan bernilai gizi tinggi, agen biokontrol penyakit tanaman dan biofungisida (Sudirman 1995).
Lentinus ternyata berpotensi menghasilkan berbagai metabolit yang dimanfaatkan untuk kepentingan kesehatan dan industri. Jamur ini telah banyak dilaporkan sebagai penghasil senyawa antimikrob yang dapat menghambat pertumbuhan mikroorganisme lain seperti cendawan dan bakteri. Senyawa antimikrob dari Lentinus dapat disekskresikan secara ekstraseluler (filtrat kultur) maupun intraseluler (miselium dan tubuh buah). Beberapa jenis Lentinus telah diteliti sebelumnya, diantaranya ialah L. trabeum, L.
lepideus, L. adhaerens dan L. degener yang berasal dari daerah subtropis dan jenis lain yang berasal dari daerah Afrika tropis yaitu L.
squarrosulus yang menghasilkan dua senyawa antibiotik yang diisolasi dari filtrat kulturnya.
Salah satu dari senyawa tersebut ialah senyawa Ls2 yang dapat menghambat pertumbuhan Bacillus subtilis, Mucor ramannianus, khamir dan Rigidoporus lignosus (Sudirman.1992; Sudirman et al 1994, diacu dalam Sudirman 2005).
L. cladopus LC4 yang sebelum diidentifikasi adalah Lentinus sp. isolat LC ialah isolat Lentinus yang memiliki potensi lebih dalam menekan pertumbuhan mikroorganisme dibandingkan isolat Lentinus tropis lainnya (Sudirman 2005). Ekstrak miselium L. cladopus LC4 dapat menghambat pertumbuhan beberapa patogen tanaman seperti Ganoderma boninense, Rhizoctonia solani, Rigidoporus lignosus, Phytophtora capsici, dan Pseudomonas syringae (Mulyaningsih 2002).
Demikian juga dengan ekstrak miseliumnya dapat menghambat pertumbuhan bakteri Escherichia coli, Bacillus subtilis, dan X. campestris (Wage 1998). Berdasarkan penelitian tersebut maka diuji ekstrak miselium L. cladopus LC4 secara in vivo pada tanaman kedelai yang terserang penyakit pustul bakteri. Hasil penelitian tersebut menunjukkan bahwa ekstrak miselium L. cladopus LC4 dapat menghambat pembentukan pustul pada tanaman kedelai yang disebabkan oleh Xanthomonas campestris pv. glycines (Tristanti 2002). Berdasarkan penelitian tersebut, maka dikembangkan suatu formula biopestisida yang
diberi nama Bio-LC4. Formula ini kemudian diuji pada tanaman caisim (Brassica rapa L. Cv. Group Caisin) yang terserang penyakit rebah semai.
Penyakit ini disebabkan oleh cendawan tanah seperti R. solani, Phytium debaryanum dan Fusarium spp. Hasil penelitian tersebut menunjukkan bahwa penambahan formula Bio- LC4 dapat menghambat serangan penyakit rebah semai pada caisim (Fatimah 2005). Secara in vitro ekstrak formula Bio-LC4 juga menunjukkan aktivitas hambatan pertumbuhan terhadap X.
campestris pv. acaciae (Sudirman 29 April 2008, komunikasi pribadi). Uji in vivo formula Bio-LC4 terhadap X. campestris pv. acaciae belum pernah dilakukan. Oleh karena itu, penelitian ini dilakukan dengan harapan dapat menurunkan jumlah populasi koloni bakteri tersebut pada media tanam akasia yang diintroduksi X.
campestris pv. acaciae
Penelitian ini bertujuan untuk mempelajari pengaruh formula Bio-LC4 terhadap X. campestris pv. acaciae pada media tanah yang digunakan untuk bibit akasia (A. c rassicarpa).
Waktu dan tempat
Penelitian ini dilaksanakan pada bulan Februari sampai Juli 2007 di Laboratorium Mikrobiologi dan Biokimia, Pusat Penelitian Studi Hayati dan Bioteknologi (PPSHB), IPB Dramaga Bogor.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini ialah formula Bio-LC4 dari Dr. Ir. Lisdar I.
Sudirman, bakteri Xanthomonas campestris pv.
acaciae koleksi Dr.Ir. Budi Tjahjono M. Agr.
Media Peptone Sucrose Agar (PSA: peptone 10 g, sucrose 20 g, agar-agar 15 g dan akuades 1 l), Peptone Sucrose Broth (PSB: peptone 10 g, sucrose 20 g dan akuades 1 l dan Nutrient Agar (NA) Difco yang ditambah nistatin (1 tetes/100 ml) sebagai antifungi. Media tanam berupa campuran tanah, pasir dan kompos. Alat-alat yang digunakan ialah alat-alat gelas, timbangan, plat pemanas, spektrofotometri, autoclave, inkubator, laminar air flow dan shaker incubator.
Metode
Peremajaan Isolat Bakteri
Bakteri X. campestris pv. acaciae diremajakan pada media PSB dan diinkubasi pada shaker incubator dengan suhu ruang selama dua hari.
Pengukuran kerapatan bakteri dihitung dengan menggunakan metode cawan tuang dan dengan
bantuan alat spektrofotometri pada panjang gelombang 620 n m.
Pembuatan Media Tanam, Perlakuan dan Pemeliharaannya.
Media tanam yang digunakan merupakan campuran tanah, pasir dan kompos dengan perbandingan 3:1:2 serta ditambah pupuk TSP dengan dosis 0,05g/10g media (BSN 2003). Media tanam diberi dua perlakuan, yaitu perlakuan pertama media disteriliasi dengan autoclave pada suhu 121oC selama 15 menit (Ms) dan perlakuan kedua tanpa sterilisasi (Mts). Setelah itu, media tanam diberi formula dengan komposisi: 0% (F0), 10% (F20), 20% (F20) dan 30% (F30), sehingga total beratnya 66 gram. Campuran media tanam dan formula tersebut diaduk dan dimasukkan ke dalam kantong plastik yang berukuran 10 x 10 cm.
Setelah komposisi dicampur, media mendapat dua perlakuan yaitu perlakuan pertama media ditambahkan inokulum bakteri X. campestris pv.
acaciae dengan kerapatan sel 3.2 x 107/ml sebanyak 1 ml yang kemudian diaduk sehingga menjadi homogen di dalam media tanam.
Perlakuan kedua media tanpa diintroduksi bakteri.
Setiap perlakuan diulang tiga kali.
Media dari masing-masing perlakuan (Tabel 1), kemudian disimpan di dalam kurungan plastik yang berukuran 1 x 1 m2 dan setiap hari media tersebut disiram.
Penghitungan jumlah koloni bakteri
Penghitungan jumlah koloni bakteri dilakukan setiap seminggu selama lima minggu, yaitu dengan menghitung jumlah koloni X. campestris pv. acaciae dan jumlah total koloni semua bakteri.
Metode yang digunakan yaitu dengan metode cawan tuang.
Sampel media tanam dari masing-masing perlakuan diambil 1 gram pada bagian permukaan, bagian tengah dan bagian dalam kantong plastik, kemudian diaduk dan diambil lagi 1 g, selanjutnya dimasukkan ke dalam tabung reaksi yang berisi 9 ml akuades steril. Sampel tersebut kemudian dikocok dengan vorteks dan diencerkan secara bertahap sehingga diperoleh pengenceran hingga 1:106. Sampel pada pengenceran 10-2, 10-4 dan 10-6 diambil 1 ml dan dimasukan ke dalam cawan Petri yang berisi media LBA (untuk menghitung koloni X. campestris pv. acaciae) (Atlas RM 1997) dan media NA (media untuk menghitung jumlah total koloni bakteri) setiap media tersebut dibuat 2 kali ulangan. Setelah 24 jam, jumlah total koloni bakteri yang saling terpisah dihitung secara visual, dikalikan faktor pengenceran.
Tabel 1 Komposisi media tanam dan formula yang dengan dan tanpa bakteri X. campestris pv.
acaciae pada masing-masing perlakuan.
Perlakuan Tanah (gam)
Pasir (gram)
Kompos (gram)
Formula (gram)
MtsXF0 33 11 22 0
MtsF0 33 11 22 0
MsXF0 33 11 22 0
MsF0 33 11 22 0
MtsXF10 29.7 9.9 19.8 6.6
MtsF10 29.7 9.9 19.8 6.6
MsXF10 29.7 9.9 19.8 6.6
MsF10 29.7 9.9 19.8 6.6
MtsXF20 26.4 8.8 17.6 13.2
MtsF20 26.4 8.8 17.6 13.2
MsXF20 26.4 8.8 17.6 13.2
MsF20 26.4 8.8 17.6 13.2
MtsXF30 23.1 7.7 15.4 19.8
MtsF30 23.1 7.7 15.4 19.8
MsXF30 23.1 7.7 15.4 19.8
MsF30 23.1 7.7 15.4 19.8
Keterangan:
Ms : media steril Mts : media tidak steril
F0 : konsentrasi formula 0% (kontrol) F10 : Konsentrasi formula 10%
F20 : Konsentrasi formula 20%
F30 : Konsentrasi formula 30%
X : Introduksi bakteri X. campestris pv.
acaciae
- : Tidak ada Introduksi bakteri X. campestris pv. acaciae
Uji in vitro Formula Bio-LC4
Pengujian ekstrak Bio-LC4 terhadap X.
campestris pv. acaciae secara in vitro dilakukan pada media PSA dengan konsentrasi agar 0.75 %.
Bakteri X. campestris pv. acaciae yang digunakan adalah bakteri hasil isolasi dari media tanam pada percobaan sebelumnya. Dua lup bakeri X. campestris pv. acaciae yang tumbuh pada media PSA dimasukkan ke dalam Erlenmeyer yang berisi 20 ml media PSB, kemudian dikocok dengan shaker selama 2 hari pada suhu ruang sehingga diperoleh suspensi bakterinya.
Lima ml suspensi tersebut diinokulasikan ke dalam 100 ml media PSA 0.75%, kemudian media ini dikocok agar bakteri tercampur merata dan dituangkan ke dalam cawan Petri sebanyak 10 ml.
Ekstrak Bio-LC4 sebanyak 100 µl diteteskan pada cakram kertas berdiameter 13 mm, kemudian dikeringkan dengan pengering rambut. Setelah kering, kertas cakram kertas itu disinari dengan UV (λ = 254 nm) selama 15 menit dan diletakkan di permukaan media yang telah diinokulasi bakteri X. campestris pv. acaciae pada cawan Petri.
Cawan diinkubasi pada suhu 10oC selama 2 jam.
Setelah itu diinkubasi pada suhu ruang selama 24 jam. Diameter zona bening diukur dan dinyatakan sebagai zona hambatan pertumbuhan setelah dikoreksi dengan diameter cakram kertas.
HASIL
Hasil Penghitungan Jumlah Koloni Bakteri X.
campestris pv. acaciae
Koloni Xanthomonas sp. berbentuk bulat, permukaan cembung, bertepi utuh dan berwarna kuning (Aini et.al. 2002) (Gambar 1). Warna kuning ini merupakan karakteristik dari Xanthomonas sp. (Dowson 1939).
Gambar 1. Koloni X. campestris pv. acaciae pada media PSA
Pada Tabel 2 menunjukkan bahwa X.
campestris pv. acaciae dapat diisolasi dari MtsX (media tidak steril yang diintroduksi X. campestris pv. acaciae) dan MsX (media tidak steril yang diintroduksi X. campestris pv. acaciae), sedangkan pada Mts dan Ms yang tidak diintroduksi Xanthomonas tidak ditemukan bakteri tersebut, kecuali pada MtsF10, MtsF20 dan MtsF30 pada minggu ke-4 dan ke-5 yang jumlahnya berkisar antara 0,03-0.08 x 106 cfu/ml. Introduksi Xanthomonas juga dapat menambah jumlah total koloni semua bakteri pada Mts dan Ms (lampiran 3). Pada minggu ke-0 jumlah total koloni semua bakteri pada MtsX selalu lebih banyak jumlahnya dibandingkan dengan jumlah total koloni semua bakteri pada Mts yang tidak diintroduksi Xanthomonas pada semua perlakuan. Hal yang sama juga terjadi pada MsX. Pada minggu ke-0 jumlah total koloni semua bakterinya selalu lebih banyak dibandingkan dengan jumlah total koloni semua bakteri pada Ms yang tidak diintroduksi Xanthomonas. Contohnya jumlah total koloni semua bakteri pada MsXF0 pada minggu ke-0 jumlahnya 4200 x 106 cfu/ml. Jumlah tersebut lebih banyak dibandingkan dengan jumlah total koloni semua bakteri pada MsF0 yang berjumlah 2400 x 106 cfu/ml pada minggu ke-0 (Tabel 3).
Jumlah koloni X. campestris pv. acaciae pada perlakuan MtsX mengalami penurunan dari minggu ke-0 sampai minggu ke -5 (Gambar 2).
Koloni X. campestris pv. acaciae pada MtsXF0 (media tidak steril yang diintroduksi X. campestris pv. acaciae tanpa formula) pada minggu pertama jumlahnya sama dengan MtsXF20 (media tidak steril diintroduksi X. campestris pv. acaciae dengan formula 20%) dan MtsXF30 (media tidak steril diintroduksi X. campestris pv. acaciae dengan formula 30%) yaitu berkisar 8-9 x 106 cfu/ml. Jumlah koloni Xanthomonas pada ketiga perlakuan tersebut jauh lebih sedikit dibandingkan dengan jumlah Xanthomonas pada MtsXF10 (media tidak steril yang diintroduksi X. campestris pv. acaciae dengan formula 10%) yaitu sebesar 19 x 106 cfu/ml pada minggu pertama. Hal yang sama juga terjadi pada minggu ke-2 dan ke -3, jumlah X.
campestris pv. acaciae pada media MtsXF10 berkisar 9-11 x 106 cfu/ml. Jumlah ini lebih banyak dibandingkan dengan jumlah bakteri Xanthomonas pada MtsXF0, MtsXF20 dan MtsXF30 yang berkisar 0-6 x 106 cfu/ml pada minggu ke-2 sampai ke-3. Jumlah bakteri yang diisolasi semakin berkurang untuk semua perlakuan MtsX seiring dengan lamanya bakteri tersebut di dalam tanah, dengan kisaran 0-0.4 x 106 cfu/ml pada minggu ke-5 (Tabel 2).
32
8
3 2 3,9
0,3 32
19
11 9
3 0,3 32
9 6 5
0,2 0
32
8
2 0 0,7 0,4
0 10 20 30 40 50
0 1 2 3 4 5
Waktu (minggu)
Jumlah koloni x 10 6
MtsF0Xi MtsF10Xi MtsF20Xi MtsF30Xi
Ga mbar 2. Jumlah koloni X. campestris pv.
acaciae pada media tidak steril yang diintroduksi X. campestris pv.
acaciae (MtsX) pada minggu ke-0 sampai minggu ke-5.
Jadi jumlah Xanthomonas pada MtsXF10 jauh lebih besar dibandingkan ketiga perlakuan lainnya.
Hal ini berbeda pada perlakuan MsX. Pada minggu pertama jumlah Xanthomonas pada MsXF20 (media steril yang diintroduksi X.
campestris pv. acaciae dengan formula Bio-LC4 20%) dan MsXF30 (media steril yang diintroduksi X. campestris pv. acaciae dengan formula Bio- LC4 30%) yaitu masing-masing 15 x 106 cfu/ml
dan 48 x 106 cfu/ml. Jumlah tersebut jauh lebih banyak dibandingkan dengan jumlah Xanthomonas pada MsXF0 (media steril yang diintroduksi X. campestris pv. acaciae tanpa formula ) dan MsXF10 (media steril yang diintroduksi Xanthomonas dengan konsentrasi formula Bio-LC4 10%) yang berjumlah masing- masing 5 x 106 cfu/ml dan 3 x 106 cfu/ml pada minggu pertama. Pada minggu ke-2 sampai ke-5 jumlah Xanthomonas pada MsXF20 dan MsXF30 turun drastis menjadi 0-0,7 x 106 cfu/ml. Jumlah ini lebih sedikit dibandingkan dengan jumlah Xanthomonas pada MsXF0 dan MsXF10 yang berkisar 0.03-5 x 106 cfu/ml pada minggu ke-2 sampai ke-5 (Gambar 3).
3 2
5 5
2 0,6 0,03
3 2
3 2 1 0,5 0
3 2
1 5
0 0 0 0
3 2 4 8
0 0 0 0,7
0 10 20 30 40 50
0 1 2 3 4 5
Waktu (minggu)
Jumlah koloni x 10 6
MsF0Xi MsF10Xi MsF20Xi MsF30Xi
Gambar 3. Jumlah koloni X. campestris pv.
acaciae pada Ms yang diintroduksi X. campestris pv. acaciae pada minggu ke-0 sampai minggu ke-5.
Apabila jumlah bakteri X. campestris pv.
acaciae pada MtsX dibandingkan dengan jumlah Xanthomonas pada MsX, maka jumlah Xanthomonas paling banyak diisolasi dari MsX, yaitu dari MsXF30 sebesar 48 x 106 cfu/ml pada minggu pertama. Pada minggu ke-2 sampai ke-5 jumlah bakteri X. campestris pv. acaciae mengalami penurunan pada semua perlakuan MtsX dan MsX. Koloni Xanthomonas bahkan tidak ditemukan pada MsXF20 saat minggu ke-2 sampai ke-5 dan pada MsXF30 pada minggu ke-2 sampai ke -4, tetapi pengaruh formula tidak terlihat pada perlakuan diatas. Hal tersebut disebabkan jumlah Xanthomonas pada kontrol juga mengalami penurunan, tetapi penambahan formula pada media tanam dapat mempercepat waktu kematian Xanthomonas. Pada MtsX, waktu kematian Xanthomonas paling cepat terjadi pada MtsXF30 yaitu pada minggu ke-3, kemudian pada MtsXF20 pada minggu ke-5. Hal ini menunjukkan semakin tinggi konsentrasi formula, semakin cepat waktu kematian Xanthomo nas. Hal yang sama terjadi pada MsX. Waktu kematian pada MsX
paling cepat terjadi pada MsXF20 dan MsXF30 yaitu pada minggu ke-2 (Tabel 2).
1600
2 4 8 3 1,5 0,34
1400
7 2 47 26 6,7 0,98
2200
7 6 53 19 8,2 1,75
3700
9 0 24 13 7,9 1,02
0 1000 2000 3000 4000
0 1 2 3 4 5
Waktu (minggu)
Jumlah koloni x 10 6
MtsXF0 MtsXF10 MtsXF20 MtsXF30
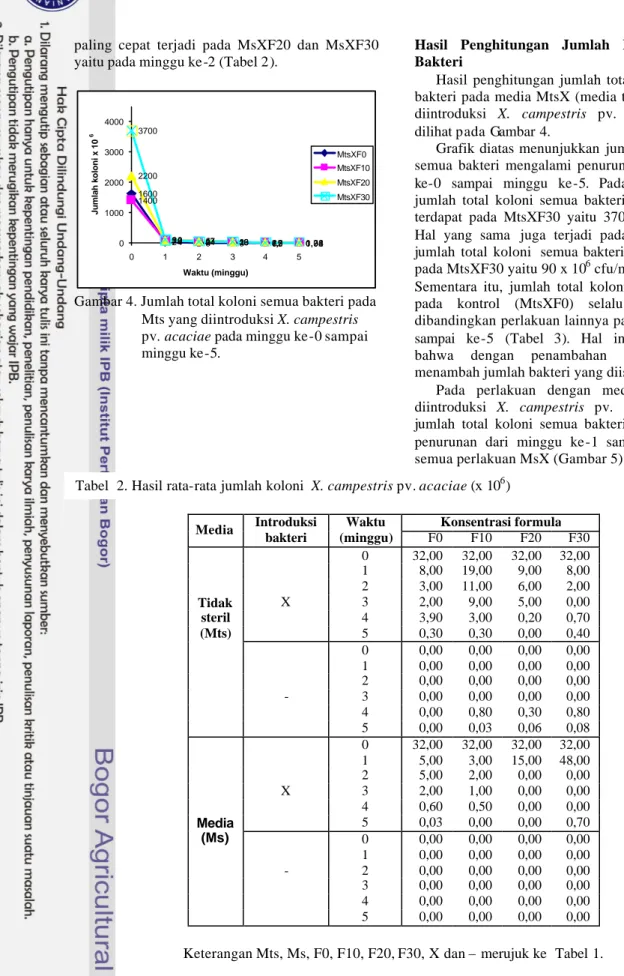
Gambar 4. Jumlah total koloni semua bakteri pada Mts yang diintroduksi X. campestris pv. acaciae pada minggu ke-0 sampai minggu ke-5.
Hasil Penghitungan Jumlah Koloni Semua Bakteri
Hasil penghitungan jumlah total koloni semua bakteri pada media MtsX (media tidak steril yang diintroduksi X. campestris pv. acaciae) dapat dilihat pada Gambar 4.
Grafik diatas menunjukkan jumlah total koloni semua bakteri mengalami penurunan dari minggu ke-0 sampai minggu ke-5. Pada minggu ke-0 jumlah total koloni semua bakteri paling banyak terdapat pada MtsXF30 yaitu 3700 x 106 cfu/ml.
Hal yang sama juga terjadi pada minggu ke-2, jumlah total koloni semua bakteri paling banyak pada MtsXF30 yaitu 90 x 106 cfu/ml (Lampiran 3).
Sementara itu, jumlah total koloni semua bakteri pada kontrol (MtsXF0) selalu lebih sedikit dibandingkan perlakuan lainnya pada minggu ke-1 sampai ke-5 (Tabel 3). Hal ini menunjukkan bahwa dengan penambahan formula dapat menambah jumlah bakteri yang diisolasi.
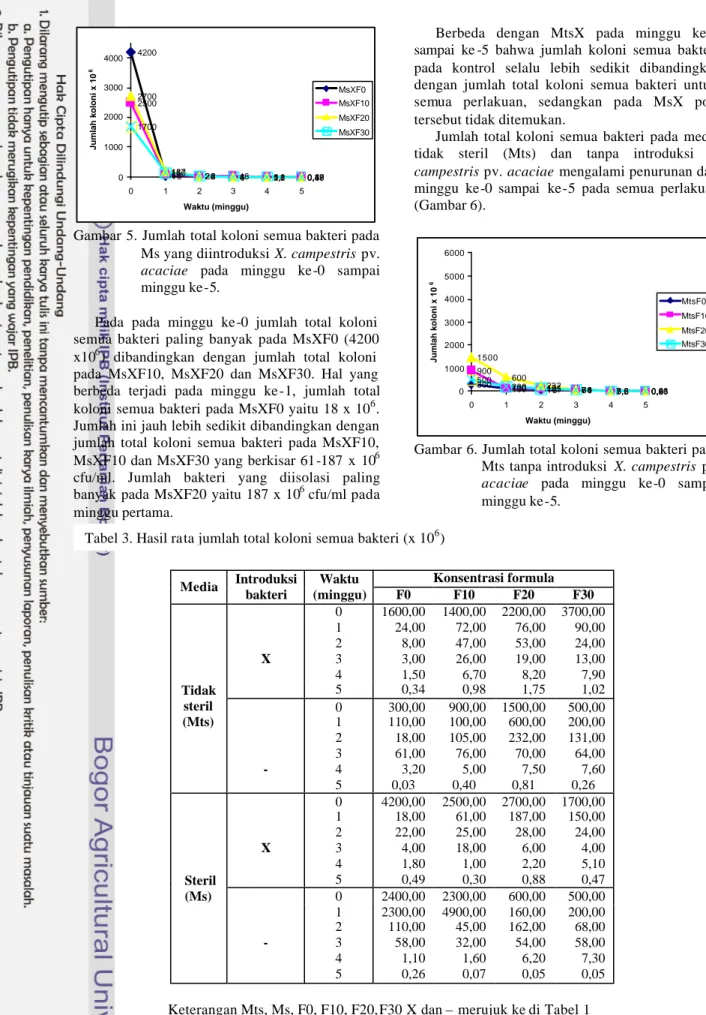
Pada perlakuan dengan media steril yang diintroduksi X. campestris pv. acaciae (MsX) jumlah total koloni semua bakterinya mengalami penurunan dari minggu ke-1 sampai ke -5 pada semua perlakuan MsX (Gambar 5).
Tabel 2. Hasil rata-rata jumlah koloni X. campestris pv. acaciae (x 106)
Media Introduksi bakteri
Waktu (minggu)
Konsentrasi formula
F0 F10 F20 F30
Tidak steril (Mts)
X
0 32,00 32,00 32,00 32,00
1 8,00 19,00 9,00 8,00
2 3,00 11,00 6,00 2,00
3 2,00 9,00 5,00 0,00
4 3,90 3,00 0,20 0,70
5 0,30 0,30 0,00 0,40
-
0 0,00 0,00 0,00 0,00
1 0,00 0,00 0,00 0,00
2 0,00 0,00 0,00 0,00
3 0,00 0,00 0,00 0,00
4 0,00 0,80 0,30 0,80
5 0,00 0,03 0,06 0,08
Media (Ms)
X
0 32,00 32,00 32,00 32,00 1 5,00 3,00 15,00 48,00
2 5,00 2,00 0,00 0,00
3 2,00 1,00 0,00 0,00
4 0,60 0,50 0,00 0,00
5 0,03 0,00 0,00 0,70
-
0 0,00 0,00 0,00 0,00
1 0,00 0,00 0,00 0,00
2 0,00 0,00 0,00 0,00
3 0,00 0,00 0,00 0,00
4 0,00 0,00 0,00 0,00
5 0,00 0,00 0,00 0,00
Keterangan Mts, Ms, F0, F10, F20, F30, X dan – merujuk ke Tabel 1.
4200
1 8 2 2 4 1,8 0,49
2500
6 1 2 5 18 1 0,3
2700
187 2 8 6 2,2 0,88
1700
150 2 4 4 5,1 0,47
0 1000 2000 3000 4000
0 1 2 3 4 5
Waktu (minggu)
Jumlah koloni x 10 6
MsXF0 MsXF10 MsXF20 MsXF30
Gambar 5. Jumlah total koloni semua bakteri pada Ms yang diintroduksi X. campestris pv.
acaciae pada minggu ke-0 sampai minggu ke-5.
Pada pada minggu ke-0 jumlah total koloni semua bakteri paling banyak pada MsXF0 (4200 x106) dibandingkan dengan jumlah total koloni pada MsXF10, MsXF20 dan MsXF30. Hal yang berbeda terjadi pada minggu ke-1, jumlah total koloni semua bakteri pada MsXF0 yaitu 18 x 106. Jumlah ini jauh lebih sedikit dibandingkan dengan jumlah total koloni semua bakteri pada MsXF10, MsXF10 dan MsXF30 yang berkisar 61-187 x 106 cfu/ml. Jumlah bakteri yang diisolasi paling banyak pada MsXF20 yaitu 187 x 106 cfu/ml pada minggu pertama.
Berbeda dengan MtsX pada minggu ke-2 sampai ke -5 bahwa jumlah koloni semua bakteri pada kontrol selalu lebih sedikit dibandingkan dengan jumlah total koloni semua bakteri untuk semua perlakuan, sedangkan pada MsX pola tersebut tidak ditemukan.
Jumlah total koloni semua bakteri pada media tidak steril (Mts) dan tanpa introduksi X.
campestris pv. acaciae mengalami penurunan dari minggu ke-0 sampai ke-5 pada semua perlakuan (Gambar 6).
300 110 1 8 6 1 3,2 0,03
900
100 105 7 6 5 0,4
1500
600
232 7 0 7,5 0,81
500 200 131 6 4 7,6 0,26
0 1000 2000 3000 4000 5000 6000
0 1 2 3 4 5
Waktu (minggu)
Jumlah koloni x 10 6
MtsF0 MtsF10 MtsF20 MtsF30
Gambar 6. Jumlah total koloni semua bakteri pada Mts tanpa introduksi X. campestris pv.
acaciae pada minggu ke-0 sampai minggu ke-5.
Media Introduksi bakteri
Waktu (minggu)
Konsentrasi formula
F0 F10 F20 F30
Tidak steril (Mts)
X
0 1600,00 1400,00 2200,00 3700,00
1 24,00 72,00 76,00 90,00
2 8,00 47,00 53,00 24,00
3 3,00 26,00 19,00 13,00
4 1,50 6,70 8,20 7,90
5 0,34 0,98 1,75 1,02
-
0 300,00 900,00 1500,00 500,00 1 110,00 100,00 600,00 200,00 2 18,00 105,00 232,00 131,00
3 61,00 76,00 70,00 64,00
4 3,20 5,00 7,50 7,60
5 0,03 0,40 0,81 0,26
Steril (Ms)
X
0 4200,00 2500,00 2700,00 1700,00 1 18,00 61,00 187,00 150,00
2 22,00 25,00 28,00 24,00
3 4,00 18,00 6,00 4,00
4 1,80 1,00 2,20 5,10
5 0,49 0,30 0,88 0,47
-
0 2400,00 2300,00 600,00 500,00 1 2300,00 4900,00 160,00 200,00 2 110,00 45,00 162,00 68,00
3 58,00 32,00 54,00 58,00
4 1,10 1,60 6,20 7,30
5 0,26 0,07 0,05 0,05
Keterangan Mts, Ms, F0, F10, F20,F30 X dan – merujuk ke di Tabel 1 Tabel 3. Hasil rata jumlah total koloni semua bakteri (x 106)
Pada minggu ke-0 jumlah total koloni semua bakteri pada Mts paling banyak pada MtsF20 yang berjumlah 1500 x 106 cfu/ml. Jumlah ini jauh lebih banyak dibandingkan dengan jumlah total koloni semua bakteri pada kontrol (MtsF0), MtsF10 dan MtsF30 yang berkisar 300-900 x 106 cfu/ml. Hal yang sama juga terjadi pada minggu ke-1 sampai ke-2, jumlah total koloni semua bakteri pada MtsF20 lebih banyak dibandingkan jumlah total koloni semua bakteri pada tiga perlakuan lainnya. Hal yang berbeda terjadi pada minggu ke-3 sampai ke -5, MtsF20 tidak lebih banyak dari perlakuan lainnya (Lampiran 3).
Pada media steril tanpa introduksi bakteri X.
campestris pv. acaciae, jumlah total koloni semua bakteri pada minggu ke-0 sampai ke -5 mengalami penurunan (Gambar 7).
2400 2300
110 5 8 1,1 0,26
2300 4900
4 5 3 2 1,6 0,07
600
160 162 5 4 6,2 0,05
500 200 6 8 5 8 7,3 0,05
0 1000 2000 3000 4000 5000 6000
0 1 2 3 4 5
Waktu (minggu)
Jumlah koloni x 106
MsF0 MsF10 MsF20 MsF30
Gambar 7. Jumlah total koloni semua bakteri pada Ms tanpa introduksi X. campestris pv.
acaciae pada minggu ke-0 sampai minggu ke-5.
Grafik diatas menunjukkan bahwa pada minggu ke-0 jumlah total koloni semua bakteri paling banyak pada MsF0 yaitu 2400 x 106 cfu/ml.
Pada minggu pertama jumlah total koloni semua bakteri paling banyak pada MsF10 yaitu 4900 x 106 cfu/ml , sedangkan yang paling sedikit pada MsF20 yaitu 160 x 106. Hal yang berbeda terjadi pada minggu ke-2 dan ke-3, jumlah total koloni semua bakteri pada MsF10 yang pada awalnya paling banyak menjadi paling sedikit yaitu berkisar 32-45 x 106 cfu/ml dibandingkan jumlah total koloni semua bakteri pada kontrol (MsF0), MsF20 dan MsF30 yang jumlahnya berkisar 54- 162 x 106 cfu/ml pada minggu ke-2 dan ke-3.
Jumlah total koloni semua bakteri mengalami penurunan pada semua perlakuan sehingga berjumlah
Jadi apabila jumlah total koloni semua bakteri pada Mts dibandingkan dengan jumlah total koloni semua bakteri pada Ms, maka jumlah total koloni semua bakteri paling banyak terdapat
pada MsF10 (media steril yang tidak diintroduksi X. campestris pv. acacia dengan formula Bio-LC4 10%) yaitu sebesar 4900 x 106 cfu/ml pada minggu pertama.
Hasil Uji in vitro Ekstrak Formula Bio-LC4 Uji ekstrak Bio-LC4 terhadap Xanthomonas yang diisolasi dari media perlakuan pada penelitian ini menunjukkan adanya aktivitas hambatan pertumbuhan. Hal ini dapat dilihat dari adanya daerah hambatan pertumbuhan berupa zona bening disekitar cakram kertas. Besarnya zona hambatan tersebut yaitu 17 mm, 11,3 mm dan 17,6 mm. Jadi rata-rata zona hambatannya 15,3 mm (Gambar 8).
Gambar 8. Zona hambatan pertumbuhan X.
campestris pv. acaciae oleh ekstrak Bio-LC4 (tanda panah).
PEMBAHASAN
X. campestris pv. acaciae dapat diisolasi dari MtsX dan MsX, sedangkan pada Mts dan Ms yang tidak diintroduksi X. campestris pv. acaciae bakteri tersebut tidak ditemukan, kecuali pada minggu ke-4 dan ke-5 Xanthomonas terisolasi pada MtsF10, MtsF20 dan MtsF30 dengan kisaran 0,03-0,8 x 106 cfu/ml. Hal ini kemungkinan besar karena media tersebut terkontaminasi dari media tanam yang diintroduksi bakteri Xanthomonas.
Ernawati (2008) mengatakan sumber inokulum bakteri X. campestris pv. acaciae selalu ada di pembibitan A. crassicarpa. Hal tersebut terbukti dari terdeteksinya bakteri tersebut dari benih, media tanam (tanah gambut, sekam padi, serbuk kelapa dan komp os kelapa sawit), maupun sumber air penyiramannya dengan populasi yang cukup tinggi yaitu 2.9 x 102 sampai 9.9 x 106 cfu/ml. Hal ini memberi peluang terjadinya epidemi penyakit jika faktor lingkungan seperti angin, air dan curah hujan lebih mendukung perkembangan dan penyebaran inokulum (Koesmaryono 1999). Curah hujan yang tinggi dapat meningkatkan kelembaban
sehingga mempercepat perkembangan dan penyebaran penyakit hawar daun bakteri. Hal yang sama terjadi pada penyakit pustul bakteri atau bisul bakteri yang disebabkan X. campestris pv.
glycines, kondisi lingkungan yang basah dan suhu yang relatif tinggi dengan suhu optimum 30-350C dapat mengembangkan penyakit tersebut (Semangun 1991).
Pengendalian penyakit pustul pada kedelai dapat dilakukan dengan rotas i tanaman, sanitasi tanaman dari sisa-sisa tanaman dan inang lainnya, penanganan pascapanen yang tepat untuk menghindari kerusakan benih (Machmud 1994;
Sinclair 1993). Selain itu, secara kimia penyakit ini dapat dikontrol dengan menggunakan pestisida kimia (Chet & Inbar 1997). Semua usaha tersebut belum dapat menekan perkembangan penyakit hawar daun bakteri pada A. crassicarpa, tapi penambahan formula Bio-LC4 dengan konsentrasi 10% dapat mengurangi bercak klorosis pada bibit akasia tersebut (Dewi 2008). Sementara itu, pengaruh penambahan formula Bio-LC4 terhadap populasi X. campestris pv. acaciae pada media tanam akasia tidak dapat terlihat.
Pada MtsX dan MsX jumlah koloni bakteri X.
campestris pv. acaciae mengalami penurunan pada semua perlakuan dari minggu ke-0 sampai ke-5, tetapi efektivitas formula Bio-LC4 t idak terlihat pada perlakuan tersebut. Hal ini disebabkan jumlah Xanthomonas pada media kontrol (MtsXF0 dan MsXF0) juga mengalami penurunan walaupun tanpa ditambah formula .
Faktor penyebab turunny a jumlah koloni Xanthomonas kemungkinan karena media tanam yang digunakan kurang cocok untuk perkembangan bakteri tersebut. Pada tahun 2004 di Riau persentase kejadian penyakit hawar daun bakteri yang disebabkan X. campestris pv. acaciae sebesar 59,5%. Saat itu media tanam yang digunakan adalah tanah gambut dan sekam padi.
Pada tahun 2007 persentase kejadian penyakit hawar turun menjadi 15,79% ketika menggunakan media cocopeat (Ernawati 2008). Ghezzi dan Steck (1999) mengatakan bahwa media kultur yang nutrisinya tidak menunjang kebutuhan X.
campestris pv. campestris dapat menurunkan jumlah koloninya sampai di bawah 105 cfu/ml. Hal yang sama mungkin terjadi pada penelitian ini.
Media yang digunakan tidak dapat menunjang pertumbuhan X. campestris pv. acaciae, sehingga jumlah koloninya mengalami penurunan. Pada awalnya pada penelitian ini akan menggunakan media cocopeat dengan asumsi bahwa media tersebut dapat menunjang kebutuhan nutrisi X.
campestris pv. acaciae, sehingga bakteri itu dapat berkembang. Kelebihan media cocopeat adalah
bebas dari patogen tular tanah dan gulma, sehingga baik untuk pertumbuhan akasia (Ernawati 2008). Media ini digunakan untuk pembibitan akasia di daerah Riau, tapi karena media tersebut tidak tersedia maka diganti dengan media standar untuk pembibitan akasia. Media standar tersebut merupakan campuran dari tanah, pasir dan kompos dengan perbandingan 3:1:2 serta ditambah pupuk TSP dengan dosis 0,05g/10g media (BSN 2003). Pada penelitian ini media yang digunakan diharapkan dapat menunjang kebutuhan X. campestris pv. acaciae, sehingga bakteri tersebut dapat berkembang. Ernawati (2008) pada saat mengisolasi X. campestris pv. acaciae di daerah Riau melaporkan bahwa koloni X.
campestris pv. acaciae banyak diisolasi pada media kompos kelapa sawit dibandingkan pada media lain seperti tanah gambut, serbuk kelapa dan sekam padi. Jadi untuk penelitian selanjutnya perlu mengganti media yang digunakan dengan media lain terutama media kompos kelapa sawit.
Faktor lain yang menyebabkan turunnya jumlah X. campestris pv. acaciae yaitu karena terlalu sedikitnya bakteri Xanthomonas yang diintroduksikan ke dalam media tanam yaitu hanya satu ml, sehingga bakteri tersebut tidak dapat bertahan di dalam tanah dan jumlahnya sangat turun pada minggu ke-2 seperti yang terjadi pada MsXF0 dan MsXF30. Suspensi bakteri yang diintroduksi ke dalam tanah minimal 10 ml agar jumlah bakteri tidak terlalu turun dan dapat bertahan lebih lama di media tanam (Sudirman 29 April 2008, komunikasi pribadi). Harni et. al (2006) mengintroduksikan 100 ml suspensi bakteri endofit ke dalam 2 kg media tanam ketika ingin mengetahui pengaruh aplikasi bakteri endofit terhadap nematoda peluka akar tanaman nilam.
Jadi itulah beberapa faktor yang kemungkinan menjadi penyebab turunnya jumlah koloni Xanthomonas, sehingga pengaruh penambahan formula Bio-LC4 pada media tanam tidak terlihat.
Walaupun demikian, grafik log menunjukkan bahwa penambahan formula pada media tanam dapat mempercepat turunnya jumlah koloni Xanthomonas. Pada MtsX, jumlah koloni Xanthomonas paling sedikit diisolasi dari MtsXF20 dan MtsXF30, dibandingkan dengan jumlah koloni Xanthomonas pada kontrol dan MtsXF10. Selain itu, koloni Xanthomonas sudah tidak ditemukan lagi pada minggu ke-5 pada MtsXF20 dan pada minggu ke-3 pada Mts XF0, tapi koloni Xanthomonas pada MtsXf30 kembali terisolasi pada minggu ke-4 dan minggu ke-5 (Gambar 9). Jadi penambahan formula dapat mempercepat waktu kematian Xanthomonas pada MtsX. Hal yang sama juga terjadi pada MsX.
Bakteri X. campestris pv. acaciae tidak ditemukan pada MsXF20 dan MsXF30 pada minggu ke-2, sedangkan pada MsXF10 tidak ditemukan pada minggu ke-5. Hal ini menunjukkan semakin besar konsentrasi formula, semakin cepat waktu kematian X. campestris pv. acaciae (Gambar 10).
Sudirman (2002) menyatakan bahwa formula Bio- LC4 mengandung tiga senyawa aktif yaitu LC4-1, LC4-2 dan LC4-3 yang berperan dalam menghambat pertumbuhan mikroorganisme lain.
y = -0,3171x + 7,66 y = -0,3143x + 7,9333
y = -1,22x + 9,82 y = -0,5371x + 7,2467
0 1 2 3 4 5 6 7 8 9 10
0 1 2 3 4 5
Waktu (minggu)
Jumlah koloni (log)
MtsXF0 MtsXF10 MtsXF20 MtsXF30 MtsXF0 MtsXF10 MtsXF20 MtsXF30
Ga mbar 9. Jumlah koloni X. campestris pv.
acaciae pada media tidak steril yang diintroduksi X. campestris pv.
acaciae (MtsX) pada minggu ke-0 sampai minggu ke-5.
y = -0,5171x + 8,06
y = -1,1486x + 9,3533
y = -1,6886x + 8,36 y = -0,8886x + 6,6267
-3 -2 -1 0 1 2 3 4 5 6 7 8 9 10
0 1 2 3 4 5
Waktu (minggu)
Jumlah koloni (log)
MsXF0 MsXF10 MsXF20 MsXF30 MsXF0 MsXF10 MsXF20 MsXF30
Gambar 10. Jumlah koloni X. campestris pv.
acaciae pada Ms yang diintroduksi X. campestris pv. acaciae pada minggu ke-0 sampai minggu ke-5.
Pada perlakuan MtsX, jumlah total koloni semua bakteri pada minggu ke-0 paling banyak pada MtsXF30 yaitu 3700,00 x 106 cfu/ml . Hal ini menunjukkan bahwa dengan penambahan formula dapat menambah jumlah bakteri. Keadaan yang berbeda terjadi pada MsX, pada minggu ke-0, jumlah total koloni semua bakteri paling tinggi pada MsXF0 dibandingkan dengan jumlah total koloni semua bakteri pada p erlakuan MsX lainnya.
Hal yang sama juga terjadi pada Ms yang tidak diintroduksi Xanthomonas. Pada minggu ke-0 jumlah total koloni pada kontrol (MsF0) lebih
tinggi dari tiga perlakuan lainnya. Hal tersebut kemungkinan terjadi karena media steril yang digunakan sebelum dicampur dengan formula didiamkan dulu selama tiga hari, sehingga bakteri dalam media tanam tumbuh kembali (Sudirman 29 April 2008, komunikasi pribadi).
Pengaruh formula Bio-LC4 tidak terlihat pada semua perlakuan Mts dan Ms, karena jumlah koloni semua bakteri pada kontrol juga mengalami penurunan walaupun tidak ditambah formula.
Selain faktor media tanam, turunnya jumlah koloni bakteri kemungkinan karena dalam media tersebut terdapat mikroorganisme antagonis yang menghambat pertumbuhan bakteri lain.
Mikroorganisme antagonis seperti bakteri, jamur dan aktinomiset dalam tanah dapat menekan infeksi penyakit tanaman di lapangan (Subba Rao 1994). Keadaan ini disebut hambatan alamiah mikroba (Weller 1988). Kurang berfungsinya formula Bio-LC4 dalam menekan pertumbuhan bakteri pada media tanam akasia mungkin juga disebabkan karena formula tersebut terkontaminasi oleh organisme lain terutama cendawan Hal ini dapat diketahui berdasarkan pengamatan pada minggu pertama. Pada MtsXF0, MtsF0, MsXF0 dan MsF0 tidak ditumbuhi cendawan, sedangkan pada semua media tanam yang diberi formula permukaan media dipenuhi oleh cendawan dan semakin tinggi konsentrasi formula yang ditambahkan, semakin banyak pula koloni cendawan yang tumbuh (Gambar 11 dan 12).
Uji in vitro Ekstrak Formula Bio-LC4
Ekstrak formula Bio-LC4 mampu menghambat Ganoderma boninense, Rizoctonia solanii, Rigidoporus lignosus, Phytophtora capsici, dan Pseudomonas syringae secara in vitro (Mulyaningsih 2002). Ekstrak formula Bio-LC4 juga dapat menghambat pertumbuhan X.
campestris pv. acaciae secara in vitro yang ditandai dengan adanya zona hambatan (Sudirman 29 April 2008, komunikasi pribadi). Pada penelitian ini uji in vitro kembali dilakukan untuk membuktikan efektivitas ekstrak formula Bio-LC4 dalam menghambat pertumbuhan bakteri X.
campestris pv. acaciae yang diisolasi dari perlakuan pada penelitian ini.
Uji ekstrak Bio-LC4 terhadap Xanthomonas yang diisolasi dari media perlakuan pada penelitian ini menunjukkan adanya aktivitas hambatan pertumbuhan. Hal tersebut dapat dilihat dengan adanya daerah hambatan pertumbuhan berupa zona bening di sekitar cakram kertas (gambar 8). Percobaan ini menunjukkan bahwa ekstrak Bio-LC4 masih efektif dalam menekan pertumbuhan Xanthomonas walaupun bakteri
tersebut sudah diintroduksikan ke dalam tanah.
Kurang berfungsinya formula Bio-LC4 pada saat di dalam tanah mungkin terjadi karena bahan pembawa yang dicampurkan dengan ekstrak Bio- LC4 terkontaminasi oleh organisme lain seperti cendawan.
Gambar 11. Media tanam akasia tidak steril dengan konsentrasi formula: a. 0%
(MtsF0), b. 10% (MtsF10), c. 20%
(MtsF20) d. 30 % (MtsF30) pada umur 1 minggu.
Gambar 12. Media tanam akasia steril dengan konsentrasi formula: a. 0% (MsF0), b. 10% (MsF10), c. 20% (MsF20) d.
30 % (MsF30) pada umur 1 minggu.
SIMPULAN
Pengaruh formula Bio -LC4 dalam menghambat pertumbuhan X. campestris pv.
acaciae pada media tanah tidak terlihat pada penelitian ini. Ha l tersebut disebabkan jumlah koloni X. campestris pv. acaciae pada media kontrol juga mengalami penurunan walaupun tidak ditambah formula. Turunnya jumlah koloni bakteri mungkin disebabkan karena media tanam yang digunakan kurang sesuai untuk pertumbuhan X.
campestris pv. acaciae dan terlalu sedikitnya suspensi bakteri yang diintroduksikan ke dala m media tanam. Hal lainnya adalah tumbuhnya cendawan dengan cepat pada media yang diberi formula .
Secara in vitro ekstrak Bio-LC4 dapat menghambat pertumbuhan X. campestris pv.
acacia yang diisolasi dari media perlakuan, yang ditunjukkan dengan adanya zona hambatan pertumbuhan berupa zona bening disekitas cakram kertas.
SARAN
Disarankan untuk melakukan penelitian yang lebih dalam mengenai X. campestris pv. acaciae terutama faktor-faktor yang mendukung pertumbuhannya, sehingga apabila akan diuji kembali dapat memenuhi kebutuhan perkembangannya.
Penelitian selanjutnya perlu dilakukan dengan menambah lebih banyak suspensi X. campestris pv. acaciae ke media tanam sehingga jumlahnya tidak turun drastis pada minggu kedua. Selain itu, media tanam yang digunakan diganti dengan media lain seperti media kompos kelapa sawit.
DAFTAR PUSTAKA
Atlas RM. 1997. Di dalam: Parks LC, editor.
Handbookof Microbiological Media. Ed ke-2.
New York: CRC Press INC.
[BSN] Badan standarisasi Nasional. 2003.
Tanaman kehutanan, Bagian ke-13 : Ppenangannan bibit pohon hutan melalui pembiakan generatif (biji). SNI 01-5006. 13- 2003.
Ernawati NL. 2008. Karakterisasi fenotipik dan molekuler bakteri patogen serta epidemi penyakit hawar daun bakteri pada bibit tanaman Acacia crassicarpa {disertasi}.
Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Fatimah S. 2005. Pengujian biofungisida Bio-LC4 dan pengaruhnya terhadap pertumbuhan caisim (Brassica rapa L. Cv. Group Caisin). [skripsi].
Bogor : Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Ghezzi JI, Steck TR. 1999. Induction of the viable but non-culturable condition in Xanthomonas campestris pv. campestris in liquid microcosms and sterile soil. FEMS Microbiol Ecol 30:203-208.
Harni R, Supramana, Munif A, Mustika I. 2006.
pengaruh metode aplikasi bakteri endofit
terhadap perkemabngan nematoda peluka akar (Pratylenchus brachyurus) pada tanaman nilam. Littri 12:161-165.
Dewi IK. 2005. Aplikasi biopestisida Bio-LC4 terhadap pertumbuhan bibit akasia (Acacia crassicarpa). [skripsi]. Bogor : Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Koesmaryono Y. 1999. Hubungan cuaca-iklim dengan penyakit tanaman. Bogor: Institut Pertanian Bogor, Fakultas Peternakan.
Machmud M. 1994. Present status of bacterial diseases of major crop in Indonesia. Di dalam:
Mien AR, editor. Biology and Control of Pathogen. Proceding of Symposium on Biology and Control of Pathogens. Bogor.
SEAMEO BIOTROP. Hlm 54.
Mulyaningsih C. 2002. Aktivitas ekstrak miselium Lentinus isolat LC terhadap beberapa mikrob patogen tanaman dan cendawan penghasil aflatoksin [Skripsi]. Bogor: Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Old KM, Lee SS, Sharma JK, Zi QY. 2000. A manual of disease of tropical acacias in Australia, South-East Asia and India. Jakarta:
Center for International Forestry Research.
Pegler DN. 1983. The Genus Lentinus: A World Monograph. London: HMSO.
Prosea. 1995. Plant Resources of South-East Asia.
Bogor: Prosea Foundation.
Semangun H. 1991. Penyakit-penyakit Tanaman Pangan di Indonesia. Yogyakarta: Gajahmada University Press.
Sinclair JB. 1993. Control of seedborne pathogen and diseases of soybean seeds and seedlings. J Pesticide Sci 37: 15-19.
Subba Rao NS. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Edisi kedua.
Jakarta: Universitas Indonesia.
Sudirman LI. 1992. Purification et recherche de la structure d’antibiotiques de Lentinus squarrosulus actifs contre Rigidoporus lignosus, a parasite de I’hevea [Disertasi].
Prancis: Faculte de Science, Universite de Nancy I.
Sudirman LI, Lefebvre G, Kiffer E, Botton B.
1994. Purification of antibiotics produced by Lentinus squarrosulus and preliminary characterization of a compound active against Rigidoporus lignosus. Curr Miicrobiol 29:1-6 Sudirman LI. 1995. Pemanfaatan Lentinus spp.
dalam menunjang industri farmasi dan pertanian. Agrotex 2: 55-59.
Sudirman LI. 2002. Senyawa antibiotik baru dari jamur tropis Lentinus yang berguna bagi pertanian dan farmasi. Seminar Bioteknologi.
Bandung 10-11 Oktober 2002.
Sudirman LI. 2005. Deteksi senyawa antimikrob yang diisolasi dari beberapa Lentinus tropis dengan metode bioautografi. Hayati 12:67-72.
Tristanti W. 2003. Uji aktivitas formulasi bahan aktif dari miselium Lentinus cladopus LC4 in vitro dan in vivo terhadap patogen tanaman kedelai Xanthomonas campestris pv. glycines [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Wage S. 1998. Spektrum aktivitas Lentinus spp.
terhadap beberapa mikrob patogen tanaman [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Weller, D.M. 1988. Biological control of soil- borne pathogens in the rhizosphere with bacteria. Annu Rev Phytopathol. 26: 379-407.