7 2.1 Mycobacterium tuberculosis
Mycobacterium tuberculosis (Mtb) merupakan jenis bakteri yang menyebabkan penyakit TB. Mtb pertama kali ditemukan oleh Robert Koch pada tahun 1882. Bakteri Mtb termasuk ke dalam genus Mycobacterium dengan bentuk sel basiler. Karakteristik dari bakteri dalam genus tersebut adalah struktur dinding sel yang kaya akan kandungan lipid sehingga membentuk barrier yang hidrofobik dan memiliki permeabilitas rendah serta menyediakan proteksi terhadap agen antimikroba (Chan et al., 2006). Struktur dinding sel tersebut menyebabkan sulitnya pewarnaan terhadap bakteri dalam genus tersebut. Namun ketika dapat terwarnai akan dapat mempertahankan hasil pewarnaan pada kondisi asam mineral encer sehingga pewarnaan Mycobacterium dikenal sebagai pewarnaan basil tahan asam (BTA). Kultur bakter Mtb biasanya dilakukan pada media Lowenstein-Jensen (LJ) dengan suhu optimum 37oC dan pH 6,8 selama masa inkubasi hingga 6 minggu. Waktu multiplikasi bakteri ini sangat lambat, yaitu berkisar 14-16 jam. Mtb akan mati pada pemanasan 60oC selama 15-20 menit (Vasanthakumari, 2007).
2.2 Multidrug Resistant Tuberculosis (MDR-TB)
MDR-TB adalah penyakit tuberkulosis yang disebabkan oleh strain
INH (WHO, 2012). Pada tahun 2012, WHO mencanangkan program post-2015
global TB strategy sebagai tinjak lanjut atas tercapainya program Millenium Development Goals (MDGs) 2015 dalam hal pengendalian Tuberkulosis (TB).
Tujuan program tersebut adalah untuk menghentikan epidemi TB secara global pada tahun 2035. Peningkatan kasus resistensi obat antituberkulosis; OAT merupakan ancaman utama terhadap keberhasilan program pengendalian TB (WHO, 2015).
RIF dan INH termasuk ke dalam obat lini pertama atau primer pada infeksi
Mtb. Pengobatan MDR-TB dilakukan dengan OAT lini kedua. Pengobatan ini
lebih lama, lebih mahal dan regimen terapinya lebih rumit. Pasien MDR-TB membutuhkan waktu beberapa bulan lebih lama, bahkan mungkin mencapai 2 hingga 3 tahun untuk menjadi kultur negatif dibandingkan dengan pasien TB tanpa MDR (Dipiro et al., 2008). Beberapa efek yang potensial terjadi pada pengobatan MDR TB yaitu pasien mendapatkan pengobatan yang tidak adekuat dalam waktu lama, peningkatan resiko kegagalan pengobatan atau kematian, seleksi terhadap strain yang resisten terhadap OAT, pasien tetap terinfeksi, dan meningkatkan penyebaran penyakit (Tessema, et al., 2012).
Kejadian resistensi OAT dapat terjadi karena ketidaksesuaian regimen dosis terapi, ketidaktaatan pasien, dan ketersediaan OAT yang rendah sehingga pengobatan TB menjadi tidak adekuat. Secara molekuler, diketahui bahwa mekanisme resistensi terjadi karena adanya mutasi pada gen pengkode target OAT atau protein tertentu yang berperan dalam aktivasi OAT dalam tubuh. Beberapa penelitian telah dilakukan untuk mengetahui mutasi pada gen-gen yang berperan
dalam mekanisme resistensi OAT terutama pada kasus MDR-TB. Beberapa mutasi gen yang berperan terhadap kejadian resistensi OAT pada MDR-TB ditunjukkan pada Tabel 2.1.
Tabel 2.1 Mutasi gen yang berperan terhadap resistensi OAT (Zhang dan Yew, 2009; Da Silva dan Palomino, 2011)
OAT Mekanisme
Kerja Obat
Gen yang Mengalami
Mutasi
Produk Gen Frekuensi Mutasi INH Inhibisi biosintesis asam mikolat katG inhA ahpC kasA ndh Katalase persksidase Anoyl-ACP reduktase Alkil hidroksi-peroksidase reduktase -50-95% 8-43% -RIF Inhibisi sintesis
RNA
rpoB Subunit β dari RNA polimerase
95%
2.3 Resistensi RIF
RIF merupakan agen bakterisidal yang bekerja dengan cara berinteraksi dengan RNA polimerase DNA-dependent untuk menghambat transkripsi dan pemanjangan rantai RNA. Dari empat subunit RNA polimerase, subunit yang mengkode gen rpoB merupakan yang paling penting karena dengan terjadinya mutasi genetik pada unit ini, RIF tidak dapat berikatan dengan enzim RNA polimerase dan menyebabkan resistensi bakteri M. tuberculosis terhadap RIF (Raoot dan Dev, 2012).
Daerah yang paling sering mengalami mutasi dan menyebabkan resistensi terhadap RIF disebut sebagai RRDR. Segmen tersebut mencakup kodon 507
hingga 533. Mutasi pada segmen ini didominasi oleh perubahan nukleotida tunggal yang menghasilkan substitusi asam amino tunggal, walaupun delesi dan insersi juga terjadi dalam frekuensi yang rendah (Raoot dan Dev, 2012). Frekuensi mutasi pada gen rpoB bervariasi pada berbagai daerah geografis. Selain itu, titik mutasi juga mempengaruhi tingkat resistensi Mtb terhadap RIF ketika data mutasi dicocokan dengan hasil DST (Wang et al., 2013). Frekuensi mutasi beberapa kodon pada daerah RRDR dapat dilihat pada Tabel 2.2 berikut.
Tabel 2.2 Frekuensi mutasi pada kodon di daerah RRDR
No. Kodon Frekuensi Mutasia
1 533 0 – 7,7 % 2 531 3,7 – 66,6 % 3 526 12,1 – 29,7% 4 522 0 – 5,3 % 5 516 3,1 – 18,2% 6 513 0 – 11,1% 7 511 0 – 9,4% 8 510 0 – 47,7%b 9 Lainnya 0 – 18,8% Keterangan : a = Chen et al., 2010
b = Saeed et al., 2009;Bestanabad et al., 2011; Agdamag et al., 2003
Missense mutations pada kodon 526 hingga 531 telah dilaporkan memiliki
peran krusial pada tingginya angka kejadian resistensi terhadap RIF. Mutasi pada kodon 513, 526, dan 531 berkaitan dengan tingkat resistensi yang tinggi pada RIF sedangkan mutasi pada kodon 516 dikaitkan dengan tingat resistensi yang rendah pada RIF. Hal tersebut dikarenakan isolat yang mengalami mutasi pada kodon 516 menunjukkan nilai MIC yang lebih rendah secara signifikan dibandingkan isolat
yang mengalami mutasi pada kodon 513, 526, dan 531 (del-Valle et al., 2001). Hasil penelitian Bodmer et al. (1995) menunjukkan bahwa isolat M. tuberculosis yang mengalami mutasi pada kodon 513, 526, dan 531 memiliki nilai MIC rifampisin, rifabutin, dan rifapentin yang tinggi (> 8 mg/L) bila dibandingkan dengan isolat wildtype. Sementara itu, hasil penelitian Ma et al. (2006) dan Wang
et al. (2013) menunjukkan bahwa mutasi pada kodon 533 tidak menujukkan
korelasi dengan kejadian resistensi RIF.
Penelitian yang dilakukan terhadap isolat MDR-TB di Bali menunjukan adanya mutasi gen rpoB pada kodon 418, 510, 516, 526, dan 531 (Pradnyaniti, 2013; Rusyanthini, 2013; Wijaya, 2013). Jenis mutasi yang ditemukan pada isolat MDR-TB tersebut adalah mutasi titik yang menyebabkan perubahan asam amino (missense mutation). Selain pada daerah RRDR, beberapa mutasi di luar daerah RRDR juga dikaitkan dengan kejadian resistensi RIF. Namun, frekuensi terjadinya mutasi sangat kecil. Siu et al. (2011) telah mengidentifikasi dua mutasi yang jarang terjadi di luar daerah RRDR yaitu pada kodon 146 (V146F) dan kodon 572 (I572F). Mutasi pada kodon 572 juga diidentifikasi oleh del-Valle et
al. (2001).
2.4 Mutasi Gen
Mutasi didefinisikan sebagai perubahan urutan basa nukleotida pada untaian molekul DNA sebagai akibat dari penggantian, penambahan, atau pengurangan pasang basa pada molekul DNA. Mutasi dapat disebabkan oleh adanya paparan mutagen yang menyebabkan kerusakan pada molekul DNA atau kesalahan pada
saat proses replikasi DNA. Apabila mutasi terjadi pada untaian DNA yang berperan dalam proses sintesis protein maka mutasi tersebut dapat menyebabkan terbentuknya protein yang memiliki sekuen asam amino abnormal (Chatterjea dan Shinde, 2012; Lieberman dan Marks, 2013). Secara garis besar, mutasi dibedakan menjadi 2 jenis yaitu mutasi titik (point mutation) dan frameshift mutation.
2.4.1 Point mutation
Mutasi titik (point mutation) melibatkan perubahan pada nukleotida tunggal sehingga sering disebut sebagai substitusi nukelotida. Mutasi titik dibedakan menjadi 2 jenis berdasarkan perubahan jenis basa nukelotida yang terjadi, yaitu transisi dan tranversi. Transisi merupakan subtitusi basa nukleotida purin menjadi purin (A→G atau G→A) atau pirimidin menjadi pirimidin (C→T atau T→C). Sedangkan transversi adalah subtitusi basa nuklotida purin mennjadi primidin atau sebaliknya (Chatterjea dan Shinde, 2012; Young, 2010). Berdasarkan efeknya terhadap asam amino atau protein yang dihasilkan, subtitusi basa nukleotida tunggal dapat menyebabkan 3 jenis mutasi yaitu sebagai berikut. a. Silent mutation adalah adanya substitusi basa nukelotida dalam suatu kodon
pada jenis mutasi ini tidak menyebakan adanya perubahan asam amino yang dikode kodon tersebut. Misalnya pada asam amino valin yang dikode oleh empat kodon yang berbeda, yaitu GUU, GUA, GUC, dan GUG. Adanya substitusi pada basa nukleotida ketiga dari tiap kodon tersebut tidak akan menyebabkan perubahan asam amino (Young, 2012).
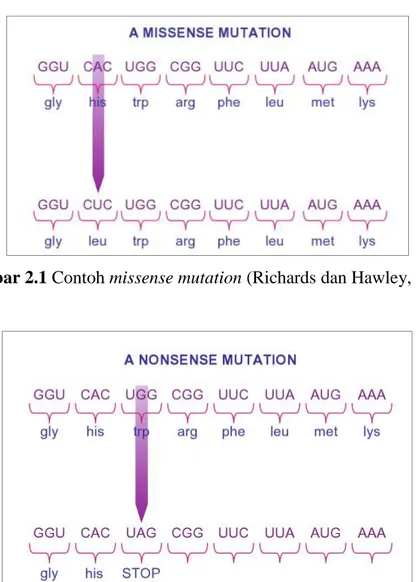
b. Missense mutation adalah adanya substitusi basa nukleotida yang menyebabkan perubahan sekuen asam amino sehingga dapat menyebabkan
perubahan struktur protein dan mungkin juga menyebabkan perubahan fungsi protein. Missense mutation yang menyebabkan perubahan sekuen asam amino tanpa merubah fungsi protein yang dihasilkan disebut missense mutation konservatif. Sedangkan missense mutation non-konservatif menyebabkan terjadinya perubahan fungsi protein (Young, 2012; Richards dan Hawley, 2011). Contoh missense mutation adalah mutasi pada kodon CAC (histidin) menjadi CUC (leusin) yang ditunjukkan pada Gambar 2.1.
Gambar 2.1 Contoh missense mutation (Richards dan Hawley, 2011)
c. Nonsense mutation adalah subtitusi pada basa nukleotida dalam suatu kodon yang menyebabkan terbentuknya kodon stop (UAG, UGA, atau UAA).
Nonsense mutation menyebabkan terjadinya terminasi lebih awal pada proses
translasi sehingga protein yang dihasilkan terpotong dengan sekuen asam amino yang tidak lengkap (truncated protein) dan bersifat inaktif. Apabila
nonsense mutation terjadi pada daerah awal reading frame dari gen, maka
protein mungkin sama sekali tidak dihasilkan (Richards dan Hawley, 2011). Contoh nonsense mutation ditunjukkan pada Gambar 2.2.
Gambar 2.3 Contoh frameshift mutation akibat (a) delesi dan (b) insersi (Chatterjea dan Shinde, 2012)
2.4.2 Frameshift mutation
Frameshfit mutation melibatkan adanya proses insersi (penambahan) atau
delesi (pengurangan) dari urutan basa nukelotida sehingga terjadi perubahan (a)
reading frame. Perubahan reading frame akan menyebabkan terbentuknya sekuen
asam amino yang berbeda dari sekuen asam amino yang seharusnya dihasilkan, sehingga terbentuk protein baru yang lebih panjang atau lebih pendek dari protein yang seharusnya dihasilkan (Chatterjea dan Shinde, 2012; Richards dan Hawley, 2011). Contoh perubahan reading frame pada frameshift mutation ditunjukkan pada Gambar 2.3.
2.5 Enzim Restriksi
Enzim restriksi merupakan enzim yang berperan dalam pemotongan untai
double helix DNA secara spesifik pada urutan basa nukleotida tertentu. Enzim
restriksi yang tersedia saat ini umumnya diperoleh dari bakteri dan archae (Khan, 2012). Enzim restriksi akan berikatan pada urutan nukleotida spesifik atau yang dikenal dengan situs pemotongan spesifik (situs restriksi) pada DNA target yang selanjutnya akan memotong DNA pada daerah tersebut. Enzim restriksi berinteraksi dengan DNA melalui ikatan hidrogen multiple (umumnya 10-15) dan beberapa ikatan van der Waals. Situs pengenalan spesifik enzim restriksi umumnya terdiri dari empat hingga enam urutan basa nukleotida dan urutan tersebut dapat membentuk pola palindrom. Pola palindrom merupakan urutan basa nukleotida yang sama dari arah yang berlawanan (Clark dan Pazdernik, 2015; Walker dan Rapley, 2005).
Sebagian besar enzim restriksi bekerja optimum pada pH 7,4. Beberapa enzim memerlukan buffer dengan pH tertentu bergantung pada pH optimal enzim dan persyaratan kekuatan ionik yang dibutuhkan untuk restriksi. Komponen utama
buffer untuk reaksi enzim restriksi adalah natrium klorida (NaCl) dan magnesium
(Mg2+). Magnesium dalam buffer reaksi enzim restriksi mutlak diperlukan karena ion magnesium diperlukan sebagai kofaktor enzim untuk dapat berfungsi saat restriksi DNA substrat. Pada beberapa enzim juga diperlukan dithitheritol (DTT) yang akan menstabilkan enzim dan mencegah inaktivasi enzim selama proses digesti (Brown, 2016). Setiap produsen enzim restriksi umumnya telah menentukan kondisi optimal digesti masing-masing enzim restriksi sehingga dalam pembelian enzim restriksi akan disertai dengan larutan buffer yang sesuai untuk aktivitas enzim tersebut dan informasi aktivitas enzim pada buffer yang disediakan. Larutan buffer tersebut biasanya tersedia dalam konsentrasi 10X yang kemudian dapat diencerkan menjadi larutan buffer 1X untuk digunakan pada digesti enzim restriksi (Karcher, 1995).
Gambar 2.4 Mekanisme pemotongan DNA oleh enzim restriksi (Pingoud dan Jelstch, 2001)
buffer untuk reaksi enzim restriksi adalah natrium klorida (NaCl) dan magnesium
(Mg2+). Magnesium dalam buffer reaksi enzim restriksi mutlak diperlukan karena ion magnesium diperlukan sebagai kofaktor enzim untuk dapat berfungsi saat restriksi DNA substrat. Pada beberapa enzim juga diperlukan dithitheritol (DTT) yang akan menstabilkan enzim dan mencegah inaktivasi enzim selama proses digesti (Brown, 2016). Setiap produsen enzim restriksi umumnya telah menentukan kondisi optimal digesti masing-masing enzim restriksi sehingga dalam pembelian enzim restriksi akan disertai dengan larutan buffer yang sesuai untuk aktivitas enzim tersebut dan informasi aktivitas enzim pada buffer yang disediakan. Larutan buffer tersebut biasanya tersedia dalam konsentrasi 10X yang kemudian dapat diencerkan menjadi larutan buffer 1X untuk digunakan pada digesti enzim restriksi (Karcher, 1995).
Gambar 2.4 Mekanisme pemotongan DNA oleh enzim restriksi (Pingoud dan Jelstch, 2001)
buffer untuk reaksi enzim restriksi adalah natrium klorida (NaCl) dan magnesium
(Mg2+). Magnesium dalam buffer reaksi enzim restriksi mutlak diperlukan karena ion magnesium diperlukan sebagai kofaktor enzim untuk dapat berfungsi saat restriksi DNA substrat. Pada beberapa enzim juga diperlukan dithitheritol (DTT) yang akan menstabilkan enzim dan mencegah inaktivasi enzim selama proses digesti (Brown, 2016). Setiap produsen enzim restriksi umumnya telah menentukan kondisi optimal digesti masing-masing enzim restriksi sehingga dalam pembelian enzim restriksi akan disertai dengan larutan buffer yang sesuai untuk aktivitas enzim tersebut dan informasi aktivitas enzim pada buffer yang disediakan. Larutan buffer tersebut biasanya tersedia dalam konsentrasi 10X yang kemudian dapat diencerkan menjadi larutan buffer 1X untuk digunakan pada digesti enzim restriksi (Karcher, 1995).
Gambar 2.4 Mekanisme pemotongan DNA oleh enzim restriksi (Pingoud dan Jelstch, 2001)
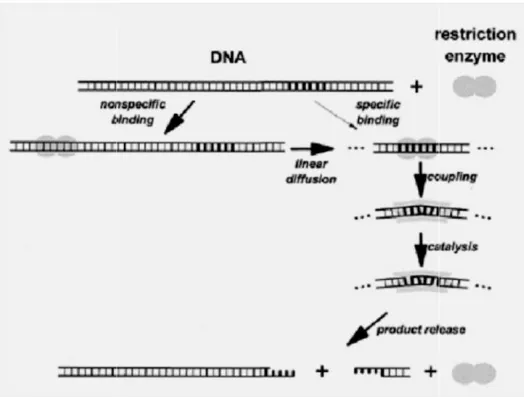
Mekanisme pemotongan oleh enzim restriksi dapat dilihat pada Gambar 2.4. Secara umum, proses pemotongan DNA oleh enzim restriksi diawali dengan interaksi nonspesifik antara enzim restriksi dengan DNA khususnya pada gugus fosfat. Selanjutnya, enzim restriksi bergerak sepanjang untai DNA melalui difusi linier hingga situs pengenalan spesifik ditemukan. Pada saat enzim restriksi menemukan situs pengenalan spesifik, molekul air akan dilepas dan terbentuk ikatan hidrogen antara enzim restriksi dengan basa nukleotida pada situs pengenalan. Setelah kompleks spesifik DNA-enzim restriksi terbentuk, masing-masing DNA dan enzim restriksi akan mengalami perubahan konformasi untuk aktivasi reaksi katalisis. Kemudian, enzim restriksi dengan bantuan Mg2+ akan memotong ikatan fosfodiester (reaksi katalisis) pada tiap untai DNA. Pemotongan ikatan fosfodiester tersebut akan menyebabkan terpotongnya untai DNA sesuai dengan posisi pemotongan (Williams, 2003; Pingoud dan Jeltsch, 2001).
Tabel 2.3 Perbedaan tipe enzim restriksi (Stenesh, 1998) Enzim restriksi
Tipe I Tipe II Tipe III
Situs pemotongan 1-10 kpb dari situs pengenalan
Dalam situs pengenalan
24-26 pb dari situs pengenalan
Subunit Multisubunit Subunit tunggal Multisubunit
Kebutuhan ATP Ya Tidak Tidak
Berdasarkan daerah pemotongan, jumlah subunit, dan kebutuhan ATP pada proses restriksi maka enzim restriksi dibagi menjadi tiga tipe yang ditnjukkan pada Tabel 2.3. Dari ketiga tipe tersebut, enzim restriksi tipe II merupakan enzim
restriksi yang paling sering dimanfaatkan dalam bidang biologi molekuler. Hal tersebut dikarenakan situs pemotongan enzim restriksi tipe II berada dalam situs pengenalannya, sehingga pemotongan DNA menjadi sangat spesifik pada sekuen tertentu (Stenesh, 1998). Selain itu, enzim restriksi tipe II umumnya memiliki situs pengenalan yang palindrom (Clark dan Pazdernik, 2015).
Gambar 2.5 Pemotongan enzim restriksi tipe II pada untai DNA (Clark dan Pazdernik, 2015)
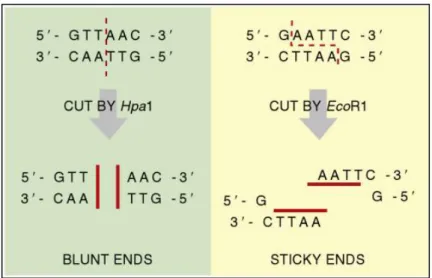
Enzim restriksi tipe II dapat memotong untai DNA dengan dengan menghasilkan dua tipe fragmen, yaitu blunt end dan sticky end. Pada mekanisme pemotongan blunt end, enzim tersebut memotong DNA tepat pada posisi yang sama sehingga menghasilkan dua fragmen DNA dengan ujung untai ganda. Sedangkan pada mekanisme pemotongan sticky end, enzim tersebut memotong pada urutan yang sama dari situs pengenalan namun pada posisi yang tidak sama tepat sehingga akan menghasilkan dua fragmen DNA dengan ujung untai tunggal pendek (Clark dan Pazdernik, 2015). Mekanisme pemotongan tersebut dapat dilihat pada Gambar 2.5.
2.6 Pemilihan Enzim Restriksi
Berbagai jenis enzim restriksi telah berhasil diidentifikasi dari organisme prokariot dan beberapa diantaranya telah dimanfaatkan dalam penelitian biologi molekuler. Setiap enzim restriksi memiliki karakterisitk tersendiri, sehingga dalam pemanfaatannya perlu diperhatikan berapa kriteria pemilihan enzim restriksi. Menurut Gerstein (2001), beberapa kriteria yang perlu dipertimbangkan dalam pemilihan enzim retriksi adalah titik pemotongan yang dikehendaki pada DNA, star activity, sensitivitas terhadap metilasi, dan kemampuan enzim restriksi memotong jenis sampel DNA yang digunakan.
Titik pemotongan yang dikehendaki pada DNA merupakan pertimbangan utama dalam pemilihan enzim restriksi karena setiap enzim restriksi memiliki situs restriksi yang spesifik. Jumlah situs restriksi pada sampel DNA juga perlu dipertimbangkan karena situs restriksi yang terlalu banyak dapat menyebaban proses restriksi berlangsung lebih lama dan terjadi partial digestion (Gerstein, 2001). Berdasarkan titik pemotongan yang dikehendaki, maka ukuran fragmen yang dihasilkan juga harus diperhatikan. Ukuran fragmen yang dihasilkan akan menjadi pertimbangan dalam pemilihan metode yang digunakan pada analisis fragmen restriksi. Umumnya, metode analisis fragmen yang digunakan adalah elektroforesis. Pada elektroforesis, konsentrasi dan jenis gel yang digunakan sangat menentukan resolusi pemisahan DNA untuk analisis fragmen restriksi (Brown, 2016).
Star activity merupakan kemampuan enzim restriksi untuk dapat memotong
reaksi tidak optimal). Star activity dapat disebabkan oleh pH buffer yang tinggi, waktu inkubasi yang lama, konsentrasi enzim yang tinggi, konentrasi gliserol yang tinggi, dan adanya pelarut organik. Pada enzim EcoRI pada kondisi pH
buffer yang tinggi diketahui dapat memotong pada urutan N▼AATTC, walaupun situs restriksinya pada kondisi spesifik adalah G▼AATTC (Gerstein, 2001). Menurut Wei et al. (2008), star activity diinyatakan dengan nilai fidelity index (FI) yaitu rasio jumlah tertinggi enzim yang tidak menimbulkan star activity terhadap jumlah minimum enzim yang diperlukan untuk mendigesti DNA secara keseluruhan (complete digestion). Semakin tinggi nilai FI suatu enzim, maka potensi adanya star activity akan semakin besar. Untuk mencgeah terjadinya star
activity, maka kondisi kondisi reaksi restriksi harus diatur dengan buffer yang
sesuai agar tercapai kondisi optimal.
2.7 PCR
Polymerase Chain Reaction (PCR) adalah suatu teknik amplifikasi segmen
nukleotida spesifik secara in vitro. Teknik PCR merupakan teknik yang sensitif, selektif, dan cepat dalam amplifikasi segmen nukleotida yang diinginkan. PCR didasarkan pada proses enzimatik oleh DNA polimerase pada replikasi DNA. Pada Replikasi DNA terjadi reaksi polimerisasi nukleotida menggunakan untaian DNA sebagai cetakan (template) dengan bantuan enzim DNA polimerase serta diperlukan suatu primer yang akan menginisiasi polimerisasi rantai nukleotida. PCR melibatkan siklus reaksi polimerisasi yang berulang untuk menghasilkan
salinan segmen nukleotida dengan kuantitas tinggi walaupun jumlah sampel nukleotida yang digunakan sangat kecil (Stephenson, 2010; Gupta, 2008).
PCR pertama kali dikembangkan oleh Karry Mullis dan koleganya pada tahun 1985. Pada awalnya amplifikasi sekuen DNA dengan PCR dilakukan menggunakan primer oligonukleotida spesifik dan enzim DNA polimerase bakteri. Pada perkembangannya, diketahui bahwa penggunaan DNA polimerase termostabil dapat meningkatkan efektivitas amplifikasi hingga mampu menghasilkan salinan DNA target lebih dari 107kali lipat walaupun sekuen target hanya tersedia satu dari 100.000 untai DNA pada reaksi. Dengan berbagai perbaikan teknik dan variasi penggunaan PCR, saat ini PCR telah dimanfaatkan dalam berbagai hal seperti deteksi penyakit infeksi, studi mekanisme inflamasi, analisis mutasi, dan deteksi tumor (Cagle dan Allen, 2009).
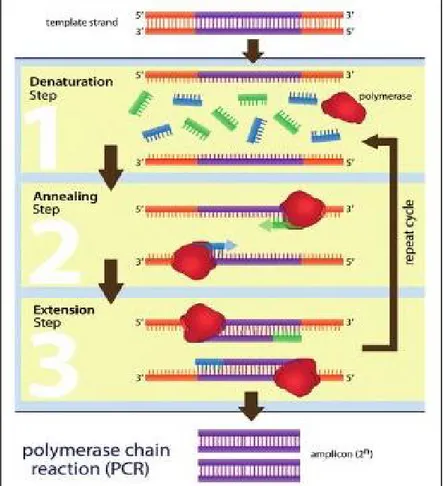
Proses PCR dibagi menjadi tiga tahap dasar, yaitu: (1) denaturasi; (2) penempelan primer oligonukleotida pada sekuen target (annealing); dan (3) pemanjangan primer-sekuen target dengan bantuan DNA polimerase (extension). Tahapan dasar PCR tersebut akan terulang sejalan dengan pengulangan siklus PCR. Ketiga tahapan dasar PCR tersebut dapat dilihat pada Gambar 2.6.
Pada tahap denaturasi, double-stranded DNA (dsDNA) didenaturasi menjadi
single-stranded DNA (ssDNA). Faktor utama yang mempengaruhi tahapan ini
adalah melting temperature atau suhu yang diperlukan dari untai double helix DNA untuk dapat terdenaturasi menjadi ssDNA. Melting temperature ditentukan berdasakan komposisi nukleotida terutama komposisi guanin-sitosin (GC). Hal tersebut dikarenakan komposisi GC memiliki ikatan hidrogen yang lebih kuat
sehingga memerlukan energi yang lebih besar untuk terdisosiasi dibandingkan ikatan hidrogen pada adenin-timin. Denaturasi awal umumnya dilakukan pada suhu 94oC selama 6 hingga 8 menit. Pada siklus berikutnya umumnya proses denaturasi diperpendek menjadi 1 hingga 2 menit (Bartlett et al., 2015).
Gambar 2.6 Tiga tahapan utama dalam PCR (Bartlett et al., 2015)
Ketika DNA sampel telah terdenaturasi menjadi ssDNA, akan proses
annealing terjadi yaitu primer oligonukleotida menempel pada sekuen target
secara spesifik. Suhu annealing biasanya ditentukan melalui optimasi. Tahap
annealing biasanya berlangsung selama 1 hingga 2 menit. Setelah primer
untai DNA komplementer sehingga dihasilkan salinan sekuen DNA target atau yang disebut sebagai amplikon. Proses polimerisasi tersebut merupakan tahapan ekstensi. Tahapan tersebut ditentukan oleh dua faktor utama, yaitu suhu dan panjang ekstensi. Faktor suhu berkaitan dengan aktivitas optimum DNA polimerase dan panjang ekstensi ditentukan berdasarkan aktivitas DNA polimerase dan panjang sekuen target. Secara umum, tahap ekstensi dilakukan pada suhu 72oC dengan waktu 1 menit per kilo pasang basa (kpb) nukleotida. Waktu ekstensi bersifat spesifik untuk tiap reaksi dan ditentukan melalui optimasi. Dengan adanya pengulangan siklus PCR, maka jumlah amplikon yang akan dihasilkan dari satu molekul DNA target dinyatakan dengan 2x, yang mana x menyatakan jumlah siklus PCR yang dilakukan (Bartlett et al., 2015).
Untuk melaksanakan proses PCR, diperlukan beberapa komponen reaksi. Komponen- komponen yang diperlukan pada proses PCR adalah templat DNA; sepasang primer, yaitu suatu oligonukleotida pendek yang mempunyai urutan nukleotida yang komplementer dengan urutan nukleotida DNA templat; dNTPs (Deoxynucleotide triphosphates); buffer PCR; magnesium klorida (MgCl2) dan enzim DNA polimerase (Handoyo dan Rudiretna, 2001).
2.8 PCR-RFLP
PCR-RFLP merupakan salah satu varian teknik analisis PCR yang didasarkan pada mekanisme pemotongan DNA secara spesifik oleh enzim restriksi endonuklease. Suatu enzim restriksi endonuklease memiliki situs pemotongan yang spesifik. Adanya polimorfisme pada untaian DNA akan
menyebabkan perubahan pada situs pengenalan enzim restriksi, sehingga ketika DNA yang mengalami polimorfisme didigesti dengan enzim restriksi tertentu akan menghasilkan fragmen DNA yang berbeda dibandingkan fragmen DNA normal (Leonard, 2007). Analisis produk PCR dengan enzim restriksi dapat dilakukan untuk identifikasi adanya polimorfisme DNA antarindividu dan untuk deteksi mutasi pada amplikon (Walker dan Rapley, 2005).
Apabila terjadi mutasi pada DNA dan mutasi tersebut menyebabkan adanya perubahan situs pengenalan enzim restriksi, maka deteksi mutasi dapat dilakukan dengan metode ini menggunakan enzim restriksi yang sesuai. Perubahan situs pengenalan enzim restriksi karena adanya mutasi dapat berupa inaktivasi atau penambahan situs pengenalan, yang berpengaruh terhadap jumlah dan panjang fragmen DNA yang terbentuk ketika dilakukan digesti dengan enzim restriksi (Buckingham, 2012). Pada prinsipnya, sekuen target dalam analisis PCR-RFLP akan diamplifikasi terlebih dahulu dengan PCR. Produk PCR kemudian didigesti dengan enzim restriksi tertentu dan fragmen hasil digesti dipisahkan serta divisualisasikan dengan elektroforesis (Walker dan Rapley, 2005).
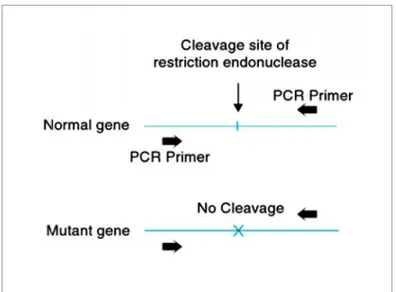
Analisis RFLP pada hasil PCR akan menghasilkan pola pita DNA tertentu ketika dilakukan pemisahan dengan elektroforesis (Filippis dan McKee, 2013). Pada Gambar 2.7, dapat dilihat bahwa dengan adanya mutasi akan menyebabkan inaktivasi situs restriksi karena terjadi perubahan urutan basa nukleotida. Gen normal yang dipotong oleh enzim restriksi akan menghasilkan dua buah fragmen yang pada elektroforesis akan terlihat adanya dua pita, sedangkan gen yang
mengalami mutasi tidak terpotong oleh enzim restriksi dan pada elektroforesis akan terlihat hanya satu pita saja seperti yang terlihat pada Gambar 2.8.
Gambar 2.7 Mutasi gen yang menyebabkan inaktivasi situs pengenalan enzim restriksi (Burns et al., 2007)
Gambar 2.8 Contoh elektroforegram hasil pemotongan produk PCR dengan enzim restriksi spesifik (Fratamico et al., 2005)
PCR-RFLP memiliki beberapa kelebihan, yaitu jumlah sampel DNA yang diperlukan sedikit, tidak memerlukan peralatan khusus karena hasil analisis dapat
Molecular weight standard Molecular weight standard Mutant gene Normal gene
mengalami mutasi tidak terpotong oleh enzim restriksi dan pada elektroforesis akan terlihat hanya satu pita saja seperti yang terlihat pada Gambar 2.8.
Gambar 2.7 Mutasi gen yang menyebabkan inaktivasi situs pengenalan enzim restriksi (Burns et al., 2007)
Gambar 2.8 Contoh elektroforegram hasil pemotongan produk PCR dengan enzim restriksi spesifik (Fratamico et al., 2005)
PCR-RFLP memiliki beberapa kelebihan, yaitu jumlah sampel DNA yang diperlukan sedikit, tidak memerlukan peralatan khusus karena hasil analisis dapat
Molecular weight standard Molecular weight standard Mutant gene Normal gene
mengalami mutasi tidak terpotong oleh enzim restriksi dan pada elektroforesis akan terlihat hanya satu pita saja seperti yang terlihat pada Gambar 2.8.
Gambar 2.7 Mutasi gen yang menyebabkan inaktivasi situs pengenalan enzim restriksi (Burns et al., 2007)
Gambar 2.8 Contoh elektroforegram hasil pemotongan produk PCR dengan enzim restriksi spesifik (Fratamico et al., 2005)
PCR-RFLP memiliki beberapa kelebihan, yaitu jumlah sampel DNA yang diperlukan sedikit, tidak memerlukan peralatan khusus karena hasil analisis dapat
Molecular weight standard Molecular weight standard Mutant gene Normal gene
divisualisasikan dengan gel agarosa, dan analisis dapat dilakukan secara cepat. Sehingga, metode tersebut dapat dilakukan dengan sederhana untuk analisis rutin di laboratorium tanpa memerlukan biaya yang tinggi (Leonard, 2007; Walker dan Rapley, 2005; Filippis dan McKee, 2013). Metode ini juga memiliki beberapa kelemahan. Yang pertama, elektroforesis konvensional memiliki keterbatasan pada pemisahan fragmen DNA yang berukuran sekitar 0,2k pb hingga 20k pb. Sehingga, besar fragmen restriksi harus berada pada rentang tersebut untuk dapat teramati pada elektroforesis. Kedua, enzim restriksi yang digunakan umumnya memotong pada beberapa titik dari fragmen DNA yang dianalisis sehingga menghasilkan beberapa pita pada hasil elektroforesis. Hal tersebut akan menyulitkan interpretasi terutama bila hasil pemotongan oleh enzim restriksi menghasilkan fragmen restriksi dengan ukuran yang tidak mampu dipisahkan pada elektroforesis dan adanya perbedaan pola restriksi antar isolat (Filippis dan McKee, 2013).
2.9 Elektroforesis
Elektroforesis merupakan teknik pemisahan suatu molekul dalam suatu campuran di bawah pengaruh medan listrik. Molekul terlarut dalam medan listrik bergerak atau bermigrasi dengan kecepatan yang ditentukan oleh rasio muatan dan massa. Sebagai contoh, jika dua molekul mempunyai massa dan bentuk yang sama, molekul dengan muatan lebih besar akan bergerak lebih cepat ke elektrode (Bhowmik dan Bose, 2011). Teknik ini dapat digunakan dengan memanfaatkan muatan listrik yang ada pada makromolekul, misalnya DNA yang bermuatan
negatif. Jika molekul yang bermuatan negatif dilewatkan melalui suatu medium, misalnya gel agarosa, kemudian dialiri arus listrik dari satu kutub ke kutub yang berlawanan muatannya, maka molekul tersebut akan bergerak dari kutub negatif le kutub positif. Selain bergantung pada rasio muatan terhadap massa molekul, kecepatan gerak molekul tersebut juga dipengaruhi oleh bentuk molekul, tegangan listrik (voltase) yang digunakan dan sifat medium (Yuwono, 2010; Wink, 2006).
Teknik elektroforesis dapat digunakan untuk analisis DNA, RNA, dan protein. Elektroforesis DNA dilakukan misalnya untuk menganalisis fragmen DNA hasil pemotongan dengan enzim restriksi dan menganalisis produk PCR (Bhowmik dan Bose, 2011). Elektroforesis dengan medium gel agarosa atau poliakrilamid merupakan metode standar untuk pemisahan, identifikasi, dan pemurnian fragmen DNA. Agarosa merupakan polisakarida yang diperoleh dari alga merah. Gel agarosa mempunyai daya pemisahan (resolusi) lebih rendah jika dibandingkan dengan gel poliakrilamid, tetapi mempunyai rentang pemisahan lebih besar. DNA dengan ukuran 100 pb hingga 10 kpb dapat dipisahkan dengan gel agarosa pada berbagai konsentrasi agarosa (Pelt-Verkuill et al., 2008). Molekul DNA untai ganda linier, yang diletakkan pada salah satu ujung gel, bergerak melalui matriks gel pada kecepatan yang berbanding terbalik terhadap log jumlah pasang basa. Molekul yang lebih besar bergerak lebih lambat karena terjadi gesekan yang lebih besar. Hal ini disebabkan karena DNA harus melewati pori-pori gel, sehingga kurang efisien lajunya diaripada molekul yang lebih kecil (Sudjadi, 2008).
Fragmen DNA linier dengan panjang tertentu bermigrasi dengan kecepatan yang berbeda pada gel yang mengandung konsentrasi agarosa berbeda pada gel yang mengandung konsentrasi agarosa berbeda (Sudjadi, 2008). Umumnya konsentrasi agarosa yang digunakan berkisar 0,7% hingga 2%. Semakin tinggi konsentrasi agarosa, resolusi pemisahan fragmen DNA dengan ukuran kecil akan semakin baik. Agarosa dengan konsentrasi 2% akan menunjukkan resolusi pemisahan yang baik terhadap DNA dengan ukuran 0,2 pb hingga 1 kpb (Bhowmik dan Bose, 2011). Dengan menggunakan konsentrasi gel agarosa yang bebeda, dimungkinkan untuk dapat memisahkan molekul DNA dengan berbagai ukuran. Rentang pemisahan beberapa konsentrasi gel agarosa dapat dilihat pada Tabel 2.4. Konsentrasi agarosa diatas 2% mungkin digunakan untuk pemisahan fragmen DNA dengan ukuran lebih kecil dari 100 pb, namun pada konsentrasi tersebut umumnya agarosa akan sulit untuk larut, dituang, serta memadat karena tingginya viskositas agarosa (Pelt-Verkuil et al., 2008; Bhowmik dan Bose, 2011).
Tabel 2.4 Rentang pemisahan pada gel agarosa (Sudjadi, 2008)
% agarosa dalam gel Efisiensi pemisahan molekul DNA linier (kb) 0,3 5-60 0,6 1-20 0,7 0,8-10 0,9 0,5-7 1,2 0,4-6 1,5 0,2-3 2,0 0,1-2