(KONYAKU) BAGI PENDERITA DIABETES MELLITUS
KARYA TULIS ILMIAH
Oleh :
Indira Yusvania Carolin NIM. 10.029
Akademi Analis Farmasi dan Makanan Putra Indonesia Malang
KARYA TULIS ILMIAH
Diajukan Kepada
Akademi Analis Farmasi dan Makanan Putra Indonesia Malang
untuk memenuhi salah satu persyaratan
dalam menyelesaikan program DIII
bidang Analis Farmasi dan Makanan
Oleh :
Indira Yusvania Carolin NIM. 10.029
Akademi Analis Farmasi dan Makanan
Putra Indonesia Malang
Karya tulis ini saya persembahkan kepada :
Tuhanku ALLAH SWT , yang selalu ada untuk ku.
Kedua orang tuaku yang selalu memfasilitasi, membimbing,
serta dukungan selama ini. Kalian tak akan kulupan seumur
hidup. Tanpa kalian aku tidak akan bisa jadi seperti ini.
Adikku Sabrina yang sering meminjamkan tasnya
Mbah ibuk yang selalu mendoakan dan memberi nasehat yang
berguna bagi kehidupanku
Tim terbaikku, agen glukomanan mba ayu asri dan ayem. Diki
bobii dan sahabat – sahabatku, dukungan dan pelajaran yang
kalian berikan tidak pernah aku lupakan. Terima kasih karena
kalian aku bisa bangkit seperti saat ini. Luv u all
Kepada Pak Sentot, Bu Ambar terima kasih atas
bimbingan yang diberikan selama ini
Dan semua teman – teman AKAFARMA angkatan 2010
dan seluruh keluarga besar PUTRA INDONESIA
MALANG
Semoga kita semua jadi orang yang sukses, di Dunia
maupun di Akhirat. Amin Ya Robbal Alamin
i
Puji syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Karya Tulis Ilmiah yang berjudul “Potensi Glukomanan Pada Tanaman Endemik Umbi Porang (Amorphophallus muelleri Blumei) Sebagai Pangan Terapi bagi penderita
Diabetes mellitus” ini tepat pada waktunya.
Adapun tujuan Karya Tulis Ilmiah ini adalah sebagai persyaratan untuk menyelesaikan program Diploma III di Akademi Analis Farmasi dan Makanan Putra Indonesia Malang.
Sehubungan dengan selesainya penulisan Karya Tulis Ilmiah ini, penulis mengucapkan terima kasih kepada :
1. Bapak Hendy Krisna Dhani,S.Si selaku Direktur Akademi Analis Farmasi dan Makanan Putra Indonesia Malang.
2. Bapak Drs. Sentot Joko Rahardjo, M.Si. selaku Dosen Pembimbing 3. Ibu Erna Susansti,M.Biomed.,Apt. selaku Dosen Penguji I
4. Bapak Edi Purwanto, S.Si., Apt. selaku Dosen Penguji II
5. Kedua orang tua dan keluarga besar yang telah memberikan doa, semangat serta motivasinya
6. Teman-teman mahasiswa Akafarma maupun Akfar dan semua pihak yang langsung maupun tidak langsung telah memberikan bantuan dan bimbingan, serta arahan kepada penulis.
ii
Penulis menyadari sepenuhnya bahwa Karya Tulis Ilmiah ini masih mempunyai beberapa kekurangan. Oleh karena itu, kritik dan saran akan sangat diharapkan. Semoga Karya Tulis Ilmiah ini dapat berguna dan bermanfaat.
Malang, September 2013
iii ABSTRAK
Carolin, Indira Yusvania, 2013.Potensi Glukomanan Pada Tanaman Endemik
Umbi Porang (Amorphophallus muelleri Blumei) Sebagai Pangan Terapi (konyaku) bagi penderita Diabetes mellitus. Karya Tulis Ilmiah. Akademi
Analis Farmasi Putra Indonesia Malang,Pembimbing Drs. Sentot Joko Rahardjo, M.Si
Kata Kunci :Porang (Amorphophallus muelleri Blumei), Senyawa Glukomanan, Diabetes mellitus
Porang (Amorphophallus muelleri Blumei) yaitu umbi - umbian dari keluarga araceae, merupakan tanaman semak yang dapat tumbuh dibawah naungan matahari.Umbi porang mengandung senyawa polisakarida jenis hemiselosa.Senyawa tersebut dinamakan glukomanan.Glukomaman mempunyai kemampuan menyerap air dan mengembang, senyawa tersebut mampu menyerap glukosa. Umbi porang dapat diolah produk pangan terapi untuk penyakit diabetes
mellitus.
Senyawa glukomanan di isolasi dengan metode hidrolisis enzimatis menggunakan enzim α-amilase pada suhu 105oC selama 2 jam. Hasil hidrolisa didapatkan rendemen glukomanan sebesar 50,9%. Isolat glukomanan dari umbi porang dibuat produk pangan yaitu konyaku.Untuk mengetahui aktifitas senyawa glukomanan dilakukan dengan pemberian produk ke hewan coba mencit (Mus
muscullus).Pemberian glukomanan dalam bentuk produk pangan untuk mencit
dengan variasi dosis pemberian. Dosis I dengan pemberian produk 0,06g/kgBB, dosis II pemberian produk 0,12g/kgBB, dosis III pemberian produk 0,18g/kgBB.
Hasil penelitian menunjukan bahwa senyawa glukomanan dapat menurunkan kadar gula dalam darah pada mencit. Dosis optimal pemberian produk dari umbi porang adalah dosis II yaitu 0,12g/kgBB.
iv DAFTAR ISI
KATA PENGANTAR ... i
ABSTRAK ... iii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang Masalah ... 1
1.2. Rumusan Masalah ... 3
1.3. Tujuan Penelitian ... 4
1.4. Kegunaan Penelitian ... 4
1.5. Asumsi Penelitian ... 5
1.6. Ruang Lingkup dan Keterbatasan Penelitian ... 5
1.7. Definisi Istilah ... 6
BAB II TINJAUAN PUSTAKA ... 7
2.1.Tanaman Endemik Porang ... 7
2.2. Glukomanan ... 10
2.3. Enzim ... 13
2.4. Diabetes mellitus ... 17
2.5. Kerangka Teori ... 22
BAB III METODE PENELITIAN... 27
3.1. Rancangan Penelitian ... 27
3.2 Populasi dan Sampel ... 28
v
3.4 Variabel dan Definisi Operasional Variabel... 29
3.5 Instrumen Penelitian ... 30 3.6.Pengumpulan Data ... 30 3.7 Analis Data ... 36 BAB IV HASIL ... 37 4.1. Determinasi Tanaman ... 37 4.2. Pembuatan Tepung ... 37
4.3. RendemenTepung Porang dan Glukomanan ... 38
4.4. Uji Fisikokimia Glukomanan ... 38
4.5. Konversi Kadar Glukomanan dalam Produk konyaku ... 38
4.6. Hasil Pengujian terhadap DM ... 39
BAB V PEMBAHASAN ... 49
BAB VI PENUTUP ... 55
6.1. Kesimpulan ... 55
6.2. Saran ... 55
1 BAB I PENDAHULUAN
1.1 Latar Belakang Masalah
Dewasa ini beras masih unggul sebagai bahan pangan utama sumber karbohidrat adalah beras.Pada dasarnya karbohidrat bisa diperoleh tidak hanya dari beras saja.Sumber karbohidrat selain beras bisa diperoleh dari jagung, serealia dan jenis umbi – umbian.Umumnya mengkonsumsi umbi - umbian dapat menyebabkan rasa kenyang, hal itu sebabkan karena umbi – umbian mengandung karbohidrat yang cukup tinggi. Sebagai sumber karbohidrat dari jenis umbi, umbi suweg, umbi porang, ganyong, dan uwi belum optimal pemanfaatannya, sehingga masih terbatas sebagai bahan pangan (Kriswidarti, 1980, 1981; Rijono, 1999).Umbi porang (Amorphophallus muelleri Blumei) adalah umbi dari keluraga araceae(Joko Dewanto, 2009).Umbi porang menghasilkan karbohidrat cukup tinggi berupa glukomanan (Heyne, 1987; Lahiya, 1993; Jansen et al 1996 dalam Sumarwoto, 2004).
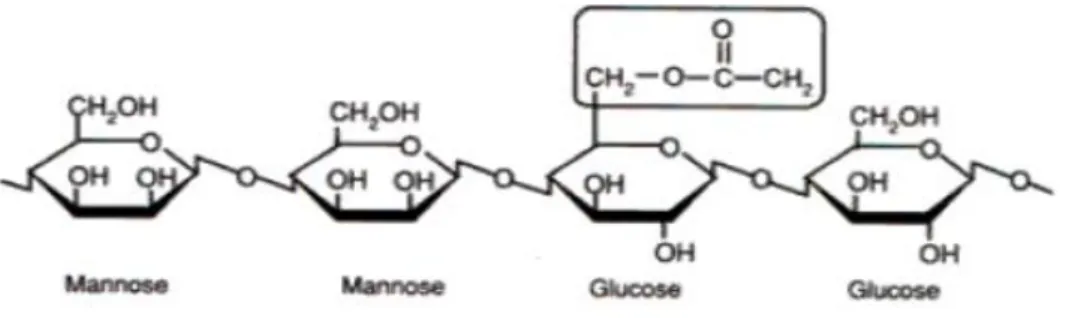
Glukomanan atau konjac merupakan polisakarida jenis hemiselulosa yang terdiri dari kerangka D-glukosil dan D-manosil yang bercabang yang mana rasio antara manosa : glukosa adalah 1,6 : 1 (Ratcliffe et al., 2005). Dalam tepung umbi porang, senyawa glukomanan mempunyai bobot jenis serta ukuran partikel terbesar bila dibandingkan dengan partikel-pertikel komponen tepung lainnya (Johnson, 2005).Glukomanan adalah senyawa dengan kempuan mengikat air
2
yang luar biasa dan mengembang, sehingga apabila dikonsumsi akan menciptakan rasa kenyang karena perasaan penuh dilambung (Chairil dan chairil, 2010).
Menurut Vuksan, et al. (2000) dinyatakan pemberian glukomanan dapat menurunkan kadar glukosa dalam darah pada penderita diabetes mellitus.Hal tersebut dikarenakan glukomanan merupakan senyawa karbohidrat yang tidak dapat diuraikan oleh enzim pencernaan (J. Anderson, et al. 2012).Glukomanan mengembang dalam lambung sehingga mengurangi penyerapan karbohidrat yang berimbasmenurunnya glukosa darah pada penderita diabetes mellitus (Ilarslan, et
al., 2001).
Menurut Soderman dan Sodeman, (1995); Dalimarta, (2005), diabetes mellitus adalah keadaan kadar glukosa darah yang melebihi nilai normal
(hiperglikemia) yang disebabkan oleh kekurangan insulin baik absolute maupun
relative sehingga menimbulkan kelainan metabolisme karbohidrat, protein, dan lemak.Populasi penderita diabetes mellitus (DM) terus meningkat dari tahun ke tahun. Pada tahun 2010 diestimasikan penderita diabetes dunia akan mencapai 220 juta jiwa dan pada tahun 2025 jumlah penderita akan meningkat lagi hingga mencapai tiga ratus juta jiwa (Kronenberg, et al, 2008). Berbagai upaya untuk mencegah dan mengatasi diabetes telah dikembangkan, salah satunya adalah terapi non obat. Terapi bagi penderita diabetes mellitus sendiri bertujuan untuk pengendalian kadar gula, selain itu juga untuk mencegah terjadinya komplikasi.
Upaya terapi non obat untuk diabetes mellitus bisa berupa terapi pangan dengan memanfaatkan glukomanan dalam umbi porang, karenaumbi porang mengandung glukomanan tinggi yang sangat baik untuk kesehatan terutama untuk diet (Sulaeman, 2004; Lase, 2007).Zhang dkk.(2005) menjelaskan bahwa
umbi porang digunakan sebagai bahan baku makanan dan industri sejak 1.000 tahun yang lalu di Jepang dan China. Umbi porang dapat diolah menjadi berbagai macam olahan pangan, salah satunya adalah konyaku.Pada dasarnya konyaku merupakan olahan dasar dari glukomanan.Konyaku merupakan nama makanan khas jepang yaitu produk pangan yang terbuat dari umbi konjac(Amorphophallus
konjac), tanaman ini serupa dengan umbi porang.Konsumsi konyaku
akanmenunda pengosongan lambung dan memperlambat pelepasan gula ke dalam aliran darah, sehingga secara perlahan akan menormalisasi kadar gula dalam darah. Ebihara. K. Masuhara, (1981).
Berdasarkan uraian diatas dapat ditarik kesimpulan bahwa pemanfaatan tanaman endemik umbi porang menjadi suatu alternatif dalam upaya mengatasi penyakit diabetes mellitus. Karena senyawa glukomanan yang terdapat dalam tanaman endemik umbi porang memiliki aktivitas sebagai penurun kadar glukosa darah, sehingga efektif bila dikonsumsi para penderita diabetes mellitus.
1.2. Rumusan Masalah
Pemanfaatan tanaman endemikumbi porang menjadi suatu produk olahan bernilai tinggi masih sangat terbatas.Padahal umbi porang memiliki kandungan glukomanan cukup tinggi yang potensial untuk dikembangkan dalam pengobatan.
Rumusan masalah dalam penelitian ini adalah sebagai berikut :
Bagaimana aktifitas senyawa glukomanan dari tanaman endemik umbi porang dalam menurunkan kadar gula darah bagi penderita diabetes mellitus ?
1.3.Tujuan Penelitian
1.3.1. Tujuan Umum
Mengetahui aktifitas senyawa glukomanan dari tanaman endemik umbi porang dalam menurunkan kadar gula darah bagi penderita diabetes mellitus.
1.3.2. Tujuan Khusus
1. Mengetahui % rendemen glukomanan umbi porang dengan metode hidrolisis enzimatis menggunakan enzim α-amylase.
2. Mengetahui penurunan kadar gula darah pada mencit yang telah dipapar glukosa, setelah pemberian produk dari umbi porang.
1.4. Kegunaan Penelitian
1.4.1. Bagi Peneliti
Sebagai sarana mengaplikasikan ilmu yang diperoleh selama perkuliahan dalam hal pengembangan farmasi dan makanan, khusunya dalam bidang pengobatan dengan memenfatkan bahan alam.
1.4.2. Bagi Institusi
Sebagai referensi mengenai aktifitas senyawa glukomanan dalam tanaman endemik umbi porang sebagai produk pangan untuk terapi pengobatan diabetes mellitus
1.4.3. Bagi Masyarakat
Sebagai sumber informasi dalam upaya peningkatan nilai ekonomi tanaman umbi porang menjadi produk pangan kesehatan, dan sebagai informasi dalam upaya mengatasi penyakit diabetes mellitus.
1.5. Asumsi Penelitian
1.5.1. Rendemen glukomanan dalam umbi porang dapat diketahui dengan menggunakan metode hidrolisis enzimatis.
1.5.2. Senyawa glukomanan yang terkandung dalam umbi porang memiliki aktifitas menurunkan kadar gula dalam darah.
1.6. Ruang Lingkup dan Keterbatasan Penelitian
Determinasi umbi porang, pembuatan tepung umbi porang menggunakan oven, penetapan % rendemen glukomanan dari umbi porang secara enzimatis menggunakan enzim α-amylase, identifikasi tepung umbi porang meliputi
Organoleptis, kelarutan dalam air, pembentukan gel, mengembang dan merekat kemudian pembuatan konyaku tanpa penambahan gula dan pemberian konyaku ke mencit untuk mengetahui aktivitas glukomanan dari umbi porang terhadap kadar gula dalam darah mencit.
Keterbatasan dalam penelitian ini adalah :
1. Umbi porang diambil dari desa Pesanggrahan kecamatan Montong Gading Kabupaten Lombok Timur, Nusa Tenggara Barat
2. Pembuatan tepung porang dilakukan dengan cara pengovenan pada suhu konstan
3. Penetapan % rendemen glukomanan dilakukan dengan hidrolisis enzim, menggunakan enzim α-amylase pada suhu 105ºC waktu inkubasi 2 jam
4. Uji aktifitas senyawa glukomanan umbi porang sebagai penenurun kadar gula darah dengan pemberian produk ke mencit.
1.7. Definisi Istilah
1. Umbi porang (Amorphophallus muelleri Blumie) merupakan tumbuhan dari keluarga Araceaeyang dapat tumnuh dibawah naungan sinar matahari. Umbi porang memiliki kandungan senyawa glukomanan relative tinggi.
2. Glukomanan adalah senyawa metabolit primer dari umbi porang, merupakan polisakarida dari jenis hemiselulosa yang memiliki kemampuan mengikat air yang luar biasa.
3. Konyaku adalah pangan yang berasal dari Jepang, yang terbuat dari umbi konjak, bertekstur kenyal dan tidak mengandung glukosa.
4. Diabetes mellitus adalah penyakit yang ditimbulkan karena rusaknya sel beta pancreas sehingga produksi insulin tidak normal yang berakibat kelebihan kadar glukosa dalam darah.
7 BAB II
TINJAUAN PUSTAKA
2.1.Tanaman Endemik Porang
Porang merupakan tumbuhan semak (herba) yang memiliki tinggi 100-150 cm dengan umbinya di dalam tanah.(Prihatyanto, 2006). Umbi porang berbentuk bulat dan berakar serabut, memiliki jaringan parenkim yang tersusun atas sel – sel berdinding tipis (Mulyono, 2010). Keunggulan umbi porang dibanding dengan umbi lainnya adalah kandungan glukomanannya. Kandungan glukomanan pada porang tergantung dari spesies dan varietasnya. Umbi porang mengandung serat yang tinggi yang sangat baik untuk kesehatan terutama untuk diet (Sulaeman, 2004; Lase, 2007).
2.1.1 Klasifikasi
Kingdom : Plantae (Tumbuhan)
Subkingdom : Tracheobionta (Tumbuhan berpembuluh) Super Divisi : Spermatophyta (Menghasilkan biji) Divisi : Magnoliophyta (Tumbuhan berbunga) Kelas : Liliopsida (berkeping satu / monokotil) Sub Kelas : Arecidae
Famili : Araceae (suku talas-talasan) Genus : Amorphophallus
Spesies : Amorphophallus muelleri BlumeiPrain sinAmorphophallus
oncophylus.
Marga Amorphophallus mempunyai 90 spesies, tetapi yang paling banyak ditemukan didaerah tropis ada 3 jenis, yaitu Amorphophallus muelleri Blumei adalah porang, Amorphophallus campanutalus yang dikenal sebagai suweg , dan
Amorphophallus variabillis atau iles iles putih (Kay, 1973). Perbedaan antara
ketiga jenis marga Amorphophallus dapat dilihat pada tabel berikut: Tabel 2.1. Karakteristik tiga jenis Amorphophallus spp
Karakter A.muelleri Blumei A.campunulatus A.variabilis
Penyebaran Tumbuh liar Umunya di tanam
dipekarangan
Tumbuh secara liar
Tangkai daun Permukaan
tangkai daun licin, warna hijau muda sampai tua dengan bercak putih
Permukaan tangkai daun licin, warna hijau muda sampai tua dengan bercak putih Permukaan tangkai daun kasar, warna sangat beraneka ragam
Warna tepi daun Ungu muda Hijau Hijau
Pertumbuhan bibit umbi
Pada helaian daun Pada umbi batang Pada umbu batang Warna umbi Kelabu coklat Kelabu coklat Putih (hijau ungu atau kelabu bila kena cahaya) Warna daging
umbi
Kuning Kuning muda
sampai kuning tua Putih Kadar glukomanan (%) Tinggi sampai sangat inggi (67) Sangat sedikit (3,1) Rendah sampai sedang (30) Kadar pati (%) 12.3 45 Kekentalah (%) 1 g tepung / 300 ml 3,12 1,14
Sumber : Sufiani (1993); Rosman dan Rusli, 1991
Menurut Otsuki (1968) komposisi kimia pada umbi porang dapat dilihat pada tabel berikut ini :
Tabel 2.2. Komposisi Kimia Umbi Porang
Komposisi Kadar (%) Kadar air 79,7 Bahan Kering 20,3 Pati 2,0 Glukomannan 55,0 Poliosa 14,0 Serat kasar 8,0 Gula Bebas 0,0 Sumber : Otsuki (1968)
Sedangkan menurut Arifin (2001), kandungan kimia per 100 gram umbi segar berbeda dengan kandungan per 100 gram tepung umbi porang.
Tabel 2.3. Kandungan Kimia per 100 g umbi porang
Senyawa Umbi segar (%) Tepung porang (%)
Air 83.3 6.8 Glukomannan 3.58 64.98 Pati 7.65 10.24 Protein 0.92 3.42 Lemak 0.02 - Serat berat 2.5 5.9 Abu 1.22 7.88
Logam berat (Cu) 0.09 0.13
Sumber : Arifin (2001)
Selain mengandung komponen pada tabel diatas, umbi porang juga mengandung kalsium oksalat yang terdapat pada lendir yang melekat pada daging
umbi. Kristal kalsium oksalat merupakan produk buangan dari metabolism sel yang sudah tidak digunakan lagi oleh tanaman (Nugroho, 2000). Dalam tanaman oksalat adalah antinutrien yang memengaruhi tidak tersedianya kalsium yang diperlukan bagi tubuh manusia (Nakata, 2003). Kalsium oksalat dapat menyebabkan rasa gatal dan panas seperti terbakar pada mulut jika terkonsumsi. Komponen kalsium oksalat ini perlu diperhatikan dalam pengolahan umbi porang.
2.2. Glukomanan
Glukomanan mengandung 60 % D-mannosa dan 40 % D-glukosa (Mikonnen, 2009). Peranan glukomanan sebagai dietary fiber dapat digunakan sebagai senyawa untuk terapi penyakit gula darah biasa disebut diabetes mellitus .
Glukomanan adalah salah satu komponen kimia terpenting yang terdapat dalam umbi iles-iles yang merupakan polisakarida dari jenis hemiselulosa. Glukomanan termasuk heteropolisakarida yang memiliki ikatan rantai utama glukosa dan manosa. Ohtsuki, (1968) menyebutkan bahwa hasil analisa hidrolisa-asetolisis dari glukomanan dihasilkan suatu trisakarida yang tersusun oleh dua D-mannosa dan satu D-glukosa, sehingga dalam satu molekul glukomanan terdapat D-mannosa sejumlah 67% dan D-glukosa sejumlah 33%. Hasil analisis secara metilasi menunjukkan bahwa glukomanan terdiri atas komponen penyusun berupa D-glukopiranosa dan D-manopiranosa dengan ikatan β-1,4 glikosidik. Menurut Parry (2010), glukomanan memiliki gugus asetil setiap 10-19 unit gugus karbon pada posisi C2, C3 dan C6. Gugus asetil tersebut berperan pada sifat fisikokimia glukomanan seperti sifat kelarutan glukomanan dalam air panas maupun air
dingin. Glukomanan memiliki bobot molekul relatif tinggi, yaitu 200,000 – 2,000,000 Dalton dengan ukuran antara 0.5 – 2 mm, 10 – 20 kali lebih besar dari sel pati. Bobot molekul yang relatif tinggi membuat glukomanan memiliki karakteristik antara selulosa dan galaktomanan, yaitu dapat mengkristal dan membentuk struktur serat-serat halus. Keadaan tersebut menyebabkan glukomanan dapat dimanfaatkan lebih luas dibandingkan selulosa dan galaktomanan. Menurut Deptan (2010), senyawa glukomanan mempunyai sifat-sifat khas sebagai berikut:
1. Larut dalam air
Glukomanan dapat larut dalam air dingin dan membentuk larutan yang sangat kental. Tetapi, bila larutan kental tersebut dipanaskan sampai menjadi gel, maka glukomanan tidak dapat larut kembali di dalam air.
2. Membentuk gel
Glukomanan dapat membentuk larutan yang sangat kental di dalam air. Dengan penambahan air kapur zat glukomannan dapat membentuk gel, di mana gel yang terbentuk mempunyai sifat khas dan tidak mudah rusak.
3. Merekat
Glukomanan mempunyai sifat merekat yang kuat di dalam air. Namun, dengan penambahan asam asetat sifat merekat tersebut akan hilang.
4. Mengembang
Glukomanan mempunyai sifat mengembang yang besar di dalam air dan daya mengembangnya mencapai 138 – 200%, sedangkan pati hanya 25%.
Larutan glukomanan dapat membentuk lapisan tipis film yang mempunyai sifat transparan dan film yang terbentuk dapat larut dalam air, asam lambung dan cairan usus. Tetapi jika film dari glukomannan dibuat dengan penambahan NaOH atau gliserin maka akan menghasilkan film yang kedap air.
6. Mencair
Glukomanan mempunyai sifat mencair seperti agar sehingga dapat digunakan dalam media pertumbuhan mikroba.
7. Mengendap
Larutan glukomanan dapat diendapkan dengan cara rekristalisasi oleh etanol dan kristal yang terbentuk dapat dilarutkan kembali dengan asam klorida encer. Bentuk kristal yang terjadi sama dengan bentuk kristal glukomanan di dalam umbi, tetapi bila glukomanan dicampur dengan larutan alkali (khususnya Na, K dan Ca) maka akan segera terbentuk kristal baru dan membentuk massa gel. Kristal baru tersebut tidak dapat larut dalam air walaupun suhu air mencapai 100ºC ataupun dengan larutan asam pengencer. Dengan timbal asetat, larutan glukomanan akan membentuk endapan putih stabil. Struktur Glukomanan ditunjukkan pada gambar 2.1
Sumber : Anonim (2002)
Menurut Sarko dan Marchessault (1967) berdasarkan bentuk ikatannya mannan dibadakan menjadi dua golongan yaitu glukomanan dan galaktomanan. Glukomanan merupakan heteropolisakarida yang terusun oleh satuan D-mannosa dan D-glukosa dengan perbandingn 1,6 : 1. Glukomanan mempunyai bentuk ikatan β-1-4-glikosida dan mempunyai gugus asetil setiap 17 gugus karbon pada
posisi C-6. Gugus asetil tersebut mempengaruhi kelarutan glukomanan dalam air (Dave et al., 1997)
2.3.Enzim
Fungsi suatu enzim ialah sebagai katalis untuk proses biokimiawi yang terjadi dalam sel maupun di luar sel. Suatu enzim dapat mempercepat reaksi 108 sampai 1011 kali lebih cepat daripada apabila reksi tersebut dilakukan tanpa katalis. Jadi enzim dapat berfungsi sebagai katalis yang sangat efisien, disamping itu mempunyai derajat kehasan yang tinggi (Pujiadi, 2005).
Enzim merupakan senyawa protein kompleks yang dihasilkan oleh sel-sel organisme dan berfungsi sebagai katalisator suatu reaksi kimia. Kerja enzim sangat spesifik, karena strukturnya hanya dapat mengkatalisis satu tipe reaksi kimia saja dari suatu substrat, seperti hidrolisis, oksidasi dan reduksi. Enzim merupakan molekul biopolimer dan tersusun dari serangkaian asam amino dalam komposisi dan susunan rantai yang teratur dan tetap. Enzim memiliki peranan yang sangat penting dalam berbagai reaksi kimia yang terjadi di dalam sel yang mungkin sangat sulit dilakukan oleh reaksi kimia biasa (Pujiadi, 2005).
Menurut (Rodwell, 1987), faktor utama yang mempengaruhi aktifitas enzim adalah :
a. pH
Enzim mempunyai aktivitas maksimal pada kisaran pH yang disebut pH optimum. Suasana terlalu asam atau alkali akan mengakibatkan denaturasi protein dan hilangnya secara total aktifitas enzim. pH optimal untuk beberapa enzim pada umumnya terletak diantara netral atau asam lemah yaitu 4,5-8 dan pH optimal untuk enzim Liquozyme supra yaitu 5,1-5,6. pH optimum sangat penting untuk menentukan karakteristik enzim. Pada substrat yang berbeda, enzim memiliki pH optimum yang berbeda (Tranggono dan Sutardi, 1990). Menurut Winarno (1995), enzim yang sama mempunyai pH optimum yang berbeda tergantung pada asal enzim.
b. Suhu
Enzim mempercepat reaksi kimia pada sel hidup. Dalam batas-batas suhu tertentu kecepatan reaksi yang dikatalisis enzim akan naik bila suhunya naik. Reaksi yang paling cepat terjadi pada suhu optimum (Rodwell, 1987). Oleh karena itu penentuan suhu optimum aktivitas enzim sangat perlu karena apabila suhu terlalu rendah maka kestabilan enzim akan naik tetapi aktifitas turun, sedangkan pada suhu tinggi aktivitas enzim tinggi tetapi kestabilan rendah (Muchtadi, 1988) namun, kecepatan akan menurun drastis pada suhu yang lebih tinggi. Hilangnya aktifitas pada suhu tinggi karena terjadinya perubahan konfirmasi thermal (denaturasi) enzim. Kebanyakan enzim tidak aktif pada suhu sekitar 55-60°C (Rabyt and White, 1987).
c. Konsentrasi substrat
Kecepatan reaksi enzimatis pada umumnya tergantung pada konsentrasi substrat. Kecepatan reaksi akan meningkat apabila konsentrasi substrat meningkat, peningkatan kecepatan reaksi ini akan semakin kecil hingga tercapai pada suatu titik batas yang pada akhirnya penambahan konsentrasi substrat hanya akan sedikit meningkatkan kecepatan (Lehninger, 1997). Menurut Lindawati (2006), semakin tinggi kecepatan reaksi enzim maka semakin banyak pati yang terhidrolisis, namun setelah hampir semua pati terhidrolisis kecepatan reaksi enzim akan berkurang.
d. Konsentrasi enzim
Menurut Whitaker (1996), panambahan konsentrasi enzim akan meningkatkan kecepatan reaksi bila substrat tersedia secara berlebih. Kecepatan reaksi dalam reaksi enzim sebanding dengan konsentrasi enzim, semakin tinggi konsentrasi enzim maka kecepatan reaksi akan semakin tinggi, sehingga pada batas konsentrasi tertentu dimana hasil hidrolisis akan konstan dengan tingginya konsentrasi enzim yang disebabkan penambahan enzim sudah tidak efektif (Martin, 1983).
2.3.1. Enzim -Amilase
Enzim α-amilasemerupakan enzim ekstraseluler yang mampu menghidrolisis ikatan α-1,4 glikosidik pada pati. Enzim α-amilase bekerja spesifik
Enzym α-amilase murni dapat diperoleh dari malt (barley), ludah manusia,
pankreas, dan diisolasi dari Aspergillus oryzae dan Bacillus subtilis (pada suhu 70°C-90°C dan pH 6 selama 15 menit) (Winarno, 1995). Enzim α-amilase adalah endo-enzim yang bekerjanya memutus ikatan α-1,4 secara acak di bagian dalam molekul baik pada amilosa maupun amilopektin. Pengaruh aktivitasnya, pati terputus-putus menjadi dekstrin dengan rantai sepanjang 6-10 unit glukosa (Tjokroadikoesoemo,1986). Golongan enzim α-amilase yang tahan pada
temperature tinggi digunakan pada proses liquifikasi (Muchtadi, 1992).
Hidrolisis amilosa oleh enzim α-amilase terjadi dalam 2 tahap. Tahap
pertama, degradasi amilosa menjadi maltosa dan maltotriosa yang terjadi secara acak. Degradasi ini terjadi sangat cepat dan diikuti dengan menurunnya viksositas dengan cepat pula. Kedua, relatif sangat lambat yaitu pembentukan glukosa dan maltosa sebagai hasil akhirnya (Muchtadi, 1992).
Cara kerja α-amilase pada molekul amilopektin akan menghasilkan glukosa, maltosa dan berbagai jenis α-limit dekstrin. Jenis α-limit dekstrin yaitu
oligosakarida yang terdiri dari 4 atau lebih residu glukosa yang semuanya mengandung ikatan α-1,6. Aktivitas α-amilase ditentukan dengan mengukur hasil
degradasi pati, biasanya diukur dari penurunan kadar pati yang larut atau dari kadar amilosa bereaksi dengan iodium akan berwarna coklat. Selain itu keaktifan α-amilase dapat dinyatakan dengan cara pengukuran viskositas dan jumlah
pereduksi yang terbentuk. Hidrolisis amilosa akan lebih cepat daripada hidrolisis rantai yang bercabang seperti amilopektin atau glikogen. Laju hidrolisis akan meningkat bila tingkat polimerisasi menurun, dan laju hidrolisis akan lebih cepat pada rantai lurus (Winarno, 1995).
2.4. Diabetes mellitus
Penyakit diabetes mellitus merupakan salah satu penyakit kronok yang berlaku bila pancreas tidak menghasilkan insulin yang cukup atau tubuh tidak dapat memanfaatkan insulin yang diproduksikan secara efektif, dan ini mengaibatkan konsentrasi glukosa dalam darah kita meningkat.
2.4.1. Prediabetes
Prediabetes adalah suatu kondisi dimana kadar gula darah terlalu tinggi untuk dianggap normal, tetapi tidak cukup tinggi unutk dilabelkan sebagai diabetes. Orang – orang dikatakan sebagai prediabetes jika kadar gula darah puasa mereka adalah antara 101 mg/dL dan 126 mg/dL atau tingkat gula darah mereka 2 jam setelah tes toleransi glukosa antara 140 mg/dL dan 200mg/dL. Mengidentifikasi orang yang prediabetes sangat penting karena mereka mempuyai resiko yang lebih tinggi untuk menderita penyakit diabetes mellitus pada masa depan. Penurunan berat badan dari 5 – 10% melalui diet dan latihan dapat mengurangi resiko terkena diabetes pada masa depan dengan signifikan.
2.4.2. Tipe 1
Pada diabetes tipe 1 (sebelumnya tersebut sebagai diabetes insulin dependent diabetes onset remaja), lebih dari 90% dari sel pancreas yang memproduksi insulin mengalami kerusakan secara permanen. Oleh karena itu, insulin yang diproduksi adalah sedikit atau langung tidak dapat diproduksikan. Namun, hanya sekitas 10% dari semua penderita diabetes mellitus menderita diabetes tipe 1. Kebayakan diabetes tipe 1 mengembangkan sign dan symptom
sebelum usia 30. Para ilmuan percaya bahwa faktor lingkungan seperti infeksi virus atau faktor gizi pada masa kanak – kanak atau awal dewasa dapat menyebabkan system kekebalan menghancurkan sel penghasil insulin dipankreas. Faktor genetik dapat membuat sebagian orang lebih rentan terhadap ancaman faktor lingkungan.
2.4.3. Tipe 2
Pada diabetes tipe 2 (sebelumnya disebut sebagai diabetes non-insulin-dependent atau diabetes onset-dewasa), pankreas adalah normal dan dapat terus menghasilkan insulin, bahkan kadang-kadang pada tingkat lebih tinggi dari normal. Tetapi tubuh manusia resisten terhadap efek insulin, sehingga tidak ada insulin yang cukup untuk memenuhi kebutuhan tubuh. Diabetes tipe 2 jarang sekali wujud pada anak-anak dan remaja tetapi menjadi lebih umum pada kebelakangan ini. Namun, diabetes tipe 2 biasanya bermula pada pasien yang umurnya lebih dari 30 dan menjadi semakin lebih umum dengan peningkatan usia. Sekitar 15% dari orang yang lebih tua dari 70 tahun menderita diabetes tipe 2. Ras dan etnis menjadi salah satu faktor resiko diabetes tipe 2. Peningkatan risiko menderita diabetes tipe 2 setinggi 2 kali lipat terjadi pada penduduk asli Amerika dan Hispanik yang tinggal di Amerika Serikat. Riwayat keluarga juga memainkan peranan yang penting dalam peningkatan risiko menderita daibetes tipe2. Obesitas adalah faktor risiko utama untuk diabetes tipe 2, setinggi 80% sampai 90% dari penderita diabetes tipe 2 mengalami obesitas. Obesitas dapat menyebabkan resistensi insulin, makanya, orang obesitas memerlukan insulin yang berjumlah sangat besar untuk mengawali kadar gula darah yang normal. Gangguan tertentu dan obat-obatan dapat mempengaruhi cara tubuh menggunakan insulin dan dapat
menyebabkan diabetes tipe 2 secara tidaklangsung. Kortikosteroid berdosis tinggi (pada penyakit Cushing atau pengambilan obat kortikosteroid) dan kehamilan (diabetes gestasi) adalah penyebab yang paling umum mengganggu fungsi dan efektivitas insulin. Diabetes juga dapat terjadi pada pasien dengan kelainan hormon seperti kelebihan hormon pertumbuhan (Akromegali) atau pada orang yang dengan tumor mensekresi hormon tertentu. Pankreatitis berat atau berulang serta gangguan lain yang dapat merusak pankreas dapat menyebabkan diabetes.
2.4.4. Diagnosis Diabetes Mellitus
Menurut Dalimartha (2007), tindakan diagnosis dilakukan untuk menentukan apakah seseorang telah menderita penyakit diabetes mellitus atau belum. Diagnosis umumnya ditegakkan berdasarkan keluhan penderita yang khas dan adanya peninggian kadar glukosa darah yang ditentukan berdasarkan pemeriksaan laboratorium. Dokter biasanya menemukan gejala khas seperti yang telah disebutkan diatas. Maulana (2008), menambahkan bahwa kepastian diagnosis diabetes mellitus jika memenuhi kriteria sebagai berikut:
1. Seseorang menderita gejala khas beserta keluhan seperti disebutkan diatasditambah dengan kadar glukosa darah sewaktu lebih besar atau sama dengan 200 mg/dl (plasma vena)
2. Seseorang memiliki kadar glukosa darah puasa (plasma vena) lebih besaratau sama dengan 126 mg/dl sebanyak dua kali pemeriksaan dengan waktu yang berbeda. Jika pemeriksaan kadar glukosa darah sewaktu masih meragukan, maka perlu dilakukan tes toleransi glukosa oral (TTGO) dengan tujuan untuk memastikan diagnosis. Semua uji diatas memberikan informasi mengenai
metabolisme glukosa pasien hanya pada saaat itu. Untuk perkiraan derajat pengendalian diabetes jangka panjang dipakai perkiraan kadar hemoglobin terglikosilasi (HbA1c) didalam darah. Kadar HbA1c bergantung pada kadar glukosa serum dan meningkat pada diabetes yang tidak terkontrol. HbA1c sekali terbentuk, tetap berada dalam eritrosit selama 120 hari umur sel. Jadi, kadar HbA1c mengindikasikan peningkatan kadar glukosa darah 2-3 bulan terakhir. HbA1c normal adalah sekitar 4% hemoglobin total (Chandrasoma, 2005).
2.4.5.Pengobatan Diabetes Mellitus
Tujuan pengobatan melalui makanan dan pemberian obat-obatan untuk penderita diabetes adalah untuk mencegah hiperglisemia, seperti diketahui bahwa hal tersebut bertanggung jawab menurunkan beberapa konsekuensi patologis jangka panjang dari penyakit tersebut (Linder, 1992).
Macam- macam obat yang dapat digunakan dalam menurunkan kadar glukosa darah adalah sebagai berikut:
2.4.5.1 Terapi Insulin
Pada diabetes tipe I, pankreas tidak dapat menghasilkan insulin sehingga harus diberikan insulin pengganti.Pemberian insulin hannya dapat dilakukan melalui suntikan, insulin dihancurkan didalam lambung sehingga tidak dapat diberikan per-oral (ditelan). Insulin disuntikkan di dalam kulit dibawah lapisan lemak, biasanya di lengan, paha atau dinding perut (Maulana, 2008).
Insulin terdapat dalam 3 bentuk besar, masing-masing memiliki kecepatan dan lama kerja yang berbeda:
a. Insulin kerja cepat
Salah satu insulin kerja cepat adalah insulin reguler, yang bekerja paling cepat dan paling sebentar. Insulin ini sering kali mulai menurunkan kadar gula dalam waktu 20 menit, mencapai puncaknya dalam waktu 2-4 jam dan bekerja selama 6-8 jam. Insulin kerja cepat sering kali digunakan oleh penderita yang menjalani beberapa kali suntikan setiap harinya dan disuntikkan 15-20 menit sebelum makan.
b. Insulin kerja sedang
Salah satu adalah insulin suspensi seng atau suspensi insulin isofan. Mulai bekerja dalam waktu 1-3 jam, mencapai puncak maksimum dalam waktu 6-10 jam, dan bekerja selama 18-26 jam. Insulin ini bisa disuntikkan pada pagi hari untuk memenuhi kebutuhan selama sehari dan dapat disuntikkan pada malam hari untuk memenuhi kebutuhan sepanjang malam.
c. Insulin kerja lambat
Salah satu adalah insulin suspensi seng yang telah dikembangkan. Efeknya baru timbul setelah 6 jam dan bekerja selama 28-36 jam.
2.4.5.2 Obat Hiperglikemik
Golongan sulfonilurea sering kali dapat menurunkan kadar gula darah secara mencukupi pada penderita diabetes tipe II, tetapi tidak efektif pada diabetes tipe I. contohnya adalah glipizid, gliburid, tolbutamid, dan klorpropamid. Obat ini menurunkan kadar gula darah dengan cara merangsang pelepasan insulin oleh pankreas dan meningkatkan efektivitasnya (Maulana, 2008). Ada 2 macam obat hipoglikemik, yaitu berupa suntikan dan berupa tablet yang dapat diminum.
Obat hipoglikemik oral (OHO) atau antidiabetes (OAD). Pemakaian istilah obat antidiabetes (OAD) sudah mulai ditinggalkan, karena memang tidak ada obat yang dapat menyembuhkan diabetes mellitus. Ada 2 golongan obat hipoglikemik oral, yaitu golongan sulfonylurea dan golongan biguanid. Obat ini sebaiknya tidak digunakan penderita diabetes mellitus yang disertai dengan gangguan fungsi ginjal dan hati (Dalimartha, 2007).
2.5. Kerangka Teori
Tanaman porang (Amorphophallus oncophyllus) adalah tanaman yang mudah dikembangkan, khususnya di daerah tropis. Menurut Prihatyanto (2006), porang merupakan tumbuhan semak yang umbinya di dalam tanah). Umbi porang mampu menghasilkan glukomanan cukup tinggi (Sumarwoto, 2004). Senyawa glukomanan merupakan bagian dari polisakarida yang termasuk jenis hemiselulosa. Glukomanan dianggap sebagai serat yang mudah larut dalam air dan membentuk larutan kental (Nurhidayat, 2008). Menurut Sulaeman (2004) dan Lase (2007), serat glukomanan baik untuk kesehatan terutama untuk diet.
Hasil eksplorasi tanaman porang endemik Jawa Timur menunjukan bahwa kandungan glukomanan pada setiap tanaman porang berbeda, tergantung faktor lingkungan habitat tanaman tersebut. Tanaman porang yang tumbuh di desa Klangon, Madiun mengandung glukomanan 16.67-17.67%, berbeda dengan tanaman porang yang tumbuh di desa Brongkos, Blitar mengandung glukomanan berkisar 9.33-20.00 % (Harijati, 2009). Dari kajian tersebut menunjukan bahwa tanaman dari jenis yang sama tetapi berbeda tempat memiliki kandungan senyawa
berbeda. Sehubungan dengan hal tersebut, jenis Amorphophalus yang tumbuh di Lombok menarik untuk dikaji kandungan senyawa glukomanan dan aktifitasnya sebagai penurun gula darah.
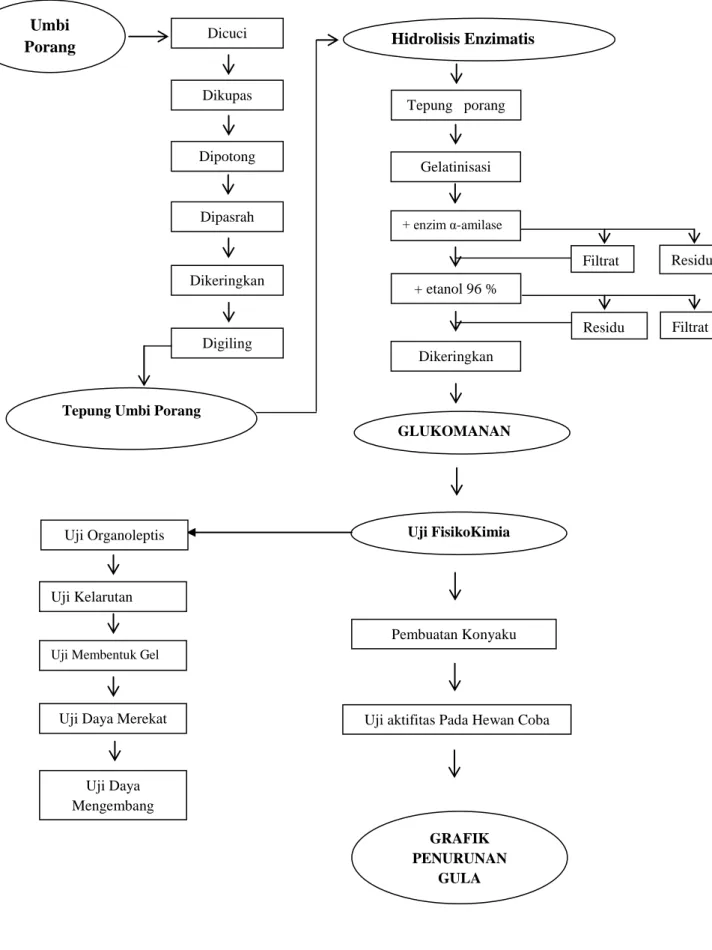
Dalam penelitian ini sampel umbi porang di ambil dari desa Pesanggrahan, kecamatan Montong Gading, Kabupaten Lombok Timur. Untuk mempermudah tahap penelitian umbi porang dibuat menjadi tepung. Umbi porang dikuliti kemudian direndam dalam larutan NaCl, larutan NaCl berfungsi untuk menghilangkan substansi Ca Oksalat yang melekat pada daging umbi. Menurut Nugroho (2000) Ca Oksalat merupakan bagian tanaman yang tidak butuhkan lagi. Substansi ini dapat menyebabkan rasa gatal dan panas. Umbi porang yang sudah tidak mengandung lendir disawut untuk memperkecil ukuran umbi. Kemudian dipress untuk menghilangkan air sehingga mempercepat proses pengeringan. Proses pengeringan dilakukan dengan metode pengovenan. Sawut umbi porang yang kering digiling supaya ukuran dari tepung porang lebih teratur dan lebih halus.
Untuk mengidentifikasi glukomanan pada umbi porang dilakukan secara uji fisik karena senyawa glukomanan ciri – ciri fisik, diantaranya yaitu mudah larut dalam air, membentuk gel, merekat dan mengembang. Glukomanan larut dalam air menjadi larutan sangat kental dan membentuk gel transparan apabila dipanaskan. Penambahan garam kalsium dapat mempertahankan stabilitas gel glukomanan. Penambahan asam pada senyawa glukomanan akan membuat sifat merekat glukoman menghilang ini dikarenakan gugus asetil pada glukomaman. Gugus asetil pada glukomanan adalah gugus yang menyebabkan glukomanan
mempunyai sifat merekat, dengan penambahan asam gugus ini akan terpotong dan sifat merekat glukomanan akan menghilang.
Untuk mengisolasi senyawa glukomanan pada umbi porang dapat hidrolisa menggunakan enzim α-amilase. Enzim α-amilase adalah endo-enzim yang mampu memotong ikatan α-1,4 secara acak di bagian dalam molekul pada amilopektin maupun amilosa. Menurut Muchtadi (1992), golongan enzim α-amilase tahan
pada temperature tinggi. Oleh karena itu dalam isolasi glukomanan memakai suhu 105oC selama 2 jam. Hasil hidrolisa tepung porang dengan menggunakan enzim α-amilase akan memisah menjadi 2 lapisan. Filtrate yang didapat
merupakan campuran antara oligosakarida dan glukomanan. Untuk mengambil senyawa glukomanan tersebut, filtrate di ekstraksi menggunakan pelarut etanol. Etanol merupakan pelarut semi polar yang dapat menarik komponen polar dalam filtrate hasil hidrolisa. Residu dari ekstraksi menggunakan etanol adalah senyawa glukomanan. Residu berupa glukomanan dicuci dengan etanol untuk mendapatkan hasil yang lebih murni, glukomanan murni kemudian dikeringkan lalu digiling dan hasil beupa tepung glukomanan.
Untuk membuat konyaku, 3 gram tepung glukomanan dilarutkan dalam 100 mL air, dengan pengadukan selama 2 jam. Selama proses pengadukan ditambah garam kalsium, yang mana garam kalsium ini berfungsi sebagai untuk menjaga kestabilan gel glukomanan. Selama proses pengadukan senyawa glukomanan akan terus mengembang dan akan mengeras. Sebelum mengeras gel glukomanan dituang dalam cetakan persegi untuk mendapatkan bentuk produk yang bagus. Produk konyaku yang sudah jadi kemudian rendam dalam larutan kapur sirih selama 30 menit, hal ini bertujuan sebagai pengawet agar dapat
disimpan lebih lama. Produk yang sudah jadi kemudian direbus dengan air mendidih selama 15 menit, hal ini bertujuan agar produk konyaku lebih aman untuk dikonsumsi.
Aktifitas senyawa glukomanan dalam menyerap glukosa darah dapat diketahui dengan pemberian produk pada mencit. Mencit merupakan hewan yang morfologinya menyerupai manusia. Mencit yang digunakan pada penelitian ini dibagi menjadi 6 kelompok perlakuan. Masing – masing kelompok beranggotakan 3 ekor mencit. (1)Kelompok kontrol positif yaitu kelompok mencit yang yang di terapi dengan obat untuk diabetes yaitu acarbose. (2)Kelompok kontrol negative yaitu kelompok mencit yang dipapar glukosa tinggi. (3)Kelompok pemberian glukomanan murni yaitu mencit di beri makan dengan glukomanan murni, selanjutnya adalah kelompok perlakuan, dalam kelompok ini dibagi menjadi 3 kelompok variasi dosis, yaitu dosis 1 kelompok (4), dosis 2 kelompok (5), dan dosis 3 kelompok (6)
Untuk kelompok perlakuan dosis 1 ditimbang konyaku sebanyak 0,06g/kgBB. Untuk kelompok perlakuan dosis 2 ditimbang konyaku sebanyak sebanyak 0,012g/kgBB. Untuk kelompok perlakuan dosis 3 ditimbang konyaku sebanyak 0,018 /kgBB.
Untuk mengetahui data penurunan gula darah pada mencit. Dilakukan pengecekan kadar gula darah awal. Kemudian mencit disonde laruran glukosa dengan dosis 0,75gram/kgBB (Anggraeni, 2006), kemudian di tunggu 2 jam. Selanjutnya pengecekan gula darah setelah pemberian. Pengamatan pada kelompok perlakukan dosis ini dilakukan selama 5 hari. Jika produk dari umbi
umbi porang dapat menurunkan kadar gula darah mencit maka dapat tetapkan bahwa, dapat menurunkan kadar gula arah pada manusia.
27 BAB III
METODE PENELITIAN
3.1. Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental yaitu isolasi dan identifikasi glukomanan dalam tanaman umbi porang sebagai pangan terapi penderita diabetes mellitus. Adapun tahapan dalam penelitian ini adalah sebagai berikut :
3.1.1 Tahap Persiapan
Tahap persiapan yang dilakukan yaitu menentukan populasi dan sampel penelitian, menentukan lokasi dan waktu penelitian, serta menghitung kebutuhan bahan dan menimbangnya, kemudian mempersiapkan peralatan yang diperlukan sesuai dengan kebutuhan.
3.1.2 Tahap Pelaksanaan
Tahap pelaksanaan meliputi determinasi tanaman kembudian pembuatan tepung umbi porang, lalu pengujian kadar pati dalam tepung porang pembuatan Selanjutnya isolasi glukomanan dengan metode hidrolisis enzim, menggunakan enzim α-amilase. Setelah itu dilakukan uji fisikokimia sebagai identifikasi
Produk yang telah dibuat diujikan pada hewan coba mencit dengan cara variasi porsi pemberian.
3.1.3 Tahap Akhir
Pada tahap ini adalah pengolahan data, dan membuat kesimpulan tentang % rendemen glukoman dan aktifitas glukomanan dalam produk pada hewan coba mencit.
3.2 Populasi dan Sampel
Dalam penelitian ini populasi dan sampel yang digunakan sebagai berikut :
3.2.1 Populasi
Populasi dalam penelitian ini adalah umbi porang tumbuh liar, yang diambil adalah umbi porang endemik dari desa Pesanggrahan, kecamatan Montong Gading, kabupaten Lombok Timur, Nusa Tenggara Barat
3.2.2 Sampel
Sampel dalam penelitian ini adalah umbi porang yang diambil dari populasi tersebut di atas sebanyak 7 kg.
3.3 Lokasi dan Waktu Penelitian
3.3.1 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Mikrobiologi Putra Indonesia Malang.
3.3.2 Waktu Penelitian
Waktu penelitian dimulai dari proses penyusunan proposal pada bulan Desember 2013 sampai terselesaikannya Karya Tulis Ilmiah ini.
3.4 Variabel dan Definisi Operasional Variabel
Dalam penelitian ini terdapat dua variabel yaitu variabel bebas dan variabel terikat. Variabel bebas dan variable terikat disajikan dalam tabel berikut :
Tabel 3.1. Tabel Variabel bebas dan Variabel Terikat
Variabel bebas Variabel terikat
Aktifitas senyawa glukoaman dalam menurunkana kadar gula darah
Penurunan kadar gula darah
Tabel 3.2. Tabel Definisi Operasional Variabel
Variabel Definisi operasional Alat ukur Hasil ukur Variabel bebas Kadar glukomanan
yang terdapat pada tepung umbi porang memiliki aktifitas sebagai penurun kadar gula dalam darah
Perhitungan% rendemen
% rendemen
Variabel terikat Penurunan kadar gula darah dengan pengukuran kadar gula setiap 2 jam setelah pemberian produk selama 5 hari
Glukotest mg/dL
3.5 Instrumen Penelitian
3.5.1 Alat
Adapun alat yang digunakan dalam penelitian ini adalah pisau, nampan, mesin giling, mesin pres, oven, timbangan, beakerglass, inkubator, sentrifuse, erlenmeyer, corong gelas, kertas saring, tabung reaksi, batang pengaduk, dan glukotest.
3.5.2 Bahan
Bahan baku yang digunakan adalah umbi porang segar. Bahan-bahan lain yang berfungsi sebagai pendukung adalah aquadest, Ca(OH)2 dan NaCl. Bahan kimia untuk analisa meliputi enzim α-amilase, etanol 70%, Etanol dan mencit.
3.6.Pengumpulan Data
3.6.1 Pembuatan Tepung Porang
1 Dipilih umbi porang yang masih bagus dan tidak busuk sebanyak 7 kg 2 Dicuci unutk menghilangkan pengotor yang melekat pada permukaan
kulit umbi
3 Dikupas dengan pisau untuk menghilangkan kulitnya
4 Dipotong – potong, direndam dalam larutan NaCl, sampai lendirnya hilang
5 Sebanyak ±7 kg potongan umbi porang yang sudah tidak berlendir mulai dipasrah.
7 Umbi porang yang telah menjadi pasrah kering lalu mulai di giling agar menjadi tepung.
3.6.2. Penetapan Kadar Pati
3.6.2.1.Penentuan pati pada umbi suweg
1. Timbang 2 gram tepung porang, tambahkan 50 ml aquades dan aduk selama 1 jam.
2. Saring suspensi dengan kertas saring dan cuci dengan aquades sampai volume filtrate 200 ml
3. Pindahkan residu secara kuantitatif dari kertas saring ke dalam erlenmeyer 4. Cuci dengan 200 ml aquades dan tambahkan 10 ml HCl 25%
5. Tutup dengan pendingin balik dan panaskan diatas penangas sampai mendidih selama 2 jam.
6. Setelah dingin, netralkan dengan larutan NaOH 45% dan encerkan sampai volume 500 ml, kemudian saring.
7. Tentukan kadar gula yang dinyatakan sebagai glukosa dari filtrate yang diperoleh.
3.6.2.2.Penentuan gula reduksi
1. Mengambil 25 ml larutan sampel tersebut, lalu memasukkan ke dalam Erlenmeyer Menambahkan 25 ml pereaksi Luff Schoorl
2. Memanaskan kembali menggunakan refluks selama kurang lebih 10 menit 3. Mendinginkan mendadak menggunakan air mengalir
4. Menambahkan 25 ml H2SO4 26,5% secara hati-hati (dialirkan melalui dinding Erlenmeyer)
5. Menambahkan 20 ml KI 15% atau 15 ml KI 20%
6. Menambahkan 1 ml indikator Amylum 1% lalu mentitrasi menggunakan Na2S2O3 0,1N hingga berubah warna menjadi krem keputihan
7. Mencatat volume titrasi sampel (A ml) 8. Membuat blanko pengujian.
9. Mencatat volume titrasi blanko (B ml)
10. Menghitung kadar pati sampel menggunakan rumus :
Angka Tabel (glukosa*) = ((B ml – A ml) x Normalitas Na2S2O3 terstandardisasi) / 0,1
Kadar Pati = (Faktor Pengenceran x Angka Tabel x 100 % x 0,90) / Bobot Sampel (mg)
3.6.3. Isolasi Glukomanan
1. Ditimbang 25 gram tepung umbi porang, dilarutkan dengan air ad 1000 mL.
2. Larutan ditambahan HCl untuk menurunkan pH, dicek dengan pH meter. 3. Larutan kemudian ditambahkan dengan enzim α-amilase
4. Diinkubasi pada suhu 105°C selama 2 jam.
5. Hasil hidrolisa selanjutnya disentrifuse sampai terentuk 2 lapisan yaitu endapan berupa serat-residu lain yang tidak terhidrolisis dan filtrat yang mengandung campuran oligosakarida dan glukomanan.
6. Filtrat selanjutnya diekstraksi secara kimia menggunakan etanol 96% berlebih dalam erlenmeyer sampai terbentuk endapan dan filtrat.
7. Kemudian dilakukan penyaringan vakum untuk memisahkan filtrat dan residu.
8. Residu yang dihasilkan dicuci dengan etanol dan dikeringkan dalam oven pada suhu 40°C selama 2 jam.
9. Setelah dikeringkan, kemudian dilakukan penggilingan sampai terbentuk tepung glukomanan murni. Kemudian ditimbang
3.6.4. Identifikasi Glukomanan 3.6.4.1. Uji organoleptis
Tepung porang diamati secara organoleptis meliputi bentuk, warna, aroma, dan rasa.
3.6.4.2. Uji kelarutan dalam air
1. 100 mg tepung porang dilarutkan dalam 10 mL air dingin 2. Larutan tepung porang dipanaskan sampai terbentuk gel 3. Kemudian dilarutkan kembali dengan air dingin
3.6.4.3. Uji daya membentuk gel
100 mg tepung porang dilarutkan dalam 10 mL air kapur 5% sampai terbentuk gel
3.6.4.4. Uji daya merekat
1. 100 mg tepung porang diarutkan dalam 10 mL air 2. Kemudian ditambah 2 mL asam asetat
3.6.4.5. Uji daya mengembang
100 mg tepung porang dilarutkan dalam air dan didiamkan selam 30 menit sampai mengembang
3.6.5. Pembuatan konyaku
1. Tepung glukomonan sebanyak 6 gram dilarutkan 100 cc air, diaduk selama ± 2 jam
2. Selama proses pengadukan campuran ini ditambahkan bahan penguat yaitu garam kalsium sebelum campuran mengeras tuangkan dalam cetakan, diamkan sampai mengeras
3. Konyaku yang sudah jadi, direndam dalam kapur sirih ± 30 menit 4. Konyaku yang sudah jadi direbus dengan air mendidih ± 15 menit
3.6.6. Uji Aktifitas Glukomanan dalam pada mencit 1. Kelompok kontrol positif
- mencit dicek kadar gula awal
- mencit disonde larutan glukosa dengan dosis 0,75gram/kgBB, ditunggu 30 menit
- mencit disonde larutan acarbose, di tunggu 2 jam, lakukan cek kadar gula
- dilakukan setiap hari selama 5 hari. 2. Kelompok kontrol negative
- mencit dicek kadar gula awal
- mencit disonde larutan glukosa dengan dosis 0,75gram/kgBB, ditunggu 30 menit
- di tunggu 2 jam, lakukan cek kadar gula - dilakukan setiap hari selama 5 hari.
3. Kelompok pemberian glukomanan murni - mencit dicek kadar gula awal
- mencit disonde larutan glukosa dengan dosis 0,75gram/kgBB, ditunggu 30 menit
- mencit disonde glukomanan murni dengan dosis 0,06 gram/kgBB, di tunggu 2 jam, lakukan cek kadar gula
- dilakukan setiap hari selama 5 hari 4. Kelompok perlakuan dosis 1
- mencit dicek kadar gula awal
- mencit disonde larutan glukosa dengan dosis 0,75gram/kgBB, ditunggu 30 menit
- mencit disonde produk konyaku dengan dosis 0,06 gram/kgBB, di tunggu 2 jam, lakukan cek kadar gula
- dilakukan setiap hari selama 5 hari 5. Kelompok perlakuan dosis 2
- mencit dicek kadar gula awal
- mencit disonde larutan glukosa dengan dosis 0,75gram/kgBB, ditunggu 30 menit
- mencit disonde produk konyaku dengan dosis 0,12 gram/kgBB, di tunggu 2 jam, lakukan cek kadar gula
- dilakukan setiap hari selama 5 hari 6. Kelompok perlakuan dosis 3
- mencit disonde larutan glukosa dengan dosis 0,75gram/kgBB, ditunggu 30 menit
- mencit disonde produk konyaku dengan dosis 0,18 gram/kgBB, di tunggu 2 jam, lakukan cek kadar gula
- dilakukan setiap hari selama 5 hari
3.7 Analis Data
Data yang diperoleh dari pengamatan dengan menggunkan tabel dan grafik. Analisis data penelitian diperoleh dari perolehan %rendemen dan penurunan kadar gula darah mencit.
Untuk melihat ketelitian masing-masing replikasi dihitung standar deviasi (SD) dan koefisien variasi (Kv) dengan menggunakan rumus sebagai berikut :
SD = KV= x 100% Keterangan : SD = standar deviasi Kv = koefisien variasi n = jumlah sampel X1 = kadar sampel
x = kadar rata-rata sampel
Data hasil pengamatan dibuat dalam bentuk grafik histogram sehingga dapat diamati dosis optimal yang dicapai. Grafik dibuat sumbu x berupa hasil pengukuran kadar gula darah dan sumbu y sebagai hitungan hari saat pengujian.
37 BAB IV
HASIL
4.1. Determinasi Tanaman
Tanaman yang digunakan dalam penelitian ini adalah umbi porang yang diperoleh dari desa Pesanggrahan kecamatan Montong Gading, kabupaten Lombok Timur, Nusa Tenggara Barat. Kemudian dilakukan determinasi di Laboratorium Taksonomi, Struktur, dan Perkembangan Tumbuhan Universitas Brawijawa Malang. Adapun hasil determinasi terlampir dalam lampiran 2.
4.2. Pembuatan Tepung
Umbi porang segar sebanyak 7 kg menghasilkan 365 gram tepung umbi porang. Tepung umbi porang berbentuk serbuk tidak terlalu halus, berwarna coklat kekuningan dan kadar air sebesar 12 % . Kadar pati dalam tepung umbi porang sebesar 13,608%. Adapaun hasil perhitungan penetapan kadar pati terlampir dalam lampiran 3.
4.3. RendemenTepung Porang dan Glukomanan
Adapun rendemen yang diperoleh dalam penelitian ini adalah sebagai berikut:
Tabel 4.1 Hasil Rendemen Tepung Porang dan Glukomanan
Bahan Hasil rendemen
7 kg umbi umbi porang 365 gram tepung porang
25 gram tepung porang 12,765 gram
glukomanan
4.4. Uji Fisikokimia Glukomanan
Adapaun hasil uji fisikokimia glukomanan umbi porang adalah sebagai berikut :
Tabel 4.2. Hasil Uji Fisikokimia Glukomanan
Uji Glukomanan Murni Isolat Glukomanan
Organoleptis - Bentuk - Warna - Bau - Rasa - Tekstur
- Butiran seperti kristal - Kuning
- Tidak berbau - Tidak berasa - Kasar
- Serpihan seperti karet - Coklat
- Tidak berbau - Tidak berasa - Kenyal Kelarutan Larut dalam airmembentuk
gel
Larut dalam air membentuk gel
Membentuk gel Gel tidak berwarna Gel tidak berwarna
Merekat Menjadi encer dengan
penamabah asam
Menjadi encer dengan penamabah asam
Mengembang Mengembang menjadi sangat banyak
Mengembang menjadi sangat banyak
4.5. Konversi Kadar Glukomanan dalam Produk konyaku
Adapun hasil konversi kadar glukomanan dalam produk konyaku adalah sebagai berikut :
Tabel 4.3. Hasil Konversi Kadar Glukomanan Dalam Produk Konyaku
Dosis Kadar Glukomanan
Dosis I (0,06g/kgBB) 0,03 g/kgBB
Dosis II(0,12g/kgBB) 0,06 g/kgBB
Dosis III(0,18g/kgBB) 0,09 g/kgBB
Adapaun hasil perhitungan penetapan konversi kadar terlampir dalam lampiran 4.
4.6. Hasil Pengujian terhadap DM
Pengujian terhadap DM dilakukan dengan pemberian tepung umbi porang yang dibuat dalam bentuk pangan. Adapun hasil pengujian terhadap DM adalah sebagai berikut :
4.6.1. Hasil Pengujian Kontrol Positif (Acarbose)
Tabel 4.4 Pengukuran kadar gula pada kelompok kontrol positif (mg/dl)
Pengamatan hari ke-1 hari ke-2 hari ke-3 hari ke-4 hari ke-5
A B AB A B AB A B AB A B AB A B AB 1 134 126 8 114 98 16 143 120 23 113 98 15 101 93 8 2 126 113 13 110 95 15 118 99 19 110 93 17 109 97 12 3 116 101 15 118 101 17 109 99 10 112 99 13 113 99 14 SD 9 13 4 4 3 1 18 12 7 2 3 2 6 3 3 KV 7 11 30 4 3 6 14 11 38 1 3 11 6 4 15 Keterangan :
A = kadar gula sebelum B = kadar gula setelah AB= penurunan kadar SD = Standart Deviasi KV = Koefisien Variasi
Adapun hasil pengamatan dalam bentuk grafik sebagai berikut :
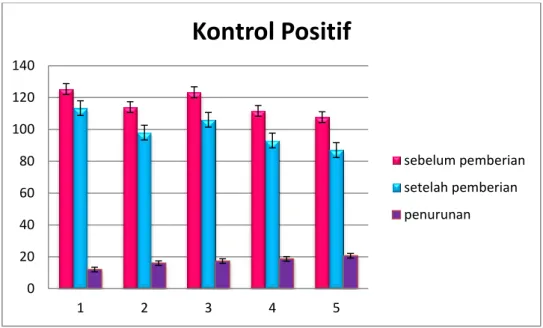
Gambar 4.1. Grafik Pengamatan Kontrol Positif
Berdasarkan grafik tersebut dapat dilihat bahwa terdapat perbedaan kadar gula darah mencit sebelum pemberian acarbose dan setelah pemberian acarbose dengan rata-rata penurunan kadar gula sebesar 17 mg/dl dalam periode 5 hari.
4.6.2. Hasil Pengujian Kontrol Negatif (Glukosa)
Tabel 4.5 Pengukuran kadar gula pada kelompok kontrol negatif (mg/dl)
Pengamatan hari ke-1 hari ke-2 hari ke-3 hari ke-4 hari ke-5
A B AB A B AB A B AB A B AB A B AB 1 161 202 41 157 203 46 129 174 45 109 157 48 132 184 52 2 101 159 58 129 173 44 124 179 55 111 163 52 154 209 55 3 116 139 23 142 184 42 138 184 46 117 172 55 149 198 49 SD 31 32 18 14 15 2 7 5 6 4 11 8 14 21 11 KV 25 19 43 10 8 5 5 3 11 4 7 17 10 10 17 0 20 40 60 80 100 120 140 1 2 3 4 5
Kontrol Positif
sebelum pemberian setelah pemberian penurunanKeterangan :
A = kadar gula sebelum B = kadar gula setelah AB= penurunan kadar SD = Standart deviasi KV = Koefisien Variasi
Adapun hasil pengamatan dalam bentuk grafik sebagai berikut :
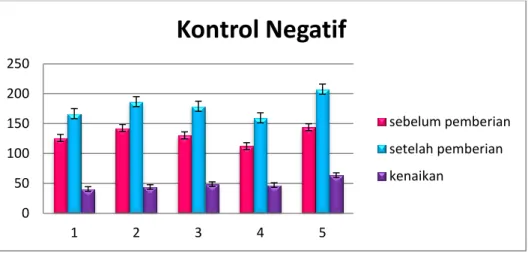
Gambar 4.2. Grafik Pengamatan Kontrol Negatif
Berdasarkan grafik tersebut dapat dilihat bahwa terdapat perbedaan kadar gula darah mencit sebelum pemberian glukosa dan setelah pemberian glukosa dengan rata-rata kenaikan kadar gula sebesar 49 mg/dl dalam periode 5 hari.
4.6.3. Hasil Pengujian Kontrol Glukomanan Murni
Tabel 4.6 Pengukuran kadar gula pada kelompok kontrol glukomanan (mg/dl)
Pengamatan hari ke-1 hari ke-2 hari ke-3 hari ke-4 hari ke-5
A B AB A B AB A B AB A B AB A B AB 1 197 109 88 167 76 91 118 56 62 109 58 51 124 82 42 0 50 100 150 200 250 1 2 3 4 5
Kontrol Negatif
sebelum pemberian setelah pemberian kenaikan2 134 76 58 152 101 51 109 56 53 144 75 69 139 103 36 3 126 58 68 145 87 58 126 51 75 126 89 37 110 85 25
SD 39 26 15 11 13 21 9 3 11 18 16 16 15 11 9
KV 26 20 20 7 11 32 7 4 17 14 24 31 12 18 25
Keterangan :
A = kadar gula sebelum B = kadar gula setelah AB= penurunan kadar SD = Standart deviasi KV = Koefisien Variasi
Adapun hasil pengamatan dalam bentuk grafik sebagai berikut :
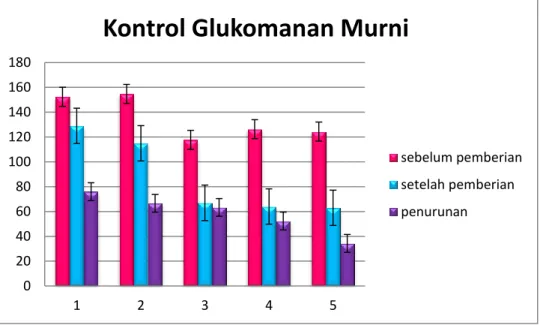
Gambar 4.3. Grafik Pengamatan Kontrol Glukomanan Murni
Berdasarkan grafik tersebut dapat dilihat bahwa terdapat perbedaan kadar gula darah mencit sebelum pemberian glukomanan dan setelah pemberian
0 20 40 60 80 100 120 140 160 180 1 2 3 4 5
Kontrol Glukomanan Murni
sebelum pemberian setelah pemberian penurunan
glukomanan dengan rata-rata penurunan kadar gula sebesar 59 mg/dl dalam periode 5 hari.
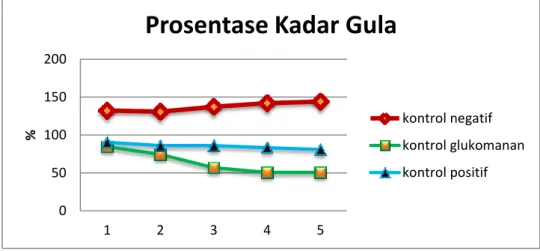
Sedangkan prosentase (%) perbedaan kadar gula masing-masing kontrol dapat dilihat pada grafik berikut ini :
Gambar 4.4. Grafik Prosentase Kadar Gula
Berdasarkan grafik tersebut maka pada kontrol negative terdapat kenaikan kadar gula darah akibat pemberian glukosa pada mencit sedangkan pada kontrol glukomanan dan kontrol positif tampak terjadi penurunan kadar gula pada mencit dengan kontrol glukomanan yang menunjukkan penurunan lebih banyak.
4.6.4. Hasil Pengujian Produk Tepung Porang
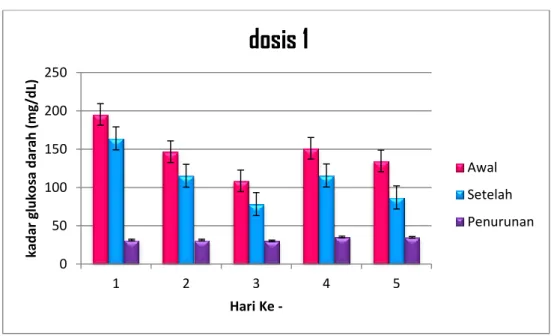
Tabel 4.7 Pengukuran Kadar Gula Pada Kelompok Perlakuan Dosis 0,06g/KgBB
Pengamatan hari ke-1 hari ke-2 hari ke-3 hari ke-4 hari ke-5
A B AB A B AB A B AB A B AB A B AB 1 221 198 23 110 75 35 107 86 21 186 147 39 162 88 74 2 176 146 30 160 138 22 115 77 38 154 111 43 130 117 13 3 189 148 41 170 133 37 104 72 32 113 89 24 112 94 18 SD 23 29 9 32 35 8 6 7 9 37 29 10 25 15 34 0 50 100 150 200 1 2 3 4 5 %
Prosentase Kadar Gula
kontrol negatif kontrol glukomanan kontrol positif
KV 12 18 29 22 30 26 5 9 28 24 25 28 19 18 97
Keterangan :
A = kadar gula sebelum B = kadar gula setelah AB= penurunan kadar SD = Standart deviasi KV = Koefisien Variasi
Adapun hasil pengamatan dalam bentuk grafik sebagai berikut :
Gambar 4.5. Grafik Pengamatan Dosis 1
Berdasarkan grafik tersebut dapat dilihat bahwa terdapat perbedaan kadar gula darah mencit sebelum dan setelah perlakuan dengan rata-rata penurunan sebesar 33 mg/dl dalam periode 5 hari.
0 50 100 150 200 250 1 2 3 4 5 kad ar g lu ko sa d ar ah (m g/ d L) Hari Ke -
dosis 1
Awal Setelah PenurunanTabel 4.8 Pengkuran Kadar Gula Pada Kelompok Dosis 0,12g/KgBB
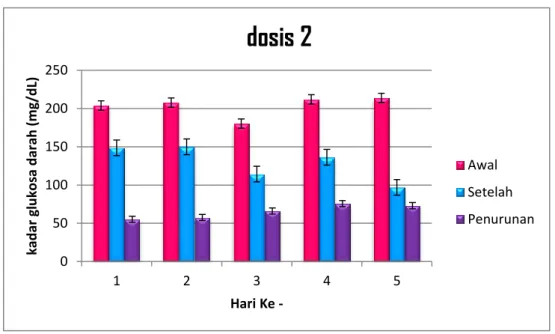
Pengamatan hari ke-1 hari ke-2 hari ke-3 hari ke-4 hari ke-5
A B AB A B AB A B AB A B AB A B AB 1 221 157 64 213 165 48 207 128 78 219 146 73 220 100 120 2 204 146 58 199 154 45 145 60 85 202 107 95 199 155 44 3 187 143 44 211 131 80 189 155 34 215 196 59 233 168 55 SD 17 7 10 8 17 19 32 49 28 9 26 18 13 36 41 KV 8 5 19 4 12 34 18 43 42 4 19 24 6 37 56 Keterangan :
A = kadar gula sebelum B = kadar gula setelah AB= penurunan kadar SD = Standart deviasi KV = Koefisien Variasi
Adapun hasil pengamatan dalam bentuk grafik sebagai berikut
Gambar 4.6. Grafik Pengamatan dosis 2 0 50 100 150 200 250 1 2 3 4 5 kad ar g lu ko sa d ar ah (m g/ d L) Hari Ke -
dosis 2
Awal Setelah PenurunanBerdasarkan grafik tersebut dapat dilihat bahwa terdapat perbedaan kadar gula darah mencit sebelum dan setelah perlakuan dengan rata-rata penurunan sebesar 66 mg/dl dalam periode 5 hari.
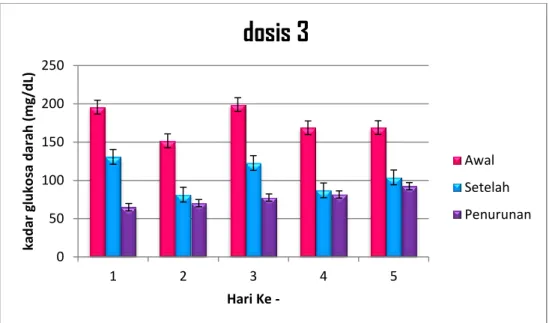
Tabel 4.9 Pengukuran Kadar Gula Pada Kelompok Dosis 0,18g/kgBB
Pengamatan hari ke-1 hari ke-2 hari ke-3 hari ke-4 hari ke-5
A S P A S P A S P A S P A S P 1 178 128 50 174 78 96 196 113 83 178 91 87 194 103 91 2 209 130 29 144 83 61 216 140 76 191 85 106 194 109 85 3 200 66 66 137 83 54 189 115 74 137 85 52 201 100 101 SD 16 3 15 20 3 23 14 15 5 28 3 27 4 5 8 KV 8 2 22 13 4 32 7 12 6 17 4 34 2 4 9 Keterangan :
A = kadar gula sebelum B = kadar gula setelah AB= penurunan kadar SD = Standart deviasi KV = Koefisien Variasi
Gambar 4.7. Grafik Pengamatan dosis 3
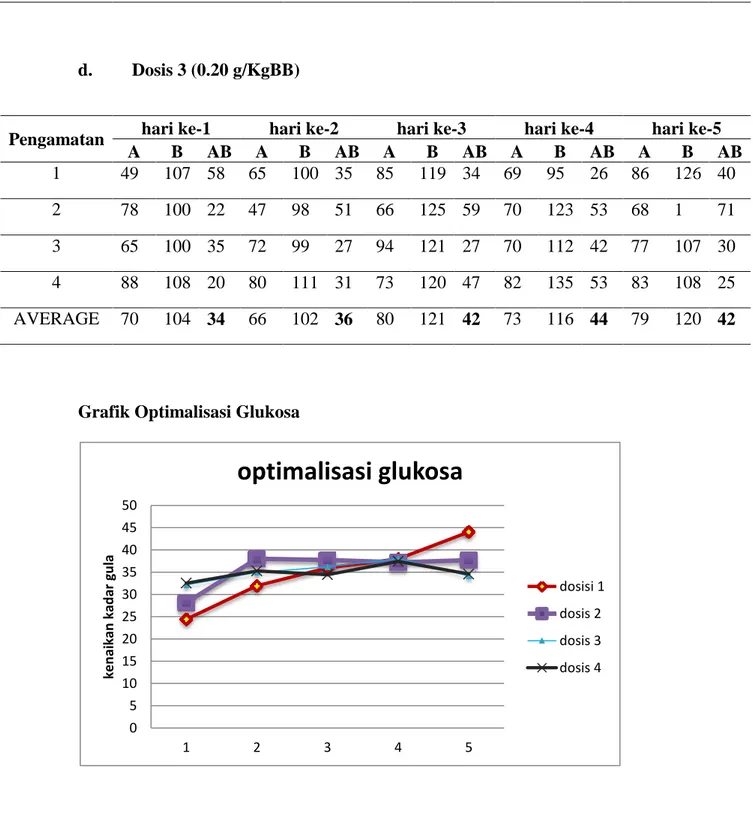
Berdasarkan grafik tersebut dapat dilihat bahwa terdapat perbedaan kadar gula darah mencit sebelum dan setelah perlakuan dengan rata-rata penurunan sebesar 77 mg/dl dalam periode 5 hari.
Sedangkan prosentase (%) perbedaan kadar gula masing-masing kontrol dapat dilihat pada grafik berikut ini :
Gambar 4.8. Grafik Prosentase Penurunan Kadar Gula
0 50 100 150 200 250 1 2 3 4 5 kad ar g lu ko sa d ar ah (m g/ d L) Hari Ke -
dosis 3
Awal Setelah Penurunan y = -4,0746x + 87,401 R² = 0,7814 y = -6,302x + 82,535 R² = 0,8024 y = -1,2529x + 62,792 R² = 0,0994 0 10 20 30 40 50 60 70 80 90 1 2 3 4 5 %Prosentase Penurunan Kadar Gula
dosis 1 dosis 2 dosis 3 Linear (dosis 1) Linear (dosis 2) Linear (dosis 3)
Berdasarkan grafik diatas maka dapat dilihat bahwa penurunan kadar gula tampak pada semua dosis pemberian dengan penurunan yang cukup signifikan. Perlakuan terbaik untuk menghasilkan penurunan kadar gula yang optimal terdapat pada dosis ke- 2.
49 BAB V
PEMBAHASAN
Pada penelitian ini umbi porang diperoleh dari desa Pesanggrahan, kecamatan Montong Gading, Kabupaten Lombok Timur, Provinsi Nusa Tenggara Barat. Setelah didapat umbi porang kemudian dilakukan determisasi tanaman di Laboratorium Taksonomi, Struktur, dan Pengembangan Tanaman, Universitas Brawijaya Malang. Determinasi tanaman sangat penting dilakukan, untuk membedakan antara umbi porang dan umbi suweg, karena jika dilihat dari bentuk umbi keduanya sama. Hasil determinasi membuktikan bahwa sampel umbi yang di ambil dari Lombok, NTB memang benar Amorphophallus muelleri Blume (nama latin umbi porang).
Tahap pertama pada penelitian ini adalah pengolahan umbi segar menjadi tepung porang. Umbi porang dicuci lalu ditiriskan untuk memisahkan tanah yang melekat pada permukaan umbi. Umbi porang bersih dikuliti, kemudian dipotong – potong. Potongan umbi porang direndam larutan NaCl jenuh selama 24 jam, hal ini perlu dilakukan untuk menhilangkan lendir yang terdapat pada umbi porang. NaCl dalam air akan terurai menjadi Na+ dan Cl-. Karena lendir pada umbi porang yang menyebabkan rasa sangat gatal merupakan senyawa Ca(C2O4)2. Perendemanan dengan NaCl akan menghasilkan reaksi kimia, atom Ca2+pada Ca(C2O4)2 akan dan diikat oleh Cl-dari NaCl membentuk senyawa CaCl2 dan terlarut dalam air. Potongan umbi porang yang sudah ditiriskan dipasrah agar