METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Juli – September 2016, pengambilan sampel ikan dan air dilakukan di kolam budidaya yang berada di Patumbak. Identifikasi bakteri pada sampel air dilakukan di Laboratorium BTKLPP (Balai Teknik Kesehatan Lingkungan dan Pengendalian Penyakit). Isolasi dan pemurnian bakteri dari sampel ikan dilakukan di Balai Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan (BKIPM) Kelas I Medan I, Jalan Karantina Ikan, Kualanamu Medan dan selanjutnya karakterisasi dan identifikasi dilakukan dengan alat Vitek 2 Compact di Laboratorium Rumah Sakit Murni Teguh.
Alat dan Bahan
Alat yang digunakan pada penelitian ini adalah alat tulis, termometer, timbangan analitik, pH meter, cawan petri, tabung reaksi, gelas ukur, object glass, bunsen, laminar air flow, labu Erlenmeyer, autoclave, pipet tetes, hand spray, sarung tangan, masker, oven, inkubator, mikroskop, jarum ose, alat-alat bedah dan alat Vitek 2 Compact.
Bahan yang digunakan pada penelitian ini yakni sampel uji ikan dan air, medium Tryptone Soya Agar (TSA), aquades steril, alkohol 70%, kapas, kertas label, kain kasa, alumunium foil dan zat untuk pewarnaan sel bakteri seperti kristal violet, iodin, alkohol aseton, dan safranin. Alat dan Bahan yang digunakan dapat dilihat pada Lampiran 1.
Pelaksanaan Penelitian
Penelitian akan dilakukan dengan pengambilan sampel ikan nila yang menunjukan gejala klinis dan sampel air serta pengukuran parameter kulaitas air pada kolam budidaya. Sampel ikan nila diambil secara acak, kemudian dilakukan tahapan isolasi pada permukaan dan bagian dalam tubuh selanjutnya dilakukan identifikasi dan karakterisai bakteri.
Pengambilan Sampel Ikan dan Sampel Air
Sampel ikan nila diambil mewakili keseluruhan lokasi tambak berdasarkan gejala ikan terserang penyakit berupa luka atau borok pada tubuh ikan. Kemudian ikan segera dibawa ke laboratorium dalam keadaan hidup yang dikemas secara steril.
Sampel air kolam diambil dengan menggunakan botol steril. Botol yang telah berisi air hasil sampling dimasukkan ke dalam coolbox untuk menjaga agar bakteri tidak mati kemudian dibawa ke laboratorium untuk dianalisis.
Pengukuran Kualitas Air
Parameter kualitas air yang diukur meliputi Suhu, Oksigen terlarut, Derajat keasaman (pH), Kecerahan, Mikrobiologi (Total coliform dan Colifaecal) Pengukuran suhu, pH dan kecerahan dilakukan di lokasi budidaya ikan (in situ) sedangkan pengukuran DO dan Mikrobiologi dianalisis di Laboratorium BTKLPP (Balai Teknik Kesehatan Lingkungan dan Pengendalian Penyakit).
Prosedur Pemeriksaan Penyakit Bakterial
Pemeriksaan penyakit bakteri pada ikan akan dilakukan dengan dua cara, yaitu pemeriksaan tubuh bagian luar dan pemeriksaan tubuh bagian
dalam. Dalam pemeriksaan ini perlu dilihat gejala-gejala klinis yang ada pada tubuh bagian luar ikan seperti luka, kekurangan lendir, tubuh kasar, bentuk tubuh tidak normal, adanya luka/borok (ulcer) dan lain-lain. Pemeriksaan organ dalam dilakukan dengan membedah tubuh ikan kemudian diamati gejala-gejala yang tidak normal pada tubuh ikan bagian dalam seperti perubahan warna ginjal, insang, adanya cairan berlebih dalam rongga tubuh dan lain-lain.
Isolasi Bakteri Patogen dari Sampel Ikan
Isolasi bakteri ini dilakukan dengan menggunakan media umum TSA. Isolasi bakteri dilakukan secara aseptik di Laminar air flow dengan teknik cawan gores, yaitu dengan menusukkan jarum ose yang steril ke organ ikan yang diduga terkena penyakit di bagian permukaan tubuh dan bagian dalam tubuh. Kemudian diisolasi ke media TSA dan diinkubasi dalam inkubator dengan suhu 30 oCselama 18 – 24 jam. Setelah diinkubasi selama 24 jam didapatkan koloni-koloni bakteri yang tumbuh di media TSA, kemudian diisolasi kembali ke media TSA yang lain untuk mendapatkan biakan murni. Tujuan dari pemurnian ini adalah untuk memisahkan bakteri yang satu dengan yang lainnya sehingga didapatkan koloni yang seragam (sejenis). Koloni yang sudah murni diisolasi kembali ke media miring TSA dan diinkubasi lagi untuk dilakukan identifikasi bakteri.
Karakterisasi dan Identifikasi Bakteri
Karakterisasi dilakukan dengan pengamatan struktur makroskopis, mikroskopis, dan uji biokimia. Struktur makroskopis dengan mengamati bentuk koloni, warna koloni serta bentuk tepi koloni. Bakteri ditumbuhkan pada medium agar TSA dan pengamatan morfologi koloni dilakukan setelah kultur diinkubasi pada suhu 37oC selama 18 – 24 jam. Struktur mikroskopis yang
diamati meliputi bentuk sel dan formasi koloni sel, serta reaksi-reaksi pengecatan.
Isolat bakteri A diambil 1 ose dan digores-goreskan pada permukaan preparat steril kemudian dilakukan fiksasi. Kristal violet sebanyak 1 tetes ditambahkan ke permukaan preparat yang terdapat lapisan bakteri tersebut dan didiamkan selama 1 menit. Setelah 1 menit, preparat dibilas dengan air sampai zat warna luntur. Preparat dikeringkan di atas api spiritus. Setelah kering, larutan iodin sebanyak 1 tetes ditambahkan ke permukaan preparat tersebut dan didiamkan selama 1 menit. Setelah 1 menit, preparat dibilas dengan air. Preparat dibilas dengan alkohol 96% sampai semua zat warna luntur kemudian dicuci dengan air. Preparat dikeringkan di atas api spiritus. Setelah kering, safranin 1% sebanyak 1 tetes ditambahkan ke permukaan preparat dan didiamkan selama 45 detik. Preparat dicuci dengan air dan dikeringkan. Preparat diamati menggunakan mikroskop dengan perbesaran 1000x. Pewarnaan diulang untuk isolat bakteri B, C dan D (Pratita dan Putra, 2012).
Seteleh dilakukan pewarnaan gram, kemudian diperhatikan bentuk bakteri, pergerakan dan warna bakteri. apabila bakteri berwarna ungu merupaan bakteri gram positif (+) dan jika berwarna merah merupaan bakteri gram negatif (-). Identifikasi jenis bakteri dilakukan dengan alat Vitek 2 Compact di laboratorium.
HASIL DAN PEMBAHASAN
Hasil
Pengamatan gejala klinis pada Ikan Nila
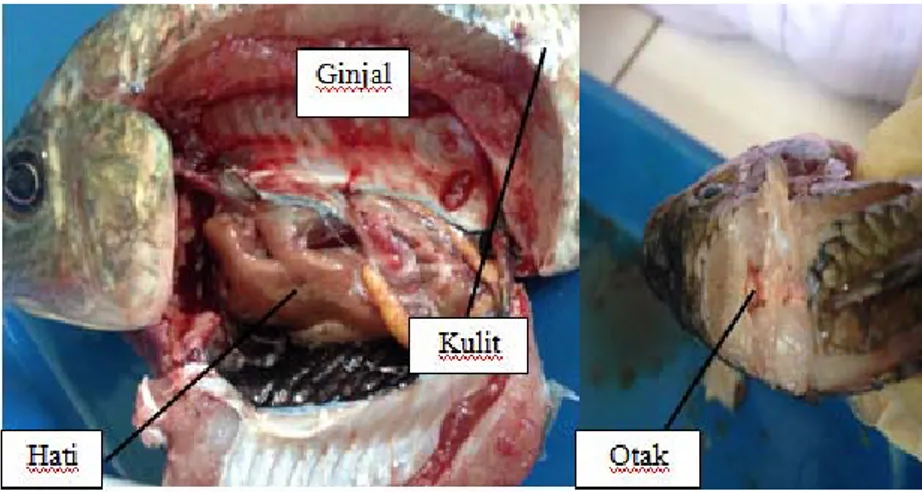
Penelitian ini dilakukan dengan mengisolasi sampel ikan nila yang terlihat sakit, sampel ikan memiliki berat 382 g dan panjang total ikan 18,5 cm (Lampiran 2). Gejala klinis pada ikan seperti terdapat luka pada permukaan tubuh dan sisik yang berlepasan. Pada pemeriksaan bagian tubuh ikan uji juga terdapat gejala klinis yaitu kulit pucat dan mengelupas, hati ikan uji terlihat pucat. Hal ini dapat dilihat pada Gambar 3.
Gambar 3. Bagian tubuh ikan nila yang diisolasi
Isolasi bakteri dari bagian tubuh ikan nila
Koloni bakteri yang tumbuh pada media kultur TSA terdapat 5 isolat yang berbeda dari keseluruhan koloni bakteri yang tumbuh. Masing-masing isolat yakni 1 isolat dari ginjal, 1 isolat dari kulit, 1 isolat dari hati dan 2 isolat dari otak (Lampiran 3).
Karakterisasi dan Identifikasi Bakteri Potensial Patogen
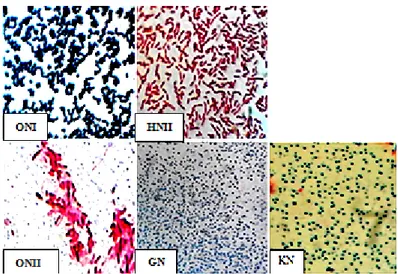
Karakterisasi bakteri secara mikroskopis dilakukan dengan pewarnaan Gram. Hasil pewarnaan Gram didapat bakteri Gram positif sebanyak 3 isolat yaitu ON1, GN dan KN sedangkan bakteri Gram posotif sebanyak 2 isolat yaitu ONII dan HNII. Struktur mikroskopis dari isolat dapat dilihat pada Gambar 3.
Keterangan: ON (isolat dari sampel otak); HN (isolat dari sampel hati); GN (isolat dari ginjal); KN (isolat dari kulit).
Gambar 4. Struktur mikroskopis dari isolat (ONI) Coccus Gram Positif; (ONII) Basil Gram Negatif; (HNII) Basil Gram Negatif; (GN) Coccus Gram Positif; (KN) Coccus Gram Positif.
Pengamatan morfologi isolat yang ditemukan dapat dilihat dari tepian, elevasi dan warna koloni. Semua isolat memiliki tepian dan elevasi yang sama, hanya terdapat perbedaan warna pada beberapa bakteri. Morfologi koloni isolat disajikan pada Tabel. 1.
Tabel 1. Morfologi Koloni dan sel isolat
No. Kode Isolat Tepian Elevasi Warna Gram Morfologi Koloni Morfologi Sel Bentuk
1. ONI Licin Cembung Kuning + Staphylococcus
2. ONII Licin Cembung Krem - Diplobasil
3. HNII Licin Cembung Krem - Diplobasil
4. GN Licin Cembung Kuning + Coccus
Hasil identifikasi (Lampiran 5) menggunakan Vitek 2 Compact menunjukkan bahwa bakteri yang didapat yaitu jenis bakteri Kocuria kristinae dan Stenotrophomonas maltophilia ditemukan pada bagian otak, bakteri Aeromonas hydriphila pada hati, bakteri Staphylococcus lentus pada ginjal dan bakteri Staphylococcus warneri terdapat pada kulit. Jenis bakteri yang ditemukan dapat dilihat pada Tabel 2.
Tabel 2. Bakteri yang ditemukan pada sampel ikan nila
No. Kode Isolat Jenis Bakteri
1. ONI Kocuria kristinae
2. ONII Stenotrophomonas maltophilia
3. HNII Aeromonas hydrophila
4. GN Staphylococcus lentus
5. KN Staphylococcus warneri
Kualitas Air Kolam Budidaya
Kondisi lingkungan perairan merupakan faktor yang dapat mempengaruhi kehidupan ikan pada habitatnya. Dari hasil pengukuran (Lampiran 4) diperoleh bahwa air kolam memiliki suhu 32 oC, pH 6,9 dan kandungan oksigen terlarut (DO) yaitu 2,96 mg/l. Hasil pengamatan parameter kualitas air terdapat pada Tabel berikut
Tabel 3. Pengukuran Kualitas Air Kolam Budidaya
No Parameter Satuan Metode/Alat Baku
Mutu*
Hasil Analisa Fisika
1. Suhu oC Termometer Deviasi 3 32
2. pH pH meter 6 – 9 6,9 Kimia 1. DO mg/l Elektroda 2,960 Mikrobiologi 1. Total Coliform MPN/100 ml APHA9221B.22nd ed.2012 5000 400 2. Colifaecal MPN/100 ml APHA9221E.22nd ed.2012 1000 170 *: Berdasarkan PP no. 82 tahun 2001 tentang persyaratan kualitas air badan air
Pembahasan
Pengamatan gejala klinis pada Ikan Nila
Pada daerah patumbak banyak masyarakat melakukan usaha kolam budidaya yang salah satu komoditi kolam yaitu ikan nila (O. niloticus). Usaha budidaya pada daerah ini masih menerapkan sistem ekstenssif/ tradisional yaitu konstruksi kolam masih menggunakan tanah, sumber air berasal dari kolam dan memenfaatkan ait hujan dan belum ada pemakaian alat-alat bantu modern. Penanganan yang kurang pada kolam menyebabkan banyak ikan nila (O. niloticus) terserang penyakit sehingga menyebabkan ikan mati. Menurut Arie (2003) sistem ekstensif merupakan sistem pemeliharaan ikan yang belum berkembang, input produksinya sangat sederhana, biasa dilakukan dikolam air tawar, dan pengairannya tergantung pada musim hujan.
Pemeriksaan sampel ikan menunjukkan gejala klinis yaitu warna tampak kulit pucat, sisik-sisik pada tubuh ikan berlepasan, bagian hati dan insang ikan uji terlihat pucat. Menurut Kordi (2010), bahwa ciri-ciri ikan yang terserang bakteri ini biasanya warna tubuh gelap, mata rusak dan agak menonjol, sisik terkelupas, seluruh siripnya rusak, bernafas di atas permukaan air, insang rusak berwarna merah keputihan, sehingga kesulitan bernafas. Serangan bakteri pada kulit meyebabkan kulit menjadi kesat, timbul pendarahan yang selanjutnya diikuti dengan luka-luka/borok/perut kembung serta terjadi pendarahan pada hati, ginjal dan limfa saat dilakukan pembedahan.
Isolasi dan identifikasi bakteri potensial patogen
Ikan nila yang terdapat gejala klinis diisolasi pada bagian ginjal, hati, otak dan kulit. Isolasi menggunakan media TSA dan di inkubasi pada suhu kamar
selama 24 jam. Setelah proses isolasi selama 24 jam selesai dan timbul berbagai macam koloni bakteri, kemudian dilakukan pemurnian terhadap bakteri yang terlihat dominan pada media TSA. Masing-masing isolat yakni 1 isolat dari ginjal, 1 isolat dari kulit, 1 isolat dari hati dan 2 isolat dari otak. Reaksi pewarnaan Gram merupakan hal penting dalam identifikasi yang digunakan untuk memisahkan anggota-anggota dominan bakteria ke dalam dua kelompok berdasarkan perbedaan dinding selnya.
Pewarnaan Gram dan pengamatan mikroskopis menunjukkan bahwa bakteri ONII dan HNII berbentuk batang dan berwarna merah yang merupakan bakteri Gram negatif sedangkan bakteri ONI, GN dan KN berbentuk coccus dan berwarna biru keunguan yang merupakan gram positif. Hal ini sesuai dengan pernyataan Dwidjoseputro (2010), bakteri Gram positif mampu mempertahankan zat warna utama dalam pewarnaan gram, yaitu gentian violet, sehingga nampak berwarna ungu saat pengamatan dikarenakan dinding sel kelompok bakteri ini tersusun oleh sebagian besar peptidoglikan, yang mampu mengikat zat warna dan tidak rusak saat dicuci dengan alkohol. Sementara itu, bakteri gram negatif memiliki komposisi dinding sel yang sebagian besar tersusun dari lapisan lipid, sehingga pada saat pewarnaan kurang dapat mempertahankan zat warna utama terutama saat dicuci dengan alkohol (lipid rusak saat dicuci dengan alkohol), akibatnya kelompok bakteri ini memberikan kenampakan warna merah.
Kocuria kristinae
Isolat ONI yang diisolasi dari otak merupakan bakteri Gram positif, memiliki sel berbentuk staphylococcus, koloni berwarna kuning dengan tepian licin, elevasi cembung. Hasil identifikasi bakteri dengan Vitek 2 menunjukkan
isolat ONI merupakan bakteri K. kristinae. Hal ini sesuai dengan Lakshmikantha dkk (2015) K. kristinae sebelumnya disebut Micrococcus Kristinae pertama kali dijelaskan pada tahun 1974 K. kristinae bakteri kokus Gram positif, koloni halus, cembung, non-hemolitik, katalase positif, koagulase negatif, oksidase positif dan nonmotile, koloni tumbuh dalam kondisi aerobik di 37oC.
Bakteri K. kristinae sangat jarang ditemukan pada ikan, bakteri ini dapat menyebabkan penyakit pada manusia.Menurut Paul dkk (2015), spesies Kocuria banyak di lingkungan dan merupakan flora normal manusia dan mamalia lainnya. K. kristinae jarang menyerang manusia dan kebanyakan menginfeksi pada orang dengan sistem kekebalan yang sudah rusak. Bakteri ini telah dilaporkan menyebabkan vena sentral kateter terkait bakteremia dan peritonitis pasien lemah kronis. Baru-baru ini, organisme ini telah terimplikasi dalam abses otak, kolesistitis akut, endokarditis infektif dan kateter terkait bakteremia lainnya.
Stenotropmonas maltophilia
Isolat ONII yang diisolasi dari otak merupakan bakteri Gram negatif dan memiliki sel berbentuk diplobasil. Hasil identifikasi bakteri dengan Vitek 2 menunjukkan isolat ONI merupakan bakteri S. maltophilia. Menurut Denton dan Kerr (1998) S. maltophilia adalah suatu organisme dengan potensi patogen sangat terbatas yang jarang mampu menyebabkan penyakit pada individu selain yang sangat lemah. S. maltophilia termasuk ke dalam Gram negatif dengan karakteristik berbentuk batang dan berukuran antara 0,5 – 1,5 µm.
Bakteri S. maltophilia diketahui merupakan bakteri oportunistik pada ikan. Keberadaan bakteri ini pada ikan dapat dikarenakan kontaminasi S. maltophilia dari air (tempat hidup ikan), suhu air pada kolam ikan sesuai dengan kondisi
lingkungan yang memungkinkan bakteri ini untuk hidup. Menurut Abraham dkk (2016), S. maltophilia merupakan bakteri patogen oportunistik global dan telah diperoleh dari tanah dan akar tanaman, hewan, invertebrata, pengolahan air dan sistem distribusi, danau, sungai. Bakteri tersebut hanya dapat tumbuh pada lingkungan yang tersedia oksigen dengan kondisi suhu optimal 35 oC. Bakteri ini perna diisolasi sebagai patogen oportunistik dari ginjal dari Clarias gariepinus.
Aeromonas hydrophila
Meskipun ikan nila mudah dibudidayakan, namun mudah juga terserang penyakit, seperti diinfeksi bakteri A. hydrophila. A. hydrophila adalah bakteri umum yang menyerang ikan, baik ikan air tawar maupun air laut. Menurut Hayes (2000) A. hydrophila telah ditemukan pada berbagai jenis ikan air tawar di seluruh dunia, dan adakalanya pada ikan laut. terdapat pandangan yang berbeda tentang peran yang tepat dari A. hydrophila sebagai ikan patogen. Beberapa peneliti menetapkan bahwa organisme ini hanya sebagai penyerang sekunder pada inang yang lemah, sedang yang lain menyatakan bahwa A. hydrophila adalah suatu patogen utama ikan air tawar
Pada ikan sampel ditemukan bahwa A. hydrophila menyerang ikan pada organ hati yang ditandai dengan hati berwarna pucat. Hati ikan adalah organ yang paling rentan terhadap penyakit infeksi, karena hepar berfungsi untuk detoksifikasi. Hal ini sesuai dengan pernyataan Asniatih dkk (2013) bahwa ikan yang sakit akibat infeksi A. hydrophila mengalami perdangan pada ginjal serta hati berwarna pucat. Hati ikan yang terinfeksi A. hydrophila menunjukkan adanya degenerasi atau kerusakan pada hepatopankreas yakni inti sel dan sitoplasma sudah tidak tampak lagi.
Keberadaan A. hydrophila pada bagian organ dalam ikan dapat disebabkan karena A. hydrophila bersifat motil sehingga dapat bergerak mencapai bagian dalam tubuh ikan. Menurut Mangunwardoyo dkk (2010) bakteri bergerak dengan sangat cepat didalam pembuluh darah, dan dengan mudah mencapai organ-organ penting dari ikan seperti pada hati dan ginjal. Lokasi tersebut akan dimanfaatkan oleh bakteri sebagai media tempat hidup dan memperbanyak diri, serta menggunakan nutrisi yang ada di sekitarnya untuk proses metabolisme.
Staphylococcus sp.
Pada penelitian ini ditemukan bakteri Staphylococcus sp. yaitu Staphylococcus lentus pada ginjal dan Staphylococcus warneri pada kulit ikan nila dengan sel coccus Gram positif. Menurut Jawetz dkk (1995), Staphylococcus sp. termasuk Gram positif, berbentuk bulat berdiameter 0,7-1,2 μm, tersusun dalam kelompok-kelompok yang tidak teratur seperti buah anggur, fakultatif anaerob, tidak membentuk spora, dan tidak bergerak. Bakteri ini tumbuh pada suhu optimum 37 ºC, tetapi membentuk pigmen paling baik pada suhu kamar (20 – 25ºC). Koloni berbentuk bundar, halus, menonjol, dan berkilau.
S. lentus adalah staphylococcus koagulase-negatif yang dimiliki kelompok Staphylococcus sciuri (S. sciuri, S. lentus, dan S. vitulinus). Staphylococci dikenal patogen hewan dan mereka telah diisolasi dari tikus, ayam, mamalia dan pertanian tanah dan air. Bakteri ini dapat berkoloni pada manusia dan menghasilkan infeksi serius, seperti endokarditis syok septik, infeksi saluran kemih, infeksi luka, endophthalmitis, dan penyakit radang panggul (Rivera, dkk., 2014). Pada penelitian ini bakteri S. lentus yang menginfeksi organ ginjal ikan dapat berpotensi sebagai patogen yang kemungkinan berasal dari lingkungan.
Bakteri Staphylococcus warneri diisolasi dari bagian dalam kulit. Adanya kulit yang mengelupas dan warna kulit yang pucat dapat mengindikasikan bahwa bakteri ini bersifat potensial patogen. Rami dkk (2015) menjelaskan bahwa Gram positif Staphylococcus spp. bisa patogen pada ikan, menyebabkan exophthalmia dan septikemia seperti gejala pada ikan yang telah terinfeksi meskipun juga telah dilaporkan dari ikan tanpa adanya penyakit. S. warneri meliputi beberapa strain dilaporkan sebagai patogen bagi manusia. Selain itu, S. warneri telah diisolasi dan tumbuh dari ginjal yang berubah warna dan hati dari ikan trout (Oncorhynchus mykiss) sakit yang muncul borok pada sirip dan exophthalmia, bersama dengan cairan asketik di perut.
Kualitas Air Kolam Budidaya
Suhu mempunyai peranan penting dalam menentukan pertumbuhan ikan yang dibudidaya, suhu yang diperoleh pada saat pengukuran di lapangan yaitu 32 oC. Menurut Kordi dan Tancung (2007) bahwa kisaran suhu yang dapat mendukung kehidupan organisme akuatik berada antara 28 – 32 oC. Perubahan suhu banyak dipengaruhi oleh musim, cuaca, dan waktu saat pengukuran.
Oksigen terlarut dalam air dapat mempengaruhi aktivitas ikan nila dan berpengaruh pada metabolisme dalam tubuh ikan. Nilai DO (oksigen terlarut) yang diperoleh yaitu 2,96 mg/l. Berdasarkan standar baku mutu air PP. No 82 Tahun 2001 (kelas II), kisaran oksigen terlarut untuk kegiatan budidaya ikan yaitu > 4 mg/l. Salah satu faktor yang menyebabkan rendahnya konsentrasi oksigen terlarut pada kolam budidaya ini yaitu suhu kolam yang relatif tinggi. Affan (2011) mengatakan bahwa peningkatan suhu dapat menurunkan kadar oksigen terlarut yang mempengaruhi metabolisme seperti laju pernafasan dan
konsumsi oksigen serta meningkatkan konsentrasi karbon dioksida. Menurut Tatangindatu dkk (2013) jika oksigen terlarut tidak seimbang akan menyebabkan stress pada ikan karena otak tidak mendapat suplai oksigen yang cukup, serta kematian akibat kekurangan oksigen yang disebabkan jaringan tubuh ikan tidak dapat mengikat oksigen yang terlarut dalam darah.
Nilai pH pada kolam budidaya yaitu 6,9, nilai ini masih berada dalam kisaran nilai ambang batas yang ditetapkan. Berdasarkan standar baku mutu air PP No.82 Tahun 2001 (kelas II), pH yang baik untuk kegiatan budidaya ikan air tawar berkisar antara 6 – 9. Menurut Affan (2011) pH sangat berpengaruh terhadap pertumbuhan dan kelangsungan hidup ikan, pada pH < 5 dan pH > 11 dapat menimbulkan kematian ikan dan tidak terjadi reproduksi.
Nilai pH pada penelitian masih dalam kisaran optimal untuk perkembangbiakan dan pertumbuhan ikan nila. Ikan nila memiliki toleransi tinggi terhadap perubahan lingkungan namun tidak mudah bertahan dengan perubahan secara tiba-tiba dengan variasi yang besar. Menurut Radhifuya (2011) kisaran pH yang ideal untuk kehidupan ikan adalah antara 6,5 – 8,5.
Pada penelitian ini dilakukan pemeriksaan bakteri Total coliform dan Colifaecal pada air kolam sebagai penilaian dalam penentuan tingkat kualitas air kolam budidaya. Menurut Yudo (2010) E.coli adalah mikroorganisme yang paling mengancam badan air sungai. Bakteri E.coli mengkontaminasi badan air sungai setelah tinja memasuki badan air, bahkan dalam keadaan tertentu E.coli dapat mengalahkan mekanisme pertahanan tubuh dan dapat tinggal di dalam pelviks ginjal dan hati.
Bakteri E.coli juga dapat membahayakan kesehatan, karena diketahui bahwa bakteri E.coli merupakan bagian dari mikrobiota normal saluran pencernaan dan menyebabkan gastroenteritis taraf sedang sampai parah pada manusia dan hewan manusia dan mungkin dapat mengandung pathogen (Diniari, dkk., 2015). Pada sampel air kolam kandungan bakteri Total coliform adalah 400 MPN/100ml sedangkan bakteri Colifaecal terdapat 170 MPN/100 ml. Standar baku mutu air kandungan Total coliform adalah <5000 MPN/100ml dan untuk Colifaecal untuk kegiatan budidaya ikan yaitu <1000 MPN/100ml (PP. No 82 Tahun 2001). Kualitas air kolam dapat dikatakan baik karena jumlah bakteri Colifaecal pada air kolam lebih kecil dari nilai baku mutu yang ditetapkan.
KESIMPULAN DAN SARAN
Kesimpulan
1. Pada penelitian ini diperoleh 5 jenis bakteri yang menginfeksi ikan nila yaitu pada otak terdapat Kocuria kristinae dan Stenotrophomonas maltophilia, Aeromonas hydrophila pada hati, Staphylococcus lentus pada ginjal dan Staphylococcus warneri pada kulit.
2. Pada penelitian ini dapat ditunjukkan bahwa kondisi lingkungan yang tidak baik (suhu relatif tinggi dan kandungan oksigen terlarut rendah) menjadi ikan ikan stress sehingga mudah terinfeksi bakteri.
Saran
Perlu dilakukan penanganan yang lebih baik untuk mengurangi terjadinya infeksi oleh bakteri pada kolam dengan cara perbaikan kualitas air pada kolam.