SINTESIS SENYAWA LAKTOGENIN DARI TETRAHIDROFURAN-3-KARBOKSALDEHID DAN 2-ASETIL-γ-BUTIROLAKTON
DALAM SUASANA BASA PIRIDIN
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi ilmu Farmasi
Diajukan oleh : Margareth Henrika Silow
NIM : 088114057
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
ii
SINTESIS SENYAWA LAKTOGENIN DARI TETRAHIDROFURAN-3-KARBOKSALDEHID DAN 2-ASETIL-γ-BUTIROLAKTON
DALAM SUASANA BASA PIRIDIN
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi ilmu Farmasi
Diajukan oleh : Margareth Henrika Silow
NIM : 088114057
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
iii
iv
v
HALAMAN PERSEMBAHAN
“Life is an opportunity, benefit from it. Life is beauty, admire it.
Life is a dream, realize it. Life is a challenge, meet it.
Life is a duty, complete it. Life is a game, play it. Life is a promise, fulfill it. Life is sorrow, overcome it.
Life is a song, sing it. Life is a struggle, accept it. Life is a tragedy, confront it.
Life is an adventure, dare it. Life is luck, make it.
Life is too precious, do not destroy it. Life is life, fight for it.”
―
Mother Teresa
Karya sederhanaku ini kupersembahkan untuk :
Papa dan Mama tercinta
Erol dan Emon tersayang
Almamaterku
vi
vii PRAKATA
Puji sembah syukur kepada Tuhan Yang Maha Esa atas segala berkat, rahmat, dan bimbingan yang melimpah kepada penulis sehingga dapat menyelesaikan skripsi yang berjudul “SINTESIS SENYAWA LAKTOGENIN DARI TETRAHIDROFURAN-3-KARBOKSALDEHIDA DAN 2-ASETIL-γ-BUTIROLAKTON DALAM SUASANA BASA PIRIDIN ” sebagai salah satu syarat dalam memperoleh gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi Universitas Sanata Dharma.
Karya sederhana ini tak lepas dari dukungan, bimbingan, dan saran yang sangat besar artinya bagi penulis. Pada kesempatan yang istimewa ini, penulis hendak menyampaikan rasa terima kasih dengan tulus kepada :
1. Ipang Djunarko, M.Si., Apt., selaku Dekan Fakultas Farmasi, Universitas Sanata Dharma Yogyakarta.
2. Jeffry Julianus, M.Si,. selaku dosen pembimbing yang dengan sabar membimbing dan memberikan saran kepada penulis dalam penyelesaian skripsi ini sekaligus sebagai dosen penguji atas segala masukan dan sarannya untuk kemajuan skripsi penulis.
3. Dra. M. M. Yetty Tjandrawati, M.Si. selaku dosen penguji atas segala masukan, kritik, dan sarannya.
4. Prof. Dr. Sri Noegrohati, Apt., selaku dosen penguji atas segala masukan, kritik, dan sarannya.
viii
5. Rini Dwi Astuti, M.Si., Apt., selaku kepala laboratorium Farmasi, atas ijin yang diberikan kepada penulis untuk melakukan penelitian di laboratorium Farmasi.
6. Semua Dosen di Fakultas Farmasi Universitas Sanata Dharma yang telah mendedikasikan waktu dan membagi ilmunya demi kemajuan Farmasi USD. Excellent in Quality, Competitiveness, and Care!
7. Staf Laboratorium Fakultas Farmasi Universitas Sanata Dharma secara khusus Pak Parlan, Mas Kunto, dan Mas Bimo yang telah menemani dan membantu penulis selama melakukan penelitian.
8. Keluarga besar Silow dan Ryadi atas doa dan semangat yang selalu penulis rasakan. Terimakasih banyak!
9. Elya Findawati dan Laurensius Widi A.P. atas kebersamaan dalam penelitian ini. Dukungan kalian yang membuat penulis selalu semangat.
10. Helena Angelina, Regina Clarissa, Sandra Ruby, Meyrina Harjani, Prasilya, Agnes Susianti, Florentina Sunaryo, Adi Wirasaputra. Bersama kalian hidup penulis menjadi indah.
11. Anasthasia Mardila, Sari Tambunan, Theresia Wijayanti. Makan siang tanpa kalian rasanya hambar sekali. Terima kasih atas kebersamaan, semangat, dan dorongan yang selalu penulis rasakan.
12. Alaen Shinto Purba. Terimakasih untuk kebersamaan selama ini baik suka dan duka.
13. Alfonsus Heppy, teman sejawat dari TITRASI 2008 hingga sekarang. Semoga sukses dan jaya terus.
ix
14. Teman kelompok praktikum dari semester 1-6 : Hepi, Elya, Widi, Icha, Dea, Natalia, Fajar, Cynthia, Singgih, Adi Wiro Sableng, Velly, Tia, Paulina, Ayen, Tiwi. Tak akan pernah terlupa praktikum bersama kalian!
15. Teman-teman Farmasi angkatan 2008, baik FST maupun FKK. Jadilah Farmasis yang e-QCC!
16. Teman-teman Farmasi dari angkatan 2009-2010, sukses terus di farmasi! 17. Teman-teman KKN angkatan 42 kelompok 12 desa Plagrak-Cangkringan:
Dita, Sita, Lando, Ika, Novia, Lukas, Dis, Vebri, dan Fajar. Semoga sukses dibidang masing-masing.
18. At least but no least, semua pihak yang telah membantu dan memberikan dukungan yang tidak dapat disebutkan satu persatu. Kalian selalu di hati.
Penulis menyadari bahwa skripsi ini jauh dari kata sempurna mengingat keterbatasan pengetahuan dan kemampuan yang dimiliki, sehingga saran dan kritik yang membangun sangat diperlukan penulis. Akhir kata semoga skripsi ini dapat berguna dan bermanfaat bagi ilmu pengetahuan maupun pembaca.
Yogyakarta, Januari 2012
x
xi
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA
ILMIAH UNTUK KEPENTINGAN AKADEMIS vi
PRAKATA vii
BAB II PENELAAHAN PUSTAKA 5
A. Kanker 5
B. Asetogenin 6
C. Sintesis Senyawa Laktogenin 8
D. Uji Pendahuluan 10
1. Pemeriksaan Organoleptis 10
xii
3. Spektrofotometri UV 11
4. Kromatografi Gas 12
E. Elusidasi Struktur Senyawa Hasil Sintesis 13
1. Spektrofotometri Inframerah 13
2. Spektrometri Massa 15
F. Landasan Teori 17
G. Hipotesis 18
BAB III METODE PENELITIAN 19
A. Jenis dan Rancangan Penelitian 19
B. Variabel dan Definisi Operasional 19
C. Bahan Penelitian 20
D. Alat Penelitian 20
E. Tata Cara Penelitian 20
1. Pembuatan Katalis Piridin 21
2. Sintesis Senyawa Laktogenin dalam suasana basa piridin 21
3. Uji Pendahuluan 21
a) Organoleptis 21
b) Uji Kemurnian Menggunakan Kromatografi Lapis Tipis
(KLT) 21
c) Uji Penentuan Panjang Gelombang Maksimum 21
d) Kromatografi Gas 22
4. Elusidasi Struktur Senyawa Hasil Sintesis 22
a) Spektrofotometri Inframerah 22
b) Spektrometri Massa 22
F. Analisis Hasil 23
1. Analisis Pendahuluan 23
2. Pemeriksaan Kemurnian Senyawa Hasil Sintesis 23
3. Elusidasi Struktur 23
BAB IV PEMBAHASAN 24
A. Sintesis senyawa laktogenin 24
B. Analisis Pendahuluan 27
xiii
1. Uji Organoleptis 27
2. Uji Kromatografi Lapis Tipis 28
3. Uji Panjang Gelombang Maksimum 30
C. Elusidasi Struktur Senyawa Hasil Sintesis 33
1. Spektrofotometri Inframerah 33
2. Spektrometri Massa 38
BAB V KESIMPULAN DAN SARAN 45
DAFTAR PUSTAKA 46
xiv
DAFTAR TABEL
Tabel 1. Tabel perbandingan organoleptis antara senyawa hasil sintesis
denganstarting material 27
Tabel 2. Nilai Rf senyawa hasil sintesis dan 2-asetil-γ-butirolakton 29
Tabel 3. Data panjang gelombang maksimal 31
Tabel 4. Perbandingan pita vibrasi gugus senyawa hasil sintesis dengan
literatur 34
Tabel 5. Perbandingan interpretasi spektra inframerah senyawa hasil sintesis
danstarting material 38
xv
DAFTAR GAMBAR
Gambar 1. Strukur umum asetogenin………... 2
Gambar 2. Interaksi antara asetogenin dengan enzim kompleks I (NADH Ubiquinone oksidoreduktase)………. 6
Gambar 3. Analisis diskoneksi senyawa laktogenin……….…... 9
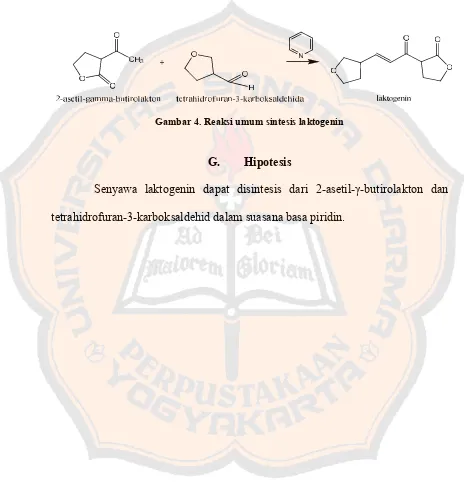
Gambar 4. Reaksi umum sintesis laktogenin………... 18
Gambar 5. Reaksi pembentukan ion enolat dari 2-asetil-γ-butirolakton………. 25
Gambar 6. Reaksi adisi ion enolat pada gugus karbonil dari tetrahidrofuran-3 karboksaldehid……….. 26
Gambar 7. Reaksi pembentukanβ-OH karbonil sebagai senyawa antara……... 26
Gambar 8. Reaksi dehidrasi dari senyawaβ-OH karbonil ………. 26
Gambar 9. Kromatogram KLT senyawa hasil sintesis……… 29
Gambar 10. Spektra UV 2-asetil-γ-butirolakton ……… 31
Gambar 11. Senyawa hasil sintesis dengan gugus kromofor……….. 31
Gambar 12. Spektra UV senyawa hasil sintesis……….. 32
Gambar 13. Spektra Inframerah senyawa hasil sintesis……….. 34
Gambar 14. Spektra Inframerah 2-asetil-γ-butirolakton ……… 36
Gambar 15. Spektra Inframerah tetrahidrofuran-3-karboksaldehid ………….. 37
Gambar 16. Kromatogram GC senyawa hasil sintesis……… 39
Gambar 17. Hasil spektra massa pada waktu retensi 3,151 menit……….. 40
Gambar 18. Hasil spektra massa pada waktu retensi 18,414 menit……… 40
Gambar 19. Mekanisme reaksi pembentukan senyawa (Z) – 3 - (hidroksi (tetra hidrofuran-3-il)metil)-3-(3-(2-oksotetrahidrofuran-3-il)but-2 enoil) dihidro furan-2(3H)-on………... 41
Gambar 20. Usulan mekanisme fragmentasi dari senyawa hasil sintesis……... 43
Gambar 21. Hasil Perhitungan C karbonil pada 2-asetil-γ-butirolakton dengan programMarvin Sketch………... 44
Gambar 22. Hasil Perhitungan C karbonil pada tetrahidrofuran-3-karboksal dehid dengan programMarvin Sketch……….……… 44
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvi
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan mol tetrahidrofuran-3-karboksaldehid ……… 50
Lampiran 2. Perhitungan bahan 2-asetil-γ-butirolakton ………. 50
Lampiran 3. Perhitungan larutan piridin……….. 51
Lampiran 4. Persamaan reaksi………. 51
Lampiran 5. Kromatogram KLT senyawa hasil sintesis ……… 52
Lampiran 6. Perhitungan nilaiRfsenyawa hasil sintesis ……… 53
Lampiran 7. Perhitungan kepolaran fase gerak KLT dan log P senyawa hasil sintesis ………….………..……… 54
Lampiran 8. Kromatogram GC senyawa hasil sintesis ………...……….. 55
Lampiran 9. Kondisisettingalat GC-MS …...……...…………...….. 56
Lampiran 10. Spektra massa senyawa hasil sintesis pada waktu retensi 3,151 menit ………...…………...…... 57
Lampiran 11. Spektra massa senyawa hasil sintesis pada waktu retensi 18,414 menit………...…………... 57
Lampiran 12. Spektra inframerah (IR) senyawa hasil sintesis...…… 58
Lampiran 13. Spektra inframerah (IR) 2-asetil-γ-butirolakton...…… 60
Lampiran 14. Spektra inframerah (IR) tetrahidrofuran-3-karboksaldehid...… 61
Lampiran 15. Hasil perhitungan C karbonil pada 2-asetil-γ-butirolakton menggunakan programMarvin Sketch……….. 62
Lampiran 16. Hasil perhitungan C karbonil pada tetrahidrofuran-3-karboksal dehid menggunakan programMarvin Sketch………... 62
PLAGIAT MERUPAKAN TINDAKAN TIDAK TERPUJI
xvii INTISARI
Telah dilakukan sintesis senyawa laktogenin dengan mereaksikan tetrahidrofuran-3-karboksaldehida 5,53 mmol (1 mL) dan 2-asetil-γ-butirolakton 5,53 mmol (0,5943 mL) melalui reaksi kondensasi aldol silang dalam suasana basa piridina. Analisis hasil sintesis dilakukan dengan uji organoleptis, uji kromatografi lapis tipis (KLT) dengan fase gerak CCl4: etil asetat (4 : 1) dan fase diam silika gel GF254, dan elusidasi struktur dengan spektrofotometri inframerah dan spektrometri massa.
Hasil penelitian menunjukkan bahwa senyawa hasil sintesis berupa larutan berwarna kuning pekat dan berbau menyengat. Uji kromatografi lapis tipis menghasilkan bercak dengan harga Rf senyawa hasil sintesis sebesar 0,380. Elusidasi struktur menggunakan spektra Inframerah dan spektra MS menunjukkan bahwa senyawa laktogenin tidak terbentuk melainkan senyawa hasil reaksi self-condentation antar 2-asetil-γ-butirolakton dan diikuti reaksi dengan tetrahidrofuran-3-karboksaldehid yaitu (Z)-3-(hidroksi(tetrahidrofuran-3-il)metil)-3-(3-(2-oksotetrahidrofuran-3-il)but-2 enoil) dihidrofuran-2(3H)-on dengan persen kemurnian sebesar 10,25% secara kromatografi gas.
Kata kunci: 2-asetil-γ-butirolakton, tetrahidrofuran-3-karboksaldehida, piridin, reaksi kondensasi aldol silang.
xviii ABSTRACT
Synthesis of laktogenin has been carried out by reacting tetrahydrofuran-3-karboksaldehida 5.53 mmol (1 mL) and 2-acetyl-γ-butirolakton 5.53 mmol (0.5943 mL) through cross-aldol condensation reaction in alkali condition of pyridine. Analysis of the results of synthesis is done by organoleptis test, Thin Layer Chromatography (TLC) test with mobile phase CCl4: ethyl acetate (4:1) and stationary phase use silica gel GF254, and structure elucidation by infrared spectrophotometry and mass spectrometry.
The research results showed that the synthetic product was dark yellow and smelly. Thin-layer chromatography test gave spots with Rf value of product by 0,380. Structure Elucidation using spectra IR and MS showed that laktogenin was not formed rather it was by reaction of self condentation between 2-acetyl-γ-butyrolactone and followed by reaction with tetrahydrofuran-3-carboxaldehyd namely (Z)-3-(hydroxyl(tetrahydrofuran-3-yl)methyl)-3-(3-(2-oxotetrahydrofuran-3-yl)but-2-enoil)dihydrofuran-2-(3H)-on with the purity 10,25% by gas chromatography.
Key words: 2-acetyl-γ-butyrolactone, tetrahydrofuran-3-carboxaldehyde, pyridine, cross aldol condensation reaction.
1 BAB I PENDAHULUAN
A. Latar Belakang
Kanker merupakan penyakit mematikan yang ditandai dengan kumpulan
sel abnormal yang terbentuk oleh sel-sel yang tumbuh secara terus-menerus, tidak
terbatas, dan tidak terkoordinasi dengan jaringan sekitarnya dan tidak berfungsi
fisiologis. Kumpulan sel tersebut akan menyebar dan merusak jaringan sekitar
hingga bagian tubuh lainnya. Hal ini sejalan dengan definisi dari American
Cancer Society yang mengatakan bahwa kanker merupakan kelompok penyakit
yang ditandai oleh pertumbuhan dan penyebaran sel abnormal yang tidak
terkendali (Colleenet al., 2006).
Pertumbuhan sel kanker akan menyebabkan jaringan menjadi besar dan
disebut tumor. Tumor merupakan istilah yang dipakai utuk semua pembengkakan
atau benjolan dalam tubuh. Sel kanker yang tumbuh cepat akan menyebar melalui
pembuluh darah dan pembuluh getah bening. Penjalarannya ke jaringan lain
disebut metastasis. Tumor diklasifikasikan sebagai benigna dan maligna. Benigna
yaitu neoplasma yang bersifat jinak dan tidak menyebar ke jaringan sekitarnya.
Sedangkan maligna merupakan tumor yang melakukan metastasis, yaitu menyebar
dan menyerang jaringan lain (Benchimol and Minden, 1998).
Asetogenin yang biasa disebut Annonaceous Acetogenins (ACGs)
merupakan senyawa alam yang berasal dari tanaman golongan Annoaceae (Oasa,
2
dengan jumlah atom C sebanyak 35-37, dan memiliki cincin tetrahidrofuran atau
tetrahidropiran, gugus hidroksil, keton dan epoksi, dan diujung rantai alifatik
terdapat terminalα,β-unsaturated γ-lactone.
Gambar 1. Struktur umum asetogenin (Anonim, 2010)
Efek biologis dari asetogenin yaitu menghambat NADH-ubiquinone
oksidoreduktase pada rantai respirasi sel atau kompleks I mitokondria dari sel
kanker (Villo, 2008; Oasa et al., 2010; Tormo et al.,2001). Hasil penghambatan
tersebut menyebabkan menurunnya produksi ATP dan pada akhirnya sel-sel
kanker akan mengalami apoptosis. Selain itu asetogenin juga memiliki
kemampuan dalam menghambat Multi Drug Resistant (MDR) sel-sel kanker
(Kojima and Tanaka, 2009 ; Yang, Zhang, Zeng, Yu, Ke, Li, 2010). Dua gugus
fungsi yang penting dan memiliki peran penting sebagai anti kanker adalah cincin
tetrahidrofuran danα,β-unsaturated γ-lactone(Tormoet al., 2001).
Dilihat dari bentuk strukturnya yang meruah dan sifat lipofilisitas yang
tinggi dengan log P.8,44, kelarutan asetogenin sangat rendah sehingga susah
diformulasikan dalam bentuk sediaan per oral. Dengan demikian, dilakukan
modifikasi struktur dengan memperpendek rantai alkilnya namun tetap
mempertahankan gugus aktifnya yaitu tetrahidrofuran dan γ-lakton. Laktogenin
3
dengan log P 0.90 sehingga dapat diformulasikan ke dalam bentuk sediaan per
oral. Sediaan dengan jalur pemberian paling menyenangkan, murah, dan paling
aman bagi pasien dan dokter adalah sediaanper oral(Anief, 2007).
Sintesis senyawa laktogenin dilakukan berdasarkan reaksi kondensasi
aldol silang yaitu dengan mereaksikan 2-asetil-γ-butirolakton dan
tetrahidrofuran-3-karboksaldehida dalam suasana basa piridin. Prosesnya meliputi : pembentukan
ion enolat dari 2-asetil-γ-butirolakton, ion enolat bereaksi dengan
tetrahidrofuran-3-karboksaldehida dengan mengadisi pada karbon karbonil untuk membentuk
β-hidroksi karbonil, dan terjadi reaksi dehidrasi dimana β-β-hidroksi karbonil merebut
sebuah proton dari dalam air untuk menghasilkan produk target laktogenin.
Pada sintesis senyawa laktogenin digunakan basa piridin dimana
merupakan suatu basa amina yang lemah. Alasan dipilih basa piridin (pKb 8,75)
karena diharapkan senyawa 2-asetil-γ-butirolakton yang merupakan ester siklik
tidak mudah terhidrolisis dan nukleofilisitas dari C alfa pada
2-asetil-γ-butirolakton semakin meningkat. Menurut Jose´ A et al. (2005) lakton mudah
terhidrolisis oleh basa kuat terutama basa golongan hidroksida. Maka dari itu
diharapkan dengan kondisi seperti itu dapat memberikan hasil akhir berupa
rendemen yang optimal.
4
1. Permasalahan
Apakah senyawa laktogenin dapat disintesis dari
tetrahidrofuran-3-karboksaldehid dan 2-asetil-γ-butirolakton dalam suasana basa piridin?
2. Keaslian Penulisan
Sejauh pengetahuan penulis, penelitian tentang sintesis laktogenin sebagai
senyawa analog asetogenin dalam suasana basa piridin belum pernah dilakukan
sebelumnya. Penelitian sejenis pernah dilakukan oleh Oasa et al., (2010) dengan
judul “Synthesis of Annonacin Isolated fromAnnona densicoma”.
3. Manfaat Penelitian a) Manfaat teoritis
Untuk menambah faedah bagi perkembangan dunia farmasi terkait sintesis
senyawa laktogenin dalam suasana basa piridin.
b) Manfaat metodologis
Untuk memberikan pengetahuan tentang cara sintesis senyawa laktogenin
dengan reaksi kondensasi aldol silang.
c) Manfaat praktis
Untuk memberikan informasi adanya senyawa yang berpotensi sebagai
antikanker.
B. Tujuan Penelitian
Untuk mengetahui sintesis senyawa laktogenin dari
5 BAB II
PENELAAHAN PUSTAKA
A. Kanker
Salah satu penyakit penyebab kematian utama di dunia terutama di
negara berkembang adalah kanker yang merupakan kumpulan sel abnormal yang
terbentuk oleh sel-sel yang tumbuh secara terus-menerus, tidak terbatas, tidak
terkoordinasi dengan jaringan sekitarnya dan tidak berfungsi fisiologis. Kanker
terjadi karena timbul dan berkembang biaknya jaringan sekitarnya (infiltratif)
sambil merusaknya (dekstrutif), dapat menyebar kebagian lain tubuh, dan
umumnya fatal jika dibiarkan (Dalimartha, 2004).
Mutasi pada DNA sel menyebabkan kemungkinan terjadinya neoplasma
sehingga terdapat gangguan pada proses regulasi homeostasis sel. Karsinogenesis
akibat mutasi materi genetik ini menyebabkan pembelahan sel yang tidak
terkontrol dan pembentukan tumor atau neoplasma (Ramalakshmi and
Muthuchelian, 2011).
Pada sel neoplasma terjadi perubahan sifat, sehingga sebagian besar
energi digunakan untuk berkembang biak. Neoplasma atau tumor dapat dibedakan
menjadi dua tipe yaitu benigna dan malignan (Ramalakshmi and Muthuchelian,
2011). Tumor jinak biasanya tidak menginvasi dan tidak menyebar ke jaringan
sekitar sehingga tidak mengancam jiwa kecuali bila ia terletak pada area vital.
Sedangkan tumor ganas dapat menginvasi jaringan lain dan beranak sebar ke
6
mempunyai sifat resisten terhadap apoptosis, tidak sensitif terhadap faktor anti
pertumbuhan.
B. Asetogenin
AnnonaceousAcetogenin(ACGs) merupakan senyawa alam yang berasal
dari tanaman golongan Annoaceae dimana memiliki efek biologis seperti
sitotoksik, antitumor, pestisida, anti-infeksi dan aktivitas antifedant. Asetogenin
merupakan inhibitor yang paling kuat terhadap enzim kompleks I
(NADH-ubiquinone oksireduktase) pada rantai respirasi sel mitokondria. Sebagian besar
asetogenin memiliki sebuah cincin tetrahydropyran (THP) atau tetrahydrofuran
(THF), gugus hidroksil, gugus keto dan gugus epoksi dua sampai tiga ikatan yang
dihubungkan dengan α,β-unsaturated γ-lactone yang menyatu dalam rantai
panjang C-35 atau C-37 (Makabe, 2008; Li et al., 2008; McLaughlin, 2008).
Penelitian sebelumnya dikatakan bahwa dua gugus fungsi yang ada pada
asetogenin yaitu tetrahidrofuran dan gugus lakton memiliki andil paling besar
terhadap penghambatan enzim kompleks I (Tormoet al., 2001).
tetrahidrofuran lakton
Gambar 2. Interaksi antara asetogenin dengan enzim kompleks I (NADH-ubiquinone oksidoreduktase) (Hongda, 2006)
7
Tetrahidrofuran yang diapit oleh gugus hidroksil dipercaya berperan
sebagai jangkar hidrofilik pada permukaan membran sel, sedangkan γ-lakton
berinteraksi langsung dengan sisi target kompleks I dan menuju ke reseptor
melalui difusi lateral (Hongda, 2006).
Mekanisme kerja asetogenin sebagai anti kanker, yaitu :
1. Menghambat atau bahkan menghentikan produksi ATP sehingga
menyebabkan menurunnya persediaan energi, dan akhirnya mengalami
apoptosis (kematian sel yang terprogram). Hal ini menyebabkan berhentinya
tahapan metastasis pada kanker (Alali, Liu, and McLaughlin, 1999).
2. ATP juga diperlukan dalam produksi DNA dan RNA. Maka apabila ATP
tidak diproduksi, maka akan menyebabkan penurunan produksi sel baru
yaitu dengan memblokir proses replikasi sel kanker (Alali, Liu, and
McLaughlin, 1999).
3. Menyebabkan penurunan tingkat angiogenesis, sehingga akan mengurangi
laju pembentukan tumor karena tumor memerlukan banyak pembuluh darah
dimana fungsi pembuluh darah sebagai penyuplai energi untuk membentuk
sel tumor yang baru (Alali, Liu, and McLaughlin, 1999).
4. Menghambat Multi Drug Resistance (MDR) sel-sel kanker, sehingga
mengembalikan sensitivitas terhadap obat kanker, karena inhibitor MDR
dapat memblokir P-glikoprotein (pompa yang memberi perlawanan
obat-obat kanker seperti kemoterapi). Apabila P-glikoprotein tidak dihambat
8
kanker tidak akan mampu membunuh sel kanker (Oberlies, Croy, Harrison,
and McLaughlin, 1997).
C. Sintesis senyawa laktogenin
Senyawa laktogenin merupakan senyawa analog asetogenin yang tetap
memiliki gugus lakton dan tetrahidrofuran pada strukturnya yang diharapkan
mempunyai aktivitas biologis sebagai antikanker dengan menghambat enzim
kompleks I mitokondria. Selain itu senyawa laktogenin memiliki sifat
hidrofilisitas yang lebih tinggi daripada asetogenin dengan log P = 0,90. Dengan
sifat hidrofilisitas yang tinggi berarti memiliki sifat kelarutan yang baik sehingga
akan mudah terdisolusi, terabsorpsi, dan menimbukan efek farmakologi yang
diinginkan.
Sintesis senyawa laktogenin dilakukan berdasarkan reaksi kondensasi
aldol silang, dimana prinsipnya adalah suatu aldehid yang tidak memiliki
hidrogen alfa bila direaksikan dengan suatu aldehid atau keton yang memiliki
hidrogen alfa, maka akan terjadi dimerisasi (Fessenden and Fessenden, 1994).
Starting material yang digunakan 2-asetil-γ-butirolakton sebagai golongan keton
dan tetrahidrofuran-3-karboksaldehida sebagai golongan aldehida dalam suasana
basa piridin.
Dalam suasana basa, hidrogen alfa pada 2-asetil-γ-butirolakton akan
terdeprotonasi membentuk ion enolat yang berperan sebagai nukleofil.
Pembentukan ion enolat akan meningkatkan nukleofilisitas dari C alfa
9
menyerang atom C karbonil dari tetrahidrofuran-3-karboksaldehida yang bersifat
elektrofil. Dari reaksi tersebut akan terbentuk produk senyawa yang mudah
terdehidrasi secara spontan sehingga menghasilkan senyawa laktogenin.
Suatu kondensasi aldol silang dengan karbonil yang mempunyai
hidrogen alfa dapat dilakukan dalam suasana asam maupun basa. Dalam suasana
asam, suatu karbonil akan membentuk enol. Sedangkan dalam suasana basa, ion
OH- akan mengambil hidrogen alfa yang bersifat asam sehingga akan terbentuk ion enolat yang lebih reaktif dan nukleofilik. Oleh karena itu digunakan basa
piridin. Penggunaan basa lemah diharapkan dapat memberikan kondisi optimum
pada proses sintesis yang dapat menjaga agar lakton tidak terhidrolisis
membentuk cincin ester yang terbuka sehingga didapatkan rendemen yang
optimal.
Analisis diskoneksi senyawa laktogenin sebagai berikut :
Gambar 3. Analisis diskoneksi senyawa laktogenin
10
D. Uji Pendahuluan
Uji pendahuluan dilakukan untuk mengetahui karakteristik dari senyawa
hasil sintesis, uji tersebut meliputi :
1. Pemeriksaan organoleptis
Uji organoleptis merupakan uji pendahuluan yang bertujuan untuk
mengetahui sifat fisik dari senyawa hasil sintesis yang meliputi bentuk, warna,
dan bau. Untuk beberapa hal dilengkapi dengan sifat kimia atau fisika
dimaksudkan untuk dijadikan petunjuk dalam pengelolaan peracikan dan
penggunaan. Uji ini merupakan uji yang sangat sederhana, bisa dilakukan tanpa
bantuan alat, dan dilakukan dengan membandingkan antara senyawa hasil sintesis
denganstarting materialyang digunakan (Dirjen POM RI, 1995).
2. Uji kemurnian menggunakan Kromatografi Lapis Tipis (KLT)
Kromatografi Lapis Tipis (KLT) digunakan untuk menguji kemurnian
secara kualitatif dari campuran suatu senyawa untuk pembuktian ada tidaknya
komponen yang dicari atau kemurnian komponen tersebut. Senyawa yang murni
akan memberikan bercak tunggal pada berbagai fase gerak dengan berbagai
tingkat kepolaran dan mempunyai harga Rf yang sama dengan senyawa
standarnya (Gasparic and Churacek, 1978). Nilai Rf diperoleh dari perbandingan
jarak yang ditempuh oleh bercak senyawa yang diidentifikasi dengan jarak yang
ditempuh pelarut (jarak pengembangan) (Gritter, Bobit, and Schwarting, 1991).
Teknik ini sering dilakukan dengan lempeng kaca atau plastik yang
11
lempengan yang dilapisi dengan fase diam dan dielusi dengan fase gerak yang
akan bergerak naik oleh karena daya kapilaritas (Bresnick, 2004).
Fase diam yang digunakan berupa serbuk halus yang berfungsi sebagai
permukaan penyerap atau berfungsi sebagai permukaan penyangga untuk lapisan
zat cair. Fase diam yang biasa digunakan adalah silika gel (asam silika), alumina
(aluminium oksida), selulosa. Sedangkan untuk fase gerak dapat digunakan
berbagai macam pelarut, didasarkan pada pustaka yang ada atau dari hasil
percobaan dengan variasi tingkat kepolaran (Gritter, Bobit, and Schwarting,
1991).
Jika fase diam bersifat polar maka senyawa yang bersifat polar akan
melekat lebih kuat pada lempeng daripada senyawa non polar dikarenakan
interaksi tarik-menarik dipol-dipol. Senyawa non polar kurang melekat pada fase
diam melainkan ikut fase gerak sehingga terelusi lebih cepat. Maka dari itu jarak
tempuh kertas lempengan merupakan cerminan polaritas senyawa (Bresnick,
2004).
Proses kromatografi lapis tipis dapat diubah-ubah dengan memodifikasi
sifat permukaan fase diam atau dengan mengubah polaritas fase gerak yaitu
dengan cara menambahkan fase gerak lain sehingga diperoleh kepolaran yang
tepat untuk memisahkan campuran senyawa (Gritter, Bobit, and Schwarting,
1991).
3. Spektrofotometri Ultraviolet-Visibel
Serapan cahaya oleh molekul dalam daerah spektra ultraviolet dan visibel
12
dari senyawa-senyawa organik berkaitan erat dengan transisi diantara
tingkat-tingkat tenaga elektronik. Transisi-transisi tersebut biasanya antara orbital ikatan
atau orbital pasangan bebas dan orbital non ikatan tak jenuh atau orbital anti
ikatan. Oleh karena itu, serapan radiasi ultraviolet atau visibel sering dikenal
sebagai spektroskopi elektronik (Sastrohamidjodjo, 2001).
Panjang gelombang serapan merupakan ukuran pemisahan tingkat
tenaga dari orbital-orbital suatu molekul. Pemisahan tenaga yang paling tinggi
diperoleh bila elektron-elektron dari ikatan sigma (σ) tereksitasi yang
menimbulkan serapan pada daerah dari 120 hingga 200 nm. Daerah ini dikenal
sebagai daerah ultraviolet vakum dan tidak memberikan keterangan. Diatas 200
nm, eksitasi elektron dari orbital-orbital p, d, dan orbital phi (π) terutama sistem
terkonjugasi dapat diukur dan spektra yang diperoleh memberikan banyak
keterangan. Dalam praktek, spektrofotometri ultraviolet digunakan terbatas pada
sistem-sistem terkonjugasi (Sastrohamidjodjo, 2001).
3. Kromatografi Gas
Kromatografi gas merupakan instrumen analitis yang memberikan
informasi kualitatif dan kuantitatif mengenai komponen dalam sampel. Sampel
akan mengalami proses pemisahan dalam kolom, lalu dideteksi, dan direkam
sebagai pita elusi (Day and Underwood, 1996).
Data kromatografi gas biasanya terdiri atas waktu retensi berbagai
komponen campuran. Waktu retensi diukur mulai dari titik penyuntikan sampai
titik maksimum puncak dan sangat khas untuk senyawa tertentu pada kondisi
13
tertentu data diidentifikasi dengan cara spiking apabila tersedia senyawa
murninya. Senyawa murni ditambahkan ke dalam cuplikan yang diduga
mengandung senyawa yang diinginkan dan dikromatografi. Jika puncak yang
sesuai diperkuat secara simetris pada dua sistem fase diam yang berlainan dan
kepolarannya berbeda, komponen itu mungkin ada (Gritter, Bobit, and
Schwarting, 1991).
E. Elusidasi Struktur Senyawa Hasil Sintesis
Data spektra dapat digunakan untuk memperoleh keterangan tentang
senyawa yang tidak diketahui. Spektra inframerah digunakan untuk
menginterprestasikan ada tidaknya gugus fungsional. Dari spektra resonansi
magnetik inti proton dapat diketahui jumlah, sifat, dan lingkungan hidrogen dalam
molekul. Spektra massa menghasilkan data bobot molekul dan perumusan tentang
tatanan gugus-gugus spesifik dalam molekul. Berbagai data yang berbeda ini dan
digabungkan dengan sifat-sifat kimia dan fisika sangat efektif digunakan untuk
mengindentifikasi dan menentukan struktur senyawa (Sastrohamidjojo, 1994).
1. Spektrofotometri Inframerah
Spektrofotometri inframerah biasanya digunakan untuk mengetahui
gugus fungsional yang terdapat dari suatu senyawa (Bresnick, 2004). Sinar
inframerah mempunyai panjang gelombang yang lebih panjang sehingga
energinya lebih rendah dengan bilangan gelombang antara 600-4000 cm-1 atau sekitar 1,7 x 10-3cm sampai dengan 2,5 x 10-4cm (Sitorus, 2009).
14
Semua ikatan mempunyai frekuensi khas yang membuat ikatan mengulur
dan menekuk. Bila frekuensi energi elektromagnetik inframerah yang dilewatkan
pada suatu molekul sama dengan frekuensi mengulur atau menekuk ikatan, maka
energi tersebut akan diserap. Serapan inilah yang dapat direkam oleh spektrometer
inframerah. Semakin tinggi frekuensi maka semakin besar energi yang
dibutuhkan. Dengan demikian, ikatan yang memerlukan energi yang lebih besar
untuk mengulur dan menekuk akan mempunyai frekuensi serapan yang tinggi
dalam spektroskopi inframerah (Bresnick, 2004).
Setiap jenis ikatan kimia mempunyai frekuensi vibrasi yang berbeda.
Jenis ikatan yang sama juga mempunyai frekuensi vibrasi yang berbeda bila diikat
oleh senyawa yang berlainan. Dengan demikian tidak ada molekul yang berbeda
strukturnya yang mempunyai pola serapan inframerah atau spektra inframerah
yang sama (Fatah, 1998).
Ikatan yang berbeda-beda (C-C, C=C, C≡C, C-O, C=O, O-H, N-H)
mempunyai frekuensi vibrasi yang berbeda-beda dan hal tersebut dapat
mendeteksi adanya ikatan-ikatan tersebut dalam suatu molekul organik, yaitu
dengan cara mendeteksi frekuensi-frekuensi kharakteristiknya sebagai pita
serapan dalam spektrum inframerah (Sastrohamidjojo, 2001).
Semua ikatan kimia memiliki frekuensi khas yang dapat membuat ikatan
mengulir (stretch) atau menekuk (blend). Bila frekuensi energi elektromagnetik
inframerah yang dilewatkan pada suatu molekul sama dengan frekuensi mengulur
atau menekuknya ikatan maka energi tersebut akan diserap. Serapan inilah yang
15
2. Spektroskopi Massa
Spektroskopi massa merupakan teknik yang digunakan untuk mengetahui
berat molekul suatu senyawa. Untuk mendapatkan informasi yang mungkin
mengenai struktur suatu senyawa dapat dilakukan dengan mengukur bobot
molekul dari fragmen-fragmen ketika molekul mengalami pemecahan (Mc.Murry,
2008).
Ada beberapa teknik yang dapat digunakan untuk menghasilkan ion
molekul yaitu : ionisasi dengan electron impact (EI), chemical ionization (CI),
field desorption (FD), fast atom bombardment (FAB), electrospray ionization
(ESI), dan matrix assisted loaser desorption ionization (MALDI). Dari beberapa
teknik tersebut yang paling umum digunakan adalah teknik EI, yaitu dengan
menembakkan berkas elektron pada suatu molekul organik menghasilkan ion
molekul bermuatan positif yang dapat pecah menjadi ion-ion yang lebih kecil
(Siverstein and Webster, 1998).
Dalam spektrometri massa, molekul-molekul organik ditembak dengan
elektron berenergi tinggi. Penembakan elektron pada suatu molekul menyebabkan
pelepasan elektron dan terbentuk ion molekul. Energi yang dibutuhkan untuk
penembakan dapat divariasikan, namun umumnya digunakan 70 eV. Pemecahan
molekul degan elektron berkekuatan 7-15 eV tidak menghasilkan
pecahan-pecahan molekul yang dapat diidentifikasi, sedangkan dengan elektron diatas 70
eV akan dihasilkan fragmen yang sulit diidentifikasi, karena masa relatif
16
spesies yang kehilangan satu elektron sehingga bermuatan positif parsial (Bruice,
1998).
Spektra massa adalah grafik antara kelimpahan relatif fragmen
bermuatan positif lawan perbandingan massa/muatan (m/z). Muatan ion dari
kebanyakan partikel yang terdeteksi dalam spektra massa adalah +1. Nilai m/z ion
semacam ini sama dengan massanya. Dari segi praktis, spektra massa adalah
rekaman dari massa partikel lawan kelimpahan relatif partikel tersebut (Fessenden
dan Fessenden, 1986).
Tabrakan antara sebuah molekul organik dengan salah satu elektron
berenergi tinggi yang menyebabkan lepasnya sebuah elektron dari molekul
tersebut akan membentuk ion molekul. Ion molekul yang dihasilkan dari
penembakan elektron berenergi tinggi ini tidak stabil dan pecah menjadi fragmen
kecil baik berbentuk radikal bebas, ion positif dan ion negatif. Dalam sebuah
spektroskopi massa, hanya fragmen bermuatan positif yang akan dideteksi.
Suatu molekul atau ion pecah menjadi fragmen-fragmen bergantung pada
kerangka karbon dan gugus fungsional yang ada. Oleh karena itu, struktur dan
massa fragmen memberikan petunjuk mengenai struktur molekul induknya
(Fessenden dan Fessenden, 1986).
Suatu zat analit yang dianalisis dengan EI akan bermuatan positif dengan
kehilangan satu elektron. Jika terdapat atom yang elektronegatif dalam struktur
molekul zat analit seperti atom nitrogen, oksigen atau sulfur, muatan positif ini
17
elektronegatif dalam struktur molekul zat analit makan muatan ini sulit untuk
ditentukan secara pasti letaknya (Watson, 2003).
Proses terjadinya fragmentasi adalah sebagai berikut :
1. Pemutusan ikatan secara homolitik diawali dengan adanya heteroatom seperti
nitrogen, oksigen, atau sulfur.Base peak atau peak dasar biasa diberikan oleh
molekul yang mengandung heteroatom.
2. Satu elektron dalam ikatan akan terpisah, suatu radikal akan dibentuk.
Elektron satunya lagi akan bergabung dengan elektron tanpa berpasangan dari
heteroatom, maka akan terbentuk ikatan rangkap ; heteroatom ini akan
bermuatan positif.
3. Kehilangan molekul radikal terbesar adalah yang paling disukai dalam
fragmentasi (Watson, 2003).
F. Landasan Teori
Reaksi kondensasi aldol silang merupakan reaksi antara senyawa
karbonil dengan sedikitnya satu hidrogen α dengan senyawa karbonil lain yang
tidak memiliki hidrogen αdalam suasana basa. Dengan starting material
2-asetil-γ-butirolakton yang memiliki hidrogen α dan tetrahidrofuran-3-karboksaldehida
yang tidak mempunyai hidrogen α dalam suasana basa lemah piridin sehingga
senyawa laktogenin dapat dibuat dengan reaksi kondensasi aldol silang.
Basa piridin yang memiliki pasangan elektron bebas pada atom nitrogen
akan mengambil hidrogen alfa yang bersifat asam dan akan terbentuk ion enolat.
18
butirolakton dan beresonansi membentuk karbanion yang kemudian menyerang
atom C karbonil dari tetrahidrofuran-3-karboksaldehid sehingga laktogenin dapat
dihasilkan.
Gambar 4. Reaksi umum sintesis laktogenin
G. Hipotesis
Senyawa laktogenin dapat disintesis dari 2-asetil-γ-butirolakton dan
tetrahidrofuran-3-karboksaldehid dalam suasana basa piridin.
19
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental deskriptif
non-analitik. Pada penelitian ini tidak ada perlakuan pada subjek uji dan hanya
dipaparkan fenomena yang terjadi yang tidak terdapat hubungan sebab akibat.
B. Variabel dan Definisi Operasional
1. Variabel
a) Variabel bebas dalam penelitian ini adalah perbandingan mol padastarting
materialyang digunakan.
b) Variabel tergantung dalam penelitian ini adalah jumlah rendemen senyawa
laktogenin karena merupakan obyek yang kehadirannya akibat reaksi
antara 2-asetil-γ-butirolakton dan tetrahidrofuran-3-karboksaldehid.
c) Variabel pengganggu terkendali pada penelitian ini adalah suhu
pencampuran dan kondisi peralatan.
2. Definisi Operasional
a) Starting material adalah senyawa awal yang digunakan dalam proses
sintesis dengan tujuan untuk mendapatkan senyawa hasil sintesis. Starting
material yang digunakan dalam penelitian ini adalah
2-asetil-γ-butirolakton dan tetrahidrofuran-3-karboksaldehid.
20
b) Senyawa target adalah senyawa yang diharapkan terbentuk dari reaksi.
Senyawa target yang diharapkan terbentuk adalah senyawa
3-(3-(tetrahidrofuran-3-il)akriloil)dihidrofuran-2(3H)-on yang bisa disebut
senyawa laktogenin.
C. Bahan Penelitian
2-asetil-γ-butirolakton (for synthesis, Merck),
tetrahidrofuran-3-karboksaldehid (for synthesis,Sigma-aldrich), piridin (p.a.,Merck), metanol (p.a.,
Merck), aquadest.
D. Alat Penelitian
Pendingin Alihn, pemanas listrik (Herdolph MR 2002), pengering
(Memmert Oven Model 400), neraca analitik (Mextler PM 100), seperangkat alat
gelas, klem, statif, termometer, corong Buchner, kromatografi gas-spektrometer
massa (Shimadzu QP 2010 SE), spektrometer IR (IR Shimadzu Prestige-21),
lampu UV254nm, mikropipet, baskom, kertas saring.
E. Tata Cara Penelitian
1. Pembuatan piridin
Piridin sebanyak 0,476 mL dilarutkan dengan aquadest 10 mL hingga
larut, lalu dimasukkan ke dalam labu takar 25 mL. Tambahkan aquadest hingga
batas tanda.
21
2. Sintesis senyawa laktogenin dalam suasana basa piridin
2-asetil-γ-butirolakton 5,53 mmol (0,5943 mL) dimasukkan ke dalam
labu erlenmeyer. Piridin sebanyak 25 mL (5,53 mmol) ditambahkan dalam larutan
tersebut. Tetrahidrofuran-3-karboksaldehid 5,53 mmol (1 mL) ditambahkan ke
dalam campuran tetes demi tetes. Campuran senyawa tersebut direfluks selama 3
jam dengan suhu 80-90˚C.
3. Uji Pendahuluan
a. Organoleptis
Senyawa hasil sintesis diamati sifat-sifat fisiknya, meliputi bentuk,
warna, dan bau. Kemudian hasil pengamatan dibandingkan dengan starting
material yang digunakan dalam penelitian yaitu 2-asetil-γ-butirolakton dan
tetrahidrofuran-3-karboksaldehid.
b. Uji kemurnian menggunakan Kromatografi Lapis Tipis (KLT)
Masing-masing larutan tersebut ditotolkan sebanyak 1,0 μL dengan
menggunakan mikropipet pada lempeng silika gel GF254 yang sudah diaktifkan
pada suhu 1000C selama 30 menit. Pengembangan dilakukan dengan fase gerak
CCl4: etil asetat (4:1) dan jarak rambat 15 cm.
c. Uji penentuan panjang gelombang maksimum
Senyawa hasil sintesis dan masing-masing starting material sebanyak 1
mL 0,001% (v/v) dilarutkan dalam metanol lalu di masukkan ke dalam kuvet.
Larutan tersebut discanpada rentang panjang gelombang 190-380nm. Ditentukan
panjang gelombang maksimumnya pada area peak dengan absorbansi tertinggi
22
starting material dibandingkan dan dilihat perbedaannya dari profil spektra dan
panjang gelombang maksimum yang dihasilkan.
d. Kromatografi Gas (GC)
Pemeriksaan kemurnian senyawa hasil sintesis dilakukan dengan
kromatografi gas dengan kondisi alat: suhu injektor 310°C, jenis kolom Rastek
Rxi-5MS, panjang kolom 30 meter, suhu kolom diprogram 80°C, gas pembawa
helium, tekanan 16,5 kPa, kecepatan alir fase gerak 0,5 ml/menit, dan detektor
ionisasi nyala. Cuplikan senyawa hasil sintesis dilarutkan dalam kloroform,
kemudian diinjeksikan ke dalam injektor pada alat kromatografi gas. Aliran gas
dari gas pengangkut helium akan membawa cuplikan yang sudah diuapkan masuk
kedalam kolom RXi-5MS yang dilapisi fase cair dimetilpolisiloksan. Selanjutnya
cuplikan diukur oleh detektor hingga diperoleh suatu kromatogram.
4. Elusidasi struktur senyawa hasil sintesis
a. Spektrofotometri inframerah
Senyawa yang berwujud cairan ditempatkan dalam film tipis di antara
dua lapis NaCl yang transparan terhadap inframerah. Cahaya inframerah dari
sumber dilewatkan melalui cuplikan, kemudian dipecah menjadi
frekuensi-frekuensi individunya dalam monokromator dan intensitas relatif dari frekuensi-frekuensi
individu diukur oleh detektor hingga didapat spektra inframerah dari senyawa
yang bersangkutan. Bilangan gelombang yang digunakan 400-4000 nm.
b. Spektrometri massa
Uap cuplikan senyawa hasil sintesis yang keluar dari kolom kromatografi
23
dengan seberkas elektron hingga terfragmentasi. Jenis pengionan yang digunakan
adalah EI (Electron Impact) 70 eV. Fragmen-fragmen akan melewati lempeng
mempercepat ion dan didorong menuju tabung analisator, dimana partikel-partikel
akan dibelokkan dalam medan magnet dan menimbulkan arus pada kolektor yang
sebanding dengan kelimpahan relatif setiap fragmennya. Kelimpahan relatif setiap
fragmen akan dicatat dan menghasilkan data spektra massa.
F. Analisis Hasil
1. Analisis Pendahuluan
Analisis pendahuluan senyawa hasil sintesis berdasarkan data organoleptis
dan spektra UV.
2. Pemeriksaan Kemurnian Senyawa Hasil Sintesis
Pemeriksaan kemurnian senyawa hasil sintesis berdasarkan data
kromatografi lapis tipis (KLT) dan kromatografi gas.
3. Elusidasi Struktur
Elusidasi struktur senyawa hasil sintesis berdasarkan data spektra
inframerah (IR) dan spektra massa (MS).
24
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis senyawa laktogenin
Sintesis senyawa laktogenin dengan nama IUPAC
3-(3-(Tetrahidrofuran-3-il)akriloil)dihidrofuran-2(3H)-on dapat dilakukan dengan mereaksikan
tetrahidrofuran-3-karboksaldehida dan 2-asetil-γ-butirolakton melalui reaksi
kondensasi aldol silang. 2-asetil-γ-butirolakton merupakan suatu senyawaan keton
yang mempunyai hidrogenalfa (H-alfa) yaitu hidrogen yang terikat pada karbon
posisialfadimana bersifat asam sehingga dengan adanya suatu basa maka H-alfa
akan tertarik pada basa dan akan terbentuk suatu ion enolat atau karbon alfa
bermuatan parsial negatif. Dan karena adanya resonansi, ion enolat yang terbentuk
relatif stabil. Dengan adanya pemanasan dengan waktu tertentu, maka
pembentukan ion enolat menjadi optimal.
Tetrahidrofuran-3-karboksaldehida merupakan suatu senyawaan aldehida
yang bertindak sebagai elektrofil. Ion enolat yang terbentuk merupakan suatu
nukleofil yang baik, sehingga akan menyerang elektrofil yaitu gugus karbonil
pada tetrahidrofuran-3-karboksaldehida yang bermuatan parsial positif akibat
adanya penarikan elektron ikatan π oleh atom oksigen yang lebih elektronegatif
daripada atom karbon, sehingga membentukintermediet β-hidroksi karbonil yang
mudah terdehidrasi membentuk senyawa laktogenin.
Tahapan pertama kali yang dilakukan adalah pembentukan ion enolat
25
Penggunaan basa lemah piridina yang diberikan secara tetes demi tetes untuk
mencegah terbukanya cincin ester dari 2-asetil-γ-butirolakton yang dapat
menyebabkan terbentuknya produk samping.
Gambar 5. Reaksi pembentukan ion enolat dari 2-asetil-γ-butirolakton
Ketika salah satu H-alfa terikat pada basa piridin maka akan terjadi ion
enolat yang berada dalam kondisi resonansi. Dari struktur resonansi, muatan
negatif diemban oleh oksigen karbonil dan karbonalfa, namun ion enolat dengan
karbon alfa yang bermuatan parsial negatif lebih reaktif sehingga ion tersebut
yang akan menyerang gugus karbonil dari tetrahidrofuran-3-karboksaldehid.
Karbon alfa tersebut memiliki orbital yang terisi penuh sehingga lebih mudah
untuk mendonorkan elektronnya. Beda halnya dengan atom O, elektron yang
berlebih akan digunakan untuk mengisi orbitalnya yang kosong sehingga sukar
untuk mendonorkan elektronnya.
Setelah ion enolat terbentuk, kemudian direaksikan dengan
tetrahidrofuran-3-karboksaldehida dengan tujuan untuk membentuk senyawa
β-OH-karbonil. Pemberian tetrahidrofuran-3-karboksaldehid di akhir dan secara
tetes demi tetes bertujuan agar piridina yang bersifat basa tidak akan menyerang
H-α dari tetrahidrofuran-3-karboksaldehid. Kemudian campuran larutan direfluks
selama tiga jam. Pada proses refluks, uap dari starting material akan
26
sehingga kestabilan termodinamika dari sistem terjaga dan maka dari itu dapat
menjaga kesempurnaan proses reaksi.
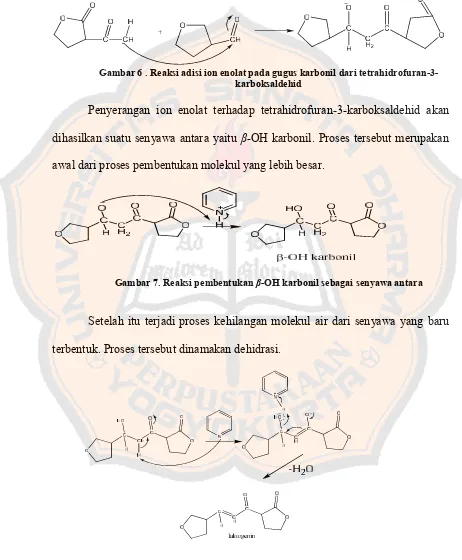
Gambar 6 . Reaksi adisi ion enolat pada gugus karbonil dari tetrahidrofuran-3-karboksaldehid
Penyerangan ion enolat terhadap tetrahidrofuran-3-karboksaldehid akan
dihasilkan suatu senyawa antara yaitu β-OH karbonil. Proses tersebut merupakan
awal dari proses pembentukan molekul yang lebih besar.
Gambar 7. Reaksi pembentukanβ-OH karbonil sebagai senyawa antara
Setelah itu terjadi proses kehilangan molekul air dari senyawa yang baru
terbentuk. Proses tersebut dinamakan dehidrasi.
Gambar 8. Reaksi dehidrasi dari senyawaβ-OH karbonil
27
Setelah direfluks selama tiga jam, dilakukan pengecekan pH larutan, dan
didapatkan pH sebesar enam untuk larutan hasil sintesis replikasi satu dan
replikasi dua. Selanjutnya dilakukan uji organoleptis, uji pendahuluan berupa uji
kromatografi lapis tipis, spektrofotometri ultraviolet, kromatografi gas, dan
elusidasi struktur dengan IR dan MS.
B. Analisis Pendahuluan
1. Uji Oganoleptis
Hasil pemeriksaan organoleptis yang meliputi warna, bentuk, dan bau dari
senyawa hasil sintesis dibandingkan dengan starting material, yaitu
tetrahidrofuran-3-karboksaldehida dan 2-asetil-γ-butirolakton ditunjukkan pada
tabel I.
Tabel I. Perbandingan organoleptis antara senyawa hasil sintesis denganstarting material Bau Menyengat Tidak berbau Tidak berbau
Dari hasil pemeriksaan organoleptis di atas, dapat disimpulkan telah
terbentuk senyawa baru, hal ini dapat dilihat dari warna dan bau yang berbeda
antara senyawa hasil sintesis denganstarting material.
28
2. Uji Kromatografi Lapis Tipis (KLT)
Tujuan dilakukan uji kromatografi lapis tipis (KLT) adalah untuk melihat
kemurnian senyawa hasil sintesis dan untuk mengindentifikasi Rf senyawa hasil
sintesis. Parameter untuk uji ini adalah harga Rf yang dibandingkan antara Rf
starting materialdenganRf senyawa hasil sintesis.
Uji KLT menggunakan fase diam silika gel GF254nm dan fase gerak CCl4
: etil asetat (4:1). Sebagai pembanding digunakan starting material
2-asetil-γ-butirolakton dengan jarak pengelusian 15 cm. Hasil bercak diamati di bawah sinar
UV karena pada cahaya tampak (visible) bercak yang dihasilkan tidak terlihat oleh
mata.
Fase diam berupa silika gel GF254 yang digunakan mengandung CaSO4
yang berfungsi untuk melekatkan silika pada lempeng dan mengandung indikator
yang dapat berfluorosensi pada panjang gelombang 254 nm sehingga
memudahkan untuk mendeteksi adanya peredaman pada bercak. Peredaman
terjadi karena starting material 2-asetil-γ-butirolakton dan senyawa hasil sintesis
memiliki gugus kromofor. Sinar UV akan diabsorpsi oleh gugus kromofor dari
kedua senyawa tersebut, senyawa hasil sintesis dan 2-asetil-γ-butirolakton.
Fase gerak yang digunakan adalah CCl4 : etil asetat (4:1) dengan indeks
polaritas (IP) 2,16. Fase gerak tersebut didapatkan dari hasil optimasi pemilihan
29
A= 2-asetil-γ-butirolakton
B= senyawa hasil sintesis replikasi 1 C= senyawa hasil sintesis replikasi 2
Gambar 9. Kromatogram KLT senyawa hasil sintesis
Tabel II. NilaiRf senyawa hasil sintesis dan 2-asetil-γ-butirolakton
Bercak Senyawa Rf
Dari hasil kromatogram tersebut, dapat dilihat bahwa setelah dilakukan
penotolan dan dielusi di dalam chamber yang telah jenuh dengan uap fase gerak
dihasilkan bercak tunggal. Selain itu didapat harga Rf yang berbeda antara
2-asetil-γ-butirolakton dengan senyawa hasil sintesis. Untuk senyawa hasil sintesis
replikasi satu dan dua memiliki harga Rf yang hampir sama menunjukan bahwa
hasil sintesisreproducible.
Perbedaan nilai faktor retensi disebabkan adanya perbedaan afinitas
30
sintesis. Interaksi silika sebagai fase diam dengan 2-asetil-γ-butirolakton dan
senyawa hasil sintesis adalah interaksi hidrogen yang terbentuk karena pada silika
terdapat gugus –OH dimana atom hidrogen mudah untuk berinteraksi dengan
atom oksigen yang memiliki pasangan elektron bebas. Interaksi hidrogen yang
terjadi antara senyawa hasil sintesis lebih banyak dibandingkan dengan
2-asetil-γ-butirolakton, sehingga afinitas senyawa hasil sintesis terhadap fase diam lebih
besar daripadastarting material-nya.
Perbedaan Rf antara 2-asetil-γ-butirolakton dan senyawa hasil sintesis
menunjukkan bahwa antara keduanya memiliki struktur yang berbeda. Namun
hasil kromatografi lapis tipis tersebut tidak dapat dijadikan tolak ukur bahwa
dengan harga Rf berbeda, telah terbentuk senyawa laktogenin. Selain itu dengan
dihasilkan bercak tunggal belum dapat dipastikan bahwa senyawa yang ditotolkan
merupakan senyawa murni atau tidak, maka perlu dilakukan uji selanjutnya. Hasil
uji ini hanya sebagai hasil kualitatif bahwa telah terbentuk senyawa baru yang
berbeda daristarting material-nya.
3. Uji Penentuan Panjang Gelombang Maksimum
Tujuan dilakukan uji pendahuluan menggunakan spektrofotometri
ultraviolet adalah untuk mengetahui panjang gelombang maksimal (λ maks) dari
starting material dan senyawa hasil sintesis, yang kemudian dibandingkan
panjang gelombang maksimal senyawa hasil sintesis dengan panjang gelombang
maksimal starting material. Pengecekan dilakukan pada panjang gelombang
daerah UV (200-380 nm).
31
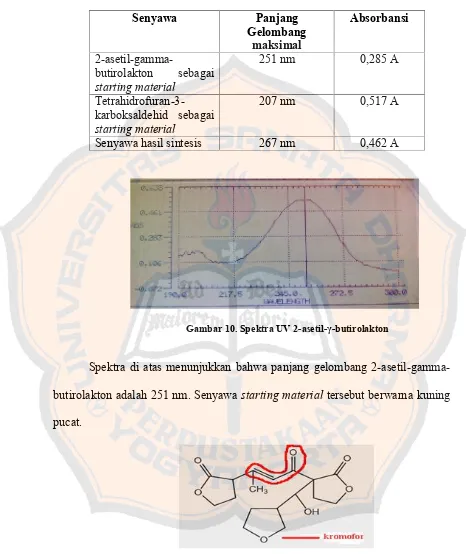
Tabel III. Data panjang gelombang maksimal
Senyawa Panjang
Gelombang maksimal
Absorbansi
2-asetil-gamma-butirolakton sebagai starting material
251 nm 0,285 A
Tetrahidrofuran-3-karboksaldehid sebagai starting material
207 nm 0,517 A
Senyawa hasil sintesis 267 nm 0,462 A
Gambar 10. Spektra UV 2-asetil-γ-butirolakton
Spektra di atas menunjukkan bahwa panjang gelombang
2-asetil-gamma-butirolakton adalah 251 nm. Senyawa starting material tersebut berwarna kuning
pucat.
32
Dilihat dari struktur perkiraan senyawa hasil sintesis yakni (Z) – 3
-(hidroksi (tetrahidrofuran-3-il)metil)-3-(3-(2-oksotetrahidrofuran-3-il)but-2 enoil)
dihidro furan-2(3H)-on mempunyai gugus kromofor. Gugus kromofor merupakan
suatu gugus yang mampu menyerap sinar UV-VIS. Dalam orbital molekul,
elektron-elektron π mengalami delokalisasi dengan adanya ikatan terkonjugasi.
Adanya efek delokalisasi ini akan menyebabkan penurunan tingkat energi π*
sehingga untuk melakukan transisi π → π* membutuhkan energi yang lebih kecil.
Energi yang dibutuhkan untuk melakukan transisi elektronik berkaitan dengan
panjang gelombang, berdasarkan persamaan :
E
=E = energi dari foton (erg)
h = konstanta Planck
Persamaan ini menunjukkan semakin kecil energi maka akan semakin
besar panjang gelombang yang diserap.
Gambar 12. Spektra UV senyawa hasil sintesis
33
Senyawa hasil sintesis menyerap pada panjang gelombang 267 nm
sehingga warna yang terlihat adalah warna kuning pekat menuju orange. Hal ini
dikarenanakan memiliki gugus kromofor.
Dari hasil panjang gelombang dan profil spektra UV, dapat diambil
kesimpulan sementara bahwa senyawa hasil sintesis telah berbeda dari starting
material-nya, karena panjang gelombang antarastarting materialdengan senyawa
hasil sintesis berbeda. Namun kesimpulan tersebut hanya bersifat kualitatif
sehingga butuh pengujian selanjutnya untuk memperkuat kesimpulan yang
diambil.
C. Elusidasi Struktur Senyawa Hasil Sintesis
Elusidasi struktur senyawa hasil sintesis dilakukan dengan spektroskopi
infrared(IR) dan spektroskopi massa (MS).
1. Spektrofotometriinfrared
Spektroskopi IR dapat digunakan untuk mengindentifikasi keberadaan
gugus-gugus fungsional yang terdapat pada senyawa hasil sintesis. Gambar 13,
14, dan 15 menunjukan hasil spektra IR dari senyawa hasil sintesis dan starting
material. Data interprestasi kromatogram senyawa hasil sintesis dan starting
materialditunjukkan pada tabel V.
34
Gambar 13. Spektra Inframerah senyawa hasil sintesis
Dari hasil analisis spektra IR senyawa hasil sintesis, didapatkan enam
profil pita reprensentatif yang menunjukkan gugus-gugus fungsional yang
terdapat pada senyawa hasil sintesis.
Tabel IV. Perbandingan pita vibrasi gugus senyawa hasil sintesis dengan literatur
No
Pita vibrasi Intensitas
Bilangan gelombang (cm-1) Literatur
35
Pita B merupakan pita vibrasi dengan itensitas kuat pada 1643,35 cm-1
yang menunjukkan adanya gugus karbonil. Dan pita vibrasi ulur dengan intensitas
sedang pada 1550,77 cm-1 (pita C) menunjukkan adanya gugus C=C aromatik.
Pita C diperkuat dengan adanya pita D yang merupakan pita overtonedari pita C
dengan intensitas sedang pada bilangan gelombang 1018,41 cm-1. Gugus ester
yang terdiri dari gugus C-O terlihat pada pita E dan F dengan bilangan gelombang
1219,01 dan 1172,72 cm-1yang memiliki intensitas lemah. Dari data-data tersebut
terlihat bahwa senyawa hasil sintesis memiliki gugus fungsional seperti yang
diharapkan. Namun, pada hasil spektra IR tersebut terdapat dua pita vibrasi, yaitu
pita A dan G, yang menunjukkan bahwa adanya gugus –OH pada bilangan
gelombang 3055,24 cm-1 dengan intensitas sedang dan pita yang melebar, dan
gugus metil (-CH3 bending) pada bilangan gelombang 1381,03 cm-1 dengan
intensitas sedang. Hal ini menunjukkan bahwa telah terjadi reaksi
self-condensation antar senyawa 2-asetil-γ –butirolakton dan diikuti reaksi dengan
tetrahidrofuran-3-karboksaldehid karena gugus metil dan gugus hidroksi
merupakan dua gugus yang ada pada produk hasil reaksi tersebut.
Pada penelitian ini digunakan pembanding 2-asetil-γ-butirolakton dan
tetrahidrofuran-3-karbosaldehid sebagai starting material. Hal ini dilakukan
dengan tujuan untuk memastikan bahwa senyawa hasil sintesis memiliki
gugus-gugus fungsional yang berbeda daristarting material-nya.
36
Gambar 14. Spektra Inframerah 2-asetil-γ-butirolakton
Pada spektra IR di atas, terdapat lima buah pita yang mempresentasikan
gugus fungsi dari 2-asetil-γ-butirolakton. Pita C dan D menunjukkan adanya
ikatan C=O yang khas pada gugus ester dan lakton, yang ditunjukkan pada
bilangan gelombang 1776,80 dan 1712,79 cm-1. Lalu pada pita E pada bilangan
gelombang 1026,13 cm-1dengan intensitas kuat menunjukkan adanya gugus C-O
ester. Sedangkan untuk pita A dan B pada bilangan gelombang 2993,52 dan
37
Gambar 15. Spektra inframerah tetrahidrofuran-3-karboksaldehid
Sedangkan untuk spektra IR diatas memperlihatkan empat pita yang
menginterpretasikan adanya gugus fungsi pada senyawa
tetrahidrofuran-3-karboksaldehid. Pada pita A dan B dengan bilangan gelombang 2978,09 dan
2885,51 cm-1 dan intensitas sedang menunjukkan adanya gugus C-H alkana
alifatik. Gugus C=O aldehid ditunjukkan pada bilangan gelombang 1712,19 cm-1
dengan intensitas kuat. Lalu pada pita D menunjukkan adanya gugus C-O dengan
38
Tabel V. Perbandingan interpretasi spektra IR senyawa hasil sintesis danstarting material
Berdasarkan tabel di atas, terdapat perbedaan gugus fungsi pada senyawa
hasil sintesis dan starting material. Adanya ikatan C=C, C=O yang terkonjugasi
pada suatu alkena dan gugus OH pada senyawa hasil sintesis yang tidak dimiliki
oleh kedua starting material.
Akan tetapi, hasil interpretasi spektra IR tersebut belum merupakan suatu
pegangan yang kuat untuk menyatakan bahwa senyawa yang dihasilkan dari hasil
sintesis merupakan senyawa yang diinginkan. Maka dari itu, untuk lebih
menyakinkan dan memastikan lagi, dibutuhkan data spektra MS yang dapat
mendukung hasil akhir tersebut.
2. Spektrometri massa
Pengujian senyawa hasil sintesis dengan alat kombinasi antara
39
memisahkan kemungkinan adanya senyawa pengotor atau senyawa yang tak
diinginkan dengan senyawa hasil sintesis. Proses elusi akan terjadi pada saat
sampel dideteksi dengan kromatografi gas. Kemudian hasil dari elusi ini akan
dideteksi oleh spektrometri massa dan dihasilkan spektra senyawa hasil sintesis.
Dengan adanya proses pemisahan terlebih dahulu, diharapkan spektra massa yang
muncul benar-benar spektra milik senyawa hasil sintesis.
Spektra massa yang diperoleh dapat digunakan untuk menentukan bobot
molekul senyawa hasil sintesis. Spektra massa juga dapat dimanfaatkan untuk
penyelidikan kerangka molekul senyawa hasil sintesis melalui interpretasi
fragmen-fragmennya.
Dari hasil pengujian dengan alat GC-MS didapatkan data kromatogram
GC dan spektra MS. Kromatogram GC senyawa hasil sintesis ditunjukkan pada
gambar 16, sedangkan gambar 17 menunjukkan spektra MS senyawa hasil
sintesis.
Gambar 16. Kromatogram GC senyawa hasil sintesis
Senyawa hasil sintesis menghasilkan sepuluh peak dengan waktu retensi
40
murni dan tidak hanya mengandung senyawa yang diinginkan, tetapi juga
mengandung senyawa lain yang mungkin berasal dari reaksi samping.
Dari gambar kromatogram GC di atas, peak dengan Area Under Curve
(AUC) terbesar, yaitu 39269839 ada pada waktu retensi 3,151 menit (peaknomor
3), diikuti denganpeaknomor 7 dengan waktu retensi 18,414 dan AUC 3143029.
Gambar 17. Hasil spektra massa pada waktu retensi 3,151 menit
Peak dengan retensi 3,151 menit memiliki ion molekul dengan m/z = 79,
dimana m/z tersebut sesuai dengan bobot molekul piridina. Hal ini menunjukkan
bahwa setelah selesai bereaksi, piridina terbentuk kembali.
Gambar 18. Hasil spektra massa pada waktu retensi 18,414 menit
Pada gambar 18 menunjukan spektra MS dengan waktu retensi 18,414
menit memiliki ion molekul dengan m/z = 337, oleh karena itu senyawa ini
41
10,25%. Peak tersebut menunjukkan bahwa telah terjadi reaksi self-condensation
antar senyawa 2-asetil-γ –butirolakton dan diikuti reaksi dengan
tetrahidrofuran-3-karboksaldehid. Perkiraan struktur senyawa hasil proses self-condentationseperti
pada gambar 11.
Gambar 19 . Mekanisme reaksi pembentukan (Z)-3-(hidroksi(tetrahidrofuran-3-il)metil)-3-(3-(2-oksotetrahidrofuran-3-il)but-2 enoil)dihidrofuran-2(3H)-on
Dari gambar spektra MS tersebut terdapat beberapa nilai m/z dengan
intensitas yang bervariasi. Dalam spektrometer massa, fragmen-fragmen yang
akan terdeteksi hanya fragmen yang bermuatan positif, sedangkan fragmen
dengan muatan netral atau radikal tidak akan terdeteksi.
42
Peak A dengan m/z 152 merupakan fragmen dari ion molekul yang
mengalami pelepasan ion C9H13O4• sehingga menghasilkan ion C8H8O3.
selanjutnya peak B berasal dari fragmen ion molekul C8H8O3 yang mengalami
pelepasan molekul C2H4O sehingga ion C7H9O2+ terbentuk. Ion tersebut muncul
pada m/z 125.
Ion C4H5O2+ merupakan ion hasil fragmentasi dari ion C7H9O2+ dengan
melepaskan molekul C4H8 mempunyai m/z sebesar 85 (peak C). Kemudian ion
C4H5O2+ akan melepaskan molekul C2H3O sehingga menghasilkan ion C3H5O+
yang tampak sebagai peak D dengan m/z 57. Ion C3H5O+ yang terbentuk
mengalami fragmentasi kembali menjadi ion C3H5+ dengan melepaskan molekul
CH5O. Ion tersebut memiliki m/z 41 (peak E) yang merupakan ion dengan
kelimpahan yang paling besar dan yang paling stabil. Fragmen-fragmen dengan
intensitas 100 % merupakan ion yang paling stabil dan biasa disebut base peak.
Lalu fragmen dengan m/z 28 (peak F) merupakan fragmen dari ion C2H3+ yang
melepaskan molekul C2H6.
43
Keterangan tesebut dapat dilihat dari gambar mekanisme fragmentasi
berikut ini :
Gambar 20. Usulan mekanisme fragmentasi dari senyawa hasil sintesis
Senyawa (Z)3( hidroksi ( tetrahidrofuran 3il) metil ) – 3 ( 3 ( 2
-oksotetrahidrofuran – 3 - il ) but-2 enoil) dihidrofuran -2(3H)-on terbentuk karena
terjadinya reaksi self-condentation antar senyawa 2-asetil-γ-butirolakton. Dapat
44
terdapat sisi elektrofil pada atom C karbonilnya. Menurut analisis menggunakan
program Marvin sketch, elektrofil pada C karbonil dari 2-asetil-γ-butirolakton
lebih kuat daripada elektrofil dari tetrahidrofuran-3-karboksaldehid dengan nilai C
karbonil pada 2-asetil-γ-butirolakton 11,62 dan C karbonil pada
tetrahidrofuran-3-karboksaldehid sebesar 10,92. Sehingga dapat menyebabkan ion enolat yang
terbentuk akan lebih sering menyerang atom C karbonil dari
2-asetil-γ-butirolakton. Setelah terjadi reaksi self-condentation, atom karbon α lain pada
2-asetil-γ-butirolakton akan menyerang atom C karbonil dari
tetrahidrofuran-3-karboksaldehid, sehingga terbentuk senyawa hasil reaksi samping.
Gambar 21. Hasil perhitungan C karbonil pada 2-asetil-γ-butirolakton dengan program
Marvin Sketch
Gambar 22. Hasil perhitungan C karbonil pada tetrahidrofuran-3-karboksaldehid dengan programMarvin Sketch
45 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Sintesis dari tetrahidrofuran-3-karboksaldehid dan 2-asetil-γ-butirolakton
dalam suasana basa piridin tidak menghasilkan laktogenin melainkan
menghasilkan senyawa
(Z)-3-(hidroksi(tetrahidrofuran-3-il)metil)-3-(3-(2-oksotetrahidrofuran-3-il)but-2 enoil)dihidrofuran-2(3H)-on dengan persen
kemurnian 10,25 % secara kromatografi gas.
B. Saran
1. Perlu dilakukan sintesis laktogenin dengan optimasi mengenai perbandingan
mol, pemilihan katalis, penggunaan suhu kamar , dan variasi waktu untuk
bereaksi.
2. Perlu dilakukan uji aktivitas senyawa
(Z)-3-(hidroksi(tetrahidrofuran-3-il)metil)-3-(3-(2-oksotetrahidrofuran-3-il) but-2-enoil) dihidrofuran-2(3H)-on
sebagai anti kanker.