ISOLASI DNA GENOM BAKTERI TERMOFILIK SUMBER AIR PANAS CIENGANG, KAWAH DARAJAT DAN HYDROTHERMAL VENT KAWIO
SKRIPSI
Diajukan untuk memenuhi sebagian dari syarat memperoleh gelar Sarjana Sains Departemen Pendidikan Biologi
Program Studi Biologi
Disusun oleh:
Meli NIM. 1001113
PROGRAM STUDI BIOLOGI
DEPARTEMEN PENDIDIKAN BIOLOGI
FAKULTAS PENDIDIKAN MATEMATIKA DAN ILMU PENGETAHUANALAM
UNIVERSITAS PENDIDIKAN INDONESIA
Isolasi DNA Genom Bakteri Termofilik
Sumber Air Panas Ciengang, Kawah Darajat
dan
Hydrothermal Vent
Kawio
Oleh Meli
Sebuah skripsi yang diajukan untuk memenuhi salah satu syarat memperoleh gelar Sarjana pada Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam
© Meli 2015
Universitas Pendidikan Indonesia Januari 2015
Hak Cipta dilindungi undang-undang.
LEMBAR PENGESAHAN
MELI
ISOLASI DNA GENOM BAKTERI TERMOFILIK SUMBER AIR PANAS CIENGANG, KAWAH DARAJAT DAN HYDROTHERMAL VENT KAWIO
disetujui dan disahkan oleh pembimbing:
Pembimbing I
Dr. Topik Hidayat, M.Si NIP. 197004101997021001
Pembimbing II
Dr. Hj. Widi Purwianingsih, M.Si. NIP. 196209621991012001
Pembimbing III
Elvi Restiawaty, ST. Ph.D. NIP. 1975072720010122001
Mengetahui,
Ketua Departemen Pendidikan Biologi
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu ABSTRAK
Indonesia merupakan negara yang memiliki banyak daerah dengan aktivitas geotermal. Kawasan sumber air panas Ciengang, kawah Darajat Garut dan kawasan hydrothermal vent
kepulauan Kawio Sulawesi Utara merupakan daerah yang memiliki karakteristik panas bumi potensial di Indonesia. Sumber air panas sebagai tempat ditemukannya bakteri termofilik yang berpotensi untuk menghasilkan enzim termostabil. Penelitian mengenai isolasi DNA genom dari bakteri termofilik asal sumber air panas Garut dan sumber perairan hydrothermal vent Kawio Sulawesi Utara telah dilakukan. Tujuan penelitian ini adalah untuk mengetahui
hasil identifikasi isolasi DNA genom dari bakteri termofilik sumber air panas Ciengang, Kawah Darajat dan hydrothermal vent Kawio. Pengamatan pertumbuhan bakteri dilakukan
selama 24 jam dengan pengecekan setiap 2 jam sekali. Setelah diketahui waktu pertumbuhan bakteri yang optimum, dilakukan isolasi DNA genom. Metode isolasi DNA genom yang dilakukan yaitu menggunakan metode isolasi Cetyl Trimethyl Ammonium Bromide (CTAB)
dengan beberapa modifikasi. Hasil encrichment sampel asal hydrothermal vent, Kawio
menunjukkan bahwa bakteri ini memiliki nilai OD maksimum sebesar 0,549 (K1) dan 0,497
(K2). Hasil kuantitatif dari isolasi DNA yang didapatkan rasio DNA berkisar antara
1,071-1,781 dengan konsentrasi DNA tertinggi 372,2 ng/µl. Sedangkan hasil kualitatif dari hasil isolasi DNA genom memiliki ukuran lebih dari 10000 bp.
Kata kunci: Isolasi DNA, Bakteri Termofilik, Sumber Air Panas.
Indonesia has many areas with geothermal activites Ciengang hot springs, Darajat Garut erater, and hydrothermal vent Kawio North Sulawesi, have geothermal potential in Idonesia. Thermophilic bacteria that potentially produce thermostable enzyme can be found in hot springs. Reasearch in the identificatio pf genome DNA isolation of thermophilic bacteria in Garut hot springs and hydrothermal vent in Kawio North Sulawesi has been conducted. This research airned at investigating the identification of genome DNA isolation of thermophilc bacteria in Garut hot springs and Kawio hydrothermal vent result. Te observation of growth bacteria was carried out for 24 hours and checked every two hours. After the optimum time of bacterial growth was known, genome DNA isolation was conducted. The genome isolation metod used was Cetyl Trimetyl Ammonium Bromide (CTAB) method eith some modifications. The result of Kawai hydrothermal vent simple showed that the bacteria has maxsimum OD by 0,594 (K1) and 0,497 (K2). Quantitative result of DNA isolation was
approximately 1,071-1,781 with te higest DNA concentration 372,2 ng/µl. Meanwhile, the qualitative result of the isolated genomic DNA had a size more than 10000 bp.
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu DAFTAR ISI
Halaman
ABSTRAK ... i
KATA PENGANTAR ... ii
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
BAB I PENDAHULUAN A. Latar Belakang ... 1
B. Rumusan Masalah ... 6
C. Batasan Masalah... 7
D. Tujuan Penelitian ... 8
E. Manfaat Penelitian ... 8
BAB II DNA GENOM BAKTERI TERMOFILIK SUMBER AIR PANAS CIENGANG, KAWAH DARAJAT GARUT DAN HYDROTHERMAL VENT KAWIO A. DNA Genom ... 9
B. Bakteri Termofilik ... 12
C. Pertumbuhan Bakteri ... 17
D. Faktor Pertumbuhan Bakteri ... 29
E. Medium BHMS ... 21
F. Sumber Air Panas Ciengang dan Kawah Darajat Garut ... 22
G. Hydrothermal Vent, Kawio ... 25
H. Isolasi DNA Metode CTAB ... 27
I. Elektroforesis ... 32
J. Spektrofotometer ... 33
BAB III METODE PENELITIAN A. Jenis Penelitian ... 38
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
C. Objek Penelitian ... 38
D. Waktu dan Lokasi Penelitian ... 38
E. Alat dan Bahan ... 39
F. Prosedur Penelitian... 39
1. Tahap Persiapan ... 39
a. Pengambilan Sampel ... 39
b. Pembuatan Medium BHMS ... 40
2. Tahap Penelitian ... 40
a. Enrichment ... 40
b. Pengukuran Optical Density (OD) ... 41
c. Isolasi DNA dengan CTAB ... 41
d. Uji Kemurnian dengan Spektrofotometer ... 42
e. Elektroforesis Gel agarose ... 43
f. Analisis Data ... 44
g. Alur Penelitian ... 45
BAB IV HASIL DAN PEMBAHASAN A. Hasil Pengukuran Suhu dan pH Air ... 46
B. Hasil Enrichment Bakteri Pada Medium BHMS ... 48
C. Isolasi DNA dengan metode CTAB ... 54
D. Hasil Uji Kuantifikasi DNA dengan Spektrofotometer ... 58
E. Hasil Uji DNA dengan Elektoforesis Gel Agarose ... 61
1. Hasil Elektroferogram DNA Genom Bakteri asal Ciengang ... 62
2. Hasil Elektroferogram DNA Genom Bakteri asal Air Panas Kawah Darajat Garut ... 63
3. Hasil Elektroferogram DNA Genom Bakteri asal Hydrothermal vent, Kawio ... 65
BAB V KESIMPULAN DAN SARAN A. Kesimpulan ... 67
B. Saran ... 68
DAFTAR PUSTAKA ... 69
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu DAFTAR TABEL
Tabel Halaman
2.1 Unsur Nutrisi Pertumbuhan Bakteri dan Fungsi Fisiologisnya ... 21
2.2 Karakteristik Gel Agarose ... 36
4.1 Perbandingan Nilai OD Bakteri Termofilik pada Medium BHMS ... 51
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu DAFTAR GAMBAR
Gambar Halaman
2.1 Struktur DNA ... 9
2.2 Struktur Genom ... 10
2.3 Perbandingan Struktur Kromosom... 11
2.4 Struktur Sel Bakteri ... 12
2.5 Suhu Pertumbuhan Kelompok Organisme ... 13
2.6 Kurva Tumbuh Bakteri ... 17
2.7 Peta Lokasi Daerah Ciengang, Garut ... 23
2.8 Peta Lokasi Daerah Kawah Darajat, Garut ... 23
2.9 Lokasi Hydrothermal Vent Kawio, Sulawesi Utara ... 25
2.10 White Smokers ... 26
2.11 Fasa, Interfasa dan Fasa Bawah ... 30
2.12 Elektroforesis dan Bagiannya ... 34
3.1 Diagram Alur Penelitian ... 45
4.1 Grafik Hasil Uji Fisika Air ... 47
4.2 Kurva Tumbuh Bakteri ... 52
4.3 Hasil Elektrofenogram DNA Bakteri Ciengang, Garut ... 62
4.4 Hasil Elektrofenogram DNA Bakteri Bakteri Kawah Darajat, Garut ... 63
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu DAFTAR LAMPIRAN
Lampiran Halaman
I. Alat dan Bahan Penelitian... 76
II. Formula Larutan dalam Preparasi CTAB ... 79
III. Protokol Pembuatan Larutan Stok ... 80
IV. Dokumentasi Penelitian ... 82
V. Langkah Kerja Penelitian ... 84
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu BAB I
PENDAHULUAN
A. Latar Belakang
Indonesia secara geologis terletak pada pertemuan tiga lempeng tektonik utama yaitu lempeng Eropa-Asia, India-Australia dan Pasifik yang berperan dalam proses pembentukan gunung api di Indonesia. Kepulauan Indonesia dibentuk dominan oleh busur vulkanik-magmatik, yang menjadikan Indonesia memiliki potensi panas bumi terbesar di dunia. Potensi ini terkait dengan kondisi geologi Indonesia yang merupakan daerah subduksi dan gunung berapi (Gupta, et
al., 2007). Sumber energi panas bumi di Indonesia tersebar hampir diseluruh
wilayah Indonesia salah satu diantaraya adalah Jawa barat yang memiliki sumber daya alam panas bumi terbesar mencapai 20% dari total potensi yang dimiliki Indonesia. Sumber daya panas bumi dapat di temukan pada air dan batuan panas di dekat permukaan bumi sampai beberapa kilometer di bawah permukaan. Bahkan jauh lebih dalam lagi sampai pada sumber yang ekstrim dari batuan yang mencair atau magma (Nurwati, 2010).
Data Dinas Pertambangan dan Energi Provinsi Jawa Barat (2001), menyatakan daerah Gunung Darajat memiliki luas wilayah sebesar 14,13 KM2.
Secara administratif berada pada dua wilayah kabupaten yaitu kabupaten Bandung (Kecamatan Pangalengan dan Kecamatan Kertasari) dan Kabupaten Garut (Kecamatan Tarogong, Kecamatan Bungbulang dan Kecamatan Cisewu). Daerah Ciengang garut termasuk kedalam Kecamatan Tarogong Kaler yang berbatasan dengan Kecamatan Leles, Samarang, Banyuresmi, dan Tarogong Kidul Luas kecamatan tersebut adalah 5.627 Ha dan berjarak sekitar 4 Km dari kota kabupaten Garut. Daerah ini terletak pada 500-1000 meter dari permukaan laut. Daerah tersebut menunjukkan karakteristik panas bumi berupa manifestasi sumber alam yaitu sumber mata air panas (hot water Spring) sebagai tempat
ditemukannya mikroorganisme terutama bakteri termofil dari genus Bacillus
2
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Selain sumber air panas, lingkungan laut juga dipandang memiliki keunikan karakteristik secara fisik, kimia, dan biologis (Steele et al., 2005). Lingkungan
laut dapat mencerminkan suatu kondisi yang memiliki tingkat keragaman mikroba yang cukup tinggi (Srimariana, 2000). Salah satu manifestasi lingkungan laut di Indonesia yaitu berupa kawasan perairan hydrothermal vent ditemukan dekat
gunung berapi Kawio Barat, Sulawesi Utara. Hydrothermal vent ini merupakan
kawasan kebulan asap gelap dari kegiatan vulkanik dapat menyemburkan air panas hingga mencapai suhu 400ºC (Nganro, 2009). Pulau Kawio terbilang unik secara tektonik karena tidak banyak daerah di dunia yang mempunyai karakteristik seperti ini. Wilayah ini merupakan pertemuan dua jalur gunung api besar di dunia dan merupakan pertemuan jalur gempa wilayah timur dan pasifik. Selain itu juga, wilayah ini merupakan wilayah laut dalam yang belum banyak dieksplorasi potensinya (BPPT, 2010).
Beberapa kondisi lingkungan yang berbeda dalam setiap lokasi memungkinkan adanya heterogenitas bakteri termofilik yang tinggi (Adiguzel et
al., 2010). Habitat alami bakteri termofilik tersebar luas di seluruh permukaan
bumi. Salah satu lingkungan alaminya terbentuk akibat aktivitas vulkanik atau perpindahan kerak bumi pada saat gempa tektonik. Fenomena geologi tersebut menghasilkan kawah air panas yang biasanya memiliki pH netral. Adanya aktivitas geothermal yang cukup besar pada daerah hydrothermal vent dan
kawasan gunung berapi memungkinkan tumbuhnya mikroorganisme termofilik yang beragam. Bakteri termofilik juga dapat ditemukan di geotermal laut dalam yang memiliki kadar mineral dan salinitas yang tinggi (Edwards, 1990). Biodiversitas pada bakteri termofililik yang ditemukan pada berbagai sumber air panas dipengaruhi oleh perbedaan kondisi seperti pH, temperatur, ketersediaan air, cahaya dan oksigen, serta jenis dan jumlah nutrien dalam suatu habitat tersebut (Madigan et al., 1998).
Hasil eksplorasi BPPT, (2010) mengungkap adanya kehidupan yang unik di kedalaman lebih dari 4.000 meter di bawah laut yaitu banyak mikroorganisme termofilik dan hipertermofilik yang hidup di laut dalam hydrothermal vent
3
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
adanya penelitian lebih lanjut agar potensi bakteri di kawasan hydrothermal vent
ini dapat dimanfaatkan dengan baik.
Bakteri termofilik merupakan bakteri yang mampu tumbuh optimal pada rentang suhu 55–85ºC (Andrade et al., 1999). Bakteri termofilik mampu
menghasilkan enzim termostabil. Kemampuan bakteri termofilik untuk hidup pada temperatur yang relatif tinggi dan juga mampu beradaptasi dalam lingkungan ekstrim merupakan sumber potensial untuk enzim termostabil yang lebih unggul peranannya dalam bidang industri dan bidang bioteknologi (Kato et al., 1995).
Sifat termofilik yang terdapat dalam bakteri ini merupakan fenomena yang sangat unik, sehingga dilakukanlah penelitian mengenai bakteri termofilik teutama bakteri yang di isolasi dari sumber mata air panas, Garut dan kawasan
hydrothermal vent, Kawio.
Menurut Brock and Madigan (1991), mikroba termofil memiliki beberapa keistimewaan di antaranya enzim dan protein yang dihasilkan bersifat termostabil dan mampu berfungsi optimal pada suhu tinggi. Enzim pada bakteri termofilik juga mampu mengakatalisis reaksi biokimia pada suhu tinggi dan umumnya lebih stabil dari bakteri mesofilik. Kemampuan bakteri termofilik untuk bertahan hidup di lingkungan panas disebabkan bakteri termofilik mempunyai membran sel yang kaya akan asam lemak jenuh dan membran ribosom yang juga tahan panas. Sifat-sifat tersebut sangat diperlukan oleh industri-industri berbasis enzim. Oleh karena itu, bakteri termofilik menawarkan keuntungan dalam bidang industri dan bioteknologi (Mayende, 2006).
4
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Salah satu pengembangan proses bioremediasi yang dilakukan oleh Restiawaty et al., (2013) berhasil mengisolasi bakteri termofilik Geobacillus sp.
dari perairan hydrothermal vent Kawio Sulawesi Utara Indonesia dengan suhu
pertumbuhan optimum 60 ºC dapat mengubah limbah gliserol menjadi bahan kimia lain yang memiliki nilai tambah. Tidak menutup kemungkinan dengan keanekaragaman bakteri yang ada pada bakteri termofilik dari sumber air panas Garut dan perairan hydrothermal vent Kawio akan menghasilkan lebih banyak
lagi bakteri penghasil enzim-enzim termostabil baru yang fungsional seperti yang diharapkan adanya enzim termostabil dari polifosfat kinase (Restiawaty et al.,
2013). Memanfaatkan dan mempelajari potensi enzim termostabil bakteri termofilik, maka tahap awal yang perlu dilakukan yaitu dengan isolasi DNA.
Tahapan dalam melakukan isolasi DNA dibutuhkan nilai kepadatan sel atau
optical density (OD) sekitar 0,6-2,0. Sehingga diperlukan upaya pengkulturan
bakteri sampel di dalam medium pertumbuhan untuk meningkatkan nilai optical
density (OD). Kepadatan sel atau optical density sel akan meningkat seiring
dengan pertumbuhan sel bakteri, sehingga untuk mengetahui nilai optical density
sel dapat dilakukan dengan menggunakan alat spektrofotometer uv pada panjang gelombang 600 nm (Restiawaty, 2013). Keterbatasan sampel yang tersedia pada sumber air panas Kawio, maka dilakukan upaya pengkulturan bakteri untuk meningkatkan nilai optical density sel yang sangat dipengaruhi oleh kondisi
lingkungan medium kultur seperti suhu dan komposisi medium (Middelbeek et
al., 1992). Komposisi medium kultur yang mengandung komposisi garam-garam
mineral sangat baik dan sesuai dengan habitat asli bakteri hydrothermal vent
Kawio tersebut yaitu medium Buhsnell Haas Mineral Salt (BHMS). Buhsnell
Haas Mineral Salt (BHMS) merupakan medium pertumbuhan bakteri yang
berasal dari sampel air laut. Medium tersebut mengandung unsur makro nutrien dan mikro nutrien yang dapat berperan penting untuk pertumbuhan bakteri. Unsur makro nutrien dan mikro nutrien tersebut berasal dari komposisi mediumnya, yaitu KH2PO4, K2HPO4, MgSO4, CaCl2, NH4NO3, dan FeCl3 (Cappello et al.,
5
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Asam deoksiribonukleat (DNA) merupakan asam nukleat yang mengandung materi genetik dan berfungsi untuk mengatur perkembangan biologis seluruh bentuk kehidupan secara seluler (Windiastika, 2011). DNA sangat menarik perhatian para biologiwan modern dalam abad ini. Oleh karena itu DNA sangat erat hubungannya dengan hampir semua aktivitas biologi (Suryo, 2005). Selama bertahun-tahun eksplorasi enzim mikroba dari alam, termasuk dari laut, hanya didasarkan pada mikroorganisme yang dapat dibiakkan di laboratorium (culturable microbes) lebih dari 99% mikroba tidak bisa dikultur (unculturable)
dengan metode konvensional, sehingga perlu adanya metode lain melalui pendekatan genomnya yaitu dengan metagenomik (Kennedy et al., 2008; Sleator
et al., 2008).
Metagenomik adalah suatu metode isolasi DNA mikroba secara langsung dari lingkungannya yaitu dengan cara membuat perpustakaan gennya (gene libraries),
diikuti dengan menganalisis informasi genetika yang terkandung didalamnya (Riesenfeld et al., 2004). Metagenomik memberikan peluang besar dalam
penemuan diversitas enzim yang baru karena kita dapat mengeksplorasi genom mikroba secara langsung dari lingkungan habitatnya (Uchiyama & Mizaki, 2009; Schmeisser et al., 2007). Metagenomik ini merupakan salah satu cara eksplorasi
enzim yang kini sedang dilakukan untuk mengungkap informasi genom baru yaitu menganalisis genom dengan cara mengisolasi DNA genom secara langsung dari lingkungan dalam rangka membangun pustaka metagenomik dari berbagai macam mikroorganisme yang ada dalam lingkungan tersebut (Handelsman, 2004).
6
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Isolasi DNA menggunakan metode CTAB (Cetyl Trimethyl Ammonium
Bromide) dengan sedikit modifikasi (Hidayat, et al., 2012). CTAB merupakan
sejenis deterjen yang dapat mendegradasi dinding sel, denaturasi protein, memisahkan karbohidrat (Kaidah & Suprapto, 2003). Metode isolasi DNA dengan menggunakan CTAB akan menghasilkan pita DNA yang berukuran tebal dan dapat memisahkan DNA dari polisakarida karena adanya perbedaan karakteristik kelarutan (differensial of solubility). Disamping diperoleh fragmen DNA, dengan
metode CTAB juga akan diperoleh RNA dengan pita tipis yang terletak jauh berada di bawah pita DNA. Keberadaan pita RNA tergantung bahan yang diekstraksi (Prasetyo, 2008). Untuk menguji DNA secara kualitatif dan kuantitatif, maka dapat dilakukan pengukuran dengan menggunakan spektrofotometri UV dan elektroforesis gel agarosa. Uji kualitatif dengan gel agarosa dapat mengukur kualitas kemurnian DNA, dimana konsentrasi gel agarosa yang digunakan berbanding terbalik dengan panjang/pendeknya pita DNA atau bentuk struktur DNA. Makin pendek urutan basa DNA-nya maka konsentrasi gelnya tinggi. Sedangkan uji kuantitatif DNA dengan menggunakan spektrofotometer UV pada panjang gelombang sinar UV 260 nm akan menangkap molekul DNA sehingga terukur nilai absorbansinya (Fatchiyah, 2011).
Menurut Sambrook dan Russel (2001) DNA murni (tanpa kontaminan)
memiliki rentang nilai perbandingan panjang gelombang λ260/ λ280 antara 1,8
-2,2, bila lebih kecil dari 1,8 diketahui DNA tersebut terkontaminasi fenol dan bila lebih besar dari 2,2 terkontaminasi protein. Oleh sebab itu, berdasarkan hasil uraian diatas maka dilakukanlah sebuah penelitian yang mengacu pada identifikasi hasil dari isolasi DNA dari berbagai sumber air panas yaitu sumber air panas Ciengang dan Kawah Darajat Garut, serta sumber air panas asal
7
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu B. Rumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas dapat dirumuskan masalah sebagai berikut:
“Bagaimana hasil isolasi DNA genom bakteri sumber air panas Ciengang, Kawah Darajat dan hydrothermal vent, Kawio?”. Berdasarkan rumusan masalah
tersebut muncul beberapa pertanyaan penelitian sebagai berikut:
1. Bagaimanakah hasil pengujian suhu dan pH air sebagai faktor fisika lingkungan pertumbuhan bakteri asal sumber air panas Ciengang, Kawah Darajat Garut dan Hydrothermal Vent Kawio?
2. Bagaimanakah laju pertumbuhan spesifik bakteri sumber air Hydrothermal
Vent Kawio pada medium Bushnell Haas Mineral Salt (BHMS) dan
berapakah nilai Optical Dencity (OD) maksimal pada pertumbuhan bakteri
termofilik tersebut?
3. Bagaimanakah hasil isolasi DNA genom bakteri termofilik asal sumber air panas Ciengang, Kawah Darajat Garut dan Hydrothermal Vent Kawio yang di
uji secara kuantitatif dan kualitatif?
C. Batasan Masalah
Agar permasalahan dalam penelitian ini terfokus pada hal yang diharapkan, ruang lingkup dibatasi pada:
1. Bakteri termofilik yang akan diisolasi DNA genomnya adalah bakteri yang mampu hidup pada medium BHMS, dalam keadaan aerob, dan pada suhu 60ºC.
2. Sampel bakteri termofilik yang digunakan dalam penelitian ini diambil dari sumber air panas Ciengang, Kawah Darajat Garut dan dari kawasan
hydrothermal vent kepulauan Kawio Provinsi Sulawesi Utara.
3. Metode Isolasi DNA yang digunakan adalah metode CTAB ( Hidayat, et al.,
8
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu D. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui hasil isolasi DNA genom bakteri sumber air panas Ciengang, Kawah Darajat Garut dan asal kawasan hydrothermal vent, Kawio yang dapat dirinci sebagai berikut:
1. Mengetahui hasil pengujian suhu dan pH air sebagai faktor fisika lingkungan pertumbuhan bakteri asal sumber air panas Ciengang, Kawah Darajat Garut dan Hydrothermal Vent Kawio.
2. Mengetahui laju pertumbuhan bakteri sumber air Hydrothermal Vent Kawio
yang di enrichment pada medium Bushnell Haas Mineral Salt (BHMS) dan
berapakah Optical Density (OD) maksimal pada pertumbuhan bakteri
tersebut.
3. Mengetahui hasil identifikasi isolasi DNA genom bakteri termofilik yang di analisis secara kuantitatif dan kualitatif asal sumber air panas Ciengang, Kawah Darajat Garut dan Hydrothermal Vent Kawio.
E. Manfaat Penelitian
Adapun manfaat penelitian ini adalah sebagai sumber informasi tambahan mengenai hasil isolasi bakteri termofilik asal sumber air panas Ciengang, Kawah Darajat Garut dan asal kawasan hydrothermal vent Kawio yang di uji secara
kuantitatif dan kualitatif, khususnya dibidang Mikrobiologi dan Biologi Molekuler. Selanjutnya DNA genom yang dihasilkan pada penelitian ini diharapkan dapat digunakan lebih lanjut untuk mengeksplorasi potensi keberadaan enzim-enzim termostabil dari bakteri termofilik sumber air panas Ciengang, Kawah Darajat Garut dan asal perairan hydrothermal vent Kawio secara
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu BAB III
METODE PENELITIAN
A.Jenis Penelitian
Jenis penelitian yang dilakukan adalah penelitian dasar dengan metode deskriptif, yaitu metode penelitian yang dibuat deskripsi, gambaran atau lukisan secara sistematis, faktual, dan akurat mengenai fakta-fakta, sifat-sifat, serta hubungan antar fenomena yang diselidiki (Nazir, 1988).
B.Populasi dan sampel
Populasi dalam penelitian ini adalah seluruh bakteri termofilik asal perairan Ciengang, Kawah Darajat Garut dan populasi bakteri termofilik asal
Hydrothermal vent, Kawio. Sampel yang digunakan diambil sebanyak 15 liter dari
sumber air panas Ciengang dengan temperatur air 50oC pH 7 dan 15 liter dari Kawah Darajat Garut dengan temperatur air 90oC kondisi pH 3. Sedangkan sampel yang berasal dari kawasan hydrothermal vent memiliki temperatur air
berkisar 250–300oC dan keadaan pH 6,5. Jenis sampelnya merupakan campuran
dari air panas dengan sedikit sediemen. Bakteri termofil asal kawasan
hydrothermal vent Kepulauan Kawio di enrichment pada medium Buhsnell Haas
Mineral Salt (BHMS) dengan penambahan sumber karbon (glukosa dan gliserol)
dengan volume medium masing-masing mencapai 500 ml pada suhu 60 ºC.
C.Objek Penelitian
Objek penelitian ini adalah DNA dari bakteri termofilik sumber air panas Ciengang, Kawah Darajat Garut dan Asal hydrothermal vent Kawio yang di
enrichment pada medium Buhsnell Haas Mineral Salt (BHMS).
D.Waktu dan Lokasi Penelitian
39
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Pusat Antar Universitas (PAU), Sekolah Ilmu Teknologi Hayati Institut Teknologi Bandung, dan Laboratorium Mikrobiologi FPMIPA UPI. Sedangakan Waktu pelaksaanaan pengambilan sampel pada bulan Desember 2014 di sumber mata air Ciengang, Garut dan Januari 2015 pengambilan sampel air panas di Kawah Darajat, Garut.
E.Alat dan Bahan
Alat dan bahan yang digunakan dalam penelitian ini terdapat di Laboratorium Rekayasa Genetika gedung Pusat Antar Universitas Institut Teknologi Bandung. Daftar alat dan bahan yang digunakan tercantum dalam
Lampiran I.
F. Prosedur Penelitian 1. Tahap Persiapan
Persiapan penelitian meliputi sterilisasi alat dan bahan, pembuatan medium untuk pengkayaan bakteri, isolasi genom dan elektroforesis. Medium tumbuh yang digunakan adalah medium Buhsnell Haas Mineral Salt (BHMS). Alat-alat
yang digunakan dicuci terlebih dahulu dan dikeringkan kemudian dibungkus dengan plastik tahan panas yang selanjutnya disterilisasi panas lembab pada autoklaf dengan suhu 121°C tekanan 1,5 atm selama 10-15 menit.
a. Pengambilan sampel
40
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
dimasukkan kedalam termos atau botol steril dan ditutup dengan rapat bisa menggunakan alumunium foil dan plastik yang diikat rapat menggunakan karet yang selanjutnya sampel air tersebut dibawa ke Laboratorium untuk di isolasi.
b. Pembuatan Medium Campuran BHMS dan sumber karbon Gliserol dan Glukosa
Bushnell Haas Mineral salts (BHMS) digunakan sebagai medium
pertumbuhan bakteri dari sampel air hydrothermal vent Kawio dibuat
masing-masing terlebih dahulu secara terpisah. Medium BHMS cair disiapkan dengan komposisi 1 g/l KH2PO4, 0,2 g/l K2HPO4, 0,2 g MgSO4.7H2O, 0,02 g CaCl2, 1 g
NH4NO3 dan 2 tetes FeCl3 60% kemudian ditambahkan aquades sampai 1 liter
(Cappello et al., 2012). Selanjutnya ditambahkan 30 mM gliserol ke dalam larutan
medium BHMS setelah itu, adjust pH sampai 7,0 ± 0,2. Setelah medium selesai
dibuat secara terpisah, kemudian langkah selanjutnya adalah membuat medium campuran Buhsnell Haas Mineral Salt (BHMS) disterilisasi dengan cara
dimasukan ke dalam autoclave selama 15 menit pada suhu 121ºC.
2. Tahap Penelitian a. Enrichment
Sampel air laut dalam telah diambil dari kawasan hydrothermal vent Kawio.
Sampel yang dikumpulkan berupa air laut dan jumlahnya terbatas. Maka untuk memperkaya sampel dan menghindari terjadinya degradasi jumlah bakteri, dilakukan metode pengayaan (enrichment). Pengayaan dilakukan dengan
menggunakan medium Buhsnell Haas Mineral Salt (BHMS). Sebanyak 10%
sampel air laut dalam Kawio ditambahkan ke dalam 10 ml medium Buhsnell Haas
Mineral Salt (BHMS). Penambahan ini dilakukan secara steril di dalam laminar
air flow untuk mencegah adanya kontaminasi.Kemudian diinkubasi dalam suhu
60oC. Setelah inkubasi overnight atau hingga sampel terlihat keruh, sebanyak 10%
sampel hasil inkubasi diinokulasikan kembali ke dalam 100 ml medium Buhsnell
Haas Mineral Salt (BHMS) dengan inkubasi pada keadaan yang sama. Baru
41
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
sampel sampai diperoleh volume sampel dengan hasil yang maksimal, kemudian dapat digunakan untuk pengamatan dengan inkubasi pada keadaan yang sama.
b. Pengukuran Optical Density (OD)
Pengukuran Optical Density (OD) dilakukan dengan metode langsung
berdasarkan turbiditas. Alat yang digunakan yaitu spektrofotometer. Pengecekan OD dilakukan setiap 1-2 jam sekali dengan cara 1 ml sampel dimasukkan ke dalam kuvet. Panjang gelombang yang digunakan yaitu 600 nm.
c. Isolasi Genom 1. Preparasi CTAB:
Dalam tahap preparasi CTAB langkah awal adalah dengan mempersiapkan
Buffer CTAB, Buffer TE, isopropanol, etanol 70% dan etanol 95%. Simpan
Isopropanol, etanol dan ammonium acetat pada lemari es -20oC. Campurkan 5 ml
buffer CTAB, 0,2 gram polivinylphyrrolidone (PVP) dan 25 µl beta
mercaptoetanol. Kemudian, campuran buffer CTAB dan kertas saring dimasukan
kedalam waterbath shaker dengan suhu 60oC inkubasi selama 1 jam. Selama
proses inkubasi aduk buffer per 30 menit dan akan terbentuk gelembung jika terjadi guncangan yang cepat (Hidayat et al., 2012)
2. Isolasi dengan metode CTAB
Metode isolasi CTAB berdasarkan metode Marshall (2011) dengan sedikit modifikasi oleh Hidayat et al., (2012). Langkah awal Sebelum sampel diisolasi,
Saring sampel air yang mengandung bakteri asal hydrothermal vent, Ciengang
dan Kawah Darajat Garut. Saring sampel dengan menggunakan kertas saring microfiber ukuran pori 0,2 µm. Setelah sampel disaring, kemudian ambil masing-masing kertas penyaring sampel asal hydrothermal vent Kawio, Ciengang dan
42
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
inkubasi dalam waterbath 55oC selama 1 jam. Lakukan pengadukan per 30 menit. Isolasi dilakukan dengan mengambil 3 ml kultur dari buffer CTAB masukkan kedalam tabung mikro kemudian sentrifugasi 14.000 rpm selama 1 menit. Supernatan yang terbentuk dibuang sehingga hanya pellet yang tersisa. Pellet hasil sentrifugasi ditambahkan dengan 1 ml kloroform: isoamil alkohol v/v (24:1) sentrifugasi selama 7 menit dengan kecepatan 13.200 rpm, ambil fasa atas pindahkan pada tabung yang baru hitung fasa air dan masukkan 0.08 µl ammonium acetat : isopropanol sebanyak 0,54 µl. Homogenkan campuran fasa tersebut dengan membolak-balik tabung sebanyak 30x atau diresuspensi menggunakan tips hingga tercampur rata. Setelah tercampur rata, kemudian disimpan dalam freezer -20oC selama 40 menit. Sentrifugasi kembali dengan kecepatan 13.200 rpm, buang supernatan masukkan 700 µl etanol 70%, invert hingga homogen, sentrifuge sampel selama 1 menit dengan kecepatan 13.200rpm. Buang supernatan masukkan 700 µl etanol 75%, invert hingga homogen, sentrifuge sampel selama 1 menit dengan kecepatan 13.200 rpm. Supernatan yang terbentuk dibuang hingga tersisa pelletnya kemudian pelletnya dikeringkan pada suhu ruang. Setelah itu dilarutkan dengan menambahkan 25 µl TE buffer pH 8,0. Flick hingga homogen. Disimpan pada suhu -20oC.
d. Uji Kemurnian dengan Spektrofotometer
Cara kerja pengujian kuantitatif DNA genom hasil isolasi diukur melalui spektrofotometri sinar ultra violet dengan alat spektrofotometer UV Genesis, Thermocientific. Sampel DNA genom hasil isolasi diambil sebanyak 2 µl dan diencerkan dengan deion sampai 50x pengenceran. Sampel DNA genom yang sudah diencerkan kemudian dimasukkan ke dalam tabung kuvet khusus selanjutnya dimasukkan ke dalam alat spektrofotometer.
43
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
[DNA] = Å 260 x 50 x faktor pengenceran Keterangan:
Å 260 = Nilai absorbansi pada 260 nm
50 = Larutan dengan nilai absorbansi 1,0 sebanding dengan 50 µg untai ganda DNA per ml
Nilai purity DNA ditentukan oleh tingkat kontaminasi protein dan fenol dalam larutan. Molekul DNA dikatakan murni jika Å 260 / Å 280 tersebut berkisar antara 1,8 – 2,0. Jika nilai rasio Å 260 / Å 280 lebih kecil dari 1,8 maka masih ada kontaminasi protein, sedangkan apabila nilai rasio Å 260 / Å 280 lebih besar dari 2,0 maka masih ada kontaminasi fenol di dalam larutan DNA (Sulandari and M. Zein, 2003).
e. Elektroforesis Gel Agarose
Tahap elektroforesis dimulai dengan menyiapkan gel agarosa 0,7% untuk dicetak pada cetakan gel yang telah dipasang sisir sebagai sumur. Panaskan gel agrose yang baru dibuat diamkan hingga hangat kuku dan tuangkan kedalam cetakan setelah gel agarose dingin atau membeku kemudian ambil dan letakkan pada kolom elektroforesis. Tuangkan buffer TAE 1x kedalam kolom elektroforesis hingga gel agarose terendam. Line pertama pada sumur dimasukkan
8 µl marker (ladder 1 kb DNA), line berikutnya diisi dengan 3 µl sampel hasil
isolasi genom yang dicampurkan dengan 2 µl loading dye. Setelah itu tegangan
dipasang 100 volt dengan waktu elektroforesis selama 25 menit. DNA hasil
running di elektroforesis kemudian diambil dan diberi pewarnaan dengan cara
direndam dalam larutan Ethidium Bromide (EtBr) selama 3 menit, setelah itu bilas
44
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
dipakai setiap saat. (Wibowo. 2008). Hasil elektroforesis akan didapatkan pita-pita protein yang terpisahkan berdasarkan berat molekulnya. Tebal tipisnya pita-pita yang terbentuk dari pita protein menunjukkan kandungan atau banyaknya protein yang mempunyai berat molekul yang sama yang berada pada posisi pita yang sama. Hal ini sejalan dengan prinsip pergerakan molekul bermuatan, yakni molekul bermuatan dapat bergerak bebas di bawah pengaruh medan listrik, molekul dengan muatan dan ukuran yang sama akan terakumulasi pada zona atau pita yang sama atau berdekatan (Retnoningrum, 2007). Hasil positif elektroforesis gel agarosa adalah munculnya pita yang berpendar jika gel dilihat di bawah sinar UV. Hasil negatif elektroforesis gel agarosa adalah tidak adanya pita yang berpendar jika gel agarosa dilihat di bawah sinar UV.
f. Analisis Data
45
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu G.Alur Penelitian
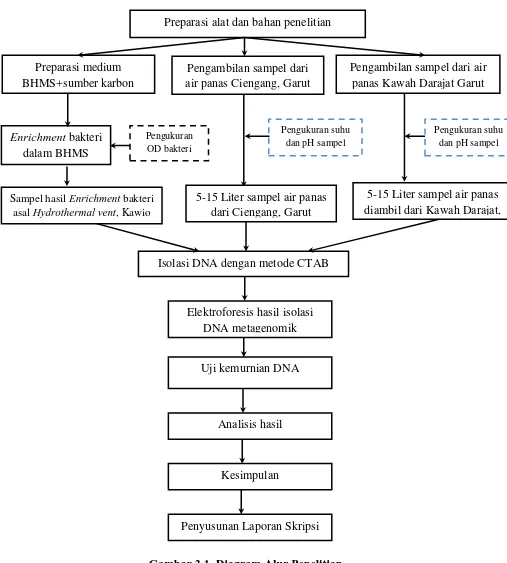
Penjelasan mengenai prosedur penelitian dapat dilihat dalam bentuk diagram, yaitu sebagai berikut:
Sampel hasil Enrichment bakteri
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian tentang identifikasi hasil isolasi DNA metagenomik bakteri termofil asal sumber air Hydrothermal Vent, Kawio dan sumber air panas
Garut (Ciengang dan Kawah Darajat Garut) dapat disimpulkan bahwa:
1. Faktor-faktor fisika yang mempengaruhi pertumbuhan bakteri antara lain yaitu suhu dan pH. Suhu tertinggi diperoleh dari sampel asal perairan
Hydrothermal Vent, Kawio yaitu 250oC dengan pH 6,5. Sedangkan sumber
air panas Ciengang memiliki suhu air 50oC dengan pH 7 dan Kawah Darajat Garut memiliki suhu air 95oC dengan pH 3 (asam) perbedaan kondisi suhu maupun pH air merupakan faktor yang mendukung untuk ditemukannya ragam mikroorganisme pada kondisi lingkungan tersebut.
2. Kurva pertumbuhan menunjukkan empat fase yang terdiri dari fase lag, fase logaritma atau eksponensial, fase stasioner dan fase kematian. Fase logaritmik terjadi dari waktu pertumbuhan jam ke-2 hingga jam ke-14. Sedangkan fase stasioner pada jam ke 14-20. Pada fase stasioner jam ke-18 Nilai OD maksimum dari hasil encrichment sebanyak 500 ml mencapai 0,549 pada K1
(BHMS+Glukosa) dan 0,497 pada sampel K2 (BHMS+Gliserol). Kondisi OD
tersebut merupakan faktor pendukung untuk dilakukannya isolasi DNA genome bakteri.
3. Secara kuantitatif pada hasil spektrofotometri yang telah dilakukan, rasio berkisar antara 1,071-1,781. Rasio DNA tersebut menyataan bahwa DNA terkontaminasi protein sebab rasionya kurang dari 1,8. Konsentrasi tertinggi pada DNA asal Ciengang (C2b) dengan total volume asal 10 liter konsentrasi
DNA 372,2 ng/µl.
4. Secara kualitatif hasil DNA genom bakteri termofilik yang di isolasi pada sampel asal Kawah Darajat (KD1, KD2, KD3) dan Ciengang (C2a dan C2b)
68
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu B. Saran
Berdasarkan penelitian yang telah dilakukan, disarankan untuk melakukan penelitian lanjutan mengenai potensi keberadaan enzim-enzim termostabil dari genom bakteri termofilik dengan teknik biologi molekuler dan potensi enzim tersebut mampu dimanfaatkan untuk berbagai bidang. Selain itu disarankan juga penelitian lebih lanjut mengenai karakteristik spesifik dari bakteri termofilik asal perairan hydrothermal vent Kawio dan sumber air panas Ciengang dan Kawah
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu DAFTAR PUSTAKA
Adibuzel et al. (2010). Molecular diversity of thermofilic bacteria isolated from
Pasinler hot spring (Erzurum, Turkey). Turkey Jurnal Biology. 35,
267-274).
Adinaryana K., P. Ellaiah & D.S. Prasad. (2003). Purification and partial characterization of thermostable serine alkaline protease from a newly isolated of Bacillus subtilis PE-11. AAPS Pharmacology Science Technology. 4, 1-9.
Andrade, M., Brown, N., Leroy, C., Hoersch, S., de Daru var, A., Reich, C., Franchini, A. Tamames, J., Valemcia, A., Ouzounis, C., & Sander,
C.(1999). “Automated genome sequence analysis”. Bioinformatics, 15. In
press.
Aprilian, R. (2009). Analisis Variasi Genetik Osphronemus gouramy Lac yang Terinfeksi Aeromonas hydrophilla Dengan Penanda Mikrosatelit. (Skripsi).
Jurusan Pendidikan Biologi FPMIPA Universitas Pendidikan Indonesia, Bandung.
Artama, W.T.(1991). Rekayasa Genetika. Pusat Antar Universitas-Bioteknologi. UGM. Yogyakarta.
Ausubel, et al. (2003). Current protocols in Molecular Biology. United Kingdom:
John Wiley & Sons Ltd Baig M.M.V., Big M.L.B., Yasmaen M. (2004).
Saccharification of banana agrowaste by cellulolytic enzymes. Afr J. Biotechnol. 3, hlm. 447-450.
Baig M.M.V., Big M.L.B., Yasmaen M. (2004). Saccharification of banana agrowaste by cellulolytic enzymes. Afr J. Biotechnol. 3, hlm. 447-450.
Bettelheim, F.A., & Landesberg, J. (1984). Laboratory Experiments for General, Organic, & Biochemistry.(edisi keempat). New Jersey: John Wiley & Sons Inc.
Birren,B., E.D. Green, S. Klapholz, R.M. Myers, & J. Roskams. (1997). “Genome
Analysis. A Laboratory manual”. Volume 1. Cold Spring Harbour
Laboratory Press.New York. Halaman 621.
Brock, T. D. (1986). Introduction : An Overview of The Thermophiles, in : Thermophiles : General, Molecular & Applied Microbiology Ed. T. D. Brock, John Whilley & Sons. New York.
70
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Campbell et al. (2008). Biology. (edisi kedelapan). San Francisco: Pearson Benjamin Cummings.
Chawla, H. S. (2003). Plant Biotechnology : A Practical Approach. Science Publishers, Inc. Plymouth.
Corkill, G., Rapley, R. (2008). The Manipulation of Nucleic Acids: Basic Tools & Techiques in Molecular Biomethods Handbook Second Edition. Ed: Walker,
J.M., Rapley, R. Humana Press, NJ,USA.
Demerdash, Hassan A,M,El. (2012). ”A Simple and Inexpensive Procedure for Chromosomal DNA Extraction from Streptococcus thermophilus Strains”.
Middle-East Journal of Scientific Research . 11 (1), hlm 13-18
Dessy, C. S. (2008). “Isolasi Bakteri dan Uji Aktivitas Amilase Termofil Kasar dari Sumber Air Panas Penen Sibirubiru Sumatra Utara”. (Tesis). Medan:
Universitas Sumatra Utara.
Edwards, C. (1990). Microbiology of Extreme Environments. New York: Mc
Graw- Hill Publishing Company
Facthiyah. (2005). Gel Elektroforesis. Malang: Laboratorium Sentral Biologi Molekuler & Seluler Universitas Brawijaya.
Fatchiyah, (2011). Modul Pelatihan Analisis Fingerprinting DNA Tanaman Dengan Metode RAPD. Laboratorium Sentral Ilmu Hayati Universitas Brawijaya, Malang.
Fardiaz, S. (1989). “Petunjuk Praktikum Analisis Mikrobiologi Pangan”. Bogor: PAU IPB.
Fauziah, L.(2010). “Isolasi DNA”. Available on
http://miss-purplepharmacy.blogspot. com/2010/01/isolasi-dna.html. Diakses tanggal
28 november 2012.
Fikrinda. (2000). Isolasi & karakterisasi bakteri penghasil selulase ekstermofilik dari ekosistem air hitam. (tesis). Institut Pertanian Bogor.
Gaffar, S. (2007). Buku Ajar Biologi Molekuler. Jurursan Kimia, Fakultas MIPA.
Universitas Padjajaran.
Garbutt, J. (1997). Essentials of Food Microbiology. London: Arnold.
Gati, W.(2011). “Metode Uji Kualitatif Dna Dengan Elektroforesis Gel Agarosa”. Balai Besar Perbenihan & Proteksi Tanaman Perkebunan Surabaya.
Ghosh. (2005). ”Production of Lipase & Phospholipase Enzymes from Pseudomonas sp & Their Action on Phospholipids. Journal of Oleo Science.
54 (7), 407-411
http://rizzo.springer-71
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu ny.com:6336/dynaweb/verlagprok/prokbook/IDMATCH
Johor Malaysia”. Jurnal of Applied Sciences. 12 (4): 354-361.
Holden, J.F. (2009). “Extremophiles: Hot Environments”, dalam Encyclopedia of Microbiology (third ed.). Oxford: Elsevier.
Hoelzel, A.R, et al. (1994). “Rapid Evolution of a heteroplasmic repetitive in the
Mitochondrial DNA Control Region of Carnivores”. Microbiology & Molecular Biology. 39, hlm. 191-199.
Ibrahim, ASS & El-diwany AI. (2007). Isolation & identification of new cellulases producing thermophilic bacteria from an Egyptian hot spring & some properties of the crude enzyme. J Appl Sci. 1, hlm. 473-478.
Jeanthon, C. (2000). “Molecular ecology of hydrothermal vent microbial communities”. Antonie van Leeuwenhoek. Microbiology & Molecular Biology. 77, hlm. 117–133.
Jude, B. (2012). Agarose Gel Electrophoresis (basic methode). Bard College.
Kalisz, H.M. (1988). Microbial proteinases. In: Biochemical Engineering and Biotecnology, Ed. Fietcher, A., Springer. Berlin.
Karp, Gerald. (2008). Cell and Molecular Biology. (edisi kelima). Wiley.
Kato, et al. (1999). Analyses of microbial diversity in the sediment obtained from
Japan Trench at a depth of 7326 m and high pressure cultivation. Biology Molecular, 15, hlm. 47–52.
Keller, G. H & Mark M. M. (1989). DNA Probe. Macmilan: University Michgan.
Kennedy J, Marchesi JR, & Dobson ADW. (2008). Marine Metagenomics: Strategies for the Discovery of Novel Enzymes with Biotechnological Applications from Marine Environments. Microbial Cell Factories, 7 (27).
Kumar, C.G. & H. Tagaki. 1999. Microbial alkaline proteases from a bioindustrial viewpoint. Biotecnology Advance. 17, 561-594.
Lasa, I. & Berenguer, J. (1993). “Thermophilic Enzymes & Their Biotecnological
Potential”. Microbiologia. 9, (2), 77-89.S.
72
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Lederberg, J. & McCray, A.T. (2001). Ome Sweet ‘Omics—A Genealogical Treasury of Words. The Scientist,15 (7), hlm. 8.
Lewin, B. (2008). “Genes IX (dalam bahasa Inggris). Sudbury: Jones & Bartlett Publishers.
Linacero, R., J. Rueda & A.M.Vazquez. (1998). Quantification of DNA. Pages 18-21 in Karp, A., P. G. Isaac, and D. S. Ingram (Eds.) Molecular Tools for Screening Biodiversity: Plants and Animals. Chapman and Hall. London, Weinheim, New York, Tokyo, Melbourne, Madras.
Longo, M.A., I.S. Isabel, L.A. Gracia & M. Diaz. (1999). Comparison of B. Subtilis and S. Marcescens as pro tease producers under different operating conditions. Journal of Bioscience and Bioengineering. 88, 1, 35-40.
Mader S.S. (1993). Biology. Wm. C Brown Publishers: Lowa
Madigan, M.T., J. M. Martinko & J. Parker. (2000). “Biology of micro organisms”. 9th Ed. Prentice Hall International, Inc., New Jersey.
Mayende L, Wilhelmi BS, Pletschke BI. (2006). Cellulase (CMCase) and polyphenol oxidase from thermophilic Bacillus spp. Isolated from compost. Soil Biol Biochem 38, hlm. 2963-2966.
Middlebeek, E.J., R.O. Jenkins & J.S., & Drijver-de Haas. (1992). “Growth in batch culture. In Vitro Cultivation of Micro-organisms”. Biotechnology by Open Learning.
Milligan, B. G. (1992). “Plant DNA Isolation. In M. G. Murray & W.F.
Thomspon”. Molecular Genetic Analysis of Population.
Nam et al. (2004). Galaktosidase gene of Thermus thermophilus KNOUC 112
isolated from hot springs of a volcano area in New Zealand: identification of bacteria, cloning, & expression of the gene in Escherichia coli. J Anim Sci,
17, hlm. 1591-1598.
Nganro, N. R. (2010).”Habitat Komunitas Fauna Laut Dalam Hydrothermal Vent
(HV) & Non-HV di Perairan Sanghie-Talaud, Provinsi Sulawesi
Utara”.Laporan INDEX-SATAL, Bidang Karakterisasi Habitat. 1-20
Niehaus F, Bertoldo, Kahler M, & Antranikian G. (1999). Extremophiles as a source of novel enzymes for industrial application. Applied Microbiol Biotechnol. 51 (6), hlm. 711-729.
Ningrum, E. P. (2008). “Keragaman Gejala & Penyebab Penyakit Keriting
Kuning Cabai”. Fakultas Pertanian Universitas Gadjah Mada. Skripsi.(Tidak
Dipublikasikan)
73
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Nuroniyah, T. & Putra, S. R. (2012). Identifikasi Spesies Isolat Bakteri S1 dengan Metode Analisa Sekuen Fragmen Gen 16S rDNA. Jurnal Teknik POMITS,
1(1), hlm. 1-6
Nurwati, W. (2010). “Studi Karakteristik Panas Bumi Di Sepanjang Lintasan
Garut-Pangalengan Dengan Metode Magnetotelurik”. Skripsi pada Program Studi Fisika. UPI Bandung: tidak diterbitkan
Pasteur, N, G. Pasteur., F. Bonhomme., J. Catalan., J. Britton. & Davidian.,
(1988). “Practical Isozyme Genetics”. Laboratory of Ecological Ge-netic.
University of Montpellier 2. France: 54 pp.
Pelzar MJJr, & Chan ECS. (1986). “Dasar-Dasar Mikrobiologi”. Volume ke-1, 2, Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Pierce, B. (2002).”Genetics: A Conceptual Approach”. New Work: W. H.
Freeman Ltd.
Prasetyo, A. (2008). “Karakterisasi virus pada tanaman jarak pagar”. Fakultas
Pertanian Universitas Gadjah Mada. Skripsi.(Tidak Dipublikasikan).
Prayitno, E. & Nuryandani, E. (2011). Optimalisasi Ekstraksi DNA Jarak Pagar (Jatropha curcas) melalui Pemilihan Daun yang Sesuai. Bioteknologi. 8 (1),
hlm. 24-31. Diakses dari www.oalib.com/paper/2740162 [11 November 2014].
Purwantara, A. (2001). “Principles of DNA Isolation & Manipulation”. Workshop on Plant Pathogens Detection by Moleculae Tehniques. 24-26 Januari 2001.
Pratiwi, R. (2001). “Mengenal Metode Elektroforesis”. Oseana. 26, (1), 25-31.
Restiawaty, E., Pertiwi, W., Insani, N., Aryantha, I.N.P., & Natalia, D. (2013). Screening Bakteri untuk Biokonversi Limbah Biodiesel dari Diversitas Bakteri Indonesia. Seminar & Pameran Inovasi & Konstribusi Perempuan Peneliti ITB bagi Industri & Masyarakat. Bandung, Indonesia.
Retnoningrum, D. (2007). “Prinsip Teknologi DNA Rekombinan”. Sekolah Genomic Analysis of Microbial communities”.Annu. Rev. Genet. 38:525-553
Rismijana J., Indiani I.N., & Pitriyani T. (2002). Penggunaan selulase-hemiselulase pada proses deinking kertas koran bekas. J Mat Sains. 8, hlm.
74
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Sambrook J, Fritsch EF, & Maniatis T. (1989). “Molecular cloning: A laboratory manual”. USA: Cold Spring Harbor Lab ress.
Sambrook, J., & Russel. (2001). Molecular Cloning-A Laboratory Manual. New
York: Cold Spring Harbor Laboratory Press.
Sari W.W. (2008). Karakterisasi selulase bakteri asal tanah pertanian Jawa Tengah & Jawa Barat. (skripsi Institut Pertanian Bogor Suryo). (2005). “Genetika”.
Yogyakarta: Gadjah Mada University Press.
Suaidah, L. (2010). Analisis Variasi Genetik Osphronemus gouramy Lac Menggunakan Penanda RAPD. (Skripsi). Jurusan Pendidikan Biologi
FPMIPA Universitas Pendidikan Indonesia, Bandung.
Scearce, C. (2006). Hydrothermal Vent Communities. [Online]. Diakses dari
http://www.csa.com/discoveryguides/discoveryguides-main.php.
Schmeisser, C., Steele, H., Streit, W. R., 2007, Metagenomics: Biotechnology with Non-Culturable Microbes, J.Appl Microbiol Biotechnol., 75:955–962
Shortall C, & Hill C. (2008). Metagenomics. Applied Microbiology. hlm. 361–
366.
Sleator RD, Shortall C, and Hill C. (2008). Metagenomics. Applied Microbiology.
hlm. 361– 366.
Steele HL & Streit W R. (2005). Metagenomics: advances in ecology and biotechnology. FEMS Microbiol. Lett., 247, hlm. 105–111.
Suckale, J. (2009). DNA extraction with phenol chloroform. [Online]. Diakses
dari
http://openwetware.org/wiki/Image:DNA_extraction_w_phenol_chloroform .jpg
Sudarsono. (1996). “Retricsion Fragmen Length Polymorphism (RFLP)”. Institut Pertanian Bogor. Bogor.ta.
Suharsono & Widyastuti, U. (2006). “Penuntun Praktikum Pelatihan Teknik Pengklonan Gen”. Pusat Penelitian Sumber Daya Hayati & Bioteknologi. Institut Pertanian Bogor.
Surzycki, S. (2000). “Basic Techniques in Molecular Biology”. Spinger-Verlag.
Berlin. Heidelberg. New York. [Online]. Diakses dari
http://www.palmta.org/uploads/132561702960108human-Molecular-Biology-Manual.pdf
Suryo. (2005). Genetika. Yogyakarta: Gadjah Mada University Press.
Sutiamiharja, N. (2008). Isolasi Bakteri & Uji Aktivitas Amilase Kasar Termofilik
dari Sumber Air Panas Gurukinayan Karo Sumatra Utara. (Tesis).
75
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Toha, A.H.A. (2001). “Deoxyribo Nucleic Acid. Keanekaragaman, Ekspresi, Rekayasa & Efek pemanfaatnnya”. Bandung: Alfabeta.
Tayyab, M.(2010). “Isolation & identification of lipase producing thermophilic Geobacillus sp. SBS-4S: Cloning & characterization of the lipase“. Journal of Bioscience and Bioengineering. No. 3, 272–278.
Triarso, E, Troa, R.A., & Prihantono, J., (2010). “Laporan Akhir Kajian
Morfostruktur & Aktivitas Hidrotermal Bawah Laut Kawasan Perairan Sangihe-Talaud, Sulawesi Utara”. Puslitbang Sumberdaya Laut dan Pesisir-Badan Litbang KP, Kementrian Kelautan dan Perikanan (unpublish)
Troa, R.A., Permana, H, Sugiarta, w, Triarso, E, & Sulistio, E., (2011). “Gunung Api Bawah Laut Kawio Barat Perairan Sanghie Sulawesi Utara: aktivitas & Mineralisasi Hidrothermal. Puslitbang Sumberdaya Laut & Pesisir-Badan Litbang KP, Kementrian Kelautan & Perikanan (unpublish)
Uchiyama, T., & Miyazaki, K.. (2009). Functional Metagenomics for Enzyme Discovery: Challenges
Utari, I.B., Fitriani, A, & Hamdiyati, Y. (2011). “Identifikasi Bakteri Termofilik
Amilolitik dari Mata Air Panas Ciengang dan Gunung Darajat, Garut”. Seminar Nasional Jurusan Pendidikan Biologi UPI.
Van Dover, C. L. (2000). The Ecology of Deep-Sea Hydrothermal Vents.
Princeton University Press. 424 pp.
Verkuil, et al. (2008). Principles & Technical Aspects of PCR Amplification.
Berlin: Springer Science + Business Media.
Virna. (2010). “Rahasia 4 Ribu Meter di bawah Laut Sangihe”. [Online]. Diakses
dari http://www.antaranews.com/berita/213742/rahasia-4-ribu-meter-bawah-Opinion in Microbiology. 1: 271-277.
Widiastika, G. (2012). “Metode Uji Kualitatif DNA dengan Elektroforesis Gel
agarosa”.
[online].Tersedia:http://ditjenbun.deptan.go.id/bbp2tpsur/images/stories/per benihan/ujikuaitatifdna.pdf [15 Augustus 2014]
76
Meli, 2014
Isolasi DNA Genom Bakteri Termofilik Sumber Air Panas Ciengang, Kawah Darajat dan Hydrothermal Vent Kawio
Universitas Pendidikan Indonesia | repository.upi.edu | perpustakaan.upi.edu
Wilkins, T.A. & Smart, L.B..( 1996). “ Isolation of RNA from Plant Tissue. Di dalam: Krieg, P.A. (ed). A Laboratory Guide to RNA. Isolation, Analysis & Synthesis”. New York: Wiley – Liss.
Wyatt, S.D. & J. K. Brown. (1996). “Detection of Subgroup III Geminiviruses
Isolates in Leaf Extract by Degenerate Primer & Polymerase Chain
Reaction”. Phytopatologi. 86:12.1288-1293