TINGKAT KEMATANGAN OOSIT SAPI SECARA IN VITRO
SETELAH INKUBASI PADA KONDISI TEMPERATUR
DAN KOMPOSISI GAS CO2 BERBEDA
DWI WALID RETNAWATI
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
DWI WALID RETNAWATI. B04101130. Tingkat Kematangan Oosit Sapi Secara In Vitro Setelah Inkubasi pada Kondisi Temperatur dan Komposisi Gas CO2 Berbeda. Di bawah bimbingan MOHAMAD AGUS SETIADI Penelitian ini dilakukan untuk mengetahui potensi oosit dari ovarium sapi yang diperoleh dari Rumah Potong Hewan dan mengetahui keunggulan sistem inkubator Oxoid anaerob pada in vitro maturasi. Inkubator yang digunakan adalah inkubator CO2 dan inkubator Oxoid anaerob dengan berbagai tingkatan suhu
38.50C, 360C dan 290C. Media yang digunakan adalah Tissue Culture Medium 199. Proses pematangan dilakukan selama 23 jam pada setiap inkubator.
Oosit dikoleksi dengan cara slicing diikuti dengan flushing kemudian oosit yang terseleksi dibagi menjadi tiga kelompok perlakuan. Perlakuan pertama oosit dimatangkan pada inkubator CO2 temperatur 38.50C, perlakuan kedua pada
inkubator Oxoid anaerob temperatur 360C dan perlakuan ketiga pada inkubator Oxoid anaerob temperatur 290C. Setiap perlakuan dilakukan pengulangan sebanyak 5 kali.
Tingkat pematangan oosit dapat diamati pada derajat ekspansi sel-sel kumulus dan tingkat kematangan inti oosit. Derajat ekspansi sel-sel kumulus dan tingkat kematangan inti dianalisa menggunakan Rancangan Acak Lengkap yang dilanjutkan dengan uji Duncan, dengan selang kepercayaan 95% (á = 0.05). Hubungan antara derajat ekspansi 3 dan metafase II diuji dengan menggunakan Regresi Liniar Sederhana.
Hasil penelitian ini menunjukkan bahwa oosit yang dimatangkan pada perlakuan pertama, kedua dan ketiga menunjukkan hasil yang berbeda nyata (p<0.05) pada derajat ekspansi kumulus ke-3, dengan nilai berturut-turut adalah 62.60%, 51.00% dan 34.74%. Tingkat kematangan inti yang mencapai metafase II pada ketiga perlakuan secara berturut-turut yaitu 76.52%, 55.00% dan 10.53%, secara statistik berbeda nyata (p<0.05).
Penelitian ini dapat disimpulkan bahwa inkubator Oxoid pada temperatur 360C dapat dipakai untuk proses pematangan oosit meskipun hasilnya tidak optimal (55%) dibandingkan dengan inkubator standar. Proses pematangan oosit pada temperatur ekstrim di bawah temperatur tubuh normal menimbulkan efek yang tidak dikehendaki dan hanya sedikit oosit yang mampu menyelesaikan pembelahan meiosis sampai tahap metafase-II. Keeratan derajat ekspansi sel kumulus oosit dengan tingkat pematangan inti mempunyai derajat keeratan yang berbeda.
TINGKAT KEMATANGAN OOSIT SAPI SECARA IN VITRO
SETELAH INKUBASI PADA KONDISI TEMPERATUR
DAN KOMPOSISI GAS CO2 BERBEDA
DWI WALID RETNAWATI B04101130
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan Institut Pertanian Bogor
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
Berbeda
Nama : Dwi Walid Retnawati NRP : B04101130
Fakultas : Kedokteran Hewan
Menyetujui,
Dr. Drh. M. Agus Setiadi Pembimbing
Mengetahui,
Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
Dr. Drh. I Wayan Teguh Wibawan, MS Wakil Dekan I
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 10 Maret 1982 di Klaten, Jawa Tengah, sebagai anak kedua dari tiga bersaudara. Penulis merupakan putri dari ayah Walidi dan ibu Parjiati.
Pada tahun 1995, penulis lulus dari Sekolah Dasar Negeri Cawas II. Kemudian pada tahun 1998 penulis menyelesaikan pendidikan di Sekolah Menengah Pertama Negeri I Cawas. Selanjutnya penulis lulus dari Sekolah Lanjutan Tingkat Atas Negeri I Cawas pada tahun 2001. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor, Fakultas Kedokteran Hewan melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan, penulis aktif sebagai pengurus dalam Himpunan Minat Profesi Ornithologi dan Unggas periode 2002-2003. Pada tahun 2003-2004 penulis aktif juga sebagai anggota dalam Himpunan Minat Profesi Ruminansia. Penulis juga pernah magang di kebun binatang Gembira Loka Yogyakarta pada bulan maret 2002 dan Balai Pembibitan Ternak Unggul Sapi Perah Baturraden pada bulan agustus 2003.
Puji dan syukur Penulis panjatkan ke hadirat Allah SWT yang telah memberikan rahmat serta hidayah-Nya sehingga Penulis dapat menyelesaikan skripsi yang berjudul Tingkat Kematangan Oosit Sapi Secara In Vitro Setelah Inkubasi pada Kondisi Temperatur dan Komposisi Gas CO2 Berbeda. Pada
kesempatan ini penyusun ingin mengucapkan banyak terima kasih kepada berbagai pihak yang turut membantu dalam pelaksanaan penelitian dan penyusunan skripsi ini, khususnya kepada:
1. Dr. Drh. M. Agus Setiadi selaku Dosen Pembimbing Akademik dan dosen
pembimbing atas ketersediaan waktu dan kesabaran dalam memberikan bimbingan selama proses penulisan skripsi sehingga penulis dapat menyelesaikan dengan sebaik-baiknya.
2. Dr. Drh. Arief Boediono selaku dosen penilai dan penguji yang telah
memberikan kritik dan saran pada saat seminar dan sidang.
3. Bapak, Ibu, Mas Eka, Dek Marten, Mbak Aris dan keluarga besar Walid atas
segala doa dan kasih sayangnya.
4. Pihak RPH yang telah memberikan izin dan pegawai RPH yang membantu
penulis untuk mendapatkan ovarium.
5. Mbak Yulna, Mbak Herwin dan Teh Enci atas bantuan selama penelitian dan
mencari literatur.
6. Teman-temanku tercinta Kru Amanah dan Kost Arsida II; Ais, Mbak Fera,
Mbak Yuyun, Mbak Heni, Mbak Niar, Nophie, Nur, Dek Ama dan Pipit atas kebersamaannya selama ini.
7. GASTRO 38, atas kebersamaannya selama penulis menyelesaikan kuliah.
Penulis menyadari skripsi ini masih jauh dari sempurna. Walupun demikian, mudah-mudahan skripsi ini dapat memberikan manfaat bagi penulis dan pembaca sekalian. Amin.
Bogor, Februari 2006 Dwi Walid Retnawati
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan ... 2 Manfaat ... 2 TINJAUAN PUSTAKA ... 3 Ovarium ... 3 Oogenesis ... 4 Folikulogenesis ... 5
Perkembangan Oosit Secara In Vivo ... 7
Perkembangan Oosit Secara In Vitro ... 9
Peranan gas CO2 ... 11
Peranan temperatur ... 13
Ekspansi sel-sel kumulus ... 14
BAHAN DAN METODE ... 16
Tempat dan Waktu Penelitian ... 16
Bahan dan Alat ... 16
Prosedur Penelitian ... 16
Koleksi ovarium ... 16
Teknik koleksi oosit ... 17
Persiapan media ... 18
Pematangan oosit ... 18
Pengamatan tingkat pematangan oosit ... 18
Analisis Data ... 19
HASIL DAN PEMBAHASAN ... 20
Ekspansi Sel-sel Kumulus ... 20
Tingkat Pematangan Inti Oosit ... 23
Korelasi Ekspansi Kumulus dengan Metafase II ... 27
KESIMPULAN DAN SARAN ... 31
DAFTAR PUSTAKA ... 32
No. Teks Halaman 1. Derajat Ekspansi Sel-sel Kumulus Oosit Sapi... 21 2. Tingkat Pematangan Inti Oosit Sapi Setelah Maturasi In Vitro... 26
DAFTAR GAMBAR
No. Teks Halaman 1. Potongan ovarium mamalia ... 4 2. Pembelahan meiosis dan maturasi oosit ... 9 3. Inkubator Oxoid CO2 GenTM atmosphere general system ... 13 4. Oosityang termasuk dalam kriteria A dan B yang dipakai untuk
pematangan ... 17 5. Oosit sapi setelah pematangan in vitro ... 21
6. Status inti oosit setelah pematangan in vitro ... 24
7. Hubungan antara derajat ekspansi 3 dengan M-II pada inkubator
CO2 temperatur 38.50C ... 29
8. Hubungan antara derajat ekspansi 3 dengan M-II pada inkubator
Oxoid temperatur 360C ... 29 9. Hubungan antara derajat ekspansi 3 dengan M-II pada inkubator
No. Teks Halaman 1. Komposisi medium ... 38 2. Alat-alat ... 39 3. Analisa ragam dan uji lanjut Duncan untuk derajat ekspansi sel-sel
kumulus ... 40 4. Analisa ragam dan uji lanjut Duncan untuk tingkat pematangan oosit
PENDAHULUAN
Latar BelakangSebagai salah satu negara agraris yang subur dan kaya dalam bidang pertanian dan bidang peternakan yang dapat menunjang keberhasilan dan kemajuan pembangunan di Indonesia, maka pemerintah terus melakuakan usaha untuk melakukan populasi ternak. Untuk meningkatkan kontribusi daging sapi dalam memenuhi kebutuan konsumsi daging nasional perlu diupayakan pengembangan peternakan sapi dari pola tradisional menjadi suatu usaha komersial. Salah satu cara yang dapat dilakukan untuk meningkatkan produktifitasnya adalah melalui penerapan bioteknologi reproduksi.
Dengan kemajuan bioteknologi dibidang reproduksi, pemanfaatkan ovarium dari Rumah Potong Hewan (RPH) sebagai sumber sel gamet betina (oosit) melalui suatu rekayasa bioteknologi dapat dijadikan suatu produk yang sangat berharga berupa embrio. Ovarium mampu menyediakan oosit dalam jumlah banyak, sehingga menjadi alternatif untuk memproduksi embrio secara in vitro. Oosit yang akan dipergunakan untuk produksi embrio in vitro harus dimatangkan terlebih dahulu. Maturasi in vitro merupakan pematangan oosit di dalam suatu media atau di luar tubuh, tetapi dapat menghasilkan embrio baru seperti pematangan didalam tubuh (in vivo). Oosit dikatakan telah matang bila telah mencapai Metafase II (M-II) dan ditandai dengan pemekaran sel-sel kumulus yang mengelilingi oosit (Kazikova and Sirokin 1992 dalam Gordon 1994). Pada fase preovulasi, oosit dalam folikel mengalami deferensiasi yaitu terjadi proses pematangan oosit dengan pengertian terjadi perubahan inti (pematangan inti) disertai perubahan sitoplasma (pematangan sitoplasma). Sehingga ovum memperoleh kemampuan fertilisasi dan kapasitasi perkembangan embrional (Supriatna dan Pasaribu 1991). Fertilisasi in vitro merupakan suatu proses peleburan dari sel spermatozoa dengan ovum yang membentuk zigot di dalam suatu media.
Keberhasilan produksi embrio dipengaruhi oleh beberapa faktor, antara lain kualitas dari oosit itu sendiri (diameter 2-5 mm), media yang sesuai dengan kebutuhan, misalnya menggunakan medium Tissue Culture Medium 199 (TCM-199) yang diperkaya nutrisi untuk pertumbuhan oosit. Lingkungan yang
mendukung juga diperlukan, misalnya tekanan gas atmosfer, temperatur dan pH harus sesuai dengan lingkungan sebenarnya (in vivo).
Kendala yang dihadapi apabila oosit memerlukan waktu lama dan jauh dari laboratorium adalah tempat pematanggan oosit (inkubator) yang praktis, yang digunakan untuk pematanggan oosit agar tidak mengalami degenerasi sebelum diproses. Inkubator CO2 yang biasa digunakan dalam In Vitro Maturation (IVM)
sangat mahal dan mempunyai ukuran besar sehingga tidak memungkinkan dibawa kemana-mana. Beberapa usaha dibuat untuk memperbaiki sistem inkubator dengan mencoba alternatif baru menggunakan keunggulan dari inkubator anaerob yang lebih murah dan berukuran kecil sehingga mudah dibawa. Oleh karenanya penelitian dilakukan untuk mengamati perkembangan oosit pada inkubator anaerob pada temperatur yang mirip dengan proses in vitro normal maupun pada temperatur ruangan untuk membuktikan fleksibilitas inkubator.
Tujuan Penelitian ini dilakukan untuk :
1. Mengetahui potensi oosit dari ovarium sapi yang diperoleh dari RPH untuk
maturasi in vitro.
2. Mengetahui kemampuan sistem inkubator anaerob Oxoid yang
memungkinkan untuk proses maturasi oosit di luar laboratorium selama transportasi.
Manfaat Manfaat penelitian ini adalah:
1. Pemanfaatan ovarium dari Rumah Potong Hewan (RPH), untuk produksi
embrio in vitro.
2. Memberikan informasi, tekanan gas atmosfer dan temperatur yang baik untuk
maturasi in vitro.
3. Mengetahui proses perkembangan oosit secara in vivo dan in vitro pada sapi.
TINJAUAN PUSTAKA
OvariumOvarium adalah organ reproduksi primer (esensial) pada hewan betina, seperti halnya testes pada hewan jantan. Ovarium sebagai organ endokrin karena dapat menghasilkan hormon (estrogen dan progesteron) yang diserap langsung ke dalam peredaran darah dan sekaligus sebagai kelenjar eksokrin, yang dapat menghasilkan sel telur (Frandson 1992). Menurut Mc Clural et al. (1973) ovarium berbentuk oval yang terletak disebelah kaudal dari ginjal dan tergantung dalam rongga peritonium yang terbungkus bursa ovari. Ovarium terletak dekat dengan dinding tubuh dan tergantung ligamentum suspensorium yang dikenal dengan mesovarium.
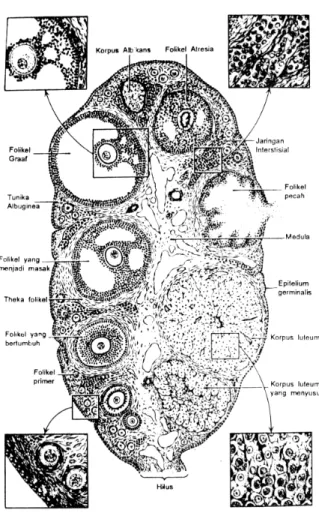
Oosit hanya bisa tumbuh dan mengalami pematangan lebih lanjut dalam ovarium bila oosit dikelilingi oleh sel-sel somatik. Proses ini dimulai sebelum lahir, ketika sel yang berasal dari epitelium menempatkan dirinya di sekeliling membrana oosit yang membatasi. Struktur oosit terbentuk ketika selapis sel berkembang secara lengkap disebut folikel primer kemudian menjadi folikel sekunder ketika sel-sel itu membelah menjadi beberapa lapis (Gambar 1). Dalam perkembangan selanjutnya, dengan terjadinya pembelahan sel lebih lanjut, sekresi dan akumulasi cairan mulai terjadi pada ruang antar sel dan bergabung secara berangsur-angsur, pulau-pulau cairan ini membentuk rongga atau antrum yang mengandung cairan folikel. Pembentukan antrum itu menandakan tercapainya stadium folikel tersier atau folikel de Graaf, tetapi hanya sebagian kecil folikel primer yang bisa mencapai stadium ini.
Pertumbuhan dan perkembangan folikel terbentuk sebelum pubertas, tetapi tidak mengalami pematangan dan ovulasi. Pematangan folikel pada umumnya terjadi selama estrus. Pada sapi dan kuda, satu folikel biasanya berkembang lebih cepat daripada yang lain sehingga pada setiap estrus hanya satu ovum yang dilepaskan. Hal ini juga didukung oleh Hafez (1987) bahwa jumlah folikel yang matang pada sapi antara 1 sampai 2 folikel dan folikel yang lain mengalami dengenerasi (Salisbury and Vandemark 1985). Menurut Toelihere (1993) diperkirakan jumlah bakal sel telur berkisar antara 75.000 pada sapi betina yang
baru lahir sampai 25.000 pada sapi betina tua (12 sampai 14 tahun). Jumlah oosit yang terdapat sawaktu lahir adalah beberapa kali lebih banyak daripada jumlahnya sawaktu pubertas. Banyak sekali oosit yang terbentuk tidak menjadi dewasa dan mengalami proses degenerasi secara normal. Proses degenerasi ini sering disebut atresia dan folikel yang berdegenerasi disebut folikel atretik (Salisbury and Vandemark 1985).
Gambar 1. Potongan ovarium mamalia (Hunter 1995).
Oogenesis
Oogenesis atau ovogenesis merupakan proses pembentukan oosit yang meliputi tiga tahap yaitu proliferasi, tumbuh dan menjadi dewasa (maturation) (Hardjopranjoto 1995). Proses ini bersamaan dengan proses pembentukan folikel
5
yang dikenal dengan folikulogenesis. Proliferasi adalah mitosis oogonium menjadi sejumlah oogonia di dalam ovarium yang terjadi pralahir sampai lahir atau beberapa saat pasca lahir dan oogonia akan berdiferensiasi menjadi oosit primer dengan inti pada profase I (tahap diploten) serta dikelilingi oleh epitel pipih yang disebut folikel primordial. Inti oosit pada tahap ini disebut dengan
Germinal Vesicle (GV) yang dicirikan dengan adanya membran inti yang utuh
dan nukleolus yang jelas.
Tahap tumbuh baru dimulai setelah hewan mencapai usia dewasa kelamin. Tahap tumbuh ini berupa pembesaran diameter oosit menjadi dua sampai tiga kali lipat dan ditandai dengan isi sitoplasma bertambah banyak oleh penambahan kuning telur, bertambahnya membran sel (zona pelusida) dan proliferasi sel-sel granulosa.
Tahap pematangan (maturation) oosit ditandai dengan perubahan pada morfologi inti selnya, yaitu perubahan dari fase diploten ke M-II II. Perubahan ini diikuti pula oleh peristiwa perpindahan kortek granula menuju ke perivetelin serta meningkatkan jumlah mitokondria. Beberapa membran inti mengadakan penyatuan dengan vesikel kemudian membran inti tersebut terlepas setelah beberapa saat Germinal Vesicle Break Down (GVBD). Pada saat hewan mencapai dewasa kelamin, oosit bertahan pada tahap diploten yang diperpanjang dengan adanya Folicle Stimulating Hormone (FSH) dan Luteinizing Hormone (LH), maka oosit akan berkembang ketahap selanjutnya sampai diovulasikan (Hafez and Hafez 2000).
Folikulogenesis
Folikulogenesis merupakan proses pertumbuhan dan perkembangan folikel yang terjadi di dalam ovarium. Proses pertumbuhan dan perkembangan folikel ini, dikontrol oleh interaksi antara hormon gonadotropin (FSH dan LH) dan faktor regulasi lokal di dalam ovarium (steroid, sitokinin dan foktor pertumbuhan). Faktor regulasi lokal dari ovarium berupa respon dan sensitifitas sel folikel terhadap gonadotropin, selain itu gonadotropin berperan dalam proliferasi folikel sampai folikel tersebut diovulasikan dari ovarium (Findlay et al. 1996). Selama proses folikulogenesis selain perkembangan inti terjadi penambahan kandungan
sitoplasma sel telur dengan meningkatnya jumlah sel organel seperti retikulum endoplasmik, ribosom, mitokondria, kortek granular dan akumulasi mRNA (Hyttel et al. 1997, Djuwita et al. 2000). Secara struktural pematangan sitoplasma sel telur digambarkan oleh sejumlah perpindahan dan transformasi organel, termasuk peningkatan jumlah kortek granula dan pergerakan sentrifugal (Sirard and Blondin 1996). Sedang menurut Hafez (1987) di dalam proses pertumbuhan terdapat proses maturasi folikel yang merupakan serangkaian transformasi subseluler dan molekul dari komponen folikel yang meliputi oosit, sel granulosa dan sel teka. Awal pertumbuhan folikel dimulai dari pembentukan cadangan folikel primordial selama kehidupan janin. Folikel primordial akan tumbuh secara terus menerus untuk diovulasikan selama masa hidup hewan hingga cadangan folikel habis.
Dua kemungkinan yang dapat terjadi dari pertumbuhan folikel primordial (cadangan) adalah pertama, folikel dapat mengovulasikan sel telur dan kedua, folikel akan mengalami atresia atau degenerasi. Dimulai setelah hewan mamalia mengalami pubertas, pertumbuhan lebih lanjut dari folikel hanya akan dirangsang oleh gonadotropin. Kunci dari folikulogenesis adalah terletak dari kemampuan masing-masing sel folikel untuk merespon gonadotropin. Bentuk ekspansi responsif ini ditunjukkan lewat ketepatan reseptor sel telur atau folikel dan maturasi dari sistem tranduksi signal pro-reseptor. Reseptor sel telur yang dimaksud adalah granulosa dari folikel preantral yang berfungsi sebagai penyalur FSH, tanpa sifat tersebut maka folikel akan menjadi atretik (Findlay et al. 1996).
Crozet et al. (1995) mengelompokan folikel berdasarkan ukuran diameternya menjadi tiga kelompok. Ketiga kelompok folikel tersebut adalah folikel ukuran kecil (2-3 mm), folikel ukuran sedang (3.1-5 mm) dan folikel ukuran besar (>5 mm). Sementara itu Findlay et al. (1996) mengklasifikasikan folikel berdasarkan tingkat ketergantungan dan sensitifitasnya terhadap gonadotropin. Klasifikasi tersebut dibagi lima kelompok yaitu folikel primordial, folikel yang mengalami pertumbuhan (folikel preantral dan folikel antral), folikel ovulatori dan folikel yang atresia. Pada folikel primordial laju atresia yang terjadi pada folikel ini sangat kecil. Sedang folikel preantral dan folikel antral pada awal pertumbuhannya sangat responsif sehingga cenderung tergantung pada
7
gonadotropin. Bentuk sensitifitasnya yang terjadi adalah apabila stimulasi gonadotropin (LH) tidak tepat maka folikel akan mengalami atresia.
Perkembangan Oosit Secara In Vivo
Hewan betina tidak hanya menghasilkan sel-sel kelamin betina yang penting untuk membentuk suatu individu baru, tetapi juga menyediakan lingkungan dimana individu tersebut terbentuk, makanan dan perkembangan selama masa permulaan hidupnya (Toelehere 1993). Sel telur merupakan sel kelamin betina yang dilapisi oleh sel kumulus, zona pelusida dan selaput vitelin menurut Frandson (1992).
Pematangan sel telur terjadi selama perkembangan folikel (folikulogenesis) di dalam ovarium yang meliputi pematangan sitoplasma dan pematangan inti. Pematangan sitoplasma meliputi penambahan butir-butir kuning telur di dalam sitoplasma, pembentukan selubung pelusida, serta pembentukan kortek granula (Djuwita et al. 2000). Oosit telah mencapai pematangan yang maksimal dan siap mengalami fertilisasi jika telah mencapai tahap M-II pada proses pembelahan secara meiosis yang ditandai dengan pecahnya stadium inti atau Germinal Vesicle
Breakdown (GVBD), nucleolus menghilang dan badan kutub I telah terbentuk
(Tsafriri 1985). Sedangkan sel kumulus yang mengelilingi oosit akan mengalami pemekaran dan warnanya akan cerah (Moltik dan Fulka 1976). Menurut Setiadi (1999) pematangan sitoplasma dinilai berdasarkan kemampuan oosit mengalami perkembangan embrio dini.
Kemampuan inti oosit untuk membelah secara meiosis selama proses maturasi oosit sangat tergantung pada stimulasi hormonal terhadap oosit yang berkumulus kompak. Analisa mekanisme rangsangan hormonal terhadap pembelahan meiosis tidak terlepas dari peran gonadotropin, steroid, siklus AMP, sintesa makromolekul dan energi metabolisme folikuler (Tsafriri 1985).
Menurut Sirard and Blondin (1996), lima faktor yang sangat berkompeten dalam keberhasilan pematangan oosit adalah morfologi kumulus, ukuran folikel, kesehatan folikel, stimulasi ovarium dan prosedur pematangan oosit sebelum dimulainya inkubasi. Laju proses maturasi oosit sapi, domba dan babi relatif lambat karena membutuhkan waktu untuk sintesa protein aktif untuk persiapan
permulaan meiosis. Lebih lanjut pendapat Sirard and Blondin (1996) pada sapi proses maturasi inti secara in vivo membutuhkan waktu selama kurang lebih 24 jam. Selama maturasi, inti oosit sapi yang masuk tahap profase pada awal meiosis I mengalami pengurangan komplemen kromosom menjadi haploid (n=30 kromosom). Pada tahap molekuler, di dalam oosit mengalami banyak interaksi antara siklus molekuler dengan substrat target pada inti dan sitoplasma (Gordon 1994).
Proses pematangan inti dimulai dengan penghilangan membran nuklear yang dikenal GVBD, penghilangan nukleoli dan kondensasi kromosom. Maturasi oosit rendah membutuhkan sintesis protein yang aktif untuk awal pembelahan meiosis. Pada rodensia dan kelinci tidak membutuhkan karena oosit rodensia dan kelinci mempunyai protein esensial lengkap yang penting untuk kondensasi kromatin dan nukleolus. Sebelum meiosis I, oosit babi, domba dan sapi dilengkapi protein hanya untuk kondensasi kromatin, sedangkan protein untuk GVBD disintesis pada waktu setelah meiosis I (Simon et al. 1989 dalam Gordon 1994).
Dengan terjadinya GVBD, kromosom memadat menjadi kompak. Sentromer (daerah khusus untuk sitoplasma padat) terbagi menjadi dua sentriol yang dikelilingi oleh aster. Aster-aster tersebut memisah dan spindel terbentuk diantaranya. Kromosom dalam pasangan diploid bebas dalam sitoplasma dan tersusun dalam bidang equator dengan benang spindel.
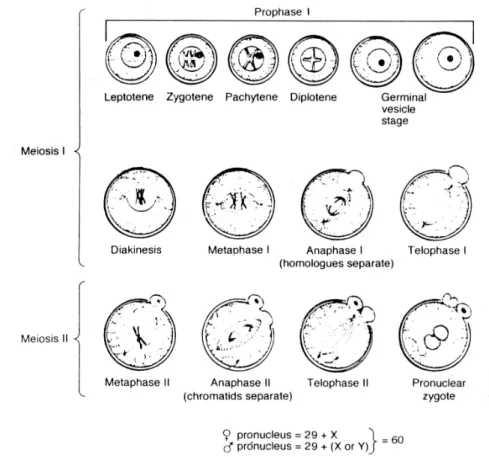
Pembelahan meiosis secara berturut-turut akan melewati tahap Diakinase (awal pemisahan dan kondensasi pasangan kromosom), Metafase (semua kromosom berada pada pusat pembelahan), Anafase (pemisahan masing-masing kromosom sepanjang pusat pembelahan spindel) dan Telofase (pembagian kromosom selesai). Oosit primer mengalami dua tahap meiosis. Pada tahap pertama, terbentuk dua anak sel. Satu diantaranya mengandung banyak sitoplasma yang disebut dengan Polar Bodi I sedangkan sel anak lainnya hanya mengandung sedikat sitoplasma (Gambar 2). Setelah terjadi penambahan kromosom, Polar Bodi I akan berisi bermacam-macam organel termasuk mitokondria, ribosom dan kortek granular. Perkembangan pada telofase tahap meiosis I hingga mengeluarkan polar bodi pertama mengakibatkan bahwa satu kelompok
9
kromosom dikeluarakan pada ruang perivitelin, sementara kelompok lain berada dalam sitoplasma oosit.
Gambar 2. Pembelahan meiosis dan maturasi oosit (Gordon 1994). Sel telur itu kemudian disebut oosit sekunder dan kromosom vitelin kembali ke formasi spindel pada tahap meiosis II. Tahap meiosis II dimulai sampai M-II, tetapi proses ini tidak berlanjut jika tidak terjadi penetrasi sperma atau oosit tidak aktif. Akhir dari tahapan meiosis II dibarengi dengan pengeluaran polar bodi II ke ruang perivitelin. Oosit pada tahap meiosis II hanya memiliki sejumlah kromosom haploid. Pada saat itu oosit berada pada tahap pembelahan profase I, tepatnya tahap dictyate (fase istirahat) proses pembelahan meiosis pada oosit dilanjutkan kembali setelah individu hewan mengalami pubertas.
Perkembangan Oosit Secara In Vitro
Pematangan oosit diluar ovarium atau tubuh hewan disebut dengan pematangan in vitro atau In Vitro Maturation (IVM). Pematangan in vitro
merupakan salah satu tahap yang penting dari rangkaian produksi embrio in vitro. Oosit untuk memproduksi embrio in vitro dapat diperoleh dari ovarium hewan betina yang masih hidup maupun ovarium hewan betina mati dari Rumah Potong Hewan (RPH) dengan tanpa memperhatikan fase siklus birahi (Ball et al. 1984). Pematangan in vitro membantu oosit agar mampu menyelesaikan proses meiosis sehingga bersifat haploid (setengah komponen kromosom) dan mampu mengalami fertilisasi (First et al. 1989). Pada in vivo, pematangan oosit terjadi selama perkembangan folikel di dalam ovarium yang meliputi pematangan sitoplasma dan pematangan inti. Kemudian oosit tersebut akan mengalami pematangan sampai metafase I (M-I) dan M-II dalam media kultur (Hunter 1995). Selama maturasi oosit sapi, struktur kromatin dalam oosit yang belum matang (immature) berupa membran nuklear utuh (GV) dimulai dari pembelahan meiosis pertama dilanjutkan dengan pembelahan meiosis kedua. Menurut Lu (1988) menunjukkan bahwa 90% dari oosit sapi mengalami pematangan pada 24 jam setelah dilakukan kultur. Dari penelitian tersebut terlihat membran nuklear menghilang setelah 5-6 jam GVBD dan M-I dicapai setelah 12 jam dan M-II dicapai setelah 19 jam (Gordon 1994). Diperkirakan pematangan inti tersebut lebih cepat pada in vitro daripada in vivo menurut Gordon (1994).
Kesempurnaan pematangan sel telur sangat berpengaruh terhadap keberhasilan fertilisasi. Pada proses pematangan sel telur secara in vitro dipengaruhi oleh faktor diantaranya medium pematangan dan lingkungan penyimpanan (inkubator). Medium standar untuk pematangan in vitro sel telur sapi adalah TCM-199. Agar menunjang keberhasilan proses maturasi in vitro dilakukan inovasi komposisi dan penambahan suplemen untuk mendapatkan kondisi medium yang optimal. Suplemen seperti serum, hormon estradiol, hormon gonadotropin (FSH dan LH), mineral, glukosa, piruvat dan asam amino ditambahkan untuk membantu transformasi inti (Sirard and Blondin 1996). Penambahan serum pada media akan memicu tingkat perkembangan oosit secara
in vitro. Serum yang sering digunakan antara lain Bovine Serum Albumin (BSA), Fetal Calf Serum (FCS), Fetal Bovine Serum (FBS). Tang et al. (1995)
mengungkapkan, media pematangan tanpa serum menyebabkan produksi blastosis yang lebih lambat. Disamping itu pada media yang disuplemasikan dengan serum,
11
perkembangan oosit lebih baik dibandingkan medium tanpa serum (Setiadi 1999). Menurut Rexroat dan Powell (1985) dalam Gordon (1994) oosit domba yang dikultur pada medium TCM-199 yang disuplemasikan dengan Fetal Bovine
Serum (FBS) ternyata mengalami perkembangan embrio lebih baik dibandingkan
dengan oosit yang dikultur pada TCM-199 tanpa serum. Penambahan kombinasi antara Pregnant Mare Serum Gonadotropin (PMSG) dan Human Chorionic
Gonadotropin (hCG), PMSG dan estradiol atau hCG dan estradiol pada media
akan menghasilkan ekspansi kumulus yang maksimal. Peranan gas CO2
Inkubator CO2 diperlukan untuk mempertahankan media sehingga
menyediakan lingkungan yang cocok untuk pematangan oosit. Inkubator CO2
standar dapat menghasilkan CO2 5% dan O2 20%, sedangkan inkubator Oxoid CO2 GenTM atmosphere general system dapat menghasilkan CO2 6% dan O2 15%
(Avery et al. 2000). Tekanan atmosfer CO2 5% diperlukan untuk memelihara
ketepatan pH pada sistem media kultur buffer bikarbonat. Tekanan atmosfer CO2
5% ini untuk mempertahankan pH fisiologis yaitu tepat dibawah 7.5. Keseimbangan pH ini dipengaruhi oleh temperatur, tekanan atmosfer dan beberapa laboratorium yang menggunakan CO2 6% dalam inkubatornya (Dale
and Elder 1998). Hal ini juga didukung oleh Rijnders et al. (1996) bahwa kandungan gas CO2 5% dan O2 20% dalam inkubator akan mempertahankan pH
medium agar tetap stabil.
Menurut pendapat Voelkel and Hu (1992) bahwa komposisi gas atmosfer pada konsentrasi O2 20% dan CO2 5% lebih baik daripada konsentrasi O2 5%,
CO2 5% dan Nitrogen (N2) 90% untuk perkembangan embrio in vitro dan
kemampuan produksi embrio in vitro. Hal ini dikarenakan lebih banyak pemakaian O2 pada awal perkembangan in vitro akan lebih baik, O2 digunakan
untuk oksidasi piruvat dan glukosa. Tetapi setelah thawing, tingkat kelangsungan hidup embrio juga dipengaruhi oleh tekanan gas atmosfer yang digunakan pada waktu kultur. Embrio yang dikultur pada konsentrasi O2 5% dapat bertahan pada
kondisi beku pada tingkat yang lebih tinggi daripada embrio pada konsentrasi O2
pada O2 5% dan CO2 5% menjadi tekanan gas atmosfer yang baik (optimum)
untuk memproduksi embrio babi pada medium N (modifikasi dari NCSU-23). Perkembangan embrio pada medium N juga tergantung pada CO2/pH. Tinggi
rendahnya konsentrasi CO2 dapat menghambat perkembangan embrio babi
(Berthelot and Terqui 1996).
Pada inkubator CO2 dilengkapi dengan pengatur kelembapan udarayang di
bagian bawah alat tersebut diisi dengan air supaya terjadi evaporasi air sehingga dapat mencapai kelembapan 80% atau lebih. Ada juga inkubator yang aktifitas airnya diatur oleh udara dan dapat memelihara 90% kelembapan relatif yang stabil. Kadang-kadang kelembapan dapat terganggu dengan sering dibukanya inkubator tersebut. Inkubator digunakan untuk menjaga kestabilan medium, tekanan gas dan juga untuk mencampur karbondiksida dengan udara luar (Avery
et al. 2000).
Inkubator anaerob OxoidTM merupakan inkubator mini yang terbuat dari alumunium atau plastik mika yang kedap udara. Anaerob OxoidTM polycarbonate
2.5 L (AG25) dan sachet CO2 GenTM (CD025A) yang berisi asam askorbik yang
diproduksi oleh Oxoid. Inkubator ini menghasilkan CO2 6% dan O2 15% (Avery et al. 2000). Sachet CO2 GenTM dirancang untuk digunakan pada tabung bervolume 2.5 L yang dapat menjadi aktif jika berhubungan dengan udara. Reaksi asam askorbik dengan oksigen adalah eksotermik, tetapi suhu yang dihasilkan tidak lebih dari 650C. Hasil penelitian Avery et al. (2000) menyebutkan bahwa
reaksi eksotermik yang ditimbulkan bersifat lokal dan tidak mempengaruhi temperatur rata-rata di dalam tabung. Lebih lanjut hasil percobaan pengukuran media sebelum dan sesudah 24 jam inkubasi menunjukkkan kisaran temperatur 30-450C. Pada proses kultur oosit atau embrio dimasukkan pada inkubator anaerob kemudian sachet CO2 GenTM dibuka dan dimasukkan pada inkubator
yang temperaturnya diatur. Disegel dengan keempat klips ditutup sehingga rapat dan aman. Penutupan klip menyebabkan tekanan positif sehingga terjadi kedap udara. Meskipun demikian tidak ada informasi berapa lama diperlukan gas atmosfer di dalam tabung menjadi terequilibrasi.
13
Gambar 3. Inkubator Oxoid CO2 GenTM atmosphere general system.
Peranan temperatur
Sejak tahun 1980-an, penelitian IVM ternak dilakukan pada temperatur 370C. Temperatur ini mendekati temperatur rata-rata tubuh yaitu 38 – 39.30C. Perubahan temperatur pada tahap pembelahan awal dapat mengganggu perkembangan in vitro embrio tahap berikutnya. Zygot tikus pada temperatur ruang dapat menghambat proses pembelahan dan mengurangi perkembangan pada tahap blastosis. Pada tahap pembelahan embrio kelinci pada temperatur ruang juga dapat mengurangi proses pembelahan. Sedangkan oosit mamalia pada temperatur ruang dapat menyebabkan kerusakan spindel meiotik (Trounser and Gardner 2000).
Menurut Lenz et al. (1983), pada penelitian pertamanya tentang efek temperatur pada IVM dan In Vitro Fertilisation (IVF) ternak menunjukkan bahwa maturasi tidak mengalami shock pada rentang temperatur 35 – 390C. Pada IVF membutuhkan temperatur yang lebih tinggi dari pada IVM. Fertilisasi secara in
vitro tertinggi dicapai pada temperatur 390C bila dibandingkan dengan temperatur
35, 37 dan 410C. Penelitian IVM ternak pada tahap meiosis mempunyai toleransi temperatur kultur yang relatif tinggi tetapi tidak sampai 50C dibawah temperatur badan. Temperatur 350C dianggap sebagai temperatur minimal maturasi in vitro (Katska and Smorang 1985 dalam Gordon 1994). Menurut Gordon (1994),
temperatur optimal pada IVM adalah 38 – 390C dan temperatur optimal pada IVF adalah 390C.
Ekspansi sel-sel kumulus
Sel-sel kumulus berperan penting di dalam pematangan oosit. Apabila sel-sel kumulus dilepaskan sebelum dikultur, maka akan terjadi kelambatan dalam pematangan oosit atau bahkan tidak terjadi pematangan. Oosit yang mempunyai kumulus lengkap menunjukkan perkembangan yang lebih baik apabila dibandingkan dengan oosit yang telah dihilangkan sel–sel kumulusnya (Younis
et al.1989).
Kualitas sel telur dan kualitas folikel mempengaruhi tingkat pematangan in
vitro sel telur. Selama pematangan secara in vitro keberadaan sel kumulus yang
mengelilingi sel telur sangat membantu pematangan sel telur sapi sampai pada perkembangan embrio tahap blastosis (Hawk et al. 1992, Boediono dan Suzuki 1996). Ini dikarenakan sel kumulus berfungsi menyediakan nutrisi untuk sel telur salama perkembangan dan membantu sintesis protein untuk pembentukan zona pelusida. Menurut Sirard and Blondin (1996) sel telur yang berasal dari folikel dominan mempunyai potensi yang lebih besar untuk berkembang menjadi embrio karena mampu mengalami pematangan inti dan sitoplasma pada maturasi in vitro. Menurut Zhang et al. (1995), sel-sel kumulus yang melekat pada zona pelusida berperan dalam pemeliharaan komunikasi intraseluler serta mengatur pertumbuhan oosit dan maturasi dengan memfasilitasi dalam proses metabolisme hormonal serta transformasi nutrisi. Sel kumulus merupakan alat spesifik dalam mekanisme tranduksi untuk transfer sinyal gonadotropin ke oosit melalui sistem
gap juction. Hal ini didukung oleh Boediono dan Suzuki (1996), bahwa gap junction tersebut merupakan jalan lintas nutrisi untuk oosit.
Selama proses pematangan oosit, hubungan antara individu sel kumulus dan hubungan antara sel kumulus dengan oosit akan terputus. Terputusnya hubungan ini dimulai dengan adanya perenggangan disebabkan oleh faktor-faktor pematangan oosit dan sel-sel kumulus yang terekspansi. Terputusnya hubungan tersebut menyebabkan gap junction dengan cepat menurun jumlahnya sehingga akses penghambatan berlangsungnya meiosis berkurang drastis serta terjadinya
15
deposisi matrik asam hyaluronat diantara sel-sel kumulus (Eppig 1980) dan ekspansi atau aktivitas sel-sel kumulus dapat diamati secara mikroskopik. Oleh karena itu, terjadinya ekspansi sel-sel kumulus dapat dijadikan sebagai indikasi yang kuat untuk pematangan oosit sebab hanya oosit dengan sel-sel kumulus aktif yang dapat difertilisasi in vitro.
Pendapat Brackett dan Zuelke (1993), bahwa komposisi media pada proses
in vitro menentukan terjadinya pemekaran sel-sel kumulus. Adanya piruvat,
glutamin dan glukosa dalam medium pematangan dapat meningkatkan ketersediaan sumber energi yang digunakan dalam proses metabolisme oksidatif mitokondria. Metabolisme glukosa dan glutamin lebih tinggi pada kumulus yang lengkap dibanding dengan oosit tanpa kumulus. Aktivitas glikolitik tidak ada yang teramati dalam oosit tanpa sel kumulus setelah proses pematangan oosit. Aktivitas siklus tricarboxylic acid (TCA) dapat ditingkatkan dengan penambahan hormon LH dalam medium pematangan oosit, yang ditandai dengan meningkatnya metabolisme glutamin dalam siklus TCA.
Glukosa dan glutamin merupakan substrat asam hyaluronat yang perlu ditambahkan pada medium selain hormon gonadotropin dan serum, yang dapat menginduksi terjadinya pemekaran sel-sel kumulus secara in vitro. Hormon gonadotropin akan menstimulir sel-sel kumulus untuk memproduksi dan mensekresikan asam hyaluronat. Hormon gonadotropin ini akan aktif dalam kondisi in vitro jika ada serum dalam medium yang dapat merangsang asam hyaluronat dan terjadinya pemekaran sel-sel kumulus yang optimal. Dalam hal ini serum diduga berperan menstabilkan asam hyaluronat dalam bahan ekstraseluler kumulus sel (Setiadi 2001).
Menurut Eppig et al. (1980), ekspansi sel-sel kumulus bertepatan dengan terjadinya pembelahan meiosis. Sel-sel yang berkembang (ekspansi) berperan dalam menciptakan lingkungan mikro untuk oosit dengan cara meningkatkan aktivitas metabolisme kebutuhan makanan oosit. Ekspansi ini disebabkan oleh adanya asam hyaluronat yang dihasilkan oleh sel-sel kumulus. Asam hyaluronat yang dihasilkan berfungsi juga untuk menginduksi reaksi akrosom spermatozoa (Rutledge et al. 1997).
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di laboratorium Fertilisasi In Vitro (FIV). Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian ini berlangsung selama 8 bulan dimulai pada bulan Januari sampai bulan Agustus 2004.
Bahan dan Alat
Oosit yang digunakan diambil dari folikel antral dan diperoleh dari ovarium tanpa memperhatikan fase siklus birahi yang diambil dari Rumah Potong Hewan, Fakultas Peternakan, Institut Pertanian Bogor. Berbagai macam bahan kimia dan alat laboratorium yang digunakan selama penelitian ini dapat dilihat pada Lampiran 1 dan 2.
Prosedur Penelitian
Adapun kegiatan penelitian meliputi 5 tahap kegiatan, yaitu koleksi ovarium, teknik dan koleksi oosit, persiapan media, pematangan oosit serta pengamatan derajat ekspansi sel-sel kumulus dan tingkat pematangan inti oosit.
Koleksi ovarium
Ovarium diambil dalam keadaan masih segar setelah sapi dipotong dari Rumah Potong Hewan, Fakultas Peternakan, Institut Pertanian Bogor. Ovarium yang diperoleh kemudian disimpan dalam termos atau kantong plastik yang berisi larutan NaCl fisiologis (0.9 % w/v, Sigma, USA) pada suhu 27-300C. Kemudian
dibawa ke laboratorium yang jaraknya tidak jauh dari RPH. Sebelum oosit dikoleksi, ovarium dicuci dengan NaCl fisiologis beberapa kali dan dibersihkan dari bagian organ reproduksi lainnya yang masih menempel dengan menggunakan gunting. Selanjutnya ovarium disimpan dalam gelas ukur yang berisi NaCl fisiologis sampai terendam selama proses seleksi.
17
Teknik koleksi oosit
Oosit dikoleksi dari folikel dengan diameter 2-5 mm dengan cara menyayat folikel yang ada dipermukaan ovarium sehingga cairan folikel keluar. Dengan keluarnya cairan folikel diharapkan oosit juga ikut keluar. Cairan ini ditampung dalam beker glass, selanjutnya dilakukan pembilasan (flushing) dengan penyemprotan NaCl fisiologis 0.9% menggunakan syringe ke dalam folikel bekas sayatan.
Cairan yang tertampung diamati dibawah mikroskop. Oosit diambil satu persatu dengan menggunakan pipet pasteur dan ditampung dalam cawan petri yang berisi media Phosphate Buffered Saline (PBS; Sigma, USA) dan mengandung Fetal Bovine Serume (FBS; Gibco, Grand Island, NY, USA) 10% (v/v). Setelah oosit terkumpul kemudian dicuci sebanyak 3 kali dengan medium PBS yang disuspensi serum 10%. Oosit diseleksi berdasarkan kondisi sitoplasma yang homogen dan jumlah lapisan sel-sel kumulus yang mengelilingi oosit. Oosit dikelompokkan menjadi 3 kategori berdasarkan Shin et al. (2001), yaitu:
- Kategori A, oosit yang dikelilingi oleh sel-sel kumulus yang banyak
(lebih dari 3 lapis) dan kompak dengan ooplasma yang homogen. - Kategori B, hanya sebagian oosit yang dilapisi oleh sel-sel kumulus atau
hanya dikelilingi oleh kurang dari 3 lapis sel-sel kumulus dengan ooplasma yang homogen.
- Kategori C, oosit tidak dilapisi oleh sel-sel kumulus atau oosit yang
dikelilingi oleh sel-sel kumulus yang sangat sedikit.
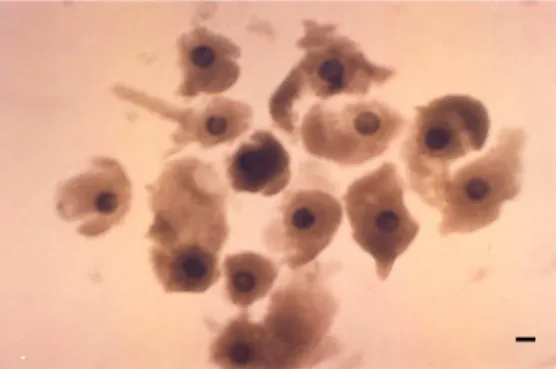
Pada penelitian ini oosit yang digunakan untuk pematangan adalah oosit yang termasuk dalam kriteria A dan B (Gambar 4).
Gambar 4. Oosit yang termasuk dalam kriteria A dan B yang dipakai untuk pematangan. Bar = 100 µµm.
Persiapan media
Media pematangan yang digunakan dalam penelitian ini adalah TCM-199 (Sigma, USA) disuplementasi dengan FBS 10%, Folligon (Intervet, Holland) 10
IU/ml, Chorullon (Intervet, Holland) 10 IU/ml dan 17β-estradiol (Intervet,
Holland) 1µg/ml. Oosit hasil koleksi terlebih dahulu dalam medium PBS yang
ditambah dengan FBS 10% dan TCM-199 masing-masing sebanyak 3 kali. Pematangan oosit
Oosit yang terseleksi dan telah melalui 3 kali pencucian dengan beberapa media, dimatangkan dalam media pematangan yang telah diequilibrasi dalam inkubator CO2 5% dengan temperatur 38.50C. Perlakuan pertama pada penelitian
ini, oosit dimatangkan dalam inkubator Heraous CO2 5% dengan temperatur
38.50C. Perlakuan kedua, oosit dimatangkan dalam inkubator Oxoid anaerob dengan temperatur 360C. Perlakuan ketiga, oosit dimatangkan dalam inkubator
Oxoid anaerob dengan temperatur kamar (290C). Oosit dimatangkan dalam medium sejumlah 15-25 oosit. Pematangan dilakukan dengan media yang sama yaitu TCM-199 selama kira-kira 23 jam dan setiap percobaan dilakukan sebanyak 5 kali ulangan.
Pengamatan tingkat pematangan oosit 1. Derajat ekspansi
Oosit yang telah diinkubasi, diamati dibawah mikroskop stereo. Ekspansi sel-sel kumulus dapat dilihat dengan adanya pemekaran atau peregangan antara sel-sel kumulus. Derajat ekspansi sel-sel kumulus diamati berdasarkan kriteria sebagai berikut :
- Derajat 1 : sel-sel kumulus tidak ekspansi.
- Derajat 2 : sel-sel kumulus terekspansi sebagian.
- Derajat 3 : sel-sel kumulus terekspansi sempurna.
2. Pematangan inti oosit
Oosit yang telah dimaturasi, dibersihkan dari sel-sel kumulusnya (denudase) dengan cara menyedot berulang-ulang menggunakan pipet pasteur yang mempunyai diameter sesuai dengan besarnya oosit pada media yang diberi asam
19
hyaluronat (Sigma, USA) 0.25%. Oosit yang telah dibersihkan diletakkan pada
cover glass yang telah diberi KCl 0.09%. Keempat ujung cover glass diberi
vaselin kemudian ditutup dengan object glass secara hati-hati.
Preparat oosit yang telah jadi, difiksasi pada ethanol dan asetat dengan perbandingan 3:1 selama 3-4 hari pada temperatur kamar. Setelah difiksasi preparat diletakkan pada ethanol selama 2-3 jam. Kemudian preparat dikeringkan dengan menggunakan tissue sebelum diwarnai dengan aceto orcein 2% selama kurang lebih 5 menit. Pewarna dicuci dengan menggunakan asam asetat 25% sampai bersih. Kemudian keempat sisi cover glass diberi kutek bening dan diamati dibawah mikroskop fase kontras.
Evaluasi dilakukan terhadap tingkat pematangan inti oosit. Pengamatan tingkat pematangan inti oosit dilakukan dengan menghitung jumlah oosit pada setiap tahap perkembangan meiosis, meliputi tahap GV ditandai dengan adanya membran inti dan nukleolus terlihat jelas ditepi, GVBD ditandai dengan robeknya membran inti sehingga nukleolus tidak terlihat jelas, M-I ditandai dengan adanya kromosom homolog yang berpasangan dan berderet di bidang equator, Anafase I (A-I) ditandai dengan sentromer menuju kedua kutub yang berlawanan, kromosom homolog tertarik menjadi dua bagian, Telofase I (T-I) ditandai dengan kromosom homolog terkumpul secara sempurna pada masing-masing kutub. Pada tahap M-II dicirikan adanya badan kutub I dan susunan kromosom yang sama dengan tahap M-I.
Analisis Data
Derajat ekspansi sel-sel kumulus dan tingkat kematangan inti oosit pada ketiga inkubator, dianalisis menggunakan Rancangan Acak Lengkap (RAL) dengan 3 perlakuan dan 5 ulangan (Lampiran 3), kemudian dilanjutkan dengan uji
Duncan, dengan selang kepercayaan 95% (á = 0.05) (Lampiran 4). Korelasi antara
Ekspansi Sel-sel Kumulus
Pada penelitian ini hanya oosit yang mempunyai kumulus kompleks (kategori A dan B), yang digunakan dalam proses pematangan in vitro (Gambar 4). Menurut Loos et al. (1989) bahwa oosit yang termasuk baik adalah sel kumulus kompak, berlapis-lapis dan rapat, ooplasma yang homogen, COC (Cumulus Oocyte Complexe) total terang dan trasparan. Keberadaan sel kumulus mendukung terjadinya pematangan oosit secara in vitro sampai tahap M-II dan berkaitan dengan pematangan sitoplasma menurut Lapthitis et al. (2002). Hal tersebut didukung oleh Schroeter and Meinecke (1995) bahwa saat pematangan in
vivo, sel-sel kumulus berperan dalam menyediakan nutrisi untuk oosit dan membantu sintesa protein untuk membentuk zona pelusida pada tahap profase. Sel telur tanpa kumulus, setelah dimaturasi banyak protein yang hilang sedangkan pada sel telur dengan kumulus yang intak, protein akan bertahan.
Hasil produk metabolik seperti choline, uridine dan inositol dapat masuk ke sel telur melalui sel kumulus karena adanya gap-junction antara sel telur dengan sel kumulus maka nutrisi akan ditransport ke sitoplasma. Selain itu sel kumulus diduga berfungsi menghambat pengerasan zona pelusida sehingga proses fertilisasi dapat berlangsung (Boediono dan Suzuki 1996). Sementara pada penelitian Triwulanningsih (2002) bahwa oosit dengan kumulus yang intak menyebabkan derajat cleavage (pembelahan) dan pematangan sampai blastosis lebih banyak dibandingkan dengan oosit tanpa sel kumulus yang tidak dapat membelah dan berkembang sampai blastosis. Hal ini membuktikan bahwa sel kumulus sangat penting fungsinya untuk maturasi sitoplasma secara normal pada proses maturasi sel telur in vitro (Chian et al. 1994).
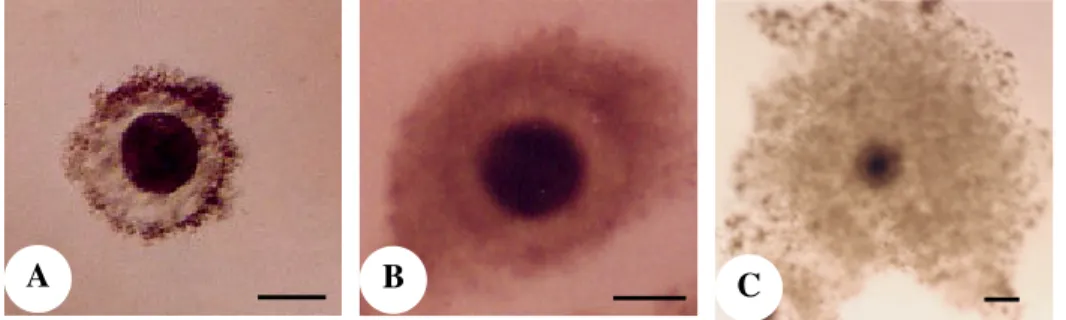
Setelah diinkubasi selama kurang lebih 23 jam, sel-sel kumulus akan terekspansi. Derajat ekspansi sel-sel kumulus dikelompokkan dalam tiga kategori yaitu (Gambar 5) : Derajat 1, sel-sel kumulus tidak mengalami ekspansi, Derajat 2, sel-sel kumulus mengalami ekspansi sebagian, Derajat 3, sel-sel kumulus mengalami ekspansi sempurna.
21
Gambar 5. Oosit sapi setelah pematangan in vitro. A: derajat 1, sel-sel kumulus tidak mengalami ekspansi; B: derajat 2, sel-sel kumulus mengalami ekspansi sebagian; C: sel-sel kumulus mengalami ekspansi sempurna. Bar = 100 µµm.
Tabel 1. Derajat Ekspansi Sel-sel Kumulus Oosit Sapi
Derajat Ekspansi Sel-sel Kumulus (%) Inkubator Jumlah
Oosit (n) Derajat 1 Derajat 2 Derajat 3 CO2 38.50C 115 8 (6.96) 35 (30.43)a 72 (62.61)a
Oxoid 360C 100 14 (14.00) 35 (35.00)a 51 (51.00)b
Oxoid 290C 95 19 (20.00) 43 (45.23)a 33 (34.74)c Keterangan : Huruf yang sama pada kolom yang sama menyatakan tidak berbeda
nyata (p>0.05).
Tabel 1. menunjukkan bahwa kondisi inkubator pada tekanan gas atmosfer dan temperatur yang berbeda memberikan pengaruh nyata terhadap ekspansi derajat 3 sel-sel kumulus. Dalam penelitian terlihat bahwa oosit yang dikultur pada inkubator Oxoid temperatur 290C mencapai ekspansi derajat 3 lebih sedikit
(34.74%) dibandingkan pada oosit yang dikultur pada inkubator Oxoid temperatur 360C mencapai ekspansi derajat 3 adalah 51%, sedangkan oosit yang dikultur pada inkubator CO2 temperatur 38.50C adalah 62.61%. Hasil uji statistik pada
ekspansi derajat 3 pada ketiga inkubator berbeda nyata (p < 0.05).
Derajat ekspansi 3 pada ketiga inkubator lebih tinggi dibandingkan derajat ekspansi 2. Hal ini disebabakan, pada ketiga inkubator terdapat komponen- komponen yang mendukung terjadinya ekspansi sel-sel kumulus. Hasil penelitian ini memberikan gambaran bahwa kondisi lingkungan pada inkubator sangat mempengaruhi proses pematangan oosit melalui pengamatan sel-sel kumulus sapi. Temperatur maturasi oosit secara in vitro harus dibuat semirip mungkin dengan kondisi maturasi oosit secara in vivo. Temperatur ini mendekati dengan
temperatur rata-rata tubuh yaitu 38 – 39.30C. Menurut Gordon (1994) temperatur optimum untuk pematangan oosit in vitro adalah 380C sampai 390C dan temperatur optimum untuk fertilisasi adalah 390C. Penggunaan temperatur
dibawah temperatur in vivo akan mengganggu pembelahan meiosis sampai M-II. Ini dibuktikan bahwa pada inkubator CO2 dengan temperatur 38.50C terdapat
banyak oosit yang mencapai ekspansi kumulus derajat 3 (tertinggi). Sementara itu pada inkubator Oxoid temperatur 360C jumlah oosit yang mencapai ekspansi kumulus derajat 3 sedikit lebih rendah daripada inkubator CO2 5%, secara statistik
berbeda nyata (p<0.05). Hal ini didukung oleh Lenz et al. (1983), bahwa temperatur 360C masih dalam rentang temperatur 35-390C dimana maturasi tidak
mengalami shock dan pada proses pematangan oosit ternak pada tahap meiosis mempunyai toleransi temperatur kultur yang relatif tinggi tetapi tidak sampai 50C dibawah temperatur badan. Sementara itu pada inkubator Oxoid yang ditempatkan pada temperatur ruang (290C) jumlah oosit yang mencapai derajat ekspansi 3 jauh lebih sedikit dibandingkan kedua perlakuan sebelumnya yang menggunakan temperatur 38.50C dan 360C. Hal ini kemungkin karena pengaruh perbedaan
temperatur yang terlalu ekstrim dibandingkan rata-rata temperatur in vivo. Pendapat ini didukung oleh Trounser and Gardner (2000) bahwa temperatur ruang dapat menghambat proses pembelahan dan mengurangi perkembangan zygot tikus pada tahap blastosis, sedangkan pada oosit mamalia dapat menyebabkan kerusakan spindel meiotik. Penurunan temperatur pada saat proses maturasi oosit dapat mempengaruhi derajat ekspansi kumulus dan selanjutnya pematangan inti oosit.
Kemampuan inkubator untuk memelihara kondisi media akan mempengaruhi pematangan oosit dan perkembangan embrio. Salah satu yang mempengaruhi adalah adanya tekanan gas atmosfer. Inkubator CO2 standar yang
digunakan pada penelitian ini dapat menghasilkan CO2 5%. Sedangkan inkubator Oxoid CO2 GenTM atmosphere general system dapat menghasilkan CO2 6% dan
O2 15%. Proses kultur in vitro yang menggunakan inkubator CO2 standar dan
inkubator Oxoid pada perkembangan embrio tidak berbeda nyata jika dilakukan pada temperatur yang sama. Embrio yang dikultur dibawah temperatur normal pada tekanan atmosfer CO2 6% dan O2 15% tidak memperlihatkan efek yang
23
merugikan pada perkembangan dan morfologi embrio (Avery et al. 2000). Hal ini dikarenakan lebih banyak pemakaian O2 pada awal perkembangan in vitro akan
lebih baik, O2 digunakan untuk oksidasi piruvat dan glukosa sedangkan CO2 tidak
hanya diperlukan untuk memelihara pH medium tetapi dapat dengan mudah memasukkan protein dan asan nukleat ke semua tahap pada embrio tikus sebelum diimplantasi (Trounson and Gardner 2000). Pendapat Azambuja et al. (1993) yang menguji pengaruh fase gas terhadap pematangan oosit sapi in vitro. Hasil penelitian tersebut menyimpulkan bahwa jumlah embrio yang berkembang menjadi morula atau blastosis pada fase gas CO2 5% di dalam udara lebih tinggi
dibanding dengan fase CO2 5%, O2 5% dan N2 90%. Oosit yang tidak dapat
berkembang hingga M-II mungkin disebabkan adanya radikal bebas yang timbul selama kultur in vitro. Seperti yang dikemukakan oleh Kim et al. (1999) bahwa kerusakan gamet atau blastosis selama dikultur in vitro karena adanya ROS (Reactive Oxygen Species). Hammerstedt et al. (1993) menyatakan radikal bebes dalam medium IVF sering terjadi disebabkan oleh adanya oksigen radikal bebas hasil proses transpor elektron dari mitokondria yang ditandai dengan terjadinya reaksi peroksida lemak yang dapat mematikan sperma.
Kemungkinan lain ekspansi sel kumulus didukung oleh komposisi media seperti penambahan hormon gonadotropin dan estradiol. Pendapat ini didukung oleh Gordon (1994) bahwa ekspansi sel-sel kumulus secara in vitro distimulasi oleh hormon gonadotropin dan faktor pertumbuhan untuk memproduksi asam hyaluronat (Hyaluronic Acid). Hormon gonadotropin ini akan aktif dalam kondisi
in vitro jika ada serum dalam medium yang dapat merangsang asam hyaluronat
dan terjadinya pemekaran sel-sel kumulus yang optimal. Asam hyaluronat bagi sel-sel kumulus merupakan faktor yang menyebabkan terjadinya ekspansi sel-sel kumulus (Setiadi 2001).
Tingkat Pematangan Inti Oosit
Kesempurnaan pematangan oosit sangat berpengaruh terhadap keberhasilan fertilisasi dan perkembangan awal embrio. Pada proses pematangan sel telur secara in vitro dipengaruhi oleh beberapa faktor diantaranya medium dan lingkungan penyimpanan (inkubator). Bahkan lingkungan penyimpanan tidak
hanya mempengaruhi terhadap proses pematangan tetapi berpengaruh juga terhadap pembuahan dan perkembangan embrio. Penelitian ini bertujuan untuk melihat pengaruh komposisi gas pada inkubator dan temperatur yang berbeda pada tingkat pematangan oosit in vitro.
Faktor yang dapat mendukung keberhasilan tingkat pematangan inti oosit menurut Zheng and Sirard (1992) adalah terjadinya ekspansi sel-sel kumulus, pematangan inti yang mencapai M-II dan pematangan sitoplasma. Menurut Moltik and Fulka (1976) bahwa sel-sel kumulus yang mengelilingi oosit akan melebar dan berwarna cerah. Oosit telah mencapai pematangaan yang maksimal dan siap untuk difertilisasi jika telah mencapai tahap M-II pada proses pembelahan secara meiosis (Gambar 6).
Gambar 6. Status inti oosit setelah pematangan in vitro. Tanda panah menunjukkan status inti pada tahap : A. Germinal Vesicle (GV); B. Germinal Vesicle Break Down (GVBD); C. Metafase I (M-I); D. Metafase II (M-II). Bar = 50 µµm.
A B
25
Proses meiosis diawali dengan tahap GV yaitu ditandai dengan membran inti jelas dan nukleolus berbentuk cincin berwarna jelas kemudian dilanjutkan dengan pecahnya stadium inti atau GVBD, nukleolus menghilang dan badan kutub I telah terbentuk (Tsafriri 1985), sedangkan pematangan sitoplasma meliputi penambahan butir-butir kuning telur didalam sitoplasma, pembentukan selubung zona pelusida, serta pembentukan granul-granul kortek (Djuwita et al. 2000).
Proses pematangan in vitro adalah proses dimana oosit mengalami perubahan meiosis dari tahap M-I sampai M-II. Setelah oosit mengalami pematangan pada media kultur (TCM-199) selama 23 jam pada inkubator CO2
standar, inkubator Oxoid temperatur 360C dan inkubator Oxoid temperatur 290C, oosit dievaluasi dengan menggunakan pewarnaan aceto orcein 2% untuk melihat perubahan inti oosit.
Kandungan gas CO2 dalam inkubator dapat mempertahankan pH medium
agar tetap stabil yaitu pH netral • 7.5 yang akan mempengaruhi proses fisiologis. Meskipun demikian didalam media maturasi tetap diperlukan adanya penyangga. Dengan menggunakan penyangga bikarbonat dan pemberian gas CO2 5% maka
dapat mempertahankan interval pH dari 7.4 – 7.6 (Gordon 1994). Keseimbangan pH ini dipengaruhi juga oleh temperatur dan tekanan atmosfer. Hal ini juga didukung oleh Rijnders et al. (1996) bahwa kandungan gas CO2 5% dan O2 20%
dalam inkubator akan mempertahankan pH medium agar tetap stabil. Penggunaan inkubator Oxoid yang menghasilkan O2 15% dan CO2 6% seharusnya dapat
mencukupi standar produksi in vitro embrio sapi. Hal ini dikarenakan pada inkubator Oxoid diduga asam askorbik dapat membatasi tekanan atmosfer dengan baik menggunakan tekanan O2 rendah dan dapat melindungi embrio dari gas dan
perubahan temperatur selama beberapa minggu waktu kultur (Avery et al. 2000). Sedangkan penggunaan inkubator CO2 5% dengan media yang ditambah buffer
fosfat dan bikarbonat lebih sering digunakan karena tidak memerlukan pemberian gas CO2 jenuh untuk memertahankan pH.
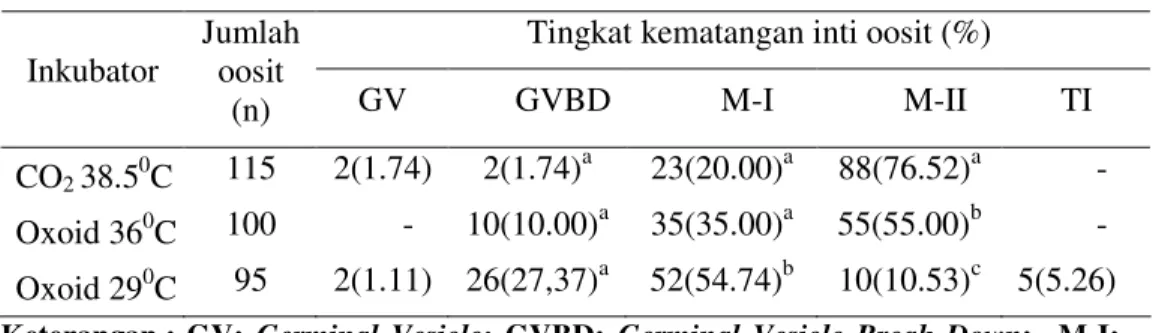
Pada Tabel 2 terlihat bahwa oosit yang dimaturasi masih dapat mencapai tingkat pematangan inti yang lebih lanjut yaitu tahap M-II. Jumlah oosit yang mencapai M-II dalam inkubator CO2 temperatur 38.50C adalah 76.52% lebih
tinggi dan berbeda nyata (P<0.05) dibandingkan dengan inkubator Oxoid temperatur 360C (55.00%) dan inkubator Oxoid temperatur 290C (10.53%). Hal ini menunjukkan bahwa temperatur 360C masih mampu mendukung pematangan
oosit in vitro meskipun lebih rendah dari temperatur normal.
Tabel 2. Tingkat Pematangan Inti Oosit Sapi Setelah Maturasi In Vitro. Tingkat kematangan inti oosit (%) Inkubator Jumlah oosit
(n) GV GVBD M-I M-II TI
CO2 38.50C 115 2(1.74) 2(1.74)a 23(20.00)a 88(76.52)a -
Oxoid 360C 100 - 10(10.00)a 35(35.00)a 55(55.00)b -
Oxoid 290C 95 2(1.11) 26(27,37)a 52(54.74)b 10(10.53)c 5(5.26)
Keterangan : GV: Germinal Vesicle; GVBD: Germinal Vesicle Break Down; M-I:
Metafase I; M-II: Metafase II; TI: Tidak teridentifikasi. Huruf yang
sama pada kolom yang sama menyatakan tidak berbeda nyata (p>0.05).
Inkubator Oxoid temperatur ruang (290C) yang secara ekstrim dibawah
temperatur tubuh, oosit yang mencapai tahap M-II sangat rendah hanya mencapai 10.53% yang berbeda nyata secara statistik baik dengan inkubator Oxoid temperatur 360C dan inkubator normal. Hal ini menunjukkan temperatur kamar bersifat detrimental terhadap proses meiosis. Pendapat ini didukung oleh hasil penelitian Lenz et al. (1983) bahwa tahap meiosis mempunyai toleransi temperatur yang relatif tinggi tetapi tidak sampai 50C dibawah temperatur badan. Sedangkan dalam penelitian ini dipakai temperatur ruang (290C) yang jauh dari temperatur normal badan ± 38 – 390C.
Lebih lanjut ditunjukkan bahwa pada inkubator Oxoid temperatur 290C
oosit mampu mengawali proses meiosis yang baik. Hal ini ditunjukkan dengan sisa yang sedikit dari oosit yang masih dalam tahap GV. Namun demikian dalam perkembangan proses meiosis oosit terhenti pada tahap M-I (Tabel 2). Hal ini didukung oleh Trounson and Gardner (2000) yang menyatakan bahwa pematangan oosit pada temperatur ruang (290C) menyebabkan kerusakan spindel
meiotik yang dapat menghambat proses pematangan oosit. Semakin rendah temperatur yang digunakan dalam proses pematangan in vitro maka semakin rendah juga oosit yang mencapai tahap M-II. Diperkuat dengan pernyataan
27
Gordon (1994), temperatur optimum untuk pematangan oosit in vitro adalah 38 – 390C dan temperatur optimum untuk fertilisasi adalah 390C.
Disamping lingkungan penyimpanan (inkubator), media pematangan juga penting. Salah satu media yang paling banyak digunakan untuk pematangan oosit
in vitro adalah TCM-199. Penambahan gonadotropin (LH dan FSH) ke dalam
medium TCM-199 dapat meningkatkan tingkat pematangan oosit dan tingkat fertilisitas in vitro dengan melihat peningkatan ekspansi sel-sel kumulus. Hormon gonadotropin dan estradiol biasanya menyebabkan peningkatkan yang bersifat sinergis terhadap pematangan inti tergantung dari jenis serum yang digunakan dalam media pematangan (Gordon 1994).
Korelasi Ekspansi Kumulus dengan Metafase II
Selama pematangan in vitro pada oosit sapi keberadaan sel kumulus yang mengelilingi oosit tersebut sangat membantu sampai pada perkembangan blastosis (Boediono dan Suzuki 1996). Hal ini diduga karena sel kumulus menyediakan nutrisi untuk oosit selama perkembangan dan membantu sintesis protein untuk pembentukan zona pelusida. Kriteria ini sering dipakai oleh beberapa peneliti karena adanya indikasi korelasi yang kuat antara dinamika pemekaran sel-sel kumulus pada oosit dari hewan tertentu dengan morfologi normal, kemampuan untuk dibuahi dan kemampuan perkembangan oosit setelah dibuahi (Chen 1994 dalam Setiadi 2001).
Pada penelitian ini, oosit dari semua perlakuan menunjukkan tanda-tanda adanya maturasi, selain ditandai dengan munculnya badan kutub I sebagai hasil dari pembelahan meiosis I. Tanda yang secara morfologis paling mudah dikenali adalah terjadinya peregangan sel-sel kumulus yang mengelilingi oosit tersebut, seperti yang dilaporkan oleh Boediono dan Suzuki (1996) bahwa peregangan sel kumulus setelah maturasi secara in vitro merupakan salah satu tanda terjadinya maturasi nukleus dan sitoplasma. Sedangkan menurut Eppig (1980) peregangan sel kumulus yang mengelilingi oosit bertepatan dengan terjadinya pembelahan meiosis. Hal ini didukung oleh pendapat Lu et al. (1988) secara in vitro peningkatan cyclic Adenin Monophosphate (cAMP) mengakibatkan sel-sel
kumulus terekspansi secara sempurna, sedangkan peningkatan cAMP akan mengaktifkan proses meiosis.
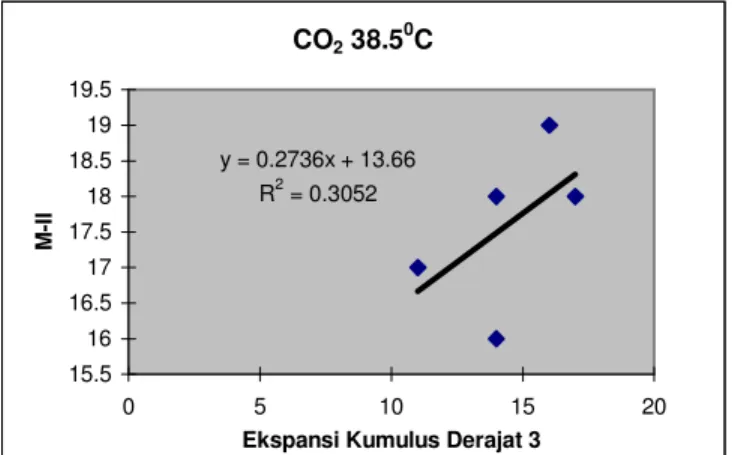
Hubungan ekspansi kumulus dengan maturasi oosit pada penelitian ini dapat dilihat pada gambar 7-9. Oosit yang dimatangkan pada inkubator CO2
temperatur 38.50C menunjukkan hubungan yang erat karena untuk setiap kenaikan rata-rata nilai ekspansi kumulus derajat 3 (maksimum) sebesar satu-satuan maka akan meningkatkan rata-rata M-II sebesar 0.274. Hal ini berarti ekspansi kumulus derajat 3 mempunyai kerapatan hubungan dengan M-II sebesar 0.55. Pada inkubator Oxoid temperatur 360C menunjukkan hubungan yang sangat erat karena
setiap kenaikan rata-rata nilai ekspansi kumulus derajat 3 sebesar satu-satuan maka akan meningkatkan rata-rata nilai M-II sebesar 0.617. Hal ini berarti ekspansi kumulus derajat 3 mempunyai kerapatan hubungan dengan M-II sebesar 0.98. Kerapatan hubungan antara derajat ekspansi sel kumulus dengan M-II pada temperatur 38.50C lebih rendah dibandingkan pada temperatur 360C. Hal ini kemungkinan disebabkan oleh kekeliruan dalam mengelompokkan derajat ekspansi sel kumulus oosit terutama derajat 2 dan 3. Pada inkubator Oxoid temperatur 290C menunjukkan hubungan yang kurang erat karena untuk setiap kenaikan rata-rata nilai ekspansi kumulus derajat 3 sebesar satu-satuan maka akan meningkatkan rata-rata nilai M-II sebesar 0.04. Ini berarti ekpansi kumulus derajat 3 mempunyai kerapatan hubungan dengan M-II sebesar 0.14.
29 CO2 38.50C y = 0.2736x + 13.66 R2 = 0.3052 15.5 16 16.5 17 17.5 18 18.5 19 19.5 0 5 10 15 20
Ekspansi Kumulus Derajat 3
M
-II
Gambar 7. Hubungan antara derajat ekspansi 3 dengan M-II pada inkubator CO2 temperatur 38.50C.
Ekspansi Kumulus Derajat 3 y = 0.6169x + 4.7078 R2 = 0.9767 0 5 10 15 0 5 10 15 20 Oxoid 360C M -II
Gambar 8. Hubungan antara derajat ekspansi 3 dengan M-II pada inkubator Oxoid temperatur 360C.
Oxoid 290C y = 0.0397x + 1.7381 R2 = 0.0198 0 0.5 1 1.5 2 2.5 3 3.5 0 2 4 6 8 10
Ekspansi Kumulus Derajat 3
M
-II
Gambar 9. Hubungan antara derajat ekspansi 3 dengan M-II pada inkubator Oxoid temperatur 290C.
Dengan melihat hasil penelitian pada Gambar 7-9, pada inkubator CO2
temperatur 380C menunjukkan ekspansi kumulus derajat 3 dengan M-II hubungannya tidak seerat pada inkubator Oxoid temperatur 360C. Hal ini
membuktikan bahwa pematangan oosit tidak hanya bergantung pada tingkat ekspansi sel-sel kumulus karena terdapat oosit yang kumulusnya tidak mengalami ekspansi maksimum yaitu pada derajat ekspansi 1 dan 2, akan tetapi pematangan inti dapat mencapai M-II yang cukup tinggi. Peran sel kumulus setiap spesies berbeda, pada oosit tanpa sel-sel kumulus dapat berkembang sampai tingkat pematangan M-II dan dapat difertilisasi (Galeati 1994). Pada inkubator Oxoid 290C hubungannya kurang erat. Hal ini karena oosit yang mencapai tingkat
pematangan M-II hanya sedikit.
Menurut Setiadi (2001), secara umum faktor yang bertanggung jawab terhadap pemekaran sel-sel kumulus melibatkan faktor internal dan ekternal. Faktor internal meliputi luapan gonadotropin sebelum ovulasi, meskipun terdapat perbedaan spesies dalam pengaturan pemekaran sel-sel kumulus. Sedangkan faktor ekternal meliputi faktor komposisi media pada proses in vitro sangat menentukan terjadinya pemekaran sel-sel kumulus. Pada penelitian ini medium maturasi yang digunakan ditambahkan FBS yang berperan dalam proses peregangan sel-sel kumulus tersebut. Peregangan sel-sel kumulus disebabkan oleh adanya hyaluronidase yang diproduksi dan disekresikan oleh sel-sel kumulus. Menurut penelitian lain sintesis asam hyaluronat oleh sel kumulus dan pengaturan asam hyaluronat dapat menaikkan ekspansi kumulus dengan adanya FBS dalam medium maturasi oosit secara in vitro, asam hyaluronat tetap dipertahankan di dalam komplek oosit kumulus. Berdasaran beberapa penelitian tersebut, maka pemekaran sel-sel kumulus dapat distimulasi in vitro oleh beberapa komponen media seperti hormon gonadotropin, serum dan substrat dari hyalironidase. Hal ini menunjukkan semakin berkembang sel kumulus maka tahap mencapai M-II sangat tinggi karena sel kumulus mempunyai peran dalam menciptakan lingkungan mikro untuk oosit, yaitu peningkatan aktivitas metabolisme untuk kebutuhan makanan oosit. Oleh karena itu, dapat disimpulkan bahwa ekspansi sel-sel kumulus berperan penting dalam pematangan oosit.
KESIMPULAN
Dari hasil penelitian yang diperoleh dapat diambil beberapa kesimpulan sebagai berikut :
1. Inkubator Oxoid pada temperatur 360C dapat dipakai untuk proses
pematangan oosit meskipun hasilnya tidak optimal (55%) dibandingkan dengan inkubator standar.
2. Proses pematangan oosit pada temperatur ekstrim dibawah temperatur
tubuh normal menimbulkan efek yang tidak dikehendaki dan hanya sedikit oosit yamg mampu menyelesaikan pembelahan meiosis sampai tahap M-II.
3. Derajat ekspansi sel kumulus oosit dan tingkat pematangan inti
mempunyai derajat keeratan yang berbeda.
SARAN
Dari penelitian yang telah dilakukan maka disarankan beberapa hal sebagai berikut :
1. Perlu dilakukan penelitian lebih lanjut penggunaan inkubator Oxoid
pada temperatur normal yang setara dengan temperatur tubuh (38-390C).
2. Perlu dilakukan penelitian lebih lanjut tingkat kompentensi oosit yang
telah dimatangkan pada inkubator Oxoid melalui percobaan fertilisasi
Avery B, Melsted JK and Greve T. 2000. A Novel Approach for In Vitro Production of Bovine Embryos Use of The Oxoid Atmosphere Generating System. Theriogenology 54: 1259 – 1268.
Azamduja RM de, Moreno JF, Kraemer D and Westhusin M. 1993. Effect of Gas Atmosphere on In Vitro Maturation of Bovine Oocytes. Theriogenology 39: 184-186.
Ball GD, Leibfreid ML, Lenz RWAx, Bavister BD and First NL. 1984. Factors Affecting Succesfull In Vitro Fertilization of Bovine Follicular Oocyte. Biol.
Reprod. 28: 717-725.
Berthelot F and Terqui M. 1996. Effects of Oxygen, CO2/pH and Medium on The
In Vitro Development of Individually Cultured Prorcine One – and Two- Sel Embryos. Reprod. Nutr. Dev. 36: 241-251.
Boediono A and Suzuki T. 1996. In Vitro Development of Holstein and Japanese Black Breeds Embryo. Media Veteriner 3: 3-9.
Boediono A, Rusiyantono Y, Mohamad K, Djuwita I dan Herliatien. 2000. Perkembangan Oosit Kambing Setelah Maturasi, Fertilisasi dan Kultur In
Vitro. Media Veteriner 7: 11-17.
Brackett BG and Zuelke KA. 1993. Analysis of Factors Involved in The In Vivo Production of Bovine Embryos. Theriogenology 39: 43-64.
Chian RC, Niwa K and Sirard. 1994. Effect Cumullus Cells on Male Pronuclear Formation and Subsequent Early Development of Bovine Oocytes In Vitro.
Theriogenology 41: 1449-1508.
Crozet IV, Ahmed-Ali M and Dubos P. 1995. Developmental Competence of Goat Oocytes from Follicles of Different Size Categories Follofing Maturation, Fertilisation and Culture In Vitro. Reprod. Fert. 76: 31-37.
Dale B and Elder K. 1998. In Vitro Fertilization. USA: Cambridge Univ. Pr. pp: 73-81.
Djuwita I, Boediono A dan Mohammad K. 2000. Bahan Kuliah Embriologi. Bogor: Laboratorium Embriologi Bagian Anatomi FKH IPB. pp: 10: 1-8.
33
Eppig JJ. 1980. Role of Serum in FSH Stimulated Cumulus Expantion by Mouse Oocyte-Cumulus Cell Complexes In Vitro. Biol.Reprod. 15: 167-573.
Frandson RD. 1992. Anatomi dan Fisiologi Ternak. Srigandono B, Praseno K, Penerjemah; Yogyakarta: Gadjah Mada Univ. Pr. Terjemahan dari: Anatomy
and Physiology of Farm Animal. pp: 599-735.
First NL, Lorraine and Florman HM. 1989. The Mollecular Biology of The
Mamalian Oocyte Fertilization. London: Academic Pr. pp: 259-288.
Findlay JK, Drummond AE and Fry RC. 1996. Intragonal Regulasion of Follicular Development and Ovulation. Anim. Reprod. Sci. 42: 321-331. Galeati G. 1994. Oocyte reaction to penetrating sperm. Zygote 2: 355-358.
Gordon I. 1994. Laboratory Production of Cattle Embryos. Biotechnology in Agriculture Series. CAB. International. pp: 30-142.
Hafez ESE. 1987. Reproduction in Farm Animals. Ed ke-5. Philadelphia: Lea & Febiger. pp: 7-205.
Hafez ESE, B. Hafez. 2000. Reproduction in Farm Animals. Ed ke-7. Philadelphia: Lea & Febiger. pp: 31-68.
Hammerstedt RH, Keith AD, Snipes W, Amann RP, Arruda D and Griel LC. 1993. Use of Spin Labels to Evaluete Effects of Cold Shock and Osmolarity on Sperm. Biol. Reprod. 18: 686-696.
Hardjopranjoto HS. 1995. Ilmu Kemajiran pada Ternak. Yogyakarta: Airlangga Univ Pr. pp: 19-55.
Hawk HK, Nel AD and Wall AW. 1992. Investigation of Means to Improve Rates of Fertilization In Vitro Matured or In Vitro Fertilization Bovine Oocytes.
Theriogenology 8: 989-998.
Hunter. 1995. Fisiologi dan Teknologi Reproduksi Hewan Betina Domestik. Haryaputra DK, penerjemah; RB Mataram, penyuting. Bandung: ITB. Terjemahan dari: Physiology and Technology Reproduction in Female
Domestic Animals. pp: 257-295.
Hyttel P, Fair T, Callesen H and Greve T. 1997. Oocyte Growth, Capaitation and Final, Maturation in Culture. Reprod. Fert. 54: 379-383.