UJI DISOLUSI TABLET PARASETAMOL DENGAN METODE DAYUNG
TUGAS AKHIR
OLEH:
ELIS SURYANI NASUTION NIM 102410079
PROGRAM STUDI DIPLOMA III ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2016
LEMBAR PENGESAHAN
UJI DISOLUSI TABLET PARACETAMOLDENGAN METODE DAYUNG
TUGAS AKHIR
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Ahli Madya Pada Program Studi Diploma III Analis Farmasi dan Makanan
Fakultas Farmasi Universitas Sumatera Utara
OLEH :
Elis Suryani Nasution NIM 102410079
Medan, Mei 2016 Disetujui oleh : Dosen Pembimbing,
Dr.Kasmirul Ramlan Sinaga, M.S.,Apt NIP 195504241983031003
Disahkan Oleh:
Dekan Fakultas Farmasi,
Prof. Dr. Masfria, M.S.,Apt.
NIP 195707231986012001 KATA PENGANTAR
Puji dan syukur kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Tugas Akhir yang berjudul
“Uji Disolusi Tablet Parasetamol Dengan Metode Dayung” tugas akhir ini diajukan untuk memenuhi dalam menyelesaikan pendidikan Program Studi Diploma III Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara.
Selama menyusun Tugas Akhir ini, penulis banyak mendapatkan bantuan dan bimbingan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih yang sebesar besarnya kepada :
1. Ibu Dr. Masfria, M.S.,Apt selaku Pejabat Dekan di Fakultas Farmasi Universitas Sumatera Utara
2. Bapak Prof.Dr. Jansen Silalahi,M.App.Sc., Apt., selaku Ketua Program StudiDiploma III Analis Farmasi dan Makanan Fakultas Farmasi USU.
3. Bapak Dr.KasmirulRamlan Sinaga,M.S., Apt., Yang telah membimbing dan mengarahkan penulis dalam penyusunan Tugas Akhir ini.
4. Bapak dan Ibu dosen beserta seluruh staf di Fakultas Farmasi USU.
5. Bapak Beben Budiman, Apt., selaku Plant Manager Produksi PT.Kimia Farma (Persero) Tbk Plant Medan, yang telah memberikan kesempatan kepada penulis untuk melaksanakan Praktek Kerja Lapangan (PKL).
6. Bapak Heru Khoerudin, Ssi, Apt., selaku Asisten Manager Pengolahan Mutu PT. Kimia Farma (Persero) Tbk Plant Medan yang telah memeberikan pengarahan dan bimbingan kepada kami selama Praktek Lapangan Kerja (PKL) berlangsung.
7. Bapak dan Ibu beserta seluruh staf dan karyawan PT.Kimia Farma (Persero) Tbk.Plant Medan yang telah memberikan kesempatan kepada penulis untuk melakukan Praktek Kerja Lapangan.
8. Papa Azhar Naution SP dan Mama Dagaria Siregar S.Ag tercinta serta kakak Nurjamiah Nasution Amkeb dan adik-adik ku Tri putri Nasution dan Siska fauziah Nasution yang telah memberikan semangat dan motivasi sehingga tugas akhir ini dapat diselesaikan dengan baik.
9. Seluruh teman-teman Mahasiswa Analis Farmasi dan Makanan angkatan 2010 yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa sepenuhnya isi dari Tugas Akhir ini masih terdapat kekurangan dan kelemahan serta masih jauh dari kesempurnaan, untuk itu dengan segala kerendahan hati, penulis mengharapkan saran dan kritik yang sifatnya membangun demi kesempurnaan Tugas Akhir ini dan demi peningkatan mutu penulisan Tugas Akhir di masa yang akan datang. Akhir kata, penulis sangat berharap semoga Tugas Akhir ini dapat memberikan manfaat kepada semua pihak yang memerlukan. Amin.
Medan, Mei 2016
Penulis
Elis Suryani Nasution NIM 102410079
UJI DISOLUSI TABLET PARASETAMOL DENGAN METODE DAYUNG
ABSTRAK
Obat merupakan suatu zat yang digunakan untuk diagnosa, pengobatan, penyembuhan atau pencegahan penyakit pada manusia atau hewan. Agar obat berfungsi sebagaimana yang diharapkan, maka jumlah atau dosis obat haruslah tepat. Dosis merupakan sifat dari obat bahwa apabila jumlahnya kurang maka obat tersebut tidak akan memberikan efek, sedangkan bila jumlahnya berlebihan, obat menjadi bersifat racun. Tujuan Uji Disolusi tablet Paracetamol dengan metode dayung ini adalah untuk mengetahui apakah kadar zat aktif yang terlepas dari tablet Paracetamol memenuhi persyaratan atau tidak.
Uji disolusi tablet Paracetamol dengan metode dayung dilakukan seperti yang tertera pada Farmakope Indonesia Edisi IV di tempat Praktek Kerja Lapangan (PKL) PT. Kimia Farma (Persero) Plant Medan. Uji disolusi dilakukan pada suhu 37o C dengan kecepatan 50rpm selama 30 menit, kemudian diambil akuadest 20 ml dan diukur daya Spektrofotometer UV-Vis dengan panjang gelombang 243 nm.
Hasil yang diperoleh dari tablet paracetamol yang di uji memenuhi persyaratan Farmakope Indonesia Edisi IV yaitu, 92,79%, 97,25%, 97,74 %, 99,27%, 95,03%, 94,38% dengan rata-rata 96,08 % Tiap unit sediaan tidak kurang dari 85 % (Q + 5% )dari jumlah yang tertera pada etiket.
Kata kunci : uji disolusi, tablet, paracetamol, metode dayung
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... v
DAFTAR ISI ... vi
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
1.1 LatarBelakang ... 1
1.2 TujuandanManfaat ... 2
1.2.1 Tujuan ... 2
1.2.2 Manfaat ... 2
BAB II TINJAUAN PUSTAKA ... 4
2.1 Tablet ... 4
2.1.1 Komposisi Tablet ... 4
2.1.2 Metode Pembuatan Tablet ... 6
2.1.3 Penggolongan Tablet ... 7
2.2 Parasetamol ... 8
2.2.1 Mekanisme Kerja ... 9
2.2.2 Farmakokinetik ... 9
2.2.3 Farmakodinamik ... 9
2.2.4 Efek Samping ... 10
2.2.5 Indikasi ... 10
2.3 Disolusi ... 11
2.3.1 Metode Uji Disolusi ... 12
2.3.2 Prosedur Pengujian Disolusi ... 13
2.3.3 Kriteria Penerimaan hasil Uji Disolusi ... 14
2.3.4 Pengaruh Bentuk Sediaan terhadap Laju Disolusi ... 14
2.3.5 Penetapan Kadar ... 16
2.4 Spektrofotometri . ... 16
2.4.1 Instrumen . ... 17
BAB III METODOLOGI ... 19
3.1 Tempat Pengujian . ... 19
3.2 Alat ... 19
3.3 Bahan ... 19
3.4 Prosedur ... 19
3.4.1 Pembuatan buffer fosfat pH 5,8 ... 19
3.4.2 Pembuatan Larutan Standar ... 20
3.4.3 Pembuatan Larutan Sampel . ... 20
3.4.4 Cara Penetapan Serapan . ... 21
3.4.5 RumusPerhitungan ... 21
BAB IV HASIL DAN PEMBAHASAN ... 22
4.1 Hasil ... 22
4.2 Pembahasan ... 22
BAB V KESIMPULAN DAN SARAN ... 24
5.1 Kesimpulan ... 24
5.2 Saran ... 24
DAFTAR PUSTAKA ... 25 LAMPIRAN ... 27
DAFTAR LAMPIRAN
Lampiran Halaman
1.Data dan hasil uji disolusi tablet parasetamol ... 27
2.Perhitungan uji disolusi tablet parasetamol ... 28
3. Lampiran gambar ... ` 29
4. Lampiran hasil spektrofotometri ... 30
BAB I PENDAHULUAN 1.1 Latar Belakang
Obat adalah suatu zat yang digunakan untuk diagnose, pengobatan penyembuhan atau pencegahan penyakit pada manusai atau pada hewan. Bahan obat dapat berasal dari nabati, hewani, kimiawi alam mapun sintetis. Sebelum dipergunakan menjadi obat , zat tersebutterlebih dahulu dibentuk menjadi sediaan farmasi, seperti kapsul, pil, tablet, sirup, suspense, salep, dan suppositories (Anief, 1987).
Sediaan tablet merupakan sediaan yang paling banyak diproduksi dan juga banyak mengalami perkembangan dalam formulasinya. Beberapa keuntungan sediaan tablet adalah sediaan lebih kompak, dosisnya tepat, mudah pengemasannya dan penggunaannya lebih praktis dibandingsediaan yang lain (Lachman dkk., 1994).
Parasetamol merupakan metabolit fenasetin dengan efek antipiretik ditimbulkan oleh gugus aminobenzen. Asetaminofen di Indonesia lebih dikenal dengan nama parasetamol, dan tersedia sebagai obat bebas. Efek analgetik parasetamol dapat menghilangkan atau mengurangi nyeri ringan sampai sedang.
Parasetamol menghilangkan nyeri, baik secarasentral maupun secara perifer.
Secara sentral parasetamol bekerja pada hipotalamus sedangkan secara perifer, menghambat pembentukan protagladin di tempat inflamasi, mencegah sensitisasi reseptor rasa sakit terhadap rangsang mekanik atau kimiawi. (Wilmana, 1995).
PT. Kimia farma (Persero) Tbk. Plant Medan memproduksi tablet parasetamol. Salah satu parameter uji yang dilakukan untuk menguju kesediaan
tablet adalah uji disolusi. Uji dilakukan untuk menentukan kesesuaian dengan persyaratan yang tertera dalam masing-masing monografi untuk sediaan tablet dan kapsul, kecuali pada etiket dinyatakan bahwa tablet harus dikunyah. Persyaratan disolusi tidak berlaku untuk kapsul gelatin lunak kecuali bila dinyatakan lain dalam monografi (Ditjen POM, 1995).
Sebelum melakukan uji disolusi, metode analisis yang digunakan harus ditetapkan terlebih dahulu dan dikaji dengan seksama antara lain: komposisi media disolusi, jumlah media, waktu, kecepatan pengaduan, prosedur penetapan konsentrasi dan toleransi. Setelah pengambilan sampel uji disolusi, dilanjutkan dengan proses analisis penetapan kadar zat aktif dalam sampel (Siregar dan wikarsa, 2010)
Factor yang harus diperhatikan dalam uji disolusi, yaitu ukuran dan bentuk yang akan dipengaruhi laju dan tingkat kelarutan, selain itu sifat media pelarut juga akan mempengaruhi uji kelarutan. Beberapa kegunaan uji disolusi antara lain : menjamin keseragaman satu batch menjamin bahwa obat akan memberikan efek terapi yang diinginkan, dan diperlukan dalam rangka pengembangan suatu obat baru (Ditjen POM, 1995).
1.1 Tujuan
Adapun tujuan dari uji disolusi tablet Paracetamol adalah untuk mengetahui apakan kadar zat aktif yang terlepas dari tablet Paracetamol PT.
Kimia Farma memenuhi persyaratan atau tidak sesuai dengan ketentuan uji disolusi talet Paracetamol yang tertera pada Farmakope Edisi IV.
1.2 Manfaat
1. Manfaat yang diperoleh dari uji disolusi table Paracetamol adalah agar dapat mengetahui bahwa kadar zat aktif yang terlepas dari produk sediaan tablet Paracetamol. PT. Kimia Farma yang beredar di pasaran memenuhi persyaratan sesuai dengan ketentuan uji disolusi tablet Paracetamol yang tertera pada Fermakope Edisi IV.
2. Menambah wawasan dan mengerti tentang uji disolusi tablet parasetamol dengan metode dayung.
BAB II
TINAJAUAN PUSTAKA 2.1 Tablet
Tablet adalah bentuk sediaan padat mengandung bahan obat dengan atau tanpa bahan pengisi. Berdasarkan metode pembuatan, tablet dapat digolongkan sebagai tablet cetak dan tablet kempa. Tablet cetak dibuat dengan cara menekan massa serbuk lembab dengan tekanan rendah kedalam lubang cetakan. Tablet kempa dibuat dengan memberikan tekanan tinggi pada serbuk atau granul menggunakan cetakan baja. Tablet dapat dibuat dalam berbagai ukuran, bentuk dan penandaan permukaan tergantung pada desain cetakan (Ditjen POM, 1995).
Tablet merupakan suatu sediaan utuh dan praktis diberikan secara oral dengan dosis yang tepat dan variasi minimal. Tablet merupakan bentuk sediaan oral dengan biaya produksi paling murah, juga paling ringan dan paling banyak.
Tablet terdiri dari zat aktif dan bahan tambahan. Bahan tambahan dapat dibagi menjadi dua kelompok besar. Pertama bahan tambahan yang mempengaruhi biofarmasi, stabilitas fisika dan kimia, termasuk didalamnya penghancuran, zat pewarna, perasa dan pemanis (Lachman, dkk., 1994).
2.1.1 Komposisi tablet
Tablet pada umumnya disamping zat aktif, juga mengandung zat pengisi, zat pengikat, zat penghancur dan zat pelican. Untuk tablet tertentu zat pewarna.
Zat perasa dan bahan-bahan lainnya dapat ditambahkan jika diperlukan.
Komposisi umum dari tablet :
1. Zat Berkhasiat/ Zat harus Aktif
Zat berkhasiat atau zat aktif jarang diberikan dalam keadaan murni, tetapi harus dikombinasikan terlebih dahulu dengan zat-zat yang bukan obat mempunyai fungsi khusus agar dapat dibentuk menjadi sediaan tablet (Anief, 1996).
2. Zat Pengisi
Zat pengisi adalah suatu zat yang ditambahkan ke dalam suatu formulasi tablet yang bertujuan untuk penyesuaian bobot dan ukuran tablet sehingga sesuai dengan persyaratan, untuk membantu kemudahan dalam pembuatan tablet, dan meningkatkan mutu sediaan tablet. Zat pengisi yang biasa digunakan adalah pati (amilum), laktosa, manitol, sorbitol dan lain-lain (Siregar dan Wikaras, 2010).
3. Zat Pengikat
Zat pengikat dimaksudkan agar tablet tidak pecah atau retak, dan dapat dibentuk menjadi granul sehingga dapat dikempa atau dicetak (Anief, 1994). Ada dua golongan bahan pengikat yaitu bahan gula atau zat polimerik. Bahan polimerik terdiri atas dua kelas yaitu (1) polimer alam seperti pati, atau gom mencakup akasia, tragakan dan gelatin. (2) polmer sintetis seperti polivinilpirolidon, metilselulosa, etilselulosa, dan hidroksipropilselulosa (Siregar dan Wikarsa, 2010).
4. Zat Penghancur
Zat penghancur dimaksudkan untuk memudahkan pecahnya tablet ketika berkontak dengan cairan saluran pencernaan dan mempermudah absorbs.
Disintegram idealnya menyebabkan tablet hancur, tidak saja menjadi granul yang
dikempa, tetapi juga menjadi partikel serbuk yang berasal dari granul (Lachman, dkk, 1994).
2.1.2 Metode Pembuatan Tablet
Dalam pembuatan tablet, zat berkhasiat dan zat-zat lain kecuali pelican dibuat granul (butiran kasar), karena serbuk halus tidak mengisi cetakan serta menjaga agar metode pembuatan tablet, yaitu :
1. Metode granulasi basah
Masing-masing zat berkhasiat, zat pengisi, dan zat penghancur dihaluskan terlebih dahulu dalam mesin penghalus, seluruh serbuk dicampur bersama-sama dalam alat pencampur, lalu dibasahi dengan larutan bahan pengikat. Setelah itu massa lembab diayak menjadi granul menggunakan ayakan 6 atau 8 mesh, dan dikeringkan dalam lemari pengering pada suhu 500-600C, setelah kering diayak lagi untuk memperoleh granul dengan ukuran yang diperlukan (biasanya digunakan ayakan 12-20 mesh). Tambahkan bahan pelican (lubrikan) kemudian dicetak menjadi tablet dengan mesin tablet (Ansel, 1989).
2. Metode granulasi kering (slugging)
Dilakukan dengan mencampurkan zat berkhasiat, zat pengisi, dan zat penghancur, serta jika perlu ditambahkan zat pengikat dan zat pelican hingga menjadi massa serbuk yang homogeny, lalu dikempa cetak pada tekanan yang tinggi, sehingga menjadi tablet besar (slung) yang tidak berbentuk baik, kemudian digiling dan diayak hingga dioperoleh granul dengan ukuran partikel yang diinginkan. Setelah itu dicetak sesuai ukuran tablet yang diinginkan (Ansel, 1989).
3. Metode kempa langsung
Masing-masing zat aktif, zat pengisi, zat penghancur, dan zat pelican dihaluskan terlebih dahulu dalam mesin penghalus. Seluruh serbuk dicampur bersama-sama dalam alat pencampur. Campuran serbuk yang telah homogeny dikempa dalam mesin tablet menjadi tablet jadi (Siregar dan Wikarsa 2010).
Komposisi tablet pada umumnya terdiri atas bahan aktif ekspien (ada sejumlah kecil tablet yang dapat dibuat tanpa eksipien). Untuk dapat menghantarkan obat dalam jumlah (dosis) yang cukup pada penggunaan klinik, diberikan bentuk sediaan yang dapat diterima pasien. Eksipien ditambahkan dengan berbagai fungsi dan tujuan spesifik sebagai pengisi, pengikat, penghancur, pelicir, antilengket, pelinci, pembasah, zat warna, peningkat rasa, pemanis, penutup rasa (Agoes, 2008).
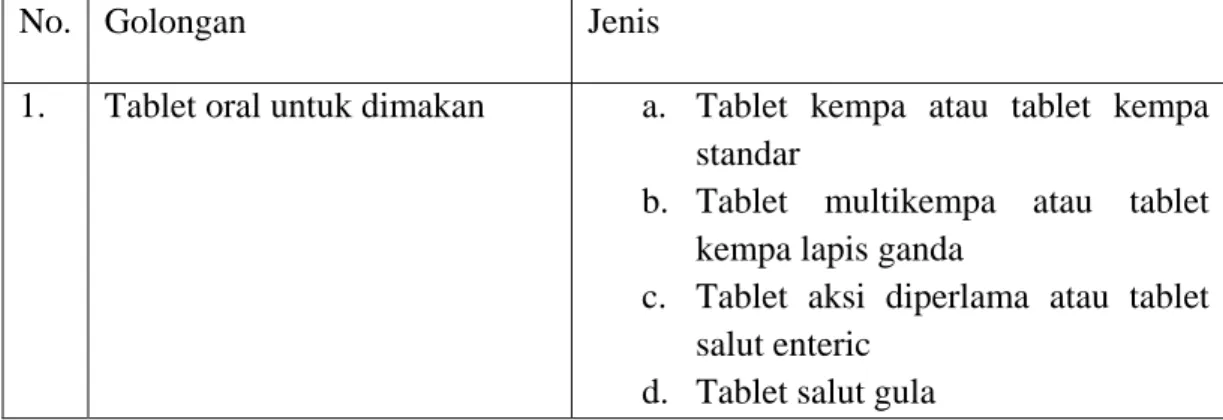
2.1.3 Penggolongan tablet
Tablet digolongkan berdasarkan cara pemberian atau fungsinya, system penyampain obat yang disesuaikan dengan cara pemberian tersebut, dan bentuk serta metode pembuatannya. Susunan macam-macam penggolongan tablet dengan penggolongan utama berdasarkan cara pemberiannya atau fungsinya dapat dilihat pada table :
Tabel 2.1 Penggolongan tablet
No. Golongan Jenis
1. Tablet oral untuk dimakan a. Tablet kempa atau tablet kempa standar
b. Tablet multikempa atau tablet kempa lapis ganda
c. Tablet aksi diperlama atau tablet salut enteric
d. Tablet salut gula
e. Tablet salut lapis tipis f. Tablet kunyah
2. Tablet yang digunakan dalam rongga mulut
g. Tablet bukal h. Tablet sublingual i. Troche atau Lozenges j. Dental cones
3. Tablet yang diberikan dengan rute lain
k. Tablet implantasi l. Tablet vaginal 4. Tablet yang dipergunakan
untuk membuat larutan
m. Tablet effervescen n. Tablet dispending o. Tablet hipodermik p. Tablet triturate (Siregar dan Wikarsa, 2010)
2.2 Parasetamol Rumus Bangun
H
N CH3
O
HO
Rumus Struktur : C8H9NO2
Berat Molekul : 151,16
Nama Kimia : 4’- Hidroksiasetanilida
Pemerian : Serbuk hablur, putih; tidak berbau; rasa sedikit pahit.
Kelarutan : Larut dalam air mendidih dan dalam natrium Hidroksida
1N; mudah larut dalam etanol; tidak larut dalam benzene dan eter (Ditjen POM, 1995)
2.2.1 Mekanisme kerja
Golongan obat ini menghambat enzim siklo-oksigenase sehingga konversi asam penting arakidonat menjadi PGG2 (prostaglandin yang mengandung peroksida yang sangat reaktif) terganggu. Setiap obat menghambat siklooksigenase dengan cara yang berbeda. Khusus paracetamol, hambatan biosintesis prostaglandin hanya terjadi bila lingkungannya rendah kadar peroksida seperti dihipotalamus. Lokasi inflamasi biasanya mengandung banyak peroksida yang dihasilakan oleh leukosit. Ini menjelaskan mengapa efek anti-inflamasi parasetamol praktis tidak ada (Ganiswara, 1995).
2.2.2 Farmakokinetik
Asetaminofen diberikan secara oral. Penyerapan dihubungkan dengan penggosongan perut, dan konsentrasi darah puncak biasanya tercapai dalam 30-60 menit. Asetaminofen sedikit terikat pada protein plasma dan sebagian dimetabolisme oleh enzim microsomal hati dan diubah menjadi sulfat danglukoronida acetaminophen, yang secara farmakologis tidak aktif. Kurang dari 5% diekresikan dalam keadaan tidak berubah. Metabolit minor tetapi sangat aktif (Nacetyle-p-benzoquinone) adalah penting dalam dosis besar karena efek toksisnya terhadap hati dan ginjal. Waktu paruh asetaminofen adalah 2-3 jam dan relative terpengaruh oleh fungsi ginjal. Dengan kualitas toksik atau penyakit hati, waktu paruhnya dapat meningkat dua kali lipat atau lebih (Katzung, 2002).
2.2.3 Farmakodinamik
Efek analgesic parasetamol dan fenasetin serupa dengan selisilat yaitu menghilangkan atau mengurangi nyeri ringan sampai sedang. Keduanya menurunkan suhu tubuh dengan mekanisme yang diduga juga berdasarkan efek
sentral seperti salisilat. Efek anti-inflamasinya sangat lemah, oleh karena itu parasetamol dan fenasetin tidak digunakan sebagai antireumatik. Parasetamol merupakan penghambat biosintesis PG yang lemah. Efek iritasi erosi dan perdarahan lambung tidak terlihat pada kedua obat ini, demikian juga gangguan pernapasan dan keseimbangan asam basa (Setiabudy, 2007)
2.2.4 Efek samping
Pada penggunaan kronis dari 3-4 g sehari dapat terjadi kerusakan hati, pada dosis diatas 6 g mengakibatkan gangguan hati yang tidak reversibel.
Hepatotoksisitas ini disebabkan oleh metabolit-metabolitnya, yang pada dosi normal dapat ditangkal oleh glutathione (suatu tripeptida dengan –SH). Pada dosis diatas 10 g, persediaan peptide tersebut habis dan metabolit-metabolit mengikat pada protein dengan –SH di sel-sel hati, dan terjadilah kerusakan irreversible.
Dosis dari 20 g dapat berakibat fatal.
Overdosis biasa meningkatkan antara lain mual, muntah dan anorexia.
Penanggulangannya dengan cuci lambung, juga perlu diberikan zat-zat penawar (asam amino N-asetilsintein dan metionin) sedini mungkin, sebaiknya dalam 8-10 jam setelah intoksikasi (Tjay dan Rahardja, 2007).
2.2.5 Indikasi
Penggunaan fenasetin dan asetaminofen sebagai analgetik dan antipiretik adalah sama dengan salisilat. Analgesic, fenasetin dan asetaminofen dapat diberikan tiap 3-4 jam untuk keadaan-keadaan seperti sakit kepala, migren, nyeri haid, arthralgia, dan lain-lain. Tetapi sebaiknya terapi jangan diberikan terlalu lama. Jika dosis terapi yang biasa diberikan tidak memberikan manfaat, dosis yang lebih besar biasanya juga tidak menolong (Tanu, 1972).
Antipiretik, penggunaan fenasetin dan asetaminofen untuk meredakan demam telah terdesak oleh penggunanya untuk menimbulkan analgesia. Untuk dewasa dosis 325 mg- 1000 mg, diberikan secara oral tiap 3 atau 4 jam. Untuk anak 20 mg per kg BB, diberikan tiap 4-6 jam, dosis total perhari jangan melebihi 3,6 g (Tanu, 1972)
Digunakan untuk mengurangi atau melenyapkan rasa nyeri dan menurunkan suhu badan yang tinggi. Misalnya pada sakit kepala, sakit gigi, nyeri haid, keseleo, demam imunisasi, demam flu dan lain sebagainya. Obat-obat golongan ini yang beredar sebagi obat bebas adalah untuk sakit yang bersifat ringan, sedangkan untuk sakit yang berat (misal: sakit karena batu ginjal dan batu empedu, kanker) perlu menggunakan jenis obat keras, dan untuk demam yang berlarut-larut membutuhkan pemeriksaan dokter.
2.3 Disolusi
Disolusi didefinisikan sebagai proses suatu zat padat masuk ke dalam pelarut menghasilkan suatu larutan. Secara sederhana, disolusi adalah proses zat padat melarut. Secara singkat, proses ini dikendalikan oleh afinitas antara zat padat dan pelarut (Ansel, 1989).
Agar suatu obat diabsorbsi, mula-mula obat tersebut harus larut dalam cairan pada tempat absorbs. Dalam hal ini dimana kelarutan suatu obat tergantung dari apakah medium asam atau medium basa, obat tersebut akan dilarutkan berturut-turut dalam lambung dan dalam usus halus. Proses larutnya suatu obat disebut disolusi (Anief, 1987).
Pada suatu partikel obat mengalami disolusi, malekul-molekul obat pada permukaan mula-mula masuk kedalam larutan menciptakan suatu lapisan jenuh obat-larutan yang membungkus permukaan partikel obat padat yang dikenal dengan lapisan difusi. Dari lapisan difusi ini, molekul-molekul obat keluar melawati cairan yang melarut dan berhubungan dengan membrane biologis serta absorbs terjadi (Anief, 1987).
Kecepatan disolusi obat merupakan tahap pembatasan kecepatan sebelum obat berada dalam darah. Apabila suatu sediaan padat berada dalam saluran cerna, ada dua kemungkinan yang akan berfungsi sebagai pembatas kecepatan. Bahan berkhasiat dari sedian tersebut pertama-tama harus terlarut, setelah itu barulah obat yang berada dalam larutan melewati membran saluran cerna. Obat yang larut baik dalam air akan melarut cepat dan akan berdisfusi secara pasif atau transport aktif, kelarut obat merupakan pembatas kecepatan absorbs melalui membrane saluran cerna. Sebaiknya kecepatan disolusi dari obat tidak larut atau disintagrasi sediaan relative pengaruhnya kecil terhadap disolusi zat aktif. Apabila kecepatan absorbs tidak dapat ditentukan oleh salah satu dari tahap, maka tidak satupun dari kedua tahap merupakan pembatas kecpatan (Syukri, 2002).
2.3.1 Metode uji disolusi
Menurut Farmakope Indonesia Edisi V (2014), ada dua metode uji disolusi yaitu :
a. Metode basket
Alat terdiri atas wadah tertutup yang terbuat dari kaca atau bahan transparan lain yang inert, dilengkapi dengan suatu motor atau alat penggerak.
Idak Wadah tercelup sebagian dalam penangas sehingga dapat mempertahankan suhu tablet atau kapsul granul atau agreget partikel halus obat dalam larutan obat
dalam darah, cairan, dan dalam jaringan lain dalam wadah 370 ± 0,50C selama penguji berlangsung. Bagian dari alat termasuk lingkungan tempat alat diletakkan tidak dapat memberikan gerakan, goncangan, atau getaran signifikasi yang melebihi gerakan akibat perputaran alat pengaduk. Wadah sdisolusi dianjurkan berbentuk silinder dengan dasar setengah bola, tinggi 160-175 mm, diameter dalam 98-106 mm, dengan volume sampai 1000 ml. batang logam berada pada posisi tertentu sehingga sumbuhnya tidak lebih drai 2 mm, berputar dengan halus dan tanpa goyangan yang berarti. Suatu alat pengatur mempertahankan kecepatan alat.
b. Metode dayung
Sama seperti metode dayung, tetapi pada alat ini digunakan dayung yang terdiri atas dayung dan batang seperti pengaduk. Batang dari dayung tersebut sumbunya tidak lebih dari 2 mm dan berputar dengan halus tanpa goyangan yang berarti. Jarak antara daun dan bagian dalam dasar wadah dipertahankan selama pengujian berlangsung. Daun dan batang logam yang merupakan satu kesatuan dapat disalut dengan suatu panyalut inert yang sesuai. Sediaan dibiarkan tenggelam kedasar wadah sebelum dayung mulai berputar.
2.3.2 Prosedur pengujian disolusi
Pada tiap pengujian, dimasukkan sejumlah volume media disolusi (seperti yang tertera dalam masing-masing monografi) kedalam wadah, pasang alat dan dibiarkan media disolusi mencapai temperature 370C. Satu tablet dicelupkan dalam keranjang atau dibiarkan tenggelam ke bagian daar wadah, kemudian pengaduk diputar dengan kecepatan seperti yang ditetapkan dalam monografi.
Pada interval waktu yang ditetapkan dari media diambil cuplikan pada daerah pertengahan antara permukaan media disolusi dan bagian atas dari keranjang berputar atau daun dari alat dayung tidak kurang 1 cm dari dinding wadah untuk analisis penetapan kadar dari bagian obat yang terlarut. Tablet harus memenuhi syarat seperti yang terdapat dalam monografi untuk kecepatan disolusi (Ditjen POM, 1995).
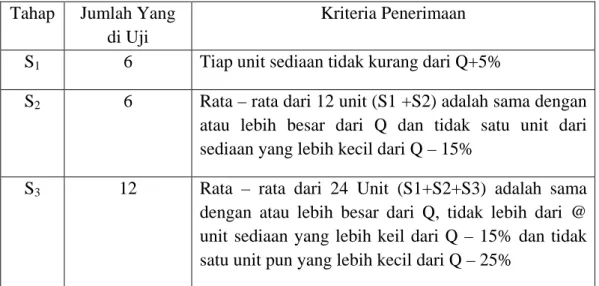
2.3.3 Kriteria penerimaan hasil uji disolusi
Persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan table penerimaan. Pengujian dilakukan sampai tiga tahap.
Pada tahap 1 (S1), 6 tablet diuji. Bila pada tahap ini tidak memenuhi syarat, maka akan dilanjutkan yaitu tahap 2 (S2). Pada tahap ini 6 tablet tambahan diuji lagi.
Bila tetap tidak memenuhi syarat, maka pengujian dilanjutkan lagi ke tahap 3 (S3). Pada tahap ini 12 ini tablet tambahan diuji lagi.
Tabel 2.2 Kriteria penerimaan uji disolusi Tahap Jumlah Yang
di Uji
Kriteria Penerimaan S1 6 Tiap unit sediaan tidak kurang dari Q+5%
S2 6 Rata – rata dari 12 unit (S1 +S2) adalah sama dengan atau lebih besar dari Q dan tidak satu unit dari sediaan yang lebih kecil dari Q – 15%
S3 12 Rata – rata dari 24 Unit (S1+S2+S3) adalah sama dengan atau lebih besar dari Q, tidak lebih dari @ unit sediaan yang lebih keil dari Q – 15% dan tidak satu unit pun yang lebih kecil dari Q – 25%
2.3.4 Pengaruh bentuk sediaan terhadap laju disolusi
Factor-faktor yang mempengaruhi laju disolusi dari bentuk sediaan biasanya diklasifikasikan atas tiga katagori yaitu :
1. Faktor yang berkaitan dengan sifat fisikokimia obat
Sifat-sifat fisikokimia dari obat yang mempengaruhi laju disolusi meliputi kelarutan, bentuk Kristal, bentuk hidrat solvasi dan kompleksasi serta ukuran- ukuran partikel. Sifat-sifat fisikokimia lain seperti kekentalan berperan terhadap munculnya permasalahan dalm disolusi seperti terbentuknya flokulasi, flotasi dan aglomerasi (Syukri, 2002).
2. Faktor yang berkaitan dengan formulasi sediaan
Formulasi sediaan berkaitan dengan bentuk sediaan, bahan pembantu dan cara pengolahan. Pengaruh bentuk sediaan pada laju disolusi tergantung pada kecepatan pelepasan bahan aktif yang terkandung pada kecepatan pelepasan bahan aktif yang terkandung di dalamnya. Secara umum laju disolusi akan menurun menurut urutan sebagai berikut: suspense, kapsul, tablet, dan tablet salut. Secara teoritis disolusi bermacam sediaan padat tidak selalu urutan dan masalahnya sama, karena diantara masing-masing bentuk sediaan padat tersebut aka nada perbedaan baik ditinjau dari segi teori maupun peralatan uji disolusi, seperti pada sediaan berbentuk serbuk, kapsul, tablet-tablet, suppositoria, suspense, topikat, penghancur, dan pelivin dalam proses formulasi mungkin akan menghambat atau mempercepat laju disolusi tergantung pada bahan pembantu yang dipakai. Cara pengolahan dari bahan baku, bahan pembantu dan prosedur yang dilaksanakan dalam formulasi sediaan padat peroral juga akan mempengarusi pada laju disolusi.
Perubahan lama waktu pengaduan pada granulasi basah dapat menghasilkan granul-granul besar, keras dan padat sehingga pada proses pencetakan dihasilkan
tablet dengan waktu hancur dan disolusi yang lama. Factor formulasi yang dapt mempengaruhi laju disolusi diantaranya kecepatan disintegrasi, interaksi obat dengan eksipien, kekerasan dan porositas (Siregar dan Wikarsa, 2010).
3. Faktor yang berkaitan dengan alat uji disolusi dan parameter uji
Faktor ini sangat dipengaruhi oleh lingkungan selama percobaan yang meliputi kecepatan pengaduan, suhu medium, pH medium dan metode uji yang dipakai. Pengaduan mempengaruhi penyebaran partikel-partikel yang berkontak dengan pelarut. Suhu medium berpengaruh terhadap kelarutan zat aktif. Untuk zat yang kelarutnya tidak tergantung pH, perubahan pH medium disolusi tidak akan mempengaruhi laju disolusi. Pemilihan kondisi pH pada percobaan in vitro penting karena kondisi pH akan berbeda pada lokasi obat di sepanjang saluran cerna, sehingga akan mempengaruhi kelarutan dan laju disolusi obat (Syukri, 2002).
2.3.5 Penetapan kadar
Metode yang dipilih dalam penetapan kadar uji disolusi tablet Parasetamol yaitu spektrofotometri sinar uv. Spektrofotometri sinar uv adalah pengukuran berapa banyak radiasi yang diserap oleh sampel. Metode ini biasanya digunakan untuk molekul dan ion-ion anorganik atau kompleks didalam larutan. Spectrum UV-Vis mempunyai bentik yang lebar dan hanya sedikit informasi tentang struktur yang didapatkan, tetapi spectrum ini sangat berguna untuk pengukuran secara kuantitatif (Dachtiyanus, 2004).
2.4 Spektrofotometri
Spektrofotometri UV-Vis adalah pengukuran serapan cayaha didaerah ultraviolet (200-400 nm) dan sinar tampak (400-800 nm) oleh suatu senyawa
Absorbansi spektrofotometri UV-Vis adalah istilah yang digunakan ketika radiasi ultraviolet dan cayaha tampak diabsorbsi oleh molekul yang diukir. Alatnya disebut UV-Vis spektrofotometer. Spektrofotometer UV-Vis adalah salah satu dari sekian banyak instumen yang digunakan dalam menganalisa suatu senyawa kimia. Spektrofotometer umumnya digunakan karena kemampuannya dalam menganalisa begitu banyak senyawa kimia serta kepraktisannya dalam hal preparasi sampel apabila dibandingkan dengan beberapa metode analisa (Mulja dan Suharman, 1995).
2.4.1 Instrumen
Suatu spektrofotometer tersusun dari sumber spectrum, monokromator, sel pengabsorbsi dan detector sebagai berikut :
1. Sumber, yang biasa yang digunakan adalah lampu wolfram. Tetapi untuk daerah UV digunakan lampu hydrogen atau lampu deuterium. Kenaikan lampu wolfram adalah energy radiasi yang dibebaskan tidak bervariasi pada berbagai panjang gelombang.
2. Monokromator, digunakan untuk mendispersikan sinar kedalam komponen-komponen panjang gelombangnya yang selanjutnya akan dipilih oleh celah (slit). Monokromator berputar sedemikian rupa sehingga kisaran panjang gelombang dilewatkan pada sampek sebagai scan instrumen melewati spectrum (Gandjar dan Rohman, 2007)
3. Optik-optik, dapat didesain untuk memecahkan sumber sinar, sehingga sumber sinar melewati 2 kompartemen, dan sebagaimana dalam spektrofotometer berkas ganda (double beam), suatu larutan blanko dapat digunakan dalam suatu kompartemen untuk mengkoreksi pembacaan atau
spectrum sampel. Yang paling sering digunakan sebagai blanko dalam spektrofotometri adalah semua pelarut yang digunakan untuk melarutkan sampel atau pereaksi (Gandjar dan Rohman, 2007).
4. Detektor, kebanyakan detector menghasilkan sinyal listrik yang dapat mengaktifkan meter atau pencatat. Setiap pencatat harus menghasilkan sinyal yang secara kuantitatif berkaitan dengan tenaga cahaya yang mengenainya. Persyaratan-persyaratan penting untuk detector meliputi : 1. Sensitivitas tinggi hingga dapat mendeteksi tenaga cahaya yang
mempunyai tingkatan rendah sekalipun.
2. Waktu respon yang pendek (Sastrohamidjojo, 1991).
BAB III METODE PENELITIAN
3.1Tempat pengujian
Uji disolusi tablet Paracetamol pengujiannya di PT. Kimia Farma (Persero) Tbk.
Plant Medan. Yang berada di jalan Sisingamangaraja no 1 Medan.
3.2 Alat
Alat yang digunakan adalah Dissolution Tester Hanson Tipe Visione 62 Elite 8TM (tipe paddle), Timbangan Analitik, pipet Volume, Erlenmeyer, Gelas Ukur 100 ml, Bola Karet, Batang Pengaduk, Beaker Glass, Pipet Tetes,Labu Tentukur 25 ml, Labu Tentukur 100 ml, Spektrofotometer UV-Vis Shimadzu UV 1800, spuit 20 ml dan printer Canon IP 1880.
3.3 Bahan
Bahan-bahan yang digunakan adalah akuades, Buffer phosphat Ph 5,8 dan tablet Paracetamol 500 mg yang di produksi oleh PT. Kimia Farma (Persero) Tbk Plant Medan.
3.4 Prosedur
3.4.1 Pembuatan buffer fosfat pH = 5,8
• Ditimbang KH2PO4 sebanyak 68,10 gr, masukkan kedalam beaker glass.
• Ditambahkan 18 ml NaoH 2N dilarutkan dalam 10 L aquadem
3.4.2 Pembuatan larutan standar
• Ditimbang seksama 55,55 mg baku kerja parasetamol, masukkan dalam labu ukur 100 ml.
• Dilarutkan dengan larutan buffer fosfat pH 5,8 (pelarut), dicukupkan dengan pelarut sampai batas.
• Dipipet 1 ml larutan, masukkan ke dalam labu ukur 100 ml lalu dicukupkan dengan pelarut, kocok.
3.4.3 Pembuatan larutan sampel
• Ditimbang bobot tablet satu persatu sebanyak 6 tablet, catat bobotnya.
• Diisi tabung disolusi dengan media (buffer fosfat) masing-masing sebanyak 900 ml.
• Panaskan media hingga suhu ± 37°C, dengan kecepatan putaran 50 rpm dengan cara menekan “HEATER” (kontrol dengan termometer bila perlu)
• Setelah suhu sesuai, dimasukkan tablet yang telah ditimbang (setara dengan bobot tablet 600 mg x 500/600 mg parasetamol) tadi kedalam masing-masing tabung (satu tablet per tabung).
• dayung dipasang pada alat disolusi
• Ditekan tombol “ON” pada alat, diatur waktu dengan menggunakan timer selama 30 menit.
• Setelah selesai, diambil sampel dengan menggunakan spuit 20 ml (posisi alat dayung masih berputar), pindahkan ke dalam beaker glass 50 ml.
• Dipipet 1 ml larutan, dimasukkan ke dalam labu ukur 100 ml, lalu dicukupkan dengan buffer fosfat pH 5,8 sampai garis tanda.
• Larutan siap dianalisis.
3.4.4 Cara penetapan serapan
Diukur serapan larutan A dan larutan B pada panjang gelombang serapan maximal ± 243 nm dengan menggunakan larutan buffer fosfat pH = 5,8 sebagai blanko
3.4.5 Rumus Perhitungan
Kadar uji disolusi dapat diukur dengan rumus K =Asp Ast x
Bsp 100x 1/100 Bst100x 1/100 x Kst
Dimana:
Asp = Absorbansi sampel Ast = Absorbansi standart
Bsp = Bobot parasetamol yang terkandung dalam sampel yang ditimbang (mg) Bst =Bobot standart parasetamol yang ditimbang (mg)
Kst =Kadar standart parasetamol (%)
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
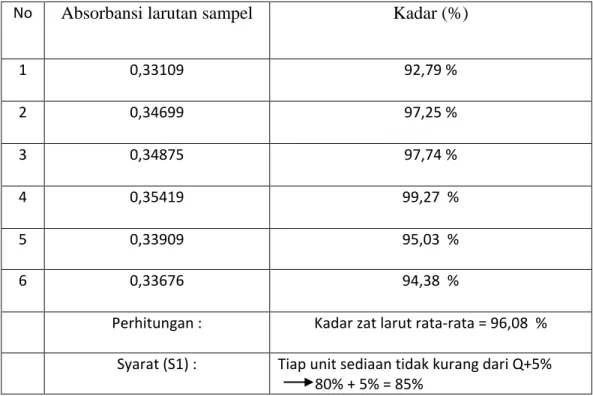
Tabel 1 Uji Disolusi
No Absorbansi larutan sampel Kadar (%)
1 0,33109 92,79 %
2 0,34699 97,25 %
3 0,34875 97,74 %
4 0,35419 99,27 %
5 0,33909 95,03 %
6 0,33676 94,38 %
Perhitungan : Kadar zat larut rata-rata = 96,08 % Syarat (S1) : Tiap unit sediaan tidak kurang dari Q+5%
80% + 5% = 85%
4.2 Pembahasan
Tablet paracetamol yang diproduksi PT. Kimia Farma (Persero) Tbk Plant Medan, sebelumnya dilakukan uji disolusi dalam rangkaian pemastian mutu produk hal ini dilakukan untuk mengetahui absorbansi dan toleransi yang akan di pasarkan ke konsumen. Hasil penetapan kadar Tablet Parasetamol 500 mg yang dilakukan pada uji disolusi secara spektrofotometri terhadap 6 (enam) tablet diperoleh kadar yaitu 92,79 %, 97,25 %, 97,74 %, 99,27 %, 95,03 %, 94,38 %.
Kadar zat aktif yang terlarut tersebut sesuai dengan persyaratan yang ditetapkan dalam Farmakope Indonesia Edisi IV, dimana jumlah keenam sampel yang diuji memenuhi persyaratan yaitu kadar tidak kurang dari Q + 5% (Q = 80%). Hal ini menunjukkan bahwa zat aktif Parasetamol mempunyai kecepatan pelarutan baik.Farmakope Indonesia Ed. IV menyatakan, kecuali dinyatakan lain dalam masing-masing monografi, persyaratan dipenuhi bila jumlah zat aktif yang terlarut dari sediaan yang diuji sesuai dengan tabel penerimaan. Pengujian dilanjutkan sampai tiga tahap, Pada tahap 1 (S1), 6 tablet diuji. Bila pada tahap ini tidak memenuhi syarat, maka akan dilanjutkan ke tahap berikutnya yaitu tahap 2 (S2). Pada tahap ini 6 tablet tambahan diuji lagi. Bila tetap tidak memenuhi syarat, maka pengujian dilanjutkan lagi ke tahap 3 (S3). Pada tahap ini 12 tablet tambahan diuji lagi (Siregar dan Wikarsa, 2010).
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari pengujian yang dilakukan terhadap 6 tablet Paracetamol, diperoleh persentase kadar zat aktif yang terlepas adalah sebagai berikut : 92,79%, 97,25%, 97,74 %, 99,27%, 95,03%, 94,38%. Tablet Paracetamol yang di uji memenuhi persyaratan disolusi karena menurut Farmakope Indonesia edisi IV. Syarat Farmakope Indonesia. Tiap unit sediaan tidak kurang dari 85 % (Q + 5% )dari jumlah yang tertera pada etiket.
5.2 Saran
Sebaiknya uji disolusi dalam tablet Paracetamol dapat dilakukan dengan metode uji disolusi lainnya, seperti uji disolusi dengan metode keranjang. Hal inu menjadi penting karen akan memberikan perbandingan akurasi dalam perhitungan. Konsumen agar mengkonsumsi obat yang telah teregistrasi dan telah terstandardrisasi oleh PT. Kimia Farma (Persero) Tbk Plant Medan. Karena obat yang telah memenuhi syarat termasuk syarat uji disolusi akan memberikan jaminan terhadap tercapainya efek terapi yang diinginkan.
DAFTAR PUSTAKA
Agoes, G. (2008). Pengembangan Sedia Farmasi. Bandung: ITB Press. Hal. 379, 380.
Anief, M. (1987). Ilmu Farmasi. Yogyakarta: Gadjah Mada University Press. Hal.
31, 38, 39, 61, 62.
Anief, M. (1996). Penggolongan Obat : Berdasarkan khasiat dan penggunaan.
Yogyakarta: Gadjah Mada University Press. Hal. 6, 7, 9.
Ansel, C.H. (1989). Pengantar Bentuk Sediaan Farmasi. Edisi Keempat. Jakarta:
UI Press. Hal. 244-245.
Charles, J.P., danWikarsa, S. (2010). Teknologi Farmasi Sediaan Tablet Dasar DasarPraktis. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 1-4,53,
85,188
Dachriyanus. (2004) Analis Struktur Senyawa Organik Secara Spektoskopi.
Padang : Andalas University Press. Hal. 62-63
Ditjen POM RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 1083, 1084.
Ditjen POM RI. (2014). Farmakope Indonesia. Edisi V. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 1083, 1084.
Gandjar & Rohman, A. (2007). Kimia Farmasi. Yogyakarta: Pustaka Pelajar. Hal.
261-262.
Ganiswara, S. G. (1995). Farmakologi dan Terapi. Edisi IV. Jakarta: Universitas Indonesia. Hal. 207,209.
Lachman, L. (1994). Teori dan Praktek Farmasi Industri. Jakarta: Universitas Indonesia Press. Hal. 645,647,795.
Katzung, B.G. (2002). Farmakologi Dasar dan Klinik. Edisi VIII. Jakarta:
Salemba Medika. Hal. 492-493.
Mulja. M. H dan Suharman. (1995). Analis Instrument. Cetakan I. Surabaya:
Airlangga University Press. Hal. 28
Sastrohamidjojo, H. (1991), Spektroskopi, Edisi Kedua, Liberty, Yogyakarta. Hal.
11,13.
Setiabudy, R. (2007). Farmakologi dan Terapi Edisi V. Jakarta: Departemen Farmakologi dan Terapeutik FK UI. Hal. 231,232,237-238.
Tjay, T. H. dan Rahardja, K. (2007). Obat – Obat Penting Edisi IV Cetakan Pertama. Jakarta: Penerbit PT. Elex Media Komputindo. Hal. 318-319.
Syukri, Y. (2002). Biofarmasetika. Edisi Pertama. Yogyakarta: UI Press. Hal.
31,36, 37, 38.
Tanu, Ian. (1972). Farmakologi Dan Terapi. Edisi Pertama. Jakarta: Universitas Indonesia. Hal. 162, 164
Wilmana, P.F. (1995). Analgesik – Antiperitik, Analgesik Anti – Inflamasi Non Steroid dan Obat Pirai: Farmakologi dan Terapi. Edisi IV. Jakarta: Universitas Indonesia Press. Hal. 217-218.
Lampiran 1. Data dan hasil uji disolusi tablet parasetamol Nama sediaan : Tablet Paracetamol
Zat berkhasiat : 500 mg Paracetamol tiap Tablet
No. Bets : A30059 T
Media Disolusi : Buffer Phosfat
Tipe Alat : Tipe dayung (Paddle)
Waktu : 30 Menit
Kecepatan Rotasi : 50 rpm Panjang gelombang : 243 nm
Persyaratan : Tiap unit sediaan tidak kurang dari Q + 5 80% + 5% = 85% dari jumlah yang tertera pada etiket
Bobot Baku : 55,55 mg
Faktor pengenceran larutan Baku (Fb) : 100 ml Faktor pengenceran larutan uji (Fu) : 100 ml Kandungan Paracetamol pada etiket (Ke) : 500 mg Absorbansi Larutan Standar : 0,35959
Absorbansi larutan sampel
Sample Absorbansi larutan sampel
1 0,33109
2 0,34699
3 0,34875
4 0,34375
5 0,33909
6 0,33676
Lampiran 2. Perhitungan uji disolusi tablet parasetamol
K =Asp
Ast x
Bsp 100x 1/100 Bst
100x 1/100 x Kst Keterangan :
Asp = Absorbansi sampel Ast = Absorbansi standart
Bsp = Bobot parasetamol yang terkandung dalam sampel yang ditimbang (mg) Bst =Bobot standart parasetamol yang ditimbang (mg)
Kst =Kadar standart parasetamol (%)
1 K = 0,33109
0,35959 x
500 900x 1/100 55,5
100x 1/100 x 100,78% = 92,79%
2 K = 0,34699
0,35959 x
500 900x 1/100 55,5
100x 1/100 x 100,78% = 97,25%
3 K = 0,34875
0,35959 x
500 900x 1/100 55,5
100x 1/100 x 100,78% = 97,94%
4 K = 0,35419
0,35959 x
500 900x 1/100 55,5
100x 1/100 x 100,78% = 99,27%
5 K = 0,33909
0,35959 x
500 900x 1/100 55,5
100x 1/100 x 100,78% = 95,03%
6 K = 0,33676
0,35959 x
500 900x 1/100 55,5
100x 1/100 x 100,78% = 94,38%
Kadar rata-rata = 92,79% + 97,25% + 97,74% + 99,27% + 95,03% + 94,38%
= 96,38 %
Lampiran 3. Gambar alat disolusi (Merk Hanson Type Vision G2 Elite 8TM)
Gambar alat spektrofotometer (Agilent 8453)
Gambar alat pH meter