III. BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan sejak bulan Mei 2005 sampai dengan November 2006 di Laboratorium Pusat Studi Keragaman Mikrob Fakultas Matematika dan Ilmu Pengetahuan Alam, Baranangsiang Bogor, dan Research and Development Charoen Phokphand Indonesia, Jakarta.
3.2 Bahan dan Alat
3.2.1 Galur-galur Bakteri dan Plasmid
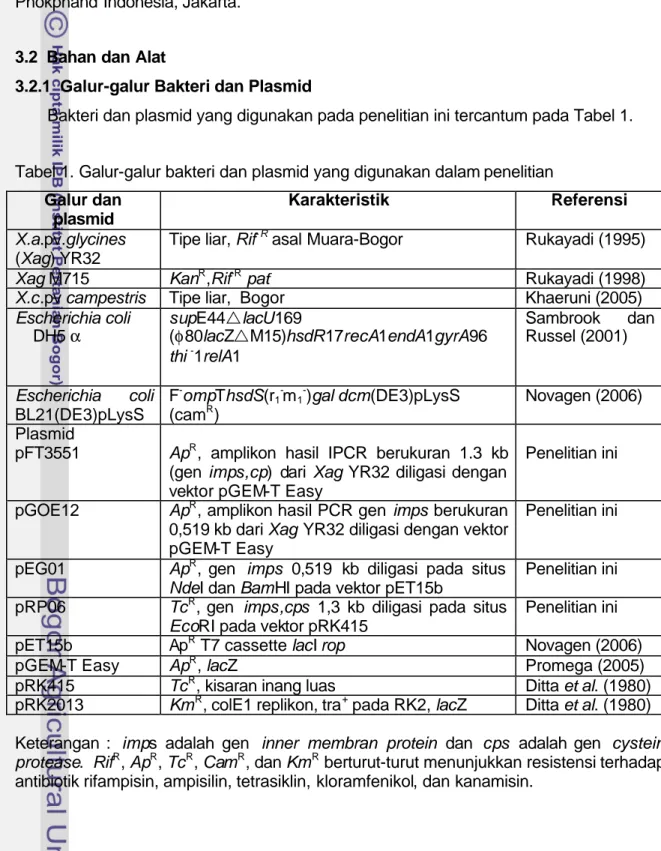
Bakteri dan plasmid yang digunakan pada penelitian ini tercantum pada Tabel 1.
Tabel 1. Galur-galur bakteri dan plasmid yang digunakan dalam penelitian
Galur dan plasmid
Karakteristik Referensi
X.a.pv.glycines (Xag) YR32
Tipe liar, Rif- R asal Muara-Bogor Rukayadi (1995)
Xag M715 KanR,Rif-R pat- Rukayadi (1998)
X.c.pv campestris Tipe liar, Bogor Khaeruni (2005) Escherichia coli DH5 α supE44rlacU169 (φ80lacZrM15)hsdR17recA1endA1gyrA96 thi -1relA1 Sambrook dan Russel (2001) Escherichia coli BL21(DE3)pLysS
F-ompThsdS(r1-m1-)gal dcm(DE3)pLysS (camR)
Novagen (2006)
Plasmid
pFT3551 ApR, amplikon hasil IPCR berukuran 1.3 kb (gen imps,cp) dari Xag YR32 diligasi dengan vektor pGEM-T Easy
Penelitian ini
pGOE12 ApR, amplikon hasil PCR gen imps berukuran 0,519 kb dari Xag YR32 diligasi dengan vektor pGEM-T Easy
Penelitian ini
pEG01 ApR, gen imps 0,519 kb diligasi pada situs NdeI dan BamHI pada vektor pET15b
Penelitian ini
pRP06 TcR, gen imps,cps 1,3 kb diligasi pada situs EcoRI pada vektor pRK415
Penelitian ini
pET15b ApR T7 cassette lacI rop Novagen (2006)
pGEM-T Easy ApR, lacZ Promega (2005)
pRK415 TcR, kisaran inang luas Ditta et al. (1980) pRK2013 KmR, colE1 replikon, tra+ pada RK2, lacZ Ditta et al. (1980)
Keterangan : imps adalah gen inner membran protein dan cps adalah gen cystein protease. RifR, ApR, TcR, CamR, dan KmR berturut-turut menunjukkan resistensi terhadap antibiotik rifampisin, ampisilin, tetrasiklin, kloramfenikol, dan kanamisin.
Pada penelitian ini digunakan isolat X.axonopodis pv.glycines YR32 sebagai acuan untuk mempelajari mekanisme patogenisitas pada X. axonopodis pv glycines YR32. Enzim yang digunakan untuk teknik molekuler antara lain EcoRV, EcoRI, NdeI, BamHI, T4 DNA ligase (New England Biolabs (NEB) Inc., USA., Invitrogen USA), Taq polimerase (New England Biolabs (NEB) USA, dan Finnzymes OY, Finland). Purifikasi DNA (Wizard®SV Gel and PCR Clean-Up System, Promega, USA). Proteinase-K, RNase dan lisozim dari Sigma Chemical Co, Australia.
Alat utama yang digunakan dalam penelitian ini adalah seperangkat piranti elektroforesis mini gel (Bio-Rad Mini-Sub Cell GT, CA, USA), kamera Polaroid Hoefer’s Photoman DS32 (Kodak), UV Transilluminator (Hoefer Scientific Instruments, San Fransisco, USA), Microcentrifuge (SORVALL® Pico, USA), Automated DNA Sequencer 2720 Thermal Cycler (Applied Biosystems, USA), GeneAmp PCR system 2400 (Applied Biosystems, USA), Gel Documentation (Herolab UVT, USA), seperangkat piranti elektroforesis protein Miniprotean® (Bio-Rad Mini-Sub Cell GT, CA, USA), Spektrofotometer U-2010 (Hitachi, Japan).
3.2.2 Media Tumbuh
Bakteri X. axonopodis pv glycines YR32 tipe liar maupun mutannya M715, ditumbuhkan pada media Yeast Dextrose CaCO3 (YDC). Setiap liter medium YDC mengandung ekstrak khamir 10 g, dekstrosa 5 gram, CaCO3 20 gram, agar-agar 15 gram dan air suling 1000 ml. Bakteri Xanthomonas diinkubasi pada suhu 28-30 oC selama 24-48 jam, sedangkan Escherichia coli ditumbuhkan pada media Luria Bertani (LB) (ekstrak khamir lima gram, triptone 10 gram, dan NaCl 10 gram, air suling 1000 ml) pada suhu 37 oC selama 12-16 jam. Antibiotika yang ditambahkan pada media adalah rifampisin (Rif) 100 µg/ml, ampisilin (Ap) 100 µg/ml, tetrasiklin (Tc) 15 µg/ml, kanamisin (50 µg/ml), atau kloramfenikol (34 µg/ml).
3.3 Metodologi
3.3.1 Isolasi DNA Genom Total
Isolasi total DNA genom mengikuti metode Lazo et al. (1987). Sel Xag ditumbuhkan selama semalam di dalam lima mililiter medium LB cair yang diinkubasi pada suhu 28oC, dan dipanen dengan disentrifugasi pada kecepatan 12000 rpm selama empat menit. Sentrifugasi dilakukan menggunakan Microcentrifuge (SORVALL® Pico, USA). Pelet dicuci dengan satu mililiter buffer STE (100mM NaCl, 10mM Tris-HCl, satu mM EDTA pH 8.0) kemudian diresuspensikan dan disentrifugasi pada kecepatan yang sama selama empat menit. Pelet diresuspensikan dengan satu mililiter buffer STE dan
disentrifugasi selama 12000 rpm selama empat menit. Setelah pelet diresuspensi dengan 200 µl buffer STE dan ditambahkan 40 µl larutan SDS 10%, suspensi diinkubasi pada suhu 65oC selama 30 menit kemudian didinginkan pada suhu ruang. Lisis sel dilakukan dengan menambahkan empat µl 10 mg/ml Proteinase-K, lalu diinkubasi pada suhu 37oC selama tiga jam. Setelah ditambah 200 µl buffer STE, suspensi diekstraksi dengan larutan fenol dan kloroform sebanyak 250 µl, lalu dibolak balik secara perlahan sampai terbentuk emulsi kemudian disentrifugasi 12000 rpm selama 10 menit. Tahap ini dilakukan sebanyak lima kali. Supernatan ditambah kloroform sebanyak 200 µl dan disentrifugasi 12000 rpm selama 10 menit. Tahap ini dilakukan dua kali. Supernatan yang mengandung DNA dipindahkan ke tabung mikro steril dan dipresipitasi dengan satu mililiter etanol 95% dingin. Benang-benang DNA dililit menggunakan ujung tip mikro ukuran 200 µl, lalu dikeringudarakan. DNA disuspensikan dalam ddH20 yang mengandung 10 µg/ml RNase. Setelah diinkubasi selama 10 menit pada suhu 65oC, DNA disimpan pada suhu –20oC.
3.3.2 Inverse Polymerase Chain Reaction (IPCR)
Inverse PCR dilakukan sesuai dengan metode seperti yang diterangkan Wahyudi et al. (2001). Primer didisain dari sekuen Pratiwi (2004) dengan urutan nukleotida P1 : 5’-ATCCTTGCCGCCATTGACCTG-3’ dan P2: 5’-CCACCGAACTTGAACTGGTC-3’. PCR dilakukan dengan LA Taq polimerase (TaKaRa Bio Inc. Japan) dengan kondisi prePCR pada suhu 94oC selama satu menit, denaturasi pada suhu 95oC selama dua menit, penempelan primer pada suhu 62oC selama satu menit, sintesis pada suhu 72oC selama satu menit, postPCR pada suhu 72oC selama 10 menit. PCR dilakukan sebanyak 30 siklus.
3.3.3 Isolasi dan Pemurnian Hasil PCR dan Fragmen DNA dari Gel Agarosa
Fragmen DNA dengan ukuran yang sesuai diisolasi dari gel dengan metode pemurnian DNA melalui sentrifugasi (Wizard SV Gel and PCR Clean-UP System, Promega, USA). Gel sisipan dipotong-potong berbentuk kubus satu mm3, lalu dimasukkan ke dalam tabung mikro steril. Kemudian pada tabung mikro tersebut ditambahkan 10 µl Membrane Binding Solution per 10 mg gel, divortex dan diinkubasi pada suhu 65oC sampai gel larut. SV Minicolumn dimasukkan ke dalam Collection Tube. Campuran gel terlarut dipindahkan pada Minicolumn kemudian diinkubasi pada suhu ruang selama satu menit. Campuran disentrifugasi pada 12000 rpm selama satu menit. Cairan dibuang dan Minicolumn dimasukkan kembali ke Collection Tube. Untuk mencuci sisa-sisa agarosa, DNA dicuci dengan 700 µl Membrane Wash Solution, lalu
disentrifugasi 12000 rpm selama satu menit. Cairan dibuang, dan Minicolumn dimasukkan kembali ke dalam Collection Tube. Pencucian diulang kembali dengan menambahkan 500 µl Membrane Wash Solution, lalu disentrifugasi 12000 rpm selama lima menit. Minicolumn dipindahkan ke tabung mikro steril, kemudian ditambahkan 50 µl ddH2O, diinkubasi pada suhu ruang selama satu menit. Hasil elusi disentrifugasi pada 12000 rpm selama satu menit, lalu disimpan pada –20 oC. Pemurnian hasil PCR dilakukan sama dengan isolasi DNA dari gel, hanya Membrane Binding Solution ditambahkan dengan volume yang sama dengan volume PCR.
3.3.4 Kloning Gen Patogenisitas
Hasil purifikasi DNA dari Inverse PCR diklon pada vektor pGEM-T Easy. Campuran diligasi dan diinkubasi pada suhu 16oC selama semalam. Transformasi dilakukan dengan terlebih dahulu menyiapkan sel kompeten. Sel E. coli DH5α ditumbuhkan pada media LB pada suhu 37oC semalam. Lalu disubkultur dengan memindahkan satu persen kultur E. coli pada medium LB dan diinkubasi selama tiga jam pada 37oC. Sebanyak 1.5 mililiter kultur dimasukkan ke dalam tabung mikro steril, kemudian disentrifugasi dengan kecepatan 6000 rpm selama dua menit. Pada pelet ditambahkan satu mililiter NaCl dingin, kemudian diresuspensi dan diinkubasi selama 20 menit di atas es. Suspensi disentrifugasi dengan kecepatan 6000 rpm selama dua menit. Dua ratus µl CaCl2-Tris dingin ditambahkan pada pelet dan diresuspensi, lalu diinkubasi selama 30 menit di atas es. Setelah itu sel kompeten siap digunakan untuk transformasi.
Transformasi dilakukan dengan mencampurkan hasil ligasi ke dalam 200 µl sel kompeten. Campuran tersebut kemudian diinkubasi di atas es selama 30 menit, kemudian diinkubasi pada suhu 42oC selama 60 detik untuk proses heat –shock. Untuk memulihkan kondisi fisiologi sel, campuran ditambahkan 250 µl medium LB cair dan digoyang horisontal pada suhu 37oC selama satu jam. Seluruh campuran disentrifugasi dengan kecepatan 6000 rpm selama dua menit. Pada pelet ditambahkan 200 µl medium LB cair dan disuspensikan. Suspensi disebar pada medium selektif LA+(X-Gal 40 µg/ml) dan antibiotika yang sesuai.
Koloni transforman yang tumbuh dan berwarna putih diambil untuk dilakukan verifikasi plasmid. Untuk mengetahui ukuran DNA sisipan pada plasmid transforman, dilakukan pemotongan plasmid menggunakan enzim EcoRI.
3.3.5 Isolasi DNA Plasmid
Isolasi plasmid dilakukan dengan metode lisis alkalin (Sambrook dan Russel 2001). Lima mililiter kultur sel ditumbuhkan semalam, kemudian dipanen dengan disentrifugasi pada kecepatan 6000 selama dua menit. Pelet disuspensi dengan 200 µl 1XTE yang mengandung 50 mM glukosa, kemudian diinkubasi di suhu ruang selama lima menit. Kemudian ditambahkan 200 µl larutan 1%SDS dalam 0.2 M NaOH, dan suspensi dibolak balik secara perlahan sampai terjadi lisis yang ditandai dengan berubahnya larutan menjadi bening dan kental. Sebanyak 200 µl larutan Na-asetat (pH 4,8) ditambahkan dan di vortex, lalu diinkubasi selama 10 menit. Tabung mikro disentrifugasi pada kecepatan 10000 rpm selama 10 menit. Supernatan diekstraksi menggunakan fenol+kloroform+isoamilalkohol (25:24:1). Fase cair dipindahkan ke tabung mikro steril lalu diendapkan dengan 2x volum etanol absolut dingin pada –20oC selama 30 menit. Setelah disentrifugasi pada 10000 rpm selama 10 menit, DNA dicuci dengan 70% (V/V) etanol dingin dan dikeringudarakan. DNA disuspensi dalam ddH2O dan mengandung 10 µg/ml RNAse (Sigma Chemical Co., Australia). Setelah diinkubasi pada suhu 37oC selama 30 menit, DNA disimpan pada suhu –20oC.
3.3.6 Sekuensing dan Analisis Sekuen DNA
Sekuensing DNA dilakukan dengan piranti DNA sequencer ABI PRISM 3100-AVANT Genetic Analyzer. DNA sisipan disekuen menggunakan primer universal M13-Reverse dan M13-Forward . Sekuen DNA yang diperoleh dibandingkan dengan sekuen DNA/protein yang ada di database European Bioinformatics Institute (EBI) BLASTX 2.0 pada situs http://www.ebi.ac.uk. Untuk mengetahui fungsi protein yang disandikan oleh gen tersebut dilakukan pelacakan dengan BLAST pada situs http://www.ncbi.nlm.nih.gov. Analisis ORF juga dilakukan dengan akses http://www.ncbi.nlm.nih.gov. Analisis promotor dilakukan dengan piranti lunak dari www.softberry.com. Struktur gen diketahui dengan perunutan sekuen setelah diketahui kodon awal dan kodon akhir.
3.3.7 Analisis Urutan Asam Amino
Urutan asam amino ImpX dibandingkan dengan database European Bioinformatics Institute (EBI) SWISS-MODEL REPOSITORY. Urutan asam amino diperoleh dari hasil pengolahan data bioinformatik dari urutan nukleotida yang diperoleh.
3.3.8 Isolasi RNA dan Reverse Transcriptase Polymerase Chain Reaction (RT-PCR)
RNA total diisolasi dari kultur cair Xag YR32 dan M715 setelah diinkubasi selama 28 jam (OD600= 0,7). RNA total diisolasi menggunakan Reagent TRIZOL® (Invitrogen, USA). Kualitas RNA yang terisolasi diverifikasi dengan melarikannya pada gel elektroforesis gel agarosa 1,5% terdenaturasi. Hasil elektroforesis diwarnai dengan 0,5
µM ethidium bromida. RNA dikuantifikasi dengan spektrofotometri pada 260 nm dan 280 nm. Sampel RNA total (5µg) dilakukan transkriptase terbalik oleh enzim reverse transcriptase M-MuLV (ProtoScript First Strand cDNA Synthesis Kit, New England Biolabs, Beverly, USA) dengan primer gen spesifik Reverse menggunakan metode standard dalam volume reaksi 20 µl. cDNA diamplifikasi dengan PCR menggunakan primer (imp-forward dan imp-reverse). Perancangan primer menggunakan Netprimer Analysis Software dari PRIMER Biosoft International. PCR dilakukan pada kondisi praPCR pada suhu 95oC selama tiga menit, denaturasi pada suhu 95oC selama satu menit, penempelan primer pada suhu 62oC selama satu menit, sintesis pada suhu 72oC selama satu menit dan postPCR pada suhu 72oC selama tujuh menit. PCR dilakukan sebanyak 30 siklus. Amplikon dilarikan pada elektroforesis gel agarosa menggunakan buffer TAE. 16S rDNA diamplifikasi dengan PCR menggunakan universal primer spesifik prokaryot (63F dan 1387R). Amplifikasi 16S rDNA dilakukan pada kondisi prePCR pada suhu 94oC selama lima menit, denaturasi pada suhu 94oC selama 30 detik, penempelan pada suhu 55oC selama 30 detik, sintesis pada suhu 72oC selama satu menit, postPCR pada suhu 72oC selama lima menit. PCR dilakukan sebanyak 30 siklus.
3.3.9 Analisis Hibridisasi Northern
Transfer RNA pada Membran Nilon. Gel yang berisikan RNA total dari Xag
YR32 dan Xag M715 (5 µg) dilarikan menggunakan elektroforesis pada gel agarosa 1% terdenaturasi selama dua jam pada 65V. Gel kemudian diwarnai dengan µM ethidium bromida 0,5 selama 15 menit dan divisualisasi menggunakan UV transilluminator. Gel dicuci dengan DEPC-treated water, lalu direndam dalam 200 ml 0,05 N NaOH selama 10 menit. Gel dipindahkan ke dalam 200 ml 20xSSC (3,0 M NaCl ; 0,3 M Na-asetat) pH 7,0 selama 40 menit. Gel segera ditransfer pada membran nilon (Amersham Life-Science, USA) semalam pada suhu ruang menggunakan larutan 20xSSC pH7,0 dengan metode kapiler (Sambrook dan Russel 2001). Membran dicuci dalam 6xSSC pada suhu ruang dengan agitasi selama 15 menit, lalu dikeringkan di atas kertas blotting (Amersham Life-Science, USA), dilanjutkan dengan fiksasi nukleotida pada membran dengan menggunakan oven pada suhu 80oC selama dua jam.
Pelabelan Pelacak dan Deteksi Hibridisasi. DNA pelacak dilabel dengan
menggunakan NEBlotTM PhototopeTM Kit (New England Biolab, Beverly, USA). Sebanyak 5 ng – 1 µg DNA hasil RT-PCR (375 bp) dalam 34 µl akuabides di dalam tabung mikro, didenaturasi dalam air dengan pemanasan 100oC selama lima menit. Untuk menjaga DNA tetap terdenaturasi, tabung mikro segera disimpan di atas es selama lima menit. Tabung mikro disentrifugasi pada 5000 rpm selama 30 detik. Selanjutnya secara berturut-turut ke dalam tabung ditambahkan 10 µl 5x mix labelling, lima µl mix dNTP, dan satu µl fragmen Klenow. Tabung reaksi kemudian diinkubasi pada suhu 37oC selama semalam. Reaksi dihentikan dengan menambahkan lima µl 0,2 M EDTA pH 8,0. DNA dipurifikasi dengan NucTrap Probe Purification Column (Stratagen, USA). Pada tabung mikro ditambahkan lima µl satu persen Tween 20 dan 15 µl 1 kali bufer STET (0,1 M NaCl; 10 mMTris pH 8,0; satu mM EDTA pH 8,0; 5% Triton X-100). Kolom dibasahi dengan 1x bufer STET sampai jenuh dan dikeluarkan dari kolom dengan syringe. Sampel dimasukkan ke dalam kolom, lalu dikeluarkan dengan syringe. Untuk mengeluarkan sisa-sisa DNA yang ada di dalam kolom, kolom dicuci dengan 1 kali buffer STET dengan syringe. DNA yang diperoleh digunakan sebagai pelacak. DNA pelacak disimpan pada suhu -20oC sebelum digunakan.
Membran diletakkan di dalam tabung hibridisasi, kemudian dimasukkan 10 ml larutan hibridisasi yang berisi formamide lima mililiter, 50xDenhardts satu mililiter, 20xSSPE 2,5 mililiter, 10% SDS 0,1 mililiter, DEPC-treated water 1,335 ml dan Salmon sperm DNA (Sigma, USA) 45 µl. Salmon sperm terlebih dahulu dipanaskan pada suhu 95oC selama 10 menit, dan disimpan di atas es selama lima menit. Tabung hibridisasi yang berisi membran diinkubasi selama dua jam pada 42oC. Pelacak yang telah dilabel dipanaskan dalam air dengan pemanasan pada suhu 100oC selama 10 menit, kemudian disimpan di atas es selama lima menit. Setelah itu dimasukkan ke dalam tabung hibridisasi, lalu diinkubasi pada suhu 42oC selama 16 jam sambil digoyang lemah. Proses hibridisasi dihentikan dengan melakukan pencucian membran menggunakan Larutan Pencuci I (1 kali SSC, 0,1% SDS) sebanyak dua kali masing-masing selama lima menit pada suhu ruang, dan Larutan Pencuci II (0,5 kali SSC, 0,1%SDS) sebanyak dua kali masing-masing selama lima menit pada suhu 50oC. Pencucian dilakukan dengan agitasi lemah. Membran dikeringudrakan dan siap untuk dideteksi.
Deteksi hasil hibridisasi RNA-DNA dilakukan dengan kit PhototopeTM Detection Kit (New England Biolab, Beverly, USA). Secara berturut-turut membran dicuci dengan Blocking solution, Larutan Streptavidin, Larutan Pencuci I, Biotinylated Alkaline Phosphatase, Blocking Solution, Larutan Pencuci II, dan Lumigen-PPD Reagent. Seluruh tahapan ini dilakukan selama lima menit pada suhu ruang dengan goyangan
sedang sesuai protokol kit PhototopeTM Detection Kit (New England Biolab, Beverly, USA). Membran ditempatkan pada kaset X-ray Exposure Holder (Eastman Kodak C0, NY). Selanjutnya dilakukan pemaparan menggunakan film X-ray (HyperfilmTM MP, Amersham Life-Science) di ruang gelap pada suhu ruang. Film X-ray diproses dengan cara direndam di dalam larutan high performance X-ray film developer (Fuji Photo Film Co., Ltd, Japan) sampai pada kontras yang diinginkan. Setelah dibilas dengan air, film X-ray dimasukkan ke dalam larutan X-X-ray film fixer (Fuji Photo Co., Ltd., Japan). Sesudah dibilas dengan air, film ray dikeringudarakan dan sinyal-sinyal yang muncul di film X-ray diamati.
3.3.10 Uji Komplementasi
Uji komplementasi dilakukan untuk mempelajari ada tidaknya pemulihan patogenisitas pada mutan non-patogenik Xag M715 jika diintroduksi dengan gen imps-cp dari Xag YR32. Gen imp-cp diklon pada vektor berspektrum luas pRK415, menghasilkan plasmid rekombinan pRP06, kemudian plasmid rekombinan ini diintroduksikan ke Xag M715 melalui konjugasi tiga tetua, dengan menggunakan E. coli HB101(pRK2013) sebagai penolong.
Pemulihan patogenisitas pada Xag mutan M715 (pRP06) dibandingkan tingkat patogenisitasnya dengan Xag YR32 tipe liar, mutan Xag M715 melalui bioesai kotiledon (Mesak et al. 1994). Gejala patogenisitas diamati mulai hari ke tiga hingga 14 hari setelah inokulasi.
3.3.11 Konjugasi Tiga Tetua
Resipien Xag M715 ditumbuhkan pada medium Luria Bertani (LB) yang ditambah 50
µg/ml kanamisin pada suhu 28oC selama 16 jam. E. coli HB101 yang membawa plasmid pRK2013 (penolong) ditumbuhkan pada medium LB yang ditambah 50 µg/ml kanamisin pada suhu 37oC selama 16 jam. Donor E. coli (pRP06) ditumbuhkan pada medium LB dengan penambahan 15 µg/ml tetrasiklin pada suhu 37oC selama 16 jam.
Perbandingan resipien, penolong dan donor adalah 15:1:1. Sebanyak 1500 µl sel resipien, 100 µl penolong dan 100 µl donor disatukan dalam tabung mikro steril. Lalu disentrifugasi dengan kecepatan 12.000 rpm selama dua menit. Pelet dicuci dengan NaCl 0,85% dan disentrifugasi kembali dengan kecepatan yang sama. Tahap ini dilakukan tiga kali. Pelet ditambah dengan 25 µl LB dan diresuspensikan dan di spot semuanya pada media LB agar. Kultur diinkubasi selama 16 jam pada suhu ruang. Koloni yang tumbuh diambil semuanya dan dipindahkan ke dalam tabung mikro steril lalu ditambahkan 100 µl LB, kemudian divortex sampai homogen. Kultur sel disebar
pada medium LA yang ditambah 50 µg/ml kanamisin, 100 µg/ml rifampisin dan 15 µg/ml tetrasiklin. Kultur diinkubasi pada suhu ruang. Koloni yang tumbuh digores kembali. Setelah itu dilakukan isolasi plasmid untuk mengecek sisipan yang ada di dalam plasmid.
3.3.12 Bioesai Patogenisitas pada Kotiledon Kedelai
Bioesai patogenisitas pustul bakteri menggunakan benih kedelai varietas Wilis yang diperoleh dari Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik (BB-Biogen,) Bogor. Biji kedelai didesinfeksi dengan NaOCl 0,5%, lalu digulung di dalam kertas merang dan diletakkan pada wadah berpenyangga berisi air, sehingga air meresap dan membasahi seluruh kertas merang. Kotiledon digunakan setelah berumur tujuh hari. Selanjutnya kotiledon dipisahkan dari tanaman dengan silet bersih dan steril lalu didesinfeksi dengan NaOCl 0,5% selama lima menit dan dibilas dengan akuades steril tiga kali untuk membersihkan sisa-sisa NaOCl. Bagian abaksial kotiledon ditusuk dengan seperangkat lima jarum steril yang diikat menjadi satu (Mesak et al. 1994). Koloni bakteri dari biakan umur 48 jam yang akan diuji dioleskan pada bekas luka tusukan pada kotiledon. Bakteri yang diuji adalah Xag YR32 tipe liar, Xag M715, Xag M715(pRP06), dan X. campestris campestris (kontrol negatif). Inkubasi dilakukan dalam ruang tumbuh bercahaya selama 3-14 hari pada suhu ruang. Parameter yang diamati adalah munculnya bercak kuning pada ktiledon.
3.3.13 Kloning dan Ekspresi Gen impX
Untuk mendapatkan gen impX, kromosom Xag YR32 tipe liar diamplifikasi menggunakan PCR dengan primer A : 5’-GGGGGACATATGAAATCCCTGAAAGTG-3’ dan B : 5’-GGGGGATCCAAACCGCGGGAATTCGAT-3’. Huruf yang digarisbawahi masing-masing menunjukkan situs restriksi NdeI dan BamHI. Primer dirancang dari urutan nukleotida yang berhasil diisolasi dari Xag YR32. PCR dilakukan pada kondisi prePCR 94oC selama satu menit, denaturasi 95oC selama dua menit, penempelan primer 60oC selama satu menit, sintesis 72oC selama satu menit dan postPCR 72oC selama 10 menit. Siklus PCR sebanyak 30 siklus. Hasil PCR dipurifikasi dengan WizardR SV Gel and PCR Clean-UP System (Promega, USA) lalu diligasi dengan pGEM-T Easy. Plasmid rekombinan ditransformasikan pada E. coli DH5α.
Plasmid rekombinan dalam E. coli DH 5α diisolasi dengan dipotong NdeI dan BamHI, lalu sisipan yang berukuran 519 bp diligasikan dengan pET15b yang sebelumnya telah dipotong dengan enzim restriksi yang sama. Plasmid rekombinan pada pET15b ditransformasikan pada E. coli BL21 (DE3)pLysS.
3.3.14 Isolasi Protein
Satu koloni tunggal E. coli BL21 (DE3)pLysS ditumbuhkan pada 2 ml medium LB yang ditambah dengan 34 µg/ml kloramfenikol. Setelah mencapai OD600= 0,7, kultur disentrifugasi 30 detik, lalu dimasukkan ke dalam 50 ml LB. Kultur diinkubasi pada suhu 37oC selama tiga jam. Untuk bakteri yang tidak diinduksi, 1,5 ml sel dimasukkan ke dalam tabung mikro steril, lalu disentrifugasi 8.000 rpm selama lima menit. Kemudian, pelet dicuci dengan 250 µl 0,1 mM TrisCl pH 7,5 sebanyak dua kali, lalu disentrifugasi dengan kecepatan yang sama. Pelet diresuspensi dengan 500 µl 0,1 mM TrisCl pH 7,5. Untuk sel yang diinduksi, kultur sel ditambah IPTG sampai konsentrasi akhir satu mM IPTG dan diinkubasi selama tiga jam. Setelah itu, 1,5 ml sel dimasukkan ke dalam tabung mikro steril, lalu disentrifugasi 8.000 rpm selama 5 menit. Pelet dicuci dengan 250 µl 0,1 mM TrisCl pH 7,5 sebanyak dua kali, kemudian disentrifugasi dengan kecepatan yang sama. Pelet disuspensi dengan 500 µl 0,1 mM TrisCl pH 7,5. Untuk mengetahui konsentrasi protein total, maka dilakukan uji Bradford. Sel divorteks lalu supernatannya dimasukkan pada Larutan Bradford. Setelah itu, diukur dengan spektrofotometri pada λ595. Kurva standard kandungan protein dengan persamaan regresi Y= 0,0006X + 0,0353; R2= 0,9673.
3.3.15 Elektroforesis Protein dengan SDS-PAGE
Elektroforesis protein dilakukan dengan Mini-Protean Electrophoresis (Bio-Rad, USA). Pada elektroforesis ini, digunakan konsentrasi gel penyangga empat persen dan konsentrasi gel pemisah 10%. Ke dalam sumur dimasukkan 13 µl protein sampel yang telah dicampur dengan buffer sampel dengan perbandingan 1:4 dan standar bobot molekul protein LMW (Low Molecule Weight Protein, Amersham, England, UK). Elektroforesis dilakukan pada kondisi 100 volt selama 80 menit dalam dingin. Selanjutnya gel diwarnai dengan 0,025% Coomassie Brilliant Blue selama dua jam, dan dicuci, hingga gel latar belakang jernih kembali. Persamaan regresi standar molekul LMW, Y=-1,3267X + 5,2925, R2=0,9666.