HITUNG SEL MANUAL
dr. Ida Ayu Putri Wirawati, Sp.PK(K)
PROGRAM STUDI ILMU PATOLOGI KLINIK FAKULTAS KEDOKTERAN UNIVERSITAS UDAYANA/ RSUP SANGLAH
DENPASAR
2019
i
KATA PENGANTAR
Puji syukur saya panjatkan kepada Tuhan Yang Maha Esa, karena saya dapat menyelesaikan Karya tulis inidengan judul Hitung Sel Manual dengan baik.
Tidak lupa saya menyampaikan terima kasih kepada. semua pihak yang telah membantu. Saya menyadari bahwa tulisan ini masih banyak kekurangan dari segi penyusunan materi dan bahasa, oleh karena itu saya mengharapkan masukan untuk dapat menyempurnakan tulisan ini. Semoga tulisan ini bermanfaat bagi kita semua. Terima Kasih.
Denpasar, Desember 2019
Penulis
ii
DAFTAR ISI
TUTOR HEMATOLOGI PUTARAN 1 ... i
KATA PENGANTAR ... ii
DAFTAR ISI ...iii
DAFTAR GAMBAR... v
DAFTAR TABEL ...vi
BAB I PENDAHULUAN ... 1
BAB II TINJAUAN PUSTAKA ………. ... 2
2.1. Definisi Hitung Sel Manual ... 2
2.2. Prinsip Hitung Sel Manual …….………. 2
2.3. Kamar Hitung ……….. 3
2.4. Larutan Pengencer ………..……….…… 4
2.4.1. Larutan Pengencer Untuk Hitung Sel Eritrosit ………..….. 4
2.4.2. Larutan Pengencer Untuk Hitung Sel Leukosit … .. …………..….. 5
2.4.3. Larutan Pengencer Untuk Hitung Sel Trombosit .………..….. 5
2.5. Prosedur Hitung Sel Eritrosit, Leukosit, dan Trombosit …...……….. 6
2.5.1. Alat dan Bahan ………. 6
2.5.2. Membuat Pengenceran Darah ……….. 8
2.5.3. Mengisi Kamar Hitung …..………. 10
2.5.4. Cara Perhitungan Jumlah Sel ……….…… 13
2.5.5. Perhitungan Jumlah Sel Eritrosit ……...………. 15
2.5.6. Perhitungan Jumlah Sel Leukosit .….………. 16
2.5.7. Perhitungan Jumlah Sel Trombosit ……… 16
2.6. Nilai Referensi Hitung Sel Manual …..………. 17
2.7. Kesalahan Pada Hitung Sel Manual …...……….. 17
BAB III RINGKASAN ………...…………. 18
DAFTAR PUSTAKA ………..………...………...…… 19
DAFTAR GAMBAR
Gambar 2.1. Hemacytometer dan Counting Area ………...……… ... 3
Gambar 2.2. Kamar hitung Improved Neubauer ………..….. 4
Gambar 2.3. Pipet Eritrosit ... 6
Gambar 2.4. Pipet Leukosit … ... …… ... ………....……...… 7
Gambar 2.5. Pengenceran Darah dengan Pipet Eritrosit ……….... 9
Gambar 2.6. Pengenceran Darah dengan Pipet Leukosit ………….……….. 9
Gambar 2.7. Homogen Sampel ……… 10
Gambar 2.8. Membuang Cairan dari Dalam Pipet Thoma ………...…… 11
Gambar 2.9. Pengisian Kamar Hitung ………. 11
Gambar 2.10. Kamar Hitung dan Kaca Penutup Dalam Cawan Petri .………… 12
Gambar 2.11. Hemocytometer ………. 14
Gambar 2.12. Arah Hitung Sel Manual ……….……….. 14
Gambar 2.13. Perbedaan Hemocytometer yang baik dan buruk …..……… 15
DAFTAR TABEL
Tabel 2.1. Larutan Pengencer Untuk Hitung Sel ………….……...……...…..….. 7
Tabel 2.2. Pengenceran Darah (1) …...…….……….. 8
Tabel 2.3. Pengenceran Darah (2) …..……… 8
Tabel 2.4. Cara Mengisi Kamar Hitung …...……….12
Tabel 2.5. Cara Hitung Jumlah Sel ………..……… 13
BAB I
PENDAHULUAN
Hitung sel darah adalah suatu pemeriksaan untuk menentukan jumlah sel dalam tiap mikroliter darah. Ketepatan dan ketelitian hasil pemeriksaan ini sangat tergantung dari ketepatan dan ketelitian pengenceran volume darah yang diperiksa dan kecermatan ketika menghitung sel tersebut dengan menggunakan mikroskop.
Pemeriksaan ini dapat dilakukan secara manual atau otomatik. Hitung sel secara manual dapat dilakukan dengan peralatan sederhana, sedangkan hitung sel dengan cara otomatik dilakukan dengan alat elektronik yang tingkat ketelitian dan ketepatannya melampaui cara manual (Sudiono et al, 2016).
Meskipun sebagian besar prosedur perhitungan sel rutin di laboratorium hematologi bersifat otomatis, terkadang perlu meggunakan metode pemeriksaan sel secara manual ketika analyzer hematologi tidak berfungsi dan tidak ada cadangan, berada di laboratorium terpencil atau berada dalam situasi bencana ketika pemeriksaan harus dilakukan (Keohane et al, 2016).
BAB II
TINJAUAN PUSTAKA
2.1. Definisi Hitung Sel Manual
Hitung sel dapat dilakukan secara manual atau dengan analisa hematologi otomatis. Hitung sel secara manual dilakukan setelah pengenceran sampel dalam hemocytometer (kamar hitung khusus yang mengandung volume spesifik),
kemudian sel dihitung dengan mikroskop. Sel darah merah, sel darah putih dan trombosit dapat dihitung secara manual (Greer et al, 2019).
2.2. Prinsip Hitung Sel Manual
Prinsip pemeriksaan hitung sel darah secara manual adalah melakukan pengenceran darah dengan larutan pengencer. Selanjutnya sejumlah kecil sel darah yang sudah dilakukan pengenceran tersebut dihitung dengan menggunakan kamar hitung, dan dihitung dengan mikroskop (Mckenzie et al,2015).
Prinsip pengenceran pada hitung sel darah secara manual adalah semakin banyak sel yang akan dihitung, semakin tinggi pengenceran yang dilakukan.
Dengan demikian, pengenceran yang dilakukan yang dilakukan pada pemeriksaan hitung eritrosit lebih tinggi daripada penegnceran yang dilakukan pada pemeriksaan hitung leukosit. Perlu diingat bahwa faktor pengenceran menentukan ketelitian dan ketepatan hasil perhitungan (Sudiono et al, 2016).
2.3. Kamar Hitung
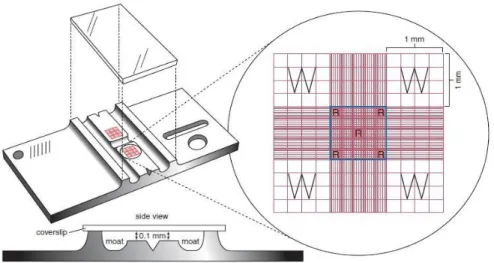
Hitung sel manual menggunakan hemacytometer atau kamar hitung. Yang paling umum digunakan adalah Improved Neubauer, yang terdiri dari dua permukaan yang terangkat, masing – masing kotak counting area berukuran 3mm x 3 mm (total area adalah 9 mm2), dipisahkan oleh parit berbentuk H. Counting area terdiri dari 9 kotak (masing – masing kotak berukuran 1mm x 1mm). Dari 9
kotak tersebut terdapat 4 kotak di setiap sudut kamar hitung (kiri atas dan kiri bawah, kanan atas dan kanan bawah) dibagi lagi menjadi 16 kotak dan digunakan untuk menghitung sel leukosit (Keohane et al, 2016).
Gambar 2.1. Hemacytometer dan Counting Area (Keohane et al, 2016).
Pada gambar diatas, area untuk menghitung sel leukosit diberi label W dan area untuk menghitung sel eritrosit diberi label R. Seluruh kotak di tengah yang diberi warna biru digunakan untuk menghitung sel trombosit. Tampilan di
samping Hemacytometer menunjukan kedalaman 0,1 mm dari permukaan counting area ke kaca penutup (Keohane et al, 2016).
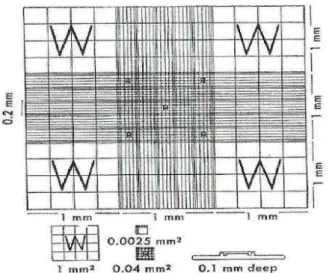
Kotak yang terletak di tengah dibagi menjadi 25 kotak kecil (masing – masing kotak kecil berukuran 0,2 mm x 0,2 mm, yang merupakan 1/25 dari tengah kotak atau 0.04 mm2). Kaca penutup diletakkan di atas permukaan counting area. Jarak antara setiap permukaan counting area dan kaca penutup
adalah 0,1 mm, dengan demikian total volume dari satu counting area pada satu sisi hemacytometer adalah 0,9 mm3 (Keohane et al, 2016).
Gambar 2.2. Kamar hitung Improved Neubauer (Seward and John, 1971).
2.4. Larutan Pengencer
2.4.1. Larutan Pengencer Untuk Hitung Sel Eritrosit
Larutan pengencer untuk pemeriksaan eritrosit harus bersifat isotonis dan sebelum digunakan harus disaring terlebih dahulu. Larutan pengencer dapat menggunakan larutan Hayem yang mengandung 5 gram natrium sitrat (berair
kristal), 1 gram natrium klorida, 0,5 gram merkuri khlorida kemudian volumenya dijadikan 200 mL dengan penambahan air suling. Juga boleh dipakai larutan Gower yang mengandung 12,5 gram natrium sulfat, 33,3 mL asam asetat glasial kemudian volumenya dijadikan 200 mL (Gandasoebrata, 2010).
Larutan pengencer hitung eritrosit dapat juga menggunakan larutan formal sitrat yang mengandung 10 mL formalin 40% yang volumenya dijadikan satu liter dengan penambahan larutan trisodium sitrat 0.109M. larutan formal sitrat bersifat isotonis, mudah dibuat dan tidak berubah dalam jangka lama. Bentuk discoid eritrosit tetap diperahankan dan tidak menyebabkan terjadi aglutinasi (Sudiono et al, 2016).
2.4.2. Larutan Pengencer Untuk Hitung Sel Leukosit
Larutan pengencer untuk hitung sel leukosit menggunakan larutan Turk yang terdiri dari larutan asam asetata 2% dan ditambahkan gention violet 1%.
Tujuan penambahan gention violet untuk mewarnai inti leukosit. Sedangkan larutan Turk menghancurkan eritrosit dan trombosit sehingga hanya leukosit dan eritrosit berinti yang terlihat (Sudiono et al, 2016).
2.4.3. Larutan Pengencer Untuk Hitung Sel Trombosit
Larutan pengencer untuk hitung sel trombosit menggunakan larutan ammonium oksalat 1% atau larutan Rees Ecker. Larutan Rees Ecker mengandung 3,8 gram natrium sitrat, 2 mL larutan formaldehida 40%, 30 mg brilliant cresyl blue dan volumenya dijadikan 100 mL dengan penambahan air suling. Sebelum
adalah larutan ammonium oksalat 1% membuat eritrosit lisis tetapi larutan Rees Ecker tidak membuat eritrosit lisis (Sudiono et al, 2016).
2.5. Prosedur Hitung Sel Eritrosit, Leukosit dan Trombosit
2.5.1. Alat dan Bahan
Alat dan bahan yang diperlukan untuk pemeriksaan hitung sel eritrosit antara lain : (Bagian Patologi Klinik Universitas Diponegoro Semarang, 2017)
- Darah vena atau darah kapiler (EDTA atau oxalat).
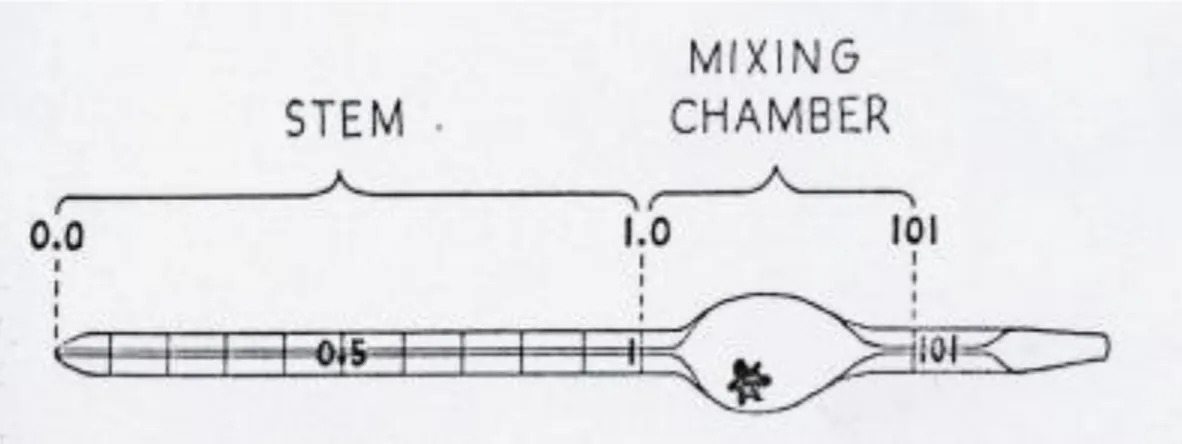
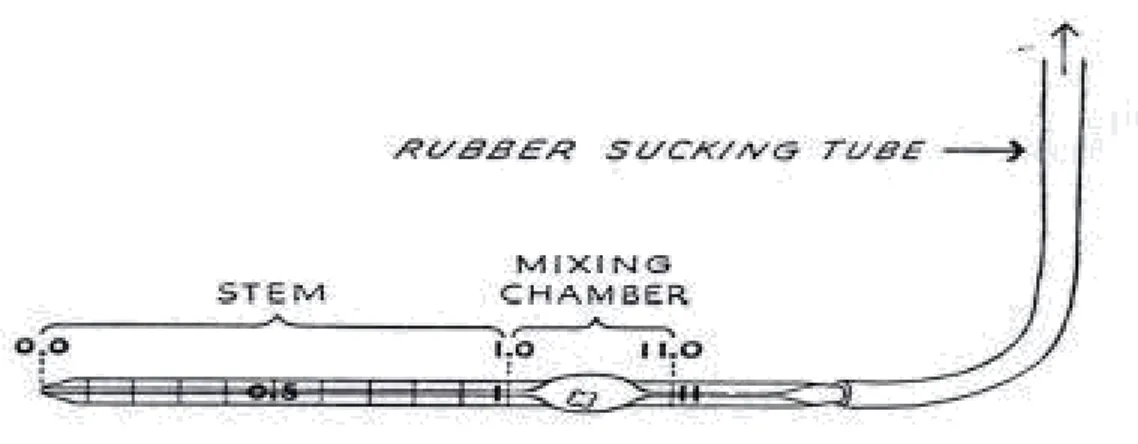
- Pipet Thoma.
o Hitung sel eritrosit menggunakan pipet eritrosit.
o Hitung sel leukosit menggunakan pipet leukosit.
o Hitung sel trombosit menggunakan pipet eritrosit.
Gambar 2.3. Pipet Eritrosit (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
Gambar 2.4. Pipet Leukosit (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
- Larutan pengencer.
Tabel 2.1. Larutan Pengencer Untuk Hitung Sel (Sudiono et al, 2016).
Hitung Sel Eritrosit Hitung Sel Leukosit Hitung Sel Trombosit
- Larutan Hayem - Larutan Turk - Larutan Rees Ecker
- Larutan Gower - Larutan Amonium
- Larutan Formal Sitrat Oksalat 1%
- Kamar hitung (Improved Neubauer).
- Kaca penutup.
- Karet penghisap.
- Mikroskop.
- Cell counter atau alat hitung.
2.5.2. Membuat Pengenceran Darah
Cara membuat pengenceran darah sebagai berikut : (Sudiono et al, 2016)
Tabel 2.2. Pengenceran Darah (1) (Sudiono et al, 2016).
Hitung Sel Eritrosit Hitung Sel Leukosit Hitung Sel Trombosit
Sampel darah dihisap Sampel darah dihisap Bilas pipet eritrosit dengan menggunakan dengan menggunakan dengan larutan pipet eritrosit sampai pipet leukosit sampai pengencer garis tanda 0,5 garis tanda 0,5
Sampel darah dihisap
dengan menggunakan
pipet eritrosit sampai
garis tanda 0,5
- Hapus kelebihan darah yang melekat pada ujung pipet thoma.
- Masukkan ujung pipet eritrosit ke dalam larutan pengencer sambil menahan sampel darah pada garis tanda tadi. Pipet dipegang dengan sudut 45 derajat.
Tabel 2.3. Pengenceran Darah (2) (Sudiono et al, 2016).
Hitung Sel Eritrosit Hitung Sel Leukosit Hitung Sel Trombosit
Larutan pengencer Larutan pengencer Larutan pengencer dihisap perlahan-lahan dihisap perlahan-lahan dihisap perlahan-lahan sampai garis tanda 101 sampai garis tanda 11 sampai garis tanda 101 (pengenceran 200 kali). (pengenceran 20 kali). (pengenceran 200 kali).
Pengenceran 100 kali Pengenceran 10 kali Pengenceran 100 kali dapat dilakukan dengan dapat dilakukan dapat dilakukan dengan mengisi pipet eritrosit dengan mengisi pipet mengisi pipet eritrosit dengan sampel darah leukosit dengan dengan sampel darah sampai garis tanda 1,0 sampel darah sampai sampai garis tanda 1,0 dan larutan pengencer garis tanda 1,0 dan dan larutan pengencer sampai garis tanda 101. larutan pengencer sampai garis tanda 101.
sampai garis tanda 11.
Gambar 2.5. Pengenceran Darah dengan Pipet Eritrosit (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
Gambar 2.6. Pengenceran Darah dengan Pipet Leukosit (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
- Angkat pipet thoma dari larutan pengencer kemudian tutup ujung pipet dengan ujung jari lalu lepaskan karet penghisap.
- Campuran dalam pipet thoma dibuat homogen dengan cara mengocok selama 15 – 30 detik dengan gerakan melingkar atau membentuk angka delapan (jika tidak segera akan dihitung, letakkan dalam posisi horizontal).
Gambar 2.7. Homogen Sampel (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
2.5.3. Mengisi Kamar Hitung
Cara mengisi kamar hitung Improved Neubauer : (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012)
- Letakkan kaca penutup yang baru atau bersih (bebas lemak) di atas kamar hitung, kemudian kamar hitung tersebut diletakkan diatas meja mendatar.
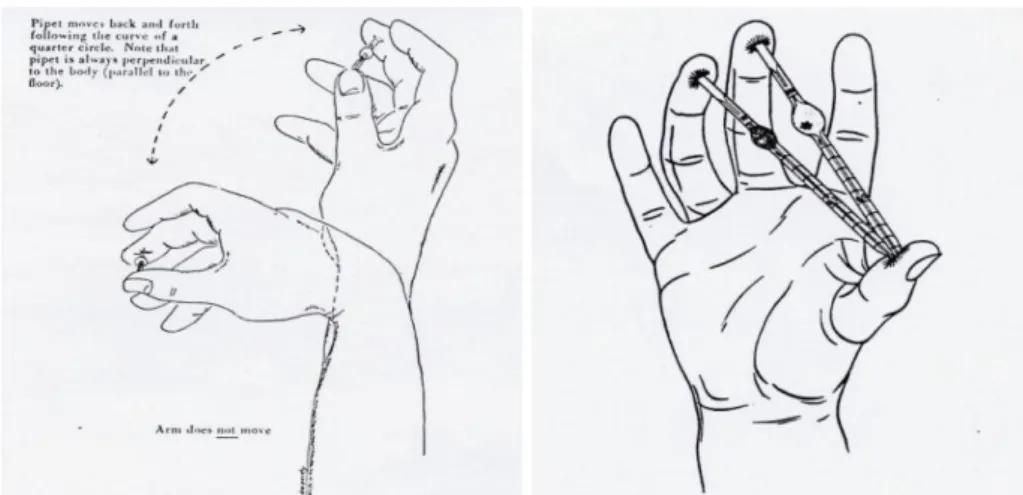
- Pipet thoma yang mengandung sampel tadi dikocok selama 1 – 3 menit secara terus – menerus.
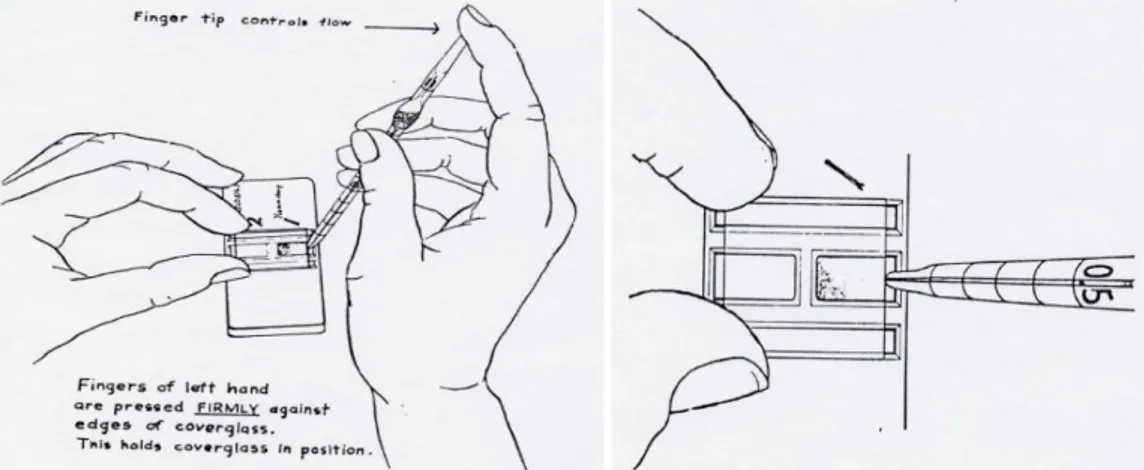
- Buang 3 - 4 tetes cairan dari dalam pipet thoma dan sentuhlah ujung pipet tersebut dengan sudut 30 derajat pada permukaan kamar hitung dengan cara menyinggung pinggir kaca penutup.
Gambar 2.8. Membuang Cairan dari Dalam Pipet Thoma (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
Gambar 2.9. Pengisian Kamar Hitung (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
- Pada saat meneteskan jangan melampaui garis batas. Bila darah merembes keluar menuju celah antar bilik, maka harus mengulang penetesan dengan cara mengangkat dan membersihkan kaca penutup lalu bersihkan kamar
- Biarkan kamar hitung terisi cairan secara perlahan-lahan dengan daya kapilaritasnya sendiri.
Tabel 2.4. Cara Mengisi Kamar Hitung (Sudiono et al, 2016).
Hitung Sel Eritrosit Hitung Sel Leukosit Hitung Sel Trombosit
Kamar hitung Kamar hitung Kamar hitung
didiamkan selama 2 - 3 didiamkan selama 2 - 3 didiamkan selama 10 menit agar eritrosit menit agar leukosit menit agar trombosit dapat mengendap. dapat mengendap. dapat mengendap.
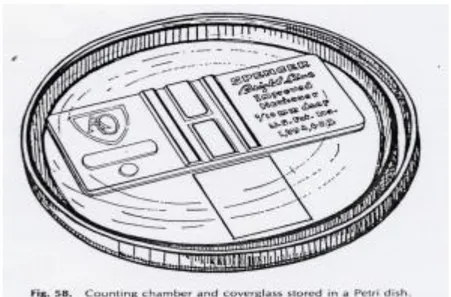
- Bila tidak dapat segera dihitung, simpan kamar hitung tersebut dalam sebuah cawan petri tertutup yang berisi segumpal kapas basah.
Gambar 2.10. Kamar Hitung dan Kaca Penutup Dalam Cawan Petri (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
2.5.4. Cara Perhitungan Jumlah Sel
Cara perhitungan jumlah sel dengan menggunakan kamar hitung Improved Neubauer : (Sudiono et al, 2016)
- Letakkan kamar hitung tersebut diatas mikroskop, turunkan lensa kondensor atau kecilkan diafragma.
- Kamar hitung dengan bidang bergaris diletakkan di bawah lensa objektif.
Tabel 2.5. Cara Hitung Jumlah Sel (Sudiono et al, 2016).
Hitung Sel Eritrosit Hitung Sel Leukosit Hitung Sel Trombosit
Atur fokus mikroskop Atur fokus mikroskop Atur fokus mikroskop dengan lensa objektif dengan lensa objektif dengan lensa objektif kecil (pembesaran 10x) kecil (pembesaran 10x). kecil (pembesaran kemudian lensa diganti 10x) kemudian lensa dengan lensa objektif diganti dengan lensa
besar (pembesaran objektif besar
40x) sampai garis – (pembesaran 40x)
garis dalam bidang sampai garis – garis
tengah jelas terlihat. dalam bidang tengah
jelas terlihat.
Hitung jumlah eritrosit Hitung jumlah leukosit Hitung jumlah yang terdapat dalam 5 yang terdapat dalam 4 trombosit yang
bidang sedang yang bidang besar yang terdapat dalam bidang tersusun dari 16 bidang terletak pada ke-4 sudut besar pada bagian kecil (terdapat di kamar hitung (yang tengah kamar hitung.
bagian tengah kamar tersusun dari 16 bidang
hitung). sedang).
Bila sel menyinggung
salah satu garis batas
bidang maka sel yang
dihitung adalah sel
yang menyinggung
garis batas atas dan kiri.
Gambar 2.11. Hemocytometer (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
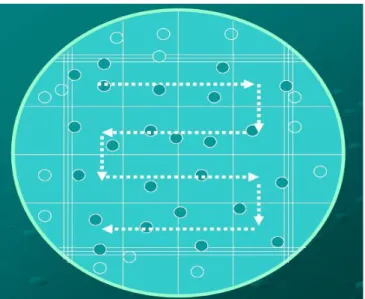
- Perhitungan sel dimulai dari sudut kiri atas, ke kanan kemudian turun ke bawah dari kanan ke kiri, dan seterusnya.
Gambar 2.12. Arah Hitung Sel Manual (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
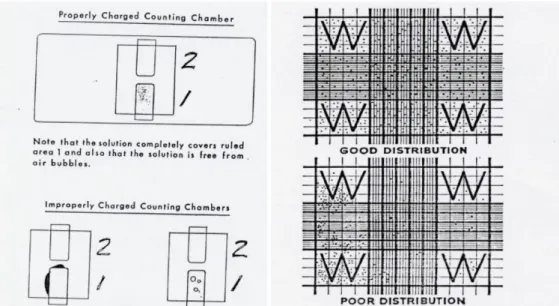
Gambar 2.13. Perbedaan Hemocytometer yang baik dan buruk (Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga, 2012).
2.5.5. Perhitungan Jumlah Sel Eritrosit (Mckenzie et al,2015) total jumlah sel eritrosit yang dihitung X pengenceran Jumlah kotak yang dihitung X luas setiap kotak X kedalaman bilik Contoh :
- Total jumlah sel yang dihitung (satu sisi dari hemocytometer) = 200 sel - Pengencer = 200
- Jumlah kotak yang dihitung = 5 - Luas setiap kotak = 0,04 mm2 - Kedalaman bilik hitung = 0,1 mm - Jumlah leukosit
= 200 X 200
5 X 0,04 mm2 X 0,1 mm
2.5.6. Perhitungan Jumlah Sel Leukosit (Mckenzie et al,2015)
total jumlah sel leukosit yang dihitung X pengenceran
Jumlah kotak yang dihitung X luas setiap kotak X kedalaman bilik hitung
Contoh :
- Total jumlah sel yang dihitung (satu sisi dari hemocytometer) = 200 sel - Pengencer = 20
- Jumlah kotak yang dihitung = 4 - Luas setiap kotak = 1 mm2
- Kedalaman bilik hitung = 0,1 mm - Jumlah leukosit
= 200 X 20
4 X 1 mm2 X 0,1 mm
= 10,000/mm3 atau 10,000/μL atau 10 x 103/μL atau 10.0 x 109/L
2.5.7. Perhitungan Jumlah Sel Trombosit (Mckenzie et al,2015) total jumlah sel trombosit yang dihitung X pengenceran Jumlah kotak yang dihitung X luas setiap kotak X kedalaman bilik
Contoh :
- Total jumlah sel yang dihitung (satu sisi dari hemocytometer) = 200 sel - Pengencer = 200
- Jumlah kotak yang dihitung = 1 - Luas setiap kotak = 1 mm2
- Kedalaman bilik hitung = 0,1 mm - Jumlah trombosit
= 200 X 200
1 X 1 mm2 X 0,1 mm
= 400,000/mm3 atau 400,000/μL atau 400 x 103/μL atau 400 x 109/L
2.6. Nilai Referensi Hitung Sel Manual
Tabel 2.6. Nilai Referensi Hitung Sel Manual (Mckenzie et al,2015).
Hitung Sel Eritrosit Hitung Sel Leukosit Hitung Sel Trombosit
4,5 – 5,5 x 106/μL 4,5 – 11,0 x 109/L 150 - 400 x 103/μL
(pria) (150 - 400 x 109/L)
4,0 – 5,0 x 106/μL (wanita)
2.7. Kesalahan Pada Hitung Sel Manual
Kesalahan yang berhubungan dengan hitung sel manual antara lain adalah Teknik yang buruk dalam mengambil sampel darah, sampel kurang homogen, penggunaan pipet yang tidak akurat, kalibrasi yang buruk pada pipet atau kamar hitung, pengisian kamar hitung yang salah, dan perhitungan sel yang salah (Bain et al, 2017).
BAB III RINGKASAN
Hitung sel dapat dilakukan secara manual atau dengan analisa hematologi otomatis. Meskipun sebagian besar prosedur perhitungan sel rutin di laboratorium hematologi bersifat otomatis, terkadang perlu meggunakan metode pemeriksaan sel secara manual ketika analyzer hematologi tidak berfungsi dan tidak ada cadangan, berada di laboratorium terpencil atau berada dalam situasi bencana ketika pemeriksaan harus dilakukan.
Prinsip pemeriksaan hitung sel darah secara manual adalah melakukan pengenceran darah dengan larutan pengencer, dimana semakin banyak sel yang akan dihitung, semakin tinggi pengenceran yang dilakukan. Selanjutnya sejumlah kecil sel darah yang sudah dilakukan pengenceran tersebut dihitung dengan menggunakan kamar hitung, dan dihitung dengan mikroskop. Sel darah merah, sel darah putih dan trombosit dapat dihitung secara manual.
DAFTAR PUSTAKA
Bagian Patologi Klinik Universitas Diponegoro Semarang. 2017. Buku Petunjuk Praktikum Pemeriksaan Hematologi Rutin. p. 59-65.
Bain, B. J., Bates, I., Laffan, M. A., Lewis, S. M. 2017. Dacie and Lewis Practical Haematology. Twelfth Edition. China : Elsevier Limited. p. 552-555.
Departemen Patologi Klinik Fakultas Kedokteran Universitas Airlangga. 2012.
Penuntun Praktikum Hematologi. p. 56-88.
Gandasoebrata, R. 2010. Penuntun Laboratorium Klinik. Cetakan keenambelas.
Jakarta : Dian Rakyat. p. 15-21.
Greer, J. P., Rodger , G. M., Glader, B., Arber, D. A., Means, R. T., List, A. F., et al. 2019. Wintrobe’s Clinical Hematology. Fourteenth edition.
Philadelphia : Wolters Kluwer. p. 184.
Keohane, E. M., Smith, L. J., Walenga, J. M. 2016. Rodak’s Hematology Clinical Principles and Applications. Fifth edition. Canada : Elsevier Saunders. p.
188-192.
Mahode, A.A., Chairlan., Lestari, E. 2011. Pedoman Teknik Dasar Untuk Laboratorium Kesehatan. Edisi 2. Jakarta : EGC. p. 279.
Mckenzie, S. B., William, J. L., Piwowar, K. L. 2015. Clinical Laboratory Hematology. Third edition. New jersey : Pearson Education. p. 794-795.
Seward, E. M., John, M. W. 1971. Textbook of Clinical Pathology. 8th ed. Asian Edition, Igaku Shoin Ltd.
Sudiono, H., Iskandar, I., Edward, H., Halim, S.L., Kosasih, R. 2016. Penuntun Patologi Klinik Hematologi. Cetakan kelima. Jakarta : PT Sinar Surya Mega Perkasa. p. 52-62.