PEMERIKSAAN CROSSMATCH
dr. IDA AYU PUTRI WIRAWATI, Sp.PK(K)
PROGRAM STUDI SPESIALIS PATOLOGI KLINIK FAKULTAS KEDOKTERAN UNIVERSITAS UDAYANA
RUMAH SAKIT UMUM PUSAT SANGLAH DENPASAR
2018
i
KATA PENGANTAR
Puji syukur saya panjatkan kepada Tuhan Yang Maha Esa, karena saya dapat menyelesaikan makalah Pemeriksaan Crossmatch dengan baik. Terima kasih juga kepada semua pihak yang telah membantu. Saya menyadari bahwa tulisan ini masih terdapat kekurangan dari segi penyusunan dan bahasa, oleh karena itu saya mengharapkan masukan untuk dapat menyempurnakan tulisan ini.
Semoga tulisan ini dapat bermanfaat bagi kita semua. Terima Kasih.
Denpasar, Oktober 2018
Penulis
ii DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... ii
DAFTAR GAMBAR ... iii
BAB I PENDAHULUAN ... 1
BAB II TINJAUAN PUSTAKA ... 3
2.1 Definisi Crossmatch ... 3
2.2 Tujuan Pemeriksaan Crossmatch ... 3
2.3 Jenis Pemeriksaan Crossmatch ... 4
2.4 Immediate-Spin (IS) Crossmatch ... 4
2.4.1 Prinsip Pemeriksaan ... 5
2.4.2 Metode Pemeriksaan ... 5
2.4.3 Alat dan Bahan ... 5
2.4.4 Prosedur Pemeriksaan ... 6
2.4.5 Interpretasi Hasil ... 7
2.5 Crossmatch dengan Tube Test ... 7
2.5.1 Prinsip Pemeriksaan ... 8
2.5.2 Alat dan Bahan ... 8
2.5.3 Persiapan Pemeriksaan... 9
2.5.4 Prosedur Pemeriksaan ... 10
2.5.5 Interpretasi Hasil ... 12
2.6 Crossmatch dengan Column Agglutination Test ... 14
2.6.1 Prinsip Pemeriksaan ... 14
2.6.2 Alat dan Bahan ... 15
2.6.3 Prosedur Pemeriksaan ... 16
2.6.4 Interpretasi Hasil ... 17
2.7 Computer (Electronic) Crossmatch ... 18
BAB III. RINGKASAN ... 20
DAFTAR PUSTAKA ... 21
iii
DAFTAR GAMBAR
Gambar 2.1 Prosedur pemeriksaan immediate spin crossmatch ... 6 Gambar 2.2 Prinsip pemeriksaan crossmatch metode gel ... 15 Gambar 2.3 Derajat aglutinasi pada pemeriksaan crossmatch metode gel ... 17
1 BAB I PENDAHULUAN
Pemeriksaan uji silang serasi darah atau yang lebih dikenal dengan crossmatch merupakan pemeriksaan utama sebelum dilakukan transfusi darah.
Pemeriksaan ini dilakukan untuk mencocokkan antara darah pasien dengan darah donor, sehingga darah yang diberikan benar-benar cocok dan supaya darah yang ditransfusikan benar-benar bermanfaat bagi kesembuhan pasien.
Crossmatch merupakan reaksi silang in vitro antara darah pasien dengan darah donor yang akan ditransfusikan. Pemeriksaan ini dimaksudkan untuk mengetahui apakah darah donor yang akan ditransfusikan tersebut nantinya akan dilawan oleh serum pasien didalam tubuhnya, atau apakah plasma donor yang turut ditransfusikan akan melawan sel pasien didalam tubuhnya sehingga menimbulkan reaksi transfusi hemolitik yang akan membahayakan pasien (Setyati, 2010).
Pemeriksaan crossmatch dapat dilakukan secara serologik dan elektronik atau komputerisasi. Pemeriksaan serologik dapat dibedakan menjadi immediate- spin crossmatch dan antiglobulin crossmatch. Sedangkan antiglobulin crossmatch sendiri dapat dilakukan dengan cara tube test ataupun dengan column agglutination test atau yang lebih dikenal dengan gel test. Pada pemeriksaan computer crossmatch kita menggunakan program komputer untuk melakukan pengecekan ada tidaknya inkompatibilitas ABO dan menyeleksi unit darah yang
2
sesuai untuk ditrasfusikan kepada pasien. Di Negara-negara berkembang pemeriksaan crossmatch baru bisa dilakukan secara serologik (Mulyantari, 2017).
Pemeriksaan crossmatch dengan tube test dilakukan melalui beberapa fase, yaitu fase suhu kamar, fase suhu inkubasi 37˚C dan fase antiglobulin. Bila skrining antibodi belum pernah dilakukan sebelumnya atau bila dalam serum terdapat antibodi yang bermakna secara klinis maka pemeriksaan harus dilakukan pada seluruh fase. Bila sebelumnya telah dilakukan skrining antibodi dan tidak ditemukan antibodi, maka fase antiglobulin tidak dilakukan. Jadi hanya dilakukan immediate spin saja untuk memastikan kompatibilitas golongan darah ABO (Brecher, 2005).
Sejalan dengan perkembangan zaman pemeriksaan crossmatch dengan metode tabung sudah mulai digantikan dengan metode gel. Metode gel memiliki banyak kelebihan dibandingkan metode tabung diantaranya lebih praktis, mudah dan cepat serta hasil reaksi stabil dan dapat disimpan (Mjafi, 2008).
3
BAB II
TINJAUAN PUSTAKA
2.1 Definisi Crossmatch
Berdasarkan standar dari American Association of Blood Bank (AABB), crossmatching didefinisikan sebagai suatu pemeriksaan yang menggunakan metode yang mampu menunjukkan inkompatibilitas sistem ABO dan adanya antibodi yang signifikan terhadap antigen eritrosit dan juga melibatkan pemeriksaan antiglobulin. Crossmatch merupakan suatu seri pemeriksaan yang dilakukan pretransfusi untuk menjamin kecocokan darah yang akan ditransfusikan kepada penerima darah (resipien) dan mendeteksi kemungkinan adanya antibodi yang tidak diharapkan dalam serum resipien yang akan mengurangi umur hidup atau menghancurkan eritrosit donor (Blaney and Howard, 2013).
2.2 Tujuan Pemeriksaan Crossmatch
Pemeriksaan crossmatch dilakukan untuk meyakinkan bahwa tidak ada antibodi didalam serum pasien yang akan bereaksi dengan sel darah donor jika transfusi dilakukan. Adapun fungsi utama crossmatch adalah ;
a. Untuk melakukan pengecekan terakhir dan meyakinkan bahwa golongan darah ABO antara pasien dan donor sudah sesuai sehingga reaksi transfusi dapat dicegah.
b. Untuk mendeteksi ada tidaknya antibodi di dalam serum pasien yang akan bereaksi dengan antigen pada sel darah merah donor terutama pada kondisi
20
dimana antibodi tidak terdeteksi dengan skrining antibodi karena tidak adanya antigen yang sesuai pada panel sel skrining (Downes, 2014).
Dengan melakukan pemeriksaan crossmatch maka diharapkan dapat mendeteksi ada tidaknya antibodi, baik antibodi komplit (IgM) maupun antibodi inkomplit (IgG) yang terdapat dalam serum atau plasma pasien, yang dapat menyebabkan kerusakan sel darah merah donor, sehingga dapat memberi keyakinan akan manfaat transfusi yang maksimal untuk penderita (meningkatkan kesempatan hidup sel darah donor dalam tubuh pasien) (Setyati, 2010).
2.3 Jenis Pemeriksaan Crossmatch
Pemeriksaan crosssmatch dapat dilakukan secara serologik dan elektronik atau komputerisasi. Di Indonesia, pemeriksaan crossmatch baru bisa dilakukan secara serologik. Pemeriksaan crossmatch serologik dibedakan menjadi immediate-spin crossmatch dan antiglobulin crossmatch. Antiglobulin crossmatch dapat dilakukan dengan metode tabung ( tube test ) atau dengan metode gel (Column agglutination test) (Mulyantari, 2017).
2.4 Immediate-Spin (IS) Crossmatch
Immediate-spin crossmatch digunakan untuk mengeksklusi adanya kesalahan golongan darah ABO. Namun pemeriksaan ini kurang baik dilakukan apabila tidak ada pemeriksaan skrining antibodi yang telah lebih dahulu dilakukan karena pemeriksaaan ini kurang adekuat untuk mendeteksi jenis IgG antibodi yang bermakna secara klinis (Powell, 2016).
21 2.4.1 Prinsip Pemeriksaan
Prinsip dari pemeriksaan immediate-spin crossmatch adalah reaksi antara antigen dan antibodi yang sesuai menghasilkan aglutinasi (Downes, 2014).
2.4.2 Metode Pemeriksaan
Immediate-spin crossmatch biasanya dilakukan dengan metode tabung.
2.4.3 Alat dan Bahan
Peralatan yang dibutuhkan untuk pemeriksan ini adalah (Brecher, 2005) : a. Tabung gelas ukuran 12 x75 mm.
b. Pipet tetes.
c. Sentrifus.
d. Rak tabung reaksi.
e. Tempat limbah.
Bahan yang dibutuhkan dalam pemeriksaan ini adalah (Brecher, 2005):
a. Sampel darah donor : merupakan darah dalam antikoagulan yang diambil dari selang kantong darah atau salah satu segmen dari selang yang terhubung dengan kantong darah. Nomor kantung harus selalu dicatat untuk melakukan identifikasi dengan benar.
b. Sampel darah pasien : merupakan darah pasien tanpa antikoagulan atau darah dengan antikoagulan yang berumur kurang dari 48 jam.
c. Salin atau NaCl 0,9%.
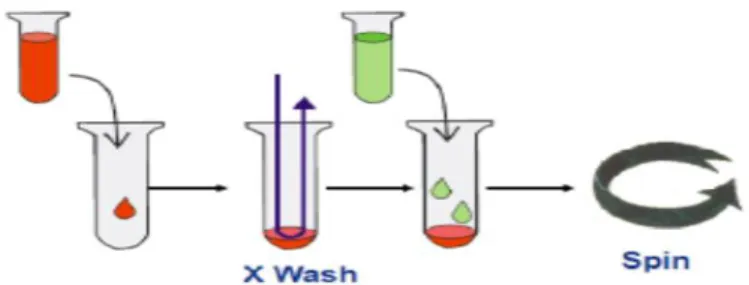
2.4.4 Prosedur Pemeriksaan
Prosedur pemeriksaan immediate-spin crossmatch adalah sebagai berikut:
22
a. Siapkan suspensi sel darah merah donor 2-5 % yang disuspensi dalam larutan normal salin.
b. Label tabung untuk masing-masing suspensi sel darah merah donor yang akan di tes dengan serum pasien.
c. Tambahkan 2 tetes serum atau plasma pasien ke dalam masing-masing tabung.
d. Tambahkan 1 tetes suspensi sel darah merah donor pada tabung sesuai dengan label.
e. Campur isi tabung dan lakukan sentrifugasi dengan kecepatan 3000 rpm selama 1 menit.
f. Baca ada tidaknya hemolisis, resuspensi endapan eritrosit pada bagian bawah tabung dan baca ada tidaknya aglutinasi.
g. Lakukan interpretasi dan catat hasil pemeriksaan (Downes, 2014;
Mulyantari, 2017).
Gambar 2.1 Prosedur pemeriksaan immediate-spin crossmatch (Powell, 2016)
23 2.4.5 Interpretasi Hasil
Bila terjadi aglutinasi atau hemolisis hasil dinyatakan positif (inkompatible). Namun bila tidak terjadi aglutinasi atau hemolisis hasil dinyatakan
negatif (kompatibel) (Downes, 2014).
2.5 Crossmatch dengan Tube Test
Crossmatch dengan metode tabung dapat dikerjakan untuk crossmatch mayor maupun crossmatch minor (Mjafi, 2008).
a. Crossmatch mayor
Pada pemeriksaan crossmatch mayor, sel darah donor dicampur dengan serum resipien. Bila dalam serum resipien terdapat antibodi terhadap sel donor maka akan terjadi destruksi sel donor.
b. Crossmatch minor
Pada pemeriksaan crossmatch minor, serum donor dicampur dengan sel darah resipien. Bila dalam serum donor terdapat antibodi terhadap sel resipien, maka akan terjadi destruksi sel resipien.
Pada pemeriksaan dimana golongan darah ABO pasien dan golongan darah ABO donor yang sesuai, maka baik mayor maupun minor tes tidak akan bereaksi. Namun pada golongan darah ABO pasien dan golongan darah ABO donor yang berlainan, misalnya donor golongan darah O dan pasien golongan darah A, maka pada tes minor akan terjadi aglutinasi (Setyati, 2010).
Di negara yang sudah maju, crossmatch minor sudah tidak dikerjakan lagi karena sampel darah donor sudah dilakukan skrining antibodi sebelumnya untuk mendeteksi adanya antibodi ireguler. Di Indonesia, crossmatch minor masih
24
dikerjakan secara rutin hampir disemua unit Bank Darah Rumah Sakit (BDRS) atau Unit Transfusi Darah (Mulyantari, 2017)
2.5.1 Prinsip Pemeriksaan
Prinsip dasar pemeriksaan pada metode tabung adalah adanya reaksi antara antigen dan antibodi yang dilakukan dalam fase dan medium yang berbeda.
Hal ini dimaksudkan karena jenis-jenis antibodi golongan darah mempunyai karakter yang berbeda. Antibodi seperti anti M, N, P, Lua,Lub bereaksi baik dalam medium salin pada suhu kamar, tetapi kurang baik reaksinya dalam medium albumin. Antibodi sistem Rhesus bereaksi baik dalam medium albumin tetapi tidak dalam medium salin (kecuali anti E). Sedangkan anti Kell, Duffy, Kidd baru tampak reaksinya dengan antiglobulin (Brecher, 2005). Dalam melakukan crossmatch harus dilakukan dalam 3 fase yaitu fase suhu kamar, fase inkubasi 37˚C dan fase antiglobulin serta harus melakukan crossmatch mayor, minor dan autokontrol (Mehdi, 2013).
2.5.2 Alat dan Bahan
Alat-alat yang diperlukan untuk melakukan pemeriksaan crossmatch metode tabung antara lain (Brecher, 2005):
a. Tabung gelas ukuran 12 x75 mm b. Inkubator (waterbath 37 C c. Sentrifus
d. Pipet disposible e. Tempat limbah f. Rak tabung reaksi
25
Bahan- bahan yang diperlukan dalam pemeriksaan metode tabung diantaranya (Brecher, 2005):
a. Sampel darah pasien : merupakan darah pasien tanpa antikoagulan atau darah dengan antikoagulan yang berumur kurang dari 48 jam.
b. Sampel darah donor : merupakan darah dalam antikoagulan yang diambil dari selang kantong darah atau salah satu segmen dari selang yang terhubung dengan kantong darah.
c. Reagensia : reagen yang diperlukan untuk melakukan pemeriksaan metode tabung diantaranya :
- Salin atau NaCl 0,9%
- Bovine albumin 22%
- Coomb’s serum
- Coombs Control Cell (CCC) 2.5.3 Persiapan pemeriksaan
Ada beberapa hal yang harus disiapkan sebelum melakukan pemeriksaan meode tabung yaitu (Mjafi, 2008) :
a. Serum resipien yang jernih bebas dari sel darah merah.
b. Suspensi sel darah merah resipien 2-5% dalam salin, setelah sel dicuci.
c. Plasma donor yang jernih bebas dari sel-sel darah.
d. Suspensi sel darah merah donor 2-5% dalam salin, setelah sel dicuci.
26 2.5.4 Prosedur Pemeriksaan
Adapun teknik dan prosedur dalam melakukan pemeriksaan crossmatch metode tabung diantaranya:
a. Fase I : merupakan fase pada suhu kamar di dalam medium salin - Siapkan tiga tabung untuk pemeriksaan crossmatch
- Tabung I (mayor) : masukkan 2 tetes serum pasien, kemudian ditambahkan 1 tetes sel donor suspensi 5%
- Tabung II (minor) : masukkan 2 tetes plasma donor, kemudian ditambahkan 1 tetes sel pasien suspensi 5%
- Tabung III (autokontrol) : masukkan 2 tetes serum pasien, kemudian ditambahkan 1 tetes sel pasien suspensi 5%
- Campur masing – masing tabung, kemudian disentrifugasi dengan kecepatan 3000 rpm selama 15 detik atau 1000 rpm selama 1 menit.
- Baca reaksi, amati adanya aglutinasi atau hemolisis pada tabung.
- Bila tidak ada reaksi lanjut ke fase II (Mehdi, 2013) b. Fase II : fase inkubasi 37˚C dalam medium bovine albumin.
- Tambahkan 2 tetes bovine albumin 22% kedalam semua tabung yang pada fase I memberikan hasil negatif.
- Inkubasi semua tabung pada suhu 37˚C selama 15 menit
- Lakukan sentrifugasi dengan kecepatan 3000 rpm selama 15 detik atau 1000 rpm selama 1 menit.
- Baca reaksi, amati adanya aglutinasi atau hemolisis pada tabung.
- Bila tidak ada reaksi lanjut ke fase III (Mehdi, 2013)
27
c. Fase III : fase antiglobulin atau dikenal juga dengan fase Indirect Antiglobulin Test (IAT) atau Anti Human Globulin (AHG) . Semua antibodi inkomplit yang telah diikat pada sel darah merah (fase II) akan beraglutinasi (positif) dengan baik setelah penambahan Coombs serum . Sepertiga dari semua antibodi yang dapat menyebabkan reaksi transfusi hanya dapat dideteksi dengan teknik antiglobulin.
- Cuci sel sebanyak 3 kali dengan menggunakan salin pada semua tabung yang memberikan hasil negatif pada fase II.
- Buang seluruh supernatan bekas cucian.
- Tambahkan 2 tetes coomb’s serum
- Lakukan sentrifugasi dengan kecepatan 3000 rpm selama 15 detik atau 1000 rpm selama 1 menit.
- Baca reaksi, amati adanya aglutinasi atau hemolisis pada tabung - Bila tidak ada reaksi menandakan hasil kompatibel.
- Tambahkan 1 tetes coombs control cells (CCC) pada ketiga tabung tersebut.
- Sentrifugasi dengan kecepatan 3000 rpm selama 15 detik atau 1000 rpm selama 1 menit.
- Baca reaksi, bila terjadi aglutinasi berarti pemeriksaan benar (Mehdi, 2013).
Coomb’s control cells (CCC) umumnya dibuat dari sel normal golongan O Rhesus positif, dengan anti D inkomplit. Tujuan penambahan CCC adalah untuk mengontrol coomb’s serum, apakah reagen coomb’s serum masih baik atau layak
28
digunakan serta dapat menguji semua hasil pemeriksaan,apakah hasil valid atau invalid (Mjafi, 2008).
2.5.5 Interpretasi Hasil
Bila crossmatch mayor dan minor fase I sampai III tidak menunjukkan reaksi aglutinasi dan atau hemolisis, hasil diinterprestasikan kompatibel (cocok), sehingga darah dapat dikeluarkan. Bila crossmatch mayor dan minor fase I sampai III menunjukkan adanya reaksi aglutinasi dan atau hemolisis, hasil diinterpretasikan inkompatibel (tidak cocok) dan darah tidak dapat dikeluarkan (Setyati, 2010).
Fase I yaitu fase suhu kamar dengan medium salin. Pada fase ini akan dapat mendeteksi adanya antibodi yang komplit (IgM / cold antibodi) misalnya terdapat ketidakcocokan pada penetapan golongan darah ABO. Selain itu juga dapat mendeteksi adanya aloantibodi (antibodi komplit) seperti anti M, anti Lewis, anti N, anti P1, anti A1 dan auto antibodi seperti anti-H, anti-I (Brecher, 2005).
Fase II yaitu fase inkubasi 37˚C di dalam medium bovin albumin. Pada fase ini dapat mendeteksi beberapa antibodi sistem Rhesus seperti anti D, anti E, anti c, serta antibodi inkomplit lain seperti anti-K, Fya, Fyb, Jka, S, Lea, Leb. Adapun tujuan dari digunakannya suhu 37˚C adalah untuk memberi kesempatan kepada antibodi untuk coated pada sel (Brecher,2005).
Fase III yaitu fase antiglobulin. Pada fase ini akan terdeteksi aglutinasi antibodi inkomplit seperti anti D, anti E, anti C, anti Duffy, anti Kell, anti Kidd, anti S dan lain-lain. Yang perlu diperhatikan adalah suhu inkubasi 37˚C dengan
29
lama inkubasi minimal 15 menit (pada fase sebelumnya). Jika waktu dikurangi maka antibodi inkomplit tidak akan coated dengan sempurna sehingga akan lepas pada waktu pencucian. Cara pencucian sel untuk menghilangkan sisa globulin yang bebas harus sempurna. Karena sisa globulin yang tertinggal akan dapat menetralisir anti globulin serum (Coomb’s serum) (Brecher, 2005)
Untuk mencegah agar hasil crossmatch tidak memberikan hasil negatif palsu maka ada beberapa prosedur yang harus diperhatikan, diantaranya (Setyati, 2010) :
a. Salin harus bersih, jernih, tidak berwarna, tidak terkontaminasi serum.
b. Suhu inkubator harus tepat.
c. Lama inkubasi harus tepat.
d. Pencucian sel darah merah harus bersih.
e. Hasil negatif harus dikontrol dengan menggunakan CCC.
2.6 Crossmatch dengan Column Agglutination Test
Saat ini column agglutination test atau yang lebih umum dikenal sebagai gel test telah digunakan secara luas menggantikan metode manual atau tube test.
Yves Lampiere dari Perancis menemukan metode gel dan mengembangkan metode gel di Switzerland pada akhir tahun 1985 sebagai metode standar sederhana yang memberikan reaksi aglutinasi dan dapat dibaca dengan mudah Metode gel pertama kali digunakan untuk pemeriksaan rutin pada tahun 1988, saat ini telah digunakan lebih dari 80 negara termasuk Indonesia (Setyati, 2010).
30
Metode gel memiliki banyak kelebihan dibandingkan metode tabung. Selain menghemat waktu pemeriksaan, prosedur tes juga lebih sederhana serta pembacaan hasil lebih mudah dilakukan. Hasil reaksi stabil dan dapat disimpan, sampel yang diperlukan sedikit, tidak ada proses pencucian dan penambahan CCC (Mulyantari, 2017)
2.6.1 Prinsip Pemeriksaan
Penambahan suspensi sel darah merah dan serum atau plasma dari donor dan pasien dalam microtube yang berisi gel di dalam buffer berisi reagen (anti A, anti B, anti D, enzim, anti Ig G, anti komplemen). Microtube selanjutnya diinkubasi selama 15 menit pada suhu 37˚C dan disentrifugasi. Tahap inkubasi akan membei kesempatan antigen pada permukaan sel darah merah berikatan dengan antibodi pada serum atau plasma sehingga membentuk aglutinasi. Pada tahap sentrifugasi, sel yang beraglutinasi kuat akan tertangkap pada bagian atas matrik gel sedangkan sel yang beraglutinasi lemah akan pindah kebagian bawah matrik gel. Bila aglutinasi tidak terjadi , maka semua sel akan melewati pori-pori gel dan akan mengendap didasar microtube (Mjafi, 2008).
31
Gambar 2.2 Prinsip pemeriksaan crossmatch metode gel (Walker and Harmening, 2012)
2.6.2 Alat dan Bahan
Alat – alat yang dibutuhkan untuk melakukan pemeriksaan crossmatch dengan metode gel antara lain (Brecher, 2005):
a. Micropipet (5µL, 25µL, 50 µL) b. Dispenser 500µL
c. Tabung reaksi ukuran 12x75mm dengan raknya
d. Inkubator dengan suhu 37˚C yang sesuai dengan ukuran plastic card e. Sentrifus yang sesuai dengan ukuran plastic card
Bahan – bahan yang dibutuhkan adalah (Brecher, 2008) : a. Sampel darah pasien
b. Sampel darah donor
c. Low Ionic Strength Solution (LISS)
32
d. Plastic card yang terdiri atas 6 microtube yang mengandung gel di dalamnya.
2.6.3 Prosedur Pemeriksaan
Langkah-langkah dalam melakukan pemeriksaan crossmatch dengan metode gel adalah (Mjafi, 2008):
a. Siapkan dua buah tabung ukuran 12x75 mm dan berikan label
b. Tabung pertama diisi 500µ LISS dan ditambahkan 5µL sel darah merah donor.
c. Tabung kedua diisi 500µ LISS dan ditambahkan 5µL sel darah merah pasien.
d. Beri label pada plastic card (identitas pasien dan nomor donor) serta berikan tanda pada microtube mana reaksi mayor, minor dan autokontrol.
e. Suspensi sel dari tabung 1 diambil 50µL kemudian dimasukkan ke dalam microtube dan ditambahkan serum atau plasma pasien sebanyak 25µL (mayor).
f. Suspensi sel dari tabung 2 diambil 50µL kemudian dimasukkan ke dalam microtube dan ditambahkan serum atau plasma donor sebanyak 25µL (minor).
g. Suspensi sel dari tabung 2 diambil 50µL kemudian dimasukkan ke dalam
microtube dan ditambahkan serum atau plasma pasien sebanyak 25µL (autokontrol).
33
h. Sampel dimasukkan ke dalam microtube dengan posisi miring. Suspensi sel darah merah dan serum atau plasma dimasukkan tepat pada reaction chamber dalam microtube.
i. Plastic card diinkubasi pada suhu 37˚C selama15 menit.
j. Plastic card disentrifugasi selama 10 menit dengan kecepatan 1000 rpm.
k. Baca dan catat hasil reaksi yang terjadi 2.6.4 Interpretasi hasil
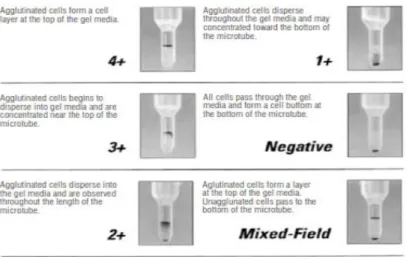
Gambar 2.3 Derajat aglutinasi pada pemeriksaan crossmatch metode gel (Walker and Harmering, 2012)
Keterangan gambar :
a. 4+ : Aglutinasi sel darah merah membentuk garis di atas microtube gel.
b. 3+ : Aglutinasi sel darah merah kebanyakan berada di atas setengah dari microtube gel
c. 2+ : Aglutinasi sel darah merah terlihat disepanjang microtube gel
d. 1+ : Aglutinasi sel darah merah berada di bawah setengah dari microtube gel
e. Negatif : Seluruh sel darah merah berada dibagian bawah microtube gel
34
f. Mixed field : Sebagian sel darah merah ada dipermukaan gel (mengalami aglutinasi) dan sebagian mengendap pada dasar gel (tidak mengalami aglutinasi).
2.7 Computer (Electronic) Crossmatch
Computer crossmatch merupakan metode untuk pengecekan terakhir ada tidaknya inkompatibilitas ABO dan menyeleksi unit darah yang sesuai untuk ditransfusikan kepada pasien dengan menggunakan komputer. Pada computer crossmatch, data hasil pemeriksaan laboratorium pasien dan donor telah tersimpan dalam komputer. Beberapa pendapat menyatakan bahwa computer crossmatch sama amannya dengan immediate spin test untuk mendeteksi inkompatibilitas ABO, bahkan lebih aman karena adanya integritas dari software komputer untuk mendeteksi inkompatibilitas ABO antara sampel pasien dan donor. Program komputer yang digunakan mampu memberikan peringatan apakah pasien layak atau tidak dilakukan komputer crossmatch (Klein and Anstee,2014).
Syarat- syarat yang harus dipenuhi untuk melakukan computer crossmatch antara lain:
a. Komputer harus divalidasi pada saat akan digunakan dan harus ada jaminan bahwa inkompatibilitas sistem ABO terdeteksi sehingga darah yang inkompatibel tidak dapat keluar.
b. Komputer harus berisi data golongan darah ABO, Rhesus, dan hasil pemeriksaan skrining antibodi pasien.
c. Sistem golongan darah ABO sudah ditentukan dengan sampel yang benar, sesuai dengan identitas pasien dan juga sudah dikonfirmasi dengan data
35
sebelumnya. Data hasil pemeriksaan pasien sebelumnya mudah diakses dan datanya valid.
d. Sistem komputer harus mencantumkan informasi donor yang meliputi jenis produk darah, nomor donor, golongan darah ABO dan Rhesus serta hasil pemeriksaan konfirmasi golongan darah.
e. Sistem komputer harus dilengkapi metode untuk memverifikasi ketepatan data yang dimasukkan sebelum produk darah dikeluarkan.
f. Komputer dilengkapi dengan sistem alarm atau peringatan bila terdapat inkompatibilitas antara donor dan pasien dan antara label unit darah dan pemeriksaan konfirmasi (Stoe, 2011)
Keuntungan dari computer crossmatch antara lain menghemat waktu dan biaya pemeriksaan, mengurangi kebutuhan sampel, mengurangi kontak dengan bahan biologis, mengurangi volume sampah medis dan mengurangi beban kerja laboratorium (Klein and Anstee,2014)
36 BAB III RINGKASAN
Pemeriksaan crossmatch dilakukan untuk dapat mencegah terjadinya reaksi transfusi baik reaksi transfusi baik reaksi transfusi yang bersifat mengancam nyawa ataupun reaksi transfusi ringan atau sedang yang dapat menggangu kenyamanan pasien. Dengan melakukan pemeriksaan crossmatch akan dapat mendeteksi ada tidaknya antibodi, baik antibodi komplit ( IgM) maupun antibodi inkomplit (IgG) yang terdapat dalam serum atau plasma pasien yang memiliki arti klinis yang dapat menyebabkan kerusakan sel darah merah donor.
Dengan melakukan pemeriksaan crossmatch dapat memastikan bahwa transfusi darah yang diberikan sesuai atau kompatibel dan tidak menimbulkan reaksi apapun pada pasien serta sel-sel darah merah yang diberikan dapat mencapai masa hidup maksimal setelah diberikan kepada pasien. Sehingga pasien akan mendapat manfaat yang maksimal dari transfusi yang dilakukan
21
DAFTAR PUSTAKA
Blaney ,K.D, Howard,P.R. 2013. Compatibility Testing. Basic&Applied Concepts of Blood Banking and Transfusion Practices. Third Edition.United States;
Elsivier Mosby.p.188-201.
Brecher ME, 2005. AABB, Technical Manual, 15th edition. P 413-415.
Downes K A, Shulman IA. 2014. Pretransfusion testing. In: FungM, Grossman BJ. Hillyer CD, Westhoff CM. eds. Technical manual 18th edition.Bethesda MD: AABB. P.367-390.
Mehdi SR, 2013. Cross-matching (compatibility testing), Essentials of Blood Banking A Handbook for Students of Blood Banking and Clinical Residents Second Edition. New Delhi; Jaypee Brother Medical Publisher.p.45-49.
Mjafi, 2008. Comparative study of blood crossmatching using convensional and gel methode.
Mulyantari K, Sutirta Yasa, 2017. Laboratorium Pratransfusi up date. Udayana University Press; 82-103
Powell V I, 2016. Blood Group Antigen and Antibodies. NYU Langone Medical Center.
Setyati J, Soemantri A, 2010. Transfusi Darah Yang Rasional, Pelita Insani Semarang; 115-131.
Stoe M, 2011. Pretransfusi Testing. In Quinley ED. Immunohematology Principle
& Third Edition. Philadelphia: Wiliam & Wilkins. p. 105-118
Klein HG, Anstee DJ. 2014. Blood Grouping Technique. Mollison’s Blood Transfusionin ClinicalMedicine 12th Edition.UK; Wiley-Blackwell. p.
303-347
Walker PS, Harmening DM. 2012. Other Technologies and Automation. Blood Groups and Serogic Testing. Modern Blood Banking & Transfusin Practices 6th Edition. Philadelphi: F.A Davis company.p.273-285.