UNSUR-UNSUR GOLONGAN VIIA
UNSUR KONFIGURASI
ELEKTRON Fasa Warna Mp & Bp
9F
1. Unsur non-logam paling reaktif, kereaktifan berkurang dari atas ke bawah,
• Awal penemuan (1700) asam klorida dianggap
sebagai senyawa asam yang mengandung oksigen, seperti penemuan gas deplogisticated yang
berwarna hijau dari asam klorida oleh Calr Wilhem Scheele (1774). Gas ini oleh para ahli dan Lavoiser dikatakan merupakan senyawa baru yang banyak mengandung oksigen.
Penemuan Gas Halogen
Gas klorin
• Tahun 1810, baru Davy bisa membuktikan
• Penemuan yodium melibatkan kimia bahan
alam. Iodium dikenal sebagai obat gondok.
Yodium
• Pada tahun 1819, kimiawan Perancis JF
Coindet menunjukkan bahwa bahan yang
bermanfaat untuk obat gondok adalah yodium
• Dimulai dari sifat periodisitas unsur dalam
teori triad oleh kimiawan Jerman Johann Döbereiner antara 1817 dan 1829, bahwa
unsur klorin, bromin dan iodin memiliki sifat yang mirip.
Bromin
• HF merupakan zat yang banyak digunakan
sebagai bahan pemula untuk membentuk senyawa lain,tetapi zat beracun, hingga
menyebabkan kematian dua penemu HF ahli kimia Prancis Henri Moissan dan istrinya
Kecendrungan Golongan
• Brom unsur non logam yang cair pada STP, dengan
takanan uap tinggi, yang lansung menghasilkan gas merah coklat beracun saat wadah bromin dibuka.
• Iodin adalah padatan yang terlihat seperti logam,
namun akan segera menghasilkan uap ungu beracun bila kristal yodium dipanaskan.
• Astatin unsur radioaktif dengan t1/2 sangat
singkat,memancarkan radiasi intensitas tinggi, terdapat di kerak bumi dengan kelimpahan 44 mg.
Astatin
• Astatin dihasilkan di alam hasil peluruhan
isotop Uranium yang ditemukan oleh ilmuan Austria Berta Karlik dan muridnya Trudy
• Mp dan Bp meningkat dari atas ke bawah,
menunjukkan bahwa dari atas ke bawah kekuatan gaya
Van Der Waals antara molekul X2 semakin tinggi akibat
dari jumlah elektron yang juga semakin banyak.
• Semua halogen memiliki nomor atom ganjil,
diharapkan juga memiliki isotop; 1. F dan I punya 1 isotop
2. Cl, dua isotop (76% 35Cl, 24% 37Cl) 3. Br, dua isotop ( 51% 79Br, 49% 81Br).
• Asam oksi halogen memiliki kaedaan oksidasi
tinggi. Namun asam oksi dari yodin memiliki struktur berbeda dari unsur-unsur di atasnya: 1. Asam perklorik = (HO)ClO3,
2. Asam perbromik = (OH)BrO3
3. Namun struktur (OH)5IO atau H5IO6 sama
• Energi ikatan Cl-Cl sampai I-I menurun secara
teratur sesuai dengan bertambahnya jari-jari atom.
Perbedaan F dan Cl
• Energi ikatan F-F tidak ikut tren, malah sangat lemah,
Untuk pembentukan ion florida ada dua faktor pada siklus Born-Haber:
1. pertama faktor entalfi adalah ikatan lemah F-F, dan mudah putus.
2. kedua, banyaknya energi yang dilepaskan jika
membentuk ikatan ionik dengan Na+, dikarenakan F-
berukuran kecil akan memberikan energi kisi yang sangat negatif.
Kelarutan halida dari logam alkali dengan alkali tanah
• Karena ukuran florida kecil dari clor, hingga kelarutan
logamflorida berbeda dengan clor, contoh; 1. AgF larut, sementara AgCl tidal larut.
2. CaF2 tidak larut, CaCl2 larut.
• Sifat kelarutan dua senyawa halida ini disebabkan
oleh perbedaan energi kisi MX dan MX2, yaitu; Ion Ag+ yang besar memiliki energi kisis relatif
rendah ion F- yg kecil. Berlawanan dengan, energi kisi maximum ketika ion kecil Ca+2 dengan densitas
• F oksidator kuat, menghasilkan ion logam
transisi 3d, 4d dan 5d dengan bilok tertinggi dibandingkan Cl.
• Kekuatan sifat oksidator F dan Cl dapat dilihat
• Sifat oksidtor F pada logam juga sama dengan
non logam, seperti; 1. F membentuk SF6, 2. Cl membentuk SCl2.
• Senyawa fluor cenderung lebih stabil secara termodina
mika dan kimia tidak reaktif daripada senyawa klorin.
• Fluor cenderung memiliki titik leleh dan titik didih yang jauh
lebih rendah dari klorida yang sesuai. Misalnya;
1. Trifluorida nitrogen adalah gas yang sangat tidak reaktif, sedangkan triklorida nitrogen adalah cairan pekat,
mudah menguap, sangat eksplosif.
2. Entalpi negatif pembentukan fluorida kovalen adalah sebagian karena lemahnya ikatan F-F, yang mudah
putus, dan sebagian untuk membentuk ikatan unsur-F yang sangat kuat.
• Seperti pada Tabel 17.7 energi ikatan fluorin dan klorin
• F adalah unsur paling reaktif, bereaksi dengan
semua unsur dalam table priodik kecuali, He, Ne dan Ar.
Flour
• Pembentukan senyawa florida ditentukan oleh
faktor entalpi yang dominan.
• F2 mengoksidasi air, hingga F2 membentuk HF
Sifat Flour sebagai oksidator
ΔG pada reduksi F2 dan Cl2 menjadi F-(aq) dan Cl -(aq)
• Diflourin F2 diproduksi dengan metoda elektrokimia
Moissan (100 th lalu).
• Sel elektrokimia bisa dirancang utk skala Lab. dengan
arus 10-50 A, atau skala industri dengan arus sampai 15 000 A.
• Sel berisi campuran cairan KF dan HF pada rasio 1:2
dan berlangsung pada 90°C.
• Jaket digunakan memanaskan sel awal dan kemudian
untuk mendinginkan elektrolisis eksoterm yang terjadi.
• Pada pusat anoda karbon, ion florida dioksidasi
• UF6 dibuat dalam dua tahap;
• UF4 hasil reaksi tahap 1, merupakan senyawa ionik. • Reaksi oksidasi terjadi pada tahap 2 oleh F2
menghasilkan U(VI).
Sintesis Uranium (VI) florida
• UF6 merupakan senyawa kovalen dengan temperatur
sublimasi = 60 °C.
• UF6 juga memiliki Bp rendah, digunakan untuk
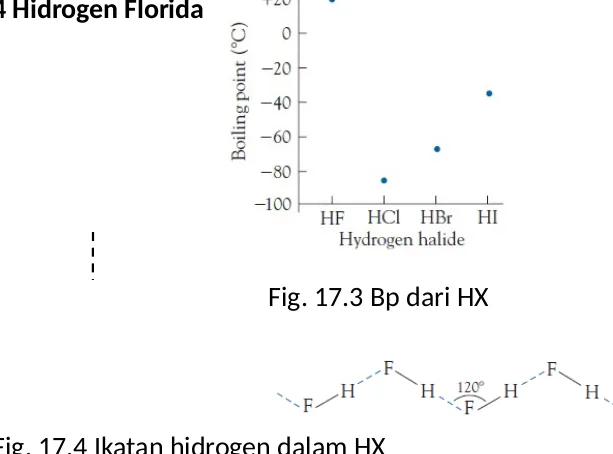
Fig. 17.3 Bp dari HX
17.4 Hidrogen Florida
• Hidrogen fluorida adalah tidak berwarna, cairan
berasap dengan titik didih tertinggi dari golongannya 20 ° C.
• Titik didih tinggi HF adalah hasil dari ikatan hidrogen
yang sangat kuat antara
• molekul HF., karena F memiliki elektronegativitas
tertinggi dari semua unsur.
• Ikatan hidrogen yang linier terhadap atom hidrogen
• tetapi berorientasi sudut 120 ° dengan atom F, sehingga
• HF sedikit larut dalam air disebabkan kuatnya
ikatan H-F
Asam Hidro Florik
pKa = 3.2 ----> HF adalah asam lemah
• HF pekat menghasilkan ion hidrogen diflorida
yang linear
• HF2- stabil hingga KHF2 dapat dikristalisasi dari
• HF sangat korosif, walau HF adalah asam lemah. • HF bereaksi dengan gelas menghasilkan ion
heksafluorosilikat. Oleh karena itu HF harus disimpan dalam botol plastik.
• Sifat HF yg bereaksi dengan kaca digunakan untuk
membuat sketsa / kaca bergores, dengan cara
• Starting material untuk membuat senyawa
lainnya (NaF), NaF digunakan untuk fluoronasi air
Kegunaan HF
• HF diproduksi dengan memanaskan CaF2
dengan asam sulfat pekat.
• 106 ton / tahun
Sintesis HF Secara industri
• HF(g) dicairkan dengan pendinginan atau ditambah
• HF adalah zat beracun, harus hati-hati
menyimpannya.
• CaSO4 sebagai hasil samping yang biasanya
digunakan hanya sebagai pengisi tanah saja. • Reaksi pementukan HF adalah endotermik
• Untuk menghemat biaya industri, dilakukan reaksi pembentukan asam sulfat yang
• Apapun keadan oksidasi, atom halogen lebih
mengoksidasi dalam suasana asam dibanding dlm susana basa.
• Diagram keadan oksidasi memperlihatkan;
• Semakin tinggi keadaan oksidasi, semakin kuat
kemampuan oksidasi.
• Klorida (Cl-) adalah spesies Cl yang paling
17.6 Klorin (Cl2)
• Klorin telah digunakan untuk membunuh
mkroorganisme penyebab penyakit menular melalui air.
• Presiden Calvin Coolidge menggunakan gas Cl2 untuk
mesterilkan ruangan, gna mencegah pilek.
• Efek sapng gas Cl2, dalam jangka lama akan merusak
paru-paru.
• Gas Cl2 beracun, dengan konsentrasi lebih dari 30
ppm mematikan setelah 30 menit. digunakan sebagai bahan perang.
• Pada tahun 1915 serangan gas Cl2 oleh tentara sekutu
• Gas Cl2 dihasilkan secara Lab dengan
penambahan asam HCl pekat ke padatan KMnO4
Pembuatan Cl2
• Secara industri Gas Cl2 dihasilkan dengan
• Cl2 digunakan untuk mensintesis senyawa
organoklorin.
• Digunakan pada industri kertas untuk
memutihkan kertas.
• Pembersihan air
• Untuk menghasilkan TiCl4
• TCl4 adalah senyawa antara untuk
mengekstrak Ti dari bijinya.
Reaksi Cl2
• Cl2 tidak sereaktif F2 tetapi dapat bereaksi dengan
banyak unsur membentuk ion dengan keadaan
oksidasi tinggi tetapi tidak setinggi yg dihasilkan oleh F2, contoh; Fe dan P dengan Cl2 berlebih akan
menghasilkan padatan FeCl3 dan PCl5 dan
• Cl2 dapat digunakan sebagai zat halogenasi senyawa
• Cl2 merupakan oksidator kuat (tidak lebih kuat dari F2,
dengan harga potensial reduksi positif (1.36 V) yg
bereaksi dengan air menghasilkan asam hidroklorida, dan asam hipoklorida.
• HCl larut sempurna dalam air.
• HCl pekat dengan konsentrasi 38%w (12 M ). • HCl cairan tidak berwarna dengan bau asam,
karena terjadi kestimbangan HCl(g) dengan HCl(aq)
Hidrogen klorida HCl
HCl(g) <----> HCl(aq)
• HCl teknis berwarna kuning, karena ada pengotor Fe+3.
• HCl adalah asam kuat dengan pKa = -7, yang akan
terionisasi sempurna menghasilkan ion H3O+1.
HCl(g) + H2O (l) <----> H3O+1
• Ion Cl- paling stabil, oleh karena itu HCl encer
merupakan oksidator kuat, contoh, dapat mengoksidasi Zn;
• Secara industri HCl disinteais dari reaksi
metana dengan gas Cl2 sebagai hasil samping.
Sintesis Hidrogen klorida HCl
Kegunaan Hidrogen klorida HCl
• Untuk menghapuskan debu pada permukaan baja
(pickling).
• Pembersihan karat.
• Pemurnian gula dan sirup jagung.
• Untuk mendapatkan kondisi asam lambung dengan
• Cl memperlihatkan sifat berbeda dlm bentuk
Cl- dibanding berikatan kovalen dgn unsur lain.
• Hampir semua senyawa ionik Cl, Br dan I larut
dalam air. Namum F tidak larut.
• Hal ini dijelaskan oleh energi kisi yang besar
untuk kristal dari kation densitas muatan tinggi dengan anion densitas muatan tinggi. Seperti CaCl2 larut, namum CaF2 tidak larut.
X-• Larutan florida dapat larutan adalah bersifat basa
karena on F- adalah basa konyugat dari asam lemah HF.
• Ada dua cara yang mungkin untu membentuk
logam-halida;
1. Kombinsi logan dan halogen menghasilkan ion dengan keadaan oksidasi tinggi dan,
2. Kombinasi logam dengan hidrogen halida HX membentuk ion logam keadaan oksiasi rendah., contoh;
Cl2 oksidator kuat
HCl oksidator lemah
• MX.H2O disintesis dari oksida atau hidroksida
logam dengan halida yang sesuai;
Sintesis hidrat Logam-halida MX.H2O
• Pelepasan molekul air dilakukan dengan eletakkan sampel
MgCl2.6H2O dala fume hood dengan menggunakanThionyl chlorida;
• MgCl2.6H2O bila dipanaskan akan enghasil
• Tidak semua M-Iodida logamnya memiliki
bilangan oksidasi tinggi, karena I- adalah pereduksi, contoh I- akan mereduksi Cu2+
menjadi Cu1+,
Sifat M-Iodida
• Artinya CuI2 tidak pernah ada
Cara identivikasi ion
X-• Identivikasi ion X- dalam larutan dilakukan dengan
menambahkan ion Ag+, hingga terbentuk endapan
garam perak AgCl = putih
• Sama seperti kebanyakan senyawa Silver,
Senyawa Silver-halida sensitif cahaya, dalam beberapa waktu berubah dengan
pengocokkan membentuk padatan abu-abu silver.
Sifat senyawa Silver-halida
• Endapan AgCl dapat diidentivikasi dengan
larutan pekat ammonia, hingga membentuk larutan diaminsilver(I).
• AgBr tidak bereaksi dengan NH3 pekat, namun
• Tes ion klorida cukup berbahaya, karena melibatkan
reaksi diduga klorida dengan campuran kalium
dikromat dan asam sulfat pekat. Ketika dipanaskan secara perlahan, dihasilkan senyawa volatile, merah,
beracun dari chromyl klorida, CrO2Cl2.
Identivikasi khusus ion Cl
-• Uap dapat ditiupkan ke dalam air, hingga terbentuk
• Untuk menguji ion bromida dan ion iodida,
larutan dikloro dalam air (klorin berair) ditambahkan ke dalam larutan ion halida.
Munculnya larutan berwarna kuning ke warna coklat menunjukkan adanya salah satu dari
ion-ion ini:
-• Untuk membedakan dibromine dan diiodine, kita
bergantung pada fakta bahwa Br2 dan I2 adalah
molekul nonpolar. Dengan demikian Br2 dan I2 akan
"lebih" larut dalam nonpolar atau pelarut polaritas-rendah, seperti karbon tetraklorida CCl4.
Membedakan ion Br- dan l
-Br2(g) dan I2(s) + CCl4 ----> Br2(CCl4) ---> coklat I2(CCl4) ----> ungu muda
• Jika larutan kecoklatan diguncang dengan pelarut
CCl4, halogen harus mentransfer ke dalam pelarut
polaritas rendah, meninggalkan lapisan berair. Jika diketahui adalah dibromine, warna akan coklat,
• Ada lagi, tes yang sangat sensitif untuk yodium: bereaksi
dengan pati untuk memberikan warna biru (biru-hitam ketika larutan pekat digunakan). Dalam interaksi yang
tidak biasa ini, polimer molekul pati membungkus diri di sekitar molekul yodium. Tidak ada ikatan kimia yang
sebenarnya terlibat.
Identivikasi l
-• Kesetimbangan digunakan secara kualitatif dalam kertas
pati-iodida. Saat kertas terkena agen pengoksidasi, iodida teroksidasi menjadi yodium (I- ---> I
2).
• Pati pada kertas membentuk kompleks pati-yodium, dan
warna biru-hitam diamati.
• Secara kuantitatif, pati digunakan sebagai indikator dalam
• I2(s) nonpolar, tetapi masih bisa larut dalam
halida encer membentuk I-3(aq).
• Ion triiodida muatan rendah, besar, akan
benar-benar membentuk senyawa padat dengan kation densitas muatan rendah seperti rubidium, dengan
• Ion Iodida I- juga akan menjalani reaksi redoks
dengan ion iodat, IO3-, dalam larutan asam
menghasilkan diiodine I2:
• Diiodine kemudian dapat dititrasi dengan ion
tiosulfat yang diketahui konsentrasinya:
-• Halida kovalen terjadi antara boron dengan
halogen.
Halida Kovalen
• Kekuatan gaya Van Der waals dari seri BX3 dari
atas ke bawah semakin bertambah, yang
• Banyak halida kovalen dapat dibuat dengan
memperlakukan unsur dengan halogen yang se suai. Bila lebih dari satu senyawa dapat
dibentuk , rasio mol dapat diubah untuk
mendukung salah satu produk dari yang lain.
Misalnya, dengan adanya kelebihan klorin, fosfor membentuk fosfor pentaklorida, sedangkan
dengan adanya kelebihan fosfor, fosfor triklorida terbentuk:
• Kebanyakan halida kovalen bereaksi keras
dengan air. Misalnya, fosfor triklorida bereaksi dengan air untuk memberikan asam dan
hidrogen klorida fosfonat:
Sifat Senyawa Halida Kovalen
• Beberapa covalen halida innert, seperti CCl4,
• Hal ini penting untuk diingat bahwa halida
logam dapat berisi ikatan kovalen bahkan ketika logam dalam keadaan oksidasi tinggi. Misalnya, timah (IV) klorida SnCl4 berperilaku seperti kovalen halida SnCl4 cair pada suhu kamar, dan bereaksi hebat dengan air:
• Jika unsur non logam ada memiliki sejumlah keadaan
oksidasi yang mungkin, maka keadaan oksidasi tertinggi biasanya distabilkan oleh florida dan terendah oleh yodium. Pola ini mencerminkan
penurunan kemampuan oksidasi unsur dalam gol 17 dari atas ke bawah.
• Namun, kita harus selalu berhati-hati dengan aplikasi
argumen sederhana ini.
• Misalnya, ketiadaan fosfor pentaiodide, PI5, adalah
lebih mungkin karena fakta bahwa ukuran atom yodium membatasi jumlah atom iodine yang akan
muat di sekitar atom fosfor daripada reduksi spontan fosfor dari +5 ke keadaan oksidasi +3.
• Seperti nitrogen, klorin oksida dengan Cl memiliki setiap
kemungkinan keadaan oksidasi ganjil. Semua oksida ini secara termodinamika tidak stabil tapi kinetik stabil, dengan energi aktivasi rendah untuk penguraian.
• ClO sangat tidak stabil dan cendrung meledak.
17.9 Klor Oksida
• Namun, ada dua oksida penting, yang keduanya memiliki
elektron yang tidak berpasangan dan mereka radikal bebas.
1. Pertama klorin monoksida ClO, secara lingkungan
• Banyak spesies yang terlalu tidak stabil ada dalam
konsentrasi yang signifikan pada suhu dan tekanan tertentu di atmosfer.
• Misalnya, dalam Bab 15, Bagian 15,8, kita
menggambarkan bagaimana NO3 bertindak sebagai deterjen troposfer malam hari.
• Molekul atmosfer penting lain adalah klorin monok
sida, ClO. Klorin monoksida adalah spesies stratosfir kunci yang bertanggung jawab untuk menyebabkan "lubang ozon," penurunan konsentrasi ozon penyaring-UV lebih selatan dan, pada tingkat lebih rendah,
• Saga diyakini mulai dengan penumpukan
molekul klorin, terutama dari pemecahan CFC selama musim dingin yang gelap saat udara terisolasi di atas Antartika. Dengan datangnya musim semi, sinar matahari menyebabkan
molekul klorin terikat lemah (energi ikatan 242 kJ / mol-1) terdisosiasi menjadi atom klorin:
• Klor bereaksi dengan ozon menghasilkan klor oksida
• Jika reaksi pembantukan ClO dihentikan di sini, kerusakan
lapisan ozon akan minimal. Namun, klorin monoksida mengambil bagian dalam siklus reaksi yang melahirkan kembali atom klorin, menyebabkan proses ini menjadi katalitik.
• Atom klorin bertindak sebagai katalis untuk konversi ozon
menjadi dioksigen.
• Langkah pertama dalam proses ini adalah kombinasi dari
dua radikal klorin monoksida untuk membentuk molekul dimer ClOOCl. Namun, pemisahan akan segera terjadi kecuali dua radikal bersamaan bertabrakan dengan partikel ketiga, M (N2 dan O2).
• Sinar matahari kembali terlibat untuk
penguaraian asimetris molekul Cl2O2:
• Peran spesies M untuk menghilangkan kelebihan
• ClOO adalah molekul tidak stabil, terpecah dengan
cepat mengasilkan atom Cl(g) dan molekul O2(g)
• Atom klorin kembali tersedia untuk bereaksi
dengan molekul ozon. Ini adalah siklus katalitik yang menghasilkan penipisan ozon kutub lebih parah.
• ClO2, adalah gas kuning yang mengembun
menjadi cairan merah tua pada 11 ° C.
• Senyawa ini cukup larut dalam air,
memberikan larutan hijau cukup stabil.
Klorin dioksida ClO2
• Menjadi spesies radikal bebas, ClO2 adalah
paramagnetik, seperti nitrogen dioksida.
Namun tidak seperti nitrogen dioksida, tidak menunjukkan kecenderungan untuk
• Panjang ikatan klor-oksigen hanya 140 pm, jauh
lebih pendek dari 170 pm yang khas untuk
panjang ikatan tunggal, dan sangat dekat dengan ikatan rangkap klorin-oksigen.
• Struktur titik-elektron mungkin mencerminkan
orde ikatan ini ditunjukkan pada Gambar 17.6 (ini bukan spesies yang sama sebagai radikal cloo
• ClO2, biasanya diencerkan dengan N2 atau CO2
untuk keselamatan.
• ClO2 adalah zat oksidator yang sangat kuat.
Misalnya, untuk pemutih tepung untuk
membuat roti putih, ClO2 adalah 30 kali lebih efektif daripada Cl2.
• Sejumlah besar ClO2 juga digunakan sebagai
larutan berair encer untuk pemutihan pulp kayu untuk membuat kertas putih. Dalam peran ini, ClO2 lebih disukai daripada Cl2,
karena pemutih ClO2 tanpa pembentukan
signifikan limbah Cl2 berbahaya.
• Keuntungan lain dari ClO2 adalah bahwa, tidak
seperti Cl2, ClO2 tidak menyerang struktur
• Demikian pula, penggunaan ClO2 semakin
meningkat untuk pengolahan air domestik, karena, ClO2 tidak menghasilkan polutan
klorinasi hidrokarbon di dalam air untuk beberapa tingkat pengukuran. Dengan
demikian, penggunaan ClO2 menghindari
masalah lingkungan.
• ClO2 digunakan untuk menghancurkan spora
• Meskipun ClO2 murni mudah meledak, ClO2 adalah
penting dari industri utama. Sekitar 106 ton diproduksi setiap tahun di seluruh dunia.
• Gas ini sangat berbahaya, umumnya diproduksi dalam
jumlah relatif kecil di lokasi yang akan digunakan.
• Reaksi sintetis melibatkan pereduksian klorin
pada keadaan oksidasi +5 (ClO3-) oleh klorin
keadan oksidasi -1 (Cl-) dalam kondisi sangat
asam untuk menghasilkan klorin dalam keadaan
• Di Amerika selatan, SO2 ditambahkan untuk
mereduksi ( dan dikeluarkan) gas Cl2 menjadi ion Cl-, SO2 bersamaan teroksidasi menjadi sulfat.
• Bagaimanapun proses ini menghasilkan
limbah Na2SO4.
• Proses Jerman memisahkan gas Cl2 dari ClO2
• Klorin membentuk serangkaian asam oksi dan
oksianion untuk masing-masing keadaan oksidasi positif ganjil dari 11 ke 17. Bentuk ion (dan asam terkait) didasarkan pada pengaturan tetrahedral di sekitar atom klorin (Gambar 17.7).
17.10 Asam Oksiklorin dan Oksianion (HClO dan ClO-)
• Ikatan klorin oksigen pendek di masing-masing
ion menunjukkan bahwa beberapa ikatan harus ada, mungkin melibatkan beberapa
kontribusi pada orbital p ikatan dengan orbital p penuh pada atom oksigen dan orbital d
kosong pada atom klorin.
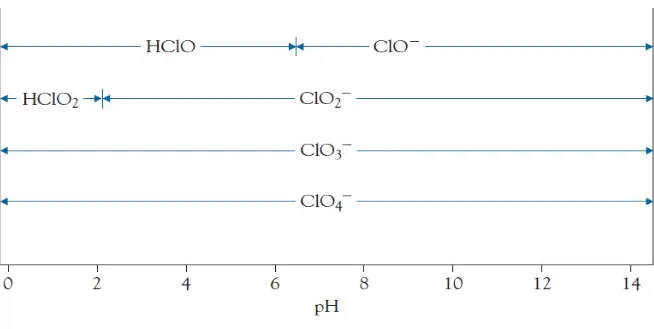
• Kekuatan asam meningkat sebagai jumlah
atom oksigen meningkat.
• Dengan demikian, asam hipoklorit sangat
• kekuatan asam relatif terbaik dapat dilihat dari diagram
pH dominasi untuk asam oksi klorin (Gambar 17.8).
• Asam hipoklorit dan ion hipoklor disintesis
dengan cara melarutkan Cl2 dalam air dingin,
Asam hipoklorit dan ion hipoklor
• Asam hipoklorit adalah asam lemah, ion
• Asam hipoklorit zat pengoksidasi kuat,
tereduksi menghasilkan gas Cl2,
• Ion hipoklorit zat pengoksidasi lemah,
tereduksi menghasilkan klorida,
• Karena daya pengoksidasi ini (pemutih dan
• Dua senyawa industri penting adalah natrium
hipoklorit dan kalsium hipoklorit (NaClO, KClO).
• NaClO hanya stabil dalam larutan, tidak dalam
fase padat; dengan demikian, KClO digunakan sebagai padatan sumber ion hipoklorit.
Kegunaan NaClO dan KClO
• Larutan NaClO digunakan dalam larutan pemutih
komersial, seperti Clorox dan Javex, dan untuk pemutihan dan penghilangan warna dari pulp kayu dan tekstil.
• Kalsium hipoklorit juga digunakan sebagai desinfektan
di perusahaan susu, bir, pengolahan makanan, dan pabrik pembotolan dan penghilang jamur dalam negeri.
• Meskipun label pada kontainer natrium larutan
hipoklorit memperingatkan tentang bahaya
pencampuran pembersih. Secara kimia larutan
natrium hipoklorit komersial mengandung ion klorida.
• Dengan adanya ion hidrogen (hidronium) dalam
natrium hidrogen berbasis sulfat pembersih, asam hipoklorit bereaksi dengan ion klorida untuk
• Beberapa cedera dan kematian disebabkan
• Meskipun ClO3- kurang menarik, ClO3- memiliki
beberapa kegunaan. NaClO3 dapat dibuat dengan
mereaksikan gas Cl2 ke dalam larutan panas
NaOH. KClO3 yang kurang larut dari NaClO3 akan
mengendap:
Ion Klorat ClO3
-• KClO3 digunakan dalam jumlah besar untuk membuat korek
api dan kembang api, karena KClO3 zat pengoksidasi kuat
yang dapat meledak tak terduga bila dicampur dengan zat pereduksi.
• Jumlah yang cukup NaClO3 dikonsumsi dalam produksi
• Klorat ClO3- terurai ketika dipanaskan, ketika
KClO3 dipanaskan pada suhu di bawah 370 ° C, disproporsionasi terjadi untuk memberikan
KCl dan perklorat KClO4:
• Perklorat ClO4- juga terurai ketika dipanaskan,
• Jalur lambat untuk reaksi tidak dikatalis, untuk
reaksi dengan katalis KMnO4, KClO3 Klorat akan menghasilkan endapan KCl.
• Reaksi total adalah,
• Bukti mekanisme reaksi ada bau Cl2,O2- teroksidasi
• Kelarutan Alkali-ClO4 menurun dengan meningkatnya
ukuran kation. Artinya,kanaikan ukuran (penurunan kepadatan muatan) dari ion akan mengurangi energi hidrasi ke titik bahwa mereka melebihi energi kisi.
• Contoh; KClO4 hanya sedikit larut (20 g/L air).
Sebaliknya, AgClO4 luar biasa larut 5 kg/ air. Asam perklorat dan ion perklorat (ClO4-)
• Kelarutan AgClO4 rendah dalam pelarut organik polaritas
rendah serta dalam air menunjukkan bahwa ikatan dalam AgClO4 padat adalah kovalen bukan ionik.
• Artinya, hanya atraksi dipol perlu diatasi untuk
• Kalium perklorat digunakan dalam kembang
api dan petasan.
• Sebagian perklorat diproduksi secara
komersial digunakan dalam pembuatan amonium perklorat.
• Ammonium perklorat digunakan sebagai
komponen bersama dengan reduktor
aluminium padat untuk pendorong roket.
• Setiap peluncuran pesawat ulang-alik menggunakan
850 ton perklorat. Kebutuhan 30 000 ton.
• Saat ini dua industri ammonium perklorat AS
berada di Henderson, Nevada, pinggiran Las Vegas.
• Atraksi sisi listrik murah dari Bendungan Hoover dan
iklim yang sangat kering, membuat penanganan dan penyimpanan amonium perklorat higroskopis lebih mudah.
Kegunaan Ammonium perklorat
• Masalah besar ammonium perklorat, mudah
• Tanggal 4 Mei, 1988, dekomposisi ini terjadi pada
skala besar di salah satu pabrik. Serangkaian ledakan menghancurkan setengah dari kapasitas produksi
amonium perklorat nasional, serta menyebabkan
kematian, cedera, dan kerusakan properti yang luas.
• Penyebab kecelakaan;
1. kelayakan pembangunan pabrik tersebut dekat dengan daerah pemukiman.
Senyawa Interhalogen dan ion Polyhalida
• Senyawa netral sesuai dengan rumus XY, XY3, XY5,
dan XY7, di mana X adalah halogen massa atom yang lebih tinggi dan Y, yang dari massa atom yang lebih rendah. Semua permutasi dikenal untuk XY dan XY3, tapi XY5 hanya dikenal di mana Y adalah fluor.
• Rumus XY7, di mana X akan memiliki keadaan
oksidasi +7, hanya ditemukan di IF7. Argumen umum untuk kurangnya klorin dan bromin analog hanya
• Senyawa interhalogen yang menarik bagi ahli
kimia anorganik karena geometri mereka.
• Bentuk senyawa semua mengikuti aturan
VSEPR, bahkan yodium heptafluorida, IF7,
• Sintesis IF7(g) dari unsur masing-masing dalam
keadaan gas.
• Senyawa ineterhalogen lainnya ICl3(g) disintesis
dengan mengalirkan gelembung gas klorin melalui larutan ion iodida membentuk larutan coklat-hitam yodium, coklat gelap ICl, dan akhirnya kuning pucat
ICl3. dari unsur masing-masing dalam keadaan gas.
Coklat-hitam Coklat-gelap
• Interhalogens sederhana seperti ICl memiliki warna
menengah antara unsur pengisi, namum emiliki titik leleh dan titik didih interhalogens yang sedikit lebih tinggi dari nilai rata-rata dari pengisi karena molekul interhalogen yang polar.
• Lebih penting, reaktivitas kimia senyawa interhalogen
biasanya mirip dengan halogen lebih reaktif. Untuk klorinasi unsur atau senyawa, seringkali lebih nyaman digunakan monoklorida yodium padat daripada gas klorin, meskipun kadang-kadang atom nonhalogen dalam dua produk memiliki oksidasi yang berbeda. Hasil ini dapat diilustrasikan untuk klorinasi
• Ruby merah, ICl padat digunakan dalam
biokimia sebagai Wijreagent untuk penentuan jumlah ikatan ganda karbon=karbon dalam
minyak atau lemak.
• Pada penambahan larutan coklat dari
• Satu-satunya senyawa interhalogen diproduksi pada skala
industri adalah ClF3, cairan mendidih pada 11 ° C.
• ClF3 adalah agen fluorinating nyaman dan sangat kuat
sebagai akibat dari kandungan fluor polaritas ikatan tinggi
Sintesis dan keguaan senyawa interhalogen
• ClF3 berguna dalam pemisahan uranium dari sebagian
produk penguraian di bahan bakar nuklir.
• Pada suhu reaksi 70 ° C, bentuk uranium(VI)fluorida cair .
• Senyawa uranium kemudian dapat dipisahkan
dari campuran dengan distilasi. Dalam larutan air, molekul interhalogen yang dihidrolisis
dengan asam halida dari halogen lebih
• Halogen juga membentuk ion pliatomik. Yodium
adalah hanya halogen yang mudah membentuk anion dengan diri sendiri.
• Ion I3-, adalah penting karena pembentukannya hanya dengan melarutkan molekul yodium I2 dalam larutan iodida I-;
• Ion I3- adalah linear dan memiliki panjang ikatan I-I sama, 293 pm. Ikatan ini sedikit lebih panjang dari ikatan tunggal I-I dalam molekul I2(273 pm).
• Ada beberapa polyiodida lainnya; I5- dan I7-, tetapi
• Ada variasi luas kation dan anion interhalogen,
contoh;
1. Ion dikloroiodida,
ICl2-2. Ion tetrakloroiodida, ICl4-.
• Teori VSEPR dapat digunakan untuk
meramalkan bentuk molekul dan ion interhalogen (Gb. 17.10)
• Interhalogens dapat digunakan sebagai
• Ion yang berperilaku seperti ion lainnya,
contoh NH4+ sama dengan ion logan alkali,
CN- berperilkaku seperti ion halida, juga seperti halogen seperti sianogen
(CN)2.
1. Garam dari ion sianida dengan Ag, Pb(II) dan Hg (I) adalah tidak larut, seperti ion klorida, bromida dan iodidanya.
• Ion sianida menyerupai ion halida dalam jumlah
cara yang luarbiasa :
3. Ion sianida adalah basa konyugasi dari asam
lemah HCN, paralel dengan ion F- dan asam HF;
4. Ion sianida membentuk berbagai ion kompleks dengan logam transisi, seperti [Cu(CN)4]2-, yang mirip dengan
7. Sianogen membentuk senyawa pseudo-interhalogen seperti ICN dengan cara sama; Ion halogen
membentuk senyawa interhalogen seperti Iodinmonoklorida (ICl),
• Halogen yang unik karena setiap anggota
kelompok stabil memiliki fungsi biologis. 17.13 Aspek Biologi
Flour dan Tanaman Pembunuh
• Di beberapa daerah di dunia, peternak sapi
memiliki masalah besar dari tanaman beracun. Australia menderita parah terutama sejak
sekitar seribu spesies tanaman ada diketahui menjadi racun bagi hewan dan manusia.
• Asam fluoroacetic adalah asam kuat dengan
pK 2,59 dibandingkan dengan nilai 4,76 untuk asam asetat. Tindakan ion fluoroacetate
dengan menghalangi siklus Krebs pada
• Tanaman menyerap sisa ion fluoride dari tanah
dan kemudian memasukkan ke dalam jalur biokimia mereka.
• Diperkirakan bahwa tanaman ini menghasilkan
ion fluoroacetate sebagai mekanisme pertahanan terhadap predator.
• meskipun Australia mungkin memiliki sebagian
besar memproduksi spesies fluoroacetate.
• Afrika Selatan memiliki pabrik yang menghasilkan
ion fluoroacetate untuk konsentrasi 1 persen,
yang berarti bahwa konsumsi satu daun tanaman ini cukup untuk membunuh seekor sapi.
• Sodium fluoroacetate digunakan oleh
beberapa di Amerika Serikat dan di tempat lain sebagai racun untuk mamalia yang tidak diinginkan seperti coyote.
Kegunaan Fluoroasetat
• Salah satu kasus yang paling terkenal yaitu,
dua pembunuhan Australia (kasus
• Ion klorida memiliki peran penting dalam
keseimbangan ion dalam tubuh kita. Cl- tidak muncul untuk berperan aktif tetapi hanya
bertindak untuk menyeimbangkan ion positif natrium dan kalium.
• Namun, klorin terikat kovalen tidak ramah. • Sebagian besar senyawa beracun yang
memperihatinkan yaitu, molekul klorin yang mengandung DDT dan PCB.
• Argumen telah dibuat untuk sepenuhnya
melarang produksi senyawa terikat kovalen yang mengandung klorin.
• Namun, ini akan mengakibatkan penghapusan
banyak bahan yang berguna seperti
polyvinylchlorida (PVC). Hal ini penting untuk mengakui bahwa ada senyawa organochloro yang dihasilkan oleh berbagai organisme;
dengan demikian, melarang senyawa chloro sintetis tidak akan benar-benar
• Sekelompok senyawa perlu perhatian khusus adalah
trihalomethanes (THMs).
• THMs diproduksi ketika air kaya bahan organik
diklorinasi untuk membunuh hama, pada air untuk konsumsi manusia.
• Bahan organik ditemukan di permukaan perairan
yang telah dilarutkan asam humat dan fulvat dari pembusukan tanaman.
• Asam sendiri relatif tidak berbahaya, meskipun
mereka menyebabkan air memiliki warna kecoklatan. Ini adalah proses klorinasi yang menghasilkan
fragmentasi molekul organik kompleks untuk memberikan molekul kecil chloro seperti
• Keberadaan THMs dalam beberapa sampel air
keran ditemukan pada 1970-an, dan peraturan membatasi tingkat perizinan telah
diperkenalkan pada awal tahun 1980.
• Pada saat itu, tingkat maksimum 100 ppb pada
• Untuk alasan ini, ada usulan untuk mengurangi
tingkat THM yang diperbolehkan.
• Salah satu cara untuk mencapai hal ini adalah
dengan menggunakan ozon (trioxygen; lihat Bab 16, Bagian 16.3) atau klorin dioksida (lihat Bagian 17.8) sebagai desinfektan utama pasokan air.
• Senyawa ini menguraikan asam organik tanpa
menghasilkan THMs yang siginifikan.
• Namun, karena ozon terurai dalam waktu singkat,
konsentrasi kecil klorin perlu ditambahkan ke pasokan air untuk mempertahankan sifat dpt
• Senyawa bromin paling kontroversial adalah
bromometana ( metil bromida).
• Metil bromida, CH3Br, adalah fumigan spektrum
luas digunakan dalam pengendalian serangga hama, nematoda, gulma, patogen, dan tikus.
• Metil bromida memiliki volatilitas tinggi dan
karenanya meninggalkan sedikit residu. Sekitar 80 000 ton digunakan setiap tahun, sekitar 75 persen sebagai fumigan tanah; 22 persen, pascapanen; dan 3 persen, pengendalian hama alat struktural.
• Metil bromida penting untuk masyarakat pertanian
karena menguasai berbagai macam hama dengan biaya rendah, dan belum ditemukan senyawa pengganti yang sama perannya dengan metil bromida.