BAB III
METODE PENELITIAN
Metode penelitian yang digunakan adalah metode eksperimental parametrik. Identifikasi tumbuhan dan karakterisasi simplisia dilakukan sebelum pembuatan ekstrak kulit buah pisang raja, kemudian dilanjutkan dengan pembuatan ekstrak kulit buah pisang raja secara maserasi, pembuatan sediaan gel dari ekstrak kulit buah pisang raja, evaluasi stabilitas sediaannya dan pengujian aktivitas antibakteri ekstrak kulit buah pisang raja (Musa X paradisiaca AAB) dan sediaan gel ekstrak kulit buah pisang raja terhadap bakteri Propionibacterium acne dan Staphylococcus epidermidis dengan metode difusi agar menggunakan pencadang kertas.
Penelitian ini dilakukan di Laboratorium Farmakognosi, Laboratorium Mikrobiologi dan Laboratorium Farmasi Fisik Fakultas Farmasi Universitas Sumatera Utara, Medan.
3.1 Alat
3.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah serbuk simplisia kulit buah pisang raja (Musa X paradisiaca AAB), etanol 80%, air suling, HPMC 4000, propilenglikol, metil paraben, bakteri uji: Propionibacterium acne (ATCC 6919), Staphylococcus epidermidis (ATCC 12228), media nutrient agar (NA), media nutrient broth (NB), pereaksi Molisch, pereaksi Dragendorff, pereaksi Bouchardat, pereaksi Mayer. Bahan kimia yang digunakan kecuali dinyatakan lain adalah berkualitas pro analisa yaitu: asam klorida pekat, asam asetat anhidrida, asam sulfat pekat, besi (III) klorida, etanol, amil alkohol, n-heksan, isopropanol, kloroform, metanol, natrium hidroksida, serbuk magnesium, timbal (II) asetat, toluena dan dimetil sulfoksida (DMSO).
3.3 Penyiapan Sampel 3.3.1 Pengumpulan sampel
Pengambilan bahan dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Sampel yang digunakan adalah kulit buah pisang raja (Musa X paradisiaca AAB) yang sudah cukup tua dan berwarna hijau yang diperoleh dari Desa Sawit Rejo, Kecamatan Kutalimbaru, Kabupaten Deli Serdang, Provinsi Sumatera Utara.
3.3.2 Identifikasi sampel
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor. 3.3.3 Pengolahan sampel
dikumpulkan sebanyak 8,6 kg dan dipotong sepanjang + 4 cm. Kulit buah ini dikeringkan di lemari pengering pada suhu 40 - 600C hingga kering, dimana jika simplisia tersebut sudah kering dapat dipatahkan, simplisia ditimbang sebagai berat kering, kemudian simplisia diserbuk menggunakan blender, disimpan dalam wadah plastik yang tertutup rapat dan terlindung dari panas dan sinar matahari. Serbuk simplisia yang diperoleh sebanyak 1,3 kg.
3.4 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut asam.
3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan pada kulit buah pisang raja (Musa X paradisiaca AAB) dengan mengamati morfologi luar tumbuhan.
3.4.2 Penetapan kadar air
Penetapan kadar air simplisia dilakukan dengan metode Azeotropi (destilasi toluen).
a. Penjenuhan toluena
Sebanyak 200 ml toluena dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml (WHO,1992).
b. Penetapan kadar air simplisia
toluen mendidih, kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.4.3 Penetapan kadar sari larut air
Sebanyak 5 g serbuk yang telah dikeringkan, dimaserasi selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling 1000 ml) dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama, dibiarkan selama 18 jam, kemudian disaring. Diuapkan 20 ml filtrat sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995). 3.4.4 Penetapan kadar sari larut etanol
3.4.5 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama dimasukkan dalam krus platina atau krus silikat yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan pada suhu 600oC selama 3 jam. Kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.4.6 Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dalam penetapan abu didinginkan dengan 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring dengan kertas masir atau kertas saring bebas abu, cuci dengan air panas, dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bobot yang dikeringkan di udara (Depkes RI, 1995).
3.5 Skrining Fitokimia
Skrining fitokimia serbuk simplisia kulit buah pisang raja meliputi: pemeriksaan senyawa alkaloid, glikosida, saponin, flavonoid, tanin dan steroid/triterpenoid.
3.5.1 Pemeriksaan alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang, kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat dipakai untuk tes alkaloid.
a. Ditambahkan 2 tetes pereaksi Bouchardat b. Ditambahkan 2 tetes pereaksi Dragendorff c. Ditambahkan 2 tetes pereaksi Mayer
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada paling sedikit 2 tabung reaksi dari percobaan diatas (Depkes RI, 1979).
3.5.2 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml campuran 7 bagian volume etanol 96% dan 3 bagian volum air suling ditambah dengan 10 ml asam klorida 2N. Direfluks selama 30 menit, lalu didinginkan dan disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4M, lalu dikocok selama 5 menit dan disaring. Filtrat disari dengan 20 ml campuran 3 bagian kloroform dan 2 isopropanol dilakukan berulang sebanyak tiga kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk percobaan berikut, yaitu 0,1 ml larutan percobaan dimasukkan ke dalam tabung reaksi, diuapkan di penangas air. Sisa dilarutkan dalam 2 ml air suling dan 5 tetes pereaksi Molish, kemudian secara perlahan ditambahkan 2 ml asam sulfat pekat. Glikosida positif jika terbentuk cincin ungu (Depkes RI, 1979).
3.5.3 Pemeriksaan saponin
3.5.4 Pemeriksaan flavonoid
Sebanyak 10 g sebuk simplisia kemudian ditambahkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, filtrat yang diperoleh kemudian diambil 5 ml lalu di tambahkan 0,1 g serbuk Mg dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.5.5 Pemeriksaan tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml larutan filtrat lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966). 3.5.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g sampel dimaserasi dengan n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap, pada sisa ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna biru atau hijau menunjukkan adanya steroid dan timbul warna merah, pink atau ungu menunjukkan adanya triterpenoid (Farnsworth, 1966).
3.6 Pembuatan Ekstrak
Serbuk simplisia diekstraksi dengan cara maserasi dengan menggunakan pelarut etanol 80%. Cara kerja:
penyari secukupnya sehingga diperoleh seluruh sari sebanyak 12000 ml, kemudian didiamkan selama 2 hari dan dienap tuang. Maserat diuapkan dengan bantuan alat penguap rotary evaporator pada temperatur + 50oC dan dipekatkan dalam freeze dryer sampai diperoleh ekstrak kental (Ditjen POM, 1979).
3.7 Pembuatan Media untuk Bakteri Uji 3.7.1 Nutrient agar (NA)
Komposisi: ‘Lab-Lemco’ powder 1,0 Yeast extract 2,0
Peptone 5,0
Sodium chloride 5,0
Agar 15,0
Cara pembuatan:
Sebanyak 28 gram serbuk Nutrient Agar (NA) dilarutkan dalam 1 L air suling steril dan dipanaskan sampai semua bahan larut sempurna, kemudian disterilkan di autoklaf pada suhu 121oC selama 15 menit (Oxoid, 1998).
3.7.2 Nutrient broth (NB)
Komposisi: ‘Lab-Lemco’ powder 1,0 Yeast extract 2,0
Peptone 5,0
Sodium chloride 5,0 Cara pembuatan:
3.7.3 Pembuatan agar miring
Ke dalam tabung reaksi steril dimasukkan 3 ml media nutrient agar steril, didiamkan pada temperatur kamar sampai membeku pada posisi membentuk sudut 45o, kemudian tabung disimpan dalam lemari pendingin pada suhu 5o C.
3.8 Pembuatan Stok Kultur
3.8.1 Pembuatan stok kultur bakteri Propionibacterium acne
Satu koloni bakteri Propionibacterium acne diambil dengan jarum ose steril, lalu diinokulasikan pada permukaan media nutrient agar miring dengan cara menggores, kemudian diinkubasikan pada suhu 35 ± 2oC selama 24 jam (Ditjen POM, 1995).
3.8.2 Pembuatan stok kultur bakteri Staphylococcus epidermidis
Satu koloni bakteri Staphylococcus epidermidis diambil dengan jarum ose steril, lalu diinokulasikan pada permukaan media nutrient agar miring dengan cara menggores, kemudian diinkubasikan pada suhu 35 ± 2oC selama 24 jam (Ditjen POM, 1995).
3.9 Pembuatan Inokulum Bakteri
3.9.1 Pembuatan inokulum bakteri Propionibacterium acne
Cara kerja:
3.9.2 Pembuatan inokulum bakteri Staphylococcus epidermidis
Cara kerja:
Koloni bakteri Staphylococcus epidermidis diambil dari stok kultur diambil menggunakan jarum ose steril, kemudian disuspensikan ke dalam 10 ml larutan Nutrient Broth (NB) steril lalu diinkubasikan pada suhu 35 ± 2oC sampai didapat kekeruhan dengan transmitan 25% menggunakan alat spektrofotometer UV panjang gelombang 580 nm (Ditjen POM, 1995).
3.10 Sterilisasi Alat dan Bahan
Alat-alat yang digunakan dalam uji aktivitas antibakteri ini disterilkan lebih dahulu sebelum dipakai. Media disterilkan di autoklaf pada suhu 121oC selama 15 menit dan alat-alat gelas lainnya disterilkan di oven pada suhu 160 - 170oC selama 2-3 jam. Jarum ose dibakar dengan lampu bunsen (Pratiwi, 2008).
3.11 Pembuatan Larutan Uji Ekstrak Kulit Buah Pisang Raja dengan Berbagai Konsentrasi
Sebanyak 1 g ekstrak kulit buah pisang raja ditimbang, lalu ditambahkan dimetil sulfoksida (DMSO) hingga volume total 2 ml dan diaduk hingga larut dan didapat konsentrasi 500 mg/ml atau 50% (b/v), kemudian dibuat pengenceran dengan konsentrasi 40%, 30%, 20%, 10%, 7,5%, 5% dan 2,5%.
3.12 Pengujian Aktivitas Antibakteri terhadap Ekstrak
3.12.1 Bakteri Propionibacterium acne
Sebanyak 0,1 ml inokulum dimasukkan ke dalam cawan petri steril, setelah itu dituang media nutrient agar sebanyak 20 ml dengan suhu 45 - 50oC, selanjutnya cawan digoyang di atas permukaan meja agar media dan suspensi bakteri tercampur rata. Pada media yang telah padat diletakkan beberapa pencadang kertas yang telah direndam (+ 15 menit) dalam larutan uji ekstrak kulit buah pisang raja dengan berbagai konsentrasi, kemudian diinkubasi dalam inkubator pada suhu 35 ± 2oC selama 18 - 24 jam, lalu diukur diameter daerah hambatan (zona jernih) pertumbuhan di sekitar pencadang dengan menggunakan jangka sorong.
3.12.2 Bakteri Staphylococcus epidermidis
Sebanyak 0,1 ml inokulum dimasukkan ke dalam cawan petri steril, setelah itu dituang media nutrient agar sebanyak 20 ml dengan suhu 45 - 50oC, selanjutnya cawan digoyang di atas permukaan meja agar media dan suspensi bakteri tercampur rata. Pada media yang telah padat diletakkan beberapa pencadang kertas yang telah direndam (+ 15 menit) dalam larutan uji ekstrak kulit buah pisang raja dengan berbagai konsentrasi, kemudian diinkubasi dalam inkubator pada suhu 35 ± 2oC selama 18 - 24 jam, lalu diukur diameter daerah hambatan (zona jernih) pertumbuhan di sekitar pencadang dengan menggunakan jangka sorong.
3.13 Pembuatan Formula Sediaan Gel Ekstrak Kulit Buah Pisang Raja 3.13.1 Pembuatan basis gel
R/ HPMC 3 Propilen glikol 15 Metil paraben 0,18 Air suling ad 100
Cara pembuatan: Air suling dipanaskan secukupnya kemudian diambil air suling panas tersebut sebanyak 20 kali berat HPMC. Kemudian HPMC dikembangkan di dalamnya selama 15 menit, setelah kembang ditambahkan metil paraben yang telah dilarutkan dalam propilen glikol sedikit demi sedikit sambil digerus sampai homogen, lalu dicukupkan dengan sisa air suling hingga 100 g (Soerartri, 2004).
3.13.2 Komposisi formula
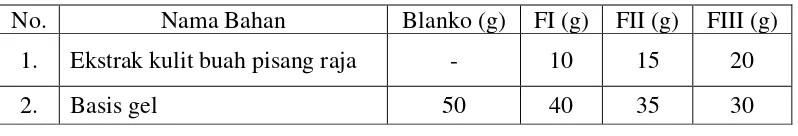
Sediaan dibuat ke dalam tiga konsentrasi dan satu blanko dimana masing masing sediaan memiliki bobot 50 gram.
Tabel 3.1 Komposisi formula sediaan gel ekstrak kulit buah pisang raja
No. Nama Bahan Blanko (g) FI (g) FII (g) FIII (g) 1. Ekstrak kulit buah pisang raja - 10 15 20
2. Basis gel 50 40 35 30
Keterangan:
Blanko = Formula tanpa mengandung ekstrak kulit buah pisang raja FI = Formula mengandung 20% ekstrak kulit buah pisang raja FII = Formula mengandung 30% ekstrak kulit buah pisang raja FIII = Formula mengandung 40% ekstrak kulit buah pisang raja 3.13.3 Cara pembuatan sediaan gel
a. Formula I
b. Formula II
Cara pembuatan: ke dalam lumpang dimasukkan 15 g ekstrak kulit buah pisang raja ditambahkan 35 g basis gel sambil gerus sampai homogen.
c. Formula III
Cara pembuatan: ke dalam lumpang dimasukkan 20 g ekstrak kulit buah pisang raja ditambahkan 30 g basis gel sambil gerus sampai homogen.
3.14 Evaluasi Formula
Evaluasi formula meliputi evaluasi fisik dan biologi. Evaluasi fisik meliputi pemeriksaan stabilitas fisik sediaan, pemeriksaan homogenitas, penentuan pH dan uji iritasi pada kulit. Evaluasi biologi meliputi pengujian aktivitas antibakteri sediaan gel ekstrak kulit buah pisang raja terhadap Propionibacterium acne dan Staphylococcus epidermidis dengan metode difusi agar menggunakan pencadang kertas.
3.14.1 Pemeriksaan stabilitas fisik sediaan
Pemeriksaan stabilitas sediaan meliputi bentuk, warna dan bau yang diamati secara visual (Ditjen POM, 1985).
Sediaan dinyatakan stabil apabila bentuk, warna dan bau tidak berubah secara visual selama penyimpanan dan juga secara visual tidak ditumbuhi jamur. Pengamatan dilakukan pada suhu kamar pada setiap minggu dari minggu ke- 0 hingga minggu ke- 12.
3.14.2 Pemeriksaan homogenitas sediaan
dilakukan pada suhu kamar pada setiap minggu dari minggu ke- 0 hingga minggu ke- 12.
3.14.3 Penentuan pH sediaan
Penentuan pH sediaan dilakukan dengan mengunakan pH meter Hanna.
Cara: alat terlebih dahulu dikalibrasi dengan menggunakan larutan dapar standar pH netral (pH 7,01) dan larutan dapar pH asam (pH 4,01) hingga alat menunjukkan harga pH tersebut, elektroda dicuci dengan air suling, lalu dikeringkan dengan kertas tissue. Sampel dibuat dalam konsentrasi 1% yaitu ditimbang 1 gram sediaan dan ditambahkan air suling hingga volume total 100 ml, kemudian elektroda dicelupkan dalam larutan tersebut sampai alat menunjukkan harga pH yang konstan. Angka yang ditunjukkan pH meter merupakan harga pH sediaan (Rawlins, 2003). Pengamatan dilakukan pada suhu kamar pada setiap minggu dari minggu ke-0 hingga minggu ke-12.
3.14.4 Uji iritasi terhadap kulit sukarelawan
Uji iritasi terhadap kulit sukarelawan dilakukan dengan cara uji terbuka (open test). Uji tempel terbuka dilakukan dengan mengoleskan sediaan pada lengan bawah bagian dalam dengan luas tertentu (2,5 x 2,5 cm), dibiarkan terbuka dan diamati apa yang terjadi. Uji ini dilakukan dengan mengoleskan sediaan sebanyak 3 kali sehari dalam selang waktu 8 jam selama tiga hari berturut-turut. Reaksi iritasi positif ditandai oleh adanya kemerahan, gatal-gatal, atau bengkak pada kulit lengan bawah bagian dalam yang diberi perlakuan (Wasitaatmadja, 1997; Tranggono dan Latifah, 2007).
1. Wanita berbadan sehat. 2. Usia antara 20-30 tahun.
3. Tidak ada riwayat penyakit yang berhubungan dengan alergi. 4. Bersedia menjadi sukarelawan untuk uji iritasi.
3.14.5 Uji mikrobiologi sediaan
Uji mikrobiologi untuk mengetahui aktivitas antibakteri sediaan gel ekstrak kulit buah pisang raja yang dilakukan dengan metode difusi agar menggunakan pencadang kertas dengan cara mengukur diameter hambatan pertumbuhan bakteri terhadap bakteri Propionibacterium acne dan bakteri Staphylococcus epidermidis. 3.14.5.1 Bakteri Propionibacterium acne
Sebanyak 0,1 ml inokulum dimasukkan ke dalam cawan petri steril, setelah itu dituang media nutrient agar sebanyak 20 ml dengan suhu 45 - 50oC, selanjutnya cawan digoyang di atas permukaan meja agar media dan suspensi bakteri tercampur rata. Pada media yang telah padat diletakkan beberapa pencadang kertas yang telah direndam (+ 15 menit) dalam 0,1 g gel ekstrak kulit buah pisang raja yang telah ditambahkan setetes DMSO, kemudian diinkubasi dalam inkubator pada suhu 35 ± 2oC selama 18 - 24 jam dan diukur diameter daerah hambatan (zona jernih) di sekitar pencadang menggunakan jangka sorong. 3.14.5.2 Bakteri Staphylococcus epidermidis
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Tumbuhan yang digunakan telah diidentifikasi Herbarium Bogoriense, Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor, adalah tumbuhan pisang raja (Musa X paradisiaca AAB), suku Musaceae. Hasil identifikasi tumbuhan dapat dilihat pada lampiran 1, halaman 47.
4.2 Hasil Karakterisasi Simplisia Kulit Buah Pisang Raja
Hasil karakterisasi simplisia terhadap kulit buah pisang raja (Musa X paradisiaca AAB) berupa kulit berwarna hijau dan bergetah dengan ketebalan kulit lebih kurang 0,2 sampai 0,3 cm, panjang 9,5 sampai 11 cm, berbau khas dan berasa kelat.
Hasil karakterisasi simplisia kulit buah pisang raja diperoleh kadar air 6,32%, kadar sari yang larut dalam air 34,20%, kadar sari yang larut dalam etanol 36,32%, kadar abu total 4,39% dan kadar abu tidak larut asam 0,84%. Hasil karakterisasi simplisia ekstrak kulit buah pisang raja dapat dilihat pada Tabel 4.1 berikut ini:
Tabel 4.1 Hasil karakterisasi simplisia kulit buah pisang raja
No. Parameter Hasil (%)
1. Kadar air 6,32
2. Kadar sari larut air 34,20
3. Kadar sari larut etanol 36,32
4. Kadar abu total 4,39
5. Kadar abu tidak larut dalam asam 0,84
etanol menyatakan jumlah zat tersari dalam air atau etanol. Penetapan kadar abu dilakukan untuk mendestruksi senyawa organik dan turunannya sehingga yang tersisa senyawa anorganik. Kadar abu tidak larut asam untuk mengetahui kadar senyawa anorganik yang tidak larut dalam asam (Depkes RI, 1995).
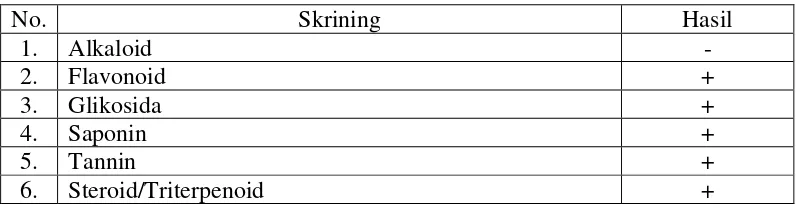
4.3 Hasil Skrining Fitokimia Simplisia Kulit Buah Pisang Raja
Hasil skrining fitokimia serbuk simplisia kulit buah pisang raja menunjukkan adanya kandungan flavonoid, glikosida, saponin, tannin, dan steroid/triterpenoid. Hasil skrining dapat dilihat di Tabel 4.2 berikut ini:
Tabel 4.2 Hasil skrining fitokimia simplisia kulit buah pisang raja
No. Skrining Hasil
6. Steroid/Triterpenoid +
Keterangan:
+ = mengandung golongan senyawa - = tidak mengandung golongan senyawa
4.4 Hasil Ekstraksi Simplisia Kulit Buah Pisang Raja
Hasil maserasi dari 1200 g simplisia kulit buah pisang raja dengan pelarut etanol 80% dipekatkan dengan menggunakan rotary evaporator diperoleh ekstrak kental 75,79 g (rendemen 6,31%).
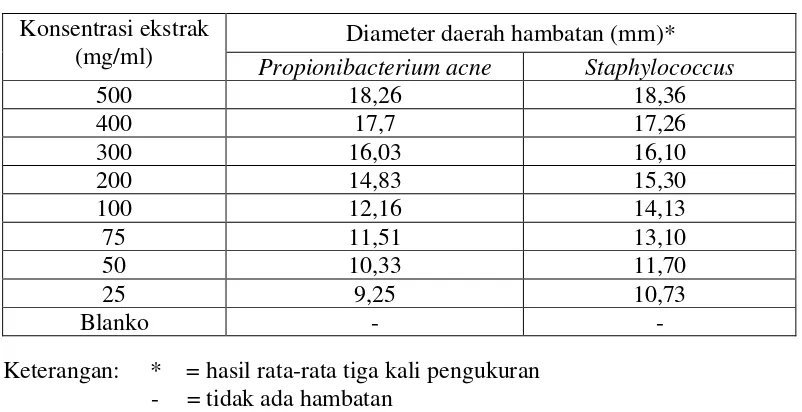
4.5 Hasil Uji Aktivitas Antibakteri Ekstrak Kulit Buah Pisang Raja terhadap Bakteri Propionibacterium acne dan Staphylococcus epidermidis dengan Metode Difusi Agar
Tabel 4.3 Hasil uji aktivitas antibakteri ekstrak kulit buah pisang raja terhadap bakteri Propionibacterium acne dan Staphylococcus epidermidis Konsentrasi ekstrak
Aktivitas antibakteri yang terjadi dapat disebabkan karena adanya kandungan senyawa kimia golongan flavonoid dan tanin (Cowan, 1999). Flavonoid dan tanin merupakan senyawa golongan fenol. Senyawa golongan fenol diketahui memiliki aktivitas antimikroba yang bersifat bakterisidal namun tidak bersifat sporisidal (Pratiwi, 2008).
Senyawa golongan fenol dan derivatnya merupakan salah satu antibakteri yang bekerja dengan mengganggu fungsi membran sitoplasma bakteri. Pada konsentrasi rendah dapat merusak membran sitoplasma yang menyebabkan bocornya metabolit penting yang menginaktifkan sistem enzim bakteri, sedangkan pada konsentrasi tinggi mampu merusak membran sitoplasma dan mengendapkan protein sel (Volk dan Wheeler, 1993).
Mekanisme kerja flavonoid adalah dengan membentuk senyawa kompleks terhadap protein ekstraseluler, sehingga terjadi koagulasi protein yang dapat mengganggu ptertumbuhan sel bakteri. Sedangkan mekanisme kerja tanin adalah dengan menciutkan dan mengendapkan protein sel yang dapat mengganggu permeabilitas sel itu sendiri, akibatnya sel tidak dapat melakukan aktivitas hidup dan pertumbuhannya terhambat atau bahkan mati. (Sirait, 2007).
4.6 Hasil Evaluasi Formula
4.6.1 Pemeriksaan stabilitas fisik sediaan
Hasil pemeriksaan stabilitas fisik sediaan gel ekstrak kulit buah pisang raja dapat dilihat pada Tabel 4.4 berikut ini:
Tabel 4.4 Data pengamatan perubahan bentuk, warna, dan bau sediaan gel ekstrak kulit buah pisang raja
Pengamatan Sediaan Lama pengamatan (minggu)
0 1 2 3 4 5 6 7 8 9 10 11 12
FI = Formula mengandung 20% ekstrak kulit buah pisang raja FII = Formula mengandung 30% ekstrak kulit buah pisang raja FIII = Formula mengandung 40% ekstrak kulit buah pisang raja b = Baik/stabil
c = Coklat kehitaman B = Bau khas pisang
Pemeriksaan dilakukan secara visual pada suhu kamar dengan parameter yang diuji meliputi perubahan bentuk, warna dan bau sediaan. Hasil uji stabilitas sediaan gel ekstrak kulit buah pisang raja menunjukkan bahwa seluruh sediaan yang dibuat tetap stabil dalam penyimpanan pada suhu kamar selama 12 minggu. 4.6.2 Pemeriksaan homogenitas sediaan
Tabel 4.5 Data pengamatan homogenitas sediaan gel ekstrak kulit buah pisang raja
Sediaan Lama pengamatan (minggu)
0 1 2 3 4 5 6 7 8 9 10 11 12
FI h h h h h h h h h h h h h
FII h h h h h h h h h h h h h
FIII h h h h h h h h h h h h h
Keterangan:
FI = Formula mengandung 20% ekstrak kulit buah pisang raja FII = Formula mengandung 30% ekstrak kulit buah pisang raja FIII = Formula mengandung 40% ekstrak kulit buah pisang raja h = Homogen
Hasil pemeriksaan homogenitas bahwa seluruh sediaan gel ekstrak kulit buah pisang raja memenuhi persyaratan homogenitas karena menunjukkan susunan yang homogen dan tidak terlihat adanya butir-butir yang kasar pada saat sediaan dioleskan pada kaca transparan. Hasil dapat dilihat pada Lampiran 4, halaman 51.
4.6.3 Penentuan pH sediaan
Hasil penentuan pH sediaan gel ekstrak kulit buah pisang raja dapat dilihat pada tabel 4.6 berikut ini:
Tabel 4.6 Data pengukuran pH sediaan gel ekstrak kulit buah pisang raja
Sediaan Lama pengamatan (minggu)
0 1 2 3 4 5 6 7 8 9 10 11 12
Secara keseluruhan terlihat bahwa pH dari sediaan gel kulit buah pisang raja menurun dengan bertambahnya waktu penyimpanan. Hasil uji stabillitas terhadap pH sediaan gel baik blanko maupun sediaan gel dari ekstrak kulit buah pisang raja menunjukkan pH sediaan tetap stabil pada penyimpanan karena masih berada dalam rentang persyaratan pH kulit yaitu 5,0 - 8,0 (Aulton,1988).
4.6.4 Uji iritasi terhadap kulit sukarelawan
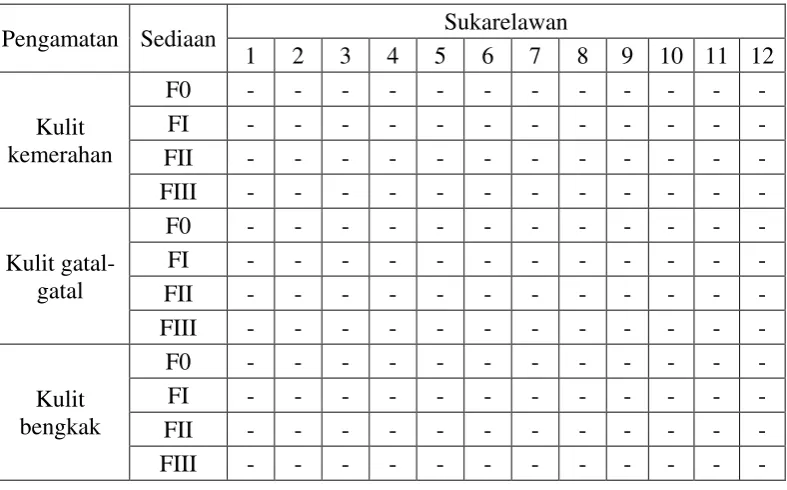
Uji iritasi dilakukan terhadap 12 orang sukarelawan. Reaksi iritasi positif ditandai oleh adanya kemerahan, gatal-gatal, atau bengkak pada kulit lengan bawah bagian dalam yang diberi perlakuan selama tiga hari berturut-turut. Hasil uji iritasi dapat dilihat pada Tabel 4.7 berikut ini.
Tabel 4.7 Data uji iritasi sediaan gel kulit buah pisang raja terhadap sukarelawan
Pengamatan Sediaan Sukarelawan
1 2 3 4 5 6 7 8 9 10 11 12
F0 = Formula tidak mengandung ekstrak kulit buah pisang raja FI = Formula mengandung 20% ekstrak kulit buah pisang raja FII = Formula mengandung 30% ekstrak kulit buah pisang raja FIII = Formula mengandung 40% ekstrak kulit buah pisang raja - = Tidak terjadi reaksi
Berdasarkan uji iritasi pada kulit lengan bawah bagian dalam sukarelawan terhadap sediaan gel ekstrak kulit buah pisang raja selama tiga hari berturut-turut, menunjukkan bahwa sukarelawan memberikan hasil negatif pada setiap parameter reaksi iritasi. Dari hasil uji iritasi tersebut dapat disimpulkan bahwa sediaan gel yang dibuat aman untuk penggunaan topikal (Tranggono dan Latifah, 2007). 4.6.5 Uji mikrobiologi sediaan gel
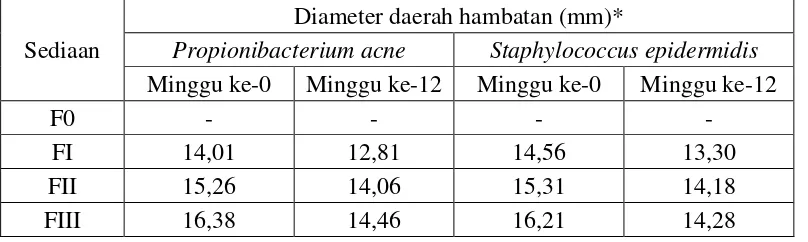
Uji mikrobiologi sediaan gel ekstrak kulit buah pisang raja dilakukan dengan metode difusi agar menggunakan pencadang kertas terhadap bakteri Propionibacterium acne dan Staphylococcus epidermidis. Hasil uji dapat dilihat pada Tabel 4.8 berikut ini.
Tabel 4.8 Hasil uji aktivitas antibakteri sediaan gel ekstrak kulit buah pisang raja terhadap bakteri Propionibacterium acne dan Staphylococcus epidermidis
Sediaan
Diameter daerah hambatan (mm)*
Propionibacterium acne Staphylococcus epidermidis Minggu ke-0 Minggu ke-12 Minggu ke-0 Minggu ke-12
F0 - - - -
FI 14,01 12,81 14,56 13,30
FII 15,26 14,06 15,31 14,18
FIII 16,38 14,46 16,21 14,28
Keterangan:
F0 = Formula tidak mengandung ekstrak kulit buah pisang raja FI = Formula mengandung 20% ekstrak kulit buah pisang raja FII = Formula mengandung 30% ekstrak kulit buah pisang raja FIII = Formula mengandung 40% ekstrak kulit buah pisang raja * = Hasil rata-rata tiga kali pengukuran
- = Tidak ada hambatan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Ekstrak kulit buah pisang raja memiliki kemampuan menghambat pertumbuhan bakteri Propionibacterium acne dan Staphylococcus epidermidis. Hasil uji aktivitas dari ekstrak diperoleh bahwa konsentrasi efektif sebagai antibakteri yaitu 200 mg/ml, 300 mg/ml dan 400 mg/ml dengan diameter daerah hambatan masing-masing terhadap Propionibacterium acne adalah 14,83 mm, 16,03 mm dan 17,7 mm serta terhadap Staphylococcus epidermidis adalah 15,30 mm, 16,10 mm dan 17,26 mm.
b. Ekstrak kulit buah pisang raja dapat diformulasikan dalam bentuk sediaan gel dan sediaan gel yang dibuat relatif stabil dan sediaan gel dengan konsentrasi 30% dan 40% memiliki kemampuan menghambat pertumbuhan bakteri masing-masing terhadap Propionibacterium acne adalah 14,06 mm dan 14,46 mm serta terhadap Staphylococcus epidermidis adalah 14,18 mm dan 14,28 mm.
5.2 Saran