Hukum Pencampuran Persamaan Keadaan Sanches-Lacombe
untuk Memperkirakan Vapor-liquid Equilibria dari Sistim
Solven-Polimer
Gede Wibawa
Laboratorium Thermodinamika Teknik Kimia, Jiurusan Teknik Kimia,Fakultas Teknologi Industri, Institut Teknologi Sepuluh Nopember (ITS
Kampus ITS Sukolilo Surabaya, 60111
Tel: 031-5946240; Fax: 031-5999282; E-mail: [email protected] Abstrak
Dalam penelitian ini dikembangkan hukum pencampuran dari dari Sances-Lacombe equation of state didasarkan model group contribusi dengan memanfaatkan grup-grup parameter yang telah tersedia. Metode ini diadaptasi dari konsep yang dikembangkan oleh Michelsen (Fluid Phase Equilib., 60, 47 (1990)). Keuntungan utama dari metode ini bahwa vapor-liquid equilibria dapat diperkirakan untuk berbagai sistim dengan range tekanan yang luas tanpa tambahan parameter-parameter yang di optimasi dari data eksperimen. Model group kontribusi yang digunakan adalah UNIFAC-FV dan UNIFAC-ZM. Model yang telah dikembangkan ini mempunyai kinerja cukup bagus untuk sistim butane-polystyrene dan isobutane-polyisoprene.
In this work, the mixing rule of Sanches-Lacmobe equation of state was developed based on group contribution models by utilizing the avaibility of group interaction parametrs determined from low molecular weight substances. This concept was adapted from Michelsen’s procedure (Fluid Phase Equilib., 60, 47 (1990) and has the main advantage, that vapor-liquid equilibria (VLE) of polymewr solutions can be predicted for a large number of systems and wide range pressure without introducing a new parameters that must be fitted to experimental data. Group contribution models used were UNIFAC-FV and UNIFAC-ZM. The mixing rule obtained in this work showed a good performance for butane-polyisoprene and isobutane-polyisoprene systems.
1. Pendahuluan
Prediksi kelakuan kesetimbangan fasa untuk larutan polimer dengan model aktifitas koefisien telah banyak digunakan dalam mendisain proses pemisahan seperti devolatilization, pervaporation dan pemilihan membran yang optimum. Untuk maksud tersebut, diskripsi dari vapor-liquid equilibrium (VLE) untuk sistim solven-polimer sangat diperlukan.
Seperti telah banyak didemontrasikan bahwa model prediksi kontribusi grup UNIFAC tidak bisa secara langsung digunakan untuk sistim solven-polimer, karena secara umum hasil prediksinya underestimate terhadap aktifitas solven. Sehingga model aktifitas koefisien yang khusus dapat diaplikasikan untuk sistim solven-polimer telah dikembangkan seperti UNIFAC-FV (Oishi and Prausnitz, 1978, and Wibawa et al. (2002)), Entropic-FV (Elbro et al., 1990) dan UNIFAC-ZM (Zhong et al., 1996). Model-model tersebut telah terbukti cukup akurat untuk memprediksi aktifitas solven. Namun demikian, untuk tekanan kesetimbangan diatas atmosfir model-model tersebut tidak memadai, karena ketergantungan terhadap tekanan tidak bisa direpresentasikan. Akhir-akhir ini, kombinasi equation of state (EoS) dengan model excess Gibbs energy atau model koefisien aktifitas untuk mencari parameter campuran telah banyak diusulkan untuk aplikasi pada tekanan tinggi dengan memanfaaatkan data VLE pada tekanan rendah (Wong et al., 1992 and Michelsen, 1996). Khusus untuk aplikasi sistim solven-polimer, Tochigi (1998) dan Louli and Tassios (2000) mengkombinasikan persaamaan PR EoS dengan GE model.
Karena data-data kritis untuk polimer tidak tersedia, maka parameter-parameter energi (a) dan co-volume (b) untuk masing-masing polimer di fitting dari data experiment PVTnya. Khusus untuk aplikasi pada polymer solution, EoS yang dikembangkan dari lattice fluid model seperti Sanches-Lacombe equation of state (SL-EoS) (Sanches and Lacombe (1978) mempunyai kelebihan karena bisa digunakan untuk mempresentasikan kelarutan polimer dalam senyawa hydrocarbon. Namun demikian penerapan model ini untuk campuran membutuhkan parameter campuran yang di fitting dari data eksperimen campuran. Sehingga tujuan dari penelitian ini adalah untuk mengembangkan mixing rule dari SL-EoS berdasarkan model excess Gibbs energy. Dengan memamfaatkan ketersediaan parameter interaksi dari model excess Gibbs energy, kita bisa prediksi VLE pada tekanan tinggi.
2. Pengembangan Model Thermodinamika
Berdasarkan latice fluid theory, Sanches dan Lacombe (1978) mengembangkan persamaan keadaan yang dikenal dengan SL-EoS:
(
)
T r T P ~ ~ ~ 1 1 ~ 1 ln ~ ~ ρ2 ρ ρ ⎟ − ⎠ ⎞ ⎜ ⎝ ⎛ − − − − = (1)Variable-variabel reduce didifinisikan dalam term parameter karakteristik: * ~ T T T = ; ~ * P P P= ; ~ * ρ ρ ρ = (2) R T * *=ε ; * * * v P =ε (3)
dimana T*, P* dan ρ* adalah karakteristik temperature, tekanan dan densitas. ε* adalah energi interaksi, dan v*adalah karakteristik volume dari lattice site. Untuk campuran, parameter-parameter karakteristiknya dievaluasi berdasarkan hukum pencampuran berikut:
=
∑∑
i j ij j i P P* φφ * (4) *(
)( )
0.5 1 ij i j ij k PP P = − (5)∑
= * 0 * * * i i iT P P T φ (6)∑
= 0 * * i iv v φ (7)(
)
∑
= * * 1ρ ωi ρi (8)(
)
∑
= 0 0 1r φi ri (9) =(
) (
∑
)
j j j j i i i i P T P T * * * * 0 φ φ φ (10)(
) (
∑
)
= j j j i i i * * ω ρ ρ ω φ (11)Persamaan (4) – (9) adalah mixing rule konvensional dari SL-EoS, dimana terlihat bahwa dibutuhkan parameter interaksi kij yang harus difitting dari data eksperimen. Dalam beberapa kasus diasumsikan tidak ada interaksi
antara solven dan polimer (kij=0) namun asumsi ini akan memberikan deviasi yang cukup signifikan.
Berikut adalah penurunan hukum pencampuran dengan menggabungkan SL-EoS dengan excess energi Gibbs pada tekanan nol sesuai dengan prosedur yang dikembangkan oleh Michelsen (1996). Dari persamaan SL-EoS, energi Gibbs untuk komponen murni diperoleh:
(
) ( )
⎭ ⎬ ⎫ ⎩ ⎨ ⎧ + − − + + − = i i i i i i i i i i i i i r T P T kT N r G ρ ρ ρ ρ ρ ρ ~ ln 1 ~ 1 ln ~ ~ 1 ~ ~ ~ ~ ~ (12)dan energi Gibbs untuk campuran adalah:
( ) ( ) ⎭ ⎬ ⎫ ⎩ ⎨ ⎧ + + − − + + − =
∑
i i i i i r r T P T rNkT G ω φ φ ρ ρ ρ ρ ρ ρ ln ~ ln 1 ~ 1 ln ~ ~ 1 ~ ~ ~ ~ ~ (13)Sehingga, excess energi Gibbs bisa diperoleh: i i i E x NkTx G G G = −
∑
− ln∑
∑
∑
⎭ ⎬ ⎫ ⎩ ⎨ ⎧ − + − = i i i i i i i i i i i i x x r r NkT kTQ N r rNkTQ ln ln ω φ φ (14) Pada P~=0 E E G G = 0 (15)(
) ( )
ρ ρ ρ ρ ρ ln1 ~ 1ln~ ~ ~ 1 ~ ~ r T Q=− + − − + (16)(
) ( )
i i i i i i i i r T Q ρ ρ ρ ρ ρ ln1 ~ 1ln~ ~ ~ 1 ~ ~ + − − + − = (17)Karena ρ~=g
( )
T~,r , Q= f( )
T~,r , sehingga pers. (16) dan (17) bisa disederhanakan dengan pendekatan berikut: Tr
i i
i r T
Q =−0.0049ln −3.2507+2.45238~ (19)
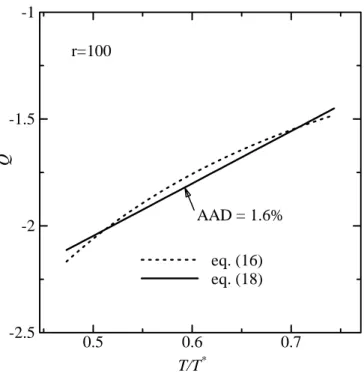
Ilustrasi plot dari pendekatan pers (16) dan (17) menjadi persamaan (18) dan (19) ditampilkan pada Fig. 1, dimana bentuk linear dipilih agar persamaannya menjadi lebih sederhana. Akurasi dari pendekatan persamaan tersebut kurang dari 3 % average absolute deviation (AAD). Untuk tekanan nol, excess energi Gibbs bisa diperoleh dari koefisien aktifitas dengan persamaan berikut:
∑
= i i E x NkT G0 lnγ (20)dimana
γ
i dapat dihitung dengan model-model aktifitas koefisien seperti FV, Entropic-FV, UNIFAC-ZM.Selanjutnya, karakteristik energi interaksi ampuran, ε* bisa diperoleh dari persamaan berikut:
⎪⎩ ⎪ ⎨ ⎧ − + = =
∑
∑
j j j j j j j j j E r Q N r rN rNkT G Tk T ω φ φ ε ln 1 4524 . 2 1 0 *∑
+
+
−
j j jx
r
x
r
ln
0
.
0049
ln
3
.
2507
1
(21)dimana r dan v* dihitung dengan hukum pencampuran konvensional.
Fig. 1 Plot ilustrasi linearisasi dari pers. (16)
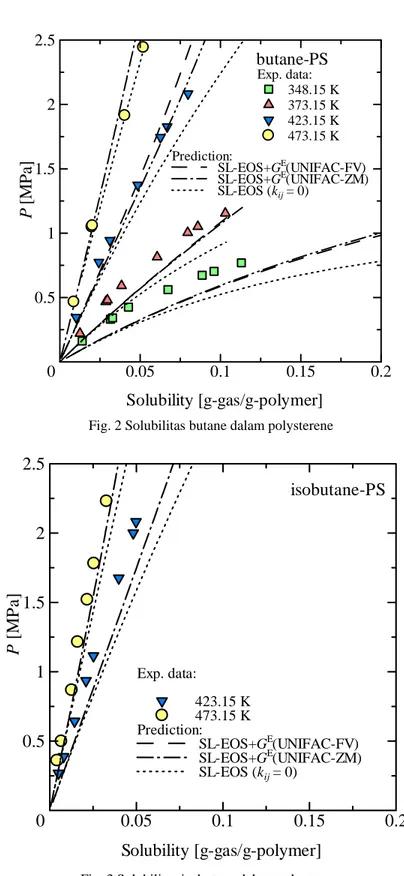
Dengan hukum pencampuran yang diperoleh dari matching persamaan SL-EoS dengan model excess energi Gibbs dengan hasil seperti ditunjukkan dengan pers. (21) kemudian digunakan untuk memprediksi VLE sistim butane-polystyrene (PS) dan isobutane-PS dimana hasil prediksi dibandingkan dengan data eksperimen yang dipublikasi oleh Sato et al. (2004) seperti ditunjukkan pada Figs. 2 dan 3. Hasil tersebut juga dibandingkan dengan hasil prediksi menggunakan hukum pencampuran konvensional pers. (4)-(11) dengan menetapkan interaksi energinya kij sama dengan nol. Dari gambar-gambar yang ditampilkan terlihat bahwa peningkatan
akurasi dari hukum pencampuran ini cukup signifikan. Dalam menghitung excess energi Gibbs menggunakan persamaan UNIFAC-FV, perhitungan free-volumnya membutuhkan input molar volume solven dan polimer ini yang membuat penggunaan persamaan menyulitkan terutama untuk molar volume solven diatas suhu kritisnya. Disamping itu, metode prediksi volume molar solven yang sederhana diatas suhu kritisnya tidak tersedia atau tidak akurat. Untuk itu penggunaan model UNIFAC-ZM lebih mudah karena model tersebut tidak membutuhkan input molar volume baik solven maupun polimer. Dengan alasan tersebut diatas maka pada suhu 423.15 K keatas, excess energi Gibbs dihitung dengan model UNIFAC-ZM. Karena terbatasnya data eksperimen yang tersedia
Q
T/T
*eq. (16)
eq. (18)
r=100
AAD = 1.6%
0.5
0.6
0.7
-2.5
-2
-1.5
-1
model ini baru bisa diuji untuk 2 sistem. Untuk lebih lanjut, lebih banyak sistim dengan range lebih luas perlu digunakan untuk menguji validitas dari model pencampuran yang diusulkan.
Fig. 2 Solubilitas butane dalam polysterene
Fig. 3 Solubilitas isobutane dalam polysterene 3. Kesimpulan
P
[MP
a]
Solubility [g-gas/g-polymer]
Exp. data: 348.15 K 373.15 K 423.15 K 473.15 Kbutane-PS
Prediction: SL-EOS+GE(UNIFAC-FV) SL-EOS+GE(UNIFAC-ZM) SL-EOS (kij = 0)0
0.05
0.1
0.15
0.2
0.5
1
1.5
2
2.5
P
[M
P
a
]
Solubility [g-gas/g-polymer]
Exp. data: 423.15 K 473.15 K Prediction: SL-EOS+GE(UNIFAC-FV) SL-EOS+GE(UNIFAC-ZM) SL-EOS (kij = 0)isobutane-PS
0
0.05
0.1
0.15
0.2
0.5
1
1.5
2
2.5
Hukum pencampuran yang diturunkan dari matching SL-EoS dengan excess energi Gibbs pada tekanan sama dengan nol telah diperoleh pada penelitian ini. Model pencampuran ini dimaksudkan untuk aplikasi VLE sistim solven-polimer pada tekanan tinggi dengan memanfaatkan parameter-parameter grup dari model kontribusi grup yang tersedia untuk tekanan rendah. Karena tersedianya data eksperimen yang masih terbatas, validasi dari model ini hanya diuji untuk sistin butane-PS dan isobutane-PS dimana menunjukkan kinerja yang cukup baik. Sehingga model ini perlu dipertimbangkan karena tidak dibutuhkannya parameter tambahan yang harus dioptimasi dari data eksperimen VLE sistim solven-polimer.
Notasi G Gibbs energy [J] k Gas constant kij Interaction parameter N Number of moles P Pressure [Mpa]
r Number of site occupied by molecules T Temperature [K] v Specific volume [m3/kg] w Mass fraction x Mole fraction Segment fraction Density [kg/m3] Energy parameter Superscripts E Excess * Characteristic parameter Subscripts i,j Component 1,2 Solvent, polymer 0 Property at zero pressure
Daftar Pustaka .
Elbro, H. S., Aa. Fredenslund and P. Rasmussen, (1990), A new simple equation for the prediction of solvent activities in polymer solutions”, Macromolecules, 23, 4707-4714.
Louli, V. and D. Tassios, (2000), “Vapor-liquid equilibrium in polymer-solven systems with a cubic equation of state“., Fluid Phase Equilib., 168, 165-182.
Michelsen, M. L., (1996), “Matching equation of state mixing rules to activity coefficient model expressions”, Fluid Phase Equilib., 121, 15-26.
Oishi, T. and J. M. Prausnitz, (1978), “Estimation of solvent activities in polymer solutions using a group contribution method”, Ind. Eng. Chem. Process Des. Dev., 17, 333-339.
Sanches, I. C. and R. H. Lacombe, (1978), “Stastitical thermodynamics of polymer solutions”, Macromolecules, 11, 1145-1156.
Sato Y, W. Ming , S. Takishima, H. Masuoka, T. Watanabe and Y. Fukasawa, (2004), “Solubility of butane and isobutane in molten polypropylene and polystyrene, Polym. Eng. Sci., 44, 2083-2089.
Tochigi, K., (1998), “Prediction of vapor-liquid equilibria in nonpolymer and polymer solutions using an ASOG-based equation of state (PRASOG)”, Fluid Phase Equilib., 144, 59-68.
Wibawa, G., S. Takishima, Y. Sato, H. Masuoka, (2002), “Revision of UNIFAC group interaction parameters of group contribution models to improve prediction results of vapor-liquid equilibria for solvent-polymer systems”, Fluid Phase Equilib., 202, 367-383.
Wong, D. S. H., H. Orbey and S. I. Sandler, (1992), “Equation of state mixing rule for nonideal mixture using available activity coefficient model that allows extrapolation over large range of temperature and pressure”, Ind. Eng. Chem. Res., 31, 2033-2039.
Zhong, C., Y. Sato, H. Masuoka and X. Chen, (1996), “ Improvement of predictive accuracy of the UNIFAC model for vapor-liquid equilibria of polymer solutions”, Fluid Phase Equilib., 123, 97-106.