1 BAB I PENDAHULUAN
A. Latar Belakang
Senyawa flavanoid merupakan senyawa fenol yang paling banyak ditemukan di alam dan jenisnya sangat beragam. Senyawa ini termasuk dalam metabolit sekunder, dan dikenal memiliki aktivitas biologis yang menarik, antara lain sebagai antioksidan, antimakanan serangga (Yogesh S. Nalwar,2009:123), antiinflamasi, antibakteri, anti jamur, dan anti kanker (NY Sreedhar,2010:480).
Kalkon (1,3-difenilpropen-1-on) merupakan senyawa yang termasuk dalam famili flavonoid dan banyak di teliti sebagai therapeutic, khususnya sebagai obat antitumor. Bahkan disebutkan oleh karena aktivitasnya sebagai ”high therapeutic index”, kalkon di anggap sebagai ”the new era of medicines ” dalam kapasitasnya sebagai antitumor, antibakterial, dan anti-inflamatory (Afzal S., et al., 2008).
Penyebaran senyawa kalkon di alam sangat terbatas dan hanya ditemukan pada beberapa golongan tumbuhan dalam jumlah yang sedikit. Hal ini disebabkan kalkon memiliki peranan yang penting dalam pembuatan turunan flavonoid karena berfungsi sebagai zat antara. Kalkon biasanya langsung berubah menjadi flavanon maupun turunan flavonoid yang lain. Oleh karena aktivitas biologi dan potensi senyawa ini sangat bermanfaat bagi pengembangan obat, maka perlu adanya upaya pengembangan sintesis senyawa kalkon dan derivatnya. Penelitian sintesis senyawa kalkon pada awalnya dipelopori oleh Perkin dan Robinson (Diedrich, 1962:1054-1062). Perkembangan selanjutnya membuktikan bahwa senyawa kalkon merupakan isomer dari senyawa flavanon, dan isomeri dapat dilakukan dengan cara menambahkan asam atau basa (Mabry, 1975 : 561). Suasana asam atau basa berpengaruh terhadap terhadap kecepatan reaksi dan rendemen senyawa hasil sintesis. Beberapa senyawa sebagai bahan dasar sintesis senyawa kalkon menyebabkan reaksi sukar terjadi jika dilakukan dalam suasana basa, tetapi reaksinya mudah berlangsung jika dalam suasana asam (Sykes, 1989 : 196).
2
Indyah Sulistyo Arty, dkk. (2000), berhasil mensintesis beberapa senyawa mono para-hidroksi kalkon yang mengandung substituen hidroksil, metoksi, tersier butil, fluoro dan kloro. Sintesis tersebut dilakukan dalam suasana asam atau menggunakan katalis asam. Berdasarkan uji aktivitas penghambatan lipid peroksidasi non enzimatis, dan aktivitas penghambatan siklooksigenase, senyawa-senyawa hasil sintesis tersebut menunjukkan sangat poten sebagai antioksidan (Indyah Sulistyo Arty, 2007). Penelitian lebih lanjut berkaitan dengan potensinya sebagai antikanker menunjukkan bahwa senyawa dengan substituen hidroksil dan fluoro ini bersifat sitotoksik pada sel HeLa, sel Raji dan sel T47D, dan efek sitotoksis tertinggi pada sel HeLa (Indyah Sulistyo Arty, 2010 dan Retno Arianingrum, dkk., 2011). Pada sel T47D, senyawa mono para hidroksi kalkon dengan substituen hidroksil bersifat antiproliferasi dengan menekan viabilitas sel dan mempengaruhi siklus sel (Retno Arianingrum, dkk, 2012). Sejauh ini sintesis senyawa derivat kalkon dengan substituent bromo belum dilakukan. Eksplorasi senyawa derivat kalkon melalui sintesis ini diharapkan dapat memperoleh senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on yang berpotensi sebagai antioksidan dan antikanker.
B. Batasan dan Rumusan Masalah
Penelitian ini dibatasi untuk mensintesis derivat kalkon dengan substituen bromo, yaitu senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on dan menguji potensinya sebagai antioksidan dan antikanker.
Dengan demikian rumusan masalah dalam penelitian ini adalah :
1. Bagaimana karakteristik senyawa mono para hidroksi kalkon bersubstituen bromo hasil sintesis dari bahan dasar 4-bromoasetofenon dan vanilin dengan katalis asam analisis serapan sinar UV-Vis, IR dan 1H-NMR ?
2. Bagaimana aktivitas senyawa mono para hidroksi kalkon bersubstituen bromo hasil sintesis sebagai antioksidan ?
3. Bagaimana aktivitas senyawa mono para hidroksi kalkon bersubstituen bromo hasil sintesis sebagai antikanker pada cancer cell lines sel HeLa
3 C. Tujuan Penelitian
Secara garis besar penelitian ini bertujuan untuk mengeksplorasi senyawa derivat kalkon yang berpotensi sebagai antioksidan dan antikanker melalui reaksi aldol silang dalam suasana asam. Sedangkan tujuan khususnya meliputi :
1. Mensintesis senyawa mono para hidroksi kalkon bersubstituen bromo dengan bahan dasar 4-bromoasetofenon dan vanilin dengan katalis asam, dan menentukan karakteristiknya dengan serapan sinar UV-Vis, IR dan 1H-NMR. 2. Mengkaji aktivitas senyawa mono para hidroksi kalkon bersubstituen bromo
hasil sintesis sebagai antioksidan
3. Mengkaji aktivitas senyawa aktivitas senyawa mono para hidroksi kalkon bersubstituen bromo hasil sintesis sebagai antikanker pada cancer cell lines sel HeLa
D. Rencana/Disain Pelaksanaan Penelitian
Ruang lingkup penelitian yang akan dilakukan meliputi sintesis senyawa mono para hidroksi kalkon dengan substituen bromo dengan cara kondensasi aldol silang, dilanjutkan dengan melakukan uji aktivitas antioksidan dengan menggunakan DPPH (1,1-difenil-2-pikrilhidrazil) dan uji aktivitas sitotoksik terhadap sel HeLa dengan metode MTT.
Kegiatan penelitian ini direncanakan akan selesai dalam waktu 6 (enam) bulan, dengan kegiatan penelitian meliputi : (1) sintesis senyawa mono para bersubstituen bromo dari 4-bromoasetofenon dan vanilin melalui reaksi kondensasi aldol silang dalam suasana asam; (2) uji aktivitas antioksidan senyawa hasil sintesis dengan menggunakan DPPH dengan metode Chow dan (3) uji aktivitas sitotoksis senyawa hasil sintesis dengan metode MTT, sebagaimana jadwal pada Tabel 1.
E. Hasil/Sasaran yang Direncanakan
Hasil yang diharapkan dari penelitian ini adalah diperoleh :
1. senyawa mono para hidroksi kalkon dengan substituen bromo, yaitu 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on
4
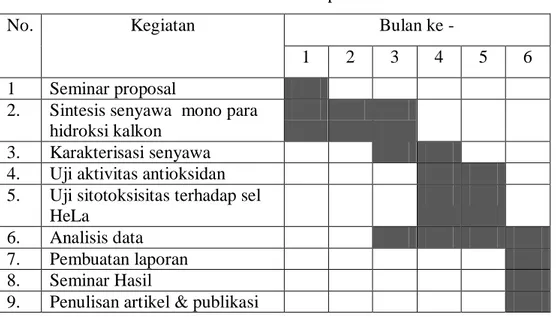
Tabel 1. Jadwal penelitian
No. Kegiatan Bulan ke -
1 2 3 4 5 6
1 Seminar proposal
2. Sintesis senyawa mono para hidroksi kalkon
3. Karakterisasi senyawa 4. Uji aktivitas antioksidan 5. Uji sitotoksisitas terhadap sel
HeLa
6. Analisis data 7. Pembuatan laporan 8. Seminar Hasil
9. Penulisan artikel & publikasi
2. informasi tentang aktivitas antioksidan dan sifat toksisitas terhadap cancer cell lines HeLa dari senyawa hasil sintesis.
3. manuskrip untuk dipublikasikan pada seminar nasional/internasional atau jurnal terakreditasi nasional atau jurnal internasional.
Selanjutnya, senyawa hasil sintesis diharapkan dapat digunakan sebagai lead compoud (model) pada industri farmasi dan dapat dikembangkan sebagai obat antikanker baru yang poten dan aman. Target hasil/luaran yang diharapkan disajikan pada gambar 1.
Gambar 1. Bagan tahapan penelitian dan hasil yang ditargetkan
Tahapan Hasil/Luaran
Sintesis senyawa mono para hidroksi kalkon bersubstituen Bromo
Karakterisasi senyawa
Uji antioksidan
Uji sitotoksisitas terhadap sel HeLa
Pembuatan laporan
Penulisan artikel & publikasi
Senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on Data tentang titik leleh, kemurnian, data
spektra UV-Vis, IR dan 1H-NMR Data aktivitas antioksidan Data sitotoksik
Laporan, seminar
5 BAB II
KAJIAN PUSTAKA
A. Reaksi Kondensasi Aldol
Kondensasi aldol merupakan reaksi organik antara dua molekul aldehida atau satu molekul aldehida dengan satu molekul keton menghasilkan senyawa aldol. Reaksi aldol dapat berjalan melalui dua mekanisme yaitu mekanisme enol yang menggunakan katalis asam kuat dan mekanisme enolat yang menggunakan katalis basa kuat (Wade, L.G,2006:1041-1063).
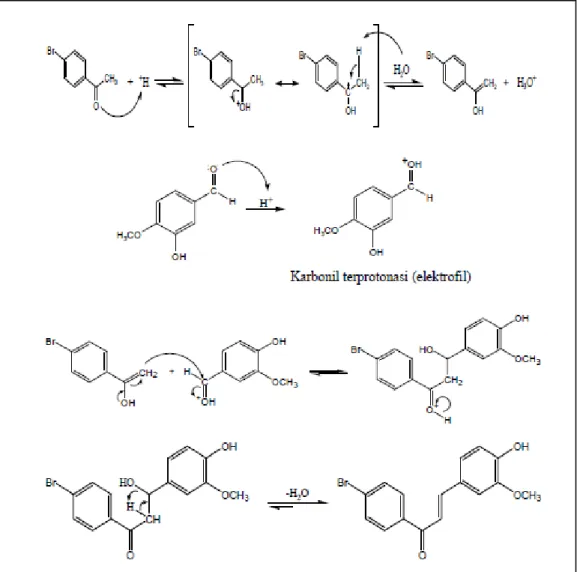
Reaksi kondensasi aldol silang yang melibatkan penggunaan senyawa aldehida aromatis dan senyawa alkil keton atau aril keton sebagai reaktannya menghasilkan senyawa α,β-keton tak jenuh dikenal sebagai reaksi Claisen-Schmidt. Reaksi ini melibatkan ion enolat dari senyawa keton yang bertindak sebagai nukleofil untuk menyerang karbon karbonil senyawa aldehida aromatis menghasilkan senyawa -hidroksi keton, yang selanjutnya mengalami dehidrasi menghasilkan senyawa ,-keton tak jenuh (Bruice, 2007). Pada reaksi kondensasi antara 4-bromoasetofenon dan vanilin dengan katalis asam, senyawa 4-bromoasetofenon akan mengalami tautomerasi dari bentuk keto menjadi bentuk enol yang bersifat nukleofilik pada karbon-α. Katalis asam juga menyebabkan karbonil pada vanilin akan terprotonasi dan bersifat elektrofilik. Enol dari 4-bromoasetofenon yang bersifat nukleofil akan menyerang vanilin yang terprotonasi membentuk senyawa aldol yang selanjutnya mengalami dehidrasi menghasilkan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on. Mekanisme reaksinya ditunjukkan seperti pada gambar 2.
B. Potensi Senyawa Derivat Kalkon Sebagai Antioksidan dan Antikanker Kalkon merupakan senyawa keton aromatik yang menjadi pusat inti dari berbagai senyawa biologi penting. Senyawa ini mengandung dua cincin aromatik dengan rantai tak jenuh, dan menunjukkan aktivitas menarik sebagai antioksidan, antibakteri, antijamur, kemopreventif, antivirus, antiprotozoal, sifat insektisida,
6
antikanker, dan anti-inflamasi (Isa, et al, 2012; Kiat, et.al., 2006; Dimmock JR, et.al; 1999, dan Nerya, 2004).
Gambar 2. Mekanisme Reaksi Claisen-Schmidt antara 4-bromoasetofenon dan Vanilin dengan Katalis Asam
Berdasarkan studi penelusuran literatur menunjukkan bahwa senyawa kalkon banyak di teliti sebagai therapeutic, khususnya sebagai obat antitumor (Afzal S., et al., 2008). Disebutkan pula bahwa sebagian besar target utama dari senyawa-senyawa kalkon adalah mempengaruhi siklus sel (cell cycle) (Boumendjel, A., Ronox X., and Boutonnat, J., 2009).
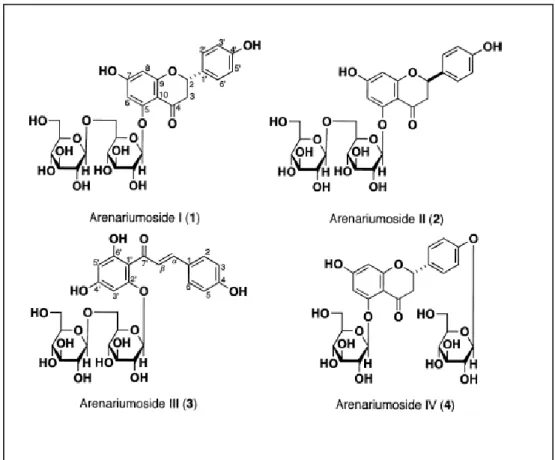
Upaya-upaya untuk melakukan eksplorasi senyawa kalkon sebagai antikanker telah dilakukan, baik dengan isolasi senyawa dari bahan alam maupun sintesis. Diantaranya empat senyawa flavon dan kalkon glikosida baru berhasil
7
diisolasi dari ekstrak metanol bunga Helichrysum arenarium, keempat senyawa tersebut memiliki aktivitas menghambat tumor necrosis faktor- (TNF- )-induced citotoxixity pada sel L929 (Gambar 3). TNF- sangat berperan dalam pengaturan mekanisme apoptosis (Toshio M, et. Al., 2009).
Gambar 3. Senyawa-senyawa Flavon dan Kalkon Glikosida dari Helichrysum arenarium, yang memiliki Aktivitas menghambat TNF- pada Sel L929.
Beberapa senyawa kalkon hasil sintesis diantaranya : Trans-4-lodo,4-boranyl-chalcone memiliki aktivitas antitumor terhadap malignant glioma cell lines secara in vitro dan in vivo (Sasayama, T., et al., 2007); senyawa 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone bersifat antitumor terhadap enam cancer cell lines secara invitro (Ye, C.L., et al., 2004); senyawa 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone memiliki aktivitas antitumor terhadap ”solid human carcinoma xenograft model”. secara invivo (Ye, C.L., et al., 2005). Tidak kalah menariknya adalah senyawa 2-hydroxy-4-methoxychalcone yang memiliki aktivitas anti-angiogenic dan antitumor (Lee, Y.S, et. Al., 2006).
8
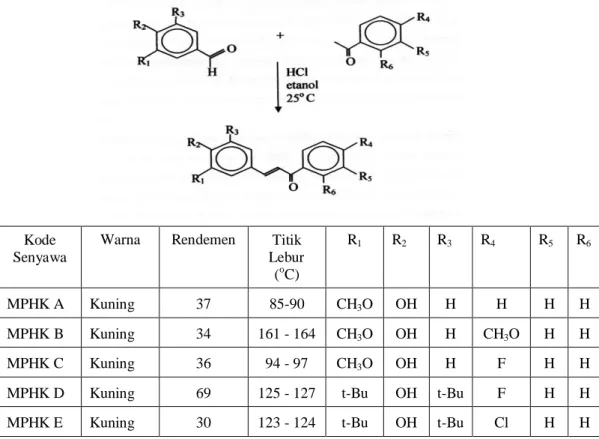
Indyah Sulistyo Arty, dkk. (2000), berhasil mensintesis beberapa senyawa mono para-hidroksi kalkon yaitu : (a) 3-(4’-hidroksi-3’-metoksifenil)-1-fenil-2-propen-1-on atau MPHK A ; (b) 3-(4’-hidroksi-3’-metoksifenil)-1-(4”-metoksifenil)-2-propen-1-on atau MPHK B; (c) 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on atau MPHK C; (d) 3-(3’, 5’-ditersierbutil-4’-hidroksifenil)-1-(4”-fluorofenil)-2-propen-1-on atau MPHK D, dan (e) 3-(3’,5’-ditersierbutil-4’-hidroksifenil)-1-(4”-kloro-fenil)-2-propen-1-on atau MPHK E (gambar 4). Berdasarkan uji aktivitas penghambatan lipid peroksidasi non enzimatis, dan aktivitas penghambatan siklooksigenase, senyawa-senyawa ini menunjukkan sangat poten sebagai antioksidan. Pada beberapa senyawa golongan terpenoid, adanya aktivitas antiinflamasi, antimutagenik dan antioksidan yang dimiliki dapat memacu apoptosis dan menekan karsinogenesis yang di picu oleh bahan kimia (Xu et al., 2007).
Kode Senyawa
Warna Rendemen Titik Lebur (oC) R1 R2 R3 R4 R5 R6 MPHK A Kuning 37 85-90 CH3O OH H H H H MPHK B Kuning 34 161 - 164 CH3O OH H CH3O H H MPHK C Kuning 36 94 - 97 CH3O OH H F H H
MPHK D Kuning 69 125 - 127 t-Bu OH t-Bu F H H MPHK E Kuning 30 123 - 124 t-Bu OH t-Bu Cl H H
Gambar 4. Senyawa-senyawa Mono Para-Hidroksi Kalkon Hasil Sintesis dari Derivat Benzaldehida dan Asetofenon atau Derivatnya melalui Reaksi Kondensasi Aldol Silang dalam Suasana Asam (Indyah Sulistyo Arty. dkk., 2000).
9
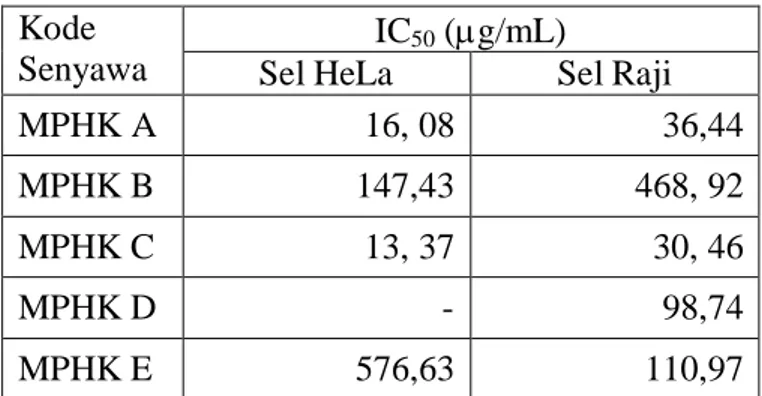
Hasil uji sitotoksisitas dari senyawa tersebut terhadap sel HeLa dan sel Raji menunjukkan bahwa senyawa MPHK A dan MPHK C memiliki aktivitas sitotoksik dalam menghambat pertumbuhan sel HeLa dan sel Raji (Tabel 2) (Indyah Sulistyo Arty, 2009). Penelitian lebih lanjut terhadap senyawa MPHK A menunjukkan bahwa senyawa ini bersifat sitotoksik pada sel kanker payudara T47D, serta tidak bersifat sitotoksik terhadap sel normal Vero (Retno Arianingrum, dkk.,2010). Pada sel T47D, senyawa MPHK A bersifat antiproliferasi dengan menekan viabilitas sel, dan mempengaruhi daur sel (Retno Arianingrum, dkk, 2012).
Tabel 2. Nilai IC50 Senyawa –senyawa MPHK terhadap sel HeLa dan Sel Raji Kode
Senyawa
IC50 (g/mL)
Sel HeLa Sel Raji
MPHK A 16, 08 36,44
MPHK B 147,43 468, 92
MPHK C 13, 37 30, 46
MPHK D - 98,74
10 BAB III
METODE PENELITIAN
.
A. Alat dan Bahan
Penelitian di awali dengan mempersiapkan alat dan bahan yang digunakan pada setiap tahap penelitian, yang meliputi sintesis dan pemurnian senyawa, uji aktivitas antioksidan, dan uji aktivitas antikanker.
1. Sintesis dan Pemurnian Senyawa
Alat yang digunakan : spektrofotometer UV 2400PC, spektrofotometer Infra Merah (Shimadzu FTIR Prestige 21), spektrofotometer 1H-NMR (1H-NMR, Jeol JNM-MY 500), plat KLT silica Gel 60 GF254 (Merck), varian Cary 100 Conc untuk mengukur spektrum ultraviolet (UV), seperangkat alat refluk, peralatan gelas untuk sintesis
Bahan yang digunakan: 4-bromoasetofenon, vanilin, NaOH, etanol, akuades, n-Heksana, etilasetat, H2SO4 pekat, kristal NaCl, CaCl2 anhidrat, dan gas nitrogen.
2. Uji Aktivitas Antioksidan
Alat yang digunakan adalah spektrofotometer UV-Vis, flakon, mikropipet, vorteks, timbangan elektrik, eppendorft, dan tip.
Bahan yang digunakan meliputi 1,1-difenil-2-pikrilhidrazil (DPPH), metanol, asam aspartat, dan BHT .
3. Uji Aktivitas Antikanker
Alat yang digunakan : tangki nitrogen cair, mikroskop fase kontras, penangas air, sentrifuge, inkubator CO2 , incubator, ELISA (Enzyme Linked Immunosorbent Assay) reader, hemocytometer (New Bauer), tabung conical steril, scraper, tissue culture flask, ampul, plate, laminar airflow, pH meter, mikroplate 96 sumuran, mikropipet, vorteks, timbangan elektrik, eppendorft, pipet, dan tip.
11
Bahan yang digunakan : Cell line cancer Sel HeLa, Medium Rosewell Park Memorial Institut (RPMI) 1640 (GIBCO BRL), medium penumbuh mengandung growth factor 10% dan 20% FBS (Fetal Bovine Serum) (Sigma Chem. CO. St. Louis. USA), DMSO (Dimetil Sulfoksida), natrium karbonat (E.Merck), kertas saring 0,2 m, akuades, fungizon dan antibiotik penisilin dan streptromisin (Sigma Chem. CO. St. Louis. USA), hepes dan tripsin (Sigma Chem. CO. St. Louis. USA). PBS (Phospat Buffer Saline), MTT (3-(4,5-dimetil tiazol-2-yl)-2,5-difenil tetrazolium bromida), dan SDS (Sodium duodecyl sulphate)10% dalam HCl 0,01 N.
B. Prosedur Penelitian
1. Sintesis dan Pemurnian Senyawa
Alat refluk yang terdiri dari labu leher tiga, erlenmeyer dilengkapi dengan magnetic stirrer dirangkai dan dihubungkan dengan gas nitrogen. Kristal NaCl di masukkan ke dalam erlenmeyer dengan ketebalan 1 cm. Senyawa 4-bromoasetofenon 0,012 mol (2,40 g) dan vanilin 0,01 mol (1,52 g) di masukkan dalam labu leher tiga kemudian diaduk. Selanjutkan kran gas nitrogen dibuka dan dialirkan ke dalam campuran. Sebanyak 15 ml larutan H2SO4 pekat ditetes-teteskan pada kristal NaCl agar terbentuk gas HCl. Campuran diaduk dalam labu leher tiga selama 7,5 jam dengan dialiri gas HCl dan gas nitrogen. Sisa gas HCl yang keluar ditangkap dengan kristal CaCl2 anhidrat. Hasil pengadukan didiamkan semalam, kemudian dituangkan ke dalam erlenmeyer yang berisi akuades dingin sambil diaduk dengan magneticstirrer hingga terbentuk endapan. Endapan dicuci dengan akuades hingga pH netral dan disaring dengan penyaring Buchner lalu dikeringkan. Kristal yang terbentuk direkristalisasi dengan pelarut etanol-akuades dengan perbandingan 1:1. Larutan selanjutnya disaring filtratnya dan didinginkan sampai terbentuk kristal kembali. Endapan hasil rekristalisasi disaring dan dicuci dengan akuades. Endapan tersebut kemudian dikeringkan, lalu ditimbang dengan menggunakan timbangan analitik. Titik leburnya ditentukan dengan menggunakan melting point apparatus. Uji kemurnian dilakukan dengan menggunakan KLT dan KLT Scanner menggunakan eluen campuran dua pelarut
12
organik yang sesuai. Struktur senyawa hasil sintesis diidentifikasi dengan menggunakan spektrofotometer UV-Vis, IR dan 1H-NMR.
2. Uji Aktivitas Antioksidan
Uji aktivitas antioksidan secara kuantitatif dilakukan menggunakan DPPH menurut metode Chow. Sampel dilarutkan dalam metanol dan dibuat dengan beberapa variasi konsentrasi, yaitu 1,25; 2,5; 5; 10; dan 20 g/mL. Ke dalam masing-masing larutan ditambahkan 0,1 mL DPPH 1 mM dan diinkubasi pada suhu 37°C selama 30 menit, selanjutnya diukur pada panjang gelombang 515 nm. Sebagai blanko digunakan metanol dan DPPH 1mM. Untuk pembanding digunakan BHT (konsentrasi 1,25; 2,5; 5; 10; dan 20 g/mL ) dan asam aspartat 3,125; 6,25; 12,5; 25 dan 50 g/mL. Persentase hambatan (%I) dihitung berdasarkan {(serapan blanko-serapan sampel)/serapan blanko} x 100%. Nilai hambatan dan konsentrasi sampel diplot masing-masing pada sumbu x dan y, dan persamaan garis yang diperoleh digunakan untuk menghitung Inhibition Concentration 50% (IC50).
3. Uji Sitotoksisitas
Uji sitotoksisitas sebagai antikanker dalam penelitian ini menggunakan cell lines HeLa yang dikembangkan di laboratorium Parasit Kedokteran UGM. Uji sitotoksisitas terhadap cell lines dilakukan dengan tahapan sebagai berikut : a. Menumbuhkan cell lines dari penyimpanan dalam nitrogen cair
Sel beku dari nitrogen cair dibiarkan pada suhu kamar sampai mencair sebagian, kemudian dimasukkan dalam tabung konikal 15 ml, dan ditambah 10 ml media pencuci lalu dikocok. Setelah itu disentrifus 750 g selama 7 menit. Pelet diambil ditambahkan dengan media kultur, kemudian sel dimasukkan dalam flask. Semua kegiatan tersebut dilakukan secara aseptis dalam laminar laminar airflow. Sel kemudian diinkubasi pada suhu 37oC dengan aliran CO2 5%. Perkembangan sel diamati tiap hari dan jika media mulai menguning diganti dengan media baru.
Jika sel sudah tumbuh memenuhi flask, media pada sel HeLa dicuci dengan PBS secukupnya. Selanjutnya sel dilepas dari dinding flask (scapper) menggunakan 0,5 ml tripsin 0,05%. Flask dikocok perlahan sampai sel terlepas
13
semua. Suspensi sel diinkubasi 2-5 menit di inkubator CO2 pada 37oC. Selanjutnya suspensi sel tersebut dimasukkan dalam tabung conical 15 ml dan ditambahkan dengan media kultur sebanyak 5 ml. Jumlah sel dihitung dengan hemocytometer, disuspensikan dalam media kultur sampai diperoleh kepadatan sel 1 x 104 sebanyak 100 L pada setiap sumuran. Selanjutnya diinkubasi selama 12 – 24 jam pada suhu 37o
C di inkubator CO2.
b. Uji sitotoksisitas dengan MTT assay
Setelah sel konfluen, media kultur di dalam sumuran dibuang, dan sel dicuci menggunakan 100 l PBS. Setelah PBS dibuang, setiap sumuran dimasukkan 100 μl sampel yang dilarutkan dalam media kultur yang mengandung DMSO 0,05% dengan berbagai konsentrasi menggunakan 3 kali ulangan. Sumuran yang tersisa digunakan untuk kontrol positif yang berisi sel tanpa penambahan sampel, dan kontrol negatif hanya mengandung media kultur. Sebagai pembanding digunakan doksorubisin yang dikenal sebagai obat leukimia akut, limfoma, dan sejumlah timor akut. Selanjutnya diinkubasi 12- 24 jam pada suhu 37oC di inkubator CO2. Media sel dibuang dan dicuci dengan PBS 1x, dan kemudian masing-masing sumuran ditambahkan 100 l media kultur yang mengandung MTT (0,5 mg/ml). Kultur diinkubasi 4 jam pada suhu 37oC di inkubator CO2. Selanjutnya ditambahkan 100 l pelarut formazan (SDS 10%), di gojog pelahan dengan shaker selama 5 menit, dan diinkubasi 12-24 jam pada suhu kamar dalam ruang gelap. Prosentase kematian dihitung berdasarkan hasil perbandingan sel kontrol yang diukur serapan menggunakan ELISA reader pada panjang gelombang 595 nm.
Selanjutnya dengan dari prosentase sel hidup dapat dihitung nilai sitotoksisitasnya sebagai Inhibition concentration (IC50). Nilai IC50 menunjukkan nilai konsentrasi yang menghasilkan kematian sel 50% hal ini menunjukkan potensi ketoksikan suatu senyawa terhadap masing-masing sel. Nilai IC50 ditentukan dengan analisis probit yang diperoleh dari konversi prosentase
% Sel Hidup = (Absorbansi perlakuan-Absorbansi kontrol media) X 100% (Absorbansi kontrol sel-Absorbansi kontrol media)
14
kematian ke dalam nilai probit, sedangkan nilai konsentrasi diubah ke dalam nilai Log konsentrasi. Nilai IC50 merupakan nilai antilog pada nilai probit 50. Dengan demikian dapat dikaji aktivitas sitotoksisitas dari senyawa bioaktif berdasarkan prosentase kematian dan IC50
15 BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis dan Pemurnian Senyawa
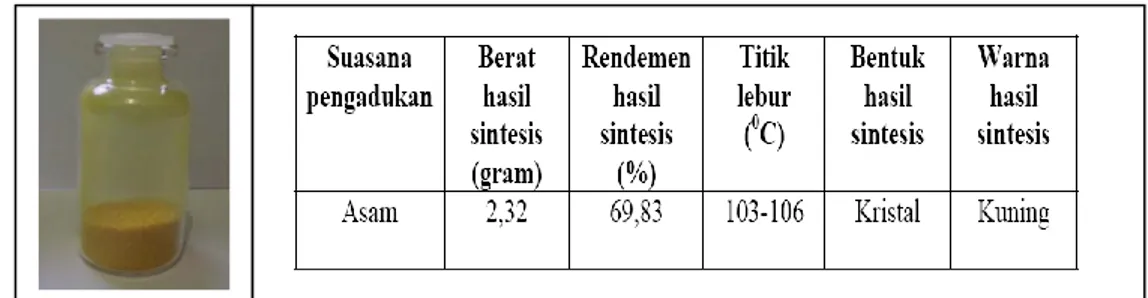
Hasil sintesis antara senyawa 4-bromoasetofenon dan vanillin diperoleh senyawa berbentuk kristal berwarna kuning dengan berat sebesar 2,32 g dengan rendemen hasil 69,83%. Senyawa ini mempunyai titik lebur 103-106oC (gambar 5 ).
Gambar 5. Data Senyawa Hasil Sintesis antara Senyawa 4-bromoasetofenon dan Vanilin
Kromatogram kromatogrfi lapis tipis (KLT) hasil identifikasi senyawa hasil sintesis antara senyawa 4-bromoasetofenon dan vanilin menggunakan pelarut n-heksana dan etil asetat 7:3 ; kloroform dan n-heksana 5:1 ; serta kloroform dan etil asetat 8:2 menunjukkan satu bercak noda hasil dengan harga Rf (Retardation factor) yang berbeda dengan bahan dasar senyawa tersebut. Hal ini menunjukkan bahwa senyawa hasil sintesis merupakan senyawa baru yang berbeda dengan senyawa asal.
Pada penelitian ini penggunaan beberapa eluen dimaksudkan untuk memperoleh pemisahan yang baik. Penggunaan eluen n-heksana dan etilasetat dengan perbandingan 7:3 menghasilkan bercak noda yang tunggal dan tidak berekor dengan harga Rf mak sebesar 0,79. Pada penggunaan eluen kloroform dan n-heksana dengan perbandingan 5:1 menghasilkan bercak noda yang tunggal dan berekor dengan harga Rf max sebesar 0,47; dan penggunaan eluen kloroform dan etilasetat dengan perbandingan 8:2 menghasilkan bercak noda yang tunggal dan berekor dengan harga Rf max sebesar 0,82. Pemisahan yang baik untuk
16
menentukan kemurnian senyawa adalah bila dihasilkan bercak noda yang tunggal, tidak berekor, dan mempunyai harga Rf berkisar antara 0,2-0,8. Oleh karena itu untuk menentukan prosentase kemurnian digunakan eluen n-heksana dan etilasetat dengan perbandingan 7:3.
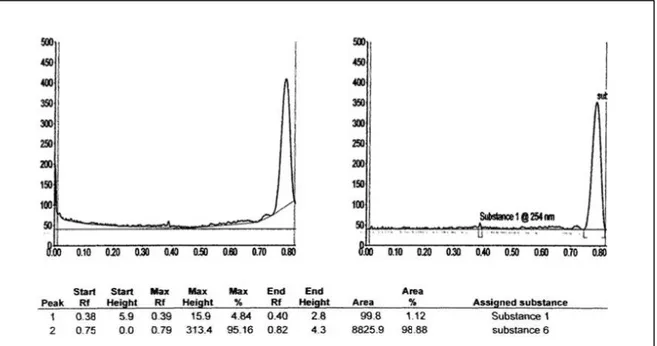
Hasil KLT Scanner pada kromatogram menggunakan eluen campuran n-heksana dan etilasetat dengan perbandingan 7:3 (gambar 6) menunjukkan bahwa senyawa hasil sintesis mempunyai kemurnian yang cukup tinggi, yaitu sebesar 98,88%.
Gambar 6. Kromatogram Hasil KLT Scanner pada kromatogram
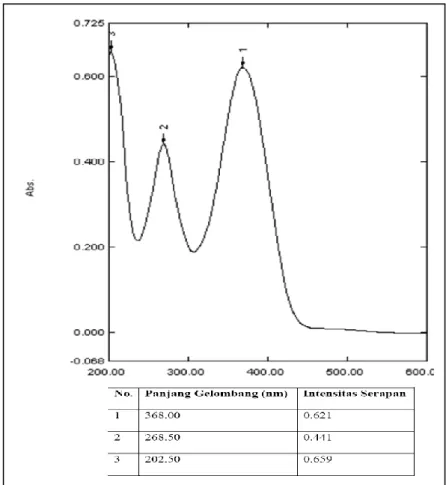
Data spektrum UV senyawa hasil sintesis menunjukkan adanya serapan pada panjang gelombang 202,5 nm, 268,5 nm, dan 368 (Gambar 7). Pada umumnya senyawa kalkon memiliki rentangan serapan spektrum UV pada pita I (unit sinamoil) di daerah 340-390 nm dan pita II (unit benzoil) di daerah 230-270 nm. Dengan demikian serapan yang muncul pada spektrum hasil sintesis berada pada rentang serapan senyawa kalkon yaitu serapan dengan panjang gelombang 368 nm berada pada rentang serapan yang berasal dari pita I, dan serapan dengan panjang gelombang 268,5 nm berasal dari serapan pita II senyawa kalkon.
17
Gambar 7. Spektra UV Senyawa Hasil Sintesis
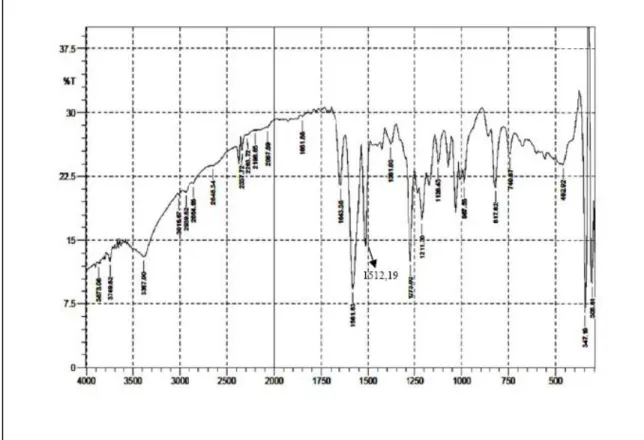
Spektrum IR senyawa hasil sintesis (Gambar 8, Tabel 3, dan Lampiran) menunjukkan adanya serapan dengan intensitas sedang pada daerah 1643,35 cm-1 dari gugus karbonil (C=O) keton. Frekuensi serapan karbonil keton normal muncul pada 1715 cm-1 dengan intensitas kuat dan tajam. Perbedaan frekuensi serapan ini terjadi karena terikatnya ikatan rangkap yang terkonjugasi dengan gugus karbonil. Serapan pada daerah 1512,19 cm-1 dengan intensitas sedang menunjukkan adanya C=C aromatik. Serapan dengan intensitas kuat pada daerah 1581,63 cm-1 menunjukkan adanya C=C vinil, yang diperkuat dengan munculnya serapan C-H vinil/aromatik pada 3016,67 cm-1. Serapan yang melebar pada 3387,00 cm-1 merupakan serapan serapan dari gugus –OH fenol, dan serapan sedang pada daerah 1273,02 cm-1 menunjukkan adanya gugus C-O fenol.
18
Gambar 8. Spektra IR Senyawa Hasil Sintesis
19
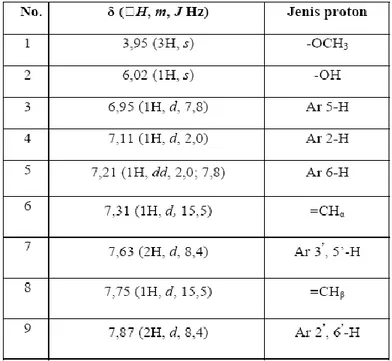
Spektrum 1H-NMR senyawa hasil sintesis (Gambar 9, Tabel 4 dan Lampiran) muncul sinyal pada daerah 3,95 (3H, s) ppm merupakan sinyal proton pada -OCH3, sinyal pada daerah 6,02 (1H, s) ppm menunjukkan proton pada – OH. Sinyal pada daerah 7,31 (1H, d, 15,5 Hz) ppm dan 7,75 (1H, d, 15,5 Hz) ppm merupakan sinyal dari proton pada C=C vinil pada posisi trans, yang ditunjukkan dengan besarnya tetapan penggabungan J. sinyal pada daerah 6,95 (1H, d, 7,8 Hz) ppm, 7,11 (1H, d, 2,0 Hz) ppm, dan 7,21 (1H, dd, 2,0;7,8 Hz) ppm merupakan sinyal proton dari cincin aromatik pita I pada posisi 5, 2, dan 6. Proton pada cincin aromatik muncul sebanyak tiga sinyal dikarenakan adanya substitusi gugus lain pada posisi 3 dan 4, sehingga terjadi perubahan lingkungan elektronik. Proton pada posisi 6 selain berinteraksi dengan proton pada posisi 5, juga berinteraksi dengan proton pada posisi 2 sehingga muncul sebagai double doublet. Sinyal pada daerah 7,63 (2H, d, 8,4 Hz) ppm merupakan sinyal proton dari cincin aromatik pita II pada posisi 3’ dan 5’. Sedangkan sinyal pada daerah 7,87 (2H, d, 8,4 Hz) merupakan sinyal proton dari cincin aromatik pita II pada posisi 2’ dan 6’. Substitusi gugus lain pada posisi 4’ menyebabkan proton pada posisi 3’ dan 5’ muncul sebagai satu sinyal karena memiliki lingkungan elektronik yang sama, demikian juga yang terjadi pada proton posisi 2’ dan 6’
20
21
Hasil analisis 13C dan HMBC disajikan pada Tabel 5. Berdasarkan hasil analisis dapat diperkirakan struktur senyawa hasil sintesis sebagaimana pada gambar 10, yaitu merupakan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on.
Gambar 10. Struktur Senyawa Hasil Sintesis
Tabel 5. Hasil Analisis Senyawa Hasil Sintesis Berdasarkan data NMR : 13C, 1H, dan HMBC No karbon δC δH (jumlah H, m, J Hz) HMBC (H→C) 1 189,6 - 2 119,2 7,31 (1H,d, 15,5) C1; C1’; C4 3 145,9 7,74 (1H,d, 15,5) C1; C4 4 127,4 - 5 123,7 7,21 (1H,dd,2,0; 7,8) C9; C3; C7 6 115,1 6,95 (1H, d, 7,8) C4; C8 7 148,7 OH - 6,02 - C6; C7 8 147,0 56,2 (OCH3) - 3,95 (3H,s) 9 110,2 7,11 (1H,d,2,0) C6; C5; C7; C3; 1’ 127,8 - 2’; 6’ 130,1 7,89 (2H, d, 8,4) C1; C1’ 3’; 5’ 131,9 7,63 (2H,d, 8,4) C1’; C4’ 4’ 137,3 - - O Br OH OCH3 H H H H H H H H H 189,6 119,2 145,9 7,31 7,74 127,8 123,7 7,21 7,11 110,2 147 56,2 3,95 148,7 6,02 115,1 6,95 127,4 130,1 7,89 7,63 131,9 137,3 131,9 7,63 7,89 130,1 1 2 3 4 5 6 7 1' 2' 4'
22 B. Uji Antioksidan
Pada penelitian ini uji aktivitas antioksidan dilakukan dengan metode DPPH menurut Chow et,al (2003). Kelebihan metode ini adalah memiliki sensitifitas yang tinggi dan membutuhkan jumlah sampel yang sedikit. Pengukuran aktivitas antioksidan sampel dilakukan pada panjang gelombang 515 nm yang merupakan panjang gelombang maksimum DPPH. Adanya aktivitas antioksidan dari sampel mengakibatkan terjadinya perubahan warna pada larutan DPPH dalam metanol yang semula berwarna ungu pekat menjadi kuning pucat. Metode DPPH didasarkan pada kemampuan antioksidan untuk menghambat radikal bebas dengan mendonorkan atom hidrogen. Prinsipnya adalah reaksi penangkapan hidrogen oleh DPPH dari senyawa antioksidan yang mengubahnya menjadi 1,1-difenil-2-pikrilhidrazin yang berwarna kuning (Gambar 11). Metode ini menggunakan kontrol positif sebagai pembanding untuk mengetahui aktivitas antioksidan sampel. Kontrol positif ini dapat berupa tokoferol, BHT, dan vitamin C atau asam aspartat. Pada penelitian ini sebagai kontrol positif digunakan BHT dan asam aspartat. Tingkat kekuatan antioksidan dengan metode DPPH dikategorikan dalam beberapa tingkatan, yaitu sangat kuat, kuat, sedang, dan lemah (Tabel 6)(Armala, 2009).
23
Tabel 6. Tingkat Kekuatan Antioksidan dengan Metode DPPH
Intensitas Nilai IC50
Sangat kuat < 50 µg/mL
Kuat 50-100 µg/mL
Sedang 101-150 µg/mL
Lemah > 150 µg/mL
Pada penelitian ini diperoleh nilai IC50 dari BHT sebesar 6,29 μg/mL, dan asam aspartat sebesar 2,43 μg/mL, sedangkan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on memiliki nilai IC50 sebesar 10,14 μg/mL (Tabel 7 & Lampiran). BHT dan asam aspartat sebagai kontrol positif memiliki nilai IC50 yang lebih rendah dibanding senyawa hasil sintesis, namun senyawa ini merupakan antioksidan yang sangat kuat, karena nilai IC50 kurang dari 50 μg/mL. Bila ditinjau dari struktur senyawanya, aktivitas antioksidan ini kemungkinan besar berasal dari adanya kontribusi gugus hidroksil dan bromide yang bersifat elektronegatif.
Tabel 7. Hasil Uji Antioksidan dari Senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on terhadap DPPH dengan Kontrol Positif BHT dan Asam Aspartat
No Sampel IC50 (μg/mL) 1 BHT 6,29 2 Asam Aspartat 2,43 3 Senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on 10,14 C. Uji Sitotoksisitas
Berdasarkan perhitungan hasil uji sitotoksik menggunakan spss (Tabel 8 dan Lampiran) menunjukkan bahwa senyawa hasil sintesis, yaitu 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on berpotensi sebagai antikanker, karena memiliki IC50 sebesar 9,6050 g/mL dan termasuk dalam kategori sangat aktif. Semakin besar konsentrasi senyawa yang ditambahkan, semakin menurun viabilitas sel HeLa.
24
Tabel 8. Data Absorbansi Hasil Uji Sitotoksik Senyawa Hasil Sintesis Terhadap Sel HeLa
C Absorbansi Kontrol Blangko Viabilitas sel Rerata SD
(g/ml) 1 2 3 1 2 3 12 0.240 0.254 0.265 0.100 0.619 26.53 29.20 31.30 29.01 2.391215 10 0.399 0.397 0.380 0.101 0.599 56.87 56.49 53.24 55.53 1.992425 8 0.427 0.463 0.438 0.103 0.656 62.21 69.08 64.31 65.20 3.520635 6 0.429 0.447 0.443 0.101 0.625 62.60 66.03 65.27 64.63 1.803746 4 0.582 0.559 0.608 91.79 87.40 96.76 91.98 4.678493 2 0.608 0.585 0.586 96.76 92.37 92.56 93.89 2.480916
Gambar 12. Kurva Viabilitas Sel HeLa dengan Perlakuan Senyawa Hasil Sintesis
1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on.
Pengamatan kematian sel dapat dilihat dari morfologi sel akibat perlakuan senyawa. Sel yang mati akan kehilangan cairan sitoplasma karena rusaknya membran sel, sehingga pada pengamatan mikroskop akan menunjukkan warna hitam (gelap). Sebaliknya, pada sel hidup akan terlihat warna terang, karena adanya cairan sitoplasma yang bersifat meneruskan cahaya dari mikroskop. Pengamatan morfologi sel HeLa akibat pemberian senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on disajikan pada Gambar 11. Nampak dari morfologinya, sel mengalami kematian dengan adanya perlakuan penambahan senyawa hasil sintesis. Semakin banyak konsentrasi yang ditambahkan, semakin banyak jumlah sel yang mengalami kematian.
25
Gambar 13. Morfologi Sel HeLa: (A) tanpa perlakuan, dan dengan penambahan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on: (B) 4 g/ml, (C) 6 g/ml, (D) 8 g/ml, (E) 10 g/ml, dan (F) 12 g/ml F E D S C B A
26 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Reaksi antara 4-bromoasetofenon dan vanilin melalui kodensasi aldol silang dengan katalis asam menghasilkan senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on yang berbentuk kristal berwarna kuning dengan rendemen 69,83% , titik lebur 103-106oC.
2. Senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on meru-pakan antioksidan yang sangat kuat dengan IC50 sebesar 10,14 g/mL
3. Senyawa 1-(4’-bromofenil)-3-(4-hidroksi-3-metoksifenil)-2-propen-1-on memi-liki sifat sitotoksik yang sangat kuat terhadap cancer cell lines sel HeLa dengan IC50 sebesar 9,6 g/mL sehingga berpotensi sebagai antikanker .
B. Saran
Perlu di lakukan lebih lanjut bagaimana mekanisme antikanker dari senyawa senyawa mono para hidroksi kalkon bersubstituen bromo apakah dengan mempengaruhi siklus sel atau dengan memacu apoptosis.
27
DAFTAR PUSTAKA
Afzal S., Asad M. K, Rumana Q. F, Ansari, Muhammad F. N, and Syed S. S. 2008. Redox Behavior of Anticancer Chalcone on a Glassy Carbon Electrode and Evaluation of its Interaction Parameters with DNA, Int. J. Mol. Sci. 2008, 9, 1424-1434
Armala, M. M. 2009. Daya Antioksidan Fraksi Air Ekstrak Herba Kenikir (Cosmos caudatus H. B. K.) dan Profil KLT, Skripsi, 39, Fakultas Farmasi Universitas Islam Indonesia, Yogyakarta.
Bruice, P.Y., 2007, Organic Chemistry, Fifth edition, New York
Boumendjel A, Ronot X, Boutonnat. 2009 . Chalcone derivatives acting as cell cycle blockers : potensial anticancer drugs ? J Curr Drug Targets. Apr;10(4):363-71. Chow ST, WW Chaw and YC Chung. 2003. Antioxidant Activity and Safety of
50 % Ethanolic Red Bean Extract (Phaseolus raditus L, Var Aurea). Journal of Food Science. 2003; 68(1):21 – 5.
Diedrich, D. F. 1962. Some New Synthetic Flavanoid Glycosides Related in Structure to Phlorizin. J. Med. Pharm. Chem, 1054-1062
Dimmock JR, Elias DW, Beazely MA, Kandepu NM. 1999. Bioactivities of chalcones. Curr Med Chem ; 6: 1125-1149.
Indyah Sulistyo Arty, Henk T, Samhudi, Sastrohamidjojo, and Henk an der Goot., 2000., Synthesis of benzylideneacetophenones and their inhibition of lipidperoxidation., Eur. J., Med. Chem. 35, 449-457
Indyah Sulistyo Arty, A., 2007, Cyclooxygenase inhibitory activity of benzilideneacetofenone analogue. Recent Development in Curcumin Pharmacochemistry, Procedding of International Symposium on Recent Progress in Curcumin Research, 11-12 September.
Indyah Sulistyo Arty, Synthesize and Citotoxicity Test of Several Compounds of mono para hidroxy chalcone, 2010, Indo. J. Chem., 10 (1), 110-115
Isa NM, Abdelwahab SI, Mohan S, Abdul AB, Sukari MA, Taha MM, Syam S, Narrima P, Cheah SC, Ahmad S, Mustafa MR.2012. In vitro anti-inflammatory, cytotoxic and antioxidant activities of boesenbergin A, a chalcone isolated from Boesenbergia rotunda (L.) (fingerroot), Braz J Med Biol Res.
Kiat TS, Pippen R, Yusof R, Ibrahim H, Khalid N, Rahman NA. 2006. Inhibitory activity of cyclohexenyl chalcone derivatives and flavonoids of fingerroot, Boesenbergia rotunda (L.), towards dengue-2 virus NS3 protease. Bioorg Med Chem Lett ; 16: 3337-3340.
Lee, Y.S.; Lim, S.S.; Shin, K.H.; Kim, Y.S.; Ohuchi, K.; Jung, S.H. 2006. Anti-angiogenic and antitumoractivities of 2-hydroxy-4- methoxychalcone. Biol. Pharm. Bull. 29, 1028-1031.
28
Mabry, T. J, K. R. Markham dan M. B. Thomas. 1975. The Systematic Identification of Flavanoid. New York: Springer-Verlag New York Inc Nerya O, Musa R, Khatib S, Tamir S, Vaya J. 2004. Chalcones as potent
tyrosinase inhibitors: the effect of hydroxyl positions and numbers. Phytochemistry; 65: 1389-1395
NY Sreedhar. 2010. Synthesis and Characterization of 4-Hydroxy Chalcones Using PEG-400 as a Recyclable Solvent. Research Journal of Pharmaceutical, Biological and Chemical Sciences, 1 (4), 480-48
Retno Arianingrum, Indyah Sulityo Arty, dan Sri Atun, 2011, Uji Sitotoksisitas Senyawa Mono Para Hidroksi Kalkon terhadap Cancer cell lines T47D, Saintek Jurnal, UNY
Retno Arianingrum, Indyah Sulityo Arty, dan Sri Atun, 2012, Mono para hydroxy chalcone inhibits the growth of breast cancer cell lines T47D and influences its cell cycle arrest , International Conference on Biomedical Science 27-28 Februari 2012, School of Life Sciences and Technology , Institut Teknologi Bandung
Sasayama, T.; Tanaka, K.; Mizukawa, K.; Kawamura, A.; Kondoh, T.; Hosoda, K.; Kohmura, E. 2007. Trans-4-lodo,4-boranyl-chalcone induces antitumor activity against malignant glioma cell lines in vitro and in vivo. J. Neu-Onc. 85, 123-132
Sykes, Peter., 1989, Penuntun Mekasisme Reaksi Kimia Organik, Edisi Keenam, Jakarta : Gramedia.
Toshio M. Li-Bo W. ,Seikou N. , Kiyofumi N., Eri Y., Hisashi M., Osamu .M., Li-Jun W., and Masayuki Y., 2009., Medicinal Flowers. XXVII.1) New Flavanone and Chalcone Glycosides, Arenariumosides I, II, III, and IV, and Tumor Necrosis Factor-a Inhibitors from Everlasting, Flowers of Helichrysum arenarium, Chem. Pharm. Bull. 57(4) 361—367 (2009) Wade, L. G. 1999. Organic Chemistry, Fourth Edition. USA: Prentice Hall
International, Inc
Xu, Z-X., Liang, J., Gaikwad, A., Connoly, F.P., Milss, G.B., and Guttermann, J.U., 2007, A plant Triterpenoid, avicin D, Induces Autophagy by Activation of AMP-activated Protein Kinase, Cell Death and Differentitaion, 14:1948-1957.
Ye, C.L.; Liu, J.W.; Wei, D.Z.; Lu, Y.H.; Qian, F. 2004. In vitro anti-tumor activity of 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone against six established human cancer cell lines. Pharmacol. Res. 2004, 50, 505-510 Ye, C.L.; Liu, J.W.; Wei, D.Z.; Lu, Y.H.; Qian, F. 2005. In vivo antitumor activity
by 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone in a solid human carcinoma xenograft model. Canc. Chemo.Pharm., 55, 447-452.
Yogesh S, Nalwar. 2009. Synthesis and Insect Antifeedant Activity of Some New Chalcones Against Phenacoccus solanopsis. World Journal of Chemistry, 4 (2): 123-126
29