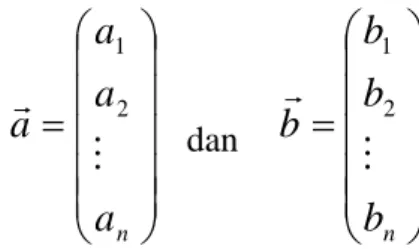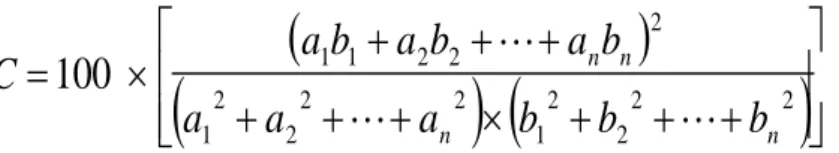1 1.1. Latar Belakang
Permasalahan penyalahgunaan dan peredaran gelap narkoba di Indonesia menunjukkan adanya kecenderungan yang terus meningkat. Sebelumnya Indonesia hanya dijadikan tempat transit kemudian berkembang menjadi tempat pemasaran, produksi dan eksportir gelap narkoba. Kencendrungan tersebut terlihat dari peningkatan angka kejahatan narkotika yang ditangani oleh Polri dan BNN. Masalah ini merupakan ancaman yang serius bukan saja terhadap kelangsungan hidup dan masa depan pelakunya tetapi juga sangat membahayakan bagi kehidupan masyarakat, bangsa dan negara. Dengan semakin meluasnya perdagangan dan peredaran gelap narkoba di Indonesia maka upaya pemberantasan harus terus dilakukan dan di perlukan suatu teknik dan metode yang tepat untuk mengusut dan menutup akses dan jalur peredarannya.
Upaya pencegahan dan pemberantasan penyalahgunaan dan peredaran gelap narkotika dalam rangka mencapai Indonesia Bebas Narkoba 2015 telah dituangkan dalam Instruksi Presiden No. 12 Tahun 2011 tanggal 27 Juni 2011 tentang Pelaksanaan Kebijakan dan Strategi Nasional Pencegahan dan Pemberantasan Penyalahgunaan dan Peredaran Gelap Narkoba (Jakstranas P4GN). Upaya pencapaian target ini tidak bisa hanya dilakukan oleh penegak hukum tetapi harus didukung oleh semua lapisan masyarakat. Salah satu langkah yang dapat dilakukan dalam mengungkap dan memutus jaringan perdagangan dan peredaran gelap narkoba baik secara nasional maupun internasional yaitu dengan mengidentifikasi sumber dan jalur peredarannya.
Polri dan BNN dalam upaya pencegahan dan pemberantasan penyalahgunaan dan peredaran gelap narkotika selain dengan informasi inteligen juga dapat didukung dari informasi data hasil analisis karakterisasi fisika dan kimia yaitu “drugs profiling”. Analisis “drugs profiling” merupakan salah satu pengembangan analisis untuk memanfaatkan IPTEK dalam melaksanakan penyelidikan dan penyidikan secara ilmiah Scientific Crime Investigation (SCI). Data hasil analisis “drugs profilings” dapat digunakan untuk mengidentifikasi dan merekontruksi jalur peredarannya (Sharma 2005, Cheng 2003). Berdasarkan hasil identifikasi jalur peredarannya dapat mempermudah untuk mengidentifikasi Negara asal, Laboratorium tempat sintesis, sumber “supply” atau distribusi dari sampel tersebut, baik di tingkat regional, nasional, maupun internasional (Esseiva 2006). Data hasil analisis karakterisasi fisika dan kimia “drugs profiling” yang dilakukan dan dilaporkan secara kontinu sangat dibutuhkan oleh pihak penegak hukum khususnya penyidik untuk mendukung langkah penyelidikan yang lebih maju dalam menangani dan menghentikan tindakan kejahatan narkoba (Wirasuta 2012).
Data hasil analisis “drugs profiling” narkoba didapatkan dari analisis karakterisasi fisik, kandungan bahan aktif dan komponen tambahan lainnya (adultrants) seperti kafein dan ketamin. Keakuratan data hasil analisis sangat dipengaruhi pada pemilihan metode analisis yang digunakan. Untuk mendapatkan data analisis yang akurat dan kontinu dari setiap barang bukti narkoba maka diperlukan suatu metode dengan validitas yang tinggi, cepat, sederhana, mudah dilakukan, biaya yang tidak terlalu mahal dan harus memperhatikan keberadaan peralatan atau instrumentasi di setiap laboratorium pemeriksa narkoba.
Secara internasional “drugs profiling” dilakukan dengan metode identifikasi kandungan kimia dengan GC-MS, tetapi tidak semua negara dapat melakukannya
secara kontinu karena masih terbentur SDM, biaya dan anggaran Negara. Indonesia sebagai Negara berkembang tentunya tidak harus menunggu waktu untuk dapat melakukan hal ini, tetapi harus mengusahakan metode yang tepat untuk bisa mendapatkan data analisis yang memiliki nilai keakuratan yang sama dengan GC-MS. Maka dari itu perlu dilakukan kajian yang lebih mendalam mengenai metode yang ada untuk dikembangkan dan dibuktikan, bahwa suatu metode memiliki tingkat kemampuan yang sama atau hampir sama dengan biaya yang murah dan dapat dikerjakan oleh semua laboratorium pemeriksa NAPZA yang tersebar di seluruh Indonesia.
Metode Kromatografi Lapis Tipis (KLT) merupakan salah satu metode yang cukup sederhana dan dapat dilakukan dengan biaya yang tidak terlalu tinggi. Dalam perkembangan instrumentasi, Camag telah mengembangkan metode KLT ini dengan menyediakan peralatan penotolan sampel secara otomatis dan alat scanner yang dikenal dengan nama Spektrofotodensitometer. Instrumentasi spektrofoto-densitometer ini dilengkapi dengan pembacaan UV-VIS insitu serta didukung data pustaka, sehingga sangat memungkinkan untuk melakukan analisis kandungan kimia narkoba secara cepat dan efisien. Adanya perkembangan materi, metode dan peralatan sehingga KLT ini berkembang menjadi kromatografi lapis tipis kenerja tinggi yang dinamakan dengan HPTLC (High Performance Thin Layer Chromatography). HPTLC memiliki lebih banyak partikel yang ukurannya jauh lebih kecil (2-7 μm), lebih tipis dan jarak elusi yang lebih pendek sehingga pemisahannya lebih cepat, lebih reprodusibel, lebih sensitif dan memiliki keakuratan yang lebih tinggi untuk analisa kuantitatif. Metode analisis karakterisasi kandungan kimia “drugs profiling” tablet ekstasi dengan menggunakan metode analisis HPTLC- Spektrofotodensitometri telah dilaporkan oleh Wirasuta tahun 2012,
dimana dari 54 sampel tablet ekstasi telah berhasil di identifikasi kandungan kimia dan dapat dikelompokkan menjadi empat kluster dengan menggunakan metode fungsi kosinus sehingga dapat mempermudah mengetahui kesamaan sidik jari kimia untuk menghubungan keterkaitan antar sampel dalam merunut jalur peredaran ekstasi guna penegakan hukum (Wirasuta, 2012).
Koefisien korelasi fungsi kosinus dapat digunakan untuk mengevaluasi hubungan satu sampel dengan sampel yang lain (Esseiva, et al., 2003). Fungsi kosinus dihitung berdasarkan besaran data area under curve (AUC) dari masing-masing puncak kromatogram (Wirasuta, 2012). Harga Rf dapat dipengaruhi oleh banyak faktor, seperti tingkat kejenuhan chamber, kelembaban udara ruangan, perbedaan kombinasi fase gerak, jumlah sampel yang diaplikasikan pada plat dan jarak elusi. Hal ini dapat mengakibatkan perubahan harga Rf pada pengembangan berulang dari satu senyawa. Perbedaan ini akan berpengaruh pada harga koefisien korelasi kosinus, yang berakibat pada kesalahan untuk menyatakan hubungan satu sampel dengan sampel yang lain. Pemisahan komponen analit dipengaruhi oleh kombinasi fase gerak seperti tingkat kepolaran dan pH, hal ini akan berakibat pada besarnya luas puncak serapan/AUC (Zeeuw, et al., 1992).
Metilendioksi metamfetamina (MDMA) atau ”Ekstasi” merupakan narkotika yang sering disalahgunakan. Berdasarkan data dari Direktur Tindak Pidana Narkotika Mabes Polri tercatat tahun 2012 tablet ekstasi yang masuk ke Indonesia mengalami peningkatan sebesar 263 % dari tahun sebelumnya. Tahun 2011 ekstasi yang berhasil diamankan sebanyak 780.885 butir sedangkan tahun 2012 melonjak sampai 2.835.324 butir. Peningkatan jumlah hasil sitaan tablet ekstasi ini hampir keseluruhan merupakan hasil sitaan barang bukti yang diselundupkan dari luar negeri. Hal ini menunjukkan Indonesia telah dianggap sebagai target peredaran
Narkoba tipe ATS (Amphetamine Type Stimulan) seperti Ekstasi. Hal ini membuktikan sindikat narkoba tak rela melepas pasar Indonesia. Fenomena lonjakan peredaran narkoba tahun ini menjadi tantangan bagi segenap masyarakat bangsa dan negara untuk mengusut sekaligus menutup akses sindikat narkoba ke Indonesia (Republika, 2012, Aktual, 2013).
Analisis “drugs profiling” tablet ekstasi dalam mendukung tugas kepolisian dan BNN dalam upaya memutus jaringan dan peredaran gelap narkoba khususnya ekstasi memerlukan suatu metode analisis dengan validitas tinggi, akan tetapi keakuratan data hasil analisis dengan metode HPTLC sangat dipengaruhi oleh faktor pengerjaan, peralatan pendukung dan instrumentasi analisis. Berdasarkan hal tersebut pada penelitian ini dilakukan uji perbandingan kesesuaian hasil analisis karakterisasi kandungan kimia “drugs profiling” tablet ekstasi antara menggunakan metode identifikasi dengan HPTLC–Spektrofotodensitometri dengan Kromatografi Gas - Spektrometri Massa (GC – MS).
1.2 Rumusan Masalah
Berdasarkan latar belakang masalah di atas, maka dapat dirumuskan masalah pada penelitian ini adalah :
1. Bagaimanakah tingkat kesesuaian hasil analisis kandungan kimia tablet ekstasi antara menggunakan HPTLC – Spektrofotodensitometri dengan
GC – MS?
2. Bagaimanakah perbandingan kesesuaian hasil analisis “drugs profiling” tablet ekstasi antara menggunakan HPTLC – Spektrofotodensitometri dengan GC – MS?
1.3 Tujuan
1. Mengetahui tingkat kesesuaian hasil analisis kandungan kimia tablet ekstasi antara HPTLC – Spektrofotodensitometri dengan GC – MS. 2. Mengetahui tingkat kesesuaian hasil analisis “drugs profiling” tablet
ekstasi antara HPTLC – Spektrofotodensitometri dengan GC – MS.
1.4. Manfaat Penelitian
1. Dapat memberikan informasi mengenai kemampuan dan ketangguhan HPTLC-Spektrofotodensitometri dalam analisis karakterisasi kandungan kimia “drugs profiling” tablet ekstasi.
2. Penelitian ini diharapkan dapat memberikan informasi mengenai metode yang cepat, tepat dan valid dalam melakukan analisis karakterisasi kandungan kimia “drugs profiling” tablet ekstasi kepada laboratorium pemeriksa narkoba.
O H2C O NH CH3 CH3 BAB II KAJIAN PUSTAKA 2.1 Ekstasi (MDMA)
MDMA mempunyai rumus molekul C10H15NO2. Nama kimia 3,4
methylenedioxy metamphetamine. Berat molekul 193,2 g/mol. Struktur dari senyawa MDMA ditunjukkan pada Gambar 2.1. Garam MDMA HCl berbentuk kristal putih larut dalam air, alkohol dan kloroform.
Gambar 2.1. Struktur senyawa MDMA (Moffat, et al., 2004)
MDMA merupakan salah satu derivat amfetamin tipe stimulan (ATS). Senyawa metilendioksi metamfetamina (MDMA) dan metilendioksi amfetamin (MDA) sangat mudah diproduksi/disintesis dimana biasanya dicampur dengan zat psikotropika atau bahan tambahan lainnya dan disalahgunakan dengan nama dagang ekstasi (Handajani, 2006).
MDMA pertama kali disintesis dan resmi dipatenkan oleh industri farmasi Ernest Merk di Darmstadt pada tahun 1914 sebagai obat penekan nafsu makan, namun tidak pernah diperdagangkan. Semenjak tahun 1971 baik di Amerika maupun di Inggris, MDMA dilarang digunakan sebagai obat dan pada tahun 1977 dikeluarkan amandemen tentang penyalahgunaan obat, MDMA dimasukkan dalam skedul I atau kelas A sebagai bahan yang dilarang diproduksi dan diedarkan untuk pengobatan. Akibat pelarangan tersebut banyak ”Clandistine Laboratory”
O O O O O O O Br O O HBr Safrol HCOOH, Peroxyde PMK formamide (DMF) MDPBP ROUTE I ROUTE II CH3-NH2 MDMA KOH etOH Isosafrol O H2C O NH CH3 CH3 HCl, HCOOH
memproduksi MDMA secara ilegal dengan memakai bahan dasar safrol dan isosafrol. (Demiya, 2005).
Sintesis MDMA dibuat dari bahan/senyawa aromatik methylendioxy berasal dari myristicin atau minyak safrol, salah satunya dari tanaman sassafras. Metode produksi MDMA dari bahan dasar saprol dapat dibuat melaui 2 jalur sintesis bisa melaui reaksi Leukart dimana bahan dasar dibuat menjadi isosaprol kemudian ditambahkan peroksida mejadi PMK (Piperonil Metil Keton) dengan pereaksi formamid dan HCl baru terbentuk MDMA. Sedangkan route yang dibuat Ernest Merk melalui MDBP menjadi MDMA. 2 Jalur sintesis MDMA tersebut dapat dilihat pada Gambar 2.2
Gambar 2.2. Skema 2 jalur sintesa MDMA pada rute I reaksi Leukart, sedangkan rute II sintesa MDMA asli dibuat oleh Ernest Marck (Reton, 1993).
2.2 Tinjauan Umum ” Drugs Profiling ”
”Drugs profiling” adalah kegiatan mengidentifikasi atau mengisolasi karakterisasi fisika dan kimia dari sampel narkoba dan kemudian mengelusidasi hubungan satu sampel dengan sampel yang lainnya berdasarkan sidik jari kimia dari masing-masing sampel dengan bantuan analisis statistik dalam upaya mengungkap net-working distribusi peredarannya (Wirasuta, 2012).
Pendekatan analisis yang paling tepat untuk studi karakterisasi narkoba tergantung pada jenis sampel yang dianalisis misalnya; sampel berupa tablet, kapsul, serbuk, cairan dan dalam bentuk aslinya atau alami seperti opium dan ganja. Teknik yang paling sederhana dalam mengkarakterisasi sampel narkoba yaitu dengan pemeriksaan visual seperti warna dan tekstur guna untuk mendapatkan data karakterisasi fisik. Selain karakterisasi fisik sampel narkoba juga dikarakterisasi secara kimia dengan menggunakan metode yang modern sehingga sangat memungkinkan untuk mendapatkan data hasil analisis komponen utama dan material tambahan (United Nations, 2001).
Hubungan karakterisasi antar sampel narkoba dapat dibuat dari perbedaan dan persamaan material yang terdapat pada masing-masing sampel tersebut. Pengelompokan sampel obat-obatan terlarang menjadi suatu kelompok yang saling terkait dan sangat berguna bagi pihak penegak hukum untuk mengetahui jaringan ”link” khusus antara pemasok, pengedar/kurir dan pengguna, sehingga dapat dibentuk pola distribusi obat terlarang termasuk sumber, asal-usul geografisnya, metode rute produksi dan prekursor yang digunakan (United Nations, 2001).
2.3 ”Drugs Profiling” Tablet Ekstasi
Karakterisasi tablet ekstasi umumnya meliputi karakterisasi fisik dan kandungan kimia. Karakterisasi fisik meliputi analisis secara visual dari tablet seperti bentuk, warna, ukuran dan logo. Sedangkan karakterisasi kimia meliputi analisis kandungan zat aktif (senyawa turunan amfetamin), pengencer (deluents), pencampur (adulterants), dan pengotor (impurities) baik yang muncul akibat proses produksi atau yang sudah ada bersama precursor dan bahan baku lainnya (United Nations Office and Drugs Crime, 2001, Suzanne, 2006).
Metode analisis yang digunakan dalam melakukan analisis karakterisasi kandungan kimia tablet ekstasi umumnya adalah metode spektrometri, GC-MS, HPLC dan FTIR. Metode analisis dengan HPTLC juga dapat digunakan dalam melakukan analisis uji “drugs profiling” senyawa turunan amfetamin (Kochana 2003). Metode analisa kharakterisasi kandungan “drugs frofiling” tablet ekstasi dengan HPTLC-Spektrofotodensitometri telah dilaporkan oleh Wirasuta tahun 2012, dari 54 sampel tablet ekstasi telah berhasil di identifikasi kandungan kimia dan dapat dikelompokkan menjadi empat klauster, sehingga dapat mempermudah mengetahui hubungan antar sampel dalam merunut jalur peredaran ekstasi dalam penegakan hukum (Wirasuta, 2012).
2.4 Analisis Kimia Tablet Ekstasi dengan HPTLC-Sepektrofotodensitometri HPTLC merupakan metode yang dipilih untuk analisis sampel yang kompleks dan banyak mengandung bahan pengotor (impurities). HPTLC juga merupakan metode yang cocok untuk memisahkan obat yang memiliki jarak (range) polaritas yang luas. HPTLC dapat digunakan untuk memisahkan komponen penyusun dari suatu obat dan kemudian dikuantifikasi dengan menggunakan
spektrofodensitometer melalui pengukuran in-situ dari absorbsi sinar UV-VIS atau flouresensi (Ahrens, et al., 2002).
Metode analisis “drugs profiling” tablet ekstasi dengan menggunakan metode analisis HPTLC-Spektrofotodensitometri telah dilaporkan oleh Wirasuta tahun 2012, dari 54 sampel tablet ekstasi telah berhasil di identifikasi kandungan kimia dan dapat dikelompokkan menjadi empat kluster dengan pengembangan metode fungsi kosinus. Wirasuta menggunakan plat HPTLC Si GF 254 dengan 2 sistem fase gerak yaitu TB (sikloheksan-toluene-dietilamin, 25 : 3 : 1 v/v) dan TAEA (toluene-aseton-etanol-amonia, 45 : 45 : 7 : 3 v/v). Secara keseluruhan tablet ekstasi uji setelah diekstraksi pelarut toluena pada dafar fosfat pH 10,5 di temukan senyawa MDMA, BDB, DOET, ketamin, etil-MDA, PMA dan senyawa yang tidak termasuk turunan amfetamin yaitu kafein dan flurazepam.
Perkembangan yang sangat pesat dalam penggunaan fase gerak sering memberikan perbedaan hasil analisis antar satu laboratorium dengan yang lainnya. Pemisahan analit menggunakan teknik kromatografi datar, kromatogram biasanya dinyatakan dengan angka Rf atau hRf. Angka Rf didefinisikan sebagai ratio antara jarak noda dari titik awal ke titik pusat zone (Ja) dengan jarak yang ditempuh pelarut (Jp ), sehingga Rf = Ja /Jp, sedangkan hRf adalah multiplikasi Rf dengan faktor 100 (hRf = 100 Rf). Perbedaan dalam pengerjaan, faktor lingkungan juga telah dilaporkan ikut memberi sumbangan pada variasi nilai hRf analit, sedangkan nilai hRf juga dijadikan dasar dalam menginterpretasikan hasil analisis. Berdasarkan kelemahan ini Deutsche Forschungsgemeinschaft (DFG) dan The International Association of Forensic Toxicologists (TIAFT) pada tahun 1992 melaporkan system KLT terstandarkan untuk keperluan analisis toksikologi forensik. DFG dan TIAFT menawarkan sistem dengan plat KLT Silika Gel dan 10
sistem fase gerak, dengan masing-masing sistem fase gerak terdapat 4 senyawa pembanding. Korelasi antara hRf analisis dengan hRfc dari 4 senyawa pembanding tersebut sehingga akan didapatkan enam titik mulai dari titik (0,0) sampai (100,100) yang kemudian diplot. Penghitungan harga hRfc analit diperoleh seperti pada Gambar 2.3 (Zeeuw, et al., 1992).
Gambar 2.3. Grafik Poligonal (Zeeuw, et al., 1992).
Harga hRfC analit dapat ditentukan dengan mengeksploitasi ke sumbu x atau dihitung dengan menggunakan rumus:
hRf C (X) = hRf C (A) + C [ hRf (X) - hRf (A)] dimana; ∆C = hRf C (B) - hRf C (A) dan ∆ = hRf (B) – hRf (A)
Berdasarkan harga hRf analit dan pembanding, dengan menghitung harga hRf terkoreksi secara metode poligonal. Berdasarkan harga hRf terkoreksi ini dari masing-masing spot dan data hRf terkoreksi dilakukan interpretasi indentitas analit (Zeeuw, et al., 1992).
Camag mengembangkan sistem kromatografi salah satunya sistem TAEA yang dianjurkan untuk analisis obat (drug), senyawa narkotika dan psikotropika. Sistem TAEA ini menggunakan senyawa referece/standar yaitu morfin, kodein, kafein, papaverin dan bromheksin. Adapun harga hRfc larutan standar pengkoreksi dengan sistem TAEA menggunakan plat silica 60 G F254 seperti pada Table 2.1
No Senyawa Pembanding hRfc 1 Morfin 8 2 Kodein 16 3 Kafein 48 4 Papaverin 55 5 Bromheksin 83
Tabel 2.1. Harga hRfc larutan standar sistem TAEA (Wirasuta, 2012, Zeeuw, et al., 1992)
Wirasuta (2012) melakukan pengembangan HPTLC-Spektrofotodensitometer untuk analisis drug profiling didapatkan bahwa data kromatogram hasil pemisahan analit dengan sistem fase gerak TAEA dapat dikombinasikan dengan sistem TB dengan mengunakan perhitungan irisan pada metode dual sistem sehingga menghasilkan data analisis yang lebih akurat. Sistem TB merupakan salah satu sistem dengan menggunakan perbandingan fase geraknya yaitu: sikloheksana : toluena : dietilamin (75:15:10), dengan senyawa reference/ standar yang digunakan yaitu Theofilin, papaverin, Dektrometorfan dan bromheksin (Wirasuta, 2012).
Harga hRfc larutan standar pengkoreksi dengan sistem TB menggunakan plat silica 60 G F254 seperti pada Table 2.2.
No Senyawa Pembanding hRfc
1 Teofilin 1
2 Papaverin 8
3 Dektrometorfan 42
4 Bromheksin 69
Tabel 2.2. Harga hRfc larutan standar sistem TB (Wirasuta, 2012)
2.5 Analisis Kimia Tablet Ekstasi dengan GC-MS
Kromatografi Gas - Spektrometri Massa (GC-MS) merupakan salah satu tehnik yang paling umum digunakan untuk identifikasi dan analisis kuantitatif sampel obat dalam bidang forensik. GC-MS menyediakan data spektral yang sangat spesifik pada senyawa individu dalam campuran kompleks. Semua senyawa yang diidentifikasi dengan GC-MS akan dibandingkan dengan spektrum massa yang sesuai dengan data pustaka/library. Identifikasi kuantitatif dilakukan dengan membandingkan area puncak pada waktu retensi (tR) yang sama dengan standar acuan (United Nations, 2001).
Makino (2003) telah berhasil menganalisis 54 tablet ekstasi menggunakan GC-MS merk Hewlett-Pakard (HP) 6890 menggunakan kolom kapiler silika ultra-2 dengan gas pembawa helium temperatur kolom diprogram 50 0C selama 1 menit kemudian dinaikan 10 0C/menit sampai suhu 300 0C ditahan selama 4 menit dengan temperatur injeksi 250 0C. Elektron-impact ionisasi massa diseting pada energi ionisasi 70 eV, current ionisasi 300 μA, suhu pengionan 300 0C secara keseluruhan dari 54 tablet didapatkan hasil analisis kandungan utama adalah MDMA methylenedioxymethamphetamine) dan komponen lainnya yaitu: MDA (3,4-methylenedioxyamphetamine), epedrin, kafein, ketamin dan metamfetamina. (Makino, 2003).
Khajiamiri et.al., (2010) menggunakan GC-MS untuk analisa kandungan kimia tablet ekstasi, dimana identifikasi senyawa aktif dan impurities di identifikasi berdasarkan waktu retensi dan sepktra massa dari sampel dibandingkan dengan spektra pada pustaka dari Wiley dan NIST. Dari hasil analisis 54 sampel tablet ekstasi didapatkan komponen kimia MDMA-hidrokloride dan beberapa tablet ditemukan ketamin, penantrasin, efedrin dan kaffein. Khajiamiri menggunakan instrument GC-MS merk Agilent tipe 5973 MSD dan 6890 GC menggunakan kolom kapiler HP-5 dan GC-MS merk Varian tipe 1200 LMS dan GC CP-3800 menggunakan kolom HP-1. Temperatur kolom diprogram 60 0C selama 0,5 menit kemudian dinaikan 12 0C/menit sampai suhu 280 0C selama 30 menit. Elektron-impact ionisasi massa diseting pada energi ionisasi 70 eV (Khajiamiri et.al 2010).
2.6 Analisis ”Drugs Profiling” dengan Fungsi Kosinus
Penelitian ini menggunakan fungsi kosinus untuk mengetahui dan mengungkap hubungan antar sampel narkotika ekstasi dengan membuat kluster/dendogram dari keseluruhan sampel tablet tersebut. Analisis dengan fungsi kosinus ini dibuat dengan mengumpamakan sampel sebagai suatu vektor. Untuk memperkirakan kedekatan atara dua vektor tersebut dengan menghitung sudutnya (Esseiva, et al., 2003).
Esseiva, et al., (2003) mengembangkan dan memanfaatkan fungsi kosinus untuk mengungkap hubungan antar sampel heroin illegal. Hubungan antar sampel dibangun memanfaatkan data puncak-puncak kromatogram dari setiap sampel heroin illegal. Puncak puncak kromatogram dan luas puncak adalah karakteristik untuk setiap sampel. Dengan memanfaatkan data tersebut dan memasukkan ke
dalam fungsi kosinus maka korelasi antar sampel dapat dihitung. Hubungan antar sampel ditentukan oleh koefisien korelasi antar sampel.
Gambar disamping ini menggambarkan dua vektor a dan b dengan sudut θ, kedekatan hubungan antar kedua vektor tersebut digambarkan dengan fungsi kosinus. Hasil kali skalar kedua vektor tersebut adalah:
cos
.b a x b x
a .
Jika ekspresi hasil skalar kedua vektor dijabarkan berdasarkan orto-normal dalam ruang, maka:
na
a
a
a
2 1 dan
nb
b
b
b
2 1Perkalian skalar kedua vektor dapat dituliskan sebagai berikut:
i i n i
b
a
b
a
.
Norma vektor menurut komponennya dalam ruang adalah:
a
a
12
a
22
a
n2 Kosinus sudut antara kedua vektor tersebut dapat dihitung:b
a
θ
n nb
a
b
a
b
a
1 1 2 2
2 2 2 2 ( ) b a b a Cos
Dengan mengikuti aturan vektor hubungan-hubungan diturunkan maka korelasi antara dua kromatogram dapat dituliskan sebagai berikut:
2 2 2 2 1 2 2 2 2 1 2 2 2 1 1100
n n n nb
b
b
a
a
a
b
a
b
a
b
a
C
Dimana; a1, a2,……,an menyatakan besaran dari variable 1 s/d n untuk kromatogram
a, dan demikian juga b1, b2, …..,bn menyatakan besaran variable kromatogram b.
Berdasarkan pemunculan pola puncak kromatografi dari sampel narkoba dengan analisis klauster dapat dianalisis kelompok atau kekerabatan dari sampel tersebut. Analisis pola kromatogram GC dari pengotor pada sediaan heroin dapat dikelompokkan berdasarkan kedekatan dari sampel tersebut, seperti yang tercantum pada Gambar 2.4.
BAB III
KERANGKA KONSEP DAN HIPOTESIS
3.1. Kerangka Konsep
“Drugs profiling” sangat membantu penegak hukum dalam usaha merunut dan pemutusan jalur peredaran narkotika. Secara internasional analisis “drugs profiling” menggunakan instrumentasi GC-MS namun dalam analisis rutin membutuhkan biaya perawatan alat yang relatif mahal dan juga membutuhkan SDM yang cukup handal untuk mengoprasikannya. Ketersediaan instrument ini juga belum memadai disetiap lab pemeriksa NAPZA.
HPTLC (High Performance Thin Layer Chromatography) merupakan salah satu metode yang cukup sederhana dan dapat dilakukan dengan biaya yang relatif murah. Dalam perkembangan instrumentasi, “Camag” telah mengembangkan metode ini dengan menyediakan peralatan penotolan sampel secara otomatis dan alat scanner yang dikenal dengan nama Spektrofotodensitometer. Instrumentasi Spektrofotodensitometer ini dilengkapi dengan pembacaan UV-VIS insitu serta didukung data pustaka/library sehingga sangat memungkinkan untuk melakukan analisis kandungan kimia narkoba secara cepat dan efisien. Metode analisa karakterisasi kandungan kimia “drugs profiling” tablet ekstasi dengan menggunakan metode analisis HPTLC-Spektrofotodensitometri telah dilaporkan oleh Wirasuta tahun 2012, dimana dari 54 sampel tablet ekstasi telah berhasil di identifikasi kandungan kimia dan dapat dikelompokkan menjadi empat kluster dengan pengembangan fungsi kosinus sehingga dapat mempermudah mengetahui kesamaan sidik jari kimia untuk menghubungan keterkaitan antar sampel dalam merunut jalur peredaran ekstasi guna penegakan hukum (Wirasuta, 2012).
Koefisien korelasi fungsi kosinus dapat digunakan untuk mengevaluasi hubungan satu sampel dengan sampel yang lain (Esseiva, et al., 2003). Fungsi kosinus dihitung berdasarkan besaran data retention factor (Rf) dan luas dari masing-masing puncak (Wirasuta, 2012). Harga hRf dapat dipengaruhi oleh banyak faktor, seperti tingkat kejenuhan chamber, kelembaban udara ruangan, perbedaan kombinasi fase gerak, jumlah sampel yang diaplikasikan pada plat dan jarak elusi (Zeeuw, et al., 1992). Pangaruh ini dapat dikurangi dengan menggunakan standar pengkoreksi dimana Deutsche Forschungsgemeinschaft (DFG) dan The International Association of Forensic Toxicologists (TIAFT) pada tahun 1992 melaporkan system KLT terstandarkan untuk keperluan analisis toksikologi forensik. DFG dan TIAFT menawarkan sistem dengan plat KLT Silika Gel dan 10 sistem fase gerak, dengan masing-masing sistem fase gerak terdapat 4 senyawa pembanding. Korelasi antara hRf analisis dengan hRfc (hRf terkoreksi) dari 4 senyawa pembanding tersebut kemudian diplot sehingga harga hRfc analit dapat dihitung (Zeeuw, et al., 1992).
HPTLC-Spektrofotodensitometri merupakan metode yang dipilih untuk analisis sampel yang kompleks dan banyak mengandung bahan impurities (pengotor). HPTLC dapat digunakan untuk memisahkan komponen penyusun dari suatu obat dan kemudian dikuantifikasi dengan menggunakan spektrofodensitometer melalui pengukuran in-situ dari absorbsi sinar UV-VIS atau flouresensi. Analisis “drugs profiling” dengan menggunakan HPTLC- Spektrofotodensitometri sudah banyak dikembangkan baik pemilihan fase gerak atau eluen, sistem ekstraksi, dan bahan plat TLC yang digunakan sehingga hal ini sangat memungkinkan untuk mendapatkan hasil analisis dan identifikasi senyawa aktif dan bahan tambahan lain/impurities pada sampel obat (Ahrens, et al., 2002).
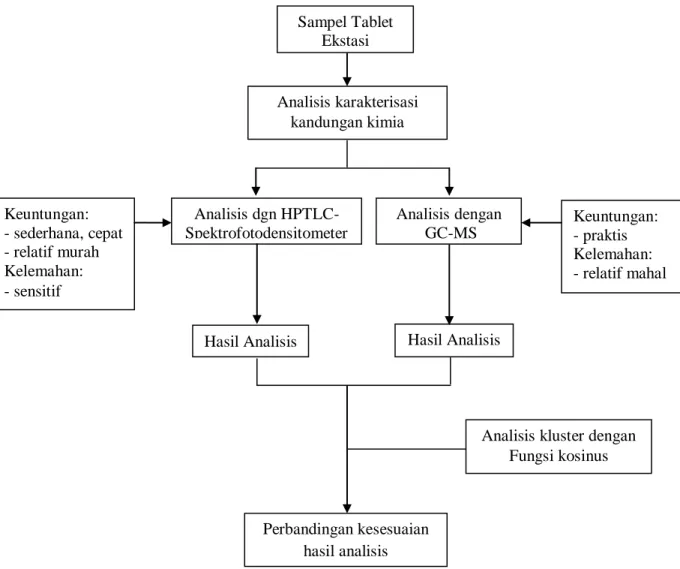
Diagram alir dari kerangka berfikir dapat dilihat pada Gambar 3.1
Gambar 3.1 Diagram alir Kerangka Berpikir
3.2. Hipotesis
Berdasarkan kerangka berpikir di atas, maka dapat dirumuskan hipotesis bahwa analisis karakteristik kimia “drugs profiling” tablet ekstasi dengan menggunakan HPTLC–Spektrofotodensitometri memiliki kesesuaian hasil dengan Kromatografi Gas - Spektrometri Massa (GC – MS).
Sampel Tablet Ekstasi Analisis dgn HPTLC- Spektrofotodensitometer Analisis karakterisasi kandungan kimia Hasil Analisis Analisis dengan GC-MS Hasil Analisis Keuntungan: - sederhana, cepat - relatif murah Kelemahan: - sensitif Keuntungan: - praktis Kelemahan: - relatif mahal
Analisis kluster dengan Fungsi kosinus
Perbandingan kesesuaian hasil analisis
BAB IV
METODE PENELITIAN
4.1. Tempat Penelitian
Preparasi sampel dilakukan di Laboratorium Forensik Polri Cabang Denpasar dan Laboratorium Toksikologi Forensik Lembaga Forensik Sains dan Kriminologi Universitas Udayana. Sedangkan analisis dengan menggunakan GC-MS dilakukan di Laboratorium Forensik Polri Cabang Denpasar dan analisis dengan HPTLC-Spektrofotodensitometri dilakukan di Laboratorium Toksikologi Forensik Lembaga Forensik Sains dan Kriminologi Universitas Udayana
4.2. Sampel
Sampel yang digunakan adalah sampel tablet ekstasi yang diperoleh di Laboratorium Forensik Polri Cabang Denpasar.
4.3 Bahan dan Alat 4.3.1 Bahan
Bahan kimia yang digunakan dalam penelitian ini berderajat pro analisis (p.a), sedangkan standar pengkoreksi yaitu; tiofilin, papaverin, dekstrometorfan, morfin, kodein dan bromheksin. Bahan-bahan kimia yang digunakan terdiri dari aseton, amonia, etanol, metanol, dietilamina, sikloheksana, toluena, ammonium hidroksida dan aquades. Plat HPTLC Silica gel 60 F 254 ukuran 20 x 10 cm Merk KgaA Germany.
4.3.2 Alat
Alat yang dipergunakan dalam penelitian ini terdiri dari labu ukur, pipet ukur, Gelas Beker (merk pyrex), pipet mikro (merk camag), meteran digital (merk Krisbow), neraca analitik (merk Mettler toledo), vortek (Ika vibrak XR basic), ultrasonik (merk Branson 1510), sentrifuge (merk Ettich EBA 20), bejana kromatografi 10 x 20 cm (merk camag), oven, Linomat V (camag), pH meter (merk Oakton seri 10), GC-MS merk Agilen GC tipe 6890N, MS 5973 dan Spektrofotodensitometer (TLC Scanner 3) merk Camag.
4.4 Prosedur Kerja
4.4.1 Pembuatan larutan campuran standar pengkoreksi 1000 ppm
Masing-masing standar tiofilin, papaverin, dekstrometorfan, morfin, kodein dan bromheksin ditimbang masing-masing sebanyak 10 mg kemudian dibuat dua standar campuran untuk pengkoreksi sistem TB terdiri dari tiofilin, papaverin, dekstrometorfan dan bromheksin yaitu dilarutkan dengan metanol dalam satu labu ukur 10 ml. Untuk pengkoreksi sistem TAEA terdiri dari papaverin, morfin, kodein dan bromheksin dilarutkan dengan metanol dalam satu labu ukur 10 ml.
4.4.2 Pembuatan larutan bufer fosfat pH 10,5
Ditimbang 2,7124 gram KH2PO4 dimasukkan ke dalam labu ukur 100 ml,
kemudian ditambahkan air aquades sampai tanda batas selanjutnya ditimbang 0,8 gram NaOH kemudian dimasukkan ke dalam labu ukur 100 ml ditambahkan aquades sampai tanda batas. Selanjutnya diambil sejumlah tertentu larutan fosfat dititrasi dengan larutan NaOH sampai pH 10,5.
4.5 Analisis ”Drugs profiling” tablet Ekstasi 4.5.1 Analisis karakterisasi fisika
Sampel tablet ekstasi yang sudah diberikan label, masing–masing di foto kemudian dilakukan analisis karakterisasi fisika meliputi; warna, logo, diameter, tebal dan berat.
4.5.2 Analisis karakterisasi kimia 4.5.2.1 Ekstraksi sampel tablet ekstasi
Masing-masing tablet digerus sampai homogen kemudian diambil 200 mg dimasukkan dalam tabung reaksi, kemudian ditambahkan bufer fosfat pH 10,5 sebanyak 5 ml, campuran dikocok 300 rpm selama 30 menit, kemudian disentrifugasi pada kecepatan 2500 rpm. Supernatan diambil sebanyak 4 ml dimasukkan dalam tabung lain dan ditambahkan 2 ml toluen. Ekstraksi dilakukan dengan menggunakan ultrasonik. Toluen dipisahkan dengan mensentrifugasi pada 2500 rpm, fase organik diambil 1 ml dipindahkan dalam tabung efendorf kemudian diuapkan dengan gas nitrogen kemudian direkonstitusi dengan 1 ml metanol. Ekstrak metanol masing-masing tablet disiapkan untuk analisis dengan GC-MS dan HPTLC-Spektrofotodensitometer.
4.5.2.2 Analisis kandungan kimia dengan GC-MS
Sampel hasil ekstraksi tablet, masing-masing diinjeksikan sebanyak 1 μL ke dalam GC-MS. Sebelumnya GC-MS telah diprogram mode full scan dengan kondisi kromatografi dipilih kolom 5% phenylmethylpoly siloxane (HP5 MS), laju alir helium (He) 1 mL/menit, suhu oven diatur 70oC selama 5 menit dinaikkan hingga 270 oC selama 5 menit dengan kecepatan 10oC/menit. Sepektroskopi massa menggunakan Elektron Impack (EI) dengan energi ionisasi 70 eV. Uji konfirmasi
kandungan kimia masing-masing tablet ekstasi dilakukan dengan membandingkan spektra massa hasil analisis dengan spektra massa library (pustaka).
4.5.2.3 Analisis kandungan kimia dengan HPTLC-Spektrofotodensitometer
Plat HPTLC sebelum digunakan terlebih dahulu dicuci dengan metanol dan diaktifkan pada suhu 120 0C selama 20 menit dalam oven. Plat HPTLC disimpan dalam desikator. Masing–masing sebanyak 2 μL ekstrak tablet ditotolkan pada plat HPTLC ukuran 10 x 20 cm dengan linomat V dengan jarak 1 cm dari tepi bawah plat dan jarak antar totolan 0,3 cm. Pada plat 1, trak/lajur pertama ditotolkan senyawa standar campuran pengkoreksi 1000 ppm (teofilin, papaverin, dekstrometorfan dan bromheksin). Plat kemudian dielusi dengan sistem TB (sikloheksan-toluene-dietilamin, 25 : 3 : 1 v/v). Pada plat 2, trak/lajur pertama ditotolkan senyawa standar pengkoreksi 1000 ppm (morfin, kodein, papaverin dan bromheksin). Plat kemudian dielusi dengan sistem TAEA (toluene-aseton-etanol-amonia, 45 : 45 : 7 : 3 v/v). Setelah batas elusi tercapai plat HPTLC diangkat dan dikeringkan pada suhu 60 0C selama 10 menit. Plat HPTLC kemudian di scan dengan TLC-Scanner 3 pada λ = 210 nm. Scanner di optimasi pada pencahayaan maksimum dengan slit dimension 3.00 x 0,10 nm, kecepatan scaning 5 mm/s dan resulusi data 200 μm/step. Setiap puncak kromatogram di scan pada kisaran panjang gelombang 190 - 400 nm dengan slit dimension 3.00 x 0,10 nm, kecepatan scaning 100 nm/s dan resulusi data 1 nm/step. Uji konfirmasi kandungan kimia masing-masing tablet ekstasi dilakukan dengan membandingkan hRfc dan sepektrum analit dengan sepektrum library (pustaka).
4.5.3 Analisis “drugs profilings” dengan fungsi kosinus
Hubungan antar sampel tablet ekstasi dibuat dalam bentuk dendogram dengan tehnik masing masing puncak disusun data area dibawah puncak (AUCi)
berdasarkan harga hRfci-nya. Komponen vektor suatu kromatogram dinyatakan
dengan: 2 2 2 2 1 a an a AUC AUC AUC a .
Cosinus sudut kedua vektor kromatogram dapat dihitung dengan :
2 2 2 2 ( ) b a b a Cos
Nilai koefisien korelasi kosinus kedua vektor adalah C100Cos2, dibangun hubungan antar sampel tablet dengan analisis kluster data kromatogram dengan bantuan program Exel 2010 dan MINITAB.
BAB V
HASIL DAN PEMBAHASAN
5.1. Karakterisasi Fisik Tablet Ekstasi
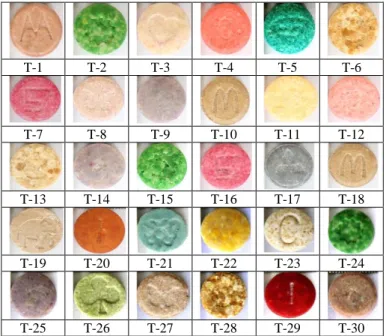
Analisis fisik tablet ekstasi meliputi pemeriksaan awal yaitu pendokumentasian tablet dan dilanjutkan pemeriksaan secara visual, pengukuran diameter, tebal dan berat. Adapun hasil pendokumentasian dari 30 sampel tablet ekstasi dapat dilihat pada Gambar 5.1. T-1 T-2 T-3 T-4 T-5 T-6 T-7 T-8 T-9 T-10 T-11 T-12 T-13 T-14 T-15 T-16 T-17 T-18 T-19 T-20 T-21 T-22 T-23 T-24 T-25 T-26 T-27 T-28 T-29 T-30
Gambar 5.1 Foto tablet ekstasi.
Pemeriksaan ciri fisik tablet ekstasi baik warna dan logo dilakukan secara visual. Sedangkan pemeriksaan diameter dan ketebalan dilakukan dengan bantuan alat ukur meteran digital dengan satuan sampai mm. Pengukuran berat dari masing- masing tablet dengan menggunakan neraca analitik dengan satuan mg dan dihitung sampai 2 angka dibelakang koma. Adapun hasil pemeriksan warna, logo, diameter dan berat seperti pada Tabel 5.1.
No ID
Sampel Warna Logo Tebal Diameter Berat
1 T-1 Coklat M 5,27 mm 7,25 mm 249, 81 mg
2 T-2 Hijau Matahari 5,10 mm 7,04 mm 228,62 mg
3 T-3 Krem Love 4,82 mm 8,02 mm 279,21 mg
4 T-4 Merah C 4,76 mm 8,20 mm 295,92 mg
5 T-5 Biru Super boy 6,19 mm 8,13 mm 355,11 mg 6 T-6 Coklat Embrio 3,65 mm 8,23 mm 224,16 mg 7 T-7 Merah 5 5,95 mm 8,11 mm 359,62 mg 8 T-8 Coklat Butterfly 5,51 mm 8,27 mm 320,80 mg 9 T-9 Ungu - 4,97 mm 8,05 mm 282,16 mg 10 T-10 Coklat Mcdonald 3,34 mm 8,06 mm 208,78 mg 11 T-11 Orange Matahari 4,83 mm 8,63 mm 280,01 mg 12 T-12 Merah C 5,03 mm 8,19 mm 292,13 mg 13 T-13 Coklat Embrio 3,64 mm 8,20 mm 221,23 mg 14 T-14 Ungu - 4,69 mm 8,04 mm 279,31 mg 15 T-15 Hijau Matahari 5,11 mm 7,12 mm 229,77 mg 16 T-16 Merah 5 5,96 mm 8,12 mm 355,94 mg 17 T-17 Abu-abu Mitsubisi 4,82 mm 8,18 mm 285,75 mg 18 T-18 Coklat Mcdonald 3,36 mm 8,01 mm 207,10 mg 19 T-19 Krem Gajah 3,34 mm 8,27 mm 210,33 mg 20 T-20 Merah I 5,38 mm 7,95 mm 310,75 mg 21 T-21 Biru Kupu-kupu 4,81 mm 7,74 mm 275,13 mg 22 T-22 Kuning - 5,01 mm 8,06 mm 290,30 mg 23 T-23 Putih C 4,85 mm 7,73 mm 236,65 mg 24 T-24 Hijau Butterfly 5,15 mm 7,03 mm 229,55 mg 25 T-25 Ungu - 4,92 mm 8,04 mm 282,61 mg
26 T-26 Hijau muda Trup 4,58 mm 8,13 mm 281,44 mg 27 T-27 Coklat Butterfly 5,23 mm 8,28 mm 294,24 mg 28 T-28 Coklat Embrio 3,56 mm 8,26 mm 214,99 mg
29 T-29 Merah I 5,43 mm 8,19 mm 335,24 mg
30 T-30 Krem - 5,03 mm 8,15 mm 292,12 mg
Berdasarkan data fisik tablet baik warna, logo, diameter, tebal dan berat dari 30 tablet terdapat 19 tablet dapat dikelompokkan menjadi 8 grup yang sudah diidentifikasi memiliki kemiripan atau kesamaan secara fisik baik warna, logo, diameter, tebal dan berat. Sisanya sebanyak 11 tablet masing-masing memiliki ciri-ciri secara fisik yang berbeda-beda.
Analisis “drugs profiling” tablet ekstasi secara fisik didapatkan dengan melihat secara visual kemiripan ciri-ciri fisik dari masing-masing tablet, diantaranya tablet yang masuk di grup I dengan ID T2, T15 dan T24 memiliki kesamaan fisik
yaitu warna hijau dengan tanda khas (logo) matahari, dilihat dari teknik pengepresan/pencetakan tablet ini berukuran sama dengan tebal ± 5 mm, diameter ±7 mm dan berat ± 229 mg. Tablet pada grup II dengan ID T6, T13 dan T28 memiliki kesamaan fisik yaitu warna coklat dengan tanda khas (logo) embrio, tebal ± 3,60 mm, diameter ± 8,20 mm dan berat ± 220 mg. Tablet pada grup III dengan ID T7 dan T16 memiliki kesamaan fisik yaitu warna merah, dengan tanda khas (logo) angka 5, tebal ± 5,9 mm, diameter ± 8,1 mm dan berat ± 355 mg. Tablet pada grup IV dengan ID T10 dan T18 memiliki kesamaan fisik yaitu warna coklat, dengan tanda khas (logo) mcdonald, tebal ± 3,3 mm, diameter ± 8 mm dan berat ±200 mg. Tablet pada grup V dengan ID T8 dan T27 memiliki kesamaan fisik yaitu warna coklat, dengan tanda khas (logo) butterfly, tebal ± 5 mm, diameter ± 8 mm dan berat ± 300 mg. Tablet pada grup VI dengan ID T4 dan T12 memiliki kesamaan fisik yaitu warna merah muda, dengan tanda khas (logo) hurup C, tebal ±5 mm, diameter ± 8 mm dan berat ± 290 mg. Tablet pada grup VII dengan ID T9, T14 dan T25 memiliki kesamaan fisik yaitu warna ungu, dengan diameter ±8mm dan berat ± 280 mg. Tablet pada grup VIII dengan ID T20 dan T29 memiliki kesamaan fisik yaitu warna merah, dengan tanda khas (logo) hurup I memiliki tebal ± 5 mm, diameter ± 8 mm dan berat ± 300 mg. Sedangkan tablet dengan ID T1, T3, T5, T11, T17, T19, T21, T22, T23, T26 dan T30 masing-masing memiliki karakter/ciri-ciri fisik yang berbeda-beda.
Analisis karakterisasi fisik dari 30 tablet ekstasi dapat dibuat “ profiling” berdasarkan perbedaan dan kemiripan fisik menjadi 19 kelompok. Perbedaan ciri fisik ini disebabkan karena adanya teknik pembuatan dan alat pengepresan/pencetakan yang berbeda. Namun perbedaan ciri fisik ini belum tentu bersumber dari jalur produksi yang berbeda karena banyak clandestin lab
mengelabui dengan menggunakan beberapa alat pengepresan/pencetak yang berbeda-beda.
5.2. Karakterisasi Kimia Tablet Ekstasi
Hasil analisis karakterisasi kimia 30 tablet ekstasi dengan instrumen GC-MS menggunakan library dari NIST11, NIST02, Wiley7n, W9N11.L dan SWDrug dengan nilai quality diatas 85 didapatkan 9 jenis senyawa yaitu MDMA (3,4- methylenedioxy metamphetamine), MDA (3,4-methylenedioxy amphetamine), PMMA (para-methoxymetamphetamine), ketamin, kafein, piperazin, kloroquin, dekstrometorpan dan klorfenamin. Senyawa aktif MDMA sebagai komponen utama terdapat pada tablet dengan ID T1, T3, T6, T8, T9, T10, T13, T14, T17, T18, T19, T20, T22, T23, T25, T27, T28, T29, dan T30. MDA sebagai bahan aktif terdapat pada tablet dengan ID T2, T15 dan T24. Kafein dan ketamin sebagai komponen utama terdapat pada tablet dengan ID T5, T7, T11, T16 dan T26 sedangkan tablet yang ditambahkan zat pencampur (adultrans) kafein dan ketamin adalah tablet dengan ID T6, T8, T13, T17, T19, T22, T25, T27, T28, dan T30. Kafein sebagai pencampur juga terdapat pada tablet dengan ID T3, T9 dan T14 sedangkan ketamin sebagai pencampur pada tablet dengan ID T2, T15 dan T24. Dekstrometorpan sebagai zat pencampur terdapat pada tablet dengan ID T17 dan klorfenamin juga ditemukan sebagai pencampur pada tablet dengan ID T8. Piperazin sebagai komponen utama terdapat pada tablet dengan ID T4 dan T12 sedangkan sebagai impurities (pengotor) terdapat pada tablet dengan ID T6, T8, T13, T27 dan T28. Kloroquin sebagai komponen utama terdapat pada tablet dengan ID T21. MDMA sebagai impurities terdapat pada tablet dengan ID T2 dan T15. PMMA sebagai impurities terdapat pada tablet dengan ID T1, T6, T13, T20, T28 dan T29.
Analisis kandungan kimia dengan HPTLC-Spektrofotodensitometer menggunakan dua metode pemisahan analit yaitu sistem pengelusi TB (sikloheksan-toluene-dietilamin, 25 : 3 : 1 v/v) dan TAEA (toluene-aseton-etanol-amonia, 45 : 45 : 7 : 3 v/v). Masing-masing sistem menggunakan 4 senyawa standar pengkoreksi yaitu sistem TB menggunakan senyawa pengkoreksi theophylline (hRfc = 1), papaverine (nilai hRfc = 8), dextromethorphan (hRfc = 42) dan bromhexin (hRfc = 69). Untuk sistem TAEA menggunakan senyawa pengkoreksi morfin (hRfc = 8), kodein (nilai hRfc = 16), papaverin (hRfc = 55) dan bromhexin (hRfc = 83). Konfirmasi identitas setiap puncak kromatogram hasil pemisahan komponen penyusun tablet ekstasi menggunakan WinCATS-Speclib-tool (Camag-Switzerland) yang dilengkapi deteksi spektra insitu. Uji konfirmasi kandungan kimia dengan street-drugs library pada toleransi penyimpangan 7 atau (hRfc ± 7) dan kesesuian nilai korelasi spektrum UVnya dengan r > 0,85. Kandungan kimia dari 30 tablet ekstasi didapatkan 6 jenis senyawa yaitu MDMA (3,4- methylenedioxy metamphetamine), MDA (3,4-methylenedioxy amphetamine), ketamin, kafein, piperazin dan kloroquin. Senyawa aktif MDMA sebagai komponen utama terdapat pada tablet dengan ID T1, T3, T6, T8, T9, T10, T13, T14, T17, T18, T19, T20, T22, T23, T25, T27, T28, T29, dan T30. MDA sebagai bahan aktif terdapat pada tablet dengan ID T2, T15 dan T24. Kafein dan ketamin sebagai komponen utama terdapat pada tablet dengan ID T5, T7, T16 dan T26 sedangkan tablet yang ditambahkan zat pencampur (adultrans) kafein dan ketamin adalah tablet dengan ID T8, T17 dan T27. Kafein sebagai pencampur juga terdapat pada tablet dengan ID T3, T6, T9, T13, T14, T19, T22, T25, T28 dan T30 sedangkan ketamin sebagai pencampur pada tablet dengan ID T2, T15 dan T24. Piperazin sebagai komponen utama terdapat pada tablet dengan ID T4 dan T12 sedangkan sebagai impurities terdapat pada tablet
dengan ID T6 dan T13. Kloroquin sebagai komponen utama terdapat pada tablet dengan ID T21.
Hasil analisis “drugs profiling” tablet ekstasi dengan menggunakan instrumen GC-MS pada penelitian sebelumnya, diantaranya adalah penelitian yang dilakukan oleh Makino et al. (2003) dari 54 tablet ekstasi di Jepang didapatkan 9 kandungan aktif yaitu MDMA methylenedioxy metamphetamine), MDA (3,4-methylenedioxy amphetamine), MA (metamphetamine), ketamin, dan efedrin. Penelitian sebelumnya juga dilakukan oleh Wirasuta (2012) dengan menggunakan HPTLC-Spektrofotodensitometer pada 54 sampel tablet ekstasi ditemukan senyawa MDMA, BDB, DOET, ketamin, etil-MDA, PMA (paramethoxy-amphetamine) dan senyawa yang tidak termasuk turunan amfetamin yaitu kafein dan flurazepam.
5.2.1. Perbandingan Hasil Analisis Kandungan Kimia antara GC-MS dengan HPTLC- Spektrofotodensitometer
Perbandingan hasil analisis kandungan kimia sebagai komponen utama dan beberapa bahan tambahan (adulterants) dari 30 sampel tablet ekstasi dengan menggunakan dua instrumentasi yaitu GC-MS dan HPTLC-Spektrofotodensitometer dapat dilihat pada Tabel 5.2.
Tabel 5.2 Perbandingan hasil analisis kandungan kimia 30 tablet ekstasi
NO ID
Sampel
Hasil analisis kandungan kimia
GC-MS HPTLC-Densitometer
1 T1 MDMA, PMMA MDMA
2 T2 MDMA, MDA, ketamin MDA, Ketamin
3 T3 MDMA, kafein MDMA, kafein
4 T4 Piperazine Piperazine
5 T5 Kafein, ketamin Kafein, ketamin,
6 T6 MDMA, PMMA, kafein, ketamin, piperazin
MDMA, kafein, piperazin
7 T7 Kafein, ketamin Kafein, ketamin
8 T8 MDMA, kafein, ketamin, piperazin, klorfenamin
MDMA, kafein, ketamin
9 T9 MDMA, kafein MDMA, kafein
10 T10 MDMA MDMA
11 T11 Kafein, ketamin Kafein
12 T12 Piperazine Piperazine
13 T13 MDMA, PMMA, kafein, ketamin, piperazin
MDMA, kafein, piperazin
14 T14 MDMA, kafein MDMA, kafein
15 T15 MDMA, MDA, ketamin MDA, Ketamin
16 T16 Kafein, ketamin Kafein, ketamin,
17 T17 MDMA, kafein, ketamin MDMA, kafein, ketamin
18 T18 MDMA MDMA
19 T19 MDMA, kafein, ketamin, dekstrometorpan
MDMA, kafein
20 T20 MDMA, PMMA MDMA
21 T21 Kloroquine Kloroquine
22 T22 MDMA, kafein, ketamin MDMA, kafein
23 T23 MDMA MDMA
24 T24 MDA, ketamin MDA, ketamin
25 T25 MDMA, kafein, ketamin MDMA, kafein
26 T26 Kafein, ketamin, Kafein, ketamin,
27 T27 MDMA, kafein, ketamine, piperazin MDMA, kafein, ketamin 28 T28 MDMA, PMMA, kafein, ketamin,
piperazin
MDMA, kafein
29 T29 MDMA, PMMA MDMA
30 T30 MDMA, kafein, ketamin MDMA, kafein
Berdasarkan hasil analisis kandungan kimia dari 30 tablet ekstasi antara HPTLC-Spektrofotodensitometer dan MS terdapat beberapa hasil analisis GC-MS tidak dapat ditemukan dengan menggunakan HPTLC-Spektrofotodensitometer seperti sediaan MDMA pada tablet dengan ID T2 dan T15, PMMA pada tablet
dengan ID T1, T6, T13, T20 dan T29, sedian ketamin pada tablet dengan ID T6, T11, T13, T25, T28 dan T30 dan sediaan piperazin pada tablet dengan ID T8 dan T27. Adanya beberapa senyawa aktif yang tidak terdeteksi disebabkan oleh sistem pemisahan pada HPTLC tidak sebanding dengan pemisahan pada kolom GC-MS yang menggunakan kolom kapiler yang panjang dan selektif. Selain itu juga adanya perbedaan limit deteksi dan keterbatasan pustaka pembanding (library) pada HPTLC-Spektrofotodensitometer. Secara keseluruhan dari 30 tablet yang dianalisis dengan HTLC-Spektrofotodensitometer didapatkan kesesuian hasil analisis kandungan kimia terhadap hasil GC-MS adalah 72 %.
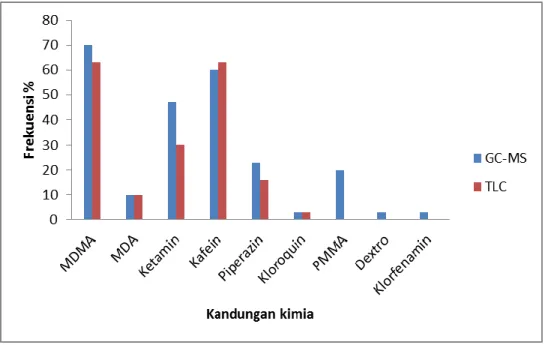
G rafik perbandingan prekuensi kandungan kimia yang terdapat pada 30 tablet ekstasi antara analisis menggunakan GC-MS dan HPTLC-Spektrofotodensitometer dapat dilihat pada Gambar 5.2.
Gambar 5.2. Grafik perbandingan Frekuensi hasil deteksi kandungan kimia antara GC-MS dan HPTLC- Spektrofotodensitometer.
Berdasarkan data kandungan bahan aktif dari hasil analisis dengan HPTLC-Spektrofotodensitometer dan GC-MS maka dari 30 tablet tersebut dapat
dikelompokkan menjadi 2 kelompok utama yaitu tablet yang mengandung ATS (Amphetamine Type Stimulan) dan yang tidak mengandung ATS sehingga dari data hasil analisis dua instrumen HPTLC- Spektrofotodensitometer dan GC-MS dapat dihitung persentase kesesuaian analisis HPTLC- Spektrofotodensitometer terhadap hasil GC-MS untuk mendeteksi tablet ATS. Adapun perbandingan hasil analisisnya dapat dilihat pada Tabel 5.3.
Tabel 5.3. Tabel kesesuaian hasil analisis HPTLC- Spektrofotodensitometer untuk mendeteksi tablet jenis ATS.
Grup Hasil GC-MS Hasil HPTLC ΣT ΣEr kesesuaian
(%) ATS T1, T2, T3, T6, T8, T9, T10, T13, T14, T15, T17, T18, T19, T20, T22, T23, T24, T25, T27, T28, T29, dan T30 T1, T2, T3, T6, T8, T9, T10, T13, T14, T15, T17, T18, T19, T20, T22, T23, T24, T25, T27, T28, T29, dan T30 22 0 100 NON ATS T4, T5, T7, T11, T12, T16, T21 dan T26 T4, T5, T7, T11, T12, T16, T21, dan T26 8 0 100 Keterangan:
ΣT = Jumlah analisis yang sesuai ΣEr = Jumlah analisis yang tidak sesuai
Berdasarkan perbandingan hasil analisis dari dua instrumen GC-MS dan HPTLC- densitometer maka dapat dihitung persentase kesesuaian analisis HPTLC- densitometer untuk membedakan tablet ATS dan non ATS adalah 100%.
5.2.2 Perbandingan Dendogram Tablet Ekstasi antara GC-MS dengan HPTLC-Spektrofotodensitometer.
Berdasarkan data yang didapat dari analisis 30 butir tablet dengan menggunakan instrumen GC-MS dan HPTLC-Spektrofotodensitometer maka dapat dilihat perbandingan hasil dendogram kedekatan hubungan antara satu tablet dengan tablet yang lainya dengan menggunakan perhitungan fungsi kosinus. Berdasarkan
data area puncak kromatogram dari komponen kimia masing-masing tablet dengan menggunakan perhitungan fungsi cosinus maka dari 30 tablet dapat dikelompokkan menjadi 9 grup dengan similirity level di atas 90. Dendogram dari 30 tablet yang dianalisis dengan dua instrumen tersebut dengan bantuan program MINITAB dengan complete lingkage dan correlattion coefficient distance dapat dilihat pada Gambar 5.3, 5.4 dan 5.5.
Gambar 5.3. Dendogram tablet ekstasi dengan metode analisis menggunakan GC-MS.
Keterangan:
- Variabel T1 s/d T30 = ID Sampel tablet
- Kesamaan warna pada garis dendogram dengan nilai similarity level di atas 90 menunjukan tablet pada grup yang sama.
Variables S im ila ri ty T21 T11 T19 T17 T14 T9 T27 T8 T7 T26 T16 T5 T24 T15 T2 T12 T4 T28 T13 T6 T29 T20 T3 T25 T30 T22 T23 T18 T10 T1 45.33 63.55 81.78 100.00 Samples by GC-MS
Gambar 5.4. Dendogram tablet ekstasi dengan metode analisis
menggunakan HPTLC-Spektrofotodensitometer sistem TB. Keterangan:
- Variabel T 1 s/d T30 = ID Sampel tablet
- Kesamaan warna pada garis dendogram dengan nilai similarity level di atas 90 menunjukan tablet pada grup yang sama.
Gambar 5.5. Dendogram tablet ekstasi dengan metode analisis
menggunakan HPTLC-Spektrofotodensitometer sistem TAEA. Keterangan:
- Variabel T1 s/d T30 = ID Sampel tablet
- Kesamaan warna pada garis dendogram dengan nilai similarity level di atas 90 menunjukan tablet pada grup yang sama.
Variables Si m ila ri ty T11 T27 T8 T26 T16 T7 T5 T24 T15 T2 T21 T12 T4 T19 T17 T14 T30 T25 T22 T9 T3 T23 T18 T10 T28 T13 T6 T29 T20 T1 36.65 57.76 78.88 100.00
Samples eluted by system TB
Variables Si m ila ri ty T21 T12 T4 T19 T17 T25 T14 T9 T11 T27 T8 T16 T26 T7 T5 T24 T15 T2 T18 T23 T10 T28 T20 T30 T29 T22 T3 T6 T13 T1 41.16 60.77 80.39 100.00
Perbandingan hasil pengelompokan 30 tablet berdasarkan dendogram atau hasil clauster yang menggunakan perhitungan fungsi cosinus dengan program MINITAB maka dapat dihitung tingkat kesesuian analisis HPTLC-Spektrofotodensitometer dalam analisis “drugs profiling” tablet ekstasi dengan hasil analisis GC-MS. Adapun hasil perhitungan perbandingan kesesuaian hasil analisisnya dapat dilihat pada Tabel 5.4.
Tabel 5.4.Tabel kesesuian analisis dengan metode HPTLC-Spektrofotodensitometer dengan sistem TB.
Grup GC-MS HPTLC sistem TB ΣT ΣEr Kesesuian
(%) I T11 T11 1 0 100 II T21 T21 1 0 100 III T2, T15, T24 T2,T15,T24 3 0 100 IV T6, T13, T28 T6,T13,T28 3 0 100 V T4, T12 T4,T12 2 0 100 VI T9,T14, T17, T19 T3,T9,T14,T17,T19,T22,T 25,T30 4 4 50 VII T20, T29 T1,T20,T29 2 1 66,7 VIII T5,T7,T8,T16,T26,T27 T5,T7,T8,T16,T26,T27 6 0 100 IX T1,T3,T10,T18,T22,T2, T25, T30 T10, T18, T23 3 5 37,5 Rata-rata 83,8 Keterangan:
ΣT = Jumlah analisis yang sesuai ΣEr = Jumlah analisis yang tidak sesuai
Tabel 5.5.Tabel kesesuian analisis dengan metode HPTLC-Spektrofotodensitometer dengan sistem TAEA.
Grup GC-MS HPTLC sistem TAEA ΣT ΣEr Kesesuian % I T11 T11 1 0 100 II T21 T21 1 0 100 III T2,T15,T24 T2,T15,T24 3 0 100 IV T6,T13,T28 T1,T3,T6,T13,T22,T29,T30 2 6 25 V T4, T12 T4,T12 2 0 100 VI T9,T14,T17,T19 T9,T14,T17,T19,T25 4 1 80 VII T20, T29 T20,T28 1 1 50 VIII T5,T7,T8,T16,T26,T27 T5,T7,T8,T16,T26,T27 6 0 100 IX T1,T3,T10,T18,T22,T23, T25,T30 T10, T18, T23 3 5 37,5 Rata-rata 77 Keterangan:
ΣT = Jumlah analisis yang sesuai ΣEr = Jumlah analisis yang tidak sesuai
Hasil perhitungan perbandingan kesesuian analisis “drugs profiling” tablet ekstasi antara menggunakan instrumen HPTLC-Spektrofotodensitometer dan GC-MS didapatkan nilai kesesuaian dengan persentase 83,8% pada sistem eluen TB dan 77% pada sistem eluen TAEA.
Berdasarkan perbandingan hasil analisis dendogram dimana nilai kepercayaan yang tertinggi didapatkan dengan menggunakan sistem TB yaitu 83,8 % nilai ini menujukan HPTLC-Spektrofotodensitometri dapat digunakan untuk claustering tablet ekstasi untuk merunut hubungan antara satu tablet dengan tablet yang lainnya dalam upaya memutus jaringan peredaran gelap narkoba khususnya ekstasi.
BAB VI
SIMPULAN DAN SARAN
6.1. Simpulan
B erdasarkan penelitian yang telah dilakukan maka dapat disimpulkan sebagai berikut:
1. Kesesuaian hasil analisis kandungan kimia tablet ekstasi menggunakan HPTLC-Spektrofotodensitometer adalah 72% terhadap hasil analisis GC-MS.
2. Perbandingan kesesuaian hasil analisis “drugs profiling” 30 tablet ekstasi dengan menggunakan instrumen HPTLC-Spektrofotodensitometer dengan menggunakan sistem eluen TB adalah 83,8% dan dengan sistem eluen TAEA adalah 77% terhadap hasil GC-MS.
6.2. Saran
Saran yang dapat disampaikan:
1. Hasil penelitian ini diharapkan dapat memberikan masukan kepada pihak-pihak terkait yang melakukan analisis “drugs profiling” tablet ekstasi sehingga memperoleh hasil analisis yang akurat.
2. Perlu dilakukan penelitian lebih lanjut untuk jenis narkotika yang lain. 3. Perlu ditambahkan pustaka pembanding (library) pada
HPTLC-Spektrofotodensitometer.