ABSTRAK. ISOLATION AND ANTIMICROBIAL ACTIVITY OF LACTIC ACID BAKTERIA (BAL) FROM YOGHURT INHIBITION GROWTH of Escherichia coli and Salmonella typhi.
Teks penuh
Gambar


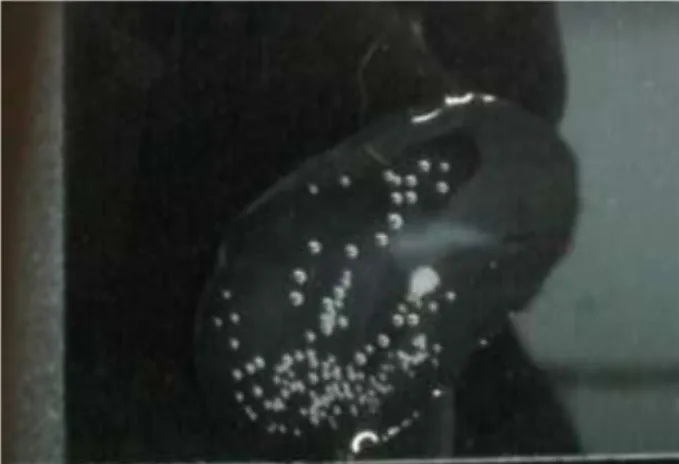
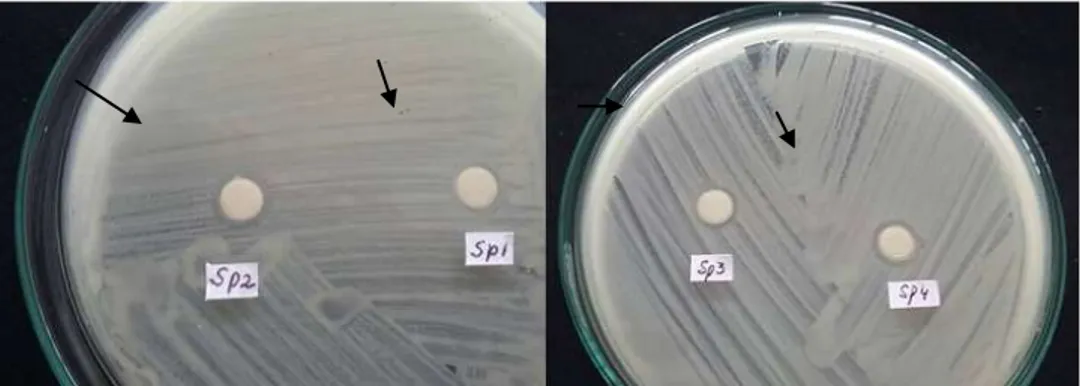
Dokumen terkait
Hasil olahan data dari penelitian ini menunjukkan bahwa x6 bernilai 0.034, yang mana dapat diartikan bahwa semakin spesifik lokasi dari departemen sistem informasi maka
Mengisi matrik perbandingan berpasangan yaitu dengan menggunakan bilangan untuk merepresentasikan kepentingan relatif dari satu elemen terhadap elemen lainnya yang dimaksud dalam
Snakes and Ladders Terhadap Kompetensi Pengetahuan Matematika Siswa 104 Problem solving adalah model mengajar yang digunakan oleh guru dalam proses pembelajaran yang meliputi
1) Relating; Guru menggunakan relating ketika mereka mencoba menghubungkan konsep baru dengan sesuatu yang telah diketahui oleh siswa. 2) Experiencing; Guru harus dapat
Dalam penelitian Indriani (2013) faktor-faktor yang berhubungan dengan status gizi buruk pada anak balita adalah pemberian makanan pendamping yang tidak
Kawalan pendedahan persekitaran Halang produk daripada memasuki longkang Jangan biarkan bahan mencemar sistem air dalam tanah Pihak berkuasa tempatan perlu dimaklumkan jika