10 The Indonesian Journal of Infectious Disease
ANALISIS FUNGSI ENZIMATIK PROTEIN KATG REKOMBINAN
DENGAN MUTASI BARU PADA MYCOBACTERIUM TUBERCULOSIS
YANG RESISTEN TERHADAP ISONIAZID
Tri Yuli Setianingsih
Program Studi Magister Ilmu Biomedik Fakultas Kedokteran Universitas Indonesia
Abstrak :Tuberkulosis masih menjadi masalah kesehatan utama di Indonesia. Salah satu penyebab tingginya kasus TB disebabkan adanya resistensi Mtb terhadap obat anti tuberkulosis. Isoniazid yang merupakan salah satu obat lini pertama dalam pengobatan TB adalah pro-drug yang akan diubah menjadi bentuk aktifnya melalui aktivitas protein KatG Mtb. Mutasi pada gen KatG yang mengkode protein KatG kemungkinan mempengaruhi aktivitas katalase dan peroksidase protein sehingga menyebabkan resistensi Mtb terhadap INH. Dalam studi ini,dilakukan kontruksi plasmid rekombinan protein KatG tipe liar dan protein KatG dengan mutasi baru pada residu N330D dan H400Y, serta mutasi yang umum dijumpai pada residu S315T dan S315N. Ekspresi protein
KatG rekombinan dilakukan menggunakan hostE.coli. Over ekspresi kelima protein rekombinan KatG terjadi
setelah induksi IPTG.Purifikasi protein KatG rekombinan dilakukan berdasarkan prinsip kromatografi afinitas menggunakan Ni sepharose.Setelah purifikasi diperoleh protein KatG yang murni.Aktivitas katalase dan peroksidase protein rekombinan KatG diukur pada berbagai konsentrasi substrat yang diperlukan dalam pengukuran efisiensi katalitik kedua aktivitas protein KatG.Hasilnya menunjukkan bahwa mutan protein KatG memiliki efisiensi katalitik lebih rendah dari protein KatG tipe liar.Penurunan efisiensi katalitik aktivitas katalase mutan N330D dan H400Y sebesar 31% dan 37% dan untuk aktifitas peroksidase sebesar 39% dan 3% dibandingkan KatG tipe liar.Struktur 3 dimensi protein KatG dari mutan tersebut dibuat menggunakan perangkat Modeller dan divisualisasikan menggunakan perangkat Pymol.Tidak terdapat adanya perubahan konformasi 3 dimensi protein KatG mutan dibandingkan dengan struktur 3 dimensi protein KatG tipe liar.Namun, letak residu N330D dan H400Y yang berada dekat daerah aktif ikatan INH pada protein KatG kemungkinan berpengaruh terhadap penurunan aktivitas enzimatik protein KatG.
Kata kunci : isoniazid, protein KatG, resistensi, efisiensi katalitik.
ANALYSIS OF ENZYMATIC FUNCTION OF RECOMBINANT KATG
PROTEINS HARBORING NEW MUTATIONS DERIVED FROM
IZONIAZID-RESISTANCEMYCOBACTERIUM TUBERCULOSIS
Abstract :Tuberculosis (TB) is currently a major health problem in Indonesia. One of the many causes of the high incident of TB is due to the resistance of the Mycobacterium tuberculosis (Mtb) to anti-TB drugs. Isoniazid (INH), one of the first line anti-TB drugs for TB treatment, is a pro-drug that is converted to its active form through the activity of Mtb KatG protein. Mutationsin the KatG gene encodingKatGmayaffect the catalytic efficiency ofthe catalaseandperoxidase activities of the protein that eventuallyconfers resistanceto INH. In this study, recombinant plasmidscontaining KatG gene that have new mutations on residue N330D dan H400Y, wild type, as well as mutant proteins with common mutations at residue S315T and S315N were constructed. Expression of recombinant KatGwas performed using E.coli as an expression host. Over expression of recombinant KatGwas facilitated by IPTG induction. Purification of recombinant KatGwas performed using affinity chromatography employing Nickel sepharose. Pure recombinant proteins were obtained, and the catalase and peroxidase activities of the recombinant KatG proteinwere measured at various concentration of substrates. Result showed that mutant KatGs have a lower catalytic efficiency for both catalase and peroxidase activities than the wild type protein. Decreasing catalytic efficiency for catalase of mutants N330D and H400Y were 31% and 37% than that of wild type KatG, while catalytic efficiency for peroxidase of mutants N330D and H400Y were 39% and 3% lower than that of wild type. Three dimensional structures of mutant KatGswere generated using Modeller and visualized using PyMol softwares. The three dimensional structural of mutant KatG showed no conformational change compared with that of wild type KatG. However, the location of residues N330D and H400Y where arein the close proximity to the active site of KatG for INH binding is likely to have an effect on the decreased enzymatic activities of mutant KatG proteins.The Indonesian Journal of Infectious Disease 11 Korespondensi :
Tri Yuli Setianingsih, S.Si., M. Biomed
RSPI Prof. Dr. Sulianti Saroso Jakarta, Jl.Baru Sunter Permai Raya Jakarta Utara 14340 Phone : 021-6506559 Fax: 021-6401411 Email : triyuli.setianingsih@gmail.com
PENDAHULUAN
Tuberkulosis (TB) masih menjadi salah satu masalah kesehatan utama di Indonesia. Jumlah kasus TB di Indonesia menempatiurutan keempat di dunia setelah India, China dan Afrika Selatan.1Tingginya insiden kasus TB di Indonesia disebabkan oleh beberapa faktor antara lain pengobatan yang tidak teratur dan pemakaian obat tunggal. Pengobatan TB yang efektif diperlukan untuk mengurangi kasus TB.Saat ini, pengobatan TB yang direkomendasikan oleh WHO terdiri dari Obat Anti Tuberkulosis (OAT)lini pertama dan OAT lini kedua. OAT yang termasuk lini pertama yaitu isoniazid (INH), rifampisin (RIF), ethambutol (EMB) dan pyrazinamide (PZA).2–4OAT yang diberikan dalam pengobatan TB mempunyai mekanisme kerja yang saling mendukung dalam membunuh bakteri patogen Mtb.5-9
Resistensi Mtb terhadapINH telah banyak dihubungkan dengan berbagai mutasi yang terjadi pada gen KatG yang merupakan gen pengkode protein katalase-peroksidase (KatG).Persentasi mutasi yang berhubungan dengan gen tersebut adalah sekitar 60%. Gen KatG Mtb yang mengkode protein KatG mempunyai peran dalam mengaktivasi INH menjadi bentuk aktifnya. Aktivasi INH akan menghasilkan senyawa radikal isonicotinoyl acil yang jika dikombinasikan dengan NAD+/NADH akan membentuk isoniazid-NADH adduct yang merupakan penghambat potensial terhadap fungsi kerja InhA dan KasA10-13Gen KatG terdiri dari 2.223 nukelotida dan mengkode protein KatG yang mempunyai berat molekul 80 kDa.14,15 Mutasi yang terjadi pada gen KatG selain berpengaruh terhadap aktivasi INH, juga berpengaruh terhadap efisiensi katalitik aktivitas katalase dan peroksidase protein KatG16-17
Berdasarkan pemodelan struktur 3 dimensi protein KatG diketahui bahwa daerah ikatan aktif INH terdapat di sekitar δ-meso dari sisi heme.18 Daerah mutasi
protein KatG yang bervariasi akan mengakibatkan terjadi tingkat resistensi yang berbeda. Mutasi yang terjadi di sekitar daerah aktif akan mengakibatkantingkat resistensi yang tinggi dan akan mempengaruhi aktivasi INH.19
Survey epidemiologi TB yang telah dilakukan di Makassar pada tahun
2007-2011 memberikan gambaran bahwa
terdapat resistensi Mtb terhadap INH yang cukup banyak.20 Dari sejumlah 269 pasien TB, ditemukan sebanyak 78 sampel yang resisten terhadap INH. Dari 78 sampel yang resisten terhadap INH, 57 sampel (70 %) memiliki mutasi pada gen KatG dan ditemukan 9 mutasi titik pada 57 sampel tersebut. Mutasi terbanyak, yakni sebanyak 39 sampel memiliki mutasi pada kodon 315.21 Berdasarkan penelusuran literatur melalui Pubmed dan database online mengenai mutasi-mutasi Mtb, diketahui bahwa terdapat dua mutasi baru yang ditemukan dari survey epidemiologi TB yang dilakukan di Makassar.22 Kedua mutasi tersebut yaitu substitusi pada kodon 330 dengan perubahan asam amino asparagin menjadi asam aspartat (N330D) dan kodon 400 dengan perubahan asam
amino histidin menjadi tirosin
(H400Y).Tujuan penelitian ini adalah untuk mengetahui pengaruh kedua mutasi tersebut terhadap resistensi INH dan untuk mengetahui perubahan struktur tiga dimensi protein KatG sebagai akibat adanya mutasi baru tersebut.Untuk itu dibuat konstruks rekombinan mutan KatG dengan mutasiN330D dan H400Y yang diselipkan ke dalam plasmid ekspresi pColdII.Setelah itu, dilakukan ekspresi protein rekombinan kedua mutan tersebut dan dipurifikasi,sertadiukur aktivitas katalase serta aktivitas peroksidasenya. Selain itu konstruksi, ekspresi rekombinan protein, pengukuran aktivitas katalase dan peroksidaseprotein rekombinanKatG tipe liar dan mutan KatGyang umum ditemukan juga dilakukan sebagai kontrol dan pembanding. Dibuat modelstruktur tiga dimensi mutan KatGuntuk melihat efek mutasi tersebut terhadap konformasi struktur protein.
12 The Indonesian Journal of Infectious Disease METODOLOGI
DNA Mutan Mtb
Studi ini mengguji mutan Mtb yang mempunyai mutasi gen KatGpada kodon N330D, dan H400Y. Selain itu, Mtb tipe liar dan mutan S315 yang sering dijumpai dalam resistensi Mtb terhadap isoniazid digunakan sebagai kontrol dan pembanding dalam penelitian ini. Keseluruhan DNA tipe liar dan mutan Mtb diperoleh dari koleksi Laboratorium Tuberkulosis Lembaga Eijkman.
Konstruksi Plasmid Ekspresi Protein Rekombinan KatG
Protein KatG rekombinan dikonstruksi pada plasmid pColdII (Takara Bio Inc). Plasmid ini merupakan vektor ekspresi
pada host E. coliyang mampu
mengekspresikan protein pada temperatur rendah. Plasmid ini didesain memiliki promoter yang berasal dari gen cspA
(cold-shock gene). Cetakan DNA gen KatG yang
digunakan sebagai sisipan dalam proses kloning didapatkan dengan mengamplifikasi gen KatG menggunakan primer KatGWG-F
(GTATTAGAATTCGTGCCCGAGC) dan
KatGWG-R
(GATAATGAATTCTCAGCGCACGTC). Kedua primer mengandung sekuens restriksi EcoRI.Proses amplifikasi dilakukan menggunakan enzim HotStar Taq DNA
polymerase (Qiagen). Preparasi sisipan
gen KatG dan vektor plasmid pColdII dilakukan dengan digesti menggunakan protein restriksi endonuklease EcoRI (New
England Biolabs). Pengecekan
keberhasilan kloning dilakukan dengan amplifikasi PCR daerah gen KatG, digesti plasmid yang mengandung sisipan gen
KatGdengan EcoRI dan sekuensing gen KatG dalam plasmid.
Ekspresi Protein Rekombinan KatG Ekspresi dilakukan dengan menginduksi kulturE.coli yang mengandung plasmid dengan sisipan gen KatG menggunakan IPTG. Optimasi dilakukan pada berbagai konsentrasi IPTG untuk menghasilkan over ekspresi protein KatG.Keberhasilan
ekspresi protein KatG ditandai dengan didapatkannya pita tebal sebesar ± 80 kDa pada supernatant/clear lysate setelah
elektroforesis SDS-PAGE. SDS-PAGE dilakukan sesuai dengan metode standar.23 Purifikasi Protein Rekombinan KatG
Purifikasi protein rekombinan dilakukan menggunakan Ni-SepharoseTM 6 Fast Flow (GE Healthcare). Keberhasilan purifikasi
diamati menggunakan SDS-PAGE.
Verifikasi hasil purifikasi dilakukan menggunakan Western blotting dengan metode standar23 terhadap eluat yang dihasilkan dari proses purifikasi. Antibodi yang digunakan dalam prosedur Western
blotting yaitu QIAexpress® Anti-His HRP Conjugate Kits (Qiagen).
Pengukuran Aktivitas Katalase dan Peroksidase Protein Rekombinan KatG
Aktivitas katalase diukur menggunakan
Catalase Activity Assay kit (Biovision).
Pengukuran aktivitas dilakukan pada beberapa konsentrasi substrat H2O2 (1 mM;
3 mM; 5 mM; 7 mM dan 9 mM). Aktivitas
peroksidase diukur menggunakan
Glutathione Peroxidase Activity Assay kit
(Biovision). Pengukuran aktivitas dilakukan pada beberapa konsentrasi NADPH (20 mM; 40 mM; 60 mM; 80 mM; dan 100 mM). Pengukuran parameter kinetik kcat dan Km diperoleh dari regresi non linear kurva Michaelis-Menton menggunakan aplikasi GraphPad Prism (http://www. graphpad. com).
Pemodelan Struktur 3 Dimensi Mutan Protein KatG
Pemodelan struktur 3 dimensi protein
KatG keempat mutan dilakukan menggunakan perangkat Modeller24 dan hasilnya divisualisasikan menggunakan perangkat PyMol.25 Hasil pemodelan keempat mutan protein KatG juga dibandingkan dengan struktur 3 dimensi protein KatG tipe liar untuk mengetahui ada tidaknya perbedaan antara kedua struktur 3 dimensi protein KatG. Dilihat juga apakah posisi residu mutan KatG berada dekat residu active site INH pada protein KatG.
HASIL
Kontruksi Plasmid Ekspresi protein Rekombinan KatG
Amplifikasi gen KatG kelima strain Mtb menghasilkan target DNA sebesar 2.223
The Indonesian Journal of Infectious Disease 13
± 80kDa M 1 2 3 4 5 6 7
bp. Proses kloning diawali dengan dilakukannya digesti secara terpisah terhadap gen KatG kelima strain Mtb dan juga plasmid pColdII. Hasil transformasi menghasilkan klon bakteri yang diduga mengandung plasmid rekombinan dengan sisipan gen KatG. Plasmid rekombinan yang mengandung sisipan gen KatG mempunyai panjang 6.615 bp, seperti ditunjukkan pada Gambar 1. Pengecekan keberhasilan kloning menunjukkan bahwa terdapat plasmid rekombinan yang memiliki sisipan gen KatG yang tepat dalam pembacaan kodonnya (in frame) dan ada yang tidak. Plasmid rekombinan yang positif mengandung sisipan gen KatG setelah melalui pengecekan keberhasilan kloning digunakan dalam proses ekspresi protein rekombinan KatG.
Gambar 1. Peta plasmid pColdII dengan sisipan gen KatG didalamnya.
Ekspresi dan Purifikasi Protein
Rekombinan KatG
Hasil optimasi ekspresi protein menunjukkan bahwa terjadi over ekspresi protein KatG setelah diinduksi IPTG dengan konsentrasi 0,1 mM untuk strain mutan S315N dan tipe liar H37Rv; 0,2 mM untuk strain mutan S315T, H400Y, dan N330D. Secara keseluruhan, proses kultur pada suhu rendah 15°C memberikan hasil yang lebih baik dalam menginduksi terjadinya over ekspresi protein KatG
dibandingkan suhu 37°C. Untuk
mendapatkan protein KatG murni, kultur tersebut dipurifikasi menggunakan Ni-sepharose. Hasilnya menunjukkan bahwa purifikasiberjalan optimal dengan didapatkannya eluat hasil purifikasi yang
cukup bersih, seperti terlihat pada Gambar 2.Tidak terdapat pita protein lain selain protein KatG dengan panjang 80 kDa setelah elektroforesis SDS-PAGE.
Pengecekan keberhasilan ekspresi dan purifikasi protein KatG menggunakan
Western blotting menunjukkan bahwa eluat
merupakan protein yang mempunyai poli-histidin, salah satunya yaitu protein KatG.
Gambar 2.Hasil pelisisan dan purifikasi ekspresi protein rekombinan KatG. Lajur M, marka protein; 1, kultur tanpa penambahan IPTG; 2, pelet hasil pelisisan membran sel E.coli; 3, supernatan hasil pelisisan membran sel E.coli; 4, flow through hasil purifikasi protein; 5, wash
fraction hasil purifikasi protein; 6& 7, eluat hasil
purifikasi protein
Aktifitas Katalase dan Peroksidase Protein KatG
Protein KatG dengan mutasi baru, N330D dan H400Y, memiliki aktivitas katalase yang lebih rendah daripada aktivitas katalase tipe liar,namun masih lebih tinggi dibandingkan protein KatG dengan mutasi yang umum dijumpai (Gambar 3). Aktivitas peroksidase protein
KatG tipe liar sedikit lebih tinggi dibandingkan dengan mutan protein KatG (Gambar 4). Keempat mutan protein KatG memiliki grafik aktivitas peroksidase yang tidak terlalu berbeda.Terjadi penurunan efisiensi katalitik yang digambarkan oleh rasio kcat/Kmkedua aktivitas katalase dan
peroksidase mutan protein KatG
dibandingkan dengan protein KatG tipe liar, seperti tercantum pada Tabel 1.
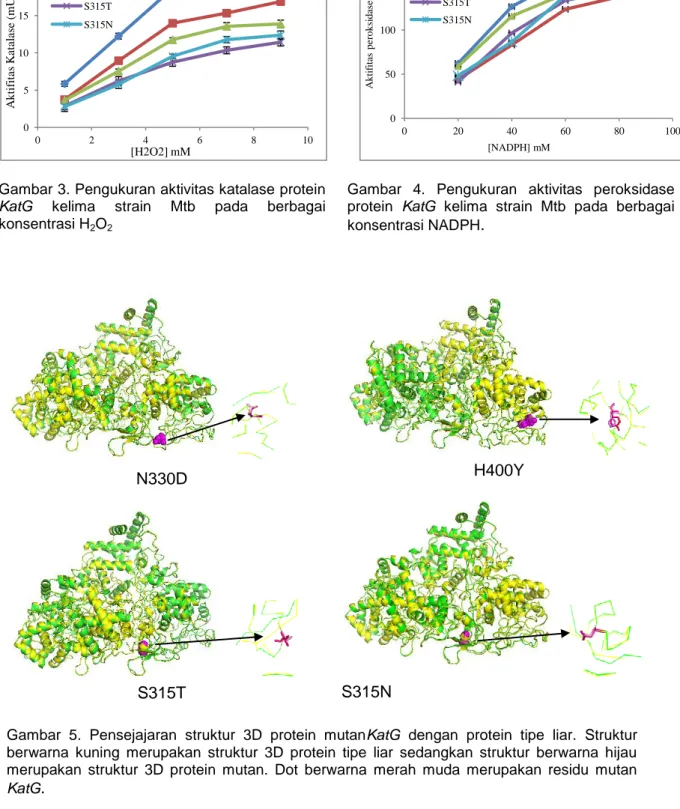
Struktur 3D mutan protein KatG
Hasil pensejajaran model struktur 3D keempat mutan protein KatG dengan protein KatG tipe liar PDB No. 1SJ2 yang ditampilkan pada Gambar 5 menunjukkan
14 The Indonesian Journal of Infectious Disease berbedaantara protein tipe liar dengan
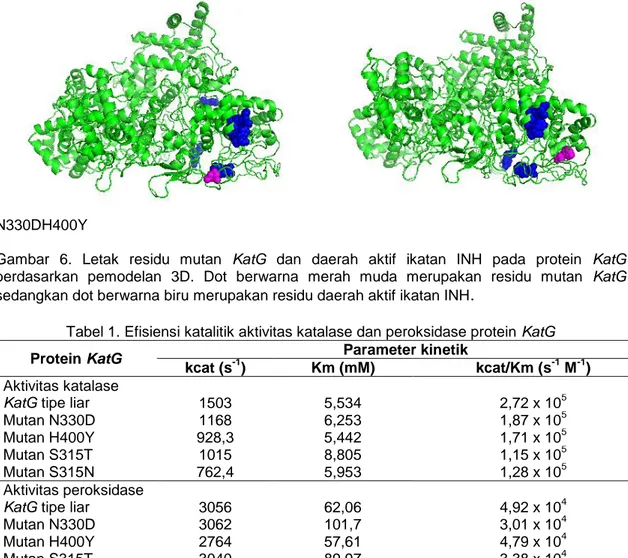
keempat mutan N330D, H400Y, S315T dan S315N. Kelima model protein KatG memiliki struktur 3D yang sama. Berdasarkan pemodelan 3D protein KatG mutan N330 dan H400, terlihat bahwa
residu 330 dan 400 berdekatan dengan residu 300 (Gambar 6).Residu 300 merupakan residu yang terletak pada daerah aktif ikatan INH sehingga berpengaruh terhadap aktivasi pro-drug INH.
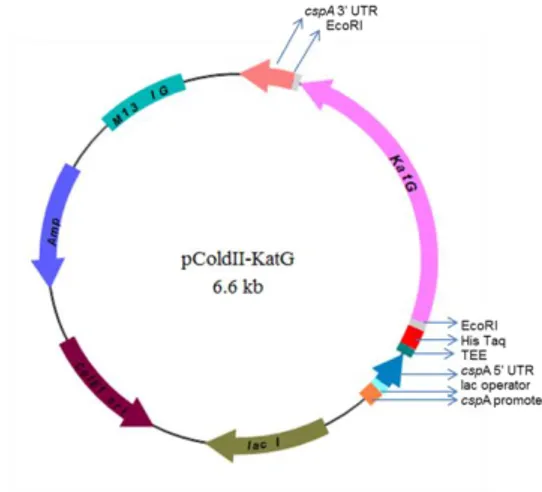
Gambar 3. Pengukuran aktivitas katalase protein
KatG kelima strain Mtb pada berbagai
konsentrasi H2O2
Gambar 4. Pengukuran aktivitas peroksidase protein KatG kelima strain Mtb pada berbagai konsentrasi NADPH.
N330D
S315T
H400Y
S315N
Gambar 5. Pensejajaran struktur 3D protein mutanKatG dengan protein tipe liar. Struktur berwarna kuning merupakan struktur 3D protein tipe liar sedangkan struktur berwarna hijau merupakan struktur 3D protein mutan. Dot berwarna merah muda merupakan residu mutan
KatG. 0 5 10 15 20 25 0 2 4 6 8 10 A k ti fi ta s K at al ase ( mU /n g ) [H2O2] mM H37Rv N330D H400Y S315T S315N 0 50 100 150 200 0 20 40 60 80 100 A kti fit as pe roks ida se ( m U/ng ) [NADPH] mM H37Rv N330D H400Y S315T S315N
The Indonesian Journal of Infectious Disease 15 N330DH400Y
Gambar 6. Letak residu mutan KatG dan daerah aktif ikatan INH pada protein KatG berdasarkan pemodelan 3D. Dot berwarna merah muda merupakan residu mutan KatG sedangkan dot berwarna biru merupakan residu daerah aktif ikatan INH.
Tabel 1. Efisiensi katalitik aktivitas katalase dan peroksidase protein KatG
Protein KatG Parameter kinetik
kcat (s-1) Km (mM) kcat/Km (s-1 M-1)
Aktivitas katalase
KatG tipe liar 1503 5,534 2,72 x 105
Mutan N330D 1168 6,253 1,87 x 105
Mutan H400Y 928,3 5,442 1,71 x 105
Mutan S315T 1015 8,805 1,15 x 105
Mutan S315N 762,4 5,953 1,28 x 105
Aktivitas peroksidase
KatG tipe liar 3056 62,06 4,92 x 104
Mutan N330D 3062 101,7 3,01 x 104
Mutan H400Y 2764 57,61 4,79 x 104
Mutan S315T 3040 89,97 3,38 x 104
Mutan S315N 3709 117,9 3,15 x 104
PEMBAHASAN
Survey epidemiologi TB yang dilakukan di Makassar pada tahun 2007-2011 menemukan 2 mutasi baru pada gen KatG yang resisten terhadap INH yaitu mutasi pada kodon N330D dan H400Y.Fungsi enzimatik protein KatGdengan mutasi baru tersebut terhadap aktivitas enzimatik katalase dan peroksidase protein KatG mutan belum diketahui.Studi ini dilakukan untuk menganalisis fungsi enzimatik protein KatG dengan mutasi baru tersebut.Untuk ini maka dibuat konstruksi plasmid rekombinan kedua mutan KatGke dalam plasmid ekspresi pColdII.Hasil ekspresi dipurifikasi dandiukur aktivitas katalase serta aktivitas peroksidasenya. Konstruksi, ekspresi rekombinan protein, pengukuran aktivitas katalase dan peroksidaseprotein rekombinanKatG tipe
liar dan mutan KatGyang umum
ditemukan serta berhubungan dengan resistensi Mtb terhadap INH yaitu KatG S315T dan S315N dilakukan sebagai kontrol dan pembanding. Struktur 3D keempat mutan dibuat modelnya untuk melihat adanya efek dari mutasi tersebut terhadap konformasi struktur dan posisi residu mutan baru terhadap daerah ikatan aktif INH pada protein KatG.
Proses pembuatan plasmid
rekombinan protein KatG tipe liar dan keempat mutan KatG yang akan diukur efisiensi katalitiknya diawali dengan amplifikasi gen KatG kelima strain Mtb. Hasil amplifikasi digunakan untuk proses kloning ke dalam hostE.coli. Pengecekan ketepatan orientasi sisipan gen KatG di dalam plasmid pColdII (in frame)
dilakukan dengan sekuensing daerah 5’- dan 3’- gen KatG tepat pada daerah
16 The Indonesian Journal of Infectious Disease perlekatan gen KatG dalam plasmid
rekombinan dan keseluruhan gen
KatGyang diperlukan untuk memastikan
bahwa memang terdapat mutasi titik pada plasmid rekombinan pada posisi asam amino 330, 400 dan 315. Berdasarkan hasil sekuensing, plasmid rekombinan yang mengandung gen KatG tipe liar dan keempat mutan gen KatG yang in frame dan memiliki mutasi yang sesuai digunakan dalam proses ekspresi protein
KatG.
Dalam genom Mtb, ekspresi protein
KatG dipromotori oleh PfurA dan PKatG.26Dalam proses rekombinasi menggunakan vektor ekspresi pColdII, transkripsi protein KatG dikendalikan oleh promoter cspA, lac operon dan lacI yang diinduksi oleh IPTG.27-28Ekspresi protein rekombinan KatG dihasilkan di daerah intraseluler sel E.coli. Untuk dapat mengeluarkan protein KatG dari sel
host,pelisisan dinding sel dilakukan secara
enzimatik maupun mekanik dengan lisozim, dan sonikasi.Pengukuran aktivitas katalitik protein KatG memerlukan protein rekombinan yang tetap terjaga aktivitas biologisnya.Oleh karena itu, protein dalam bentuk soluble dan native yang berada di supernatan digunakan untuk keperluan
ini.Untuk mendapatkan protein
rekombinan KatG yang murni, dilakukan purifikasi menggunakan kolom
Ni-sepharose berdasarkan prinsip
kromatografi afinitas. Plasmid pColdII mempunyai penanda poli-histidin pada N-terminal daerah multiple cloning site, menggabungkan residu histidin pada protein rekombinan KatG sehingga memudahkan proses purifikasi protein rekombinan KatG.29 Eluat hasil purifikasi
protein rekombinan KatG hanya
menunjukkan pita protein KatG yang menandakan bahwa proses purifikasi berjalan optimal (Gambar 2).
Grafik pengukuran aktivitas katalase pada berbagai konsentrasi substrat H2O2
memperlihatkan bahwa keempat mutan protein KatG pada residu 330, 400 dan 315 memiliki aktivitas yang lebih rendah dibandingkan dengan protein KatG tipe liar (Gambar 3). Penurunan aktivitas katalase beberapa mutan KatG yang berasal dari isolat klinis maupun mutan laboratorium dengan mutagenesis juga
telah dilaporkan.12,13,16,17 Grafik pengukuran aktivitas peroksidase pada
berbagai konsentrasi NADPH
menunjukkan bahwa aktivitas peroksidase protein KatG tipe liar sedikit lebih tinggi dibandingkan dengan mutan protein KatG. Keempat mutan protein KatG memiliki grafik aktivitas peroksidase yang tidak terlalu berbeda(Gambar 4).
Parameter kinetik berupa kcat dan Km
diperoleh menggunakan aplikasi
GraphPad Prism.Besarnya nilai Km berlawanan dengan tingkat afinitas pengikatan substrat oleh protein KatG. Makin tinggi nilai Km maka makin rendah afinitas pengikatan substrat oleh protein.30,31 Mutan KatG memiliki nilai Km katalase dan peroksidase yang lebih tinggi dibandingkan tipe liar KatG kecuali mutan N400, menandakan bahwa mutan N330 dan S315 memiliki afinitas pengikatan H2O2 dan NADPH yang rendah. Nilai kcat
menggambarkan jumlah substrat yang diubah oleh protein per detik. Makin besar nilai kcat maka makin tinggi kemampuan protein dalam mengurai substratnya.30,31 Nilai kcat aktivitas katalase keempat mutan KatG lebih kecil dibandingkan KatG tipe liar menandakan bahwa kemampuan mutan KatG dalam menguraikan H2O2
lebih rendah daripada tipe liar. Aktivitas peroksidase protein KatG menunjukkan bahwa kemampuan mutan H400Y dan S315T dalam mereduksi glutation yang sebanding dengan penurunan NADPH lebih rendah dibandingkan dengan KatG tipe liar.
Efisiensi katalitik aktivitas katalase dan peroksidase keempat mutan KatG lebih
rendah dibandingkan KatG tipe
liar.Tingginya nilai kcat dan rendahnya nilai Km mutan KatG dibandingkan tipe liar menghasilkan nilai efisiensi katalitik aktivitas katalase dan peroksidase keempat mutan KatG yang lebih rendah dibandingkan tipe liar. Mutasi gen KatG memberikan efek negatif terhadap aktivitas katalitik protein KatG sehingga
berpengaruh terhadap menurunnya
efisiensi katalitik mutan KatG. Mutan N330D dan H400Y mengalami penurunan efisiensi katalitik katalase sebesar 31% dan 37% dari nilai KatG tipe liar. Efisiensi katalitik peroksidase mutan N330D dan
The Indonesian Journal of Infectious Disease 17
H400Y sebesar 39% dan 3% lebih rendah dari nilai KatG tipe liar (Tabel 1).
Secara fisiologis protein KatG berperan dalam pertahanan Mtb terhadap reactive
oxidative intermediate (ROI) makrofag
seperti H2O2, O2-, dan .OH.Dengan
adanya protein KatG, ROI yang bersifat racun terhadap Mtb diubah menjadi zat yang tidak berbahaya.30 Penurunan aktivitas katalase dan peroksidase mutan protein KatG menyebabkan kemampuan Mtb dalam mengoksidasi ROI menjadi berkurang. Selain KatG, mekanisme pertahanan Mtb terhadap ROI difasilitasi oleh peran enzim superoxide dismutase dan alkylhydroperoxide reductase.17,32 Peran mutan KatG dalam pertahanan terhadap ROI digantikan oleh fungsi enzim tersebut.
Pensejajaran mutan KatG dengan
KatG tipe liar (PDB No. 1SJ2) menunjukkan bahwa tidak terjadi perubahan 3D protein mutan KatG (Gambar 5). Perubahan 1 asam amino tidak akan merubah model 3D protein
KatG secara signifikan. Mutasi keempat
mutan KatG yang digunakan dalam penelitian ini termasuk dalam mutasi titik dengan substitusi satu basa.Mutasi tersebut menyebabkan perubahan asam amino pada residu 330, 400 dan 315.
Seperti enzim katalase-peroksidase bakteri lain, KatG Mtb juga terdiri dari 3 domain yaitu N-terminal, domain ikatan katalitik heme, dan C-terminal. Lima puluh empat residu awal pada KatG merupakan domain N-terminal, domain ikatan katalitik heme meliputi residu 55-423, dan residu 424-740 selanjutnya merupakan residu yang berada di C-terminal.16 Ketiga residu (N330, H400, dan S315) pada penelitian ini terletak pada daerah ikatan katalitik heme sehingga walaupun tidak terdapat perubahan 3D yang signifikan pada mutan tersebut, namun kemungkinan tetap berpengaruh terhadap penurunan aktivitas katalitik KatG terhadap INH.
Sisi aktif ikatan INH pada protein KatG berpengaruh terhadap resistensi Mtb. Beberapa residu protein KatG telah terbukti merupakan sisi aktif ikatan INH pada protein KatG. Residu yang terletak pada sisi aktif ikatan INH antara lain residu R104, W107, H108, N138, Y229, dan W300.17,18 Residu N330D dan H400Y
terletak di dekat sisi aktif ikatan INH pada protein KatG. Berdasarkan pemodelan 3D protein KatG terlihat bahwa residu N330 dan H400 berada dekat dengan residu W300 (Gambar 6). Walaupun tidak terjadi perubahan konformational 3D protein mutan KatG namun posisi residu N330 dan H400 yang berada di dekat sisi aktif
pengikatan INH kemungkinan
berpengaruh terhadap ketidakmampuan
aktivasi INH oleh KatG. Tidak
teraktivasinya INH menyebabkan tidak terbentuknya INH–NADH adduct yang merupakan inhibitor InhA sehingga menyebabkan resistensi terhadap INH.
Studi ini merupakan studi awal mengenai hubungan antara mutasi pada gen KatG dengan resistensi Mtb terhadap INH. Efisiensi katalitik aktivitas katalase
dan peroksidase belum secara
menyeluruh menggambarkan resistensi Mtb terhadap INH. Beberapa studi bahkan melaporkan peningkatan aktivitas peroksidase mutan KatG.12,17 Letak residu
memegang peranan penting dalam
mekanisme resistensi INH,namun terdapat faktor lain seperti tipe oksidan, stabilitas protein dan ikatan INH pada KatG yang juga berperan dalam penentuan resistensi INH. Oleh karena itu, data lanjutan mengenai aktivitas mutan KatG dalam mengoksidasi INH, aktivitas pembentukan INH-NADH adduct oleh mutan KatG dan konsentrasi penghambatan minimal INH oleh bakteri yang mempunyai mutasi pada gen KatG diperlukan untuk melihat hubungan secara menyeluruh antara mutasi gen KatG dengan resistensi terhadap INH.
KESIMPULAN
1. Plasmid rekombinan protein KatG tipe liar dan yang mempunyai mutasi pada residu N330D, H400Y, S315T, dan S315N telah berhasil dikonstruksikan menggunakan vektor ekspresi pColdII. 2. Over ekspresi rekombinan protein KatG
tipe liar dan mutan KatGN330D, H400Y, S315T, dan S315N di E. coli telah didapatkan dengan menggunakan IPTG sebagai penginduksi ekspresi protein.
18 The Indonesian Journal of Infectious Disease 3. Diperoleh protein KatG murni melalui
proses purifikasi menggunakan metode kromatografi afinitas.
4. Mutan protein KatG memiliki efisiensi katalitik lebih rendah dari protein KatG tipe liar baik untuk aktivitas katalase maupun aktivitas peroksidase.
5. Struktur 3 dimensi protein mutan baru
KatG menunjukkan tidak adanya perubahan konformasi protein mutan
KatG dibandingkan dengan protein KatG tipe liar.
SARAN
1. Perlu dilakukan pemodelandocking mutan protein KatG terhadap INH untuk mengetahui apakah residu mutan tersebut berpengaruh langsung terhadap aktivasi INH oleh protein
KatG.
2. Perlu dilakukan studi lanjutan mengenai aktivitas mutan protein KatG dalam mengoksidasi INH, aktivitas pembentukan INH-NADH adduct oleh
mutan KatG dan konsentrasi
penghambatan minimal INH oleh Mtb yang mempunyai mutasi pada gen
KatG.
DAFTAR PUSTAKA
1. World Health Organization. Global tuberculosis control. WHO Report 2011. 2012.
2. Tripathi RP, Bisht SS, Ajay A, Sharma A, Misra M, Gupt MP, et al. Developments in chemical approaches to treat tuberculosis in the last decade. Curr Med Chem. 2011;19:488-517. 3. Johnson R, Streitcer ER, Louw GE,
Warren RM, Van Helden PD, Victor TC, et al. Drug resistance in Mycobacterium
tuberculosis. Curr Issues Mol Biol.
2006;8: 97–111.
4. World Health Organization. Anti-tuberculosis drug resistance in the world.The WHO/IUALTD Global Project on Anti-Tuberculosis Drug Resistance Surveillance. 2008;4.
5. Winder FG, Collins PB. Inhibition by isoniazid of synthesis of mycolic acids in Mycobacterium tuberculosis.J Gen Microbiol. 1997;63:41–8.
6. Somoskovi A, Parsons LM, Salfinger M. The molecular basis of resistance to isoniazid, rifampin, and pyrazinamide in
Mycobacterium tuberculosis.Respir
Res. 2001;2:164–8.
7. Mokrousov I, Narvskaya O,
Limeschenko E, Otten T, Vyshnevskiy B. Detection of ethambutol-resistant
Mycobacterium tuberculosis strains by
multiplex allele-specific PCR assay targeting embB306 mutations. J Clin Microbiol. 2002;40:1617–20.
8. Zhang Y, Wade MM, Scorpio A, Zhang H, Sun Z. Mode of action of
pyrazinamide: disruption of
Mycobacterium tuberculosis membrane
transport and energetics by pyrazinoic acid. J Antimicrob Chemother. 2003;52:790–5.
9. World Health Organization. Multidrug and extensively drug-resistant TB (M/XDR-TB).2010 Global Report on Surveillance and Response. 2010. 10.Siqueira HR, Freitas FAD, Oliveira DN,
Barreto AMW, Dalcolmo MP, Albano RM, et al.Isoniazid-resistant
Mycobacterium tuberculosis strains arising from mutations in two different regions of the KatG gene. J Bras Pneumol. 2009;35:773–9.
11.Weinberg MA, Mark AW. Isoniazid, the
frontline of resistance in
Mycobacterium tuberculosis.McGill J
Med. 2002;6:114–23.
12.Ghiladi RA, Medzihradszky KF, Rusnak FM, Ortiz de Montellano PR. Correlation between isoniazid resistance and superoxide reactivity in
Mycobacterium tuberculosisKatG. J Am
Chem Soc. 2005;127:13428–42.
13.Yu S, Chouchane S, Magliozzo RS. Characterization of the W321F mutant of Mycobacterium tuberculosis
catalase-peroxidase KatG.Protein Sci. 2002;11:58–64.
14.Heym B, Zhang Y, Poulet S, Young D, Cole ST. Characterization of the KatG gene encoding a catalase-peroxidase required for the isoniazid susceptibility of Mycobacterium tuberculosis. J Bacteriol. 1993;175:4255–9.
15.Pierattelli R, Banci L, Eady NAJ, Bodiguel J, Jones JN, Moody PCE, Raven EL, Jamart-Gregoire B, Raven EL, Brown KA, et al.
Enzyme-The Indonesian Journal of Infectious Disease 19
catalyzed mechanism of isoniazid activation in class I and class III
peroxidases. J Biol Chem.
2004;279:3900–9.
16.Wei C-J, Lei B, Musser JM, Tu S-C. Isoniazid activation defects in
recombinant Mycobacterium
tuberculosis catalase-peroxidase (KatG) mutants evident in InhA inhibitor production. Antimicrob Agents Chemother. 2003;47:670–5.
17.Cade CE, Dlouhy AC, Medzihradszky KF, Salas-Castillo SP, Ghiladi RA. Isoniazid-resistance conferring
mutations in Mycobacterium
tuberculosis KatG: catalase, peroxidase, and INH-NADH adduct formation activities. Protein Sci. 2010;19:458–74.
18.Bertrand T, Eady NAJ, Jones JM, Jesmin, Nagy JM, Jamart-Gregoire B, Raven EL, Brown KA,et al. Crystal
structure of Mycobacterium
tuberculosis catalase-peroxidase. J Biol
Chem. 2004;279:38991–9.
19.Mo L, Zhang W, Weng XH, Chen S, Shao LY, Pang MY, Chen ZW, et al.
Three-dimensional model and
molecular mechanism of
Mycobacterium tuberculosis
catalase-peroxidase (KatG) and isoniazid-resistant KatG mutants. Microbial Drug Resist Larchmont NY. 2004;10:269–79. 20.Massi MN, Wahyuni S, Halik H, Anita, Yusuf I, Leong FJ, Dick T, Phyu S, et al. Drug resistance among tuberculosis patients attending diagnostic and treatment centres in Makassar, Indonesia. Intern J Tuberc Lung Dis. 2011;15:489–95.
21.Sasmono RT, Setianingsih TY, Massi MN, Sebayang BF, Anita, Halik H, Bifani PJ, Phyu S, et al. Molecular identification of mutations associated
with multidrug-resistance
Mycobacterium tuberculosis in
Makassar, Indonesia. 2013
(Unpublished data).
22.Sandgren A, Strong M, Muthukrishnan M, Weiner BK, Church GM, Murray MB, et al. Tuberculosis drug resistance mutation database. PLoS Med. 2009;6. 23.Sambrook J, Russel DW. Molecular
cloning, a laboratory manual. 3rd ed.
New York;Cold Spring Harbor
Laboratory Press:2001.
24.Sali A. Modeller. Univ California. 2013. Available from: http://salilab.org/ modeller/
25.PyMOL. Scrodinger. 2013. Available from: http://www.pymol.org/
26.Master S, Zahrt TC, Song J, Deretic V.
Mapping of Mycobacterium
tuberculosis KatG promoters and their
differential expression in infected macrophages. J Bacteriol. 2001; 183:4033–9
27.Sorensen HP, Mortensen KK.
Advanced genetic strategies for recombinant protein expression in
Escherichia coli. J Biotechnol. 2005;
115:113–28.
28.Qing G, Ma LC, Korchid A, Swapna GVT, Mal TK, Takayama MM, Xia B, Phadtare S, Ke H, Acton T, Montelione GT, Ikura M, Inouye M, et al. Cold-shock induced high-yield protein production in Escherichia coli. Nat Biotechnol. 2004;22:877–82.
29.Hayashi K, Kojima C. pCold-GST vector: a novel cold-shock vector containing GST tag for soluble protein production. Protein Exp Purif. 2008;62:120–7.
30.Runge SW, Hill BJF, Moran WM. A Simple classroom teaching technique to help students understand Michaelis-Menten kinetics.CBE Life Sci Educ. 2006;5: 348–52.
31.Johnson KA, Goody RS. The Original Michaelis constant: translation of the
1913 Michaelis-Menten paper.
Biochem.2011;50:8264–9.
32.Bartos P, Falkinham. Mycobacterial catalases, peroxidases, and superoxide dismutases and their effects on virulence and isoniazid-susceptibility in mycobacteria-a review.Vet Med. 2004;49(5):161-70.