Abstrak — Penelitian ini membahas mengenai kinetika degradasi fotokatalitik malachite green dengan menggunakan katalis semikonduktor TiO2 dan O2/UV. Degradasi fotokatalitik malachite green mengikuti orde reaksi orde 0,4 dengan konsntanta laju reaksi 0,015 ppm/menit. Konsentrasi awal optimum sebesar 20 ppm menunjukkan prosentase degradasi tertinggi sebesar 74,167 % dengan lampu UV 6 Watt 360 menit. pH larutan optimum berada pada pH 7 yaitu sebesar 60,021 % pewarna terdegradasi pada konsentrasi awal 40 ppm. Senyawa 4-N,N-dimetilaminobenzofenon merupakan hasil utama pada degradasi fotokatalitik malachite green.
Kata Kunci — Malachite Green, Degradasi
Fotokatalitik, TiO2, Kinetika, O2/UV
I. PENDAHULUAN
EWASA ini Indonesia adalah salah satu negara yang mengalami perkembangan di industri tekstil yaitu pada 2006 sebesar 4,1 kg/kapita penduduk Indonesia menjadi 4,5 kg/kapita penduduk pada tahun 2010 [1]. Peningkatan permintaan pasar untuk tekstil akan mengakibatkan peningkatan pada penggunaan pewarna tekstil karena warna menambah keindahan tekstil. Selama akhir tahun 2012, sebanyak 29,4 juta ton pewarna diproduksi di dunia dan 15% diantaranya mengalami desorpsi menjadi limbah tekstil saat proses pewarnaan. Oleh karena itu, limbah pewarna tekstil menempati urutan atas penyebab polusi lingkungan dan kontaminasi air [2] [3]. Hal ini perlu diperhatikan karena akan menjadi potensi negarif pada lingkungan dan kesehatan manusia ataupun yang terakumulasi serta sulit terdegradasi secara alami [4].
Malachite green (hijau malasit) adalah kelompok pewarna trifenilmetan yang digunakan sebagai pewarna hijau untuk tekstil alami seperti kulit, sutra dan wol [3]. Meskipun demikian, malachite green adalah salah satu senyawa organik berstruktur kompleks yang bersifat karsinogenik, mutagenik, pemecah kromosom, merupakan racun bagi mamalia termasuk penyebab perusakan organ dan pertumbuhan abnormal [5]. Pewarna kation ini juga dilaporkan dapat masuk ke dalam metabolisme tubuh ikan menjadi leucomalachite green yang bersifat lipofilik dan dapat terakumulasi di dalam jaringan ikan [6].
Beberapa metode degradasi untuk solusi masalah kontaminan pewarna tekstil telah diajukan, salah satu metode
yang menjanjikan adalah degradasi secara oksidasi fotokatalitik dengan menggunakan TiO2. Metode ini memiliki beberapa keunggulan yaitu kinerja fotokatalitik TiO2 menunjukkan hasil yang memuaskan dan keunikan reaksi. Selain itu, TiO2 juga memiliki keunggulan antara lain: relatif murah, stabil, ramah lingkungan, menunjukkan efisiensi pada perusakan kontaminan beracun, tidak memerlukan banyak reagen, dapat dioperasikan pada temperatur dan tekanan kamar [7] [3]. Satu studi memaparkan bahwa TiO2 tersinari UV mampu mendegradasi senyawa pewarna sebanyak 99% -selama 4 jam [8]. Penelitian lain menunjukkan hasil yang cukup signifikan, yaitu sebanyak 78% pewarna terdegradasi selama 3000 menit [9].
Dalam rangka meningkatkan kecepatan degradasi pewarna beberapa elektron akseptor telah diteliti pengaruhnya pada sistem UV/TiO2 untuk mencegah rekombinasi (penggabungan kembali) elektron-hole. Satu penelitian menunjukkan bahwa penambahan H2O2 sebagai akseptor elektron pada saat pendegradasian mampu meningkatkan proses oksidasi polutan organik [10]. Gas oksigen (O2) adalah salah satu akseptor elektron yang mampu membentuk anion superoksida radikal •O2-. Spesi yang sangat reaktif ini terbentuk akibat molekul teradsorp kemudian bereaksi dengan elektron tereksitasi di permukaan TiO2 sehingga, gas O2 merupakan salah satu jenis akseptor elektron sebagai oksidator pada sistem degradasi [11]. Satu studi memaparkan bahwa TiO2 tersinari UV mampu mendegradasi senyawa pewarna sebanyak 99% selama 4 jam [8]. Penelitian yang telah dilakukan sebelumnya menyimpulkan bahwa keberadaan O2 memberikan pengaruh cukup signifikan yaitu sebesar lebih dari 70% fenol dapat terdegradasi [12].
Pada sistem aquos titanium dioksida bersifat amfoter, sehingga keasaman lingkungan terhadap titik isoelektriknya akan memengaruhi sifat TiO2 yaitu kecendrungan TiO2 mengadsorp molekul bermuatan pada sistem [8]. Oleh karena itu, pada penelitian ini akan pengaruh pH pada kecepatan degradasi, kinetika serta mengetahui hasil degradasi berdasarkan hasil analisis jika digunakan gas O2 sebagai oksidator.
II. URAIANPENELITIAN A. Alat dan Bahan
Alat-alat yang digunakan antara lain: reaktor pyrex 3000 mL yang dilengkapi dengan buffle, lampu UV 6 W Flourocent,
Kinetika Degradasi Fotokatalitik Malachite
Green dengan Katalis Semikonduktor TiO
2
dan
O
2
/UV
Yusnaya Adisti dan Endah Mutiara M.P.
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh
Nopember (ITS)
Jl. Arief Rahman Hakim, Surabaya 60111 Indonesia
e-mail: endah_mutiara@hotmail.com
JURNAL SENI DAN SAINS Vol. 2, No. 1, (2014) 1-6 2
magnetic stirrer, pH meter Cyberscan 510 Ion, centrifuge, tabung oksigen yang dilengkapi dengan regulator dan flowmeter, neraca analitik, spektrofotometer UV-Vis Thermoset, FT-IR dan GC-MS. Bahan-bahan yang digunakan antara lain: 115942 malachite green oxalate (Basic Green 4), C.I. 42000 Merck. Katalis TiO2 P-25 Degussa (22 nm nonpori, diameter pori 31,5 nm, SBET 51 m
2
/g , 9% anatase, 21% rutil). CH3COOH dan NaOH Cahaya Kimia Laboratory Chemicals. Gas oksigen Morodadi, aqua demineralisasi SUK, klorofom-etanol Merk dan Na2SO4 SAP Chemicals. Keseluruhan bahan merupakan bahan dengan grade proanalit. B. Prosedur Kerja
Degradasi malachite green dilakukan di dalam reaktor berupa beaker gelas pyrex 3000 mL yang dilengkapi dengan buffle. Sebanyak 1000 mL larutan malachite green dimasukkan ke dalam reaktor dan ditambahkan serbuk TiO2 100 mg/L larutan kemudian diaduk. Pengadukan dilakukan secara terus-menerus dengan menggunakan magnetik stirer berkeceparan konstan yaitu 3000 rpm/menit. Gas O2 dialirkan ke dalam tabung melalui difuser yang terpasang pada selang, gas dialiri secara konstan dengan kecepatan 5 L/menit sebelum lampu dinyalakan sehingga larutan jenuh dengan O2. Derajat keasaman (pH) larutan diukur dengan menggunakan pH meter kemudian diatur keasaman pH larutan sesuai keinginan dengan penambahan CH3COOH 10 % untuk penurunan pH larutan serta penambahan NaOH 0,1 N untuk penaikan pH larutan. Larutan kemudian disinari lampu UV biru 6 Watt maksimal 360 menit dan dilakukan pengukuran konsentrasi dari absorbansi yang diperoleh dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 618 nm setiap 60 menit. Larutan sebelumnya dipisahkan dari partikel TiO2 dengan menggunakan centrifuge berkecepatan 3000 rpm selama 5 menit. Secara umum skema alat digambarkan pada Gambar 2.1.
C. Pernenuan Orde dan Prosentase Degradasi
Penentuan kinetika dilakukan untuk mendapatkan nilai orde, konstanta dan laju degradasi malachite green didapat melalui persamaan laju degradasi. Perhitungan laju reaksi
oksidasi fotokatalitik malachite green (MG) didasari pada persamaan reaksi sebagai berikut:
MG + O2→ P (2.1)
Demikian maka laju reaksi secara umum dapat dituliskan: −𝑑𝑑[𝑀𝑀𝑀𝑀]𝑑𝑑𝑑𝑑 = 𝑘𝑘 𝐶𝐶𝑀𝑀𝑀𝑀𝑚𝑚 𝐶𝐶𝑂𝑂𝑛𝑛2 (2.2) Karena O2 selalu dibuat jenuh setiap saat (konstan), maka k [O2] dapat dianggap menjadi konstanta baru (k’) yaitu: − 𝑑𝑑[𝑀𝑀𝑀𝑀]𝑑𝑑𝑑𝑑 = 𝑘𝑘′𝐶𝐶
𝑀𝑀𝑀𝑀𝑚𝑚 (2.3)
𝑣𝑣 = 𝑘𝑘′𝐶𝐶
𝑀𝑀𝑀𝑀𝑚𝑚 (2.4)
Dengan melogaritmakan Persamaan 3.3 maka didapat persamaan:
log 𝑣𝑣 = 𝑚𝑚 log 𝐶𝐶𝑀𝑀𝑀𝑀 + log 𝑘𝑘′ (2.5)
Penentuan prosentase degradasi diperoleh melalui pesamaan: 𝜂𝜂 = 𝐶𝐶0+ 𝐶𝐶𝑑𝑑
𝐶𝐶0 (2.6)
D. Analisis
Analisis instrumen yang digunakan pada percobaan ini antara lain spektrofotometer Uv-vis yaitu dengan cara memindai absorbansi larutan sampel dari panjang gelombang 300-700 nm. FT-IR-8400S Shimadzu dengan cara menembakkan sinar infra merah ke sampel berada pada pelat tipis KBr. GC-MS 6890N Agilent dilengkapi kolom HP-5 dengan program injeksi sebagai berikut: 50°C - 270°C ( 1 menit 150°C, 25°C/menit, 1 menit 180°C, 5°C/menit , 5 menit 230°C, 7 menit 270°C). Sampel terlebih dahulu diekstrak dengan campuran kloroform-etanol sebelum dianalisis dengan menggunakan GC-MS. Perbandingan fasa organik dan fasa aquos adalah 9:1. Hasil ekstraksi ditambah dengan Na2SO4 sebagai penyerap air kemudian dievaporasi hingga 1/20 kali larutan awal.
III. HASILDANPEMBAHASAN A. Pengaruh Konsentrasi Awal
Hasil pada percobaan ini menunjukkan prosentase degradasi maksimal pada konsentrasi 20 ppm yaitu sebesar 74,167 %. Prosentase semakin menurun dengan bertambahnya konsentrasi awal pewarna yang dipaparkan pada Gambar 3.1. Fakta ini membuktikan bahwa semakin sedikitnya transparansi
Gambar 2.1 Skema alat
Keterangan: 1.Tabung gas oksigen 2.Reaktor pyrex 3000 mL 3.Difuser 4.Magnetik strirer 5.Stirer 6.Regulator tabung gas 7.Selang 8.Lampu UV 6Watt 9.Flowmeter 10.Buffle.
1 2 3 4 5 6 7 8 9 10
Gambar 3.1 Pengaruh konsentrasi awal terhadap prosentase degradasi pada pH 7 0,000 10,000 20,000 30,000 40,000 50,000 60,000 70,000 80,000 0 80 160 240 320 η t (menit) 20 ppm 40 ppm 60 ppm
larutan jika konsentrasi pewarna semakin tinggi, sehingga semakin sedikit pula cahaya yang dapat menembus lautan. Dengan demikian, jumlah foton akan semakin sedikit yang sampai ke permukaan partikel katalis mengarahkan kepada penghambatan degradasi pewarna [13].
Berkurangnya jumlah foton yang sampai ke permukaan katalis semakin sedikit seiring dengan meningkatnya konsentrasi pewarna, mengakibatkan semakin sedikit pula terbentuknya radikal hidroksi (OH•). Karena penurunan jumlah OH• maka akan dibutuhkan agen pengoksidasi molekul untuk mendegradasi pewarna. Beberapa peneliti sebelumnya mengajukan model degradasi molekul pewarna dimana terjadi degradasi pewarna secara langsung oleh elektron tereksitasi (e–). Oksidasi langsung oleh hole (h+) juga dilaporkan berperan dalam degradasi pewarna. Namun, seiring kenaikan konsentrasi pewarna maka akan mengakibatkan terjadinya penurunan aktivasi katalis. Hal ini menyebabkan semakin sedikit jumlah elektron (e–) yang terbentuk untuk reduksi langsung pewarna dan semakin sedikit pula hole (h+) tersedia didalam sistem. Penurunan jumlah elektron dan hole akan mengarahkan kepada penghambatan degradasi. Adapun persamaan reaksi langsung antara pewarna, elektron dan hole sebagai berikut [15]:
Dye + e–→ Dye•–→ Produk Degradasi (3.1) Dye + h+→ Dye•+→ Produk Degradasi (3.2) B. Pengaruh pH
Data mengenai pengaruh pH terhadap prosentase degradasi disajikan oleh Gambar 3.4. Prosentase degradasi (η) menunjukkan perbedaan signifikan pada konsentrasi awal 40 ppm. Sebesar 60,021% malachite green terdegradasi pada pH 7 sedangkan pada pH 5 sebesar 48,858%. Hal ini disebabkan oleh tiga faktor, keamfoteran TiO2 yang bermuatan negatif pada keadaan basa menyebabkan adsorpsi pewarna malachite green lebih maksimal, karena pewarna malachite green merupakan pewarna kationik yang mengikuti persamaan reaksi (3.11) dan (3.12). Faktor kedua, radikal hidroksil yang merupakan spesi oksidasi pendominan pada keadaan basa memiliki kemampuan mendegradasi pewarna lebih baik dari pada hole. Faktor terakhir, penurunan luas permukaan TiO2 pada keadaan asam akibat pembentukkan gumpalan [14]. TiOH + H+↔ TiOH2+ (media asam) (3.3)
TiOH + OH–↔ TiO– +H2O (media basa) (3.4) Pada penelitian hanya diamati pengaruh pH terhadap kecepatan degradasi malachite green pada keadaan asam dan netral. Pengamatan pada keadaan basa tidak memungkinkan dalam percobaan ini sebab kation malachite green akan cendrung membentuk basa malachite green jika kadar OH– larutan tinggi. Bentuk basa malachite green pada pH lebih besar dari 7 merupakan senyawa yang tidak berwarna sehingga akan menurunkan nilai absorbansi pada analisis spektrofotometer UV-Vis mengakibatkan ketidak akuratan data [15].
C. Kinetika
Penentuan kinetika degradasi fotokatalitik malachte green mengikuti Persamaan Reaksi (2.1), dimana persamaan reaksi tersebut didasari oleh Persamaan (2.3) yang menyatakan laju pengurangan konsentrasi malachite green. Persamaan (2.5) analog dengan garis lurus y = ax + b, dengan a sebagai orde reaksi, log C merupakan konsentrasi rata-rata penurunan kadar malachite green sebagai x, log v sebagai y dan log k sebagai b (konstanta laju reaksi). Dari kedua data diplot dan didapat persamaan y = 0,0404 x – 1,82. Grafik plot antara log C dan log v dipaparkan pada Gambar 4.9.
Berdasarkan persamaan garis lurus grafik diatas maka didapat nilai m (orde reaksi) yaitu sebesar 0,0404. Nilai k didapat sebesar 0, 015 ppm/menit dengan laju degradasi sebesar 0,0169 ppm/menit. Keseluruhan perhitungan laju degradasi disajikan oleh Tabel 4.3. Dari data laju degradasi terhadap pH maka dapat disimpulkan bahwa perubahan pH dapat mengubah laju degradasi tetapi tidak mengubah konstanta laju reaksi.
Tabel 3.1 Laju Degradasi Malachite Green
pH
C awal (ppm)
v (ppm/menit)
5
20
0,0169
40
0,0174
60
0,0177
7
20
0,0169
40
0,0174
60
0,0177
Gambar 3.3 Pengaruh pengaturan pH terhadap prosentase degradasi pada konsentrasi awal 40 ppm 0,000 10,000 20,000 30,000 40,000 50,000 60,000 70,000 0 50 100 150 200 250 300 350 η t (menit) pH 5 pH 7
Gambar 3.4 Grafik plot antara log v dan log C, pada konsentrasi awal 20 ppm dan pH 7 0,7 0,8 0,9 1,0 1,1 1,2 1,3 -1,55 -1,50 -1,45 -1,40 -1,35 -1,30 log C log v y = 0,404x - 1,820 R² = 0,985
JURNAL SENI DAN SAINS Vol. 2, No. 1, (2014) 1-6 4
D. Hasil Analisis
Hasil analisis spektra setiap sampel pada variasi waktu menunjukkan bahwa absorbansi larutan pada panjang gelombang maksimal terus menurun seiring bertambahnya waktu degradasi. Penurunan absorbansi ini, memperkuat kemungkinan bahwa pewarna malachite green telah terdegradasi menjadi senyawa yang lebih sederha. Saat penembakkan sinar UV dan sinar tampak setiap senyawa akan mengadsorp jumlah energi tertentu agar elektron dapat tereksitasi, eksitasi elektron tersebut akan memancarkan panjang gelobang yang khas. Terpecahnya struktur senyawa pewarna menjadi senyawa lain juga akan mengubah jumlah energi yang dibutuhkan elektron untuk tereksitasi sehingga akan menampakkan panjang gelombang yang berbeda pada spektra UV-vis. Hasil analisis spektra Uv-vis ditunjukkan oleh Gambar 3.4.
Analisis FT-IR bertujuan untuk mengetahui gugus-gugus fungsi yang terdapat di dalam sampel. Spektra FT-IR sebelum dan sesudah degradasi ditunjukkan oleh Gambar 3.6. Spektra pada saat t awal memuculkan puncak tajam pada bilangan gelombang 581,5 cm-1, 1632,67 cm-1 dan 3435,95 cm-1. Munculnya puncak di daerah bilangan gelombang 900-500 cm-1 merupakan vibrasi bending out of plane C-H senyawa aromatik, untuk daerah bilangan gelombang 1600 cm-1 menunjukkan keberadaan ikatan C=C aromatik. Berdasarkan kemunculan puncak pada bilangan-bilangan gelombang tersebut, besar kemungkinan senyawa yang terdapat di dalam sampel adalah senyawa aromatik. Sesuai dengan struktur senyawa malachite green yang memiliki 3 gugus aromatik oleh sebab itulah, malachite green dikelompokkan sebagai pewarna triarilmetan. Terdapat ikatan N-C dalam struktur malachite green yang tidak terdeteksi pada spektra, hal ini disebabkan lemahnya vibrasi C-N dibandingkan dengan vibrasi aromatik. Adapun puncak lebar pada bilangan gelombang 3435,95 cm-1 merupakan puncak vibrasi O-H milik air.
Untuk spektra pada t akhir memunculkan puncak yang tidak jauh berbeda yaitu pada 609,46 cm-1, 1632,42 cm-1 dan 3458,13 cm-1. Perbedaan antara kedua spektra hanya prosentase transmitan saja. Transmitan setiap puncak mengalami peningkatan yang menandakan intensitas setiap gugus fungsi mengalami penurunan. Sebaliknya dari kemunculan puncak spektra FT-IR dapat disimpulkan bahwa hampir tidak terdapat perubahan gugus fungsi baik sebelum
ataupun sesudah degradasi. Fakta ini dapat dikarenakan rendahnya konsentrasi produk jika dibandingkan dengan senyawa awalnya.
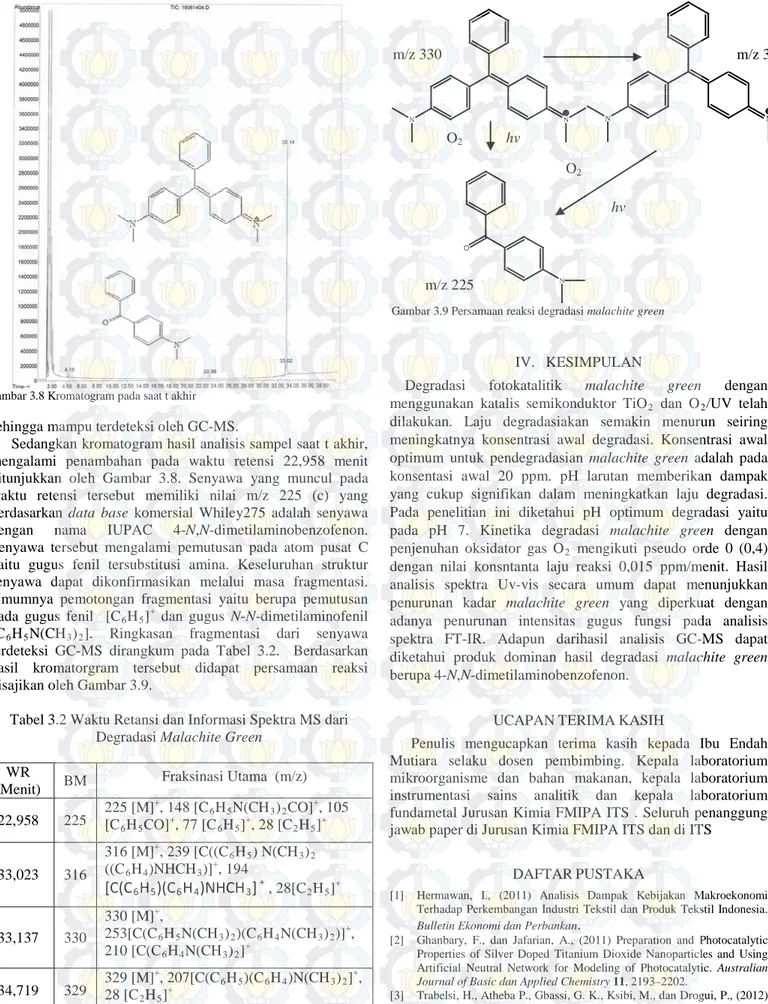
Analisis dengan menggunakan GC-MS dilakukan untuk membandingkan kromatogram sebelum dan sesudah degradasi dan mengetahui produk yang terbentuk setelah degradasi. Kromatogram hasil analisis sampel saat t awal degradasi menunjukkaan 3 waktu retensi yaitu pada 33,023 menit, 33,137 menit dan 34,719 menit yang ditunjukkan oleh Gambar 3.7. Berdasarkan data base komersial Whiley275 waktu retensi 33,137 menit memiliki nilai m/z 330 merupakan waktu retensi milik malchite green (a), waktu retensi lain yaitu pada 34,719 menit dengan nilai m/z 329 diindikasikan sebagai isotop dari malachite green. Waktu retensi 33,302 menit merupakan waktu retensi senyawa derivatif malachite green dengan m/z 316 yang mengalami pemutusan metil pada gugus N+ (b) dengan nama IUPAC N-[4-[[4-(dimetilamino)-
fenil]fenilmetilen]-2,5-sikloheksadiena-1-liden]-N-metilmetanaminium. Senyawa ini bersifat cukup stabil
Gambar 3.7 Kromatogram pada saat t awal Gambar 3.6 Hasil analisis FT-IR
4000 3500 3000 2500 2000 1500 1000 500 5 10 15 20 25 30 35 40 45 50 55 60 t awal Bilangan Gelombang (nm-1) % T t akhir
Gambar 3.5 Analisis spektra Uv-vis degradasi malachite green 300 400 500 600 700 0,0 0,2 0,4 0,6 0,8 1,0 t awal A Panjang Gelombang (nm) t akhir
JURNAL SENI DAN SAINS Vol. 2, No. 1, (2014) 1-6 5
sehingga mampu terdeteksi oleh GC-MS.
Sedangkan kromatogram hasil analisis sampel saat t akhir, mengalami penambahan pada waktu retensi 22,958 menit ditunjukkan oleh Gambar 3.8. Senyawa yang muncul pada waktu retensi tersebut memiliki nilai m/z 225 (c) yang berdasarkan data base komersial Whiley275 adalah senyawa dengan nama IUPAC 4-N,N-dimetilaminobenzofenon. Senyawa tersebut mengalami pemutusan pada atom pusat C yaitu gugus fenil tersubstitusi amina. Keseluruhan struktur senyawa dapat dikonfirmasikan melalui masa fragmentasi. Umumnya pemotongan fragmentasi yaitu berupa pemutusan pada gugus fenil [C6H5]+ dan gugus N-N-dimetilaminofenil [C6H5N(CH3)2]. Ringkasan fragmentasi dari senyawa terdeteksi GC-MS dirangkum pada Tabel 3.2. Berdasarkan hasil kromatorgram tersebut didapat persamaan reaksi disajikan oleh Gambar 3.9.
Tabel 3.2 Waktu Retansi dan Informasi Spektra MS dari Degradasi Malachite Green
WR
(Menit) BM Fraksinasi Utama (m/z) 22,958 225 225 [M] + , 148 [C6H5N(CH3)2CO] + , 105 [C6H5CO]+, 77 [C6H5]+, 28 [C2H5]+ 33,023 316 316 [M]+, 239 [C((C6H5) N(CH3)2 ((C6H4)NHCH3)]+, 194
[C(C
6H
5)(C
6H
4)NHCH
3]
+ , 28[C2H5]+ 33,137 330 330 [M]+, 253[C(C6H5N(CH3)2)(C6H4N(CH3)2)] + , 210 [C(C6H4N(CH3)2]+ 34,719 329 329 [M] +, 207[C(C 6H5)(C6H4)N(CH3)2]+, 28 [C2H5]+ IV. KESIMPULANDegradasi fotokatalitik malachite green dengan menggunakan katalis semikonduktor TiO2 dan O2/UV telah dilakukan. Laju degradasiakan semakin menurun seiring meningkatnya konsentrasi awal degradasi. Konsentrasi awal optimum untuk pendegradasian malachite green adalah pada konsentasi awal 20 ppm. pH larutan memberikan dampak yang cukup signifikan dalam meningkatkan laju degradasi. Pada penelitian ini diketahui pH optimum degradasi yaitu pada pH 7. Kinetika degradasi malachite green dengan penjenuhan oksidator gas O2 mengikuti pseudo orde 0 (0,4) dengan nilai konsntanta laju reaksi 0,015 ppm/menit. Hasil analisis spektra Uv-vis secara umum dapat menunjukkan penurunan kadar malachite green yang diperkuat dengan adanya penurunan intensitas gugus fungsi pada analisis spektra FT-IR. Adapun darihasil analisis GC-MS dapat diketahui produk dominan hasil degradasi malachite green berupa 4-N,N-dimetilaminobenzofenon.
UCAPANTERIMAKASIH
Penulis mengucapkan terima kasih kepada Ibu Endah Mutiara selaku dosen pembimbing. Kepala laboratorium mikroorganisme dan bahan makanan, kepala laboratorium instrumentasi sains analitik dan kepala laboratorium fundametal Jurusan Kimia FMIPA ITS . Seluruh penanggung jawab paper di Jurusan Kimia FMIPA ITS dan di ITS
DAFTARPUSTAKA
[1] Hermawan, I., (2011) Analisis Dampak Kebijakan Makroekonomi Terhadap Perkembangan Industri Tekstil dan Produk Tekstil Indonesia.
Bulletin Ekonomi dan Perbankan.
[2] Ghanbary, F., dan Jafarian, A., (2011) Preparation and Photocatalytic Properties of Silver Doped Titanium Dioxide Nanoparticles and Using Artificial Neutral Network for Modeling of Photocatalytic. Australian
Journal of Basic dan Applied Chemistry 11, 2193–2202.
[3] Trabelsi, H., Atheba P., Gbassi, G. K., Ksibi, M., dan Drogui, P., (2012) Sunlight-activated Photocatalysis of Malachite Green Using A Gambar 3.8 Kromatogram pada saat t akhir
N N N NH N O
Gambar 3.9 Persamaan reaksi degradasi malachite green
m/z 330 m/z 316 m/z 225 O2 O2 hv hv
JURNAL SENI DAN SAINS Vol. 2, No. 1, (2014) 1-6 6
TiO2/Cellulosic Fiber. International Journal of Hazardous Materials 1,
6–10.
[4] Christie, R. M., (2001) Color Chemistry., The Royal Society of Chemistry, Cambridge.
[5] Srivastava, S., Sinha, R., dan Roy, D., (2004) Toxicological effects of malachite green. Aquatic Toxicology 66, 319–329.
[6] Sandra, J., (2004) Malachite Green Cloride and Leucomalachite Green., U.S. Department of Health dan Human Service, USA.
[7] Fujishima, A., dan Nakata, K., (2012) TiO2 Photocatalysis: Design dan
Applications. Journal of Photochemistrydan Photobiology C: Photochemistry Review 13, 169–189.
[8] Chen, C. C., Lu, C. S., Chung, Y. C., dan Jan, J. L., (2007) UV Light Induced Photodegradation of Malchite Green on TiO2 Nanoparticles.
Journal of Hazardous Materials 141, 520–528.
[9] Kavitha, S. K., dan Palanisamy, P. N., (2010) Photocataytic Degradation of Vat Yellow 4 Using UV/TiO2. Advance in Environmental Science 2,
189–202.
[10] Zang, Y., dan Farnood, R., (2006) Effect of Hydrogen Peroxyde on The Photocatalytic Degradation of Methyl Tert-buthyl Ether. Topics in
Catalysis 37, 91–96.
[11] Oliveira-Campos, A. M., Nkeonye, P. O., dan Poulios I. (2003) Photocatalytic Degradation Studies on Malachite Green. Environment
2010: Situation and Perspectives of The European Union, 1–6.
[12] Zhang, D., Qiu, R., Song, L., Brewer, E., Mo, Y., dan Huang, X., (2009) Role of Oxygen Active Species in the Photocatalytic Degradation of Phenol Using Polymer Sensitized TiO2 Under Visible Light Irradiation.
Journal of Hazardous Materials 163, 843–847.
[13] Tang, C., dan Chen, V., (2008) The Photocatalytic Degradation of Reactive Black 5 Using TiO2/UV in An Annular Photoreactor. Water
Research 38, 2275–2781.
[14] Akpan, U. G., dan Hameed, B. H., (2009) Parameters affecting the photocatalytic degradation of dyes using TiO2-based photocatalysts: A
review. Journal of Hazardous Materials 170, 520–529.
[15] Trotman, E. R., (1970) Dyeing and Chemical Technology of Textile