72
KINETIKA REAKSI CH3COOH DENGAN Br2 SEBAGAI REAKSI YANG MIRIP
REAKSI ENZIMATIS
REACTIONS KINETICS OF CH3COOH WITH Br2 AS A SIMILIAR
ENZYMATIC REACTIONS
Novika Tusta Felandi1, Patiha1*, Edi Pramono1
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universtas Sebelas Maret, Jl. Ir Sutami No. 36 A, Kentingan Surakarta 57126 telp. (0271) 663375
E-mail: patiha31@yahoo.co.id
Received 5 November 2013, accepted 20 September 2013, published 25 September 2013 ABSTRAK
Tujuan penelitian adalah membuktikan bahwa pada kondisi tertentu reaksi antara CH3COOH dengan Br2 mirip reaksi enzimatis dan harga tetapan, dari persamaan Espenson berbeda dengan dengan harga yang diperoleh dari metode integral. Percobaan dilakukan dengan variasi konsentrasi CH3COOH. Reaksi dipelajari dengan metode spektroskopi dengan mencatat perubahan absorbansi Br2 pada panjang gelombang 400 nm (indeks absorbansi 160 M-1 cm-1) tiap rentang waktu tetap. Data dianalisis dengan persamaan integral dan order reaksi ditentukan berdasarkan harga koefisien regresi, r yang mendekati 1 atau -1. Reaksi dikatakan mirip reaksi enzimatis jika order awal reaksi berbeda dengan akhir reaksi. Data juga dianalisis dengan menggunakan persamaan Espenson dan persamaan integral (sebagai pembanding). Hasil penelitian menunjukkan bahwa pada konsentrasi CH3COOH 0,00150 M; 0,00100 M; dan 0,00075 M dan Br2 0,00300 M reaksi ini mirip reaksi enzimatis. Pada konsentrasi CH3COOH yang berbeda, harga yang diperoleh dari persamaan Espenson berbeda dengan harga yang dihitung dengan metode integral.
Kata kunci: reaksi enzimatis, order reaksi, vmaks ABSTRACT
The aims of the research are to prove that at certain conditions the reaction between Br2 with CH3COOH is similar to enzymatic reaction, and the value of
calculated from the Espenson equation is different with value calculated by integral method. The experiments were performed at various concentrations of CH3COOH. The
reaction studied by spectroscopic method by record the changes in absorbance of Br2 at
400 nm (the absorbance index is 160 M-1 cm-1) in each definited time range. Data were
analyzed with integral equations and the reaction order was determined base on the value of regression coefficient which must be close to 1 or -1. The reaction is said to be similar to the enzymatic reaction if the order of the reaction at initial is different with the order value at the end of reaction. Data were also analyzed using Espenson and integral equation (for comparison). The results showed that at concentrations of CH3COOH
0.00150 M, 0.00100 M, and 0.00075 M and 0.00300 M Br2 the reaction is similar to
enzymatic reactions. Meanwhile, at different concentrations of CH3COOH, the κ value
obtained from Espenson equation is different with the value calculated by integral method. Key words: enzymatic reaction, order of reaction, vmaks
73 PENDAHULUAN
Enzim merupakan senyawa yang mengkatalisis proses kimia pada makhluk hidup. Ada beberapa jenis mekanisme reaksi enzimatis dan yang paling sederhana yaitu reaksi enzimatis Michaelis-Menten (1913). Menurut Briggs dan Haldane (1925), persamaan hukum lajunya adalah sebagai berikut:
] [ ] [ ] [ 0 S K S E k v M kat [1] M
K adalah tetapan Michaelis-Menten.
Persamaan [1] di atas belum mempunyai order reaksi yang pasti. Pada [S] yang cukup besar (K kecil), persamaan di atas akan berubah menjadi M
0
] [E
k
v kat [2]
Pada kondisi ini, substrat bereaksi dengan semua enzim yang ada, sehingga v
mencapai harga maksimum (disebut vmaks) dan reaksi menuruti mekanisme reaksi order ke-nol terhadap [S] atau
] [E
k
vmaks kat [3]
Tetapi, pada konsentrasi substrat [S] yang cukup kecil ( KM besar), reaksi akan berlangsung menuruti mekanisme reaksi order ke-satu terhadap [S] dan persamaan [1] menjadi M kat K S E k v [ ]0[ ] [4] Substitusi [3] ke [4] menghasilkan M maks K S v v [ ] [5]
Salah satu kendala dalam mempelajari kinetika reaksi enzimatis yaitu enzim harganya mahal dan mudah rusak sehingga sulit untuk melakukan percobaan. Oleh karena itu, perlu untuk mencari reaksi lain yang dapat mirip reaksi enzimatis dengan biaya yang lebih murah dan lebih mudah percobaannya. Berdasarkan penelitian sebelumnya, Patiha (2009) menyatakan bahwa pada kondisi tertentu reaksi antara HCOOH dengan Br2 mirip reaksi enzimatis. Oleh karena itu, dilakukan penelitian reaksi antara CH3COOH dengan Br2 yang diharapkan pada kondisi tertentu pula dapat mirip reaksi enzimatis, sehingga reaksi ini dapat dijadikan sebagai model untuk mempelajari kinetika reaksi enzimatis.
74
Menurut Camps, et al. (2000) asam karboksilat (RCOOH) yang mempunyai atom karbon α primer, sekunder, atau tersier dapat mengalami reaksi bromodekarboksilasi menjadi RBr. Reaksi antara CH3COOH dengan Br2 merupakan reaksi dekarboksilasi dan reaksinya sebagai berikut:
CH3COOH + Br2 CH3Br + CO2 + H+ + Br- [6] Asam asetat mirip dengan asam formiat tetapi gugus H-nya diganti dengan gugus – CH3 sehingga mekanisme yang diusulkan seperti Hodgson, et al (1998: 1150-1153):
CH3COOH 1 1 k k H+ + CH3COO- [7] CH3COO- + Br2 k2 CH3Br + Br- + CO2 [8] Berdasarkan pendekatan keadaan mantap, akan diperoleh hukum laju:
] [ ] [ ] ][ [ 2 2 1 2 3 2 1 Br k H k Br COOH CH k k v [9] Apabila percobaan dilakukan pada kondisi [Br2]0 yang sedikit berlebihan terhadap [H+]0, karena reaksi [7] berlangsung cukup cepat (sehingga k relatif besar) maka, pada 1 awal-awal reaksi produksi [H+] cukup cepat, dan reaksi order ke-satu terhadap [Br2]. Tetapi, reaksi [7] tersebut merupakan reaksi kesetimbangan dan pada saat mendekati kesetimbangan, [H+] dapat dikatakan tetap sehingga k1[H] menjadi tetap dan akhirnya relatif lebih kecil dari [Br2], maka reaksi order ke-nol terhadap [Br2]. Dengan demikian, kemungkinan reaksi ini mirip dengan reaksi enzimatis.
Jika k1/k2[H] dianggap sebagai tetapan () dan k1[CH3COOH] dianggap
sebagai vmaks maka persamaan [9] menjadi
] [ ] [ 2 2 Br Br v v maks [10]
Selanjutnya jika dianggap sebagai K , maka persamaan reaksi tersebut mirip dengan M
persamaan hukum laju reaksi enzimatis Michaelis-Menten [1].
Harga K umumnya ditentukan dengan metode diferensial, tetapi Laidler (1987) M
menyatakan bahwa harga tetapan laju k yang tepat harus diperoleh dengan menggunakan metode integral. Telah diperkenalkan bentuk persamaan integral untuk reaksi enzimatis dan reaksi yang mirip dengannya yaitu persamaan Espenson (1995).
k A A A A t t t t ] [ ] [ ln ] [ ] [ [11]
75 Berdasarkan persamaan [11], adalah K , k adalah vM maks, sedangkan adalah rentang waktu tetap. Harga adalah negatif dari harga slop kurva linear [At][At] lawan
]} [ ]
ln{[At At .
Berdasarkan uraian di atas, ada dua hal yang perlu dibahas lebih lanjut. Pertama yaitu harga k diperoleh dari substitusi vmaks ke persamaan [5], padahal besarnya vmaks
dipengaruhi oleh banyaknya konsentrasi enzim karena reaksi order ke-satu terhadap enzim (persamaan [3]). Penelitian sebelumnya umumnya tidak memperhatikan hal ini. Kedua yaitu persamaan Espenson merupakan model persamaan linier tetapi dalam penggunaannya tidak mempersyaratkan uji linieritas.
Tujuan dilakukannya penelitian ini yaitu untuk membuktikan bahwa reaksi antara CH3COOH dengan Br2 dapat mirip dengan reaksi enzimatis dan harga yang diperoleh dari persamaan Espenson berbeda dengan persamaan integral.
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode eksperimen yang dilakukan di laboratorium. Bahan yang digunakan dalam penelitian ini adalah larutan CH3COOH (100 %) p.a.(Merck), larutan Br2 (99,5 %) p.a.(Merck), dan akuades. Data absorbansi Br2 diperoleh secara spektroskopi. Larutan blanko terdiri dari 1,5 mL larutan CH3COOH 3x10-2 M dan 1,5 mL akuades. Larutan sampel terdiri dari 1,5 mL larutan CH3COOH 3x10-2 M kemudian ditambahkan 1,5 mL Br2 3x10-3 M serentak dengan dihidupkan stopwatch. Larutan tersebut selanjutnya dianalisa menggunakan spektrofotometer UV-VIS SHIMADZU UV mini-1240 pada λ = 400 nm dan absorbansi dicatat setiap 4 menit. Percobaan tersebut diulang 2 kali dan dilakukan percobaan untuk variasi konsentrasi larutan CH3COOH (2x10-2; 1,5x10-3; 1x10-3; 7,5x10-4; 3x10-4; 2x10-4) M.
HASIL DAN PEMBAHASAN
Reaksi antara CH3COOH dengan Br2 dilakukan pada berbagai konsentrasi CH3COOH dan konsentrasi awal Br2 sama. Pada penelitian ini, CH3COOH diasumsikan bertindak sebagai enzim dan Br2 sebagai substrat. Laju reaksi diamati berdasarkan berkurangnya konsentrasi Br2. Pengamatan dilakukan dengan menggunakan alat spektrofotometer UV-VIS pada λ 400 nm dan didapatkan data absorbansi Br2. Penentuan order reaksi dengan metode integral dan diperoleh harga koefisien regreasi (r) yang
76
dirangkum di Tabel 1 untuk reaksi order 0, order 1, order 1,5 dan order 2. Harga r yang mendekati 1 atau -1 adalah order reaksi yang sesungguhnya.
Tabel 1. Koefisien regresi (r) persamaan integral reaksi CH3COOH dengan Br2 pada berbagai konsentrasi CH3COOH dengan Br2 3x10-3 M.
No. [CH3COOH] /
(M)
r integral
Order 0 Order 1 Order 1,5 Order 2 1 0,03000 Awal reaksi Akhir reaksi -0,9994 -0,9990 -0,9999 -0,9993 0,9998 0,9989 0,9994 0,9981 2 0,02000 Awal reaksi Akhir reaksi -0,9995 -0,9996 -0,9997 -0,9998 0,9996 0,9997 0,9995 0,9996 3 0,00150 Awal reaksi Akhir reaksi -0,9804 -0,9999 -0,9868 -0,9992 0,9889 0,9978 0,9904 0,9959 4 0,00100 Awal reaksi Akhir reaksi -0,9934 -0,9999 -0,9960 -0,9893 0,9970 0,9982 0,9979 0,9967 5 0,00075 Awal reaksi Akhir reaksi -0,9976 -0,9997 -0,9988 -0,9987 0,9991 0,9976 0,9992 0,9962 6 0,00030 Awal reaksi Akhir reaksi -0,9998 -0,9995 -0,9992 -0,9983 0,9987 0,9967 0,9980 0,9946 7 0,00020 Awal reaksi Akhir reaksi -0,9999 -0,9999 -0,9995 -0,9994 0,9993 0,9989 0,9989 0,9982
Reaksi enzimatis Michaelis-Menten mengikuti order reaksi yang berbeda pada awal dan akhir reaksi yaitu order ke-nol dan order ke-satu. Berdasarkan data Tabel 1, pada konsentrasi awal CH3COOH 0,03000 M dan 0,02000 M diperoleh order yang sama terhadap Br2 yaitu order ke-satu pada awal dan akhir reaksi, sedangkan pada konsentrasi awal CH3COOH 0,00030 M dan 0,00020 M diperoleh reaksi order ke-nol terhadap Br2 pada awal dan akhir reaksi. Hal ini sesuai dengan teori yaitu pada data 1 dan 2 konsentrasi CH3COOH jauh lebih besar dari konsentrasi Br2 maka [Br relatif lebih kecil terhadap 2]
] [ 1
H
k sehingga reaksi order ke-satu terhadap [Br2], sedangkan pada data 6 dan 7 konsentrasi CH3COOH jauh lebih kecil daripada konsentrasi Br2 maka Br2 relatif lebih besar terhadap k1[H] sehingga reaksi order ke-nol terhadap Br2. Oleh karena itu, pada kondisi tersebut reaksi antara CH3COOH dengan Br2 tidak mirip reaksi enzimatis.
Pada konsentrasi CH3COOH 0,00150 M; 0,00100 M dan 0,00075 M diperoleh reaksi order ke-dua pada awal dan order ke-nol pada akhir reaksi. Berdasarkan penjelasan sebelumnya bahwa reaksi antara CH3COOH dengan Br2 berlangsung dua tahap seperti pada persamaan [10] dan [11] dan mempunyai hukum laju seperti pada persamaan [12]. Apabila percobaan dilakukan pada kondisi [Br2]0 yang sedikit berlebihan terhadap [H+]0, maka reaksi tahap pertama berlangsung cukup cepat sehingga k relatif besar dan pada 1
77 awal reaksi produksi [H+] cukup cepat, maka reaksi order satu terhadap [Br2]. Tetapi, reaksi tersebut merupakan reaksi kesetimbangan dan saat mendekati kesetimbangan, [H+] dapat dikatakan tetap sehingga k1[H] menjadi tetap dan akhirnya relatif lebih kecil dari [Br2], maka reaksi order nol terhadap [Br2]. Hasil penelitian diperoleh order dua pada awal reaksi yang disebabkan karena reaksinya hanya melibatkan dua pereaksi dan konsentrasinya tidak jauh berbeda maka reaksi berlangsung secara stoikiometris. Berdasarkan metode stoikiometris, reaksi melibatkan dua pereaksi tetapi seolah-olah hanya melibatkan satu pereaksi, jadi order reaksi yang teramati adalah order semu. Pada penelitian ini, order ke-dua yang dimaksud sebenarnya adalah order ke-satu terhadap Br2 dan order satu terhadap CH3COOH. Pada kondisi ini reaksi mengikuti order reaksi yang berbeda pada awal dan akhir reaksi sehingga dapat dikatakan reaksi antara CH3COOH dengan Br2 mirip reaksi enzimatis Michaelis-Menten. Sesungguhnya, jika data pada Tabel 1. dicermati dengan lebih teliti, maka bila percobaan dilakukan dengan lebih baik, maka pada konsentrasi HCl yang lebih kecil dari 0,00075 M tetapi lebih besar dari 0,00030 M, adalah mungkin bahwa reaksi berlangsung order ke-satu pada awal dan order ke-nol menjelang akhir reaksi.
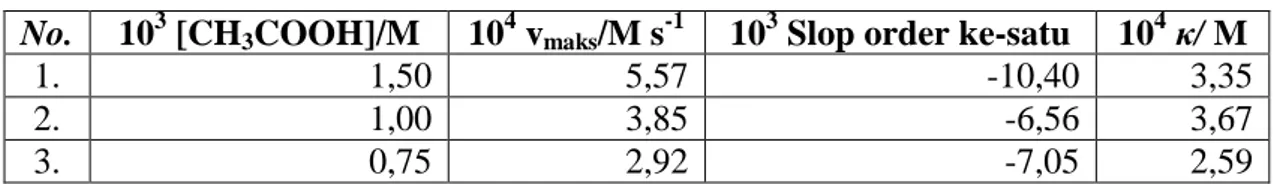
Tabel 2. Harga vmaks dan persamaan integral reaksi CH3COOH dengan Br2 pada
0,0015M; 0,001M; dan 0,00075M CH3COOH dengan 0,003M Br2.
No. 103 [CH3COOH]/M 104 vmaks/M s-1 103 Slop order ke-satu 104 κ/ M
1. 1,50 5,57 -10,40 3,35
2. 1,00 3,85 -6,56 3,67
3. 0,75 2,92 -7,05 2,59
Berdasarkan Patiha (2011), perhitungan harga dilakukan dengan menggunakan persamaan integral dengan cara mensubstitusikan vmaks yang diperoleh dari slop order
ke-nol ke dalam persamaan order ke-satu, sehingga harga dapat diperoleh hanya jika reaksi mengikuti order reaksi yang berbeda pada awal dan akhir reaksi yaitu order ke-nol dan order ke-satu. Apabila reaksi selalu mengikuti order ke-nol maka hanya diperoleh vmaks
dan tidak diperoleh harga , sedangkan apabila reaksi hanya mengikuti order ke-satu juga tidak didapatkan harga karena tidak diperoleh vmaks. Saat reaksi order ke-nol terhadap Br2 reaksi hanya dipengaruhi oleh konsentrasi CH3COOH dan faktanya berdasarkan Tabel 2 diperoleh harga vmaks yang berbeda untuk konsentrasi CH3COOH yang berbeda.
78
data 1 dan 3 dimana konsentrasi CH3COOH berbanding setengah kalinya maka harga vmaks
juga berbanding setengah kalinya. Selanjutnya, dengan membagi vmaks dengan slop order ke-satu akan diperoleh harga . Berdasarkan data Tabel 2, didapatkan harga slop order ke-satu yang berbeda untuk konsentrasi CH3COOH yang berbeda dan perbandingannya tidak sama dengan perbandingan perbedaan konsentrasi CH3COOH. Hal ini mengakibatkan harga yang diperoleh berbeda-beda.
Dalam Tabel 2 bisa dilihat bahwa harga κ yang diperoleh berbeda-beda pada konsentrasi CH3COOH. Persamaan [5] menunjukkan bahwa harga slop berbanding langsung dengan vmaks. Karena harga vmaks. berbanding langsung dengan konsenrasi enzim, maka harga slop seharusnya juga berbanding lurus dengan konsentrasi enzim. Tetapi hasil percobaan eksperimental memberikan hasil yang berbeda. Tabel 2 menunjukkan bahwa harga vmaks pada konsentrasi CH3COOH 1,5x10-3 M adalah duakali lebih besar dari harga vmaks pada konsentrasi CH3COOH 0,75x10-3 M. Akan tetapi harga slopnya hampir sama yaitu 3,35 dan 2,59. Hal ini mungkin dapat terjadi karena harga slop dihitung dengan asumsi bahwa reaksi berlangsung pada order ke-satu.
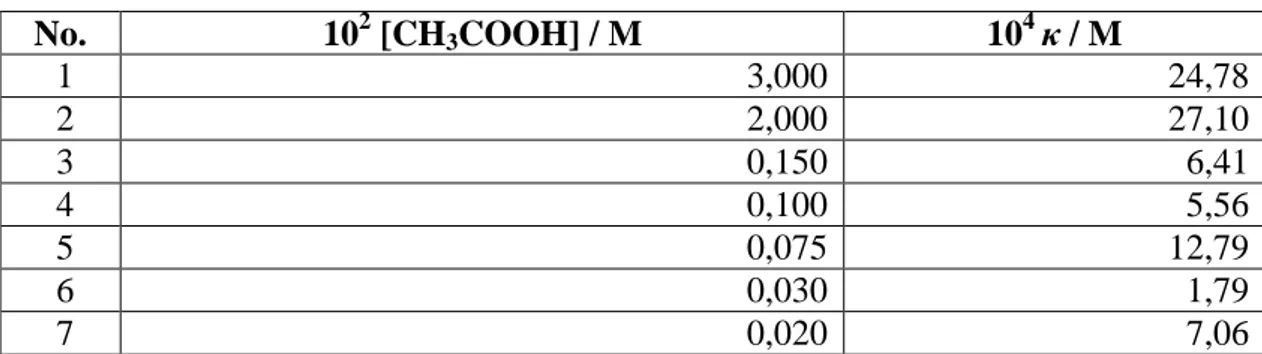
Tabel 3. Harga persamaan Espenson pada reaksi CH3COOH dengan Br2 pada berbagai konsentrasi CH3COOH dengan 0,00300 M Br2.
No. 102 [CH3COOH] / M 104 κ / M 1 3,000 24,78 2 2,000 27,10 3 0,150 6,41 4 0,100 5,56 5 0,075 12,79 6 0,030 1,79 7 0,020 7,06
Berdasarkan data di Tabel 3, dengan persamaan Espenson diperoleh harga untuk semua data, baik yang memenuhi ataupun tidak memenuhi reaksi enzimatis. Hal ini berarti bahwa perhitungan dengan persamaan Espenson bisa digunakan pada sembarang data. Selain itu, harga yang didapatkan berbeda-beda pada konsentrasi CH3COOH yang berbeda (pada hal seharusnya sama) Berdasarkan data tersebut harga yang lebih tepat tentunya pada konsentrasi awal CH3COOH 0,0015 M; 0,001 M; dan 0,00075 M karena pada kondisi ini reaksi memenuhi reaksi enzimatis, tetapi dari ketiga data tersebut belum diketahui harga yang paling tepat. Dikatakan bahwa persamaan Espenson adalah model linear tetapi dalam pemakaiannya tidak memperhatikan nilai koefisien regresinya, sehingga dengan persamaan ini tidak dapat ditentukan harga yang paling tepat.
79 Tabel 4. Harga persamaan Espenson dan integral reaksi CH3COOH dengan Br2 pada
0,0015 M; 0,001 M; dan 0,00075 M CH3COOH dengan 0,003 M Br2.
No. 103 [CH3COOH] / M 104 κ Espenson / M 104 κ Integra / M
1 1,50 6,41 3,35
2 1,00 5,56 3,67
3 0,75 12,79 2,59
Apabila hasil perhitungan harga dari persamaan Espenson dibandingkan dengan integral (ditunjukkan pada Tabel 4). Pada konsentrasi CH3COOH 0,0015 M; 0,0010 M dan 0,00075 M diperoleh bahwa harga Espenson masing-masing konsentrasi sangat berbeda dari integral. Persamaan Espenson juga merupakan persamaan berbasis metode integral, seharusnya memberikan harga yang sama. Faktanya dengan menggunakan data yang sama, dari dua persamaan diperoleh harga yang berbeda. Harga yang lebih tepat tentunya yang diperoleh dari persamaan integral karena persamaan ini mempersyaratkan uji linearitas, sehingga berdasarkan nilai koefisien regresi dapat ditentukan harga yang paling tepat.
Perbedaan harga κ yang diperoleh dari persamaan Espenson disebabkan oleh paradigma yang digunakan yaitu bahwa harga vmaks tidak berubah dengan berubahnya konsentrasi enzim. Karena rentang waktu, σ, juga dibuat tetap maka, tidak mungkin diperoleh harga κ yang sama karena harga κ yang sama hanya dapat diperoleh jika kurva persamaan garisnya sejajar, sehingga nilai slopnya tetap. Sedangkan pada persamaan yang dikembangkan oleh Patiha (2011) slop yang digunakan berasal dari persamaan garis yang berbeda (order ke-satu). Harga masing-masing slop tergantung pada konsentrasi enzimnya dan selalu sebanding dengannya.
KESIMPULAN
Hasil penelitian menunjukkan bawa reaksi CH3COOH dengan Br2 mirip reaksi enzimatis pada kondisi konsentrasi awal CH3COOH 0,00150 M; 0,00100 M; dan 0,00075 M dengan konsentrasi Br2 0,00300 M. Banyaknya konsentrasi CH3COOH yang digunakan mempengaruhi besarnya vmaks Harga reaksi CH3COOH dengan Br2 dari persamaan Espenson berbeda dengan persamaan integral. Penentuan harga lebih tepat menggunakan persamaan integral sebab persamaan ini mempersyaratkan uji linearitas.
80
DAFTAR PUSTAKA
Briggs, G. E. and J. B. S. Haldane. 1925. A Note on the Kinetics of Enzyme Action.
Biochem. Vol 19. 338 – 339.
Camps, P., A. E. Lukach, X. Pujol, S. Vasquez. 2000. Hunsdiecker-Type Bromodekarboxylation of Carboxylic Acids with Iodosobenzene Diacetate-Bromine.
Tetrahedron. Vol. 56. 2703 – 2707.
Daniels, F., J. W. Williams, P. Bender, R. A. Alberty, C. D. Cornwell, and J. E. Harriman. 1970. Experimental Physical Chemistry, 7th Ed. Tokyo: Kogakusha Company.
Espenson, J. H. 1995. Chemical Kinetics and Reaction Mechanisms, 2nd Ed. New York:
McGraw-Hill, Inc.
Hodgson, S.C., L. N. Ngeh, J. D. Orbell, and S. W. Bigger. 1998. A Student Experiment in Non-Isotermal Chemical Kinetics. JChemEd. Vol. 75 No. 9. 1150-1153.
Laidler, K. J. 1987. Chemical Kinetics, 3rd Ed. New York: Harper Collins Publisher, Inc.
Michaelis, L.; Menten, M.L. 1913, "Die Kinetik der Invertinwirkung", Biochem Z 49: 333– 369
Patiha. 2009. Persamaan Kinetika Kimia Terpadu untuk Reaksi Enzimatis
Michaelis-Mentenis dan yang Mirip. Laporan Penelitian Fundamental Tak-dipublikasikan.
Surakarta: FMIPA UNS.
Patiha, 2011. Teknik dan Persamaan Baru yang Efektif untuk Penentuan Tetapan
Michaelis-Menten dan yang Mirip. Laporan Penelitian Fundamental