7
Agar merupakan campuran polisakarida yang diekstraksi dari dinding sel ganggang merah (Rhodophyta), khususnya genus Gracilaria dan Gelidium. Agar merupakan sebuah polisakarida kompleks terbarukan yang terdiri dari agarosa dan agaropektin yang digunakan dalam penyusunan media pertumbuhan mikroba, permen dan agar jelly. Agarosa memiliki potensi pemanfaatan sebagai pangan, farmasi dan industri kosmetik seperti penyedia biomassa potensial, sumber oligosakarida, anti bakteri, anti kanker dan antioksidan, serta dapat mempengaruhi sel-sel melanoma sehingga dapat melembabkan dan memutihkan kulit (Kobayashi 1997).
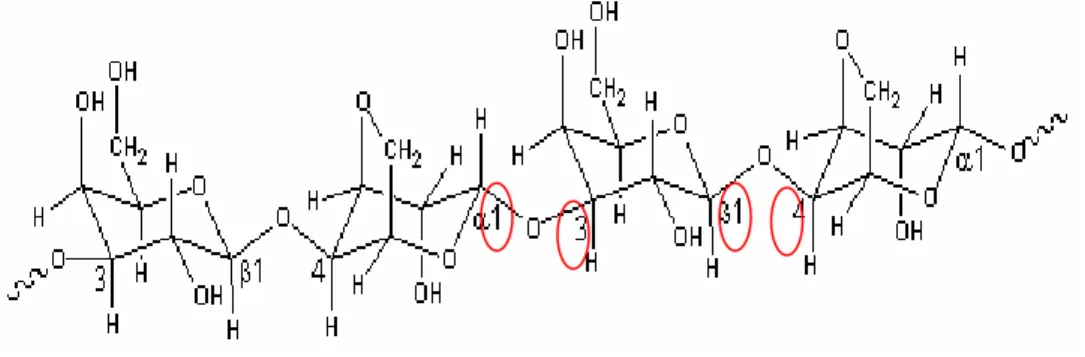
Agarosa memiliki berat molekul di atas 100.000 Daltons dengan kadar sulfat rendah di bawah 0,15%. Agaropektin memiliki berat molekul lebih ringan sebesar kurang dari 20.000 Daltons tetapi dengan kadar sulfat tinggi sekitar 5% sampai 8% (Kim Sang Moo 2010). Kandungan sulfat pada agarosa rendah sehingga sering dimanfaatkan sebagai media pertumbuhan bakteri. Kandungan sulfat mempengaruhi gel strength sehingga agar yang mengandung agarosa akan mudah memadat. Agarosa terdiri dari rantai D-galaktosa yang berikatan secara 1,3 dengan 3,6-anhidro-L-galaktosa dan rantai 3,6-anhidro-L-galaktosa yang berikatan secara 1,4 dengan D-galaktosa.
Gambar 1. Struktur Agarosa (Sumber : Moo 2010)
Pemanfaatan agarosa dalam bidang bioteknologi (Renn 1990 dalam Rasyid 1999):
1 Elektroforesis
Gel agarosa digunakan sebagai media elektroforesis untuk pemisah protein, asam nukleat dan derivat keduanya.
2 Immunologi
Penggunaan agarosa dalam immunologi adalah untuk mendeteksi dan mempelajari berbagai jenis antigen, terutama indikator penyakit dan penentuan spesifikasi antibodi.
3 Kromatografi
Agarosa efektif untuk pemisahan senyawa karena bersifat uniform. Cocok digunakan untuk pemisahan senyawa dengan berat molekul lebih dari 250.000
2.2 Enzim Agarase
Enzim adalah molekul biopolimer yang tersusun dari serangkaian asam amino dalam komposisi dan susunan rantai yang teratur dan tetap. Enzim memegang peranan penting dalam berbagai reaksi di dalam sel. Sebagai protein, enzim diproduksi dan digunakan oleh sel hidup untuk mengkatalisis reaksi, antara lain konversi energi dan metabolisme pertahanan sel (Girindra 1986).
Enzim dikatakan sebagai suatu kelompok protein yang berperan dalam aktivitas biologis. Enzim ini berfungsi sebagai katalisator dalam sel dan sifatnya sangat khas. Enzim dalam jumlah yang sangat kecil dapat mengatur reaksi tertentu sehingga dalam keadaan normal tidak terjadi penyimpangan hasil reaksinya. Enzim akan kehilangan aktivitasnya karena panas, asam dan basa kuat, pelarut organik atau apa saja yang bisa menyebabkan denaturasi protein. Enzim dinyatakan mempunyai sifat yang sangat khas karena hanya bekerja pada substrat tertentu (Girindra 1986).
Enzim tersusun atas dua bagian. Apabila enzim dipisahkan satu sama lainnya menyebabkan enzim tidak aktif. Namun keduanya dapat digabungkan
menjadi satu, yang disebut holoenzim. Kedua bagian enzim tersebut yaitu apoenzim dan koenzim (Girindra 1986).
Agarase adalah enzim yang berperan dalam proses hidrolisis agar. Agarase digunakan untuk menyiapkan protoplas dari ganggang laut (Araki 1998) dan untuk mengisolasi asam deoksiribonukleat (DNA) dari gel agarosa (Sugano 1993).
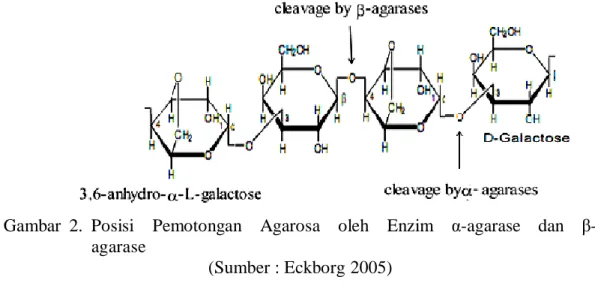
Berdasarkan mekanismenya dalam menghidrolisis agarosa, enzim agarase diklasifikasikan kedalam dua kelompok yaitu α-agarase yang memotong ikatan α-1,3 dari agarosa dan β-agarase yang memotong ikatan β-1,4 dari agarosa (Sugano 1993). Bakteri pada kelompok I dapat melembutkan agar (media) dan membentuk cekungan di sekitar koloni dan kelompok II menyebabkan pencairan luas agar (media) (Kobayashi 1997).
Gambar 2. Posisi Pemotongan Agarosa oleh Enzim α-agarase dan β-agarase
(Sumber : Eckborg 2005)
α-agarase yang menghidrolisis ikatan α-1,3 dari agarosa akan menghasilkan rangkaian oligosakarida yang disebut agarobiose. Sedangkan β-agarase yang menghidrolisis ikatan β-1,4 dari agarosa akan menghasilkan rangkaian oligosakarida yang disebut neoagarobiose (Moo 2010).
Gambar 3. Struktur Agarobiose (A), Struktur Neoagarobiose (B) (Sumber : Moo 2010)
Berdasarkan sekuen gen glikosida hidrolase, ada tiga famili β-agarase yaitu GH-16, GH-50 dan GH-86. Famili GH-16 ditemukan sangat melimpah dengan β-agarase yang berasal dari Streptomyces coelicolor A3, Aeromonas sp., Pseudomonas sp. ND137, Pseudoalteromonas CY24, Pseudoalteromonas atlantica ATCC 19262 dan dari Zobellia galactanivorans. Family GH-50 mengandung dua β-agarase dari Vibrio sp. JT0107, sedangkan family GH-86 mengandung β-agarase dari P. alantica (Allouch 2003).
Tahapan reaksi degradasi agarosa oleh β-agarase terkarakterisasi dengan baik pada Pseudoalteromonas atlantica ATCC 19262. Pada bakteri ini terdapat dua jenis β-agarase yang bekerja secara sekuensial. Enzim ekstraseluler endo-β- agarase I memiliki aktivitas mendepolimerisasi agarosa menjadi neoagarotetrosa sebagai produk akhir. Neoagarotetrosa kemudian akan dihidrolisis lebih lanjut oleh 2 enzim periplasmik, β-agarase II (lebih dikenal dengan sebutan neoagarotetrosa hidrolase) dan neoagarobiose hidrolase, yang menghasilkan produk akhir berupa 3,6-anhidro-L-galaktosa dan D-galaktosa (Vera 1998).
Berbeda halnya dengan β-agarase yang dihasilkan oleh banyak kelompok bakteri, enzim α-agarase diketahui hanya dihasilkan oleh Alteromonas agaroliticus GJIB. Sistem agarolitik pada bakteri ini terdiri atas 2 enzim yaitu suatu α-agarase yang memecah ikatan α-(1,3) dari agarosa menjadi oligosakarida dalam bentuk agarobiosa dan enzim β-galaktosidase spesifik untuk kehadiran 3,6-anhidro-L-galaktosa sebagai produk akhir (Vera 1998).
Sejauh ini, beberapa agarase telah diisolasi dari mikroorganisme yang berbeda, termasuk Alteromonas sp. (Kirimura 1999 dan Wang 2006), Pseudoalteromonas sp. (Vera 1998), Vibrio (Araki 1998), Cytophaga (Duckworth 1969) dan Thalassomonas (Ohta 2005). Semua mikroorganisme tersebut merupakan bakteri gram negatif. Di samping itu, agarase juga telah diisolasi dari beberapa bakteri non-marine, seperti dari tanah (Sampietro 1971), sungai (Agbo 1979) dan limbah (Hofsten 1975).
Kemampuan mendegradasi agarosa oleh agarase membuat agarase sangat bermanfaat dalam industri makanan, industri kosmetik, dan medis. Produk degradasi dari agar, neoagarooligosakarida menghambat pertumbuhan bakteri dan memperlambat laju degradasi pati. Selain itu, neoagarobiose (NA2), merupakan suatu senyawa langka karena memiliki kemampuan sebagai pelembab dan memberikan efek pemutih pada sel melanoma (Kobayashi 1997). Fraksi polisakarida dari ganggang laut oleh agarase juga memiliki aktivitas merangsang makrofag (Kirimura 1999 dan Ohta 2005).
2.3 Teknik 16S rRNA
RNA ribosom (rRNA) merupakan komponen inti pembentuk protein pada suatu makhluk hidup. Molekul rRNA bersifat ubikuitus dengan fungsi yang identik pada seluruh organisme. Ribosom merupakan kompleks ribonukleoprotein yang terdiri atas dua subunit yaitu subunit kecil (small subunit) dan subunit besar (large subunit). Terdapat tiga jenis RNA dalam ribosom prokariotik berdasarkan nilai koefisien sedimentasi, yaitu 5S, 16S, dan 23S rRNA. Gen 16S rRNA merupakan bagian dari subunit kecil ribosom dan berperan penting dalam pengenalan ujung 5’–mRNA serta memposisikan pada letak yang tepat dalam ribosom (Clarridge 2004).
RNA ribosom pada semua sel memiliki daerah yang urutan basanya sangat lestari dan beberapa daerah yang urutan basanya variatif. Perbandingan urutan basa yang lestari berguna untuk mengkonstruksi pohon filogenetik karena mengalami perubahan dengan relatif lambat dan mencerminkan kronologi evolusi bumi. Sebaliknya, urutan basa yang bersifat variatif
dapat digunakan untuk melacak keragaman dan menempatkan galur-galur dalam satu spesies (Pangastuti 2006).
Molekul 5S rRNA memiliki urutan basa terlalu pendek sehingga tidak ideal dari segi analisis statistika. Sementara molekul 23S rRNA memiliki struktur sekunder dan tersier yang cukup panjang sehingga menyulitkan analisis. Sekuens gen 16S rRNA ini dapat digunakan untuk identifikasi bakteri yang mengalami penyimpangan strain fenotip. 5S memiliki 120 urutan basa, 16S memiliki 1500 urutan basa, dan 23S memiliki 2900 urutan basa (Pangastuti 2006).
Jadi metode 16s rRNA adalah teknologi analisis secara molekuler dengan menganalisis sekuen gen 16S rRNA. Gen ini adalah gen yang mengkode RNA ribosomal sub unit kecil ribosom (16S untuk prokariot) dan memiliki urutan yang khas dan berbeda pada setiap bakteri sehingga bisa dijadikan penanda molekuler untuk proses identifikasi (Claridge 2004). Dua bakteri dapat dikelompokkan dalam satu genus bila memiliki kemiripan maksimum (maximum identity) ≥ 93 ≤97%. Sementara dua bakteri dianggap sebagai satu spesies bila memiliki kemiripan maksimum ≥ 97% (Hagstrom 2002).
Analisis gen penyandi 16S rRNA praktis untuk definisi spesies, karena molekul ini bersifat ubikuitus, sehingga dapat dirancang suatu primer yang universal untuk seluruh kelompok. Penentuan spesies baru pun dapat dilakukan tanpa mengisolasi mikroorganisme yang bersangkutan.
Secara umum, beberapa keuntungan menggunakan metode 16S rRNA adalah :
Molekul yang dikode oleh gen 16S rRNA ini ditemukan pada semua prokariot Memiliki jumlah nukleotida yang cukup banyak untuk dibandingkan satu dengan lainnya
Memiliki basa-basa yang lestari
Memiliki daerah variable yang cukup untuk melihat hubungan kekerabatan antar mikroorganisme
2.4 Identifikasi 16S rRNA dengan Metode Polymerase Chain Reaction (PCR)
Identifikasi molekuler digunakan untuk mempelajari kesamaan deoxyribonucleic acid (DNA) atau homologi genetik diantara organisme. Kesamaan DNA dapat dipelajari dengan sekuensing terhadap basa DNA atau RNA dan hibridisasi DNA (Malik 2006). Penggunaan untai gen ribosomal RNA untuk klasifikasi mikroorganisme saat ini merupakan salah satu analisis yang cukup akurat untuk menentukan kekerabatan diantara mikroorganisme (Suryadi 2002). Situs DNA molekul 16S rRNA dikenal mempunyai informasi genetik yang cukup lengkap untuk melihat kekerabatan bakteri (Leblond 1996).
Identifikasi 16S rRNA dapat dilakukan dengan metode Polymerase Chain Reaction (PCR). PCR merupakan suatu metode untuk membuat salinan segmen spesifik dari suatu DNA. Metode ini jauh lebih cepat daripada pengklon gen dengan DNA plasmid atau DNA faga dan seluruhnya dilakukan in vitro (Campbell 2002).
Gen pengkode 16S rRNA terdapat bagian penyimpan yang berguna untuk mendesain primer universal PCR yang mampu memperbanyak beberapa fragmen. Fragmen ini termasuk bagian hipervariable yang tidak mudah termutasi dan mengandung tanda urutan spesifik spesies yang berguna untuk mengidentifikasi bakteri hingga ke level spesies (Israhmadini 2008).
Proses PCR merupakan proses siklus yang berulang meliputi denaturasi, annealing dan ekstensi utas DNA oleh enzim DNA polymerase. Setiap siklus dikondisikan pada temperatur berbeda yang telah diprogram oleh mesin yang disebut thermal cycler. Dasar siklus PCR ada 30-35 siklus, siklus ini meliputi:
denaturasi (95°C), untaian ganda DNA target dipisahkan
annealing (55-60°C), primer dibiarkan berikatan dengan ujung-ujung urutan DNA target yang spesifik, dan
ekstensi (72°C) merupakan proses pemanjangan pita DNA setelah berikatan dengan primer.
Taq polimerase menambahkan nukleotida pada ujung 3’ primer dengan menggunakan untai DNA yang lebih panjang sebagai cetakannya. Sedangkan untuk waktu tergantung pada panjang pendeknya ukuran DNA yang diinginkan sebagai produk amplifikasi. Campuran reaksi PCR terdiri atas komponen-komponen yaitu template DNA, buffer, dNTP (dATP, dCTP, dGTP, dTTP), primer dan unit taq polimerase (Malik 2006).
2.5 Gracilaria sp.
Gracilaria sp. merupakan penghasil agar (agarofit) yang merupakan senyawa hidrokoloid dari rumput laut yang mempunyai kekuatan gel yang besar. Selama ini Gracilaria sp. merupakan bahan baku utama industri makanan untuk pembuatan agar-agar serta bahan kosmetik. Rumput laut ini digolongkan ke dalam rumput laut merah (Rhodophyta).
Kingdom : Protista Divisi : Rhodophyta Kelas : Rhodophyceae Ordo : Gigartinales Famili : Gracilariaceae Genus : Glacilaria Spesies : Glacilaria sp. Gambar 4. Gracilaria sp. (Sumber : dokumentasi pribadi)
Sebanyak 90% Gracilaria sp. hidup di laut dan 10% hidup di air tawar. Ciri umum dari Gracilaria sp. adalah :
1. Berwarna merah karena mengandung pigmen fikoeritrin
2. Mempunyai bentuk thallus silindris atau gepeng dengan percabangan yang membentuk garpu
3. Permukaannya halus.
4. Diameter thallus berkisar antara 0,5 – 2 mm 5. Panjang dapat mencapai 30 cm atau lebih
6. Glacilaria tumbuh di rataan terumbu karang dengan air jernih dan arus cukup
7. Hidup pada salinitas ideal berkisar 20-28 per mil
Gracilaria merupakan jenis rumput laut yang mempunyai toleransi cukup luas terhadap faktor-faktor lingkungannya, dapat hidup di perairan yang tenang dengan substrat berlumpur dan pH berkisar antara 6-9 (Anggadiredja 2006). Reproduksinya dapat terjadi secara generatif yaitu dengan pembentukan spora yang selanjutnya tumbuh menjadi ganggang jantan dan betina (Anggadiredja 2006).
2.6 Sargassum sp.
Salah satu jenis dari alga coklat adalah Sargassum sp. Alga ini mampu tumbuh pada substrat batu karang di daerah berombak (Anggadiredja 2006). Klasifikasi Sargassum sp. sebagai berikut :
Kingdom : Plantae Divisi : Phaeophyta Kelas : Phaeophyceae Bangsa : Fucales Suku : Sargassaceae Genus : Sargassum Spesies : Sargassum sp.
Gambar 5. Sargassum sp. (Sumber : dokumentasi pribadi)
Ciri-ciri umum dari jenis ini adalah bentuk thallus umumnya silindris atau gepeng, cabangnya rimbun menyerupai pohon di darat, bentuk daun melebar, lonjong, atau seperti pedang, mempunyai gelembung udara (bladder) yang umumnya soliter, panjang umumnya mencapai 7 meter (di Indonesia terdapat 3 spesies yang panjangnya 3 meter), warna thalllus umumnya coklat. Sargassum biasanya dicirikan oleh tiga sifat yaitu adanya pigmen coklat yang menutupi warna hijau, hasil fotosintesis terhimpun dalam bentuk laminaran dan algin serta adanya flagel (Tjondronegoro 1989).
Sargassum tersebar luas di Indonesia, tumbuh di perairan yang terlindung maupun yang berombak besar pada habitat batu. Pada umumnya Sargassum tumbuh di daerah terumbu karang (coral reef) seperti di Kepulauan Seribu, terutama di daerah rataan pasir (sand flat). Daerah ini akan kering pada saat surut rendah, mempunyai dasar berpasir, secara sporadis terdapat pula pada karang hidup atau mati, rumput laut coklat tumbuh diatasnya (Atmadja dan Soelistijo 1988). Sargassum sp. mengandung iodium dan senyawa aktif seperti senyawa fenol.