PREPARASI DAN UJI STABILITAS 177LU-DOTA-NIMOTUZUMAB
SEBAGAI RADIOFARMAKA TERAPI KANKER
Titis Sekar Humani, Martalena Ramli, Cecep Taufik Rustendi, Muhammad Subur
Pusat Radioisotop dan Radiofarmaka – BATAN Kawasan Puspiptek Gd. 11 Serpong – Tangerang
E-mail : inok_humani7@yahoo.com
Abstrak
PREPARASI DAN UJI STABILITAS 177Lu-DOTA-NIMOTUZUMAB SEBAGAI RADIOFARMAKA TERAPI KANKER. Nimotuzumab adalah “humanized” antibodi monoklonal (mAb) yang spesifik terhadap epidermal growth factor receptor (EGFR), sasaran kunci dalam pengembangan obat terapi kanker. Dalam penelitian ini telah dilakukan preparasi dan uji stabilitas 177Lu-DOTA-Nimotuzumab sebagai radiofarmaka terapi yang diharapkan lebih poten dibandingkan dengan penggunaan Nimotuzumab atau radiasi secara sendiri-sendiri. Preparasi 177Lu-DOTA-Nimotuzumab, diawali dengan penyiapan immunokonjugat DOTA-Nimotuzumab yang kemudian dilanjutkan dengan proses penandaan dengan 177Lu dan proses pemurnian dengan kolom Sephadex G-25M, berhasil memberikan 177Lu-DOTA-Nimotuzumab dengan kemurnian radiokimia > 99%. Untuk memonitor kualitas dan stabilitas hasil penandaan sistem kromatografi lapis tipis (KLT), dengan fase diam dan fase gerak masing-masing adalah ITLC-SG dan salin telah berhasil dikembangkan. Hasil uji stabilitas 177Lu-DOTA-Nimotuzumab memperlihatkan bahwa radiimmunokonjugat ini masih tetap utuh. Kemurnian radiokimia radioimmunokonjugat ini setelah penyimpanan selama 96 jam pada suhu kamar, pada suhu 4C dan dalam serum pada suhu 37C berturut-turut adalah 97,42 ± 0,59, 96,27 ± 0,08 dan 99,46 ± 0,07%.
Kata kunci : 177Lu-DOTA-Nimotuzumab, epidermal growth factor receptor (EGFR), glioma, radiofarmaka terapi
Abstract
PREPARATION AND STABILITY TEST OF 177Lu-DOTA-NIMOTUZUMAB AS RADIOPHARMACUTICAL FOR THERAPY OF CANCER. Nimotuzumab is a humanized monoclonal antibody (mAb) that targets the epidermal growth factor receptor (EGFR), a key target in the development of cancer therapeutics. In this research project a preparation and stability test of a potential therapeutic radiopharmaceutical, 177Lu-DOTA-Nimotuzumab, which was expected to be more potent than the use of Nimotuzumab or radiotherapy alone, had been carried out. Preparation of 177Lu-DOTA-Nimotuzumab, which was initiated by preparing of immunoconjugate DOTA-Nimotuzumab then followed by radiolabelling with 177Lu and purification process using Sephadex G-25M column, resulted in a 177Lu-DOTA-Nimotuzumab with radiochemical purity of >99%. A Thin-Layer-Chromatography (TLC) system, where ITLC-SG used as static phase and saline as mobile phase, for monitoring of quality and stability of 177Lu-DOTA-Nimotuzumab, had also been developed successfully. The stability test 177Lu-DOTA-Nimotuzumab showed that this radioimmunoconjugate was still intact for 96 hours. The radiochemical purity of 177Lu-DOTA-Nimotuzumab which kept at room temperature, at 4 0C and in serum at 37 0C for 96 hours was found to be 97,42 ± 0,59, 96,27 ± 0,08 dan 99,46 ± 0,07% respectively.
Keywords : 177Lu-DOTA-Nimotuzumab, epidermal growth factor receptor (EGFR), glioma, therapeutic radiopharmaceutical
PENDAHULUAN
Nimotuzumab merupakan obat anti kanker yang termasuk dalam kelompok inhibitor epidermal growth factor receptor (EGFR). Senyawa ini menghambat protein reseptor epidermal growth factor (EGF) yang banyak terdapat pada pemukaan sel kanker. EGF secara normal menstimulasi sel untuk tumbuh dan berdiferensiasi. Dengan menghambat reseptor ini, nimotuzumab mencegah sel kanker menerima pesan yang diperlukan sel untuk tumbuh, berkembang dan menyebar.(1) Nimotuzumab menghambat aktivasi protein tirosin kinase dan berikatan dengan afinitas yang optimal serta spesifisitas tinggi pada daerah ekstraseluler dari EGFR, sehingga dapat menghambat ikatan ligan dan aktivasi reseptor.(2,3)
Nimotuzumab merupakan humanized antibodi monoclonal yang 95% rangkaian asam aminonya mirip dengan rangkaian asam amino antibodi manusia, sehingga pada penggunaanya dapat mengurangi efek samping seperti ruam, diare dan konjungtivitis.(4) EGFR merupakan target kunci dalam pengembangan terapi kanker. Obat-obatan dengan target EGFR terbukti dapat meningkatkan efek terapi bila digunakan bersamaan dengan terapi secara konvensional seperti terapi radiasi dan kemoterapi.(3) Nimotuzumab telah digunakan oleh lebih dari 1800 pasien di seluruh dunia melalui uji klinis maupun penjualan komersial, dan dari laporan terakhir tidak ditemukan adanya efek samping seperti yang diuraikan diatas. Efek samping yang sering ditemukan pada penggunaan EGFR-targeting monoclonal antibodies atau molekul kecil lainnya hampir atau jarang terjadi pada penggunaan Nimotuzumab.(2)
Laporan terakhir juga menginformasikan bahwa Nimotuzumab sedang dipelajari dalam uji klinis untuk lebih dari 10 indikasi keganasan, dan secara bervariasi sudah disetujui di beberapa negara untuk terapi kegansan otak, kanker leher dan glioma, serta sedang dalam uji klinis untuk bermacam-macam tipe keganasan lain seperti kolorektal, glioma (pada manula dan dewasa), pankreas, prostat, non-small cell lung, esofagus, leher rahim dan keganasan payudara.(1) Di Amerika, uji klinis fase II untuk keamanan dan efikasi dari nimotuzumab pada pasien manula yang menderita glioma yang kambuh secara berkepanjangan dan sudah menyebar sedang dilakukan. Uji ini sudah dimulai dari Oktober 2007 dan berakhir pada Desember 2009.(2)
Berdasarkan fakta adanya peningkatan efek pengobatan dari nimotuzumab bila digunakan bersamaan dengan radioterapi(3), maka dirasa perlu dilakukan pengembangan radiofarmaka yang dapat
mensinergikan kemampuan Nimotuzumab yang tidak hanya mampu berikatan dengan target target EGFR secara spesifik tetapi juga mampu menghentikan berkembang dan menyebarnya keganasan dengan radionuklida pemancar partikel alfa atau beta yang mampu mentransfer energi (cross fire) pada sel kanker yang ada disekitarnya yang pada gilirannya akan menghancurkan sel kanker tersebut. Terapi keganasan dengan radiofarmaka ini diharapkan bersifat terarah (targeted) sehingga bisa lebih efektif dibandingkan dengan penggunaan Nimotuzumab atau radioterapi secara sendiri-sendiri. Selain itu terapi dengan radiofarmaka ini diharapkan memberikan efek samping yang jauh lebih rendah karena bersifat terarah sehingga radiasi terhadap sel yang tidak menjadi target (sel normal) dapat dihindarkan.
Radionuklida yang dipilih untuk penandaan Nimotuzumab dalam penelitian ini adalah 177Lu. Pemilihan radionuklida ini karena 177Lu mempunyai mempunyai sifat kimia dan terutama sifat fisika yang sangat atraktif untuk terapi kanker. Lu-177 adalah pemancar partikel relatif lunak dengan Emax 497 keV (78,6%) dan 176 (12,2%) keV dan
kemampuan penetrasi ~ 1,5 mm yang sesuai untuk kanker berukuran kecil. Radionuklida 177Lu juga memancarkan sinar [113 (6,4%) dan 208 (11%) keV] yang sangat ideal digunakan untuk pencitraan, sehingga deposisi agent secara in vivo dapat diamati. Pengadaan 177Lu dengan aktifitas jenis yang cukup tinggi (~ 10 Ci/ mg Lu) melalui reaksi inti [176Lu(n,)177Lu] relatif mudah karena tampang lintang reaksi yang cukup tinggi yaitu 2100 barn.(5)
Kromatografi adalah suatu metoda pemisahan yang banyak digunakan dalam proses pemurnian dan kendali kualitas radiofarmaka. Kromatografi adalah suatu metoda pemisahan yang didasarkan pada perbedaan migrasi senyawa-senyawa yang dipisahkan pada suatu sistim yang terdiri dari dari fasa diam dan fasa gerak. Pada awal perkembangannya pemisahan dengan kromatografi hanya didasarkan pada perbedaan kemampuan serap senyawa-senyawa yang akan dipisahkan pada suatu fasa diam (kromatografi adsorpsi). Fasa diam kemudian dielusi dengan eluen yang sesuai untuk memisahkan senyawa-senyawa yang terserap tersebut. Senyawa yang tidak terserap dengan baik pada fasa gerak akan bergerak bersama fasa gerak dan yang terserap dengan baik akan tetap pada posisi awal senyawa tersebut diaplikasikan. Pada perkembangannya pemisahan campuran dengan kromatografi juga didasarkan pada perbedaan koeffisen partisi,/ koeffesien distribusi kromatografi partisi), muatan (penukar ion), perbedaan besar molekul (kromatografi saring molekul) dan beberapa prinsip migrasi lainnya.(6) Pada penelitian
ini dua metoda kromatografi yaitu kromatografi lapisan tipis (KLT) dan kromatografi saringan molekul digunakan berturut-turut untuk penentuan kemurnian dan pemurnian radiofarmaka yang disiapkan dalam penelitian ini.
Tujuan dari penelitian ini adalah untuk melakukan penandaan Nimotuzumab dengan 177Lu dan uji stabilitas hasil penandaan. Dengan mensinergikan kemampuan Nimotuzumab dan
177
Lu dalam bentuk Nimotuzumab bertanda 177Lu maka radioimmunokonjugat ini diharapkan dapat mengantisipasi permintaan dalam negeri akan radiofarmaka terapi untuk pengobatan berbagai macam keganasan seperti keganasan leher, pankreas maupun glioma yang mempunyai ekspresi EFGR.
METODE
Bahan kimia yang digunakan dalam penelitian ini adalah DOTA (Fluka), resin penukar ion Chelex 100 (Bio-Rad), larutan salin (IPHA), ammonium asetat, NaHCO3, K2HPO4, KH2PO4,
sulfo-N-hydroxisulfosuccinimide (sulfo-NHS), dan 1-ethyl-3-[3-dimethylaminoprpyl]carbodimide hyrocloride) (EDC) (Sigma), Nimotuzumab (Innogene, Kalbe Tech), HCl, NaOH, dan EDTA (E. Merck), Bovine Serum Albumin (BSA, Sigma), dan air bebas ion (hambatan 18 MegaOhm). Bahan lain yang digunakan adalah kaset dialisa (20.000 MWCO, Pierce), protein filter (10.000 MWCO, 5 ml, Viva Science) dan Sephadex G-25 Medium (Pharmacia). Lu-177 (177LuCl3) diperoleh dengan cara irradiasi 176
Lu (176Lu2O3, pengkayaan 39,60%, Isoflex,) di
RSG-GAS yang kemudian diproses di laboratorim PRR. Semua bahan kimia digunakan sebagaimana adanya kecuali jika ada pemurnian akan dijelaskan dalam prosedur kerja.
Alat yang digunakan dalam penelitian ini diantaranya adalah magenetic stirer (Labcompanion), kromatografi cair kinerja tinggi (KCKT) yang dilengkapi dengan detektor UV-Vis (Shimadzu), thermomixer (Eppendrof) Kromatografi Lapisan Tipis (KLT) scanner.
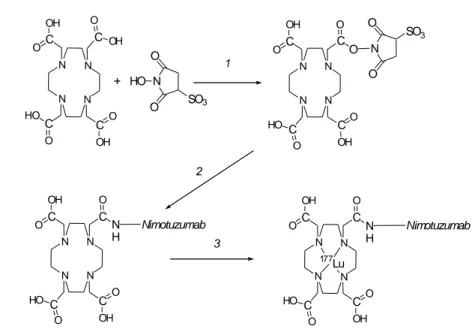
N N N N C OH O CO O C OH O C HO O N O O SO3 N N N N C OH O CN H O C OH O C HO O Nimotuzumab 177 Lu N O O HO SO3 C OH O C HO O C OH O C OH O N N N N N N N N C OH O CN H O C OH O C HO O Nimotuzumab + 1 2 3
Gambar 1. Skema Reaksi Penandaan DOTA-Nimotuzumab dengan 177Lu
Reaksi dan Kondisi: (1) EDC, (2) Nimotuzumab, (3) 177Lu
Nimotuzumab bertanda 177Lu disiapkan melalui beberapa tahap reaksi seperti terlihat pada Gambar 1. Oleh karena Nimotuzumab adalah merupakan protein yang tidak bisa langsung ditandai dengan
177
Lu, maka Nimotuzumab harus dimodifikasi sedemikian rupa sehingga mampu mengikat 177Lu dengan stabil. (DOTA) adalah bifunctional chelating agent yang dilaporkan mampu mengikat logam lantanida dengan stabil. Tahap reaksi ini mengacu pada metoda preparasi 90 Y-1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic
acid-mAb (90Y-DOTA-mAb) yang dilaporkan oleh Lewis et al dan Govidan et al,(7,8) yang kemudian dioptimasi oleh Ramli et al.(8) Pertama DOTA diaktifkan dengan cara mereaksikannya dengan sulfo-NHS untuk membentuk ester aktif sulfo-NHS-DOTA dengan menggunakan EDC sebagai condensing agent. Ester aktif ini kemudian dikonjugasikan pada nimotuzumab untuk mendapatkan immunokonjugat DOTA-Nimotuzumab. Immunokonjugat DOTA-Nimotuzumab yang terbentuk kemudian
dimurnikan dari hasil reaksi sampingnya dengan cara dialisis dengan menggunakan kaset dialisa.
1. Dialisis Nimotuzumab
Sebelum dikonjugasikan dengan DOTA, Nimotuzumab dimurnikan terlebih dahulu dengan cara dialisis. Sebanyak 10 ml Nimotuzumab (5mg/ml) dimasukkan dalam kaset dialisis dan kemudian diikuti dengan proses dialisis dalam 1 L dapar fosfat (K2HPO4) 0,1 M pH 7,5 dengan 1,2 g
resin penukar ion Chelex-100. Proses dialisis dilakukan selama selama 72 jam pada suhu 4o C dengan penggantian larutan dapar setiap 24 jam.
2. Penyiapan sulfo-NHS-DOTA dengan EDC sebagai “condensing agent”
Sebelum DOTA dikonjugasikan pada nimotuzumab, DOTA terlebih dahulu harus diaktifasi menjadi bentuk esternya. DOTA (57 mg, 120 mmol) dilarutkan dalam 1620 µl H2O ditambah 160 µl
NaOH 1 M, didinginkan pada suhu 4º C. Sulfo-NHS disiapkan dalam kondisi segar (26 mg, 120 mmol) dilarutkan dalam 800 µl H2O 4º C. Campuran ini
kemudian didinginkan pada temperatur 4C, kemudian ditambahkan 195 µl larutan EDC segar yang dilarutkan dalam H2O (25 mg/ml). Campuran
kemudian dibiarkan bereaksi sambil diaduk selama 30 menit pada suhu 4C. Sulfo-NHS-DOTA yang terbentuk langsung digunakan tanpa pemurnian lebih lanjut.
3. Konjugasi sulfo-NHS-DOTA pada
Nimotuzumab
Kedalam tabung yang berisi 2 ml nimotuzumab ditambahkan larutan sulfo-NHS-DOTA yang telah diatur pH nya menjadi 7,3 (dengan penambahan 0,2 M Na2HPO4 pH 9). Campuran reaksi ini kemudian
diinkubasi pada rotator selama 24 jam pada suhu 4C. Immunokonjugat DOTA-Nimotuzumab yang terbentuk kemudian dimurnikan dengan cara dialisis menggunakan kaset dialisa.
4. Pemurnian immunokonjugat
DOTA-Nimotuzumab
Immunokonjugat DOTA-Nimotuzumab dimasukkan dalam kaset dialisis dan kemudian diikuti dengan proses dialisis dalam 1 L dapar ammunium asetat 0,25 M pH 7.0 dengan 1,2 g resin penukar ion Chelex-100. Proses dialisis dilakukan selama 72 jam pada suhu 4o C kali dengan penggantian larutan dapar setiap 24 jam. Immunokonjugat ini kemudian di masukan ke dalam vial (0,2 mg Nimotuzumab/vial) dan disimpan dalam deep freezer siap untuk ditandai dengan 177Lu.
5. Penyiapan 177LuCl3
177
LuCl3 disiapkan dengan cara mengiradiasi 0,5 –
1,0 mg 176Lu (176Lu2O3, pengkayaan 60.60%) di
RSG-GAS selama 4 atau 10 hari. Target yang telah diiradiasi kemudian dipindahkan kedalam gelas beaker dan kemudian ditambahkan 2 mL HCl 6M. Campuran kemudian didiamkan selama 30 menit sebelum ditambahkan 2 mL H2O2. Campuran reaksi
kemudian dipanaskan dengan pengadukan sampai kering. Garam Lu-177 yang terbentuk kemudian dilarutkan dengan 3 mL HCl 0,5 M.
6. Penandaan immunokonjugat
DOTA-Nimotuzumab dengan 177Lu
Kedalam aliquot immunokonjugat DOTA-Nimotuzumab ditambahkan aliquot 177LuCl3 (yang
telah dikondisikan dengan amonium asetat 0,25 M pH 7,0; 1 : 3). Campuran reaksi kemudian diatur pH nya sampai menjadi 5,5 dengan penambahan larutan HCl 1 M. Campuran reaksi kemudian diinkubasi pada suhu 42C selama 1 jam. Pada akhir reaksi ditambahkan larutan EDTA 0,05 M secara berlebih (perbandingan mol EDTA : 177Lu = 20 : 1) dan diinkubasi selama 5 menit pada suhu 42C. Untuk menentukan persentase penandaan sejumlah 5 µL contoh kemudian diambil dan dianalisa menggunakan KLT dengan fase diam dan fase gerak masing-masing ITLC-SG dan larutan salin. Persentase penandaan dihitung berdasarkan total cacah yang berada dibawah puncak radioimmunokonjugat dibandingkan terhadap cacah total yang diaplikasikan.
7. Pemurnian 177Lu-DOTA-Nimotuzumab
Pemurnian dilakukan dengan melewatkan larutan ke dalam kolom Sephadex G-25 Medium (diameter 1, cm panjang 20 cm) yang sudah dijenuhkan dengan 1 mL larutan BSA 10%, kemudian dielusi dengan 0,1 M phosphate buffer saline (PBS) pH 7,2. Eluat kemudian ditampung dalam 27 tabung reaksi per 0,5 ml.
HASIL DAN PEMBAHASAN
Oleh karena Nimotuzumab adalah merupakan protein yang tidak bisa langsung ditandai dengan
177
Lu, maka Nimotuzumab harus dimodifikasi sedemikian rupa sehingga mampu mengikat 177Lu dengan stabil. 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA) adalah senyawa bifunctional chelating agent (BCA) yang dilaporkan mampu mengikat logam termasuk lantanida dengan stabil.(10,11) Dalam penelitian ini DOTA akan digunakan sebagai BCA yang yang diharapkan mampu mengikat Lu-177 dengan stabil. Konjugasi
DOTA pada Nimotuzumab diawali dengan mengaktifasi DOTA dengan sulfo-NHS untuk membentuk ester aktif sulfo-NHS-DOTA. Ester aktif sulfo-NHS-DOTA ini kemudian dikonjugasikan pada Nimotuzumab untuk membentuk DOTA-Nimotuzumab (Gambar 1.)
Untuk mengkuantifikasi hasil penandaan DOTA-Nimotuzumab dengan 177Lu, suatu sistem kromatografi lapis tipis (KLT) dengan fase diam dan fase gerak berutut-turut ITLC-SG dan larutan salin telah berhasil dikembangkan. Berdasarkan hasil orientasi dengan sistem kromatografi ini didapatkan Rf untuk 177Lu bebas dan 177 Lu-DOTA-Nimotuzumab berhimpitan pada < 0,3 sehingga persentase penandaan tidak dapat dikuantifikasi. Hasil orientasi juga memperlihatkan bahwa kompleks 177Lu-EDTA memberikan Rf > 0,6. Oleh sebab itu untuk dapat mengkuantifikasi persentase
177
Lu yang berikatan dengan DOTA-Nimotuzumab atau 177Lu bebas (177Lu yang tidak berikatan dengan DOTA-Nimotuzumab), maka pada akhir proses reaksi 177Lu dengan DOTA-Nimotuzumab ditambahkan EDTA secara berlebih (mol Lu : EDTA = 1 : 20) sehingga 177Lu bebas akan berikatan dengan EDTA membentuk kompleks
177
Lu-EDTA. Dengan demikian persentase 177Lu yang berikatan DOTA-Nimotuzumab akan dapat dikuantifikasi karena 177Lu bebas (dalam bentuk
177
Lu-EDTA, Rf > 0,6) terpisah dengan baik dari
177
Lu-DOTA-Nimotuzumab (Rf < 0,3) . Metoda dan sistim kromatografi ini digunakan sepanjang penelitian ini.
Penandaan DOTA-Nimotuzumab dengan 177Lu dilakukan dalam ammonium acetat 0,25 M dengan pH reaksi 5,5 pada suhu 42C selama 1 jam. Pada akhir reaksi ditambahkan larutan EDTA 0,05 M secara berlebih. Persentase penandaan kemudian diamati dengan KLT dengan fase diam dan fase gerak berutut-turut ITLC-SG dan larutan salin. Hasil penandaan DOTA-Nimotuzumab dengan
177
Lu memperlihat hanya ~ 85% yang berikatan dengan DOTA-Nimotuzumab. Oleh karena persayaratan kemurnian radiokimia suatu sediaan radiofarmaka yang baik adalah ≥ 95%, maka produk ini perlu dimurnikan lebih lanjut.
Pemurnian 177Lu-DOTA-Nimotuzumab dari
177
Lu bebas (dalam bentuk 177Lu-EDTA) dilakukan dengan melewatkan campuran pada kolom Sephadex-G25 Medium (diameter 1 cm x panjang 20 cm). Eluat (0.5 mL/ fraksi) kemudian ditampung dan diukur radioaktifitasnya dengan Dose Calibrator. Radiokromatogram pemurnian
177
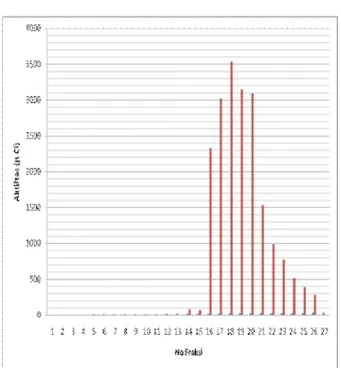
Lu-DOTA-Nimotuzumab dari 177Lu bebas (dalam bentuk 177Lu-EDTA) dapat dapat dilihat pada Gambar 2 berikut.
Gambar 2. Radiokromatogram Pemurnian 177
Lu-DOTA-Nimoimotuzumab dari 177Lu Bebas (Dalam Bentuk 177Lu-EDTA)
Dari kromatogram di atas (Gambar 2) dapat dilihat bahwa aktivitas yang cukup tinggi diperoleh pada fraksi antara 16 – 20. Kelima fraksi tersebut kemudian dianalisa dengan sistem KLT. Hasil analis KLT fraksi-fraksi ini menunjukan bahwa fraksi ini adalah fraksi yang mengandung 177 Lu-DOTA-Nimotuzumab dengan kemurnian ~ 99,9%. Sementara fraksi berikut adalah 177 Lu-DOTA-Nimotuzumab dengan kemurnian radiokimia < 99%. Fraksi 16 – 20 kemudian dikumpulkan dan dipekatkan dengan menggunakan protein filter menjadi 200 µl. Larutan ini masing-masing sebanyak 50 µl kemudian digunakan untuk uji stabilitas penyimpanan pada suhu kamar dan pada suhu 4 0C, serta kestabilan dalam serum.
Suatu produk radiofarmaka harus cukup stabil sehingga masih dama keaadan utuh pada saat sampai di target yang diinginkan. Oleh sebab itu uji stabilitas secara in vitro untuk melihatkan apakah ada 177Lu atau 177Lu-DOTA yang terlepas 177 Lu-DOTA-Nimotuzumab merupakan langkah awal untuk mengevaluasi kestabilan 177 Lu-DOTA-Nimotuzumab sebelum uji-uji lain dilakukan.. Uji stabilitas dilakukan berturut-turut dengan menyimpan sejumlah 177Lu-DOTA-Nimotuzumab pada suhu kamar dan pada suhu 40 C. Sedangkan uji stabilitas dalam serum dilakukan dengan cara menambahkan 50 µl 177Lu-DOTA-Nimotuzumab kedalam 450 µl serum manusia yang sudah disaring (0,22 m). Campuran kemudian diinkubasi pada 370 C dan cuplikan diambil setiap 24 jam dan
dianalisa dengan sistim KLT. Analisa dilakukan dengan penambahan EDTA untuk menghindari kesalahan pengukuran karena 177Lu bebas mempunyai Rf yang berhimpitan dengan 177
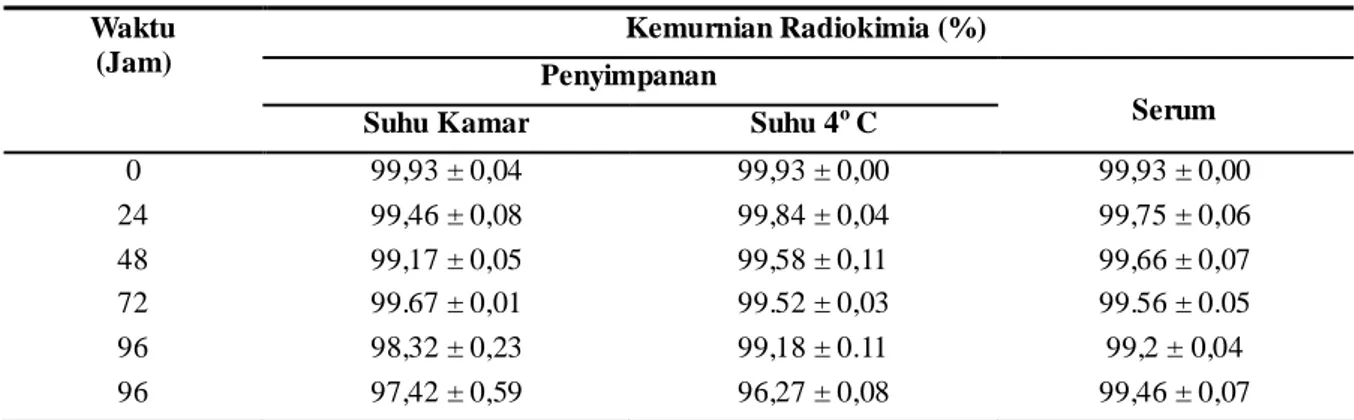
Lu-DOTA-Nimotuzumab. Hasil uji stabilitas 177 Lu-DOTA-Nimotuzumab dalam penyimpanan pada suhu kamar dan pada suhu 40 C, serta dalam serum pada 370 C dapat dilihat pada Tabel 1.
Tabel 1. Hasil Uji Stabilitas 177Lu-DOTA-Nimotuzumab
Waktu (Jam)
Kemurnian Radiokimia (%) Penyimpanan
Serum Suhu Kamar Suhu 4o C
0 99,93 ± 0,04 99,93 ± 0,00 99,93 ± 0,00 24 99,46 ± 0,08 99,84 ± 0,04 99,75 ± 0,06 48 99,17 ± 0,05 99,58 ± 0,11 99,66 ± 0,07 72 99.67 ± 0,01 99.52 ± 0,03 99.56 ± 0.05 96 98,32 ± 0,23 99,18 ± 0.11 99,2 ± 0,04 96 97,42 ± 0,59 96,27 ± 0,08 99,46 ± 0,07
Dari Tabel 1 diatas dapat dilihat bahwa 177
Lu-DOTA-Nimotuzumab merupakan
radioimmunokonjugat yang cukup stabil karena setelah 96 jam dalam penyimpanan pada suhu kamar dan suhu 40 C serta dalam serum pada 37 C, 177Lu- DOTA-Nimotuzumab masih tetap utuh. Kemurnian radiokimia 177Lu-DOTA-Nimotuzumab setelah penyimpanan pada kondisi diatas masih berturut-turut adalah 97,42 ± 0,59; 96,27 ± 0,08 dan 99,46 ± 0,07%.
KESIMPULAN
Radiofarmaka berbasis antibodi monoklonal anti EFGR, 177Lu-DOTA-Nimotuzumab dengan kemurnian > 99% setelah proses pemurnian dengan kolom Sephadex G-25M telah berhasil disiapkan. Sistim KLT dengan menggunakan fase diam dan fase gerak masing-masing ITLC-SG dan salin yang digunakan untuk mengkuantifikasi hasil penandaan DOTA-Nimotuzumab dengan 177Lu juga telah berhasil dikembangkan. Penggunaan sistim KLT ini harus diawali dengan penambahan EDTA secara berlebih pada akhir proses reaksi penandaan sehingga 177Lu yang tidak bereaksi dengan DOTA-Nimotuzumab akan membentuk kompleks 177 Lu-EDTA. 177Lu-DOTA-Nimotuzumab dan 177 Lu-EDTA terpisah secara baik karena masing-masing berturut-turut memberikan nilai Rf pada > 0,3 dan pada > 0,6.
Hasil uji stabilitas 177Lu-DOTA-Nimotuzumab memperlihatkan bahwa radiofarmaka ini sangat stabil. Kemurnian radiokimia 177 Lu-DOTA-Nimotuzumab setelah penyimpanan selama 96 jam baik pada suhu kamar ataupun pada suhu 4 0C, serta dalam serum pada suhu 37 0C masih > 95%.
UCAPAN TERIMA KASIH
Penulis mengucapkan banyak terima kasih kepada Drs. Adang Hardi Gunawan, Apt. atas bantuan nimotuzumabnya dan kepada semua pihak yang telah memberikan saran, motivasi dan dukungan baik material maupun spiritual, sehingga penulis dapat menyelesaikan penulisan karya tulis ilmiah ini.
DAFTAR PUSTAKA
1. ANONYMOUS, Nimotuzumab. Available:
http://www.emea.europa.eu/pdfs/human/comp /opinion/19668208en.pdf. (diakses pada tanggal 3 September 2009).
2. ANONYMOUS, Nimotuzumab. Avaiable:
http://www. ymbiosciences.com/products/ nimotuzumab /index.php. (diakses pada tanggal 3 September 2009).
3. ANONYMOUS, Nimotuzumab, Available:
http://en. wikipedia.org/wiki/Nimotuzuma. (di-akses pada tanggal 3 September 2009).
4. Scot, A.M. and Welt, S. Antibody-based immunological therapies. Current Opinion in Immunology, 9 (5), (1997) 717-722.
5. ANONYMOUS, New promise for radio-therapeutic radio-pharmaceuticals, Marker Researh in the Healthcare with expertise in Medical Imaging and Radiotherapy, Bio-Tech System, Inc., (2006), March 19.
6. Soetono, S, Rukihati, Gunanjar, Iswani, Susetyo, W Zulkarnian, M. dan Sudarti, Instrumentasi
Kimia I. Pusat Pendidikan dan Latihan. Badan Tenaga Atom Nasinal. 1983. pp. 280.
7. Lewis, M.R., Raubitschek, A., Shively, J.E. A Facile, water soluble method for modification of proteins with DOTA. Use of Elevated temperature and optimized pH to achieve high specific activity and high chelate stability in radiolabeled immunoconjugates, Bioconjugate Chem 5(1994), 565-576.
8 Govindan, S.V., Shih, L.B., Goldenberg, D.M., Sharky, R.M., Karacay, H., Donnelly, J.E., Losman, M.J., Hansen, H.J., Griffths, G.L.,
90
Yttrium-labelled complementary-determining-region-grafted monoclonal antibodies for radioimmunotherapy: radiolabeling and animal biodistribution studies, Bioconjugate Chem, 9, (1998) 773-782.
9. Ramli, M., Widya, R.R., Humani, T.S., Maskur, Rustendi, C.T., Subur, M. Optimasi metoda preparasi 177Lu-DOTA-h-IgG analog 177 Lu-DOTA-Trastuzumab untuk terapi kanker payudara. Seminar Pusat Teknologi Akselerator dan Proses Bahan, (2009) 159-165.
10. Jang, Y.H., Blanco, M., Dasgupta, S., Keire, D.A., Shively, J.E., Goddard III, W.A. Mechanism and energetic for complexation of 90Y with 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA), a model for cancer radioimmunotherapy. J. Am. Chem. Soc. 121: (1991). 6142-6151.
11. Milenic, D.E., Roselli, M., Breichbeil, M.W., Pippin, C.G., McMurray, T.J. Carrasquillo, J.A., Colcher, D., Lambrecht, R., Gansow, O.A., Schlom, J. In vivo evaluation of a lead-labled monoclonal antibody using the DOTA ligand, Eur. J. Nucl. Med., 25, (1998) 471-480.