BAB 2
TINJAUAN PUSTAKA
2.1 Sejarah Perkembangan Baterai
Baterai adalah alat yang dapat mengubah energi kimia menjadi energi listrik melalui proses elektrokimia yaitu proses terjadinya reaksi oksidasi dan reduksi. Listrik yang dihasilkan oleh sebuah baterai muncul akibat adanya perbedaan potensial energi listrik kedua buah elektrodanya. Perbedaan potensial ini dikenal dengan potensial sel atau gaya gerak listrik (ggl).
Alessandro Volta merupakan orang yang pertama kali menciptakan baterai pada awal abad ke-19 yang dikenal dengan Tumpukan Volta (Voltaic Pile). Baterai ini terdiri dari tumpukan cakram seng dan tembaga berselang seling dengan kain basah yang telah dicelup air garam sebagai pembatasnya. Baterai ini
telah mampu menghasilkan arus yang kontinu dan stabil.
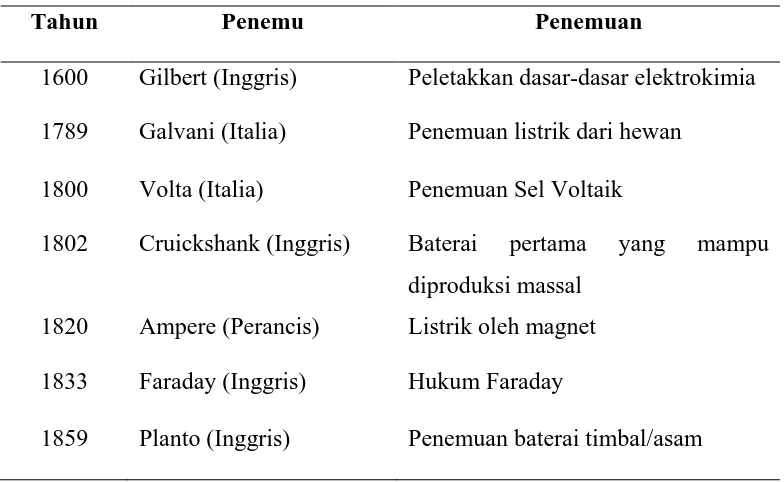
Baterai mempunyai sejarah yang panjang dan terus mengalami perkembangan. Berikut sejarah perkembangan baterai yang dapat dilihat pada Tabel 2.1.
Tabel 2.1. Sejarah Perkembangan Baterai
Tahun Penemu Penemuan
1600 Gilbert (Inggris) Peletakkan dasar-dasar elektrokimia
1789 Galvani (Italia) Penemuan listrik dari hewan
1800 Volta (Italia) Penemuan Sel Voltaik
1802 Cruickshank (Inggris) Baterai pertama yang mampu diproduksi massal
1820 Ampere (Perancis) Listrik oleh magnet
1833 Faraday (Inggris) Hukum Faraday
1868 Leclanche (Inggris) Penemuan sel Leclanche
1888 Gassner (AS) Penyempurnaan sel kering
1899 Jungner (Swedia) Penemuan baterai Ni-Cd
1901 Edison (AS) Penemuan baterai Ni-besi
1932 Schlect dan Ackerman (Jerman)
Penemuan pelat kutub yang dipadatkan
1947 Neumann (Perancis) Berhasil mengemas baterai Ni-Cd
1960-an Union Carbide (AS) Pengembangan baterai alkaline primer
1970-an Union Carbide (AS) Pengembangan baterai timbal/asam dengan pengaturan katup
1990 Union Carbide (AS) Komersialisasi baterai Ni-MH
1992 Kordesch (Kanada) Komersialisasi baterai alkaline yang dapat dipakai ulang
1999 Kordesch (Kanada) Komersialisasi baterai Li-ion polimer
Sumber : Buchmann (2001)
2.1.1 Komponen Utama Baterai
Komponen utama pada baterai yaitu terdiri atas :
a. Elektroda negatif (anoda) yaitu elektroda yang melepaskan elektron ke
rangkaian luar dan mengalami proses oksidasi pada proses elektrokimia.
b. Elektroda positif (katoda) yaitu elektroda yang menerima elektron ke rangkaian luar dan mengalami proses reduksi pada proses elektrokimia.
c. Elektrolit adalah media transfer ion yang bergerak dari anoda ke katoda dalam sel baterai saat penggunaan (Linden, 2002).
d. Separator.
Seperator adalah material berpori yang diletakkan di antara anoda dan katoda untuk mencegah terjadinya gesekan antar plat yang menyebabkan arus pendek
2.1.2 Jenis – Jenis Baterai
Berdasarkan kemampuannya untuk dikosongkan (discharged) dan diisi ulang (recharged) baterai terbagi menjadi dua jenis yaitu sebagai berikut :
1. Baterai Primer
Baterai primer adalah baterai yang tidak dapat diisi ulang. Setelah kapasitas baterai habis (fully discharged), baterai tidak dapat dipakai kembali. Beberapa contoh baterai jenis ini adalah baterai Seng-Karbon (Baterai Kering), baterai Alkalin dan baterai Merkuri.
2. Baterai Sekunder
Baterai sekunder adalah baterai yang dapat diisi ulang. Kemampuan diisi ulang baterai sekunder bervariasi antara 100-500 kali (satu siklus adalah satu kali pengisian dan pengosongan). Beberapa contoh baterai sekunder adalah baterai Ni-Cd, baterai Ni-MH dan baterai ion lithium (Buchmann, 2001).
2.1.3 Istilah-Istilah Umum dalam Baterai
Beberapa istilah-istilah umum dalam baterai yaitu antara lain : 1. Kapasitas baterai
Kapasitas baterai merupakan kemampuan baterai untuk menyimpan dan memberikan arus listrik pada waktu tertentu yang dinyatakan dalam satuan Ampere-hour (Ah). Proses reaksi sel yang terjadi secara spontan, terkait dengan perubahan energi bebas dan jumlah total muatan yang bisa ke rangkaian luar Q, disebut "kapasitas sel", oleh hukum Faraday dirumuskan dengan:
Q = ∫ �0� �� = zF*N (2.1)
dimana i adalah arus yang mengalir dalam rangkaian, t adalah waktu, z adalah jumlah elektron yang berhubungan dengan reaksi redoks, F adalah konstanta Faraday (96.490 Cmol-1) dan N merupakan jumlah mol dari reaksi elektrokimia Persamaan 2.1. diatas menyatakan bahwa jumlah total listrik yang dihasilkan
Besar kapasitas baterai secara teoritik tergantung dari jumlah material aktif terkandung terlihat pada rumus 2.1. Sebagai contoh, besar kapasitas material katoda LiCoO2 sebesar 1 gram adalah sebagai berikut :
Berat atom Li = 7, Co = 59 dan O2 = 16. 1 gram LiCoO2 setara dengan 0,010204 mol Jumlah muatan = 1
Dari bilangan Avogadro diketahui 1 mol material mengandung 96.500 Couloumb.
Maka 1 gram LiCoO2 memiliki kapasitas listrik sebesar = 0,010204 × 1 ×
96.500 /3600 = 273,5 mAh (Triwibowo, 2011).
2. Kapasitas spesifik
Kapasitas spesifik adalah total muatan yang dihasilkan pada saat discharge dari
sel dalam satu siklus dibagi dengan total massa (∑ �) dari sel.
Q = ��∗�
∑ � (2.2)
3. Efisiensi baterai
Efisiensi baterai merupakan perbandingan antara kapasitas discharge dan kapasitas charge yang dirumuskan sebagai berikut :
Efisiensi baterai = ����ℎ���� ke n
�ℎ���� ke n x 100 % (2.3)
dimana discharge ke n adalah kapasitas discharge pada siklus ke n dan charge ke n adalah kapasitas charge pada siklus ke n.
4. Kerugian kapasitas irreversible
Kerugian kapasitas irreversible berhubungan dengan banyaknya kapasitas yang hilang setiap siklus.
Kerugian kapasitas irreversible = �ℎ���� ke n−����ℎ���� ke n
�ℎ���� ke n x 100 % (2.4)
2.2 Baterai ion Lithium
Baterai ion lithium adalah baterai yang digerakkan oleh ion lithium. Baterai ion lithium pertama kali dikomersialisasikan pada tahun 1990 oleh Sony Corp untuk ponsel Kyocera. Sejak diperkenalkan, pasar ion lithium telah berkembang menjadi sekitar $ 4 miliar pada tahun 2005 (Yoshio et al. 2009).
Baterai ion lithium memiliki banyak keunggulan dibandingkan dengan baterai sekunder lainnya yaitu ringan, densitas energinya tinggi, tidak memiliki memory effect, dapat diisi ulang (rechargeable), tahan lama, tegangannya tinggi (4V), ramah lingkungan dan penurunan charge baterai ion lithium rendah sekitar 5% per bulan. Namun, baterai ion lithium masih memiliki kekurangan diantaranya sangat sensitif terhadap suhu tinggi dan biayanya lebih tinggi dibandingkan dengan baterai yang sudah ada (Oswal et al. 2010).
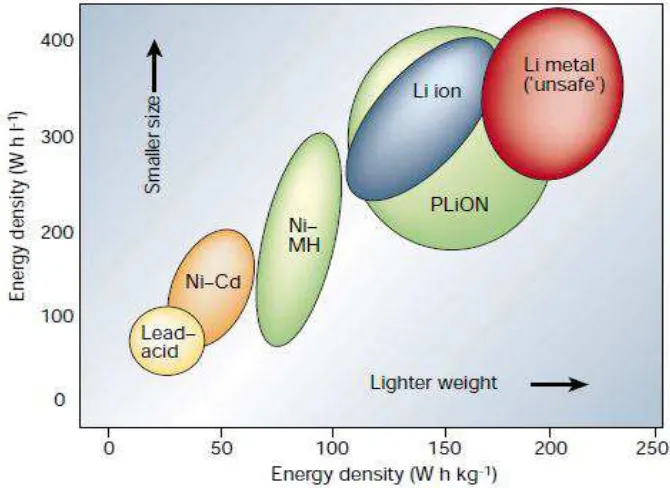
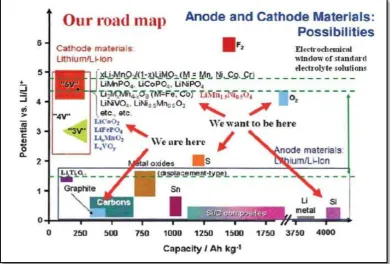
Baterai ion lithium juga memiliki sifat utama yaitu nilai spesifik energi secara grafimetrik maupun volumik jauh lebih unggul dibandingkan dengan baterai sekunder lain (Kawamoto, 2010). Hal ini dapat dilihat perbandingannya
pada Gambar 2.1.
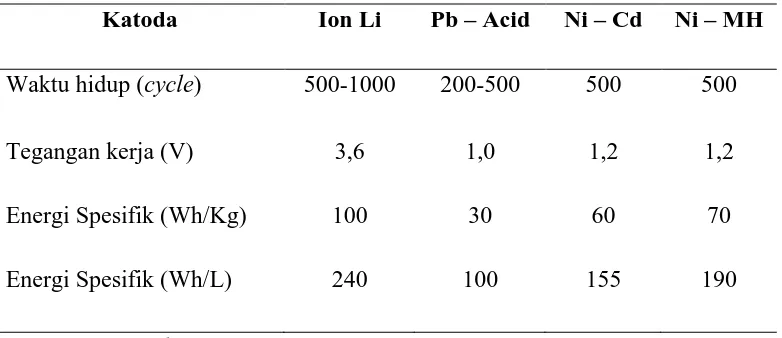
Penjelasan pada Gambar 2.1. dapat dilihat perbandingan antara baterai ion lithium dengan baterai sekunder lainnya pada Tabel 2.2. dibawah ini.
Tabel 2.2. Perbandingan Baterai ion Lithium dengan Baterai Sekunder Lainnya
Katoda Ion Li Pb – Acid Ni – Cd Ni – MH Waktu hidup (cycle) 500-1000 200-500 500 500
Tegangan kerja (V) 3,6 1,0 1,2 1,2
Energi Spesifik (Wh/Kg) 100 30 60 70
Energi Spesifik (Wh/L) 240 100 155 190
Sumber : Wu et al (2011)
Dalam kondisi charge dan discharge baterai ion lithium bekerja menurut fenomena interkalasi, yaitu proses pelepasan ion lithium dari tempatnya di struktur kristal suatu bahan elektroda dan pemasukan ion lithium pada tempat di struktur kristal bahan elektroda yang lain (Munshi, 1995). Sehingga bahan elektroda harus mempunyai tempat bagi perpindahan ion lithium yang sering disebut host. Bahan elektroda mempunyai struktur host dengan variasi interkalasi
yang berbeda-beda. Pada umumnya, bahan memiliki tiga model interkalasi berdasarkan struktur dari hostnya, yaitu interkalasi satu dimensi, dua dimensi dan tiga dimensi seperti pada Gambar 2.2. (Prihandoko, 2008).
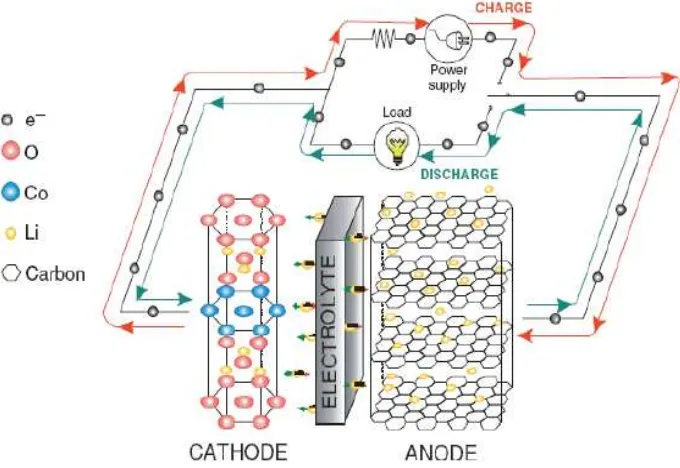
Proses interkalasi pada baterai ion lithium saat charge dan discharge dapat dilihat pada Gambar 2.3. dibawah ini.
Gambar 2.3. Proses Interkalasi pada Baterai ion Lithium saat Charge dan Discharge (Leite, 2009)
Selama proses charge baterai, terjadi pergerakan ion lithium dari elektroda positif (katoda) melalui seperator dan elektrolit ke elektroda negatif (anoda). Baterai menyimpan energi selama proses ini (densitas energi). Selama discharge,
ion lithium bergerak dari elektroda negatif (anoda) ke elektroda positif (katoda) melalui seperator dan elektrolit, menghasilkan densitas daya pada baterai. Dalam proses interkalasi elektron mengalir dalam arah yang berlawanan dengan ion di sekitar sirkuit luar (Oswal et al. 2010).
Reaksi kimia yang terjadi dalam baterai ion lithium bersifat reversible, sehingga material penyusun sel dipilih dari material yang memiliki struktur kristal dengan kemampuan ’insertion compound’ yaitu material yang mampu menerima dan melepaskan ion lithium tanpa mengalami perubahan besar atau kerusakan dalam struktur kristalnya (Linden, 2002). Reaksi yang terjadi merupakan reaksi reduksi dan oksidasi (redoks) pada katoda dan anoda.
molekul atau atom. Reaksi oksidasi dan reduksi yang terjadi pada katoda LiFePO4 dan anoda LiC6 saat charge dan discharge pada baterai ion lithium yaitu :
Pada katoda : LiFePO4 + xLi+ + xe- xFePO4 + Li1-xFePO4 (2.5) (Wu et al. 2011).
Pada anoda : C6 + x Li+ + x e- LixC6 (2.6)
Reaksi pada sel baterai : LiFePO4 + C6 Li1-xFePO4 + LixC6 (2.7) (Zhao et al. 2015).
Suatu material elektrokimia dapat berfungsi baik sebagai elektroda anoda maupun katoda bergantung pada pemilihan material yang akan menentukan karakteristik perbedaan nilai tegangan kerja (working voltage) dari kedua material tersebut. Potensial tegangan yang terbentuk antara kedua elektroda bergantung dari reduksi dan oksidasi pada bahan elektroda yang dipilih (Subhan, 2011).
Tegangan kerja dari beberapa material elektroda dapat dilihat pada Gambar 2.4.
Pada Gambar 2.4. tampak bahwa material yang dapat berfungsi sebagai katoda dan anoda dilihat pada tegangan kerjanya. Material yang berperan sebagai katoda harus memiliki tegangan kerja yang lebih tinggi dibandingkan dengan tegangan kerja pada material anoda. Misalnya, grafit berfungsi sebagai anoda ketika dipasangkan dengan LixMnO2 karena tegangan kerja grafit sebesar 0,5 V sedangkan LixMnO2 tegangan kerjanya sebesar 3 V. Namun grafit dapat berfungsi sebagai katoda saat dipasangkan dengan elektroda Li metal sebagai anodanya
karena tegangan kerja Li metal masih dibawah tegangan kerja grafit sebesar 0 Volt (Subhan, 2011).
2.3 Material Elektroda untuk Baterai ion Lithium
Material elektroda pada baterai ion lithium terdiri atas material aktif katoda dan material aktif anoda. Material aktif katoda yang sering digunakan yaitu LiFePO4 dan material aktif anoda yaitu Mesocarbon Microbead (MCMB).
2.3.1 Material Katoda
Struktur, sifat fisik dan sifat elektrokimia material katoda menentukan kinerja pada baterai ion lithium. Untuk setiap berat material katoda, jumlah ion lithium yang dilepaskan material katoda saat charging dan jumlah ion lithium yang kembali dalam waktu tertentu ke material katoda saat discharging menggambarkan densitas energi dan densitas daya sel baterai. Semakin banyak ion lithium dipindahkan dari katoda ke anoda maka semakin besar pula densitas energi sel baterai. Semakin banyak ion lithium yang kembali ke katoda dari anoda maka semakin besar densitas dayanya. Oleh karena itu, material katoda harus bersifat ion dan elektron konduktif (Triwibowo, 2011).
Ada beberapa karakteristik yang harus dimiliki oleh material katoda yaitu antara lain :
1. Struktur host nya harus memiliki kemampuan interkalasi yang besar (kapasitas energinya tinggi) dan memiliki koefisien difusi kimia lithium yang
2. Perubahan struktur host selama interkalasi dan deinterkalasi harus sekecil
mungkin (siklus hidupnya panjang).
3. Material harus memiliki sifat kimia yang stabil, tidak beracun dan murah. 4. Proses pengerjaannya mudah (Yao, 2003).
Material katoda yang sering digunakan pada baterai ion lithium yaitu LiCoO2, LiFePO4, LiMn2O4 dan material lainnya. Ketiga material tersebut memiliki bentuk struktur host yang berbeda yang dapat dilihat pada Gambar 2.5.
a) b) c)
Gambar 2.5. (a) Struktur Layered pada Material Katoda LiCoO2, (b) Struktur Spinel pada LiMn2O4 dan
(c) Struktur Olivine pada LiFePO4 (Buchmann, 2001)
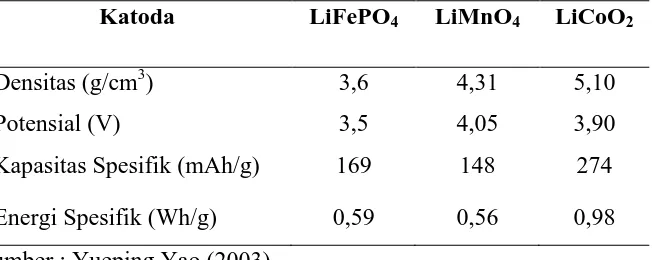
Pada struktur host bentuk layered, ion lithium beinterkalasi dalam tiga arah, pada struktur host bentuk spinel interkalasi ion lithium dalam dua arah, sedangkan pada struktur host bentuk olivine interkalasi ion lithium dalam satu arah (Buchmann, 2001). Karakteristik elektrokimia dari masing-masing material tersebut dapat dilihat perbandingannya pada Tabel 2.3.
Tabel 2.3. Karakteristik Elektrokimia dari Beberapa Material Katoda
Katoda LiFePO4 LiMnO4 LiCoO2
Densitas (g/cm3) 3,6 4,31 5,10
Potensial (V) 3,5 4,05 3,90
Kapasitas Spesifik (mAh/g) 169 148 274
Energi Spesifik (Wh/g) 0,59 0,56 0,98
Lithium Ferrophosphate (LiFePO4)
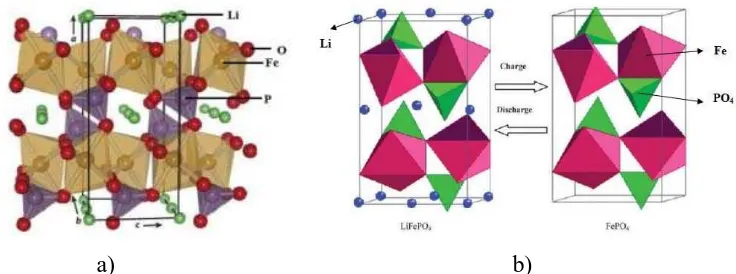
LiFePO4 merupakan salah satu material katoda yang memiliki struktur olivine, termasuk kedalam sistem kristal ortorombik Pnma. Konstanta kisi a, b dan c adalah masing-masing 1,033, 0,601 dan 0,4693 μm. Ikatan kovalen kuat pada PO membuat LiFePO4 stabil bahkan pada suhu diatas 200 °C. Struktur kristal LiFePO4 dapat dilihat pada Gambar 2.6.
a) b)
Gambar 2.6. (a) Struktur Kristal LiFePO4 (Padhi et al. 2002) dan b) Struktur
Kristal LiFePO4 saat Charge-Discharge (Rizki, 2014)
Penggunaan LiFePO4 sebagai material aktif katoda pertama kali dilakukan oleh John Goodenough’s di Universitas Texas pada tahun 1996. Alasan pemilihan LiFePO4 sebagai material aktif katoda karena memiliki banyak keunggulan dibandingkan material katoda lain diantaranya seperti biaya pembuatan lebih murah karena bahan pembentuknya mudah didapatkan di alam, tidak beracun, kapasitas sedang (170 mAh/g), keelektronegatifannya tinggi, sangat reaktif, densitas energi yang tinggi, dan ramah lingkungan. Namun, material ini masih memiliki kelemahan yaitu konduktifitas listrik yang rendah berorde 10-9 S/cm dan difusi ion lithium yang lambat (Padhi et al. 2002).
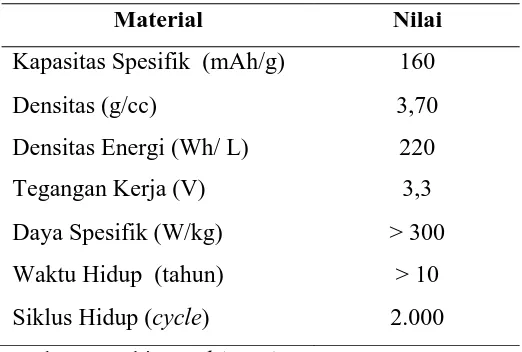
Tabel 2.4. Karakteristik dari LiFePO4
Material Nilai
Kapasitas Spesifik (mAh/g) 160
Densitas (g/cc) 3,70
Densitas Energi (Wh/ L) 220
Tegangan Kerja (V) 3,3
Daya Spesifik (W/kg) > 300 Waktu Hidup (tahun) > 10
Siklus Hidup (cycle) 2.000
Sumber : Yoshio et al (2009)
2.3.2 Material Anoda
Bahan anoda yang sering digunakan sebagai komponen sel baterai lithium rechargeable adalah grafit/karbon dan logam lithium. Kedua material tersebut memenuhi syarat sebagai suatu material untuk proses interkalasi.
Adapun tiga syarat utama yang harus dimiliki material anoda pada baterai ion lithium yaitu sebagai berikut :
1. Potensial penyisipan dan pelepasan ion lithium pada anoda harus sekecil mungkin.
2. Banyaknya ion lithium yang dapat dimuat oleh material anoda harus besar untuk mencapai kapasitas spesifik yang besar.
3. Host pada anoda harus menahan penyisipan dan pelepasan ion lithium yang berulang–ulang tanpa kerusakan strukturnya untuk memperoleh siklus hidup yang panjang (Yao, 2003).
Bahan karbon dapat digunakan sebagai material anoda untuk sel ion lithium berdasarkan potensial lithiasi karbon sangat dekat dengan logam Lithium. Tegangan lithiasi grafit vs logam Li adalah 0,0-0,5 V.Selama proses pengisian dan pengosongan, ion lithium dapat berinterkalasi dan de-interkalasi dari karbon tanpa mengalami perubahan sifat mekanik, listrik dan volume yang signifikan (Hossains, 1995).
Perbedaan bahan karbon memiliki pengaruh besar pada proses interkalasi ion lithium. Karbon dengan ikatan sp2 antar atom karbon dapat diklasifikasikan menjadi tiga kategori yaitu sebagai berikut :
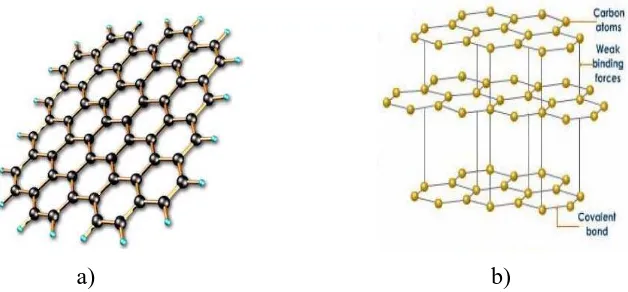
1. Grafit
Grafit merupakan lembaran graphene yang membentuk tiga dimensi (3D). Graphene tersusun dari atom karbon yang membentuk pola heksagonal dengan susunannya berupa lembaran dengan ketebalan sebesar satu atom karbon. Jarak antar atom karbon pada satu ikatan pada graphene adalah 0,142 nanometer
sedangkan untuk membentuk suatu grafit, jarak antar lembaran graphene-nya adalah 0,335 nanometer. Kapasitas maksimum secara teori yang dihasilkan dari grafit adalah berkisar 372 mAh/g (Patterson, 2009). Struktur lembaran graphene dan grafit dapat dilihat pada Gambar 2.7. dibawah ini.
a) b)
Gambar 2.7. (a) Struktur Graphene berupa Lapisan dengan Ketebalan 1 Atom C (b) Struktur Grafit yang terdiri dari Lapisan Graphene
2. Hard carbon
Hard carbon merupakan jenis karbon yang pertama kali dikomersialkan pada baterai ion litihum. Lapisan atom karbon tersusun tidak rapi dengan jarak antar layernya 0,38 nanometer (Patterson, 2009). Jenis karbon ini memiliki kapasitas yang lebih tinggi namun sangat reaktif dan hasil kapasitas ireversibelnya tinggi selama discharge (Hossains, 1995). Karbon ini tidak digunakan lagi sebagai material anoda pada baterai karena tempat difusinya tampak seperti labirin sehingga menyulitkan ion lithium untuk berinterkalasi (Yoshio et al. 2009).
3. Soft carbon
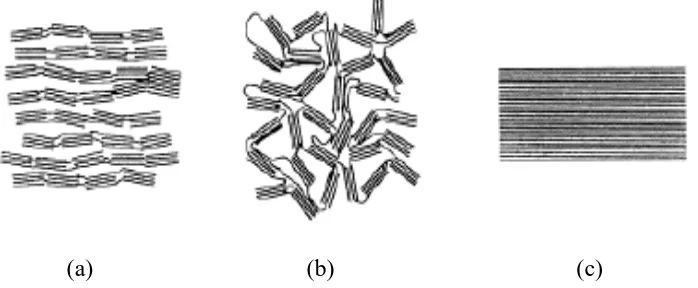
Soft carbon merupakan grafit sintesis yang tersusun atas lapisan graphene dengan jarak antar lembaran graphene-nya 0,375 nm (Patterson, 2009). Grafit sintesis memiliki kemurnian yang tinggi, struktur yang cocok untuk proses interkalasi dan deinterkalasi ion lithium. Namun, grafit sintesis memiliki kekurangan pada struktur kristalnya yang berbentuk amorf sehingga untuk membuatnya memiliki
struktur kristal menggunakan biaya yang tinggi karena memerlukan perlakuan pada suhu diatas 2.800 0C pada proses grafitisasinya (Yoshio et al. 2009). Salah satu grafit sintesis yang sering digunakan sebagai material aktif anoda pada industri baterai ion lithium yaitu Mesocarbon Microbeads (MCMB). Struktur karbon pada soft carbon, hard carbon dan grafit dapat dilihat pada Gambar 2.8.
(a) (b) (c)
Perbandingan antara grafit, hard carbon, dan soft carbon dapat dilihat pada Tabel 2.5. dibawah ini.
Tabel 2.5. Perbandingan antara Grafit, Hard Carbon, dan Soft Carbon
Material Kapasitas
Material MCMB termasuk bagian dari soft carbon yang memiliki struktur kristal lebih sedikit dibandingkan dengan grafit alam. Adapun alasan pemilihan karbon MCMB sebagai material anoda karena memiliki kapasitas yang baik pada tegangan rendah dan kemampuan siklusnya yang terbaik diantara semua jenis bahan anoda karbon (Yao, 2003).
MCMB terdiri dari struktur bola dengan diameter 1-40 μm sehingga luas permukaan spesifiknya rendah. Besar kapasitas spesifik pada MCMB mencapai 320-330 mAh/g (Yoshio et al. 2009). Struktur MCMB tipe Brooks–Taylor dapat dilihat pada Gambar 2.9.
Grafitisasi MCMB memiliki banyak kelebihan bila digunakan sebagai anoda baterai yaitu sebagai berikut :
1. Densitas muatan yang tinggi menjamin densitas energi yang tinggi pula.
2. Luas permukaan yang kecil menurunkan kapasitas ireversible sesuai dengan
dekomposisi elektrolit.
3. MCMB memiliki struktur spinel sehingga ion lithium mudah berinterkalasi dan
hal tersebut akan meningkatkan kapasitas baterai (Yoshio et al. 2009).
Karakteristik dari Mesocarbon Microbead (MCMB) dapat dilihat pada Tabel 2.6.
Tabel 2.6. Karakteristik dari Mesocarbon Microbead (MCMB)
Properties
Kemurnian Karbon (%) 99,6
Discharge Pertama (mAh/gr) 500
Efisiensi (%) 93,4
Titik Lebur (0C) 3550
Tekanan Uap (mm Hg) (0C) 3586 Temperatur Sintering (K) 1800-2500
Sumber : MTI Corporation (2010)
2.4 Zat Aditif Super P
Bahan karbon seperti acetylene black, super p, carbon black dan grafit yang banyak digunakan dalam elektroda positif dan elektroda negatif sebagai zat aditif konduktif berfungsi untuk meningkatkan konduktifitas listrik dan mengurangi hambatan listrik dalam sistem elektrokimia. Namun, bahan tersebut tidak terlibat dalam proses redoks elektrokimia. Konduktifitas elektron pada sumber karbon
aditif sebesar 10-2- 10-4 S/cm (Shin et al. 2006).
permukaan dan volume pori yang rendah (Zheng et al. 2012). Karakteristik dari Super P dapat dilihat pada Tabel 2.7.
Tabel 2.7. Karakteristik dari Super P
Parameter Nilai
Luas Permukaan (m2/g) 76,4
Volume Pori (cm3/g) 0,36
Efisiensi Siklus Pertama pada at 0,1 C (%) 83,4 Kapasitas charge pada elektroda spinel
setelah 200 cycles (1 C) (%)
91,5
Sumber : Zheng et al (2012)
2.5 Matriks Polyvinylidene Fluoride (PvDf)
Pengikat (binder) elektroda pada baterai ion lithium digunakan untuk mengikat lapisan bahan aktif atau antara lapisan bahan aktif dengan current collector. Pengikat yang digunakan harus memiliki karakteristik seperti kemampuan mengikat dengan baik, fleksibilitas, ketidaklarutannya dalam elektrolit, stabil pada kimia dan elektrokimianya, dan aplikasi yang mudah untuk pelapisan elektroda (Yoshio et al. 2009).
Polyvinylidene Fluoride (PvDf) termasuk matriks termoplastik floropolimer murni yang tidak reaktif yang baik untuk molekul polar, dan sering digunakan sebagai binder pada anoda dan katoda. PvDf memiliki karakteristik seperti berwarna putih, dapat tembus cahaya dalam bentuk padat, tidak larut dalam air, sekitar 50 % dan 60 % kristalin, titik lelehnya rendah, dan densitasnya rendah. Adapun struktur dari PvDf dapat dilihat pada Gambar 2.10. dibawah ini.
Sifat umum Polyvinylidene fluorida (PvDf) dapat dilihat pada Tabel 2.8. dibawah ini.
Tabel 2.8. Sifat Umum Polyvinylidene Fluorida (PvDf)
Sifat Nilai
Kekuatan Tarik (Mpa) 21,0-57,0
Modulus Elastisitas (Mpa) 1380-55200
Elongasi (%) 12-600
Kekuatan Fleksural (Mpa) 67-95
Modulus Fleksural (Mpa) 1173 – 82800
Temperature Transisi Gelas (Tg) (0C) -60 – (-20) Temperature Leleh (Tm) (0C) 141 – 178
Sumber : Abdillah (2008)
2.6 Pelarut N, N-Dimethylacetamide (DMAC)
N,N-Dimethylacetamide (DMAC) merupakan pelarut yang dapat digunakan sebagai pelarut PvDf pada baterai ion lithium. Pelarut tersebut memiliki kelarutan terhadap bahan organik dan anorganik yang tinggi, titik didih tinggi, titik beku yang rendah, stabilitas yang baik dan tidak akan mengalami degradasi serta perubahan warna jika dipanaskan dibawah suhu 350 0C (BASF, 2014). Sifat fisik dan kimia DMAC dapat dilihat pada Tabel 2.9.
Tabel 2.9. Sifat Fisik dan Kimia DMAC
2.7 Elektrolit Lithium Hexafluorophosphate (LiPF6)
Elektrolit merupakan suatu material yang bersifat penghantar ionik, baik dalam bentuk cair ataupun padat. Karakteristik yang perlu dimiliki elektrolit adalah konduktifitas ionik tinggi dan konduktifitas elektronik yang rendah sehingga mampu menghantarkan ion selama proses reaksi redoks terjadi antara elektroda positif dan elektroda negatif tanpa terjadi kebocoran arus elektron (Subhan, 2011).
Ada beberapa syarat yang harus dimiliki elektrolit pada baterai ion lithium yaitu sebagai berikut :
1. Elektrolit harus bersifat ion konduktif. Konduktifitas elektrolit cair berkisar antara 10-3 – 10-2 S/cm.
2. Stabil sifat kimia, panas, dan elektrokimianya serta sifat mekanik yang kuat. 3. Jumlah pemindahan ion lithium harus besar karena konduktifitas bergantung
pada pergerakan ion (Yao, 2013).
Lithium Hexafluorophosphate (LiPF6) adalah garam yang paling banyak digunakan sebagai elektrolit untuk sel ion lithium komersial. Garam LiPF6 murni
secara termal stabil sampai suhu 380 K di tempat yang kering, dan merupakan proses dekomposisi dari LiF padat dan PF5 sebagai produk gas (Yang et al. 2003). Proses penguraian LiPF6 dapat dilihat dari reaksi dibawah ini (Sloop et al. 2001).
LiPF6→ LiF + PF5 (2.8)
Tabel 2.10. Karakteristik dari Lithium Hexafluorophosphate (LiPF6)
Properties
Rumus Molekul LiPF6
Massa Molar (g/mol) 151.905
Bentuk Bubuk Putih
Densitas (g/cm3) 1.5
Titik Lebur oC (392 oF; 473 K) 200
Kelarutan dalam air Larut
2.8 Separator
Seperator adalah membran berpori yang berfungsi untuk memastikan terjadinya aliran ion dan mencegah terjadinya hubungan arus pendek. Ukuran pori-pori pada seperator harus lebih kecil dari ukuran partikel pada komponen elektroda dan terdistribusi secara merata. Hal ini untuk memastikan distribusi arus merata diseluruh separator supaya dapat menekan pertumbuhan lithium pada anoda. Sedangkan porositas dari separator harus memiliki jumlah yang tepat untuk proses pergerakan ion antar elektroda. Biasanya, separator pada baterai ion lithium memiliki porositas 40% (Kim et al. 2012). Seperator berpori dalam sel baterai ion lithium dengan elektrolit cair dapat dilihat pada Gambar 2.11.
Gambar 2.11. Seperator dalam Sel Baterai ion Lithium (Prihandoko, 2008)
Bahan separator konvensional yang sering digunakan pada baterai ion lithium adalah polyolefin, seperti polietilen (PE) dan polipropilen (PP). Polyolefin sangat umum digunakan sebagai bahan separator, khususnya pada laptop dan hp, karena tipis dan memiliki kestabilan elektrokimia yang baik. Polyolefin sendiri terdiri atas perpaduan antara polypropylene (sebagai penyangga utama, backbone) dan polyethylene sebagai pelapis pada lubang/pori-pori.
Polyethylene memiliki sifat meleleh pada suhu diatas 120-130 oC. Apabila panas yang dihasilkan didalam baterai melewati ambang batas, polyethylene akan meleleh dan menutup lubang pada separator, mengakibatkan proses perpindahan lithium ion berhenti. Sehingga separator memiliki fungsi utama dalam hal
2.9 Analisis Mikrostruktur
Analisis mikrostruktur pada suatu sampel dapat dilakukan dengan menggunakan beberapa alat karakterisasi diantaranya sebagai berikut :
2.9.1 X-Ray Diffraction (XRD)
Difraksi sinar-X merupakan suatu teknik yang digunakan untuk mengidentifikasi adanya fasa kristalin didalam material-material benda dan serbuk, dan untuk menganalisis sifat-sifat struktur (seperti stress, ukuran butir, fasa komposisi orientasi kristal, dan cacat kristal) dari tiap fasa. Metode ini menggunakan sebuah sinar-X yang terdifraksi seperti sinar yang direfleksikan dari setiap bidang, berturut-turut dibentuk oleh atom-atom kristal dari material tersebut. Dengan berbagai sudut timbul, pola difraksi yang terbentuk menyatakan karakteristik dari sampel. Susunan ini diidentifikasi dengan membandingkannya dengan sebuah data base internasional (Zakaria, 2003).
Salah satu teknik yang digunakan untuk menentukan struktur suatu padatan kristalin adalah metode difraksi sinar-X serbuk (X- ray powder diffraction) seperti terlihat pada Gambar 2.12. Sampel berupa serbuk padatan kristalin yang memiliki ukuran kecil dengan diameter butiran kristalnya sekitar 10-7 – 10-4 m ditempatkan pada suatu plat kaca. Sinar-X diperoleh dari elektron yang keluar dari filamen panas dalam keadaan vakum pada tegangan tinggi, dengan kecepatan tinggi menumbuk permukaan logam, biasanya tembaga (Cu).
Sinar-X tersebut menembak sampel padatan kristalin, kemudian mendifraksikan sinar ke segala arah dengan memenuhi Hukum Bragg. Detektor bergerak dengan kecepatan sudut yang konstan untuk mendeteksi berkas sinar- X yang didifraksikan oleh sampel. Sampel serbuk atau padatan kristalin memiliki bidang-bidang kisi yang tersusun secara acak dengan berbagai kemungkinan orientasi, begitu pula partikel-partikel kristal yang terdapat di dalamnya. Setiap kumpulan bidang kisi tersebut memiliki beberapa sudut orientasi sudut tertentu, sehingga difraksi sinar-X memenuhi Hukum Bragg :
n λ = 2 d sin θ (2.9)
dengan n adalah orde difraksi (1,2,3,…), λ adalah panjang sinar-X, d adalah jarak kisi dan θ adalah sudut difraksi.
Bentuk keluaran dari difraktometer dapat berupa data analog atau digital. Rekaman data analog berupa grafik garis-garis yang terekam per menit sinkron, dengan detektor dalam sudut 2θ per menit, sehingga sumbu-x setara dengan sudut 2θ. Sedangkan rekaman digital menginformasikan intensitas sinar-X terhadap jumlah intensitas cahaya per detik. Pola difraktogram yang dihasilkan berupa deretan puncak-puncak difraksi dengan intensitas relatif bervariasi sepanjang nilai 2θ tertentu. Besarnya intensitas relatif dari deretan puncak-puncak tersebut bergantung pada jumlah atom atau ion yang ada, dan distribusinya di dalam sel satuan material tersebut. Pola difraksi setiap padatan kristalin sangat khas, yang
bergantung pada kisi kristal, unit parameter dan panjang gelombang sinar-X yang digunakan. Dengan demikian, sangat kecil kemungkinan dihasilkan pola difraksi yang sama untuk suatu padatan kristalin yang berbeda (Warren, 1969).
2.9.2 Scanning Electron Microscope (SEM)
Scanning Electron Microscope (SEM) adalah sebuah mikroskop elektron yang didesain untuk mengamati permukaan objek solid secara langsung. Ada beberapa sinyal penting yang dihasilkan oleh SEM. Pada pantulan inelastis didapatkan sinyal elektron sekunder dan karakteristik sinar X sedangkan dari pantulan elastis didapatkan sinyal backscattered elektron.
Elektron backscattered (BSE) yaitu ketika elektron beam menembak atom sampel akan tetapi elektron beam tidak mengenai elektron pada atom tersebut. BSE ini digunakan untuk menggambarkan kontras dalam komposisi dalam sampel multiphase dan untuk menangkap informasi mengenai nomor atom dan topografi.
Elektron sekunder (ES) yaitu ketika elektron beam menembak atom pada sampel dan elektron pada sampel tersebut langsung terlepas. Elektron sekunder ini yang menghasilkan gambar SEM dan biasanya digunakan untuk pencitraan sampel dalam menunjukkan morfologi dan topografi pada sampel. Sinyal – sinyal yang dihasilkan oleh SEM dapat dilihat pada Gambar 2.13. dibawah ini.
Gambar 2.13. Sinyal-Sinyal dalam SEM
Prinsip kerja dari SEM yaitu elektron gun menghasilkan elektron beam dari filamen. Pada umumnya elektron gun yang digunakan adalah tungsten hairpin gun dengan filamen berupa lilitan tungsten yang berfungsi sebagai katoda. Tegangan yang diberikan kepada lilitan mengakibatkan terjadinya pemanasan. Anoda kemudian akan membentuk gaya yang dapat menarik elektron melaju menuju ke anoda. Lensa magnetik memfokuskan elektron menuju suatu titik pada permukaan sampel. Sinar elektron yang terfokus memindai (scan) keseluruhan sampel dengan diarahkan oleh koil pemindai. Ketika elektron mengenai sampel, maka akan terjadi hamburan elektron, baik Secondary Electron (SE) atau Back Scattered Electron (BSE) dari permukaan sampel dan akan dideteksi oleh detektor dan dimunculkan dalam bentuk gambar pada monitor CRT. Penjelasan prinsip kerja SEM diatas dapat dilihat pada Gambar 2.14. dibawah ini.
Gambar 2.14. Prinsip Kerja SEM
2.9.3 Mikroskop Optik
Mikroskop optik mudah untuk dikembangkan dan populer karena menggunakan cahaya tampak sehingga sampel dapat langsung diamati oleh mata. Pada saat ini, gambar dari mikroskop optik dapat ditangkap oleh kamera normal yang peka cahaya untuk menghasilkan mikrograf dan langsung disambungkan ke layar monitor komputer. Perbesaran mikroskop optik dapat mencapai 1000 x. Bagian-bagian mikroskop optik dapat dilihat pada Gambar 2.15.
Gambar 2.15. Bagian-bagian dari Mikroskop Optik
Prinsip penting dari mikroskop adalah bahwa lensa objektif dengan panjang fokus yang sangat pendek (sering hanya beberapa mm saja) digunakan untuk membentuk perbesaran bayangan nyata dari objek. Lensa objektif adalah sebuah kaca pembesar bertenaga sangat tinggi dengan panjang fokus yang sangat pendek. Lensa ini diletakkan sangat dekat dengan spesimen yang akan diteliti sehingga cahaya dari spesimen jatuh ke fokus sekitar 160 mm di dalam tabung mikroskop sehingga menciptakan perbesaran sebuah gambar dari subjek.
untuk fokus pada gambar virtual. Pada semua mikroskop, gambar dimaksudkan untuk dilihat dengan mata terfokus tak terhingga (diingat bahwa posisi mata pada gambar di atas ditentukan oleh fokus mata peneliti). Untuk pengujian mikroskop optik ini diperlukan juga permukaan spesimen yang rata dan halus. Sehingga pengujian ini dilakukan setelah pengujian emission spektrometer yang juga memerlukan permukaan yang halus.
2.10 Pengujian Charge-Discharge.
Untuk mendapatkan performa sebuah baterai maka diperlukan pengujian charge/discharge sehingga akan didapatkan besar kapasitas sel baterai. Pada penelitian ini pengujian dilakukan dengan membuat sistem pengujian charging dan discharging dengan alat BTS8-10A30V.
BST8-10A30V adalah baterai analyzer delapan channel untuk menganalisis kecil sel koin dan baterai silinder dari 0,1 mA sampai 10 A dan tegangan sampai