LAMPIRAN
Lampiran 1: Bagan Alir Penelitian
Isolasi bakteri filosfer pada tanaman ornamental
Identifikasi
Mikroorganisme Bioaerosol
Identifikasi bakteri filosfer yang didapat
Uji antagonis bakteri filosfer dan mikroorganisme
bioaerosol berpotensi patogen Isolasi Mikroaorganisme
Lampiran 2 : Perhitungan Koloni Mikroba Pada Udara (Merlin, 2012)
• Pengukuran volume udara pada ruangan (m3)
Lama Pengambilan sempel (menit) x 0,0283m3/menit…...…….(1)
• Koloni mikroba pada ruangan CFU/m3= Jumlah koloni dalam media agar (CFU) Volume udara (m3)
=……….(2)
Contoh perhitungan : 15 (menit) x 0,0283m3/menit= 0,42 m3 191 CFU
0,42 m3
Lampiran 3: Foto-foto Kerja
Koloni pada media MSA Koloni pada media SDA Koloni pada media MC
Koloni pada media PCA Daun tanaman ornamental Pewarnaan Gram yang hendak di -shaker
Pewarnaan Gram positif Pewarnaan Gram positif Uji Oksidase
A.Uji pada TSIA Uji pada MSA Uji pada SIM B.Uji pada SIM
Pewarnaan endospora Penampakkan pewarnaan Uji antagonis bakteri Endospora di mikroskop
DAFTAR PUSTAKA
Abidin,Z., Qurata, J & Abadi, S. 2015. Pengaruh bakteri Bacillus sp. dan Pseudomonas sp. terhadap pertumbuhan jamur patogen Sclerotium rolfsii sacc. penyebab penyakit rebah semai pada tanaman kedelai. Jurnal HPT. 1(3): 1-10.
Augustowska, M & Dutkiewicz, J. 2006. Variability of airborne microflora in a hospital ward within a period of one year. Ann. Agric. Environ.Med. 13(1): 99-106.
Andrew, J. H & Haris, R.F. 2000. The ecology and biogeography of microorganisms on plant surface. Annu. Rev. Phito. 38(2): 145-180.
Asih, N. P. S., Warseno, T & Kurniawan, A. 2014. Araceae berpotensi obat di Kebun Raya “Eka Karya” Bali. UPT Balai Konservasi Tumbuhan Kebun Raya "Eka Karya" Bali LIPI. Semnas Biodiversitas. 3(1): 84-87.
Arunachalam, C & Gayathri, P. 2010. Studies on bioprospecting of endophytic bacteria from the medical plant of andrographis paniculata or their antimicrobial activity and antibiotic susceptibility pattern. Int J Cur Pharma Res. 4(2): 63-68.
Azevado, J. L., Macheron, W. J. R. & Pereira. 2000. Endophitic microorganisms: a review on insect control and recent advances on tropical plants. J Biotec. 3(1): 40-65.
Baharutan, A., Rares, F.E.S & Soeliongan, S. 2015. Pola bakteri penyebab infeksi nosokomial pada ruang perawatan intensif anak di RSUP Prof. Dr. R. D. Kandou Manado. Jurnal e-biomedik. 2(3):412-419.
Barrow and Feltham. 1993. Manual for Identification of Medical Bacteria. Third Edition. Cambridge University Press. Cambridge: London. Hal. 165. Bonang, s. 1986. Uji Antagonis jamur Trichoderma harzianum terhadap Erwinia
sp.J. Fitomedika. 7(3): 150 – 154.
Darmadi. 2008. Infeksi Nosokomial Problematika dan Pengendaliannya. Salemba Medika : Jakarta. Hal. 12-20.
Dewi, A. K. 2013. Isolasi, Identifikasi dan Uji Sensitivitas Staphylococcus aureus terhadap Amoxicillin dari Sampel Susu Kambing Peranakan Ettawa (PE) Penderita Mastitis Di Wilayah Girimulyo, Kulonprogo, Yogyakarta. JSV: 31(2): 232-235.
Ducel, G. 2002. Prevention of Hospital-Acquired Infections A Practical Guide. Second Edition. World Health Organization. Department of Communicable Disease: Canada. Hal. 2.
Elis, D., Davis, S. & Alexious, H. 2007. Description of Medical Fungi. 2nd ed. Nexus Print Solution: Australia. Pages 55-58.
Gandjar, I., Samson, R.A., Karin van Der Tweel Vermulen., A. Oetari., I. Santoso. 1999. Pengenalan Kapang Tropik Umum. Yayasan Obor Indonesia: Jakarta. Hal. 136.
Geornaras, I & Holy, A. 2001. Antimicrobial susceptibilities of isolates of Staphylococcus aureus, Listeria species and Salmonella serotypes associated with poultry processing. Int Food Microbiol. 70(2): 29–35. Ginting, R. C. B., Suwanto, A & Tjahjoleksono, A. 2005. Transfer gen horizontal
dan populasi bakteri filosfer pada kapas transgenik dan nontransgenik. Hayati. 12(3): 93-97.
Griffin, H. D. 1981. Fungal Physiology. John Willey and Sons, Inc: New York. Hlm. 154.
Harper, T. A. M., Bridgewater, S., Brown, P & Johnson, A. S. 2013. Bioaerosol sampling for airborne bacteria in a small animal veterinary teaching hospital. Infect Eco Epi. 3(1): 20376-99302.
Haas, D. & Devago, G. 2005. Biologycal control of soil-borne pathogens by fluorescens Pseudomonads. Nature Reviews Microbiol. 1(2): 1-13
Hermawan, A., Hana, W & Wiwiek, T. 2007. Pengaruh ekstrak daun sirih (Piper betle L) terhadap pertumbuhan Staphylococcus aureus dan Escherichia coli dengan metode difusi disk. [Skripsi]. Unair: Surabaya.
Hirano, S. S & C. D. Upper. 2000. Bacteria in the leaf ecosystem with emphasis on Pseudomonas syringae pathogen, ice nucleus, and epiphyte. Microbiol Mol Biol Rev. 64(1): 642-653.
Ilyas M. 2007. Isolasi dan Identifikasi Mikoflora Kapang Pada Sampel Serasah Daun Tumbuhan di Kawasan Gunung Lawu, Surakarta, Jawa Tengah. J. Biodiversitas. 8(2): 334-337.
Irianto, A. 2002. Mikrobiologi Lingkungan. Edisi Pertama. Pusat Penerbitan Universitas Terbuka: Jakarta. Hal. 72.
Jeyamohan, D. 2010. Angka Prevalensi Infeksi Nosokomial Pada Pasien Luka Operasi Pasca Bedah Di Bagian Bedah di Rumah Sakit Umum Pusat Haji Adam Malik, Medan. [Skripsi]. USU: Medan.
Kamel, F., Ismael, H. M & Ahmed, A. A. 2012. Effect of natural surface secretes of some common ornamental plants leaves on pathogenic micro-organisms. J Lif Sci. 6(2): 1387-1390.
Kasim, E., Yulinery, R., Hardiningsih, R., Triana& Napitupulu, R. N. R. 2005. Daya anti Staphylococcus aureus dari fermentasi daun beberapa jenis tumbuhan obat. Biol. Indones. 3(1): 397-404.
Kinkel, L. L., Wilson, M & Lindow, S.E. 2000. Plant species and plant incubation conditions influence variability in epiphytic bacterial population size. Microb Ecol. 39(1):1-11.
Koneman, E.W. & Roberts, G.D. 1985. Practical laboratory mycology. 3rd ed. Williams and Wilkins Publisher Inc: Baltimore. Hal. 211.
Kumala, S & Siswanto, E. B. 2007. Isolation and screening of endophitic microbes from Morinda citrifolia and their ability to produce antimicrobial subtance. Microbiol Ind. 3(1): 145-148.
Kusmayati., Agustini, N. W. R. 2007. Uji aktivitas senyawa antibakteri dari mikroalga (Porphyridium cruentum). J. Biod. 8(1) : 48–53.
Lindow, S. E & Brandl, M. T. 2003. Microbiology of the phyllosphere. Appl
Environ Microbiol. 69(4) :1875–1883.
Londok, P.V., Homenta, H & Buntuan, V. 2015. Pola bakteri aerob yang berpotensi menyebabkan infeksi nosokomial di ruang ICU BLU RSUP Prof. dr. R. D. Kandou Manado. Jurnal e-Biomedik (eBm). 3 (1).: 448-452.
Madigan, M. T., Martinko, J. M & Parker, B. 2001. Biology of Microorganism. Eight Edition. Prentice Hall International, In: New Jersey. Page 231. Maier, R. M., Pepper, I.L & Gerba, C. P. 2005. Environmental Microbiology a
Laboratory Manual. Edisi Kedua. Elsevier Academic Press: USA. Pages 67-68.
Merlin, 2012. Studi kualitas udara mikrobiologis dengan parameter jamur pada ruangan pasien rumah sakit (studi kasus: ruang rawat inap Gedung A Rumah Sakit Umum Pusat Nasional Dr.Ciptomangunkusumo. [Skripsi]. Universitas Indonesia: Jakarta.
Mutfianti, R. D. 2011. Pengantar Vegetasi Landscape Pengelompokan Vegetasi Berdasarkan Pembentuk dan Ornamental Space. Jurusan Arsitektur‐ITATS: Surabaya. Hal: 34.
Obbard, P. J & Fang, L.S. 2003. Airborne concentrations of bacteria in hospital environment in Singapore. Water, air, and soil pollution. 144: 333- 341. Olmsted, R. N. 1996. APIC Infection Control and Applied Epidemiology:
Principles and Practice: St Louis: Mosby. Pages 328-329.
Pelczar, M. J & Chan, E.C.S. 1988. Dasar-dasar Mikrobiologi. UI Press: Jakarta. Hal. 642-643.
Preece, T. F., & Dickinson, C.H. 1971. Ecology of Leaf Surface Microorganisms. Academic Press: London. Pages 112-115.
Qudiesat, K., Elteen, K. A., Elkarmi, A., Hamad, M., & Abussaud, M. 2009. Assessment of airborne pathogens in healthcare settings. Afr J Microb Res. 3(2): 66-76.
Rosen, D. 1990. The armoured scale insects: their biology, natural, enemies and control. Else Sci Publis. 4(2): 189-192.
Richaed, J., Lewis, J.R & Tisha, M. 2015. Regulating indoor microbes International Conference on Fungi and Bacteria Microflora Indoor Air Contaminants. 2 (5): 5-9.
Santosa, D.A. Handayanf, N., & Iswandil, A. 2003. Isolasi dan seleksi bakteri filosfer pemicu tumbuh dari daun padi (Oryza sativa L.) varietas IR-64. J. Ilm Tan Lingk. 5(1): 7-12.
Sari, U. F. 2010. Budidaya Tanaman Hias Philodendron Di Deni Nursery and Gardening Karangpandan. [Skripsi]. Fakultas Pertanian. Universitas Sebelas Maret: Surakarta.
Setlhare, G., Malebo, N., Shale, K & Lues, R. 2014. Identification of airbone microbiota in selected areas in health-care setting in South Africa. BMC Microbiology. 14(22):100 : 1471-2180.
Sien, L.S., Chuan, C.H., Lihan, S & Yee, L.T. 2013. Isoaltion and identification of airbone bacteria inside swiftlet houses in Sarawak, Malaysia. Maka J Sci. 17(3): 105-108.
Simarmata, R., Lekatompess, S & Sukiman, H. 2007. Isolasi mikroba endofitik dari tanaman obat sambung nyawa (Gynura procumbens) dan analisis potensinya sebagai antimikroba. Pusat Penelitian Bioteknologi-LIP. Berk Panel Hay: 13(2): 85-90.
Starr, F & Loope, L. 2003. Ficus elastica India Rubber Tree. United States Geological Survey Biological Resources Division. Haleakala Field Station, Maui: Hawai. Hal. 121-124.
Steenis, C.G.G.J. 2003. Flora untuk Sekolah di Indonesia. Cetakan Kesembilan. PT. Pradnya Paramita: Jakarta. Hal. 167.
Sundin, G.W & J.L. Jacobs. 1999. Ultraviolet radiation (UVR) sensitivity analysis and UVR survival strategies of a bacterial community from the phyllosphere of field-grown peanut (Arachis hypogea). Microb. Ecol. 38(3): 27-38.
Supriadi. 2006. Analisis resiko agen hayati untuk pengendalian patogen tanaman. J. Litbang Pertanian. 25(3): 75-80.
Thompson, I.P., M.J. Bailey, J.S. Fenlon, T.R. Fermor, A.K. Lilley, J.M. Lynch, P.J. McCormack, M.P. McQuilken, & K.J. Purdy. 1993.Quantitative and qualitative seasonal changes in the microbial community from the phyllosphere of sugar beet. Plant Soil. 150(3):177-191.
Waluyo, L. 2005. Mikrobiologi Lingkungan. Penerbit Universitas Muhammadiyah Malang: Malang. Hal. 67-68.
Widyati, E. 2013. Memahami interaksi tanaman-mikroba. Pusat Penelitian dan Pengembangan Peningkatan Produktivitas Hutan Kampus Balitbang Kehutanan Bogor. Tekno Hutan Tanaman. 1(6): 13–20.
BAB 3
BAHAN DAN METODE
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April sampai dengan Oktober 2015. Lokasi pengambilan sampel udara dilakukan di Rumah Sakit Umum Dr. Pirngadi, Medan. Penelitian ini dilanjutkan di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara dan di Laboratorium Kesehatan Daerah Medan.
3.2. Deskripsi Lokasi Pengambilan Sampel Mikroorganisme Bioaerosol Pengambilan sampel dilakukan pada tiga lokasi di RSU Pirngadi, Medan, Sumatera Utara yaitu di koridor rumah sakit, ruang rawat inap pasien, dan ruang tunggu. Lokasi 1 yaitu di koridor merupakan lokasi yang paling banyak dilewati oleh pengunjung, pasien dan paramedis dengan jumlah pengunjung rata-rata 11-20 orang per hari. Lokasi 2 yaitu di ruang rawat inap rata-rata memiliki 6 buah tempat tidur dengan rata-rata jumlah pasien dalam setiap kamar 5-6 orang, sedangkan lokasi 3 terdapat di ruang tunggu pasien rawat jalan dimana kegiatan yang berlangsung saat pengambilan sampel ialah orang berjalan, tidur, makan dan duduk. Perawatan ruangan yang dilakukan ialah penggunaan disinfektan pada saat mengepel lantai, menyapu ruangan dengan rutin, dan disediakan sanitazor di setiap ruangan dan koridor.
3.3. Isolasi Mikroorganisme Bioaerosol
sesuai lokasi dan dibawa ke laboratorium. Cawan petri yang berisi media PCA, MSA, dan MC diinkubasi pada suhu 37 oC selama 24-48 jam, sedangkan untuk media SDA diinkubasi pada suhu 25 oC selama 3-5 hari.
3.4. Identifikasi Mikroorganisme Bioaerosol Berpotensi Patogen
Koloni yang berbeda secara morfologi dan terpisah pada media MSA dan MC dikarakterisasi dengan melihat struktur morfologi dan mikroskopis dengan pewarnaan Gram, kemudian diidentifikasi dengan uji biokimia, meliputi uji katalase, uji koagulase, uji oksidase, pewarnaan spora, uji indol, uji methyl-red, Voges Proskauer, uji fermentasi gula, uji sitrat, uji motilitas. Uji karakteristik biokimia dan fisiologi bakteri dilakukan berdasarkan buku Bergey’s Manual of Determinative Bacteriology Edisi ke-9 (Holt et al., 1994). Koloni yang berbeda dan terpisah pada media SDA diidentifikasi dengan mengamati struktur makroskopis yang meliputi warna koloni,warna tepi, konsentris, ada tidaknya garis radial dan tekstur berdasarkan Gandjar et al. (1999) dan Elis et al. (2007). Pengamatan secara mikroskopis dilakukan dengan pewarnaan jamur menggunakan Lactophenol Cotton Blue (LPCB) untuk melihat struktur hifa, miselium dan konidia.
3.5. Isolasi Bakteri Filosfer Tanaman Ornamental
3.6. Uji Antagonis Bakteri Filosfer Tanaman Ornamental dan Bakteri Bioaerosol Berpotensi Patogen
Biakkan murni bakteri patogen disuspensikan dalam 10 ml aquades steril dan dilakukan pengenceran sesuai dengan standard Mac Farland. Media Muller Hinton Agar (MHA) yang telah disterilkan dengan autoklaf dituang ke dalam cawan petri setebal 4 ml, didiamkan hingga memadat. Bakteri patogen potensial diinokulasikan dengan cotton bud steril yang telah dicelupkan ke dalam suspensi bakteri dengan cara mengoleskan ke seluruh permukaan media. Biakkan bakteri filosfer ditotolkan dengan menggunakan ujung tumpul tusuk gigi ke media MHA, diinkubasi selama 24-48 jam pada suhu 37oC, terbentuknya zona bening di sekeliling koloni bakteri merupakan uji positif (Gambar 4).
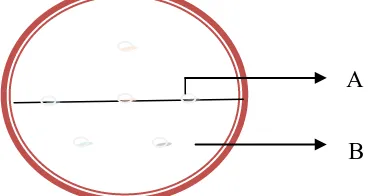
Gambar 4. Metode penotolan biakan murni bakteri filosfer pada media MHA yang telah diolesi biakkan bakteri patogen potensial: A. Titik penotolan bakteri filosfer; B. Media MHA yang telah diolesi biakkan bakteri patogen.
3.7. Uji Antagonis Bakteri Filosfer Tanaman Ornamental dan Jamur Bioaerosol Berpotensi Patogen
Pengujian daya hambat isolat bakteri filosfer terhadap jamur patogen dilakukan secara in vitro pada media MHA yang telah disterilkan dengan autoklaf dituang ke dalam cawan petri setebal 4 ml, didiamkan hingga memadat. Tepi bagian aktif tumbuh dari biakan jamur diambil dengan menggunakan cork borer diinokulasi pada media MHA dibagian tengah, selanjutnya ditotol bakteri filosfer dengan menggunakan tusuk gigi tumpul sejauh 3 cm dari letak biakan jamur. Biakan diinkubasi pada suhu ambien. Aktivitas antagonis bakteri ditunjukkan dengan adanya penghambatan pertumbuhan jamur yang ditandai dengan terbentuknya zona hambat. Pengamatan pengukuran zona hambat dilakukan pada hari ke-7 (Gambar 5).
A
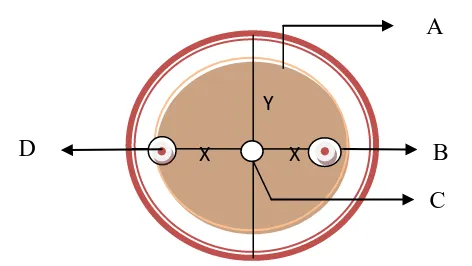
Gambar 5. Metode pengukuran zona hambat bakteri filosfer terhadap koloni jamur berpotensi patogen: A. Koloni jamur; B. Zona hambat bakteri filosfer; C. Titik tengah jamur diletakkan; D. Koloni bakteri filosfer; X. Diameter koloni jamur yang terhambat pertumbuhannya; Y. Diameter koloni jamur normal.
3.8. Identifikasi Bakteri Filosfer berdasarkan Uji Biokimia
Isolat murni yang memiliki daya hambat diidentifikasi dan dikarakterisasi secara morfologinya berdasarkan bentuk, warna, elevasi dan tepi koloni dan berdasarkan pewarnaan Gram serta uji biokimia. Hasil karakterisasi dari masing-masing isolat diidentifikasi dengan merujuk kepada buku Bergey’s Manual of Determinative Bacteriology Edisi Kesembilan (Holt et al., 1994).
Y
X X
A
BAB IV
HASIL DAN PEMBAHASAN
4.1. Isolasi Mikroorganisme Bioaeresol di RSU Pirngadi
Isolasi mikroorganisme bioaerosol di RSU Pirngadi Medan diperoleh koloni yang pada media SDA sebanyak 11 koloni jamur, pada media MSA sebanyak 12 koloni bakteri Gram positif dan pada media MC sebanyak 3 koloni bakteri Gram negatif (Tabel 2).
Tabel 2. Hasil isolasi mikroorganisme bioaeresol di RSU Pirngadi Medan
Jenis Media
Jumlah Koloni (cfu)
Jumlah Koloni Dominan
Koridor (L1) Ruang Inap (L2) Ruang Tunggu
(L3)
PCA 90 (214 cfu/m3) 30 (71 cfu/m3) 65 (154 cfu/m3) -
MSA 42 31 27 12
MC 3 3 3 3
SDA 14 9 3 11
menjadi sumber pencemar udara dalam ruangan karena dapat mengeluarkan partikel-partikel butiran udara (aerosol).
Jumlah koloni bakteri Gram positif pada media MSA paling banyak diperoleh di koridor sebanyak 42 koloni dan didapatkan 12 koloni yang paling dominan. Bakteri Gram negatif pada media MC, baik di koridor, ruang inap dan ruang tunggu diperoleh 3 koloni yang dominan. Jamur pada media SDA diperoleh sebanyak 14 koloni di koridor, 9 koloni di ruang inap, 3 koloni di ruang tunggu, dan didapatkan 11 koloni yang dominan. Isolasi mikroorganisme menggunakan media selektif memungkinkan adanya bakteri yang tidak terisolasi karena adanya komposisi media yang menghambat pertumbuhan bakteri tertentu. Selain itu, metode isolasi settle plate yang bersifat pasif hanya mengisolasi mikroorganisme yang berada di sekitar cawan petri saja pada waktu isolasi. Hal ini berbeda dengan metode menggunakan air sampler yang bisa mengisolasi mikroorganisme dalam suatu ruangan yang lebih representatif.
Indeks angka kuman di RSU Pirngadi dari hasil isolasi masih tergolong rendah dan sesuai dengan persyaratan kesehatan lingkungan rumah sakit berdasarkan KEPMENKES 1204/Menkes/SKIX/2004, yaitu kurang dari 500 cfu/m3. Meskipun hasil perhitungan angka kuman tergolong rendah, tidak menutup kemungkinan akan tetap terjadi infeksi nosokomial oleh mikroorganisme tersebut, karena kondisi ketahanan pasien yang lemah.
4.2. Karakterisasi Mikroorganisme Bioaeresol dari RSU Pirngadi Medan 4.2.1. Karakterisasi dan Identifikasi Bakteri Bioaerosol
Tabel 3. Karakteristik dan identifikasi bakteri bioaerosol Gram positif (+) dari RSU Pirngadi pada media Manitol Salt Agar
No Kode
Isolat
Lokasi
isolasi Morfologi sel Penataan Katalase Koagulase Manitol Endospora Pendugaan spesies/genus
1 BP01 Koridor bulat bergerombol + + + - Staphylococcus aureus
2 BP02 Koridor batang berantai panjang + + - + Bacillus sp.
3 BP03 Koridor batang tunggal + + - + Bacillus sp.
4 BP04 Koridor bulat bergerombol + - + - Staphylococcus sp.
5 BP05 Koridor bulat bergerombol + - + - Staphylococcus sp.
6 BP06 Ruang inap bulat berantai panjang - - + - Streptococcus sp.
7 BP07 Ruang inap bulat bergerombol + + + - Staphylococcus aureus
8 BP08 Ruang inap bulat bergerombol + - + - Staphylococcus sp.
9 BP09 Ruang tunggu batang tunggal + + - + Bacillus sp.
10 BP10 Ruang tunggu batang tunggal - + + + Bacillus sp.
11 BP11 Ruang tunggu batang tunggal + - - + Basillus sp.
12 BP12 Ruang tunggu bulat bergerombol + - + - Staphylococcus sp.
Keterangan :
Katalase + : Menghasilkan enzim katalase - : Tidak menghasilkan enzim katalase Koagulase + : Menghasilkan enzim koagulase - : Tidak menghasilkan enzim koagulase
Manitol + : Dapat Memfermentasi manitol
+ : Tidak dapat memfermentasi manitol Endospora + : Menghasilkan endospora
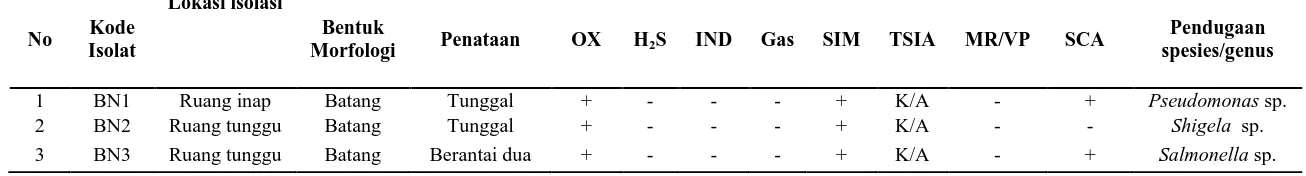
Tabel 4. Karakteristik dan identifikasi bakteri bioaerosol Gram negatif dari RSU Pirngadi (-) pada media Mac Conkey
No Kode
Isolat
Lokasi isolasi
Bentuk
Morfologi Penataan OX H2S IND Gas SIM TSIA MR/VP SCA
Pendugaan spesies/genus
1 BN1 Ruang inap Batang Tunggal + - - - + K/A - + Pseudomonas sp.
2 BN2 Ruang tunggu Batang Tunggal + - - - + K/A - - Shigela sp.
3 BN3 Ruang tunggu Batang Berantai dua + - - - + K/A - + Salmonella sp.
Keterangan OX : Oksidase IND : Indol SIM : Motiliti
TSIA :Triple Sugar Iron Agar MR : Metil Red VP : Voges Poskouer
Menurut penelitian Baharutan (2015) yang meneliti pola bakteri penyebab infeksi nosokomial, bakteri Staphylococcus sp. merupakan bakteri tersering ditemukan sebagai penyebab infeksi nosokomial. Bakteri ini merupakan flora normal pada kulit dan selaput lendir manusia. Pada penelitian ini, Staphylococcus sp. ditemukan di udara melalui droplet pengunjung, keluarga pasien atau pasien sendiri, maupun tangan medis. Bakteri ini bisa bersifat patogen karena sering menghemolisis darah, mengkoagulasi plasma dan menghasilkan beberapa enzim dan toksin yang stabil pada suhu panas. Hal ini mengakibatkan bakteri ini bisa berada pada siklus udara ruang perawatan intensif anak. Bakteri ini bisa menyebabkan keracunan makanan dan toxic shock syndrome. Demikian pula penelitian yang dilakukan oleh Setlhare et al. (2014 ) menemukan Bacillus cereus dan genus Staphylococcus spp. yang diisolasi dari udara di dapur rumah sakit dan ruang rawat inap.
Menurut Londok (2015), distribusi dari 30 sampel yang diteliti, Bacillus subtilis merupakan bakteri terbanyak dengan 8 sampel (26,67%), Staphylococcus sp. dengan 5 sampel (16,67%), Pseudomonas sp., Streptococcus sp. masing-masing 1 sampel (3,33%). Sementara itu, penelitian yang dilakukan di RSUP Prof. Dr. R. D. Kandou ditemukan jenis bakteri pada perabotan ruangan Bacillus subtilis memiliki distribusi terbanyak dari keseluruhan sampel pada perabotan ruang (50%). Pada penelitian infeksi nosokomial yang dilakukan oleh Richards et al. (2013) di PICU United States, jenis bakteri yang ditemukan penyebab infeksi nosokomial yaitu Staphylococcus koagulase negatif (38%), Escherichia coli (19%), dan Pseudomonas aeruginosa (22%).
Lima dari dua belas isolat yang bersifat Gram positif memiliki sel berbentuk batang yang memiliki struktur endospora (BP2, BP3, BP9, BP10, dan BP11). Preparat pewarnaan endospora tersebut dibuat dari kultur yang diinkubasi secara aerobik. Keberadaan struktur endospora dan sifat aerobik dari isolat tersebut mengindikasikan bahwa kelimanya termasuk ke dalam kelompok Bacillus (Abidin, 2015).
BN3, sementara dua spesies yang lain memiliki penataan tunggal yaitu isolat BN01 dan BN02. Kelompok bakteri Gram negatif yang umumnya bersifat patogen pada manusia ialah Shigella sp. dan Salmonella sp. Bakteri ini merupakan bakteri di saluran cerna, misalnya S. disentriae. Apabila bakteri ini terbawa di udara dapat menimbulkan enteritis dan enterokolitis. Kedua penyakit tersebut merupakan penyakit menular melalui udara.
Jenis bakteri lain yang ditemukan ialah Pseudomonas.Salah satu bakteri patogen yang umum pada kelompok ini ialah P. aeruginosa yang banyak ditemukan di tanah, air, tumbuh-tumbuhan, dan binatang. Bakteri ini sering terdapat di dalam flora normal usus dan pada kulit manusia dalam jumlah kecil. P. aeruginosa tersebar luas di alam dan biasanya terdapat di lingkungan rumah sakit yang lembab. Bakteri ini dapat menyebabkan penyakit pneumonia yang disebabkan nekrosis bila daya tahan tubuh pejamu abnormal (Jawetz et al., 2007).
4.3.2. Karakterisasi dan Identifikasi Jamur Bioaerosol
Setelah melakukan isolasi jamur dengan media SDA, diperoleh 11 isolat jamur yang paling dominan. Genus kapang yang berhasil diisolasi terdiri dari genus Aspergillus, Fusarium, Chrysonilia, Mucor, Trichoderma, dan Penicilium. Genus Aspergillus ditemukan paling banyak dan memiliki karasteristik makroskopis bermacam-macam, yaitu ada yang berwarna putih dan hijau kekuningan, tekstur koloni bergranul kasar (Tabel 5).
4.2.2. Karakterisasi dan Identifikasi Bakteri Bioaerosol
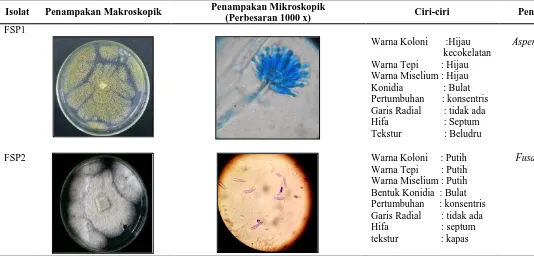
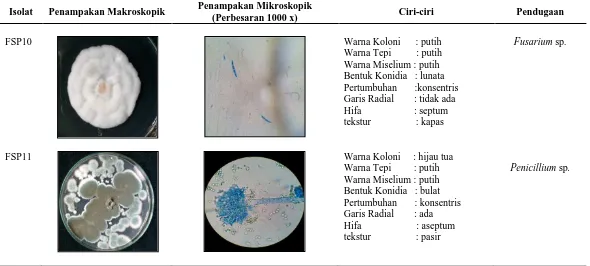
Tabel 5. Karakterisasi dan identifikasi jamur bioaerosol yang diperoleh dari RSU Pirngadi pada media SDA
Isolat Penampakan Makroskopik Penampakan Mikroskopik
(Perbesaran 1000 x) Ciri-ciri Pendugaan
FSP1
Warna Koloni :Hijau kecokelatan Warna Tepi : Hijau Warna Miselium : Hijau Konidia : Bulat Pertumbuhan : konsentris Garis Radial : tidak ada Hifa : Septum Tekstur : Beludru
Aspergillus sp.
FSP2 Warna Koloni : Putih
Warna Tepi : Putih Warna Miselium : Putih Bentuk Konidia : Bulat Pertumbuhan : konsentris Garis Radial : tidak ada Hifa : septum tekstur : kapas
FSP3
Warna Koloni : hijau Warna Tepi : putih Warna Miselium : putih Bentuk Konidia : oval Pertumbuhan : konsentris Garis Radial : ada Hifa : septum tekstur : beludru
Alternaria sp.
Isolat Penampakkan Makroskopis Penampakkan Mikroskopis
Perbesaran 1000x
Ciri-ciri Pendugaan Genus
FSP4 Warna Koloni : cokelat
Warna Tepi : putih Warna Miselium : cokelat
Tabel 5.
Karakterisasi dan identifikasi jamur bioaerosol yang diperoleh dari RSU Pirngadi pada media SDA (Lanjutan)
Bentuk Konidia : Bulat Pertumbuhan : konsentris Garis Radial : ada Hifa : aseptum tekstur : beludru
FSP5
Warna Koloni : oranye Warna Tepi : putih Warna Miselium : putih Bentuk Konidia : kotak Pertumbuhan : menyebar Garis Radial : tidak ada Hifa : septum tekstur : kapas
Neurospora sp.
FSP6 Warna Koloni : putih
Warna Tepi : putih Warna Miselium : putih Bentuk Konidia : bulat Pertumbuhan : konsentris Garis Radial : ada Hifa : septum tekstur : kapas
Aspergillus sp.
Isolat Penampakkan Makroskopis Penampakkan Mikroskopis
Perbesaran 1000x
FSP4 Warna Koloni : cokelat
Warna Tepi : putih Warna Miselium : cokelat Bentuk Konidia : Bulat Pertumbuhan : konsentris Garis Radial : ada Hifa : aseptum tekstur : beludru
Mucor sp.
FSP5 Warna Koloni : oranye
Warna Tepi : putih Warna Miselium : putih Bentuk Konidia : kotak Pertumbuhan : menyebar Garis Radial : tidak ada Hifa : septum tekstur : kapas
Tabel 5. Karakterisasi dan identifikasi jamur bioaerosol yang diperoleh dari RSU Pirngadi pada media SDA (Lanjutan)
Isolat Penampakan Makroskopik Penampakan Mikroskopik
(Perbesaran 1000 x) Ciri-ciri Pendugaan
FSP7 Warna Koloni : hijau
Warna Tepi : putih Warna Miselium : cokelat Bentuk Konidia : bulat Pertumbuhan : konsentris Garis Radial : tidak ada Hifa : septum tekstur : beludru
Aspergillus sp.
FSP8 Warna Koloni : cokelat
tua Warna Tepi : putih Warna Miselium : cokelat Bentuk Konidia : bulat Pertumbuhan : kosentris Garis Radial : ada Hifa : septum tekstur : kapas
Aspergillus sp.
FSP9 Warna Koloni : hijau
Warna Tepi : putih Warna Miselium : putih Bentuk Konidia : bulat Pertumbuhan :konsentris Garis Radial : ada Hifa : aseptum tekstur : kapas
Tabel 5. Karakterisasi dan identifikasi jamur bioaerosol yang diperoleh dari RSU Pirngadi pada media SDA (Lanjutan)
Isolat Penampakan Makroskopik Penampakan Mikroskopik
(Perbesaran 1000 x) Ciri-ciri Pendugaan
FSP10 Warna Koloni : putih
Warna Tepi : putih Warna Miselium : putih Bentuk Konidia : lunata Pertumbuhan :konsentris Garis Radial : tidak ada Hifa : septum tekstur : kapas
Fusarium sp.
FSP11 Warna Koloni : hijau tua
Warna Tepi : putih Warna Miselium : putih Bentuk Konidia : bulat Pertumbuhan : konsentris Garis Radial : ada Hifa : aseptum tekstur : pasir
Dari hasil isolasi fungi di RSU Pirngadi Medan, ditemukan bahwa genus Aspergillus merupakan genus yang paling banyak diperoleh. Menurut Ekhaise (2008), genus paling umum yang diisolasi dari lingkungan indoor rumah sakit adalah Aspergillus, yang berperan dalam kasus aspergillosis, infeksi telinga dan kulit. Demikian pula penelitian oleh Augustowska et al. (2006) juga menemukan Aspergillus sebagai fungi terbanyak yang diisolasi dari dua rumah sakit di Jerman. Genus fungi yang ditemukan lainnya pada penelitian ini adalah Alternaria dan Penicillium. Menurut Ilyas (2007), faktor yang menyebabkan tingginya kehadiran Aspergillus disebabkan fungi tersebut memiliki sebaran kosmopolit yang dapat menghasilkan spora vegetatif (konidia) dalam jumlah yang besar dan pertumbuhan yang sangat cepat. Menurut Manfoeld (1993), kapang A. flavus dan A. fumigatus menghasilkan berbagai jenis toksin, diantaranya adalah aflatoksi, asam aspergilat, asam kojat, palmotoksin Bo dan Go dihasilkan A. flavus dan famagilin, fumigatoksin dan asam helvenat dihasilkan A. fumigatus. Toksin-toksin tersebut sangat membahayakan dan bersifat akut pada manusia.
Berdasarkan hasil pengamatan makroskopis koloni genus Penicillium yang ditemukan, memiliki karasteristik koloni tumbuh cepat secara konsentris, warna koloni hijau kebiru-biruan dengan tepi berwarna putih, koloni datar, dengan lapisan tepung/pasir. Sementara itu, genus Fusarium yang didapatkan berwarna putih, pertumbuhan koloni lambat dan secara konsentris, hifa bersepta, dan teksturnya seperti kapas. Menurut Elis et al. (2007), secara makroskopik koloni Fusarium umumnya berwarna putih, krem, kekuningan, kecokelatan, atau kemerahan. Tekstur dari koloni Fusarium seperti kapas (wooly atau cottony). Genus Crysonilia (teleomorf: Neurospora) memiliki pertumbuhan koloni yang sangat cepat, berwarna oranye, teksturnya seperti kapas, pengamatan secara mikroskopis menunjukkan hifa yang bersepta. Sedangkan genus Tricodherma menunjukkan koloni konsentris berwarna hijau dengan tepi putih, terdapat garis radial.
4.3. Isolasi Bakteri Filosfer dari Tanaman Ornamental
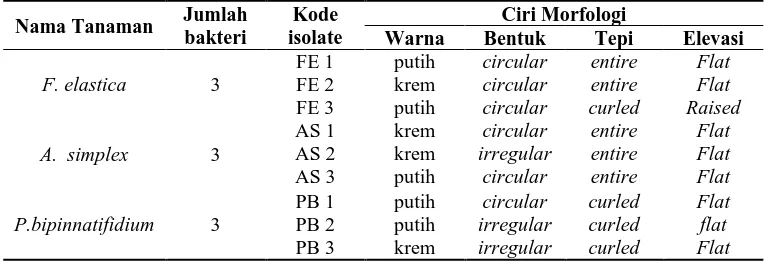
dari ketiga jenis tanaman. Hasil isolasi dari F. elastica diperoleh 3 isolat dengan kode FE1, FE 2, dan FE3. Hasil isolasi dari P. bipinnatifidum didapatkan 3 isolat dengan kode PB1, PB2, dan PB3. Sementara itu, hasil isolasi dari A. simplex juga didapatkan 3 isolat dengan kode AS1, AS2, dan AS3 (Tabel 6). Warna koloni bakteri yang diperoleh ialah berwarna putih dan krem, bentuk bulat (circular) dan tidak beraturan (irreguler), tepi koloni ada yang rata (entire) dan bergelombang (curled), sedangkan elevasi koloni datar (flat) dan hanya ada satu koloni yang menggunung (raised).
Tabel. 6. Ciri-ciri morfologi koloni bakteri filosfer dari tanaman ornamental
Nama Tanaman Jumlah
Karakteristik bakteri filosfer yang diperoleh dari tanaman ornamental hampir mirip (Tabel 6). Hal ini disebabkan karena kondisi lingkungan dari ketiga jenis tanaman yang diisolasi hampir sama. Menurut Lindow dan Brandl (2003), keragaman isolat bakteri filosfer dipengaruhi oleh kondisi lingkungan tempat pengambilan sampel dan jenis sampel tanaman yang diambil. Selain itu, ketersediaan nutrisi pada permukaan tanaman juga mempengaruhi keragaman bakteri filosfer. Selain itu, senyawa antimikroba yang diproduksi oleh beberapa bakteri filosfer dapat juga mempengaruhi keragaman bakteri filosfer.
4.4. Uji Antagonis Bakteri Filosfer Tanaman Ornamental dan Mikroorganisme Bioaerosol Berpotensi Patogen
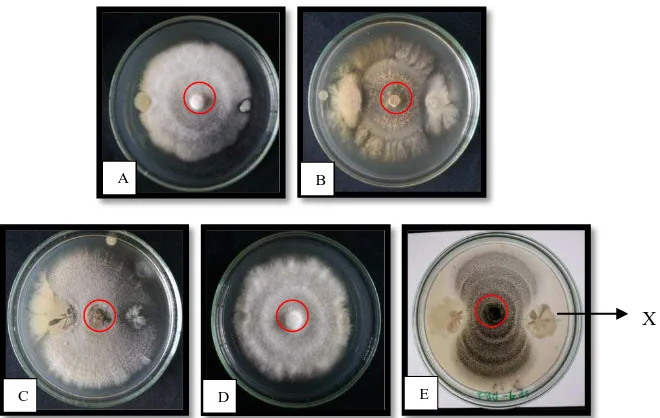
Gambar 6. Uji daya hambat bakteri filosfer terhadap jamur berpotensi patogen: A. AS2 dengan
Fusarium sp.; B. FE 2 dengan Aspergillus sp.; C. PB2 dengan Alternaria sp.; D. FE2
dengan Fusarium sp.(Negatif); E. AS2 dengan Mucor sp.; : Jamur bioaerosol; X. Bakteri filosfer
Gambar 6 menunjukkan isolat bakteri filosfer menghambat pertumbuhan hifa dari beberapa jamur bioaerosol berpotensi
patogen. Isolat AS2, PB2 dan FE2 merupakan tiga isolat terpilih
yang memiliki daya hambat paling besar pada uji antagonis dengan
jamur. Isolat jamur bioaerosol Fusarium, Aspergillus, Mucor dan
Alternaria merupakan isolat terpilih untuk jamur uji, yang merupakan jamur dengan jumlah terbanyak saat dilakukan isolasi mikroorganisme bioaerosol. Isolat AS2 (Gambar 6 E) menunjukkan zona hambat yang paling besar dengan daya hambat bakteri filosfer terhadap miselium Mucor sp. Sementara itu, pada isolat FE2 (Gambar 6 D) menunjukkan daya hambat yang kurang efektif, karena miselium Fusarium sp. jamur tetap tumbuh mendekati bakteri filosfer. Demkian juga dengan Gambar 6 A dan Gambar 6 C. Pertumbuhan hifa tidak menunjukkan penghambatan, bahkan ada hifa yang dapat tumbuh mlewati bakteri filosfer yang ditotolkan.
Bakteri filosfer AS2 mengeluarkan aktivitas senyawa bioaktif ditandai dengan terbentuknya zona bening di sekeliling koloni bakteri filosfer (Gambar 7). Zona bening tersebut terbentuk karena pada area tersebut mengandung senyawa
A B
C D E
antimikroba yang berdifusi sehingga bakteri bioaerosol berpotensi patogen tidak dapat tumbuh di bagian tersebut.
Gambar 7. Zona hambat isolat bakteri AS2 terhadap Staphylococcus sp. A. Isolat bakteri bioaerosol BP01 (Staphylococcus aureus.); B. Isolat bakteri filosfer AS2; C. Zona bening
Dari Tabel 7 dapat dilihat bahwa bakteri filosfer cenderung lebih besar daya hambatnya terhadap jamur bioaerosol dibandingkan terhadap bakteri bioaerosol. Isolat bakteri filosfer yang memiliki kemampuan menghambat pertumbuhan miselium jamur mengindikasikan bakteri memiliki mekanisme penghambatan secara antibiotis dengan menghasilkan metabolit sekunder seperti enzim. Supriadi (2006) menyatakan bahwa beberapa bakteri mampu menghasilkan enzim kitinase, dimana enzim ini mampu mendegradasi kitin yang terkandung pada dinding sel hifa jamur menjadi N-asetilglukosamin. Haas dan Devago (2005) menyebutkan bahwa Pseudomonas sp. dapat mengeluarkan senyawa antibiotik (antifungal), siderofor, dan metabolit sekunder lainnya yang sifatnya dapat menghambat aktivitas jamur.
Tabel 7. Hasil uji antagonis bakteri filosfer tanaman ornamental dan mikroorganisme bioaerosol berpotensi patogen
Jenis Patogen
Kelompok patogen
Besar Zona Hambat Antagonis Filosfer (cm)
Fusarium sp. 0 0 0 0 0 0,3 0 0 1,2
Dari Tabel 7 dapat dilihat bahwa isolat AS1, AS2, dan AS3 menunjukkan zona hambat yang paling besar, terutama isolat AS2 yang menghasilkan zona hambat paling besar yaitu 4,2 cm dalam menghambat jamur Mucor sp., diikuti AS3 sebesar 4,0 cm dan AS1 sebesar 3,3 cm juga terhadap Mucor sp. Kelompok isolat AS menunjukkan daya hambat yang paling banyak terhadap beberapa patogen dibandingkan dua isolat yang lain. Sementara itu, isolat PB2 merupakan isolat terbaiknya pada saat melawan Mucor sp., yang menghasilkan zona hambat sebesar 3,7 cm. Isolat PB3 sebesar 3,3 cm dan isolat PB1 sebesar 3,0 cm. Isolat FE menunjukkan daya hambat yang rendah dengan besar zona hambat yang paling baik pada saat melawan Mucor sp. yaitu sebesar 2,4 cm. Sementara isolat FE1 tidak dapat menghambat jenis patogen manapun. Hal ini dapat diartikan bahwa isolat FE1 tidak meiliki potensi dalam menghambat mikroorganisme bioaerosol.
Dari data yang diperoleh dapat dilihat bahwa hanya sedikit isolat bakteri filosfer yang mampu menghambat semua kelompok bakteri bioaerosol berpotensi patogen, yaitu AS1 dan AS2. Besar zona hambat yang dihasilkan saat uji antagonis dengan bakteri bioaerosol berpotensi patogen masih tergolong rendah yaitu dibawah 1,0 cm. Dalam hal ini, AS2 juga menunjukkan zona hambat paling besar yaitu 0,8 cm. Sementara itu, dalam menghambat jamur bioaerosol, bakteri filosfer mengahsilkan zona hambat yang lebih besar (diatas 1,0 cm) dengan kategori sedang hingga sangat kuat. Akan tetapi, pengecualian untuk isolat FE1 yang tidak menunjukkan aktifitas hambat sama sekali.
Menurut Shehata et al. (2008), salah satu sifat mikroba antagonis adalah pertumbuhannya lebih cepat dibanding dengan patogen dan menghasilkan senyawa antibiotik yang dapat menghambat pertumbuhan patogen. Adanya perbedaan kemampuan menghambat diantara bakteri filosfer diduga karena potensi dari jenis antibiotik bakteri berbeda-beda pada tanaman yang berbeda.
jamur dan bakteri. Gula dimanfaatkan oleh jamur yaitu sebagai prekursor dari metabolit sekunder, sedangkan gula dimanfaatkan oleh bakteri untuk menjaga keseimbangan osmotik di dalam sel. Jamur dan bakteri memerlukan air untuk difusi nutrien ke dalam sel-sel dan mempertahankan sitoplasmanya. Air bagi bakteri merupakan penyusun terbesar bagi sel dan penting untuk proses kehidupannya. Mineral digunakan untuk aktivitas sel yaitu dalam reaksi enzim dan proses transportasi (Madigan et al. 2001).
Perbedaan kemampuan bakteri filosfer dalam menekan pertumbuhan patogen disebabkan perbedaan senyawa biologis yang dihasilkan. Isolat bakteri filosfer AS2 yang mampu menekan pertumbuhan patogen menghasilkan senyawa biologis yang lebih potensial dibandingkan dengan bakteri filoser lainnya, sehingga dapat menunjukkan zona bening paling besar. Bakteri filosfer menghasilkan suatu senyawa baik berupa enzim, toksin maupun antibiotik yang dalam konsentrasi rendah dapat menghambat atau membunuh organisme lainnya.
Isolat mikroorganisme bioaerosol berpotensi patogen yang diuji antagonis dengan bakteri filosfer dalam penelitian ini, merupakan isolat terpilih. Penentuan isolat terpilih dilakukan berdasarkan jumlah koloni yang paling banyak pada saat pengambilan sampel di udara rumah sakit. Penelitian ini belum melakukan uji antagonis terhadap beberapa isolat bioaerosol lain yang terisolasi dalam jumlah sedikit.
4.5. Karakterisasi Bakteri Filosfer berdasarkan Uji Biokimia
Tabel 8. Potensi zona hambat isolat bakteri filosfer terpilih terhadap
Aspergillus sp 1,6 Sedang
FE2 Ficus elastica Mucor sp. 2,4 Sangat kuat
Aspergillus sp 1,2 Sedang
Isolat bakteri filosfer dari A. simplex (AS) memiliki daya hambat terhadap bakteri dan jamur yang paling baik, terutama isolat AS2 dihasilkan terhadap jamur Mucor sp. Hal ini ditunjukkan dengan besarnya zona hambat yang itu 4,2 cm dan menghambat bakteri S.aureus sebesar 0,8 cm. Daya hambat bakteri filosfer pada P. bipinnatifidium yang paling baik ditunjukkan oleh isolat PB2 melawan Mucor sp, sebesar 3,7 cm sedangkan zona hambat terhadap Aspergilus sp. sebesar 1,6
cm. Daya hambat yang paling baik dari F. elastica ditunjukkan oleh isolat FE2 sebesar 2,4 cm, sedangkan terhadap Aspergillus sp. menghasilkan zona hambat
sebesar 1,2 cm.
Pewarnaan Gram dilakukan untuk identifikasi awal isolat bakteri filosfer terpilih. Hasil dari pewarnaan Gram menunjukkan ketiga isolat berwarna merah atau termasuk kelompok Gram negatif dan berbentuk batang dengan penataan monobasil (Gambar 8).
Gambar 8. Preparat pewarnaan Gram isolat AS2, PB2, dan FE2 pada perbesaran 1000x
Berdasarkan hasil karakterisasi sifat biokimia dapat disimpulkan bahwa genus bakteri filosfer merupakan Pseudomonas sp. Karakterisasi biokimia yang dilakukan meliputi uji oksidase, uji hidrogen sulfida, uji sitrat, uji motilitas, uji katalase, uji indol (Tabel 9).
FE2 PB2
Tabel 9. Karakteristik bakteri filosfer potensial dengan uji biokimia
KETERANGAN:
O : Oksidase
TSIA : Triple Sugar Iron Agar SIM : Uji Motilitas
SCA : Simon Citrat Agar IND : Indol
G : Gas
K/A : mampu memfermentasi jenis gula
Uji oksidase dari ketiga isolat menunjukkan hasil positif. Menurut Bergey’s Manual, oksidase positif untuk bakteri Gram negatif berbentuk batang termasuk ke golongan Pseudomonas. Menurut Lindow and Brandl (2003), contoh bakteri filosfer yang termasuk ke dalam kelompok ini ialah P. syringae dan P. fluroscens. Bakteri-bakteri antagonis tersebut diketahui mampu menghambat jamur patogen dengan menghasilkan senyawa yang diketahui sebagai antifungal, seperti siderofor, dan metabolit sekunder lainnya yang sifatnya dapat menghambat aktivitas jamur (Haas dan Devago, 2005).
Ditemukannya genus Pseudomonas baik pada bioaerosol dan filosfer daun tanaman ornamental menunjukkan bahwa keberadaan genus ini sangat kosmopolit dan memiliki keanekaragaman yang tinggi. Kelompok bakteri ini ada yang bersifat patogen maupun non patogen, sehingga perlu dilakukan uji patogenitas pada penelitian selanjutnya sebelum pemanfaatan bakteri.
Kode
Isolat Gram Bentuk Penataan O TSIA SIM SCA IND H2S G Pendugaan
AS2 - Batang Monobasil + K/A + + - - + Pseudomonas
PB2 - Batang Monobasil + K/A - - - - + Pseudomonas
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang dilakukan dapat disimpulkan bahwa:
a. Mikroorganisme bioaerosol berpotensi patogen dari Rumah Sakit Umum Pirngadi Medan ialah bakteri Staphylococcus aureus, Staphylococcus sp., Bacillus sp., Streptococcus sp., Pseudomonas sp., Salmonella sp. dan Shigella sp., sedangkan jamur yang diperoleh ialah dari genus Aspergillus, Alternaria, Trichoderma, Neurospora, Fusarium dan Penicillium.
b. Isolasi bakteri filosfer dari tanaman ornamental Ficus elastica, Philodendron bipinnatifidum dan Aglonema simplex diperoleh sebanyak 9 isolat, yaitu isolat FE1, FE2, FE3, AS1, AS2, AS3, PB1, PB2, dan PB3. c. Isolat bakteri filosfer yang memiliki potensi paling baik dalam menghambat
mikroorganisme bioaerosol ialah isolat AS2, PB2, dan FE2, yang merupakan bakteri Pseudomonas spp. Bakteri filosfer tanaman ornamental memiliki kecenderungan menekan pertumbuhan jamur bioaerosol dan dapat dipertimbangkan sebagai salah satu cara pengendalian infeksi nosokomial melalui metode biologi.
5.2 Saran
a. Metode pengambilan sampel mikroorganisme udara perlu dilakukan pembandingan dengan menggunakan metode aktif yaitu menggunakan air sampler untuk mendapatkan perhitungan mikroorganisme bioaerosol yang lebih representatif..
BAB 2
TINJAUAN PUSTAKA
2.1. Mikroorganisme Udara (Bioaerosol)
Bioaerosol merupakan materi partikulat bakteri yang berasal dari hewan ataupun tanaman, baik yang bersifat patogenik maupun non patogenik. Partikel bioaerosol yang tersuspensi di udara memiliki kisaran ukuran sebesar 0,5-30 µm (Irianto, 2002). Komponen penyusun udara meliputi bakteri, air, polen, debu, senyawa organik maupun senyawa anorganik. Mikroorganisme yang paling banyak memenuhi komponen udara bebas adalah bakteri, jamur dan mikro alga, dalam bentuk vegetatif atau generatif, umumnya berbentuk spora. Udara bukan merupakan medium tempat bakteri tumbuh, tetapi merupakan pembawa bahan partikulat, debu, tetesan air yang semua dapat sebagai tempat tumbuh bakteri Kandungan udara dalam ruangan akan berbeda dengan luar ruangan. Bakteri dalam ruangan dipengaruhi oleh laju ventilasi, padatnya orang, taraf kegiatan orang yang menempati ruangan tersebut. Flora bakteri yang terdapat di udara bersifat sementara dan beragam (Waluyo, 2005).
Udara tidak mengandung komponen nutrisi yang penting untuk bakteri, adanya bakteri udara kemungkinan terbawa oleh debu, tetesan uap air kering ataupun terhembus oleh tiupan angin. Bakteri yang berasal dari udara biasanya akan menempel pada permukaan tanah, lantai, maupun ruangan. Mikroorganisme yang berasal dari udara yang terutama mengakibatkan infeksi di rumah sakit misalnya Bacillus sp., Staphylococcus sp., Streptococcus sp., Pneumococcus, Coliform, virus hepatitis, Clostridium sp. (Lay,1992).
hidup lama. Ketahanan hidup yang berbeda-beda dari suatu bakteri di udara ditentukan oleh keadaan lingkungan seperti keadaan atmosfer, kelembaban, cahaya, suhu, ukuran partikel pembawa mikroorganisme tersebut serta ciri-ciri mikroorganisme itu sendiri terutama ketahanan terhadap keadaan fisik di atmosfer. Beberapa metode penangkapan bakteri udara antara lain dengan cara sedimentasi dan alat penangkap udara (air sampler) (Pelczar, 1988).
Komponen-komponen penyusun bioaerosol diantaranya ialah jamur, virus dan bakteri. Udara tidak mempunyai flora alami, mikroorganisme tersebut hanya tinggal sementara mengapung di udara dan terbawa bersama dengan debu. Jumlah dan macam mikroorganisme dalam suatu volume udara bervariasi sesuai dengan lokasi, kondisi dan jumlah orang yang ada. Tipe-tipe bakteri yang hidup di udara meliputi bakteri pembentuk spora dan bukan pembentuk spora, basil gram positif, coccus gram positif dan basil gram negatif. Golongan jamur dominan yang bisa didapati dalam suatu ruang adalah dari genus Trichosporon, Monieliella, Trichoderma dan Aspergillus, sedangkan golongan bakteri dominan adalah dari genus Pseudomonas dan Bacillus (Waluyo, 2005).
Ada banyak faktor yang mempengaruhi biaoaerosol yang menentukan seberapa baik bagi kesehatan manusia. Faktor-faktor tersebut meliputi kehadiran dan efisiensi dari alat penyaring udara, desain dan operasi sistem sirkulasi udara, kesehatan dan kehigenisan dari penghuni ruangan, komponen udara yang bersih sekitar bangunan, tipe pencahayaan, temperatur, dan kelembapan udara relatif (Maier, 2005).
2.2. Infeksi Nosokomial
kesehatan, dari pasien ke pengunjung atau keluarga ataupun dari petugas ke pasien (Husain, 2008).
Pasien akan terpapar berbagai macam mikroorganisme selama ia dirawat di rumah sakit. Kontak antara pasien dan berbagai macam mikroorganisme ini tidak selalu menimbulkan gejala klinis karena banyaknya faktor lain yang dapat menyebabkan terjadinya infeksi nosokomial. Kemungkinan terjadinya infeksi tergantung pada karakteristik mikroorganisme, resistensi terhadap zat-zat antibiotika, tingkat virulensi, dan banyaknya materi infeksius. Semua mikroorganisme termasuk bakteri, virus, jamur dan parasit dapat menyebabkan infeksi nosokomial. Infeksi ini dapat disebabkan oleh mikroorganisme yang didapat dari orang lain (cross infection) atau disebabkan oleh flora normal dari pasien itu sendiri (endogenous infection) (Ducel, 2002).
Menurut Obbard et al. (2002) terdapat beberapa bakteri yang umumnya terdapat di dalam ruangan rumah sakit, yaitu: Staphylococcus sp., Corynebacterium sp., Escherichia coli dan Enterobacter (Tabel 1).
Tabel 1. Genera mikroorganisme dari sampel udara di dalam ruangan rumah sakit di bagian barat daya Singapura
NO Mikroorganisme Pewarnaan Gram Lokasi
1 Staphylococcus + Bangsal
2 Corynebacterium + Bangsal
3 Acinetobacter - Bangsal
4 Moraxella - Lobi
5 Bacillus + Lobi
6 Pseudomonas stutzerry - Bangsal
7 Escherichia coli - Lobi
8 Actinomyces + Farmasi
9 Enterobacter + Lobi
10 Alcaligenes - Bangsal
Tabel 1 memperlihatkan bahwa bakteri yang diperoleh dari penelitian tersebut sebagian merupakan bakteri yang berasosiasi dengan mikroflora normal dari kulit, dan dapat juga berasal dari tanah dan air. Selain itu terdapat bakteri patogen oprtunistik yang dapat menular melalui pernapasan dan menyebabkan infeksi tertentu pada individu yang rentan seperti pasien imunokompromis (Obbard et al., 2002).
memutuskan rantai penularannya. Rantai penularan adalah rentetan proses berpindahnya mikroba patogen dari sumber penularan (reservoir) ke pejamu dengan/ tanpa media perantara. Jadi, kunci untuk mencegah atau mengendalikan penyakit infeksi adalah mengeliminasi mikroba patogen yang bersumber pada reservoir serta mengamati mekanisme transmisinya (Darmadi, 2008).
2.3. Bakteri Filosfer
Keragaman bakteri bisa dilihat dari berbagai sudut pandang seperti: morfologi, fisiologi, dan genetik. Tiap-tiap habitat yang berbeda memberikan keragaman yang berbeda pula. Contoh habitat yang sering dihuni oleh bakteri adalah daun. Tiap tanaman mempunyai daun yang berbeda, baik dari segi bentuk, ukuran, maupun eksudat yang dikeluarkannya. Perbedaan tersebut menyebabkan bakteri yang menghuninya juga berbeda, meskipun pada tanaman tertentu ditemukan populasi bakteri yang sama (Widyawati, 2013).
Filosfer merupakan salah satu habitat mikroorganisme saprofit. Beberapa di antaranya merupakan mikroorganisme antagonis. Populasi bakteri yang menghuni permukaan daun disebut dengan filoplen (phyllo= daun, plane= permukaan). Pemakaian istilah filosfer lebih disukai karena cakupannya lebih luas (Preece, 1971).
Bakteri merupakan kelompok mikroba yang paling dominan di filosfer. Perbedaan ukuran populasi disebabkan oleh adanya fluktuasi yang besar pada kondisi fisik dan nutrisi di filosfer. Hal ini karena lingkungan filosfer sangat terpengaruh oleh angin dan hujan sehingga nutrisi yang melekat pada daun akan tergantung kepada kecepatan angin dan curah hujan. Di samping itu, jenis tanaman diduga juga mempengaruhi daya dukung daun terhadap mikroba (microbial carrying capacity). Hasil isolasi bakteri dari tumbuhan berdaun lebar seperti ketimun dan kacang polong memiliki total populasi jauh lebih tinggi dibandingkan dengan yang diisolasi dari rumput-rumputan atau tumbuhan berdaun lebar yang memiliki lapisan lilin tebal (Kinkel, 2000).
bunga. Ada beberapa faktor yang mempengaruhi keragaman mikroorganisme yang mendiami permukaan daun, yaitu radiasi ultra violet, kelembapan, kecepatan angin dan sumber nutrisi. Komunitas bakteri filosfer yang tidak ternaungi kanopi atau setengah ternaungi, akan sangat dipengaruhi oleh radiasi ultra violet. Adanya radiasi ini meyebabkan dihasikannya dua jenis mikroorganisme filosfer, yaitu mikroorganisme sensitif ultraviolet (UV) dan mikrorganisme yang toleran terhadap ultraviolet. Bakteri yang toleran terhadap UV adalah bakteri yang memiliki pigmen. Pigmen bakteri meliputi merah muda, orange dan kuning (Sundin dan Jacob, 2001).
Keragaman bakteri filosfer juga sangat dipengaruhi oleh kelembaban dan kecepatan angin. Kelembaban dapat diperoleh dari air hujan dan embun. Kelembaban ini dapat hilang disebabkan oleh temperatur, angin dan aktivitas sel tanaman. Kelembaban dan kecepatan angin mempengaruhi mobilitas bakteri, yang akhirnya dapat menentukan keberadaan bakteri. Hal lain yang dapat menentukan keragaman dan keberadaan bakteri filosfer, yaitu nutrisi. Kelimpahan nutrisi pada daun dapat mengindikasikan keberadaan mikroorganisme, terutama sumber karbon dan sumber nitrogen (Lindow et al., 2006).
Thompson et al. (1991) menganalisis sebanyak 1.236 strain bakteri dari daun muda, daun dewasa (aktif fotosintesis) dan daun yang menguning pada gula bit. Data yang diperoleh menunjukkan bahwa pada daun yang muda memiliki jumlah genera lebih beragam dibandingkan dengan daun yang tua. Menurunnya jumlah genera tersebut disebabkan lingkungan alami (angin, hujan, cahaya matahari) di filosfer yang melakukan seleksi terhadap bakteri yang mengkoloni daun.
2.4. Interaksi Tumbuhan dan Bakteri
menjadi rizoplen (menempel pada akar) dan endofit (berada dalam sel-sel akar). Peranan utama bakteri tersebut adalah membantu tanaman mendapatkan unsur hara dan sebagai anti bakteri bagi patogen yang merugikan tanaman inangnya. Keuntungan yang didapat oleh bakteri adalah mendapat habitat dan memperoleh suplai makanan dari tanaman (Widyawati, 2013).
Permukaan tanaman yang mengalami kontak dengan udara memuat berbagai macam bakteri, sebagian diantaranya mungkin berpotensi sebagai pengganggu tanaman, namun sebagian lainnya merupakan bakteri yang menguntungkan. Terdapat dua bakteri yang mengkoloni filosfir yaitu bakteri filosfir dan bakteri epifit. Bakteri filosfir merupakan koloni bakteri udara yang ditemukan pada permukaan tanaman (daun, kulit dan batang), sedangkan bakteri yang ditemukan pada jaringan bagian dalam tanaman disebut bakteri epifit. (Lindow et al., 2003).
Area terjadinya interaksi antara bakteri udara (bioaerosol) dengan bagian tanaman yang terletak di atas permukaan tanah diberi istilah filosfer. Permukaan daun sudah lama dikenal sebagai lingkungan yang dapat dikoloni oleh banyak genera bakteri. Hal ini karena pada permukaan daun melekat partikel-partikel debu dan air. Debu berasal dari lapisan atas permukaan tanah yang diterbangkan oleh angin dan melekat pada permukaan daun sehingga mengandung unsur-unsur hara terbatas yang diperlukan oleh bakteri. Adapun air datang dari embun dan hujan yang dapat memelihara suhu dan kelembaban yang sesuai bagi pertumbuhan bakteri (Widyawati, 2013).
2.5. Tanaman Ornamental
Beberapa tanaman yang sering digunakan di dalam ruangan ialah Ficus elastica, Philodendron bipinnatifidum dan Aglaonema simplex.
a. Ficus elastica (Karet hias)
Ficus elastica atau karet hias adalah tanaman hias populer di dunia yang termasuk ke famili Moraceae. Tanaman ini dapat tumbuh di dalam ruangan dengan suhu yang rendah dan di luar ruangan dengan iklim tropis (Starr et al., 2003). Habit pohon, tinggi tanaman bias mencapai 8-40 m, namun untuk di dalam ruangan dapat diperpendek dengan pemangkasan rutin. Daun tunggal, pertulangan daun menyirip, panjang helai daun 8-12 cm, berselang-seling, bertangkai cukup panjang, bentuk memanjang atau oval, kerapkali dengan pangkal tumpul dan ujung meruncing, tepi daun rata, permukaan atas berwarna hijau tua dan mengkilat, permukaan bawah lebih muda dan buram, dapat juga ditanam sebagai tanaman hias dalam pot (Gambar 1) (Steenis, 2003).
Gambar 1. Ficus elastica
Sumber: http://fp.unram.ac.id/
b. Philodendron bipinnatifidium
Gambar 2. Philodendrom bipinnatifidum
Sumber
c. Aglaonema simplex (Sri Rejeki Hutan)
A. simplex merupaka Ciri tanaman A. simplex ialah habit herba, daun elips, lanset dengan pangkal membundar, berwarna hijau, tepi daun rata hingga agak bergelombang, batang tegak dan tinggi hingga 1,2 m kadang bisa mencapai 3 m, spadix (tongkol), spadix sama panjang atau agak lebih panjang dari seludangnya, tegak, buah matang berwarna oranye hingga merah (Gambar 3) (Asih et al., 2014).
Gambar 3. Aglaonema simplex
Sumber :www.wikipedia.org
2.6. Bakteri Filosfer sebagai Antibakteri
matinya, rusaknya, atau terhambatnya pertumbuhan bakteri oleh pengaruh bakteri lain (Kasim et al. 2005).
Penelitian mengenai aktivitas antibakteri dari bakteri endofit telah banyak dilakukan, seperti pada penelitian bakteri endofit tanaman obat Gynura procumbers yang memiliki aktivitas antibakteri terhadap Candida albicans, E.coli, Pseudomonas sp. dan B.subtilis (Simarmata et al., 2007). Ditemukan pula aktivitas antibakteri dari bakteri endofit tanaman mangrove Brugulera gymnorrhiza, aktivitas antibakteri bakteri endofit dari tanaman Morinda citrifolia (Kumala & Siswanto, 2007), serta aktivitas antibakteri dan antibiotik dari bakteri endofit Andrographis paniculata (Arunachalam & Gayathri, 2010).
2.7. Teknik Pengujian Aktivitas Antimikroba
Daya antimikroba diukur secara in vitro agar dapat ditentukan kemampuan suatu zat antimikrobia. Adanya fenomena ketahanan tumbuhan secara alami terhadap mikroorganisme menyebabkan pengembangan sejumlah senyawa yang berasal dari tanaman yang mempunyai kandungan antibakteri dan antifungi (Griffin, 1981). Uji aktivitas antibakteri dapat dilakukan dengan metode difusi dan metode pengenceran. Disc diffusion test atau uji difusi cakram dilakukan dengan mengukur diameter zona bening (clear zone) yang merupakan petunjuk adanya respon penghambatan pertumbuhan bakteri oleh suatu senyawa antibakteri dalam ekstrak. Syarat jumlah bakteri untuk uji sensitivitas yaitu 105-108 cfu/ml (Hermawan et al., 2007).
BAB I PENDAHULUAN
1.1. Latar Belakang
Bioaerosol di lingkungan rumah sakit yang tidak dikendalikan dengan baik dapat menjadi sumber kontaminasi udara. Mikroorganisme udara di lingkungan rumah sakit dapat berasal dari pasien, lingkungan dalam (indoor) dan lingkungan luar ruangan (outdoor). Mikroorganisme tersebut berpotensi menyebabkan infeksi pada pasien maupun pengunjung yang rentan, sehingga menimbulkan diagnosis penyakit yang sebelumnya tidak diderita oleh pasien ketika pertama kali dirawat di rumah sakit. Kejadian ini biasa disebut sebagai infeksi nosokomial (Harper, 2013).
Infeksi nosokomial adalah suatu infeksi yang diperoleh atau dialami oleh pasien selama perawatan di rumah sakit dan menunjukkan gejala infeksi baru setelah 72 jam berada di rumah sakit (Olmsted, 2002). Pada beberapa rumah sakit di Indonesia dilaporkan angka kejadian infeksi nosokomial di RSU Dr. Pirngadi Medan (2006) mencapai 32,16%, di RSU Dr. Sardjito (2007) sebesar 5,9%, sedangkan di RSU Adam Malik (2010) sebesar 5,6% (Jeyamohan, 2010).
Bagian tumbuhan yang menjadi habitat bagi mikroorganisme, berada di atas tanah dan kontak langsung dengan udara disebut filosfer. Menurut Leveau (2001), filosfer adalah habitat alami bagi bakteri epifit sehingga bakterinya disebut filosfer. Bakteri merupakan kelompok yang paling utama mengkoloni daun, jumlahnya berkisar antara 106-107 koloni/cm2 daun (Hirano dan Upper, 2000).
Populasi bakteri filosfer sangat beragam dan berbeda-beda untuk setiap tanaman. Selain itu, interaksi yang terjadi pada filosfer menentukan tingkat keberadaan bakteri patogen manusia yang dapat berkoloni dan hidup di permukaan tanaman, seperti pada tanaman ornamental (Yadavi et al., 2010). Penelitian sebelumnya oleh Kamel et al. (2012) menunjukkan bahwa sekret yang dihasilkan daun tanaman oranamental Ficus elastica, Philodendron bipinnatifidum dan Aglaonema comutatum mampu menghambat pertumbuhan dan mengurangi jumlah patogen yang berkoloni di permukaan daun. Kemampuan dari setiap tanaman ini berbeda-beda tergantung sekret tanaman yang dihasilkan. Bakteri filosfer hidup pada daun disebabkan adanya senyawa organik seperti fruktosa, sukrosa, asam organik, asam amino, dan vitamin yang dijadikan sebagai sumber karbon, energi dan senyawa pemicu tumbuh. Oleh sebab itu, perbedaan eksudat yang disekresikan daun pada jenis tanaman tertentu menyebabkan bakteri yang menghuninya juga berbeda (Widyawati, 2013).
1.2. Permasalahan
Bioaerosol di lingkungan rumah sakit berpotensi menjadi media penularan infeksi nosokomial. Penelitian ini dapat memberikan alternatif lain untuk mengurangi mikroorganisme bioaerosol dengan cara biologi yang lebih hemat biaya dan menambah nilai estetika lingkungan dengan tanaman ornamental.
1.3. Tujuan
Tujuan penelitian ini ialah:
a. mengisolasi dan mengidentifikasi bakteri bioaerosol berpotensi patogen dari RSU Dr. Pirngadi, Medan
b. mengisolasi dan mengidentifikasi bakteri filosfer dari tanaman ornamental Ficus elastica, Philodendrom bipinnatifidum dan Aglaonema simplex
c. mengetahui potensi bakteri filosfer tanaman ornamental F. elastica, P. bipinnatifidum dan A. simplex dalam mengendalikan pertumbuhan mikroorganisme bioaerosol berpotensi patogen dari RSU Dr. Pirngadi, Medan
1.4. Hipotesis
Bakteri filosfer pada tanaman ornamental mampu menghambat pertumbuhan mikroorganisme bioaerosol berpotensi patogen dari lingkungan rumah sakit.
1.5. Manfaat
MIKROORGANISME BIOAEROSOL BERPOTENSI
PATOGEN DARI LINGKUNGAN RUMAH SAKIT UMUM
PIRNGADI MEDAN
ABSTRAK
Bioaerosol di lingkungan rumah sakit yang tidak dikendalikan dengan baik dapat menjadi sumber infeksi nosokomial. Perlu adanya alternatif untuk mengatasi penularan infeksi ini. Penelitian ini bertujuan untuk mengetahui potensi bakteri filosfer tanaman ornamental Ficus elastica, Philodendron bipinnatifidum dan Aglaonema simplex dalam mengendalikan pertumbuhan mikroorganisme bioaerosol berpotensi patogen. Bakteri bioaerosol diisolasi dari udara lingkungan RSU dr. Pirngadi, Medan menggunakan media MSA, MC, PCA dan SDA dengan cara mengarahkan media ke udara selama 15 menit. Hasil isolasi bioaerosol didapatkan isolat yang paling dominan ialah Staphylococcus aureus, Staphylococcus sp., Bacillus sp., Streptococcus sp., Pseudomonas sp., Salmonella sp., Shigella sp., dan jamur dari genus Aspergillus, Alternaria, Trichoderma,
Neurospora, Fusarium dan Penicillium. Hasil pengujian aktifitas daya hambat
bakteri filosfer menunjukkan isolat dari A. simplex memiliki daya hambat paling baik terhadap pertumbuhan jamur bioaerosol. Isolat yang paling potensial adalah AS2 dengan besar zona hambat terhadap Mucor sp. sebesar 4,2 cm. Daya hambat bakteri filosfer dari P. bipinnatifidium yang paling baik ditunjukkan oleh isolat PB2 terhadap Mucor sp sebesar 3,7 cm., sedangkan daya hambat bakteri filosfer yang paling baik dari F. elastica ditunjukkan oleh isolat FE2 terhadap Mucor sp. sebesar 2,4 cm. Hasil karakterisasi ketiga isolat bakteri filosfer menunjukkan Pseudomonas spp. Dari penelitian dapat disimpulkan bahwa bakteri filosfer dari tanaman ornamental cenderung menghambat pertumbuhan jamur bioaerosol. Kata kunci : Bakteri filosfer, Bioaerosol, Infeksi nosokomial, Tanaman
PATHOGENIC BIOAEROSOL MICROORGANISM GROWTH
FROM ENVIRONMENT OF PIRNGADI MEDAN HOSPITAL
ABSTRACT
Uncontroled bioaerosol in a hospital environment can be the source of nosocomial infection. An alternative way to overcome the transmission of this infection is needed. This study aimed to determine the potention of phyllosphere bacteria from ornamental plants Ficus elastica, Philodendron bipinnatifidum and Aglonema simplex in controlling the growth of potentially pathogenic bioaerosol microorganism. Bioaerosol bacteria isolated from ambient air of RSU dr. Pirngadi, Medan using MSA, MC, PCA and SDA plate exposed to the air for 15 minutes. The most dominant isolated bioaerosol bacteria were Staphylococcus aureus, Staphylococcus sp., Bacillus sp., Streptococcus sp., Pseudomonas sp., Salmonella sp., Shigella sp., and fungi of the genus Aspergillus, Alternaria, Trichoderma, Neurospora, Fusarium and Penicillium. Inhibitory activity test results indicated that phyllosphere bacteria of A. simplex had the highest inhibitory effect to the growth of bioaerosol fungal. The most potential isolate was AS2 with inhibition zone against Mucor sp. was 4.2 cm. Phyllospheric bacterial inhibition of P. bipinnatifidium isolate PB2 was 3.7 cm against Mucor sp.,while the highest inhibition of phyllospheric bacteria of F. elastica showed by isolate FE2 was 2.4 cm against Mucor sp. The identification result of three phyllosphere bacteria belong to Pseudomonas spp. This study concluded that phyllospheric bacteria from ornamental plant had better inhibition for against bioaerosol fungal rather than bioaerosol bacterial.
POTENSI BAKTERI FILOSFER TANAMAN ORNAMENTAL UNTUK MENGHAMBAT PERTUMBUHAN MIKROORGANISME BIOAEROSOL
BERPOTENSI PATOGEN DARI LINGKUNGAN RUMAH SAKIT UMUM PIRNGADI MEDAN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
OLEH
IMELDA MARGARETHA ARITONANG 110805060
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul :Potensi Bakteri Filosfer Tanaman Ornamental untuk Menghambat Pertumbuhan Mikroorganisme Bioaerosol Berpotensi Patogen dari Lingkungan Rumah Sakit Umum Pirngadi Medan
Kategori : Skripsi
Nama : Imelda Margaretha Aritonang
Nomor Induk Mahasiswa : 110805060
Program Studi : Sarjana (S1) Biologi
Departemen : Biologi
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universtas Sumatera Utara
Disetujui di Medan, April 2016
Komisi Pembimbing :
Pembimbing 2, Pembimbing 1,
Prof. Dr. Dwi Suryanto, M.Sc. NIP.196404091994031003
Dr. It Jamilah, M.Sc.
NIP. 1965310121991032003
Disetujui Oleh
Departemen Biologi FMIPA USU Ketua,
POTENSI BAKTERI FILOSFER TANAMAN ORNAMENTAL UNTUK MENGHAMBAT PERTUMBUHAN MIKROORGANISME BIOAEROSOL
BERPOTENSI PATOGEN DARI LINGKUNGAN RUMAH SAKIT UMUM PIRNGADI MEDAN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2016
anugerahNya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Potensi Bakteri Filosfer Tanaman Ornamental untuk Menghambat Pertumbuhan Mikroorganisme Bioaerosol Berpotensi Patogen dari Lingkungan Rumah Sakit Umum Pirngadi Medan”, Skripsi ini dibuat sebagai salah satu syarat untuk meraih gelar Sarjana Sains pada Fakultas MIPA USU Medan.
Pada kesempatan ini penulis mengucapkan terimakasih kepada orang tua terkasih dan terbaik Ayahanda Tongam Aritonang dan Ibunda Sirta Marbun yang selalu memberikan doa, semangat, perhatian, kasih sayang dan pengorbanan yang begitu besar kepada penulis. Kepada Kakak Suharto Hotroha Aritonang, Adik Robinson Pangihutan Aritonang yang selalu memberikan dukungan semangat dan perhatian kepada penulis.
Terimakasih penulis sampaikan kepada Ibu Dr. It Jamilah, M.Sc. selaku pembimbing I dan Bapak Prof. Dr. Dwi Suryanto M.Sc. selaku pembimbing II yang telah banyak meluangkan waktu, tenaga dan pikiran selama masa penelitian dan penulisan skiripsi ini. Ucapan terimakasih juga penulis ucapkan kepada Ibu. Ibu Dra. Nunuk Priyani M. Sc. dan Ibu Dr. Nursahara Pasaribu, M.Sc selaku dosen penguji yang telah memberikan banyak masukan dan arahan dalam penyempurnaan penulisan skripsi ini. Bapak Miswar Budi Mulya, M.Si. selaku dosen pembimbing akademik yang telah memberikan nasehat dan semangat selama masa perkuliahan. Ibu Dr. Nursahara Pasaribu M. Sc. selaku ketua Departemen Biologi FMIPA USU. Ibu Nurhasni Muluk, Bang Erwin dan Ibu Rosalina Ginting selaku staf pegawai Departemen Biologi FMIPA USU.
Dalam kesempatan ini penulis juga menyampaikan terimakasih kepada teman-teman seperjuangan di Laboratorium Mikrobiologi terimaksih atas canda dan tawa yang menghiasi hari-hari penulis selama penelitian dan pengerjaan skiripsi ini, khususnya Grace Sonia, sebagai partner selama penelitian. Teman-teman Biologi 2011, seluruh mahasiswa Biologi terimakasih atas kerja samanya selama di bangku perkuliahan., pengertian yang diberikan selama pengerjaan penelitian dan penulisan skripsi ini.
Akhirnya dengan penuh ketulusan dan kerendahan hati, penulis menyadari bahwa skiripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang berisfat membangun demi kesempurnaan skiripsi ini. Atas partisipasi dan dukungannya penulis ucapkan terimakasih.
Medan, April 2016
MIKROORGANISME BIOAEROSOL BERPOTENSI
PATOGEN DARI LINGKUNGAN RUMAH SAKIT UMUM
PIRNGADI MEDAN
ABSTRAK
Bioaerosol di lingkungan rumah sakit yang tidak dikendalikan dengan baik dapat menjadi sumber infeksi nosokomial. Perlu adanya alternatif untuk mengatasi penularan infeksi ini. Penelitian ini bertujuan untuk mengetahui potensi bakteri filosfer tanaman ornamental Ficus elastica, Philodendron bipinnatifidum dan Aglaonema simplex dalam mengendalikan pertumbuhan mikroorganisme bioaerosol berpotensi patogen. Bakteri bioaerosol diisolasi dari udara lingkungan RSU dr. Pirngadi, Medan menggunakan media MSA, MC, PCA dan SDA dengan cara mengarahkan media ke udara selama 15 menit. Hasil isolasi bioaerosol didapatkan isolat yang paling dominan ialah Staphylococcus aureus, Staphylococcus sp., Bacillus sp., Streptococcus sp., Pseudomonas sp., Salmonella sp., Shigella sp., dan jamur dari genus Aspergillus, Alternaria, Trichoderma,
Neurospora, Fusarium dan Penicillium. Hasil pengujian aktifitas daya hambat
bakteri filosfer menunjukkan isolat dari A. simplex memiliki daya hambat paling baik terhadap pertumbuhan jamur bioaerosol. Isolat yang paling potensial adalah AS2 dengan besar zona hambat terhadap Mucor sp. sebesar 4,2 cm. Daya hambat bakteri filosfer dari P. bipinnatifidium yang paling baik ditunjukkan oleh isolat PB2 terhadap Mucor sp sebesar 3,7 cm., sedangkan daya hambat bakteri filosfer yang paling baik dari F. elastica ditunjukkan oleh isolat FE2 terhadap Mucor sp. sebesar 2,4 cm. Hasil karakterisasi ketiga isolat bakteri filosfer menunjukkan Pseudomonas spp. Dari penelitian dapat disimpulkan bahwa bakteri filosfer dari tanaman ornamental cenderung menghambat pertumbuhan jamur bioaerosol. Kata kunci : Bakteri filosfer, Bioaerosol, Infeksi nosokomial, Tanaman