PRODUKSI HORMON ASAM INDOL-3-ASETAT OLEH
BAKTERI DIAZOTROF ENDOFITIK DAN APLIKASINYA
PADA TANAMAN KENTANG
PINGKAN PATRICIA ISHWARI
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi Produksi Hormon Asam
Indol-3-Asetat oleh Bakteri Diazotrof Endofitik dan Aplikasinya pada Tanaman
Kentang adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun
kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip
dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
dituliskan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir
skripsi ini.
Bogor, Januari 2006
ABSTRAK
PINGKAN PATRICIA ISHWARI. Produksi Hormon Asam Indol-3-Asetat
oleh Bakteri Diazotrof Endofitik dan Aplikasinya pada Tanaman Kentang.
Dibimbing oleh NORMAN RAZIEF AZWAR dan RATIH DEWI HASTUTI.
Bakteri diazotrof endofitik adalah bakteri yang hidup di jaringan tanaman
dan menambat nitrogen. Inokulasi bakteri diazotrof endofitik dapat mempengaruhi
pertumbuhan tanaman melalui hormon tumbuh yang dihasilkannya, seperti asam
indol-3-asetat (AIA). Seleksi bakteri adalah dengan mengukur produksi AIA oleh
14 isolat bakteri diazotrof endofitik. Hasil seleksi didapat lima isolat dengan AIA
tertinggi (BBd1, BCr1.2, BPr2.3, KACP13, dan RIFCB2) dan satu isolat unggul
(APK2.4) yang kemudian diinokulasikan pada tanaman kentang (
Solanum
tuberosum
L. cv. Granola). Inokulasi dibedakan menjadi empat perlakuan: kultur
murni, supernatan, pelet, dan supernatan diotoklaf. Pembanding adalah AIA
sintetis dan blanko.
ABSTRACT
PINGKAN PATRICIA ISHWARI. Production of Indole-3-Acetic Acid
Hormone by Diazotroph Endophytic Bacteria and Its Application on Potato.
Under the direction of NORMAN RAZIEF AZWAR and RATIH DEWI
HASTUTI.
Diazotroph endophytic bacteria lives in plant tissues and fixes nitrogen.
Inoculation of diazotroph endophytic bacteria will increase plant growth by
producing plant growth substances, such as indole-3-acetic acid (IAA). Selection
of 14 isolate of diazotroph endophytic bacteria by measuring production of IAA.
Five isolates which produce the highest IAA (BBd1, BCr1.2, BPr2.3, KACP13,
and RIFCB2) and one prime isolate (APK2.4) were chosen to be inoculated on
potato (
Solanum tuberosum
L. cv. Granola). The inoculation was classified in four
treatment: pure culture, supernatant, autoclaved supernatant, and pellet. Synthetic
IAA and blank were used as reference.
PRODUKSI HORMON ASAM INDOL-3-ASETAT OLEH
BAKTERI DIAZOTROF ENDOFITIK DAN APLIKASINYA
PADA TANAMAN KENTANG
PINGKAN PATRICIA ISHWARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Produksi Hormon Asam Indol-3-Asetat oleh Bakteri Diazotrof
Endofitik dan Aplikasinya pada Tanaman Kentang
Nama
: Pingkan Patricia Ishwari
NIM
:
G44101044
Disetujui
Komisi Pembimbing
Prof. Dr. H. Norman R. Azwar
Ir. Ratih Dewi Hastuti, M.Sc.
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr.Ir. Yonny Koesmaryono, M.S.
NIP 131473999
Buat Mami dan Papi
Early bee
PRAKATA
Puji dan syukur kepada Tuhan Yesus Kristus atas berkat dan karunia-Nya
sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian ini adalah hormon tumbuh tanaman dengan judul Produksi Hormon
Asam Indol-3-asetat oleh Bakteri Diazotrof Endofitik dan Aplikasinya pada
Tanaman Kentang. Penelitian ini dilaksanakan dari bulan April 2005 di
Laboratorium Mikrobiologi, Kelompok Peneliti Biologi Tanah, Balai Penelitian
Tanah, Cimanggu Bogor.
Penulis mengucapkan terima kasih kepada Bapak Prof.Dr.H. Norman R.
Azwar dan Ibu Ir. Ratih Dewi Hastuti, M.Sc. selaku pembimbing; Dr. Rasti
Saraswati beserta staf Kelompok Peneliti Biologi Tanah; serta staf Laboratorium
Biologi Molekuler Tanaman Pusat Antar Universitas IPB. Ungkapan terima kasih
juga disampaikan kepada Papi, Mami, Bang Hary, serta teman-teman atas
dukungan, doa, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2006
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 6 Januari 1982 dari ayah Aloysius
Yoanes Kus Haryono dan ibu Doris Katrien Sondakh. Penulis merupakan anak
kedua dari tiga bersaudara.
Penulis lulus dari Sekolah Menengah Analis Kimia Bogor pada tahun 2001
dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan
Seleksi Masuk IPB. Penulis memilih Program Studi Biokimia, Departemen Kimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... x
DAFTAR TABEL... xi
DAFTAR LAMPIRAN... xi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Bakteri Diazotrof Endofitik ... 1
Asam
Indol-3-Asetat...
2
Produksi Asam Indol-3-Asetat oleh Bakteri Diazotrof Endofitik... 2
Pertumbuhan kentang (
Solanum tuberosum
L.) secara Kultur Jaringan 3
BAHAN DAN METODE
Bahan dan Alat... 4
Metode ...
4
HASIL DAN PEMBAHASAN
Seleksi
Bakteri ...
6
Penentuan
Waktu
Optimum Produksi AIA... 6
Aplikasi Bakteri pada Tanaman Kentang ... 8
SIMPULAN ... 11
SARAN ... 12
DAFTAR PUSTAKA ... 12
DAFTAR GAMBAR
Halaman
1 Struktur
asam
indol-3-asetat ...
2
2 Biosintesis asam indol-3-asetat/AIA (Zakharova
et al.
1999) ... 3
3 Tanaman kentang yang ditumbuhkan secara kultur jaringan... 4
4 Produksi AIA oleh isolat bakteri diazotrof endofitik... 6
5 Pengukuran kandungan AIA biakan pada bakteri diazotrof endofitik yang
ditunjukkan oleh warna merah muda ... 6
6 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat BCr1.2 ... 7
7 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat APK2.4 ... 7
8 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat KACP13 .... 7
9 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat RIFCB2... 7
10 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat BBd1... 7
11 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat BPr2.3... 7
12 Pembentukan pelikel oleh bakteri diazotrof endofitik dalam medium
JNFb semi padat... 8
13 Pengaruh inokulasi terhadap pemanjangan batang eksplan kentang ... 9
14 Pemanjangan akar oleh perlakuan penambahan supernatan BCr1.2 (atas) dan
supernatan
BBd1
(bawah) ...
9
DAFTAR TABEL
Halaman
1 Bakteri yang memproduksi auksin... 3
2 Isolat yang digunakan dalam penelitian... 4
3 Pengaruh aplikasi isolat APK2.4, BBd1, dan BCr1.2 terhadap pertumbuhan
tanaman
kentang...
9
4 Peningkatan pertumbuhan tanaman setelah diinokulasi ... 11
DAFTAR LAMPIRAN
Halaman
1 Diagram alir pengukuran AIA ... 15
2 Diagram alir penelitian... 16
3 Komposisi
medium ... 17
4 Data pengukuran konsentrasi AIA bakteri diazotrof endofitik ... 19
5 Data pengukuran konsentrasi AIA dan populasi bakteri... 20
1
PENDAHULUAN
Indonesia terkenal sebagai negara agraris dengan sebagian besar penduduknya bermata pencaharian pokok sebagai petani. Berbagai usaha dilakukan untuk meningkatkan produksi pertanian, salah satu di antaranya adalah pemanfaatan lahan pertanian secara optimal dengan mempergunakan pupuk sebagai penambah kesuburan tanaman. Penggunaan pupuk sintetis bertujuan meningkatkan kandungan hara tanah yang umumnya berupa hara makro seperti N, P, K, C, dan lain-lain. Akan tetapi pemberian pupuk sintetis yang berlebih dapat menimbulkan efek samping seperti kerusakan tanah akibat terjadi ketidakseimbangan hara dalam tanah dan menurunkan kualitas tanaman.
Salah satu cara mencegah terjadinya kerusakan tanah akibat penggunaan pupuk sintetis adalah dengan memanfaatkan pupuk hayati. Pupuk hayati merupakan organisme yang ditambahkan ke dalam tanah yang mampu meningkatkan pertumbuhan tanaman. Organisme yang ditambahkan umumnya berupa mikroba (mikroorganisme) seperti bakteri penyubur tanah, cendawan,
actinomycetes, dan lainnya. Prinsip penggunaan pupuk hayati berdasarkan kemampuan mikroorganisme tersebut menghasilkan senyawa yang dapat meningkatkan pertumbuhan tanaman, atau senyawa yang dapat membunuh bakteri patogen tanah (Tien et al. 1979, Kloepper et al. 1980, Kloepper 1983).
Bakteri endofitik adalah bakteri yang diketahui hidup dan berkembang biak di dalam jaringan tanaman namun tidak bersifat parasit terhadap tanaman. Jenis bakteri endofitik yang telah dilaporkan mampu meningkatkan pertumbuhan tanaman sering disebut Plant Growth Promoting Rhizobacteria (PGPR) yang terdiri atas genus
Rhizobium, Azotobacter, Azospirillum, Bacillus, Arthrobacter, Bacterium, Mycobacterium, dan Pseudomonas (Tien et al.
1979; Kloepper et al. 1980; Kloepper 1983; Schroth & Weinhold 1986; Biswas et al.
2000). Mekanisme PGPR meningkatkan pertumbuhan dilakukan dengan dua cara yaitu dengan menginduksi pertumbuhan atau sebagai kontrol biologis.
Peningkatan pertumbuhan tanaman dapat terjadi ketika suatu rhizobakterium memproduksi metabolit yang secara langsung meningkatkan pertumbuhan tanaman (Tien et al. 1979; Schroth & Weinhold 1986; Zakharova et al. 1999; Maor et al. 2004).
Metabolit yang dihasilkan dapat berupa fitohormon, antibiotik, siderofor, sianida, dan lain sebagainya. Fitohormon atau hormon tumbuh yang diproduksi dapat berupa auksin, giberelin, sitokinin, etilen, dan asam absisat.
Penelitian ini bertujuan untuk mengukur asam indol asetat (AIA) yang dihasilkan oleh beberapa bakteri diazotrof endofitik dan mengamati pengaruhnya terhadap pertumbuhan tanaman kentang yang ditumbuhkan pada media agar.
Hipotesis penelitian ini adalah bakteri diazotrof endofitik mampu menghasilkan hormon asam indol asetat (AIA) yang dapat meningkatkan pertumbuhan tanaman kentang.
Manfaat penelitian ini adalah menemukan fungsi lain dari beberapa isolat bakteri diazotrof endofitik penambat nitrogen dan mencari alternatif penggunaan zat pengatur tumbuh yang murah dan efisien.
Penelitian ini dilakukan di Laboratorium Mikrobiologi Kelompok Peneliti Biologi Tanah, Balai Penelitian Tanah, dimulai dari bulan April sampai November 2005.
TINJAUAN PUSTAKA
Bakteri Diazotrof Endofitik
Bakteri diazotrof adalah kelompok bakteri yang memperoleh energi dengan menambat nitrogen, sedangkan bakteri endofitik adalah bakteri yang hidupnya berkoloni di dalam jaringan tanaman (Ladha & Reddy 2000). Bakteri diazotrof endofitik dapat diartikan sebagai bakteri yang berkoloni di dalam jaringan tanaman dan menambat nitrogen.
Bakteri diazotrof endofitik umum dijumpai pada akar dan batang, namun ada juga yang ditemukan hidup di daun (Ladha & Reddy 2000). Kelompok bakteri yang hidup di daerah perakaran dan mengkolonisasi akar disebut sebagai rhizobakteri (Schroth & Hancock 1982, diacu dalam Kloepper 1992). Golongan bakteri yang mengkolonisasi akar dan menimbulkan peningkatan pertumbuhan tanaman disebut dengan Plant Growth-Promoting Rhizobacteria/PGPR (Kloepper et al. 1980).
2
diazotrof endofitik di jaringan tanaman juga memberikan keuntungan bagi pertumbuhan tanaman dengan memproduksi hormon tumbuh. Kondisi ini dapat terjadi jika bakteri tersebut mampu mengkolonisasi akar ataupun hanya sebagai mikroorganisme saprofit pada permukaan akar (Schroth & Weinhold 1986). Keadaan ini ditunjukkan dari beberapa penelitian seperti kemampuan Acetobacter diazotrophicus dan Herbaspirillum spp. yang hidup di batang dan daun tebu untuk menambat nitrogen dari udara (Ladha & Reddy 2000). Azospirillum brasilense mampu memproduksi auksin, giberelin, dan memperbanyak jumlah akar rambut di permukaan akar pearl millet/Pennisetum americanum L. (Tien et al. 1979).
Asam Indol-3-Asetat
Zat pengatur tumbuh (ZPT) merupakan senyawaan organik yang mempengaruhi proses fisiologis pada tumbuhan dengan konsentrasi yang sangat rendah. Jika ZPT diproduksi secara endogen oleh tumbuhan sering disebut fitohormon (hormon tumbuhan), sedangkan ZPT mencakup senyawa-senyawa yang terbentuk baik secara sintetis maupun alami. Nickell (1982) dalam Arshad & Frankenberger (1992) mendefinisikan ZPT sebagai senyawa alami maupun sintetis yang digunakan langsung pada tumbuhan untuk mengubah proses metabolisme ataupun strukturnya untuk memperbaiki kualitas, meningkatkan hasil, atau mempercepat panen. Fitohormon endogen mencakup auksin, giberelin, sitokinin, etilen, dan asam absisat (Thimann 1974; Arshad & Frankenberger 1992).
Kata auksin berasal dari bahasa Yunani
auxein yang berarti tumbuh. Auksin merupakan istilah yang mewakili segolongan senyawa yang dicirikan melalui kemampuannya menginduksi pemanjangan batang pada wilayah sub apikal (Weerasooriya 2005). Auksin tidak hanya mempengaruhi proses pemanjangan batang saja, begitu juga dengan pertumbuhan bagian tanaman lainnya, namun pemanjangan batang adalah yang terutama. Auksin biasanya berupa senyawa asam dengan turunannya. Auksin alami yang sering ditemui adalah asam indol-3-asetat/AIA (Gambar 1).
AIA pertama kali ditemukan di dalam urin manusia. Sejak itu banyak peneliti melaporkan penemuan AIA di berbagai tanaman (Thimann 1974; Kawaguchi & Syōno 1996). AIA eksogen juga dapat
disintesis oleh sejumlah spesies non tumbuhan meliputi bakteri, fungi, dan alga (Tien et al.
1979; Hutcheson & Kosuge 1985; Frankenberger & Poth 1987; Lestari 2003; Maor et al. 2004). Walaupun terdapat beberapa auksin alami yang sesuai untuk menjadi ZPT, AIA merupakan auksin alami yang paling memenuhi segala kriteria (Arshad & Frankenberger 1992; Arteca 1996). AIA disintesis dari triptofan di polen dan jaringan-jaringan tumbuhan yang aktif bertumbuh seperti meristem batang, primordia daun, daun muda yang masih berkembang, benih yang sedang berkembang, bunga, dan daun (Arteca 1996; Anonim 2005).
Jika hormon tumbuhan lainnya ditranspor melalui xilem dan floem, AIA ditranspor secara aktif dan lebih cepat dari difusi melalui jaringan parenkim seperti korteks, gabus, atau sel-sel parenkim yang berasosiasi dengan jaringan vaskular. AIA bergerak menuruni tumbuhan, karena itu AIA bergerak menuju bagian pangkal batang dan menuju bagian ujung akar (Anonim 2005).
N H
COOH
Gambar 1 Struktur asam indol-3-asetat/AIA (Weerasooriya 2005)
Produksi Asam Indol-3-Asetat oleh Bakteri Diazotrof Endofitik
Azospirillum brasilense yang ditumbuhkan dalam media yang mengandung suksinat dan fruktosa diketahui memproduksi asam indol-3-asetat/AIA (Tien et al. 1979). Selain AIA,
A. brasilense juga memproduksi asam indol-3-laktat. Bukan hanya senyawa auksin saja yang diproduksi oleh A. brasilense tetapi juga asam giberelat dan sitokinin. Zakharova et al.
3
Gambar 2 Biosintesis asam indol-3-asetat/ AIA (Zakharova et al. 1999)
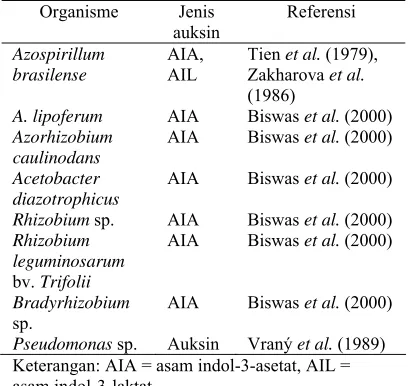
Beberapa rhizobakteri dilaporkan mampu memproduksi AIA (Schroth & Weinhold 1986) antara lain Pseudomonas sp. (Vraný et al. 1989) dan rhizobium (Biswas et al. 2000). Spesies rhizobium yang dilaporkan bermacam-macam (Tabel 1). Bakteri tersebut diisolasi dari akar, bintil akar, batang, dan daerah pengakaran pada tumbuhan yang selanjutnya dikulturkan.
Tien et al .(1979) melaporkan bahwa pemberian AIA sebesar 0,01 µg/ml dapat meningkatkan bobot tunas daun. Sistem akar tumbuhan lebih sensitif terhadap auksin daripada batangnya, sedangkan kombinasi AIA, asam giberelat, dan kinetin mampu meningkatkan pertumbuhan jika konsentrasi AIA dan kinetin sangat rendah (berturut-turut 0,005 dan 0,001 µg/ml). Konsentrasi AIA dan kinetin yang lebih tinggi dapat menurunkan kualitas pertumbuhan. Akar rambut dan akar lateral tampak lebih padat ketika AIA, asam giberelat, dan kinetin ditambahkan. Efek ini sama dengan efek yang terjadi pada pertumbuhan pearl millet yang diinokulasikan
Azospirillum brasilense.
Menurut Schroth dan Weinhold (1986) penggunaan rhizobakteri yang efektif bagi perkembangan tumbuhan bergantung pada kesesuaian mikroorganisme terhadap lingkungan yang mendukung aktivitas mikroorganisme tersebut. Vraný et al. (1989) melaporkan bahwa isolat bakteri fluoresens mampu menurunkan jumlah patogen di sekitar akar tanaman kentang dan juga mampu memproduksi senyawa sejenis auksin sehingga produksi kentang dapat meningkat. Konsentrasi dan komposisi auksin yang dihasilkan berbeda-beda tergantung pada jenis isolat yang digunakan. Biswas et al. (2000) melaporkan bahwa produksi AIA dan penambatan nitrogen hayati dari udara oleh
bakteri diazotrofik merupakan faktor yang mendukung pertumbuhan padi.
Indol-3-asetaldoksima
Indol-3-asetonitril
AIA mendukung pertumbuhan tanaman atau pemanjangan batang dengan meningkatkan proses pembesaran ukuran sel serta pembelahannya. AIA mengendurkan dinding sel tumbuhan dan diikuti dengan pemasukkan molekul air ke dalam sel sehingga terjadi pertumbuhan. Untuk dapat memperbesar ukuran sel, maka ukuran dinding selnya harus diperluas. AIA memicu perluasan dinding sel namun peranannya dalam proses ini masih belum jelas. Tampaknya AIA mengubah gen yang mengkode pembentukan bahan-bahan untuk sintesis dinding sel yang baru (Anonim 2005).
Indol-3-asetamida Asam indol-3-asetat Asam indol-3-piruvat triptofan Indol-3-asetaldehida
Tabel 1 Bakteri yang memproduksi auksin
Organisme Jenis auksin Referensi Azospirillum brasilense AIA, AIL
Tien et al. (1979), Zakharova et al.
(1986)
A. lipoferum AIA Biswas et al. (2000)
Azorhizobium caulinodans
AIA Biswas et al. (2000)
Acetobacter diazotrophicus
AIA Biswas et al. (2000)
Rhizobium sp. AIA Biswas et al. (2000)
Rhizobium leguminosarum
bv. Trifolii
AIA Biswas et al. (2000)
Bradyrhizobium
sp.
AIA Biswas et al. (2000)
Pseudomonas sp. Auksin Vraný et al. (1989) Keterangan: AIA = asam indol-3-asetat, AIL = asam indol-3-laktat.
Pertumbuhan Kentang (Solanum tuberosum L.) secara Kultur Jaringan
Di dataran tinggi tempat jagung dan gandum sulit tumbuh, Solanum tuberosum
4
famili Solanaceae (tumbuhan berbunga terompet); genus Solanum L.; dan spesies
Solanum tuberosum L. (Miller & Lipschutz 1984).
Kultur jaringan merupakan suatu metode untuk mengisolasi bagian tanaman seperti protoplasma, sel, bagian sel, jaringan, dan organ, serta menumbuhkannya dalam kondisi aseptik, sehingga bagian-bagian tanaman tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman utuh kembali. Pada mulanya orientasi kultur jaringan hanya pada pembuktian teori totipotensi sel, kemudian berkembang menjadi sarana penelitian di bidang fisiologi tanaman dan aspek-aspek biokimia tanaman (Gunawan 1992).
Eksplan batang yang lebih tebal dan lebih pendek akan mempermudah proses subkultur daripada batang yang lebih panjang dan lebih kurus (Hussey & Stacey 1981).
Burr et al. (1978) melaporkan bahwa inokulasi Pseudomonas spp. pada benih kentang dapat meningkatkan pertumbuhan. Strain tersebut dapat bertahan selama 1 bulan dan merupakan bakteri yang dominan pada daerah perakaran hingga 2 bulan setelah penanaman. Proses bakterisasi (inokulasi bakteri pada tanaman) meningkatkan bobot batang sebanyak 100% dan juga sistem akar pada periode 4 minggu. Mekanisme bakteri ini meningkatkan pertumbuhan dapat diasosiasikan dengan perubahan komposisi flora bakteri daerah perakaran. Kloepper et al.
(1980) bahkan memperoleh peningkatan hasil hingga 500% pada tanaman kentang yang dikolonisasi dengan dua strain Pseudomonas
spp. Kedua strain bakteri ini diisolasi dari peridermis kentang dan akar tumbuhan seledri. Kloepper (1983) memperoleh bahwa aplikasi PGPR sebelum penanaman menurunkan zona populasi patogen Erwinia carotovora.
Gambar 3 Tanaman kentang yang
ditumbuhkan secara kultur jaringan
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah empat belas isolat bakteri diazotrof endofitik (Tabel 2), tanaman kentang (Solanum tuberosum L. cv. Granola), medium sari khamir manitol, medium JNFb (Jensen’s Nitrogen Free broth), medium kaldu nutrien, medium minimum salt, dan medium Murashige-Skoog agar (Lampiran 3).
Alat-alat yang digunakan adalah cawan petri, tabung reaksi, otoklaf, oven, neraca analitik, Erlenmeyer, pipet serologi, pengaduk magnetik, rak laminar, sentrifus, mesin pengocok, oven gelombang mikro, kertas alumunium, pipet mikro, pH meter, sudip, inkubator, botol selai, spektrofotometer, mikropipet, rak kultur, pinset, skapel, rak tabung, dan labu semprot.
Tabel 2 Isolat yang digunakan dalam penelitian Kode Isolat Asal Jaringan Asal Daerah APK2.4 Akar padi Parung Kuda,
Sukabumi, Jawa Barat BBd1 Batang padi Bendo, Magetan, Jawa
Timur
BCbd1.3 Batang padi Cibadak, Sukabumi, Jawa Barat
BCr1.2 Batang padi Caringin, Sukabumi, Jawa Barat
BCr2.1 Batang padi Caringin, Sukabumi, Jawa Barat
BCr2.3 Batang padi Caringin, Sukabumi, Jawa Barat
BPr2.3 Batang padi Parung, Bogor, Jawa Barat
KACP13 Akar kedelai Ciapus, Jawa Barat RIFCB1 Akar kedelai Mojosari, Jawa Timur RIFCB2 Akar kedelai Ngawi, Jawa Timur RIFCB3 Akar kedelai Banjaragung, Gunung
Balak, Lampung RIFCB4 Akar kedelai Ganjaran, Pringsewu,
Lampung RIFCB5 Akar kedelai Karang Agung,
Lampung
RIFCB6 Akar kedelai Nusa Tenggara Timur Sumber: Lestari 2003.
Metode
5
ditumbuhkan pada medium JNFb agar. Setelah inkubasi (waktu inkubasi tergantung dari sifat masing-masing bakteri), isolat disimpan dalam lemari pendingin bersuhu 4oC.
Seleksi Bakteri
Seleksi bakteri dilakukan dengan mengukur kandungan AIA yang dihasilkan oleh 14 isolat bakteri setelah diinkubasi 24 jam. Lima isolat bakteri yang menunjukkan kandungan AIA tertinggi dan satu isolat unggul APK2.4 dipilih untuk digunakan dalam pengujian selanjutnya.
Penentuan Waktu Optimum Produksi AIA
Kemampuan memproduksi AIA diukur dengan menumbuhkan bakteri pada medium kaldu nutrien dan mengukur konsentrasi AIA yang dihasilkan serta jumlah populasi bakteri setiap hari selama 7 hari berturut-turut.
Konsentrasi AIA diukur dengan menggunakan metode Gordon-Weber (1951) yang telah dimodifikasi (Lampiran 1). Bakteri ditumbuhkan dalam medium Nutrien Broth -M26 (NB--M26) selama 24 jam di atas pengocok (150 rpm pada suhu ruang). Setelah diinkubasi, 100 µl kultur diinkubasikan ke dalam 10 ml medium minimum salt yang sudah ditambahkan 5 mM L-triptofan dan ditumbuhkan sekali lagi selama 48 jam di atas mesin pengocok.
Kultur cair bakteri dalam medium garam minimum sebanyak 1,5 ml disentrifus dengan kecepatan 12000 rpm selama 5 menit. Satu mililiter supernatan ditambahkan 2 ml pereaksi FeCl3-HClO4 yang dibuat dengan mencampurkan 1 ml FeCl3 0,5 M dengan 50 ml HClO4 35%. Setelah 25 menit, larutan diukur absorbansinya dengan spektrofotometer pada panjang gelombang 530 nm. Konsentrasi AIA didapat dengan perbandingan absorbansi terhadap standar AIA (Husen 2000).
Pada bakteri rhizobium pengukuran jumlah populasi menggunakan metode angka lempeng total (ALT), sedangkan untuk isolat bakteri lainnya menggunakan metode angka paling mungkin (APM). Metode ALT diawali dengan mengencerkan 1 ml kultur cair menjadi 101-109 kali pengenceran, tergantung kekeruhan kultur cair. Kemudian masing-masing pengenceran disebar sebanyak 0,1 ml pada cawan petri yang berisi medium SKM yang ditambahkan 10 ml indikator merah kongo (0,259 g/100 ml) per liter medium. Diinkubasi pada suhu ruang selama 3-5 hari
lalu dihitung jumlah koloni yang tumbuh. Satu koloni yang tumbuh mewakili satu bakteri yang terhitung.
Metode APM juga diawali dengan mengencerkan 1 ml kultur cair menjadi 101- 109 kali pengenceran, tergantung kekeruhan kultur cair. Kemudian tiap pengenceran tersebut diinokulasikan sebanyak 0,1 ml ke dalam 5 tabung (sebagai ulangan) yang berisi 5 ml medium JNFb semi padat. Diinkubasi selama 5-7 hari pada suhu ruang. Adanya pertumbuhan bakteri endofit ditunjukkan oleh terbentuknya cincin (pelikel) pada medium (positif) atau tidak terbentuknya pelikel (negatif). Tabung yang menunjukkan pertumbuhan dihitung berdasarkan tabel APM (Lorch et al. 1995).
Aplikasi Bakteri pada Tanaman Kentang
Untuk pengujian pada tanaman kentang dipilih isolat bakteri yang mempunyai konsentrasi AIA tertinggi. Setengah bagian kultur cair dari isolat terpilih disentrifus pada kecepatan 12000 rpm selama 5 menit untuk digunakan sebagai inokulan. Setengah bagian supernatan diotoklaf dan digunakan sebagai inokulan. Medium pertumbuhan kentang menggunakan medium Murashige-Skoog (MS) agar.
Medium MS agar dituang ke dalam botol-botol selai lalu ditutup dengan kertas alumunium selanjutnya disterilisasi dengan otoklaf. Pada medium agar steril yang sudah dibiarkan selama 2 hari ditanam enam eksplan kentang berupa batang berukuran 1 cm lalu ditambahkan supernatan, pelet, kultur cair, supernatan yang sudah diotoklaf, atau AIA murni pada konsentrasi 0,25 mg/l (Ghaffoor et al. 2003). Kultur ditumbuhkan selama 30 hari pada suhu 20-25oC dengan penerangan 24 jam (Hussey & Stacey 1981). Pada akhir masa penanaman dilakukan pengukuran jumlah dan panjang akar lateral, serta tinggi batang.
Perancangan Percobaan
6
menurut Torrie dan Steel (1960) adalah sebagai berikut:
Yij = µ + τi + εij
Keterangan: i = 1, 2, 3, 4
Yij = pengamatan pada perlakuan ke-i dan ulangan ke-j
µ = rataan umum
τi = pengaruh perlakuan ke-i = µi - µ
εij = pengaruh acak pada perlakuan ke-i ulangan ke-j
HASIL DAN PEMBAHASAN
Seleksi Bakteri
Pengujian aktivitas produksi AIA pada keempat belas isolat bakteri diazotrof endofitik menunjukkan bahwa seluruh isolat mampu memproduksi AIA. Hal ini sesuai dengan penelitian Tien et al. 1979; Schroth dan Weinhold 1986; Vranỳ et al. 1989; dan Biswas et al. 2000 yang menyatakan bahwa bakteri diazotrof endofitik dapat memproduksi AIA. Vranỳet al. (1989) melaporkan bahwa produksi AIA oleh bakteri berbeda-beda sesuai dengan spesiesnya dan hasil pengukuran dengan spektrofotometer memperlihatkan konsentrasi AIA yang diproduksi oleh masing-masing isolat (Gambar 4). Menurut prosedur Husen (2003), kandungan AIA yang diproduksi oleh bakteri ditunjukkan oleh pembentukan larutan berwarna merah muda (Gambar 5).
0 10 20 30 40 50
Jenis isolat [AIA],
mg/l
Gambar 4 Produksi AIA oleh isolat bakteri diazotrof endofitik
Gambar 5 Pengukuran kandungan AIA pada biakan bakteri diazotrof endofitik yang ditunjukkan oleh warna merah muda
Dari keempat belas isolat selanjutnya dipilih lima isolat yang mampu memproduksi AIA dengan konsentrasi tertinggi (RIFCB2, BPr2.3, BBd1, KACP13, dan BCr1.2) dan satu isolat unggul APK2.4 yang mampu meningkatkan fiksasi nitrogen pada tanaman padi dan jagung serta bersifat anti patogen. Keenam isolat ini kemudian diukur produksi AIA dan jumlah populasi bakteri setiap hari selama 7 hari berturut-turut.
Penentuan Waktu Optimum Produksi AIA
7
0 4 8 12 16 200 1 2 3 4 5 6 7
hari ke-populasi bakteri (log n), koloni/ml 0 4 8 12 16 20 [AIA], ppm
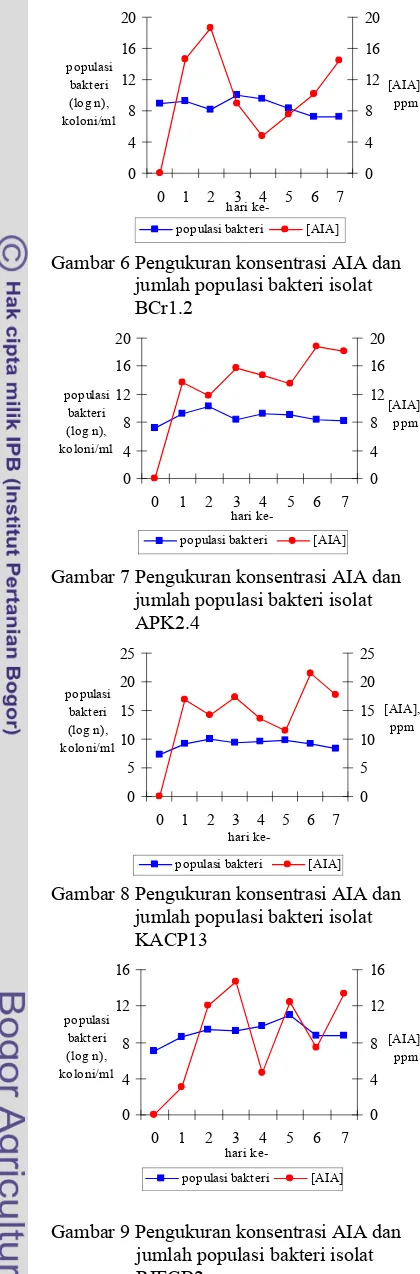
populasi bakteri [AIA]
Gambar 6 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat BCr1.2 0 4 8 12 16 20
0 1 2 3 4 5 6 7
hari ke-populasi bakteri (log n), koloni/ml 0 4 8 12 16 20 [AIA], ppm
populasi bakteri [AIA]
Gambar 7 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat APK2.4 0 5 10 15 20 25
0 1 2 3 4 5 6 7
hari ke-[AIA], ppm 0 5 10 15 20 25 populasi bakteri (log n), koloni/ml
populasi bakteri [AIA]
Gambar 8 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat KACP13 0 4 8 12 16
0 1 2 3 4 5 6 7
hari ke-[AIA], ppm 0 4 8 12 16 populasi bakteri (log n), koloni/ml
populasi bakteri [AIA]
Gambar 9 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat RIFCB2 0 5 10 15 20 25 30
0 1 2 3 4 5 6 7 hari ke-populasi bakteri (log n), koloni/ml 0 5 10 15 20 25 30 [AIA], ppm
populasi bakteri [AIA]
Gambar 10 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat BBd1 0 5 10 15 20 25 30
0 1 2 3 4 5 6 7
hari ke-populasi bakteri (log n), koloni/ml 0 5 10 15 20 25 30 [AIA], ppm
populasi bakteri [AIA]
Gambar 11 Pengukuran konsentrasi AIA dan jumlah populasi bakteri isolat BPr2.3
Grafik juga memperlihatkan produksi AIA yang tidak selalu stabil. Peningkatan dan penurunan konsentrasi AIA berbeda-beda pada masing-masing isolat. Pada isolat APK2.4 dan KACP13 konsentrasi AIA tertinggi sebenarnya terjadi pada hari keenam. Namun usia ini tidak dipergunakan dalam memproduksi AIA di tahap aplikasi karena telah terjadi penurunan konsentrasi AIA pada hari sebelumnya yaitu pada hari keempat dan kelima. Penurunan ini mengindikasikan kondisi kultur yang sudah tidak stabil. Karena itu pada isolat APK2.4 dan KACP13 produksi AIA dilakukan pada usia kultur tiga hari.
8
Jika diamati hubungan antara jumlah populasi bakteri dengan produksi AIA dapat dilihat pada isolat APK2.4, BCr1.2, BPr2.3, dan KACP13 produksi AIA maksimum dicapai saat jumlah populasi bakteri menurun. Pada saat tersebut jumlah sel yang mati lebih besar daripada jumlah sel yang hidup. Kondisi yang tidak stabil ini mendorong sel bakteri memproduksi AIA lebih banyak, karena AIA merupakan metabolit sekunder yang produksinya dapat meningkat pada kondisi yang kurang menguntungkan.
Isolat-isolat APK2.4, KACP13, BBd1, BCr1.2, dan BPr2.3 yang dihitung menggunakan metode Angka Paling Mungkin (APM) memperlihatkan perubahan warna JNFb semi padat dari kuning menjadi biru. Perubahan warna menunjukkan peningkatan pH medium menjadi lebih basa, akibat oksidasi malat. Beberapa milimeter di bawah permukaan medium juga terdapat pelikel yang berbentuk seperti kabut tipis (Gambar 12). Pembentukan pelikel ini menunjukkan pertumbuhan bakteri penambat nitrogen (Saraswati et al. 2002).
Pada isolat APK2.4, KACP13, BBd1, dan BPr2.3 terjadi penurunan konsentrasi AIA pada hari kedua pengkulturan. Penurunan ini disebabkan oleh produksi yang terlalu tinggi pada hari pertama. Pada saat isolat mulai ditanam dalam medium yang baru, sel-sel bakteri beradaptasi dalam lingkungannya yang baru. Dalam proses adaptasi tersebut, bakteri mengeluarkan metabolit sekunder, seperti AIA, dalam jumlah besar. Pada hari kedua pengkulturan, sel-sel bakteri sudah terbiasa dengan lingkungannya sehingga produksi metabolit sekunder kembali normal.
Gambar 12 Pembentukan pelikel oleh bakteri diazotrof endofitik dalam medium JNFb semi padat (ditunjukkan oleh anak panah)
Konsentrasi AIA yang menurun juga disebabkan oleh degradasi AIA oleh bakteri menjadi senyawa lain (Arteca 1996). Penurunan ini tidak terjadi pada isolat RIFCB2 dan BCr1.2 karena proses adaptasi yang dialami oleh bakteri ini tidak sampai menimbulkan pembentukan metabolit sekunder dalam jumlah besar.
Aplikasi Bakteri pada Tanaman Kentang
Tanaman kentang (Solanum tuberosum L. cv. Granola) yang ditumbuhkan secara kultur jaringan dan diberi perlakuan penambahan pelet, supernatan, kultur murni, ataupun supernatan yang diotoklaf ternyata menunjukkan respon yang berbeda-beda (Tabel 3). Parameter yang dibandingkan adalah panjang batang (Gambar 13), panjang akar, serta jumlah akar (Gambar 14 dan 15). Standar yang digunakan sebagai pembanding adalah penambahan AIA sebagai kontrol positif dan tanpa perlakuan hormon sebagai blanko.
9
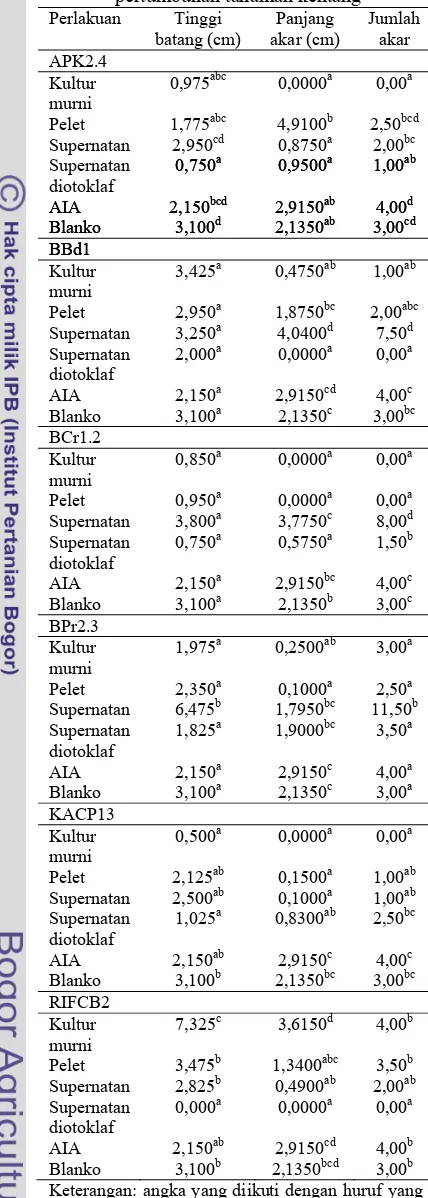
Tabel 3 Pengaruh aplikasi isolat bakteri diazotrof endofitik terhadap pertumbuhan tanaman kentang
Perlakuan Tinggi batang (cm) Panjang akar (cm) Jumlah akar APK2.4 Kultur murni
0,975abc 0,0000a 0,00a Pelet 1,775abc 4,9100b 2,50bcd Supernatan 2,950cd 0,8750a 2,00bc Supernatan
diotoklaf
0,750a 0,9500a 1,00ab AIA
AIA 2,150bcd 2,9150ab 4,00d Blanko
Blanko 3,100d 2,1350ab 3,00cd BBd1
BBd1
0,750a 0,9500a 1,00ab 2,150bcd 2,9150ab 4,00d 3,100d 2,1350ab 3,00cd Kultur
murni
3,425a 0,4750ab 1,00ab Pelet 2,950a 1,8750bc 2,00abc Supernatan 3,250a 4,0400d 7,50d Supernatan
diotoklaf
2,000a 0,0000a 0,00a AIA 2,150a 2,9150cd 4,00c Blanko 3,100a 2,1350c 3,00bc
BCr1.2 Kultur
murni
0,850a 0,0000a 0,00a
Pelet 0,950a 0,0000a 0,00a
Supernatan 3,800a 3,7750c 8,00d Supernatan
diotoklaf
0,750a 0,5750a 1,50b AIA 2,150a 2,9150bc 4,00c Blanko 3,100a 2,1350b 3,00c BPr2.3 Kultur
murni
1,975a 0,2500ab 3,00a Pelet 2,350a 0,1000a 2,50a Supernatan 6,475b 1,7950bc 11,50b Supernatan
diotoklaf
1,825a 1,9000bc 3,50a AIA 2,150a 2,9150c 4,00a Blanko 3,100a 2,1350c 3,00a KACP13 Kultur
murni
0,500a 0,0000a 0,00a Pelet 2,125ab 0,1500a 1,00ab Supernatan 2,500ab 0,1000a 1,00ab
Supernatan diotoklaf
1,025a 0,8300ab 2,50bc AIA 2,150ab 2,9150c 4,00c Blanko 3,100b 2,1350bc 3,00bc
RIFCB2 Kultur
murni
7,325c 3,6150d 4,00b Pelet 3,475b 1,3400abc 3,50b Supernatan 2,825b 0,4900ab 2,00ab Supernatan
diotoklaf
0,000a 0,0000a 0,00a AIA 2,150ab 2,9150cd 4,00b Blanko 3,100b 2,1350bcd 3,00b Keterangan: angka yang diikuti dengan huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan (α=0,05).
Gambar 13 Pengaruh isolat diazotrof endofitik terhadap pemanjangan batang eksplan kentang
Gambar 14 Pemanjangan akar oleh perlakuan penambahan supernatan BCr1.2 (atas) dan supernatan BBd1 (bawah)
10
Perlakuan supernatan diotoklaf isolat APK2.4 juga tidak memberikan respon tanaman yang lebih baik daripada AIA sintetis dan blanko. Hal ini disebabkan oleh rusaknya zat pemacu tumbuh yang terkandung di dalam supernatan setelah dipanaskan. Terlihat juga bahwa respon tanaman oleh perlakuan supernatan lebih baik daripada supernatan diotoklaf. Karena itu, pemberian pelet APK2.4 dapat menunjukkan pertumbuhan eksplan yang terbaik.
Aplikasi isolat BBd1 menunjukkan perlakuan supernatan memberikan hasil yang lebih baik terhadap panjang akar (4,0400 cm) serta jumlah akar (7,50) eksplan kentang dibanding perlakuan lainnya. Aplikasi supernatan juga meningkatkan tinggi batang (3,250 cm). Respon yang ditunjukkan juga lebih baik dibandingkan AIA sintetis dan blanko. Batang tertinggi dihasilkan oleh perlakuan kultur murni (3,425 cm). Namun perlakuan ini tidak meningkatkan kualitas pengakaran pada tanaman. Jika dibandingkan dengan perlakuan pelet, perakaran dalam perlakuan kultur murni masih kurang baik daripada pelet. Seperti dalam isolat APK2.4, penambahan kultur murni yang masih membawa medium pertumbuhan bakteri membuat proses pertumbuhan bakteri lebih cepat daripada tanaman sehingga menghambat pengakaran tanaman. Tetapi kondisi ini tidak mempengaruhi proses pemanjangan batang karena penyebaran bakteri terbatas pada permukaan medium pertumbuhan eksplan. Secara keseluruhan pertumbuhan eksplan terbaik dihasilkan oleh penambahan supernatan BBd1.
Aplikasi isolat BCr1.2 memperlihatkan perlakuan supernatan berpengaruh nyata terhadap jumlah akar (8,00), dan juga meningkatkan tinggi batang (3,800 cm) serta panjang akar (3,7750 cm). Respon ini lebih baik dibandingkan AIA sintetis maupun blanko. Perlakuan lainnya berupa kultur murni, pelet, dan supernatan diotoklaf tidak dapat meningkatkan pertumbuhan eksplan kentang. Diduga isolat BCr1.2 bersifat patogen terhadap tanaman karena perlakuan kultur murni dan pelet yang masih membawa sel bakteri hidup menurunkan kualitas pertumbuhan. Pertumbuhan eksplan kentang terbaik ditunjukkan oleh penambahan supernatan BCr1.2 (Gambar 14).
Aplikasi isolat BPr2.3 memperlihatkan penambahan supernatan berpengaruh nyata terhadap tinggi batang (6,475 cm) dan jumlah akar (11,50) eksplan kentang. Respon ini juga melebihi AIA sintetis dan blanko. Namun
tidak demikian halnya dengan pemanjangan akar. Tidak ada perlakuan yang dapat meningkatkan panjang akar eksplan kentang. Pertumbuhan eksplan terbaik ditunjukkan oleh perlakuan supernatan BPr2.3.
Aplikasi isolat KACP13 menunjukkan tidak ada satu perlakuan pun yang berpengaruh nyata dalam meningkatkan pertumbuhan eksplan kentang. Perlakuan supernatan dapat meningkatkan tinggi batang (2,500 cm) lebih baik daripada penambahan AIA sintetis (2,150 cm), namun masih kurang baik dibandingkan blanko (3,100 cm). Karena itu penambahan supernatan KACP13 memberikan pertumbuhan eksplan yang terbaik.
Aplikasi isolat RIFCB2 menunjukkan perlakuan kultur murni menghasilkan pengaruh nyata pada tinggi batang (7,325 cm) eksplan kentang. Perlakuan ini juga dapat meningkatkan panjang akar (3,6150 cm) serta jumlah akar (4,00). Perlakuan pelet juga meningkatkan tinggi batang (3,475 cm) dan jumlah akar (3,50). Peningkatan pertumbuhan eksplan oleh penambahan pelet dan kultur murni menunjukkan respon yang lebih baik daripada AIA sintetis maupun blanko. Tetapi pertumbuhan eksplan yang terbaik adalah pada penambahan kultur murni RIFCB2 karena dapat meningkatkan baik tinggi batang, panjang akar, maupun jumlah akarnya.
Peningkatan pertumbuhan tanaman oleh perlakuan berbagai bentuk isolat bakteri ini sesuai dengan hasil penelitian yang dilaporkan Tien et al. 1979; Biswas et al. 2000; Maor et al. 2004; dan Lestari (2003). Lestari (2003) juga menyebutkan bahwa inokulasi isolat bakteri diazotrof endofitik dapat mempengaruhi keseimbangan fitohormon sehingga terbentuk suatu keadaan yang lebih produktif kemudian menghasilkan tinggi tanaman terbaik.
Penambahan AIA 0,25 mg/l sebagai kontrol positif menghasilkan panjang akar dan jumlah akar yang lebih tinggi dari blanko tetapi tidak terjadi peningkatan tinggi batang dikarenakan sistem akar tumbuhan lebih sensitif terhadap auksin daripada batangnya (Tien et al. 1979). Selain itu, pertumbuhan dapat ditingkatkan jika konsentrasi AIA sangat rendah.
11
BPr2.3, serta KACP13 memproduksi AIA maksimum yang lebih tinggi dan dibanding isolat APK2.4 dan RIFCB2 memberikan respon tanaman yang lebih baik. Menurut Biswas et al. (2000) produksi AIA oleh bakteri diazotrof merupakan faktor pemicu pertumbuhan tanaman.
Perlakuan supernatan yang diotoklaf bertujuan untuk mengetahui sifat hormon tumbuh yang diproduksi oleh tiap-tiap isolat. Penambahan supernatan yang diotoklaf rata-rata memberikan hasil dengan kualitas lebih rendah daripada penambahan supernatan, karena AIA merupakan hormon yang rusak jika dipanaskan.
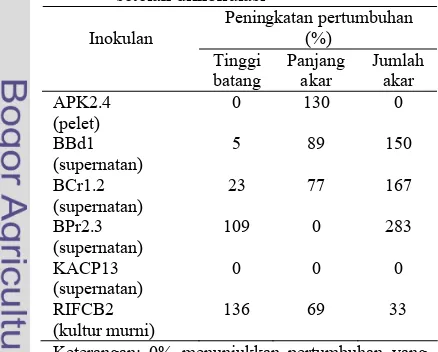
Jika dibandingkan dengan blanko tampak bahwa tiap isolat dapat meningkatkan pertumbuhan tanaman hanya pada bagian tertentu saja (Tabel 4). Seperti pada supernatan BPr2.3 yang dapat meningkatkan jumlah akar hingga 283% namun tidak meningkatkan panjang akar. Begitu juga dengan pelet APK2.4 yang mampu meningkatkan panjang akar hingga 130%, tetapi tidak demikian halnya dengan tinggi batang dan jumlah akar. Hal ini dapat terjadi karena diduga kandungan zat pemacu tumbuh yang diproduksi oleh bakteri diazotrof endofitik bukan hanya auksin saja, tetapi dapat juga terkandung golongan zat pemacu tumbuh lainnya. Peningkatan pertumbuhan akan optimal jika komposisi campuran zat pemacu tumbuh yang diserap tanaman sesuai. Jika tidak demikian maka pertumbuhan tanaman akan lebih rendah kualitasnya dibandingkan dengan tanaman yang tidak diberi zat pemacu tumbuh (Tien et al. 1979).
Tabel 4 Peningkatan pertumbuhan tanaman setelah diinokulasi Peningkatan pertumbuhan (%) Inokulan Tinggi batang Panjang akar Jumlah akar APK2.4 (pelet)
0 130 0 BBd1
(supernatan)
5 89 150 BCr1.2
(supernatan)
23 77 167 BPr2.3
(supernatan)
109 0 283 KACP13
(supernatan)
0 0 0 RIFCB2
(kultur murni)
136 69 33 Keterangan: 0% menunjukkan pertumbuhan yang lebih rendah dari blanko.
Inokulan berbentuk pelet dan kultur murni yang masih membawa sel bakteri hidup kurang memberikan hasil yang positif pada tanaman karena medium kultur jaringan tanaman juga dapat menjadi medium yang baik bagi pertumbuhan bakteri. Pada isolat APK2.4, BCr1.2, dan KACP13 penambahan kultur murni menimbulkan kompetisi antara sel bakteri dengan tanaman, sehingga tanaman kekurangan nutrisi dan terhambat pertumbuhannya. Tetapi isolat RIFCB2 menunjukkan pertumbuhan terbaik karena pengaruh perlakuan kultur murni. Jadi pertumbuhan bakteri isolat RIFCB2 tidak menghambat pertumbuhan tanaman. Pada isolat BCr1.2 tampak tidak ada pertumbuhan pada tanaman karena penambahan pelet dan supernatan. Perlakuan penambahan pelet yang terbaik diperlihatkan oleh isolat APK2.4. Seperti pada penambahan kultur murni, perlakuan pelet juga dapat menimbulkan kompetisi antara sel bakteri dengan tanaman. Namun keadaan ini tidak berlaku bagi isolat RIFCB2.
Isolat yang menunjukkan respon terbaik adalah BCr1.2 (supernatan) dan RIFCB2 (kultur murni) karena dapat meningkatkan baik tinggi batang, panjang, serta jumlah akarnya hingga melebihi pengaruh penambahan AIA sintetis. Walaupun BPr 2.3 dapat meningkatkan tinggi batang serta jumlah akar namun bukan isolat terbaik karena walau jumlah akar yang dihasilkan banyak tetapi pendek. Bentuk akar seperti ini kurang menunjang pertumbuhan tanaman karena proses penyerapan nutrisi terbatas hanya di daerah sekitar tanaman saja.
Inokulasi isolat bakteri diazotrof endofitik (dalam bentuk pelet, supernatan, ataupun kultur murninya) dapat menghasilkan respon tanaman yang lebih baik daripada penambahan AIA sintetis. Diduga hormon penunjang pertumbuhan yang dihasilkan bakteri diazotrof endofitik bukan hanya AIA, namun terdapat juga golongan hormon lainnya (Tien et al. 1979). Ataupun terkandung zat lain yang turut mendukung pertumbuhan tanaman.
SIMPULAN
12
tanaman kentang. Aplikasi supernatan BCr1.2 dapat meningkatkan tinggi batang sebesar 23%; panjang akar sebesar 77%; dan jumlah akar sebesar 167%. Aplikasi supernatan BPr2.3 meningkatkan tinggi batang sebesar 109% dan jumlah akar sebesar 283%. Aplikasi supernatan BBd1 dapat meningkatkan tinggi batang sebesar 5%; panjang akar sebesar 89% dan jumlah akar sebesar 150%. Aplikasi supernatan KACP13 tidak dapat meningkatkan pertumbuhan tanaman. Supernatan yang diotoklaf tidak meningkatkan pertumbuhan tanaman karena AIA merupakan hormon yang dapat rusak jika dipanaskan. Aplikasi kultur murni RIFCB2 meningkatkan tinggi batang sebesar 136%; panjang akar sebesar 69%; dan jumlah akar sebesar 33%. Aplikasi pelet isolat APK2.4 dapat meningkatkan panjang akar tanaman sebesar 130%. Isolat yang menunjukkan respon terbaik adalah BCr1.2 (supernatan) dan RIFCB2 (kultur murni) karena dapat meningkatkan baik tinggi batang, panjang, serta jumlah akar tanaman.
SARAN
Penelitian selanjutnya adalah meneliti zat pemacu tumbuh selain AIA yang juga diproduksi oleh bakteri diazotrof endofitik. Selain itu dapat juga diteliti aplikasi isolat bakteri diazotrof endofitik pada jenis tanaman lainnya dengan mengamati pembentukan daun oleh pengaruh hormon tumbuh yang dihasilkannya, dan melakukan peningkatan skala produksi untuk aplikasi bakteri diazotrof endofitik penghasil AIA pada usaha pembibitan tanaman secara kultur jaringan.
DAFTAR PUSTAKA
[Anonim]. 2005. Hormonal regulation of growth. http://psb.usu.edu/courses/ plsc3500/html. [31 Mar 2005].
Arshad M, Frankenberger WT. 1992. Microbial production of plant growth regulators. Di dalam: Arshad M, Frankenberger WT, Kloepper JW, Metting FB (editor). Soil Microbial Ecology. New York: Marcel Dekker. hlm.307-347.
Arteca RN. 1996. Plant Growth Substances. New York: Chapman and Hall. 332 hlm.
Biswas JC, Ladha JK, Dazzo FB, Yanni YG, Rolfe BG. 2000. Rhizobial inoculation influences seedling vigor and yield of rice. Agron. J. 92:880-886.
Burr TJ, Shcroth MN, Suslow T. 1978. Increased potato yields by treatment of seedpieces with specific strains of
Pseudomonas fluorescens and P. putida. Phytopathology 68:1377-1383.
Frankenberger WT, Poth M. 1987. Biosynthesis of indole-3-acetic acid by the pine ectomycorrhizal fungus
Pisolithus tinctorius. Appl. Environt. Microbiol. 53:2908-2913.
Ghaffoor A, Shah GB, Waseem K. 2003.
Biotechnology 2(3):191-197.
Gordon SA, Weber RP. 1951. Colorimetric estimation of indoleacetic acid. Plant Physiol. 26:192-195.
Gunawan LW. 1992. Teknik Kultur Jaringan Tumbuhan. Bogor: Pusat Antar Universitas IPB.
Husen E. 2003. Screening of soil bacteria for plant growth promotion activities in vitro. Ind. J. Agri. Sci. 4(1):27-31.
Hussey G, Stacey NJ. 1981. In vitro
propagation of poatato (Solanum tuberosum L.). Ann. Bot. 48:787-796.
Hutcheson SW, Kosuge T. 1985. Regulation of 3-indolacetic acid production in
Pseudomonas syringae pv. savastanoi.
J. Biol. Chem. 260:6281-6287.
Kawaguchi M, Syōno K. 1996. The excessive production of indole-3-acetic acid and its significance in studies of the biosynthesis of this regulator of plant growth and development. [mini review]. Plant Cell Physiol. 37:1043-1048.
Kloepper JW, Schroth MN, Miller TD. 1980. Effects of rhizosphere colonization by plant growth-promoting rhizobacteria on potato plant development and yield.
Phytopathology 70:1078-1082.
Kloepper JW. 1983. Effect of seed piece inoculation with plant growth-promoting rhizobacteria on populations of Erwinia carotovora on potato roots and daughter tubers. Phytopathology
13
Kloepper JW. 1992. Plant growth-promoting rhizobacteria as biological control agents. Di dalam: Arshad M, Frankenberger WT, Kloepper JW, Metting FB (editor). Soil Microbial Ecology. New York: Marcel Dekker. hlm.255-274.
Ladha JK, Reddy PM. 2000. Steps toward nitrogen fixation in rice. Di dalam: Ladha JK, Reddy PM (editor.). The Quest for Nitrogen Fixation in Rice. Los Baños: International Rice Research Institute. hlm. 33-46.
Lestari Y. 2003. Seleksi bakteri diazotrof endofitik padi penghasil asam indol-3-asetat (AIA). [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Lorch HJ, Benckieser G, Ottow JCG. 1998. Basic methods for couting microorganisms in soil and water. Di dalam: Alef K, Nannipieri P (editor).
Methods in Applied Soil Microbiology and Biochemistry. London: Academic Press. hlm. 146-161.
Maor R, Haskin S, Levi-Kedmi H, Sharon A. 2004. In planta production of indole-3-acetic acid by Colletotrichum gloeosporioides f. sp. Aeschynomene. App. Environt. Microbiol. 70:1852-1854.
Miller SA dan Lipschutz L. 1984. Potato. Di dalam: Miller SA, Lipschutz L, Ammirato PV, Evans DA, Sharp WR, Yamada Y (editor). Handbook of Plant Cell Culture. Vol. 3 Crop Species. New York: Macmillan. hlm 291-321.
Nickell LG. 1982. Plant Growth Regulators: Agricultural Uses. New York: Springer-Verlag. hlm. 173.
Prescott LM, Harley JP, Klein DA. 1993.
Microbiology, second edition. Iowa: Wm C Brown. hlm. 163.
Saraswati R, Susilowati DN, Indrasumunar A, Misgiyarta, Simanungkalit RDM. 2002. Teknologi pengembangan pupuk hayati dan perombak bahan organik untuk lahan kering dan lahan sawah. Di dalam: Soegiarto B, Mulya K, Matadjib, Orbani IN (editor). Laporan Tahunan Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian. hlm. 98-115.
Schroth MN, Hancock JG. 1982. Science
216:1376-1381.
Schroth MN, Weinhold AR. 1986. Root colonizing bacteria and plant health.
Hort. Sci. 21:1295-1298.
Syariefa E. 2001. Sejarah panjang umbi kentang. Trubus 32(383):58-59.
Thimann KV. 1974. Fifty years of plant hormone research. Plant Physiol.
54:450-453.
Tien TM, Gaskin MH, Hubell DH. 1979. Plant growth substances produced by
Azospirillum brasilense and their effect on the growth of pearl millet (Pennisetum americanum L.). Appl. Environt. Microbiol. 37:1016-1024.
Torrie JH, Steel RGD. 1960. Principles and Procedures of Statistics with Special Reference to The Biological Sciences. New York: McGraw-Hill. hlm. 99-160.
Vraný J, Dobiáš K, Fiker A. 1989. Yield of potatoes and the contamination by fusaria after inoculation with bacteria and fungi in field experiments. Di dalam: Interrelationship between Microorganisms and Plants in Soil Proceedings of an International Symposium; Liblice, 22-24 Juni 1987. Amsterdam: Elsevier. hlm 469-473.
Weerasooriya R.2005. Auxin: indole-3-acetic acid (IAA), a hormone with diverse effects: synthesis and applications. http://www.projectlabs.com/htmldocs/ auxin.html. [31 Mar 2005].
14
15
Lampiran 1 Diagram alir pengukuran AIA
10 ml medium NB-M26 + 1 ose biakan bakteri
inkubasi 24 jam suhu kamar di atas pengocok dengan kecepatan 150 rpm
100 µl kultur + 9 ml medium MS + 1 ml L-triptofan
inkubasi 48 jam suhu kamar di atas pengocok dengan kecepatan150 rpm
1,5 ml kultur
disentrifus 12000 rpm 5 menit
1 ml supernatant + 2 ml pereaksi FeCl
3-HClO
4didiamkan 25 menit
16
Lampiran 2 Diagram alir penelitian
seleksi bakteri
pengukuran [AIA] dan populasi bakteri
dikulturkan dalam medium
nutrien broth
disentrifus 12000 rpm
kultur murni
aplikasi pada tumbuhan
pelet
aplikasi
supernatan
pada tumbuhan
aplikasi
diotoklaf
pada tumbuhan
17
Lampiran 3 Komposisi medium
A. Medium JNFb (
Jensen’s Nitrogen Free broth
)
Asam
malat
5
g
K
2HPO
40,6
g
KH
2PO
41,8
g
MgSO
4.7H
2O
0,2
g
NaCl
0,1
g
CaCl
2.2H
2O
0,2 g
FeEDTA
0,066
g
BTB
2
ml (stok: 0,5 g dalam 100 ml alkohol 75%)
Mikronutrien
2
ml
Ekstrak
khamir 0,02
g
KOH
4,5
g
Agar:
padat
20
g
semi
padat
1,99
g
Akuades
1000
ml
pH
5,8
Mikronutrien
Na
2MoO
4.H
2O
0,2
g
MnSO
4.H
2O
0,0235
g
H
3BO
30,28
g
CuSO
4.5H
2O
0,08 g
ZnSO
4.7H
2O
0,024 g
Akuades
200
ml
B. Medium Sari Khamir Manitol (SKM)
KH
2PO
40,5
g
MgSO
4.7H
2O
0,2
g
NaCl
0,1
g
Manitol 10
g
Ekstrak
khamir 0,5
g
Merah kongo
10
ml (stok: 0,25 g dalam 100 ml akuades)
Akuades
1000
ml
Agar
20
g
pH
6,8
C. Medium
Nutrient Broth
-M26 (NB-M26)
NaCl
5
g
Pepton
10
g
Ekstrak daging sapi 10
g
Akuades
1000
ml
D. Medium
Minimum Salt
KH
2PO
41,36
g
Na
2HPO
42,13
g
MgSO
4.7H
2O
0,2
g
18
Lampiran 3 (Lanjutan)
Akuades
1000
ml
Trace elements
CaCl
2.2H
2O
700 mg
FeSO
4.7H
2O
300 mg
MnSO
4.H
2O
20
mg
CuSO
4.5H
2O
40
mg
ZnSO
4.7H
2O
20
mg
H
3BO
33
mg
CoCl
2.6H
2O
7
mg
Na
2MoO
4.H
2O
4
mg
H
2SO
4pekat
1
ml
E. Larutan L-triptofan
Glukosa 10
g
L-triptofan
1
g
Ekstrak
khamir 0,1
g
Akuades
100
ml
Larutan disaring melalui membran
milipore
dengan diameter lubang 0,2 µm.
F. Medium Murashige-Skoog
KNO
31,9
g
NH
4NO
31,65
g
MgSO
4.7H
2O
0,37 g
KH
2PO
40,17
g
CaCl
2.2H
2O
8,8 g
KI
0,83
mg
H
3BO
36,2
mg
MnSO
4.4H
2O
22,3 mg
ZnSO
4.7H
2O
8,6
mg
Na
2MoO
4.H
2O
0,25
mg
CuSO
4.5H
2O
0,025 mg
CoCl
2.6H
2O
0,025 mg
Asam
nikotinat 0,5
mg
Piridoksin
HCl 0,5
mg
Tiamin
HCl
0,1
mg
Glisin
2
mg
Myo-inositol
100
mg
NaFeEDTA
36,8
mg
Gula
30
g
Agar
10
g
Akuades
1000
ml
19
Lampiran 4 Data pengukuran konsentrasi AIA bakteri diazotrof endofitik
Isolat [AIA], mg/l APK2.4 11,9944
20
Lampiran 5 Data pengukuran konsentrasi AIA dan populasi bakteri
A. Isolat RIFCB2
Hari ke- [AIA], mg/l populasi (log n) 0 0,0000 7,0492 1 3,0704 8,5315 2 12,0875 9,3263 3 14,6570 9,3032 4 4,5746 9,8325 5 12,3859 10,9542 6 7,3637 8,7284 7 13,2970 8,7160
B. Isolat KACP13
Hari ke- [AIA], mg/l populasi (log n) 0 0,0000 7,2041 1 16,8202 9,2041 2 14,1301 9,9638 3 17,3424 9,4472 4 13,5719 9,5798 5 11,4646 9,8451 6 21,4150 9,2304 7 17,7622 8,4150
C. Isolat APK2.4
Hari ke- [AIA], mg/l populasi (log n) 0 0,0000 7,2041 1 13,7586 9,2041 2 11,7500 10,2041 3 15,7054 8,3010 4 14,7167 9,2304 5 13,4208 9,0414 6 18,7686 8,3802 7 18,0750 8,2041
D. Isolat BBd1
21
Lampiran 5 (Lanjutan)
E. Isolat BCr1.2
Hari ke- [AIA], mg/l populasi (log n) 0 0,0000 8,9638 1 14,6291 9,2041 2 18,6667 8,2304 3 8,9297 10,0414 4 4,8433 9,6021 5 7,5639 8,3424 6 10,1993 7,3010 7 14,5254 7,2553
F. Isolat BPr2.3
22
Lampiran 6 Tabel analisis varians
A.
Isolat APK2.4
Jumlah Kuadrat db Kuadrat Tengah F Sig. Tinggi Perlakuan 19,135 5 3,827 6,040 0,002
Batang Galat 11,405 18 0,634
Total 30,540 23
Panjang Perlakuan 62,736 5 12,547 3,021 0,038
Akar Galat 74,764 18 4,154
Total 137,500 23
Jumlah Perlakuan 40,833 5 8,167 7,000 0,001
Akar Galat 21,000 18 1,167
Total 61,833 23
B. Isolat BBd1
Jumlah Kuadrat db Kuadrat Tengah F Sig. Tinggi Perlakuan 7,069 5 1,414 1,365 0,283
Batang Galat 18,638 18 1,035
Total 25,706 23
Panjang Perlakuan 45,224 5 9,045 8,576 0,000
Akar Galat 18,984 18 1,055
Total 64,209 23
Jumlah Perlakuan 140,833 5 28,167 15,364 0,000
Akar Galat 33,000 18 1,833
Total 173,833 23
C. Isolat BCr1.2
Jumlah Kuadrat db Kuadrat Tengah F Sig. Tinggi Perlakuan 33,733 5 6,747 1,797 0,164
Batang Galat 67,580 18 3,754
Total 101,313 23
Panjang Perlakuan 51,640 5 10,328 10,296 0,000
Akar Galat 18,056 18 1,003
Total 69,697 23
Jumlah Perlakuan 183,500 5 36,700 73,400 0,000
Akar Galat 9,000 18 0,500
Total 192,500 23
D. Isolat BPr2.3
Jumlah Kuadrat db Kuadrat Tengah F Sig. Tinggi Perlakuan 62,637 5 12,527 6,597 0,001
Batang Galat 34,183 18 1,899
Total 96,820 23
Panjang Perlakuan 24,694 5 4,939 4,203 0,010
Akar Galat 21,149 18 1,175
Total 45,843 23
Jumlah Perlakuan 234,833 5 46,967 1,875 0,149
Akar Galat 451,000 18 25,056
23
Lampiran 6 (Lanjutan)
E. Isolat KACP13
Jumlah Kuadrat db Kuadrat Tengah F Sig. Tinggi Perlakuan 18,555 5 3,711 2,353 0,082
Batang Galat 28,385 18 1,577
Total 46,940 23
Panjang Perlakuan 30,056 5 6,011 6,029 0,002
Akar Galat 17,947 18 0,997
Total 48,003 23
Jumlah Perlakuan 44,833 5 8,967 4,362 0,009
Akar Galat 37,000 18 2,056
Total 81,833 23
F. Isolat RIFCB2
Jumlah Kuadrat db Kuadrat Tengah F Sig. Tinggi Perlakuan 114,267 5 22,853 9,398 0,000
Batang Galat 43,772 18 2,432
Total 158,040 23
Panjang Perlakuan 39,207 5 7,841 6,088 0,002
Akar Galat 23,185 18 1,288
Total 62,392 23
Jumlah Perlakuan 47,500 5 9,500 3,490 0,022
Akar Galat 49,000 18 2,722