EFIKASI EKSTRAK LENGKUAS PADA MIKROBA
INDIGENOUS BUAH SALAK (Salacca edulis Reinw)
REIVANIA ROSIHAN
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH ASIL
KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI
ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA
MANAPUN.
Jakarta, Desember 2014
ABSTRAK
REIVANIA ROSIHAN, Efikasi Ekstrak Lengkuas Pada Mikroba Indigenous Buah Salak (Salacca edulis Reinw). Dibawah bimbingan SETYADJIT dan
SANDRA HERMANTO.
Penelitian mengenai potensi ekstrak rimpang lengkuas merah dalam menghambat
pertumbuhan kapang/ khamir indigenous salak telah dilakukan. Bahan yang
digunakan adalah rimpang lengkuas merah yang diekstrak dengan berbagai
pelarut yaitu dengan air dingin (akuades), air panas (±100˚C), etil asetat, dan
n-heksana. Selanjutnya dilakukan uji aktivitas antijamur dan uji pembentukan zona
hambat pada variasi suhu (15˚C,25˚C,30˚C, dan 35˚C), analisis total fenolik dan
identifikasi konventional dengan pengamatan karakter morfologi kapang. Kapang
yang digunakan dalam penelitian diisolasi langsung dari buah salak busuk. Hasil
penelitian menunjukkan bahwa jenis ekstrak dan suhu inkubasi mempengaruhi
pertumbuhan kapang/khamir perusak buah salak. Ekstrak terbaik dalam
menghambat pertumbuhan kapang/ khamir adalah ekstrak etil asetat. Hasil
identifikasi morfologi kapang diduga sebagian kapang dan khamir yang tumbuh
dalam buah salak adalah Aspergillus sp, Thielaviopsis sp, Penicillium sp, Saccharomyces sp, Rhodotorula sp, dan Streptomyces sp. Ekstrak lengkuas tidak diperlukan pada ruang pendingin, namun sebaiknya digunakan pada suhu kamar.
ABSTRACT
REIVANIA ROSIHAN, Efficacy of Galangal Extract on Indigenous Microbes of Snake Fruit (Salacca edulis Reinw). The adviser are SETYADJIT and SANDRA HERMANTO.
Research on the potential of red galangal rhizome extract in inhibiting the growth of mold / yeast indigenous snake fruit has been done. The materials used were red galangal rhizome extracted with various solvents with cold water (distilled water), hot water (± 100˚C), ethyl acetate, and n-hexane. After that, antifungal activity tested on inhibition zone formation by used variations of incubation temperatures (15C, 25˚C, 30C, and 35˚C), the analysis of total phenolic and conventional identification with the observed morphological characters mold. Molds used in the study were isolated directly from rotten snake fruit. The results showed that the type of extract and incubation temperature affects the growth of mold / yeast destroyer snake fruit. The best extract in inhibiting the growth of mold / yeast is ethyl acetate. The results of the morphological identification of suspected mold fungi and yeasts are partially grown in snake fruit were Aspergillus sp, Thielaviopsis sp, Penicillium sp, Saccharomyces sp, Rhodotorula sp, and Streptomyces sp. Galangal extract is not required in the refrigerator, but should be used at room temperature.
i
KATA PENGANTAR
Puji syukur penulis haturkan pada Allah SWT karena berkat rahmat dan
hidayah-Nya penulis dapat menyelesaikan proposal penelitian yang berjudul
“Efikasi Ekstrak Lengkuas Pada Mikroba Indigenous Buah Salak (Salacca
edulis Reinw)”. Shalawat serta salam penulis sampaikan kepada Nabi
Muhammad SAW beserta keluarga dan sahabatnya yang setia mengorbankan jiwa
raga dan lainnya untuk tegaknya syi’ar Islam, yang pengaruh dan manfaatnya
hingga kini masih terasa.
Penulisan skripsi ini dapat diselesaikan berkat adanya pihak-pihak yang
telah memberikan bimbingan dan dukungannya kepada penulis. Oleh karena itu,
pada kesempatan ini penulis menyampaikan ucapan terima kasih yang
setinggi-tingginya terutama kepada :
1. Dr. Setyadjit, MAppSc, selaku pembimbing I yang telah memberikan ilmu
pengetahuan dan bimbingannya kepada penulis selama penyusunan skripsi ini.
2. Sandra Hermanto, M.Si, selaku pembimbing II yang telah membimbing dan
memberikan arahan dalam penulisan skripsi ini.
3. Anna Muawanah, M.Si, selaku dosen penguji I yang telah memberikan saran
dan kritiknya pada skripsi ini.
4. Adi Riyadhi, M.Si, selaku dosen penguji II yang telah memberikan saran dan
ii
5. Yusraini Dian Inayati Siregar, M.Si, selaku Ketua Program Studi Kimia
Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah
Jakarta.
6. Dr. Agus Salim, M.Si, selaku Dekan Fakultas Sains dan Teknologi Universitas
Islam Negeri Syarif Hidayatullah Jakarta.
7. Isalmi Aziz, MT selaku pembimbing akademik dan seluruh dosen Program
Studi Kimia UIN Syarif Hidayatullah Jakarta yang telah memberikan ilmu
pengetahuan serta bimbingan kepada penulis.
8. Para karyawan BB-Pascapanen yang telah memberikan ilmu pengetahuan dan
pengalaman kepada penulis.
9. Kedua orang tua, Bapak Rosihan Rosman dan Ibu Vera Syarief serta kakakku
Riviega Rosihan, yang selalu mendoakan, melimpahkan kasih sayang,
memotivasi dan memberikan dukungan moril serta materil kepada penulis.
10.Teman-teman seperjuangan di Program Studi Kimia 2010 yang telah
memberikan semangat, doa dan dukungan serta membantu penulis.
11.Teman-teman di Laboratorium Kimia dan Mikrobiologi BB-Pascapanen
Bogor, yang telah memberi masukan hingga skripsi ini selesai.
Penulis menyadari dalam penyusunan skripsi ini tidak terlepas dari
kekurangan. Oleh karena itu, kritik dan saran yang membangun sangat penulis
harapkan.
Jakarta, Desember 2014
iii
DAFTAR ISI
Halaman
KATA PENGANTAR. ... i
DAFTAR ISI. ... iii
DAFTAR TABEL. ... vii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN 1.1 Latar Belakang. ... 1
1.2 Perumusan Masalah. ... 3
1.3 Hipotesa Penelitian. ... 3
1.4 Tujuan Penelitian. ... 4
1.5 Manfaat Penelitian. ... 4
BAB II TINJAUAN PUSTAKA 2.1 Lengkuas (Alpinia Galanga) . ... 5
2.1.1. Karakteristik Lengkuas ... 5
2.1.2. Kandungan Bioaktif. ... 6
2.1.2.1. Senyawa Fenolik ... 6
2.1.2.2. 1’-Asetosikhavikol Asetat (ACA). ... 8
2.2. Ekstraksi ... 10
iv
2.2.2. Cara Ekstraksi ... 12
2.3. Kandungan Senyawa Fenolik ... 15
2.4 Salak Pondoh ... 19
2.4.1. Karakteristik ... 19
2.4.2.Kerusakan Pascapanen ... 22
2.4.3. Mikroba Perusak Salak... ... 23
2.4.3.1. Kapang ... 23
2.4.3.2. Klasifikasi Kapang.. ... 25
2.4.3.3. Morfologi Kapang ... 26
2.5 Antimikroba ... 27
2.5.1. Jenis-Jenis Antimikroba ... 28
2.5.2. Mekanisme Kerja Antimikroba ... 29
BAB III METODE PENELITIAN 3.1 Waktu dan Tempat Penelitian . ... 32
3.2 Alat dan Bahan . ... 32
3.2.1 Alat . ... 32
3.2.2 Bahan . ... 32
3.3 Metode Penelitian . ... 33
3.3.1 Pembuatan Ekstrak . ... 33
3.3.1.1. Ekstraksi lengkuas dengan air dingin (akuades) ... 32
3.3.1.2. Ekstraksi lengkuas dengan air panas ... . 33
v
3.3.1.4. Ekstraksi lengkuas dengan pelarut etil asetat ... 34
3.3.2. Analisis Total Fenolik ... 34
3.3.2.1.Persiapan Larutan Standar Asam Galat ... 34
3.3.2.2. Penetapan Kadar Fenol ... 35
3.3.3. Uji Aktivitas Antimikroba ... 35
3.3.3.1 Penyiapan Isolasi Kapang / Khamir ... 35
3.3.3.2 Uji Pembentukan Zona Hambat ... 36
3.4 Pengamatan Karakter Morfologi Kapang ... 37
3.5. Hubungan Antara Jenis Ekstrak dan Daya Hambat ... 37
3.6. Skema Penelitian ... 39
BAB IV. HASIL DAN PEMBAHASAN 4.1. Total Fenolik Ekstrak Lengkuas ... 40
4.2. Karakter Morfologi Isolat Kapang ... 41
4.2.1. Isolat S13E, S13F, S13G, dan S11D ... 42
4.2.2. Isolat S8A1 ... 47
4.2.3.Isolat S11B ... 48
4.2.4. Isolat S10B ... 51
4.2.5. Isolat S11A1 ... 52
4.2.6. Isolat S11A3 ... 53
4.3. Aktivitas Antimikroba Berbagai Jenis Ekstrak ... 56
vi
BAB V. KESIMPULAN DAN SARAN
5.1. Kesimpulan ... 74
5.2. Saran ... 74
DAFTAR PUSTAKA . ... 75
vii
DAFTAR TABEL
Tabel 1. Aktivitas beberapa komponen bioaktif pada rempah-rempah (Duke,
1994). . ... 7
Tabel 2. Konstanta dielektrikum pelarut organik ... 12
Tabel 3. Komposisi kimia daging buah salak pondoh ... 22
Tabel 4. Kadar total fenolik pada ekstrak lengkuas ... 40
Tabel 5. Hasil pengamatan karakter morfologi dari isolat buah salak busuk ... 55
Tabel 6. Pertumbuhan kapang Aspergillus sp. (S13E) pada berbagai perlakuan ... 58
Tabel 7. Pertumbuhan kapangAspergillus sp. (S13F) pada berbagai perlakuan ... 59
Tabel 8. Pertumbuhan kapang Aspergillus sp. (S13G) pada berbagai perlakuan ... 61
Tabel 9. Pertumbuhan kapang Aspergillus sp. (S11D) pada berbagai Perlakuan ... 62
Tabel 10. Pertumbuhan kapang Thielaviopsis sp. (S8A1) pada berbagai perlakuan ... 64
Tabel 11. Pertumbuhan kapang Penicillium sp. (S11B) pada berbagai perlakuan ... 66
viii
Tabel 13. Pertumbuhan khamir Rhodotorula sp. (S11A1) pada berbagai
perlakuan ... 70
Tabel 14. Pertumbuhan kapang Streptomyces sp. (S11A3) pada berbagai perlakuan ... 71
Tabel 15. Hubungan antara daya hambat dengan konsentrasi ACA ... 72
ix
DAFTAR GAMBAR
Gambar 1. Lengkuas Merah (A) (Dokumentasi pribadi) dan lengkuas
Putih (B) (Ulfah, 2013). ... 5
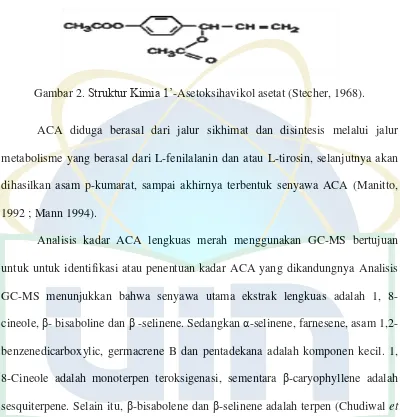
Gambar 2. Struktur Kimia 1’-Asetoksihavikol asetat (Stecher, 1968).. ... 9
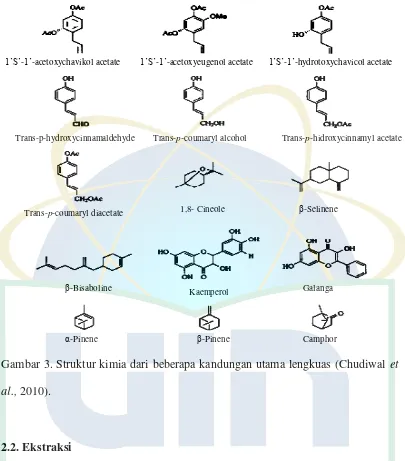
Gambar 3. Struktur kimia dari beberapa kandungan utama lengkuas
(Chudiwal et al., 2010)... 10 Gambar 4 Reaksi Pembentukan Kompleks Molibdenum-Tungsten Blue
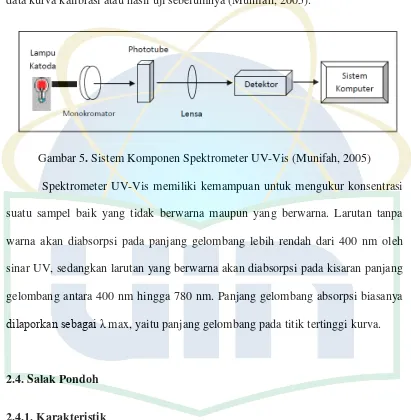
(Julkunen-Tiito, 1985)... 15
Gambar 5. Sistem Komponen Spektrometer UV-Vis (Munifah, 2005) ... 19 Gambar 6. (a) Struktur Morfologi Aspergillus secara umum; (b) Hifa bersekat dan
tidak bersekat (Benson, 2001). ... 27
Gambar 7. Struktur kimia Benomyl (Mnif et al., 2011) ... 29 Gambar 8. Diagram alir penelitian ... 39
Gambar 9. Hasil pengamatan karakter morfologi secara mikroskopik dari
Aspergillus sp. S13E umur 7 hari pada medium PDA di suhu ruang 43 Gambar 10. Hasil pengamatan karakter morfologi secara mikroskopik dari
Aspergillus sp. S13F umur 7 hari pada medium PDA di suhu ruang 44 Gambar 11. Hasil pengamatan karakter morfologi secara mikroskopik dari
Aspergillus sp. S13G umur 7 hari pada medium PDA di suhu ruang 45 Gambar 12. Hasil pengamatan karakter morfologi secara mikroskopik dari
x
Gambar 13. Hasil pengamatan karakter morfologi secara mikroskopik dan
makroskopik dari Thielaviopsis sp. S8A1 umur 7 hari pada medium PDA di suhu ruang. ... 48
Gambar 14. Hasil pengamatan karakter morfologi secara mikroskopik dan
makroskopik dari Penicillium sp. S11B umur 7 hari pada medium PDA di suhu ruang. ... 50
Gambar 15. Hasil pengamatan karakter morfologi secara mikroskopik dan
makroskopik dari Saccharomyces sp. S10B umur 7 hari pada
medium PDA di suhu ruang. ... 52
Gambar 16. Hasil pengamatan karakter morfologi secara mikroskopik dan
makroskopik dari Rhodotorula sp. S11A3 umur 7 hari pada medium PDA di suhu ruang ... 53
Gambar 17. Hasil pengamatan karakter morfologi secara mikroskopik dan
xi
DAFTAR LAMPIRAN
Lampiran 1. Tabel Foto Uji Pembentukan Zona Hambat Aspergillus sp.
(S13E). ... 83
Lampiran 2. Tabel Foto Uji Pembentukan Zona Hambat Aspergillus sp. (S13F) ... 84
Lampiran 3. Tabel Foto Uji Pembentukan Zona Hambat Aspergillus sp. (S13G) ... 85
Lampiran 4. Tabel Foto Uji Pembentukan Zona Hambat Aspergillus sp. (S11D) ... 86
Lampiran 5. Tabel Foto Uji Pembentukan Zona Hambat Thielaviopsis sp. (S8A1) ... 87
Lampiran 6. Tabel Foto Uji Pembentukan Zona Hambat Penicillium sp. (S11B) ... 88
Lampiran 7. Tabel Foto Uji Pembentukan Zona Hambat Saccharomyces sp. (S10B) ... 89
Lampiran 8. Tabel Foto Uji Pembentukan Zona Hambat Rhodotorula sp. (S11A1) ... 90
Lampiran 9. Tabel Foto Uji Pembentukan Zona Hambat Streptomyces sp. (S11A3) ... 91
Lampiran 10. Contoh Perhitungan Total Fenolik ... 92
Lampiran 11. Total Fenolik ... 93
1 BAB I
PENDAHULUAN
1.1.Latar Belakang
Buah salak merupakan salah satu jenis buah tropis asli Indonesia yang
banyak digemari karena mempunyai rasa yang khas. Salah satu jenis salak adalah
salak pondoh. Buah salak pondoh harganya lebih tinggi dibanding dengan salak
jenis yang lain sehingga mampu untuk meningkatkan pendapatan petani dari hasil
panennya. Buah salak pondoh (Sallaca edulis) sama dengan hasil hortikultura yang lain yang cepat mengalami kerusakan selama penyimpanan, kerusakan
tersebut dapat terjadi karena reaksi enzimatis, reaksi kimia dan aktivitas
mikroorganisme (Syafi’ah, 2010).
Salak termasuk buah yang bersifat perishable/ mudah rusak. Tranggono (1992) mengatakan bahwa salak pondoh yang telah dipetik dan disimpan pada
suhu kamar, pada hari ke 10 sudah menunjukkan tanda-tanda kebusukan dan tidak
layak dikonsumsi. Pangkal buah salak yang berbentuk meruncing sangat peka
terhadap beban mekanik yang menimpanya. Kerusakan fisik pada salak menjadi
titik awal infasi jamur perusak yang sudah mengkontaminasi buah sejak di
lapangan. Pertumbuhan dan kegiatan fisiologik jamur akan meningkatkan suhu
dalam tumpukan buah. Peningkatan suhu, memar pada buah dan serangan jamur,
2
Usaha pencegahan kerusakan dan pengendalian penyakit buah yang
disebabkan oleh jamur selama pasca panen, umumnya menggunakan fungisida.
Penanganan menggunakan bahan kimia masih dipandang sebagai metode yang
paling efektif dan murah dalam menghambat penyakit pasca panen. Senyawa
seperti thiabendazole, imazilil, sodium ortho-phenylphenate adalah komponen-komponen aktif dalam fungisida yang sering digunakan. Namun, penggunaan
senyawa-senyawa ini secara terus-menerus ternyata justru menyebabkan resistensi
beberapa jenis jamur perusak terhadap fungisida ini (Novianti, 2009).
Peningkatan kesadaran masyarakat akan efek samping penggunaan
fungisida terhadap lingkungan dan kesehatan karena residu toksisitasnya
mendorong dilakukannya penelitian tentang senyawa-senyawa antijamur yang
aman dan ramah lingkungan (natural fungisida). Dalam penelitian ini digunakan lengkuas sebagai fungisida yang ramah lingkungan.Lengkuas (Alpinia galanga L. Swartz) merupakan salah satu tanam-an dari famili Zingiberaceae yang rimpangnya dapat dimanfaatkan sebagai obat (Hernani, 2010). Berdasarkan warna
rimpang, dikenal dua kultivar lengkuas, yaitu lengkuas berimpang putih (Alpinia galanga (L) Wild) dan lengkuas berimpang merah (Alpinia purpurata K. Schum). Lengkuas merah merupakan tanaman obat yang telah dibuktikan pada
berbagai penelitian, memiliki daya antijamur dibandingkan jenis lengkuas putih.
Kandungan minyak atsiri dan komponen antijamur pada lengkuas merah,
memiliki konsentrasi yang lebih tinggi dibanding lengkuas putih (Budiarti, 2007).
3
metanol rimpang lengkuas pada beberapa spesies bakteri dan jamur. Efikasi
merupakan efektivitas pestisida terhadap organisme sasaran yang didaftarkan
berdasarkan pada hasil percobaan lapangan atau laboratorium menurut metode
yang berlaku (Permentan, 2007). Pestisida yang dimaksud juga termasuk
fungisida.
Penggunaan ekstrak rimpang lengkuas sebagai penanggulangan hama dan
penyakit khususnya jamur dinilai bersifat ramah lingkungan. Namun demikian,
ekstrak lengkuas belum banyak digunakan untuk pengawetan buah-buahan
termasuk buah salak segar. Oleh karena itu, maka dilakukan penelitian dengan
menggunakan ekstrak rimpang lengkuas merah sebagai agen antimikroba untuk
mencegah kerusakan dari buah salak pondoh selama penyimpanan.
1.2.Perumusan Masalah
1. Apakah ekstrak rimpang lengkuas merah mampu menghambat
pertumbuhan mikroba indigenous salak?
2. Jenis pelarut manakah yang menghasilkan efikasi terbesar dalam
penghambatan pertumbuhan mikroba indigenous salak?
3. Bagaimanakah hubungan total fenolik ekstrak rimpang lengkuas merah
terhadap penghambatan pertumbuhan mikroba indigenous salak?
1.3.Hipotesis Penelitian
1. Ekstrak rimpang lengkuas merah mampu menghambat pertumbuhan
4
2. Jenis pelarut yang paling bisa menghasilkan efikasi terbesar adalah
pelarut semipolar.
2. Total fenolik ekstrak rimpang lengkuas merah berhubungan dengan
penghambatan pertumbuhan mikroba indigenous salak.
1.4.Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Mengetahui kemampuan ekstrak lengkuas merah dalam menghambat
pertumbuhan mikroba indigenous salak.
2. Mengetahui pengaruh jenis pelarut yang digunakan terhadap efikasi
ekstrak lengkuas dalam menghambat pertumbuhan mikroba indigenous
salak.
3. Mengetahui hubungan antara total fenolik ekstrak rimpang lengkuas
merah dengan daya hambat pertumbuhan mikroba indigenous salak.
1.5. Manfaat Penelitian
Manfaat dari penelitian ini yaitu memberikan informasi secara ilmiah
kepada masyarakat tentang potensi, kandungan senyawa aktif dan total fenolik
dari ekstrak rimpang lengkuas merah (Alpinia purpurata K. Schum) yang dapat dipergunakan untuk menghambat pertumbuhan mikroba indigenus salak dalam
5 BAB II
TINJAUAN PUSTAKA
2.1. Lengkuas (Alpinia galanga)
2.1.1. Karakteristik Lengkuas
Tanaman lengkuas termasuk famili Zingiberaceae (Sudarnadi, 1996 dan
Mangoting et al., 2008). Secara umum ada dua jenis lengkuas yang dikenal, yaitu lengkuas merah (Alpinia purpurata K. Schum) dan lengkuas putih (Alpinia galanga (L) Wild). Lengkuas putih biasanya digunakan untuk bumbu masakan dan lengkuas merah dimanfaatkan sebagai obat (Hernani et al., 2007). Lengkuas berkhasiat untuk mengobati panu, bronkhitis, masuk angin, dan diare.
Gambar 1. Lengkuas Merah (A) (Dokumentasi pribadi) dan
lengkuas Putih (B) (Ulfah, 2013).
Secara umum ada dua jenis lengkuas yang dikenal, yaitu lengkuas merah
(Alpinia purpurata K. Schum) dan lengkuas putih (Alpinia galanga (L) Wild). Lengkuas putih biasanya digunakan untuk bumbu masakan dan lengkuas merah
dimanfaatkan sebagai obat (Hernani et al., 2007). Lengkuas berimpang merah memiliki batang semu berukuran tinggi 1-1,5 m, diameter batang 1 cm, dan
diameter rimpang 2 cm (Budiarti, 2007). Lengkuas berimpang putih mempunyai
6
batang semu setinggi 3 m, diameter batang 2,5 cm, dan diameter rimpang 3-4 cm.
Lengkuas merah merupakan tanaman obat yang telah dibuktikan berbagai
penelitian memiliki daya antijamur dibandingkan jenis lengkuas putih.
Kandungan minyak atsiri dan komponen antijamur pada lengkuas merah,
memiliki konsentrasi yang lebih tinggi dibandingkan pada lengkuas putih
(Budiarti, 2007).
2.1.2. Kandungan Bioaktif 2.1.2.1. Senyawa Fenolik
Senyawa fenolik terdiri atas molekul-molekul besar dengan beragam
struktur, karakteristik utamanya adalah adanya cincin aromatik yang memiliki
gugus hidroksil. Kebanyakan senyawa fenolik termasuk ke dalam kelompok
flavonoid (Pratt dan Hudson, 1990). Perasan rimpang lengkuas mempunyai daya
hambat dan daya bunuh terhadap bakteri karena mengandung minyak atsiri antara
lain alkohol, senyawa fenol termasuk flavonoid dan deterjen yang bersifat
bakterisidal. Flavonoid merupakan senyawa fenol bekerja dengan cara
mendenaturasi protein dan merusak membran sel bakteri. Denaturasi protein
menyebabkan aktivitas metabolisme sel terhenti karena berhentinya semua
aktivitas metabolisme berakibat pada kematian sel bakteri (Sumayani et al., 2008).
Selain itu, komponen bioaktif pada rempah-rempah, khususnya dari famili
7
Komponen flavonol yang banyak tersebar pada tanaman misalnya yang terdapat pada lengkuas adalah galangin, kaemferol, kuersetin, dan mirisetin. Salah satu golongan flavonoid adalah kalkon. Kalkon adalah komponen yang berwarna kuning terang. Komponen lainnya yang ditemukan pada Alpinia adalah flavonon. Komponen flavonon dan dihidroflavonol dikenal sebagai senyawa yang bersifat fungistatik dan fungisida dan yang terdapat pada tumbuhan Alpinia dan Kaempferia dari golongan Zingiberaceae adalah alpinetin (Hemzela, 2006). Pada minyak atsiri lengkuas, seperti telah diteliti oleh Scheffer et al. (1981) dan De Pooter et al. (1985) terdapat senyawa 1,8-sineol, a-pinen, limonen, terpineol, tujon, mirsen. Masing-masing komponen tersebut mempunyai aktivitas bioaktif seperti terlihat pada Tabel 1.
Tabel 1. Aktivitas beberapa komponen bioaktif pada rempah-rempah (Duke, 1994).
Jenis Komponen Beberapa aktivitas bioaktif
1,8-sineol Antiseptik, bakterisida, herbisida, insektifuga
a-pinen Pencegah kanker. Insektifuga
Limonen Antikanker, herbisida, insektisida
Terpineol Antialergik, antiseptik, bakterisida, insektifuga
Tujon Herbisida
Kaemferol Antifertilitas, antioksidan, pencegah kanker, mutagenik
Kuersetin Antioksidan, bakterisida, mutagenik, antifeedant
Mirisetin Antifeedant, pencegah kanker
Mirsen Bakterisida, insektifuga
Senyawa antijamur dari lengkuas yang sangat efektif untuk menghambat
8 (E)-8β, 17 epoksilabd-12-en-15, 16-dial, (E)-8-(17)-12-labadiene-15, 16-dial, dan galanolakton. Senyawa-senyawa tersebut termasuk dalam golongan diterpen (Parwata, 2008).
2.1.2.2. 1’-Asetosikhavikol Asetat (ACA).
Lengkuas merah merupakan tanaman obat yang telah dibuktikan berbagai
penelitian memiliki daya antijamur dibandingkan jenis lengkuas putih.
Kandungan minyak atsiri dan komponen antijamur pada lengkuas merah,
memiliki konsentrasi yang lebih tinggi dibandingkan pada lengkuas putih
(Budiarti, 2007).
Komponen kimia utama yang memberikan aroma pada lengkuas adalah
senyawa asetoksihavikol asetat (ACA/ galangal asetat) yang bersifat sebagai anti alergi, antioksidan, dan antijamur (Hernani, 2010). De Pooter et al. (1985) menyatakan bahwa rimpang lengkuas mengandung senyawa 1’-asetosikhavikol
asetat sekitar 0,5-1% dari minyak atsiri rimpang lengkuas segar dengan metode
destilasi uap, sedangkan Kondo et al. (1993) menemukan senyawa ACA sebesar lebih kurang 0,11% (per 100 gram bahan lengkuas segar) yang diperoleh dengan
metode kromatografi kinerja tinggi (HPLC) preparatif.
ACA termasuk kelompok monoterpen, tergolong ke dalam fenil propanoid
yang diduga berasal dari jalur sikhimat. ACA larut dalam pelarut yang semipolar
seperti etil asetat, diklorometana atau kloroform. ACA memiliki nama lain yaitu
9
ACA juga memiliki titik didih 325,4˚C dalam 760 mmHg (CAS). Struktur ACA
dapat dilihat pada gambar 2.
Gambar 2. Struktur Kimia 1’-Asetoksihavikol asetat (Stecher, 1968).
ACA diduga berasal dari jalur sikhimat dan disintesis melalui jalur
metabolisme yang berasal dari L-fenilalanin dan atau L-tirosin, selanjutnya akan
dihasilkan asam p-kumarat, sampai akhirnya terbentuk senyawa ACA (Manitto,
1992 ; Mann 1994).
Analisis kadar ACA lengkuas merah menggunakan GC-MS bertujuan
untuk untuk identifikasi atau penentuan kadar ACA yang dikandungnya Analisis
GC-MS menunjukkan bahwa senyawa utama ekstrak lengkuas adalah 1,
8-cineole, β- bisaboline dan β -selinene. Sedangkan α-selinene, farnesene, asam
1,2-benzenedicarboxylic, germacrene B dan pentadekana adalah komponen kecil. 1,
8-Cineole adalah monoterpen teroksigenasi, sementara β-caryophyllene adalah
10
Gambar 3. Struktur kimia dari beberapa kandungan utama lengkuas (Chudiwal et al., 2010).
2.2. Ekstraksi
Ekstraksi adalah pemisahan suatu zat dengan pembagian antara dua
pelarut yang tidak dapat bercampur untuk mengambil zat terlarut tersebut dari
suatu pelarut ke pelarut lain (Setyowati, 2009). Serbuk yang diekstrak
mengandung senyawa aktif yang dapat larut dan tidak dapat larut dalam pelarut
organik seperti serat, karbohidrat, protein dan lain-lain. Senyawa aktif yang
terdapat dalam berbagai serbuk dapat digolongkan ke dalam golongan minyak Galanga
1’S’-1’-hydrotoxychavicol acetate 1’S’-1’-acetoxyeugenol acetate
11
atsiri, alkaloid, flavonoid dan lain-lain. Struktur kimia yang berbeda-beda dapat
mempengaruhi kelarutan serta stabilitas senyawa-senyawa tersebut terhadap
pemanasan, udara, cahaya, logam berat dan derajat keasaman. Diketahuinya
senyawa aktif yang dikandung dalam serbuk dapat mempermudah pemilihan
pelarut dan cara ekstraksi yang tepat.
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi
senyawa dari serbuk nabati atau serbuk hewani menggunakan pelarut yang sesuai,
kemudian pelarut diuapkan sehingga diperoleh massa atau serbuk yang tersisa
diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan (Soesilo,
1989). Beberapa faktor utama yang diperlukan pada pemilihan pelarut yaitu
selektivitas, ekonomis, dan ramah lingkungan. Pemekatan dan penguapan
(evaporasi) merupakan proses penguapan pelarut sehingga diperoleh ekstrak kental atau pekat (Soesilo, 1989).
2.2.1. Pelarut Organik
Proses ekstraksi didasarkan pada kelarutan komponen terhadap komponen
lain dalam campuran. Kelarutan suatu komponen tergantung pada derajat
kepolarannya. Pelarut organik berdasarkan konstanta elektrikum dapat dibedakan
menjadi dua yaitu pelarut polar dan pelarut non-polar. Konstanta dielektrikum
dinyatakan sebagai gaya tolak-menolak antara dua partikel yang bermuatan listrik
dalam suatu molekul. Semakin tinggi konstanta dielektrikumnya maka pelarut
12
beberapa pelarut organik berdasarkan nilai konstanta dielektriknya dapat dilihat
pada Tabel 2 berikut.
Tabel 2. Konstanta dielektrikum pelarut organik
Pelarut Rumus Kimia Tititk Didih Konstanta
Dielektrik
Ekstraksi dapat menggunakan pelarut tunggal dan pelarut campuran. Pelarut
campuran yang biasa digunakan yaitu campuran air dan etanol, campuran air dan
metanol, campuran air dan eter (Agoes, 2007). Menurut Guenther (1987), syarat
pelarut yang digunakan pertama harus bersifat selektif artinya pelarut harus dapat
melarutkan semua senyawa dengan cepat. Syarat kedua harus mempunyai titik
didih yang cukup rendah. Hal ini supaya pelarut mudah dapat diuapkan tanpa
menggunakan suhu tinggi, namun titik didih pelarut tidak boleh terlalu rendah
karena akan mengakibatkan kehilangan akibat penguapan. Syarat ketiga bersifat
inert artinya pelarut tidak bereaksi dengan komponen minyak.
2.2.2. Cara Ekstraksi
Metode ekstraksi menggunakan pelarut dapat dibagi menjadi dua
berdasarkan temperatur yang digunakan (Ritiasa, 2000), yaitu:
13
1. Maserasi, ialah suatu proses pengekstrak serbuk dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada
temperatur ruang. Metode maserasi digunakan untuk mengekstrak serbuk
yang mengandug komponen kimia yang mudah larut dalam cairan
pengekstrak. Cairan pengekstrak akan masuk ke dalam sel melewati
dinding sel. Isi sel akan larut karena adanya perbedaan konsentrasi antara
larutan di dalam sel dengan di luar sel. Larutan yang konsentrasinya
tinggi akan terdesak keluar dan diganti oleh cairan pengekstrak dengan
konsentrasi rendah (proses difusi). Peristiwa tersebut berulang sampai
terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam
sel.
2. Perkolasi, ialah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan. Prinsip
perkolasi yaitu serbuk sampel ditempatkan dalam suatu bejana silinder,
yang bagian bawahnya diberi sekat berpori. Cairan pengekstrak dialirkan
dari atas ke bawah melalui serbuk tersebut, cairan pengekstrak akan
melarutkan zat aktif sel-sel yang dilalui sampai mencapai keadaan jenuh.
Gerak kebawah disebabkan adanya gaya gravitasi, dikurangi dengan daya
kapiler yang cenderung untuk menahan. Kekuatan yang berperan pada
perkolasi antara lain: gaya berat, kekentalan, daya larut, tegangan
permukaan, difusi, osmosis, adhesi dan daya kapiler. Secara umum proses
perkolasi ini dilakukan pada temperatur ruang. Sedangkan parameter
14
senyawa lagi berdasarkan pengamatan secara fisik pada ekstraksi bahan
alam terlihat pada tetesan perkolat yang sudah tidak berwarna.
2. Cara panas, terdiri dari:
1. Refluks, ialah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendinginan balik. Ekstraksi dengan refluks digunakan
untuk bahan-bahan yang tahan terhadap pemanasan. Penarikan komponen
kimia yang dilakukan dengan cara sampel dimasukkan ke dalam labu alas
bulat bersama-sama dengan cairan pengekstrak lalu dipanaskan, uap-uap
cairan ekstrak terkondensasi pada kondesor menjadi molekul-molekul
cairan pengekstrak yang akan turun kembali menuju labu alas bulat, akan
mengekstrak kembali sampel yang berada pada labu alas bulat, demikian
seterusnya berlangsung secara berkesinambungan sampai penyaringan
sempurna, penggantian pelarut dilakukan sebanyak 3 kali setiap 3-4 jam.
Filtrat yang diperoleh dikumpulkan dan dipekatkan.
2. Sokhletasi, ialah ekstraksi menggunakan pelarut yang selalu baru pada
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi secara
terus-menerus dengan jumlah pelarut relatif konstan dengan adanya
pendinginan balik (Ritiasa, 2000). Sokhletasi merupakan metode ekstraksi
dengan cara pemanasan dan terjadi sirkulasi pelarut yang membasahi
sampel. Akan tetapi proses ini hanya cocok untuk senyawa organik yang
15
3. Digestasi, ialah maserasi kinetik (dengan adanya pengadukan) pada
temperatur yang lebih tinggi dari temperatur ruangan. Pada umumnya
dilakukan pada suhu 40-50ºC (Ritiasa, 2000).
2.3. Kandungan Senyawa Fenolik
Pengujian total fenolik dilakukan dengan metode Folin Ciocalteau yang
didasarkan pada kemampuan senyawa fenolik bereaksi dengan oksidator
fosfomolibdat dibawah kondisi alkalis menghasilkan senyawa fenolat dan
kompleks molibdenum-tungsten berwarna biru. Reagen ini tidak bersifat spesifik
untuk senyawa fenol dan warna yang dihasilkan sangat tergantung pada gugus
hidroksi dan kedudukan gugus tersebut dalam struktur molekul. Warna biru yang
dihasilkan tidak hanya ditentukan oleh jumlah senyawa fenolik yang ada, tetapi
juga oleh variasi struktur dan agen-agen pereduksi non fenolik (Julkunen-Tiito,
1985).
Gambar 4. Reaksi Pembentukan Kompleks Molibdenum-Tungsten Blue
(Julkunen-Tiito, 1985).
Penggunaan asam galat sebagai standar pengujian karena asam galat (asam
3,4,5-trihidroksibenzena) memiliki gugus hidroksil dan ikatan rangkap
16
bereaksi membentuk kompleks dengan reagen Folin-Ciocalteau serta merupakan
unit penyusun senyawa fenolik (Rorong dan Suryanto, 2010). Reaksi uji dapat
dilihat pada gambar 4.
Pada saat direaksikan antara reagen Folin-Ciocalteau dengan senyawa
fenolik akan terjadi perubahan warna dari kuning menjadi biru. Intensitas warna
biru ditentukan dengan banyaknya kandungan fenol dalam larutan sampel.
Semakin besar konsentrasi senyawa fenolik dalam sampel semakin pekat warna
biru yang terlihat. Menurut Singleton dan Rossi (1965), warna biru yang teramati
berbanding lurus dengan konsentrasi ion fenolat yang terbentuk, semakin besar
konsentrasi senyawa fenolik maka semakin banyak ion fenolat yang terbentuk
sehingga warna biru yang dihasilkan semakin pekat. Nely (2007) mengatakan
penambahan larutan Na2CO3 pada uji fenolik bertujuan untuk membuat suasana
basa agar terjadi reaksi reduksi Folin-Ciocalteau oleh gugus hidroksil dari fenolik
di dalam sampel.
Spektrofotometer Uv-Vis (Harmita, 2006)
Spektrum Uv-Vis merupakan hasil interaksi antara radiasi elektromagnetik (REM) dengan molekul. REM merupakan bentuk energi radiasi yang memiliki
sifat gelombang dan partikel (foton). REM bersifat sebagai gelombang maka
perlu diketahui beberapa parameter, seperti panjang gelombang, frekuensi,
bilangan gelombang dan serapan. REM memiliki vektor listrik dan magnet yang
bergetar dalam bidang yang tegak lurus satu sama lain dan masing-masingnya
17
Spektrofotometer digunakan untuk mengukur besarnya energi yang
diabsorbsi atau diteruskan. Jika radiasi monokromatik melewati larutan
mengandung zat yang dapat menyerap, maka radiasi ini akan dipantulkan,
diabsorbsi oleh zat tersebut dan sisanya akan ditransmisikan.
Lambert dan Beer telah menurunkan secara empiris hubungan antara
intensitas cahaya yang ditransmisikan dengan tebalnya larutan dan hubungan
antara intensitas tersebut dengan konsentrasi zat. Hukum Lambert-Beer:
dimana: Po = Intensitas cahaya masuk
P = Intensitas cahaya keluar
c = Konsentrasi zat yang menyerap sinar
k = Tetapan
Hukum Lambert menyatakan bahwa bila suatu cahaya monokromatik
dialirkan pada suatu media yang transparan, maka bertambah turunnya cahaya
berbanding lurus dengan panjang media penyerapan cahaya. Hal itu juga dapat
ditulis dengan persamaan berikut:
dimana: Po = Intensitas cahaya masuk
P = Intensitas cahaya keluar
b = Konsentrasi zat yang menyerap sinar
k = Tetapan
Jadi, apabila hukum Beer-Lambert digabung dapat dinyatakan bahwa bila
18
berbanding lurus dengan media penyerap dan konsentrasi media penyerap. Hal ini
dapat dinyatakan dengan persamaan:
dimana: Po = Intensitas cahaya masuk
P = Intensitas cahaya keluar
c = Konsentrasi zat yang menyerap sinar
A = Absorbansi (Sinar yang diserap)
a = Absortivitas spesifik (jika c dalam gr/L)
b = Ketebalan media yang dilalui sinar
E = Extingsi (Absortivitas molar (jika c dalam mol/L).
Ada empat bagian penting dalam spektofotometer UV-Vis yaitu:
1. Lampu
Berkas cahaya putih yang keluar dari lampu ini adalah kombinasi dari semua
panjang gelombang spektrum tampak (visible).
2. Monokromator
Bagian yang mengisolasi suatu pita dengan panjang gelombang yang sempit dari
dalam semua energi cahaya yang memasukinya.
3. Phototube
Tempat ditaruhnya sampel yang akan diradiasi.
4. Detektor
Suatu piranti yang mengubah energi radiasi menjadi energi listrik yang
19
5. Sistem Komputer
Suatu program untuk menerjemahkan sistem dari penurunan intensitas cahaya
akibat absopsi oleh sampel berbanding dengan konsentrasinya serta menyimpan
data kurva kalibrasi atau hasil uji sebelumnya (Munifah, 2005).
Gambar 5. Sistem Komponen Spektrometer UV-Vis (Munifah, 2005) Spektrometer UV-Vis memiliki kemampuan untuk mengukur konsentrasi
suatu sampel baik yang tidak berwarna maupun yang berwarna. Larutan tanpa
warna akan diabsorpsi pada panjang gelombang lebih rendah dari 400 nm oleh
sinar UV, sedangkan larutan yang berwarna akan diabsorpsi pada kisaran panjang
gelombang antara 400 nm hingga 780 nm. Panjang gelombang absorpsi biasanya
dilaporkan sebagai max, yaitu panjang gelombang pada titik tertinggi kurva.
2.4. Salak Pondoh
2.4.1. Karakteristik
Salak (Salacca edulis) merupakan tanaman buah yang disukai dan mempunyai prospek yang baik untuk diusahakan. Tanaman salak termasuk famili
20
Salak merupakan salah satu buah tropis yang banyak diminati oleh orang. Buah
salak memiliki kandungan gizi yang cukup tinggi (Tim Karya Mandiri, 2010).
Buah salak terdiri atas kulit buah, daging buah dan biji. Sisik kulit buah
menjadi satu dengan kulit buahnya. Kulit buah sangat tipis, tebalnya sekitar 0,3
mm. Sedangkan kulit luar buah salak berfungsi sebagai pelindung alami terhadap
daging buah yang dibungkusya terhadap pengaruh keadaan lingkungan. Daging
buah tidak berserat berwarna putih kekuningan, kuning kecoklatan, atau merah
tergantung varietasnya. Rasa buah manis, manis agak asam, manis agak sepet atau
manis bercampur asam dan sepet. Dalam 1 buah salak mengandung 1-3 biji.
Bijinya berwarna coklat berbentuk persegi dan berkeping satu (Nazarudin dan
Kristiawati, 1992).
Umur buah salak yang baik untuk dipasarkan adalah antara 6-7 bulan sejak
keluarnya bunga, tetapi jika musim hujan tiba pada saat buah salak sudah
membesar (4-5 bulan), maka petani memanen buahnya lebih awal dari biasanya.
Hal ini disebabkan karena buah salak tersebut cepat membesar sehingga terjadi
ketidak seimbangan dalam membesarkan kulit dan isi mengakibatkan kulit buah
pecah sebelum mencapai umur 6-7 bulan (Sumarto, 1976).
Menurut Nazaruddin dan Kristiawati, (1992) buah salak yang sudah masak
umumnya mempunyai ciri-ciri seperti di bawah ini :
a. Kulit buah bersih mengkilap dan susunan sisiknya tampak lebih renggang.
b. Bila buah dipetik, mudah sekali terlepas dari tandan buah.
c. Biji salak berwarna coklat gelap kehitaman.
21
e. Bila dicium menyebar aroma salak dan bila dimasukan kedalam air akan
terapung.
Diantara bermacam-macam salak yang ada, salak pondoh merupakan salak
yang paling disukai oleh konsumen. Salak pondoh merupakan salah satu varietas
salak yang banyak dibudidayakan di daerah Sleman, Yogyakarta. Tanaman salak
pondoh mempunyai batang pendek, berumah dua, berduri banyak, tumbuh tegak
dengan ketinggian 3-7 meter dari atas permukaan tanah, batang beruas banyak,
perakaran dangkal dan kuat, daun majemuk menyirip dengan ujung anak daun
lebih lebar (Santosa, 1990). Buah salak pondoh pada umumnya lebih kecil
daripada buah salak jenis lain. Namun dewasa ini dikenal jenis salak pondoh
ekspor yang ukurannya normal seperti buah salak biasa. Warna kulit salak pondoh
bervariasi mulai dari coklat kehitaman, coklat kemerahan, kuning kemerahan,
coklat kekuningan dan merah gelap kehitaman dengan rasa buahnya yang manis
(Santoso, 1990).
Salak pondoh memiliki keistimewaan yang tidak dimiliki oleh salak
varietas lain yaitu telah manis ketika buah masih muda. Namun kelemahan dari
buah ini adalah umur simpannya setelah panen sangat singkat. Menurut
Tranggono (1992), buah salak pondoh yang telah dipetik dan disimpan pada suhu
kamar, pada hari ke 10 sudah menunjukkan tanda-tanda kebusukan dan tidak
layak dikonsumsi.
Adapun komposisi kimia dari daging buah salak pondoh dalam setiap 100 g
22
Tabel 3. Komposisi kimia daging buah salak pondoh
Komposisi Kadar
sangat besar. Kerusakan oleh mikrobia dianggap faktor utamanya. Infeksi oleh
mikroba yang terjadi melalui luka pada saat panen atau sesudahnya merupakan
kerugian utama yang menyebabkan pembusukan buah. Perkembangan selanjutnya
setelah terjadi infeksi bergantung pada kemampuan enzimatis patogen dan kondisi
fisiologis jaringan inang yang meliputi kelembaban, kemudahan untuk diserang
patogen, dan ketahanan jaringan inang sebelum proses infeksi sempurna
(Novianti, 2009).
Kebanyakan buah mempunyai pH yang rendah (<4,5). Ini berarti kerusakan
mikrobiologis yang mungkin timbul disebabkan oleh jamur perusak pangan,
23
daya perusaknya maka jamur perusak pangan dapat dikelompokkan menjadi 2
yaitu, jamur yang merusak tanaman sebelum panen dan jamur yang menyerang
komoditas setelah panen. Sifat pertumbuhan yang khas dari jamur adalah
berbentuk kapas dan biasanya terlihat pada buah-buahan yang membusuk.
Pertumbuhannya dapat berwarna hitam, putih, atau berbagai macam warna.
Adanya jamur pada buah atau sayuran dapat menimbulkan kerusakan sangat hebat
hingga merusak jaringan tanaman hingga menyerupai bubur (Novianti, 2009).
2.4.3. Mikroba Perusak Salak
Bahan pangan yang berasal dari tumbuh-tumbuhan merupakan bahan yang
mudah rusak (perishable), misalnya buah salak yang memar sehingga daging buahnya menjadi berwarna coklat. Buah salak yang ketika dipanen berasa manis,
namun setelah dibiarkan beberapa hari kemudian daging buah berangsur-angsur
melunak dan kemudian menjadi berasa asam karena perubahan oleh enzim. Hal
ini terjadi disebabkan adanya kerusakan mikrobiologis oleh bakteri, ragi dan
jamur karena kondisi bahan sesuai dengan kebutuhan hidup mikroba. Pembusukan
buah salak disebabkan oleh tiga jenis jamur yaitu Ceratocystis paradoxa, Fusarium sp, dan Aspergilus sp (Novianti, 2009). Menurut Oka (1964) dalam Semangun (1989) pembusukan buah salak pondoh kadang-kadang juga
disebabkan oleh bakteri, Erwinia carotovora. Namun, kerusakan oleh mikroba yang paling utama disebabkan oleh kapang.
2.4.3.1. Kapang
Kapang adalah sekelompok mikroba yang tergolong dalam fungi dengan
24
dalam mikrobiologi pangan karena selain berperan penting dalam industri
makanan, kapang juga banyak menjadi penyebab kerusakan pangan. Kapang
adalah fungi multiseluler yang mempunyai filamen dan pertumbuhannya pada
makanan mudah dilihat karena penampakannya yang berserabut seperti kapas.
Pertumbuhannya mula-mula akan berwarna putih, tetapi jika spora telah timbul
akan terbentuk berbagai warna tergantung dari jenis kapang.
Sifat fisiologi kapang (Waluyo, 2007), yaitu: (1) Umumnya kebanyakan
kapang membutuhkan water activity (aw) minimal untuk pertumbuhan lebih rendah dibandingkan dengan khamir dan bakteri. Kadar air bahan pangan kurang
dari 14-15%, misalnya pada beras dan serealia, dapat menghambat atau
memperlambat pertumbuhan kebanyakan khamir; (2) Kebanyakan kapang bersifat
mesofilik yaitu tumbuh baik pada suhu kamar. Suhu optimum pertumbuhan untuk
kebanyakan kapang adalah sekitar 25-300C tetapi beberapa dapat tumbuh pada
suhu 35-37°C atau lebih tinggi. Beberapa kapang bersifat psikrotrofik dan
beberapa bersifat termofilik; (3) Semua kapang bersifat aerobik, yaitu
membutuhkan oksigen untuk pertumbuhannya. Kebanyakan kapang dapat pada
kisaran pH yang luas, yaitu 2-8,5 tetapi biasanya pertumbuhannya akan lebih baik
pada kondisi asam atau pH rendah; (4) Pada umumnya kapang dapat
menggunakan berbagai komponen makanan, dari yang sederhana hingga
kompleks. Kebanyakan kapang memproduksi enzim hidrolitik, misal amylase,
pektinase, proteinase dan lipase, oleh karena itu dapat tumbuh pada
makanan-makanan yang mengandung pati, pektin, protein atau lipid, dan (5) Beberapa
25
Komponen itu disebut antibiotik,misalnya penisilin yang diproduksi oleh
Penicillium chrysogenum dan clavasin yang diproduksi oleh Aspergillus clavatus. Pertumbuhan kapang biasanya berjalan lambat bila dibandingkan dengan
pertumbuhan khamir dan bakteri. Oleh karena itu jika kondisi pertumbuhan
memungkinkan semua mikroorganisme untuk tumbuh, kapang biasanya kalah
dalam kompetisi dengan khamir dan bakteri. Tetapi sekali kapang dapat mulai
tumbuh, pertumbuhan yang ditandai dengan pembentukan miselium dapat
berlangsung dengan cepat.
2.4.3.2. Klasifikasi Kapang
Berdasarkan ada tidaknya septa dibedakan beberapa kelas (Waluyo, 2007)
yaitu :
1. Kapang tidak bersepta
a. Kelas Oomycetes (spora seksual disebut oospora) terdiri dari ordo
saprolegniales (spesies Saprolegnia) dan ordo Peronosporales (spesies Pythium).
b. Kelas Zygomycetes (spora seksual zigospora) terdiri dari ordo Mucorales
(spora aseksual adalah sporangiospora) seperti : Mucor mucedo, Zygorrhynchus, Rhizopus, Absidia dan Thamnidium.
2. Kapang bersepta
a. Kelas fungi tidak sempurna (imperfecti) tidak mempunyai spora
seksual
26
a). Famili Monialiaceae: Aspergillus, Penicillium, Trichothecium, Geotrichum, Neurospora, Sporatrichum, Botrytis, Cephalosporium, Trichoderma, Scopulariopsis, Pullularia.
b). Famili Dematiceae: Cladosporium, Helminthosporium, Alternaria, Stempylium.
c). Famili Tuberculariaceae : Fusarium
d). Famili Cryptococcaceae (fungsi seperti khusus atau false yeast) :
Candida (khamir), Cryptococcus
e). Famili Rhodotorulacee : Rhodotorula (khamir).
2). Ordo Melanconiales : Colletotrichum, Gleosporium, Pestalozzia. 3). Ordo Sphaeropsidales (konidia berbentuk botol, dinamakan piknidia) :
Phoma, Dlipodia.
b. Kelas Ascomycetes. Spora seksual adalah askospora, sperti : jenis
Endomyces, Monascus, Sclerotinia. Yang termasuk dalam fungi imperfecti: Neurospora, Eurotium (tahap seksual dari Aspergillus), dan Penicillium.
2.4.3.3. Morfologi Kapang
Kapang terdiri dari suatu thallus yang tersusun dari filamen yang
bercabang yang disebut dengan hifa. Kumpulan dari hifa disebut dengan
miselium. Hifa tumbuh dari spora yang melakukan germinasi membentuk suatu
tuba germ, dimana tuba ini akan tumbuh terus membentuk filamen yang panjang
27
massa hifa yang disebut miselium. Pembentukan miselium merupakan sifat yang
membedakan grup-grup didalam fungi.
Hifa dapat dibedakan menjadi dua macam yaitu hifa vegetatif atau hifa
tumbuh dan hifa fertil yang membentuk bagian reproduksi. Pada kebanyakan
kapang hifa fertil tumbuh di atas permukaan, tetapi pada beberapa kapang
mungkin terendam. Penyerapan nutrien terjadi pada permukaan miselium.
Sifat-sifat kapang baik penampakan makroskopik ataupun mikroskopik
digunakan untuk identifikasi dan klasifikasi kapang. Kapang dapat dibedakan
menjadi dua kelompok berdasarkan struktur hifa yaitu hifa tidak bersekat atau
nonseptat dan hifa bersekat atau septatyang membagi hifa dalam
ruangan-ruangan, dimana setiap ruangan mempunyai satu atau lebih inti sel (nukleus).
Dinding penyekat yang disebut septum tidak tertutup rapat sehingga sitoplasma
masih bebas bergerak dari suatu ruangan ke ruangan lainnya.
Gambar 6. (a) Struktur Morfologi Aspergillus secara umum; (b) Hifa bersekat dan
tidak bersekat (Benson, 2001).
2.5. Antimikroba
Mikroorganisme dapat menyebabkan rusaknya bahan pangan, infeksi, dan
menimbulkan penyakit. Mikroorganisme dapat disingkirkan, dihambat, dan
28
dibunuh dengan cara fisik maupun kimia. Senyawa antimikroba adalah zat yang
dapat menghambat pertumbuhan mikroba dan dapat digunakan untuk kepentingan
pengobatan infeksi pada manusia, hewan, dan tumbuhan. Antimikroba meliputi
antibakteri, antifungal, antiprotozoa, dan antivirus (Inayati, 2007).
2.5.2. Jenis-Jenis Antimikroba
Antifungi/antimikroba adalah suatu bahan yang dapat mengganggu
pertumbuhan mikroorganisme. Pemakaian bahan antimikroba umumnya dalam
suatu usaha untuk mengendalikan bakteri maupun jamur. Pengendalian mikroba
yaitu segala kegiatan yang dapat menghambat, membasmi, atau menyingkirkan
mikroorganisme. Tujuan utama pengendalian mikroorganisme untuk mencegah
pembusukan dan perusakan oleh mikroorganisme, mencegah penyebaran penyakit
dan infeksi, dan membasmi mikroorganisme pada inang yang terinfeksi. Ada
beberapa persyaratan yang harus dipenuhi oleh suatu bahan antimikroba, seperti
mampu mematikan mikroorganisme, mudah larut dan bersifat stabil, tidak bersifat
racun bagi manusia dan hewan, tidak bergabung dengan bahan organik, efektif
pada suhu kamar dan suhu tubuh, tidak menimbulkan karat dan warna,
berkemampuan menghilangkan bau yang kurang sedap, murah dan mudah didapat
(Pelczar & Chan 1988).
Upaya pengendalian penyakit pada buah yang disebabkan oleh jamur
selama pasca panen umumnya dilakukan menggunakan fungisida (Pantastico,
29
fungisida sintetis, sedangkan fungisida alami tidak mengandung bahan aktif yang
membahayakan.
Gambar 7. Struktur Kimia Benomyl (Mnif et al., 2011)
2.5.3. Mekanisme Kerja Antimikroba
Mekanisme kerja antijamur dapat dikelompokkan menjadi dua. Pertama,
sebagai pengganggu membran sel, gangguan ini terjadi karena adanya ergosterol
dalam sel jamur, ini adalah komponen sterol yang sangat penting dan sangat
mudah diserang oleh antibiotik turunan polien. Kompleks polien-ergosterol yang
terjadi dapat membentuk suatu pori dan melalui pori tersebut konstituen essensial
sel jamur seperti ion K, fosfat anorganik, asam karboksilat, asam amino dan ester
fosfat bocor keluar hingga menyebabkan kematian sel jamur. Penghambatan
biosintesis ergosterol dalam sel jamur, mekanisme ini merupakan mekanisme
yang disebabkan oleh senyawa turunan imidazol karena mampu menimbulkan
ketidakteraturan membran sitoplasma jamur dengan cara mengubah permeabilitas
membran dan mengubah fungsi membran dalam proses pengangkutan senyawa –
senyawa essensial yang dapat menyebabkan ketidakseimbangan metabolik
sehingga menghambat pertumbuhan atau menimbulkan kematian sel jamur
30
Kedua, melalui hambatan sintesis asam nukleat dan protein jamur,
merupakan mekanisme yang disebabkan oleh senyawa turunan pirimidin. Efek
antijamur terjadi karena senyawa turunan pirimidin mampu mengalami
metabolisme dalam sel jamur menjadi suatu antimetabolit. Metabolik antagonis
tersebut kemudian bergabung dengan asam ribonukleat dan kemudian
menghambat sintesis asam nukleat dan protein jamur. Penghambatan mitosis
jamur, efek antijamur terjadi karena senyawa antibiotik griseofulvin yang mampu
mengikat protein mikrotubuli dalam sel, kemudian merusak struktur spindle mitotic dan menghentikan metafasa pembelahan sel jamur (Sholichah, 2010).
Pengujian aktivitas bahan antimikroba secara in vitro dapat dilakukan
melalui dua cara. Cara pertama yaitu metode dilusi, cara ini digunakan untuk
menentukan kadar hambat minimum dan kadar bunuh minimum dari bahan
antimikroba. Prinsip dari metode dilusi menggunakan satu seri tabung reaksi yang
diisi medium cair dan sejumlah tertentu sel mikroba yang diuji. Selanjutnya
masing-masing tabung diisi dengan bahan antimikroba yang telah diencerkan
secara serial, kemudian seri tabung diinkubasi pada suhu 37˚C selama 18-24 jam
dan diamati terjadinya kekeruhan konsentrasi terendah bahan antimikroba pada
tabung yang ditunjukkan dengan hasil biakan yang mulai tampak jernih (tidak ada
pertumbuhan jamur merupakan konsentrasi hambat minimum). Biakan dari semua
tabung yang jernih ditumbuhkan pada medium agar padat, diinkubasi selama 24
jam, dan diamati ada tidaknya koloni jamur yang tumbuh (Tortora et al, 2001).
Cara kedua yaitu metode difusi cakram (Uji Kirby-Baner). Prinsip dari
31
mengandung bahan antimikroba tertentu pada medium lempeng padat yang telah
dicampur dengan jamur yang akan diuji. Medium ini kemudian diinkubasi pada
suhu 37˚C selama 18-24 jam, selanjutnya diamati adanya zona jernih disekitar
kertas cakram. Daerah jernih yang tampak di sekeliling kertas cakram
menunjukkan tidak adanya pertumbuhan mikroba. Jamur yang sensitif terhadap
bahan antimikroba akan ditandai dengan adanya daerah hambatan disekitar
cakram, sedangkan jamur yang resisten terlihat tetap tumbuh pada tepi kertas
cakram (Tortora et al, 2001).
Penentuan daya antimikroba didasarkan pada besarnya zona hambat yang
terbentuk, dinyatakan dalam tiga kategori (Lorian, 1980), yaitu:
1. Zona hambat total yaitu bila zona hambat yang terbentuk di sekitar silinder
terbentuk jernih.
2. Zona hambat parsial yaitu bila di dalam zona hambat yang terbentuk masih
terdapat adanya pertumbuhan beberapa koloni jamur.
3. Zona hambat nol yaitu bila tidak ada zona hambat yang terbentuk disekeliling
32 BAB III
METODOLOGI PENELITIAN
3.1.Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Balai Besar Penelitian dan Pengembangan
Pascapanen Pertanian yang bertempat di Cimanggu-Bogor. Penelitian
dilaksanakan mulai dari bulan Maret 2014 sampai dengan bulan Oktober 2014.
3.2. Alat dan Bahan
3.2.1. Alat
Alat yang digunakan dalam penelitian ini adalah Erlenmeyer, tabung
reaksi, rak tabung reaksi, cawan petri, pipet tetes, pipet mikro, gelas ukur, gelas
piala, kertas saring, labu ukur, autoklaf, rotary evaporator, sentrifuge, cover glass,
Spektrofotometer UV-Vis Cary 60, dan Mikroskop Trinokular LW Scientific.
3.2.2. Bahan
Bahan yang digunakan dalam penelitian ini adalah lengkuas merah dari
daerah Bogor, buah salak pondoh yang telah busuk, pelarut n-heksana, pelarut
etil asetat, akuades, tween 80, larutan benomyl 500 ppm, larutan natrium klorida,
33 3.3. Metode Penelitian
3.3.1. Pembuatan Ekstrak
Bahan baku rimpang lengkuas merahyang berumur ± 7 bulan, dicuci dan
dibersihkan dari kotoran yang melekat. Setelah itu rimpang lengkuas dikecilkan
ukurannya melalui pengirisan, dan kemudian diparut. Selanjutnya, dilakukan
pembuatan ekstrak secara maserasi dengan empat jenis pelarut, yaitu air dingin,
air panas, pelarut n-heksana dan pelarut etil asetat.
1.3.1.1. Ekstraksi lengkuas dengan air dingin (akuades)
Lengkuas yang sebelumnya telah diparut ditimbang sebanyak 50 g, lalu
dimasukkan ke dalam gelas beaker kemudian ditambah 500 ml akuades.
Selanjutnya, ditunggu selama 10 menit sambil diaduk rata. Kemudian direndam
selama 24 jam, selanjutnya di sentrifuge dan filtrat yang dihasilkan diuapkan pelarutnya menggunakan rotary evaporator selama 45 menit dengan suhu 50°C
sampai sisa pelarut habis dan menghasilkan ekstrak kental.
1.3.1.2. Ekstraksi lengkuas dengan air panas
Lengkuas sebelumnya telah diparut, kemudian 500 ml air dipanaskan
sampai mendidih dan lengkuas sebanyak 50 g dimasukkan, lalu ditunggu selama
10 menit (± 100°C) sambil diaduk rata. Kemudian direndam selama 24 jam,
selanjutnya di sentrifuge dan filtrat yang dihasilkan diuapkan pelarutnya menggunakan rotary evaporator selama 20 menit dengan 50°C sampai sisa pelarut
34 1.3.1.3. Ekstraksi lengkuas dengan pelarut n-heksana
Pembuatan ekstrak lengkuas dengan menggunakan larutan n-heksana
dilakukan secara maserasi basah. Lengkuas ditimbang sebanyak 50 g dan
dilarutkan dalam 500 ml larutan n-heksan.Kemudian direndam selama 24 jam,
selanjutnya di sentrifuge dan filtrat yang dihasilkan diuapkan pelarutnya menggunakan rotary evaporator pada suhu 55°C sampai 20 menit sisa pelarut
habis dan menghasilkan ekstrak kental.
1.3.1.4. Ekstraksi lengkuas dengan pelarut etil asetat
Pembuatan ekstrak lengkuas dengan menggunakan larutan etil asetat
dilakukan secara maserasi basah. Lengkuas ditimbang sebanyak 50 g dan
dilarutkan dalam 500 ml larutan etil asetat. Kemudian direndam selama 24 jam,
selanjutnya di sentrifuge dan filtrat yang dihasilkan diuapkan pelarutnya menggunakan rotary evaporator pada suhu 40°C selama 20 menit sampai sisa
pelarut habis dan menghasilkan ekstrak kental.
3.3.2. Analisis Total Fenolik
3.3.2.1. Persiapan Larutan Standar Asam Galat
Pembuatan larutan induk asam galat, ditimbang 50 mg asam galat
dimasukkan ke dalam labu ukur 100 ml, ditambahkan akuades sampai 100 ml
sehingga diperoleh konsentrasi 500 ppm dari larutan induk dipipet 1;
2.5;5;10;15,20 ml diencerkan dengan akuades sampai volume 50 ml. Sehingga
35 3.3.2.2. Penetapan Kadar Fenol
Ekstrak diambil sebanyak 0,5 ml dan dilarutkan dalam 9,5 ml metanol,
kemudian di ultrasonic selama 20 menit. Setelah itu disaring, filtrat diambil 0,5 ml. Kemudian ditambahkan 1 ml reagen Folin Ciocalteu, 10 ml Na2CO3 7% dan
ditambahkan akuades sampai dengan 25 ml. Campuran tersebut didiamkan disuhu
ruang selama 90 menit lalu dilakukan pengukuran dengan spektrofotometer Uv-Vis pada panjang gelombang 750 nm. Semua sampel dianalisa dua kali (Singleton dan Rossi, 1965).
3.3.3. Uji Aktivitas Antimikroba
3.3.3.1. Penyiapan Isolasi Kapang / Khamir
Kapang diisolasi dari buah salak pondoh yang telah rusak. Tanda-anda
kerusakan adalah sampel berbau busuk dan ditumbuhi kapang/khamir. Setelah itu
sampel diambil sebanyak 10 g, lalu dimasukkan ke dalam 90 ml larutan pengencer
NaCl 0,85% steril. Sebanyak 1 ml cairan dari sampel diambil dan dimasukkan
dalam cawan petri steril kemudian dituangkan media PDA dan diinkubasi pada
suhu kamar selama dua hari. Koloni kapang/khamir yang tumbuh dari sampel
diambil dengan menggunakan ose secara aseptis dan dipindahkan ke cawan yang
berisi PDA beku dan dilakukan gores kuadran. Gores kuadran dilakukan sebanyak
tiga kali untuk mendapatkan kultur murni. Cara ini dilakukan untuk setiap jenis
36
murni selanjutnya dibuat agar miring untuk masing-masing kultur dan diberi kode
kultur sebagai stok. Kultur stok disegarkan terlebih dahulu setiap kali digunakan.
Isolat kapang dari kultur stok yang telah berumur 7 hari, dipanen sporanya.
Sebanyak 10 ml pengencer steril ditambahkan menjadi ± 109. Kemudian
dilakukan metode plating. Sebanyak 1 ml suspensi spora dituamgkan ke dalam cawan petri steril . kemudian dituangkan media PDA dan diinkubasi selama 2 hari
(Daulay, 1989 dalam Sukasih et al., 2008). 3.3.3.2 Uji Pembentukan Zona Hambat
Pengujian ini dilakukan dengan metode difusi sumur (Berghe dan
Vlientinck, 1991; Rios et al., 1988 dalam Hutasoit et al., 2013). Uji ini dilakukan dengan menentukan daya hambat ekstrak dengan melihat terbentuknya zona
hambat disekitar sumur ekstrak, meliputi zona hambat total yang ditandai dengan
zona hambat bening sempurna, zona hambat parsial yang ditandai dengan zona
hambat tidak bening sempurna dan zona hambat yang tidak dapat terukur. Ekstrak
diuji dengan metode difusi sumur. Sebanyak 1 ml suspensi semua masing-masing
isolat dengan konsentrasi 1x105 konidia/ml dimasukkan ke dalam cawan petri
kemudian dituangi media PDA 20 ml yang masih cair. Biakan tersebut digoyang
sampai konidia bercampur rata ke seluruh media. Setelah beku dibuat lubang
dengan blue tips steril ± 5 mm tepat di bagian tengah petri. Selanjutnya lubang
sumur diisi 100 l ekstrak. Biakan diinkubasi pada suhu 35°C, ditaruh dalam suhu
kamar 30°C, disimpan dalam suhu AC dan suhu kulkas dengan masing-masing
suhu 25°C dan 15°C. Selanjutnya diameter koloni diukur dengan jangka sorong
37
PDA, Benomyl 500 ppm, tween 80 + pelarut etil asetat dan tween 80 + pelarut
n-heksana.
3.4. Pengamatan Karakter Morfologi Kapang (Listiandiani, 2011).
Identifikasi isolat kapang dilakukan dengan pengamatan karakter
morfologi kapang. Hal-hal yang perlu diamati pada pengamatan karakter
morfologi secara mikroskopik meliputi ada atau tidak spora, dan bentuk spora
seksual dan spora aseksual, jenis dan bentuk hifa kapang dan karakter lainnya.
Pengamatan kapang menggunakan mikroskop cahaya atau mikroskop trinokular,
yaitu biakan yang telah 7 hari pada agar miring diambil dengan ose secara aseptis.
Lalu digoreskan ke media PDA dengan cara gores sinambung. Setelah 3-5 hari,
kapang yang tumbuh di dalam media PDA tersebut diamati warna koloni dan
warna sebalik koloni.
Kemudian pengamatan secara mikroskopis dilakukan dengan mengambil
sedikit biakan kapang dengan menggunakan ose, lalu ditusuk ke dalam kaca
obyek cekung yang berisi media PDA, lalu ditutup dengan cover glass. Setelah itu diamati dibawah mikroskop dengan pembesaran 40X.
3.5. Hubungan Antara Jenis Ekstrak dan Daya Hambat
Pada penelitian ini, metode perhitungan jumlah daya hambat terhadap
ekstrak dengan berbagai suhu, tidak ditemukan referensi yang terkait dengan
metode ini, namun dikarenakan metode ini diperlukan untuk mendukung adanya
hubungan senyawa aktif lengkuas merah dengan daya hambat yang dihasilkan
38
ekstrak lengkuas pada masing-masing isolat pada berbagai suhu dengan kisaran
keefektifan yaitu ekstrak sangat efektif menghambat pertumbuhan kapang/ khamir
(+), ekstrak efektif menghambat pertumbuhan kapang/ khamir (++) sampai
ekstrak cukup efektif menghambat pertumbuhan kapang/ khamir (+++). Kisaran
data ini diperoleh berdasarkan hasil pertumbuhan kapang/ khamir yang
dipengaruhi oleh berbagai ekstrak lengkuas dan benomyl 500 ppm. Kemudian
39 3.6. Skema Penelitian
Skema penelitian dibuat agar memudahkan dalam melihat dan mengetahui
proses penelitian. Dimana skema penelitian tersebut akan diawali dengan
pembuatan ekstrak lengkuas yang dilakukan dengan proses maserasi sampai
didapatkan ekstrak kental, hingga berbagai macam pengujian.
40 BAB IV
HASIL DAN PEMBAHASAN
4.1. Total Fenolik Ekstrak Lengkuas
Analisa total fenolik pada penelitian ini menggunakan ekstrak lengkuas
dengan bermacam-macam variasi pelarut. Pelarut ysng digunakan adalah air
dingin, air panas, pelarut etil asetat, dan pelarut n-heksana. Ekstrak lengkuas
dibuat dengan menggunakan metode maserasi selama 24 jam. Hal ini bertujuan
untuk melarutkan komponen flavonon dan dihidroflavonol dikenal sebagai senyawa yang bersifat fungistatik dan fungisida yang terdapat pada lengkuas (Hemzela, 2006). Hal ini dibuktikan dengan dihasilkannya Tabel 4 dibawah ini.
Tabel 4. Kadar total fenolik pada ekstrak lengkuas.
Keterangan: * Srividya et al., (2010)
Hasil pengujian kadar total fenolik menunjukkan bahwa ekstrak air panas
lengkuas memiliki kandungan senyawa fenolik paling tinggi yaitu 1110,3 ppm
GAE, lalu ekstrak etil asetat lengkuas sebesar 746, 3 ppm GAE, ekstrak air dingin
lengkuas sebesar 733,6 ppm GAE dan ekstrak n-heksana lengkuas sebesar 293, 4
ppm GAE. Sedangkan hasil penelitian Srividya et al., (2010) total fenolik dari
Sampel Kadar Total Fenolik (ppm GAE)
Ekstrak Air Dingin Lengkuas 733,6 (220 ± 0.87*)
Ekstrak Air Panas Lengkuas 1110,3
Ekstrak Etil Asetat Lengkuas 746, 3 (227 ± 1.03*)
41
ekstrak etil asetat lengkuas adalah 227 ± 1.03 ppm GAE dan ekstrak air dingin
lengkuas 220 ± 0.87 ppm GAE. Hal ini membuktikan bahwa penelitian telah
dilakukan memiliki total fenolik jauh lebih tinggi daripada dengan hasil penelitian
Srividya et al., (2010).
Berdasarkan Tabel 4 diatas menunjukkan bahwa kadar total fenolik
tertinggi adalah ekstrak air panas lengkuas dibandingkan dengan ekstrak air
dingin lengkuas. Perbedaan pelarut ternyata menghasilkan perbedaan total fenolik
dan lama ekstraksi juga mempengaruhi ekstrak yang dihasilkan (Revilla et al., 1998). Hal ini juga terlihat pada ekstrak etil asetat lengkuas yang memiliki kadar
total fenolik lebih tinggi dibandingkan ekstrak n-heksana lengkuas.
4.2. Karakter Morfologi Isolat Kapang
Identifikasi konvensional kapang dilakukan dengan pengamatan karakter
morfologi. Berdasarkan hasil pengamatan karakter morfologi, terlihat bahwa
sembilan isolat tersebut adalah tujuh isolat berbentuk kapang dan dua isolat
berbentuk khamir. Sembilan isolat ini memiliki karakteristik yang berbeda-beda