POTENSI GEN
BMPR-1B
DAN
BMP-15
SEBAGAI PENCIRI
UNTUK SELEKSI SIFAT PROLIFIK PADA DOMBA EKOR
GEMUK (DEG) LOMBOK
TAPAUL ROZI
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis yang berjudul Potensi Gen
BMPR-1B dan BMP15 sebagai Penciri untuk Seleksi Sifat Prolifik pada Domba Ekor Gemuk (DEG) Lombok adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2011
TAPAUL ROZI. Potential of BMPR-1B and BMP-15 genes as Marker Selection for Prolification in The Lomboknese Fat Tail Sheep (LFTS). Under supervised of MULADNO and JAKARIA
The Lomboknese fat tailed sheep (LFTS) is a local sheep that have been long time raised and well adapted to the extreme environments of Lombok island. The aim of this study was to identify the BMPR-1B and BMP-15 genes and their influences on the prolification of the LFTS. Polymorphism of BMPR-IB and
BMP-15 genes were identified with restriction enzymes AvaII and HinfI. Data were analyzed based on allele frequencies and t test was applied to compare the mean values of litter size in different genotypes. The results of study showed that polymorphism of BMPR-1B gene resulted in three genotypes, namely : ++ (140 bp/140 bp), B+ (140 bp/109 bp/31 bp) and BB (109 bp/31 bp) with allele + and B frequencies were 0.839 and 0.161, respectively. While BMP-15 gene resulted in two genotypes, namely ++ (110 bp/110 bp) and G+ (141 bp / 110 bp) with allele G and + frequencies were 0.946 and 0.054, respectively. Chi-square test for confirming the Hardy-Weinberg equilibrium showed that both BMPR-1B and
BMP-15 genes were in the equilibrium conditions.A highly significant difference (P<0.01) in the average of litter size in different genotypes was observed. The highest average of litter size was found in the genotype combination of the two genes (B+/G+), namely 1.781±0.123 lambs, while the lowest average was obtained in the genotype ++/++, namely 1.015 ± 0.063 lambs.
Seleksi Sifat Prolifik pada Domba Ekor Gemuk (DEG) Lombok. Dibimbing oleh MULADNO dan JAKARIA.
Domba ekor gemuk di NTB dikenal sebagai domba yang prolifik yaitu memiliki kemampuan melahirkan lebih dari satu anak dalam setiap kelahiran. Umumnya domba betina melahirkan anak seekor (single), namun yang paling sering adalah melahirkan dua anak (twin), kadangkala tiga ekor (triplets) bahkan ada yang empat ekor (quadruplets). Sifat prolifik pada domba diatur oleh tiga gen utama (major gene) yaitu: Bone morphogenetic protein receptor IB (BMPR-1B),
Bone morphogenetic protein 15 (BMP-15) dan Growth differentiation factor 9
(GDF9). Gen BMPR-1B dan gen BMP-15 ditemukan terekspresi khusus pada oosit yang sedang berkembang di ovarium, mutasi yang terjadi pada kedua gen ini menyebabkan meningkatnya kecepatan ovulasi dan jumlah anak sekelahiran (litter size) pada ternak domba. Gen BMP-15 dalam keadaan homozigot menyebabkan sifat infertil pada individu (Davis et al. 2005).
Berkembangnya teknik-teknik molekuler sebagai metode seleksi berdasarkan penciri DNA dapat mempercepat program seleksi. Penggunaan penciri DNA dalam program seleksi disebut sebagai Marker Assisted Selection
(MAS), yang diharapkan mampu meningkatkan respon seleksi yang jauh lebih baik daripada tanpa menggunakan penciri DNA (Quali dan Talmant 1990). Penerapan MAS paling tepat digunakan untuk kegiatan seleksi pada sifat produksi/reproduksi dengan nilai heritabilitas rendah seperti sifat prolifik pada hewan ternak. Munculnya gagasan penggunaan MAS adalah adanya gen yang memiliki hubungan nyata dan menjadi target secara spesifik dalam seleksi (Werf, 2000).
Materi penelitian yang digunakan untuk analisis DNA adalah sampel darah DEG-Lombok sebanyak 137 ekor yang diambil dari kecamatan Sambelia, kabupaten Lombok Timur propinsi Nusa Tenggara Barat (NTB). Darah yang diambil diperoleh dari DEG-Lombok yang telah melahirkan minimal 3 kali kelahiran untuk selanjutnya diamati kelahirannya dan dihitung nilai rataan litter size dari induk tersebut. Identifikasi keragaman gen BMPR-1B dan BMP-15
dilakukan menggunakan pendekatan PCR-RFLP. Analisis yang dilakukan yaitu frekuensi alel, uji χ2 (chi-square), frekuensi nilai heterozigositas pengamatan, frekuensi heterosigositas harapan dan ragam heterozigositas harapan dan perbandingan nilai rataan litter size. Amplifikasi fragmen gen BMPR-1B dan
BMP-15 menggunakan dua set primer dengan susunan masing-masing yaitu
Forward: 5’-GTCGCTATGGGGAAGTTTGGATG-3’; Reverse: 5’-CAAGATG- TTTTCATGCCTCATCAACACGGTC-3’ dan Forward: 5’-CACTGTCTTCTT- GTTACTGTATTTCAATGAGAC-3’; Reverse: 5’ -GATGCAATACTGCCTGC-TTG-3’ dengan panjang produk amplifikasi masing-masing 140 bp dan 141 bp. Genotipe yang ditemukan dari hasil PCR-RFLP yaitu untuk gen BMPR-1B
diperoleh tiga macam genotipe (++, B+ dan BB) sedangkan untuk gen BMP-15
diperoleh dua macam genotipe (++ dan G+).
frekuensi lebih tinggi dibandingkan dengan genotipe lainnya (BB, B+ dan G+). Genotipe GG pada gen BMP-15 tidak ditemukan pada DEG-Lombok, hal ini diduga karena sampel domba yang digunakan jumlahnya sedikit sehingga genotipe GG tidak ditemukan, pejantan yang tersedia sebagai pemacek jumlahnya sangat terbatas pada populasi, selain itu juga diduga pejantan yang tersedia hanya membawa genotipe ++. Hanrahan et al. (2004) menyatakan bahwa pada domba betina Camridge dengan genotipe GG ditemukan infertil (steril), sehingga betina yang membawa genotipe GG tidak bisa menghasilkan keturunan.
Uji χ2 (chi-square) telah dilakukan terhadap gen BMPR-1B dan BMP-15, hasil yang diperoleh tidak berbeda terhadap populasi, hal ini mengindikasikan bahwa proporsi genotipe pada populasi DEG-Lombok masih dalam keadaan seimbang (keseimbangan Hardy-Weinberg). Keseimbangan gen dalam populasi terjadi jika tidak adanya seleksi, mutasi, migrasi dan genetic drift. Sebaliknya, jika terjadi akumulasi genotipe, populasi yang terbagi, mutasi, seleksi, migrasi dan perkawinan dalam kelompok/populasi yang sama (endogami) maka dapat menimbulkan terjadinya ketidakseimbangan frekuensi genotipe atau alel dalam populasi tersebut (Noor 2004).
Hasil analisis perbedaan genotipe dari gen BMPR-1B, BMP-15 dan kombinasi kedua gen tersebut berpengaruh sangat nyata (P<0.01) terhadap rataan
litter size DEG-Lombok. DEG-Lombok dengan kombinasi genotipe dari kedua gen tersebut (B+/G+) memberikan rataan litter size yang paling tinggi yaitu 1.781±0.123 ekor dan rataan paling rendah pada genotipe ++/++ degan nilai rataan 1.015±0.063ekor. Berdasarkan rataan litter size yang diperoleh dari DEG-Lombok maka kombinasi kedua gen (BMPR-1B dan BMP-15) berpotensi dijadikan sebagai MAS untuk seleksi domba prolifik.
Kata kunci : DEG-lombok, gen BMPR-1B, gen BMP-15, keragaman genetik,
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
POTENSI GEN
BMPR-1B
DAN
BMP-15
SEBAGAI PENCIRI
UNTUK SELEKSI SIFAT PROLIFIK PADA DOMBA EKOR
GEMUK (DEG) LOMBOK
TAPAUL ROZI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
SEKOLAH PASCA SARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis
:
Potensi Gen BMPR-1B dan BMP15 sebagai Penciri untuk Seleksi Sifat Prolifik pada Domba Ekor Gemuk (DEG) LombokNama
:
Tapaul Rozi NIM:
D151080201Disetujui
Komisi Pembimbing
Prof. Dr.Ir. Muladno, MSA. Dr. Jakaria, S.Pt, M.Si Ketua Anggota
Mengetahui
Koordinator Mayor
Ilmu Produksi dan Teknologi Peternakan
Dr. Ir. Rarah R.A. Maheswari, DEA
Dekan Sekolah Pascasarjana IPB
Prof. Dr. Ir. Khairil A. Notodiputro, M.S
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga studi, penelitian dan penulisan tesis ini dengan judul “Potensi gen BMPR-1B dan BMP-15 sebagai Penciri untuk Seleksi Sifat Prolifik pada Domba Ekor Gemuk (DEG) Lombok” dapat diselesaikan dengan baik.
Penulis menyadari bahwa dalam penyelesaian penulisan tesis ini adalah atas bantuan dan sumbangsih materi maupun pemikiran dari berbagai pihak. Oleh sebab itu dalam kesempatan ini penulis mengucapkan terimakasih yang sebesar-besarnya kepada:
1. Prof. Dr.Ir Muladno, MSA dan Dr. Jakaria, S.Pt, M.Si selaku pembimbing, Dr. Ir. Rarah R.A. Maheswari, DEA dan Prof. Dr. Ir. Subandriyo, M.Sc APU selaku penguji serta saran yang diberikan.
2. Ir. Maskur, M.Si dan Prof. Ir. Chairussyuhur Arman, MSc. Ph.D selaku senior penulis di Fakultas Peternakan UNRAM atas semua dukungan motivasi dan materi penelitian serta diskusi secara mendalam dan intensif dalam melaksanakan penelitian sampai penulisan tesis ini diselesaikan.
3. Drh. Hultatang dan Muh. Yahya sebagai kepala dan staf Poskeswan Sambelia atas bantuannya dalam pengambilan sampel dan pengumpulan data (aspek tekhnis pemeliharaan dan data litter size).
4. Khususny bagi kedua orang tua tercinta (H. Syamsuddin dan Hj.Mertisah) sembah sujud ananda dan ungkapan terimakasih yang tiada tara penulis sampaikan atas motivasi yang diberikan disertai dengan do’a yang tiada henti. Isteriku tercinta “Yuniarti Rahmi” dan anakku tersayang “Kamila Lubna dan Firas Abrar” atas pengertian, perhatian dan kerelaannya yang tulus serta do’a yang tiada putusnya diberikan kepada penulis. Bapak dan Ibu mertua (Drs. H. Surahman dan Ny. Haryati) atas dukungan motivasi dan keikhlasannya untuk menjaga Isteri dan ke dua anakku selama masa studi. Saudara-saudaraku tercinta (Zainul Irpan, Ahmad Jupri, Suardin, Syamsul Anwar, Nikmaturrahmi dan Indrwati Suarni), semua kakak dan adik ipar beserta semua keponakanku atas semangat dan do’a yang diberikan selama penulis menempuh studi.
5. Teman-teman seperjuangan ITP angkatan 2008, angkatan 2009 dan teman-teman di Animal Breeding and Genetic Student Comunity (ABGSCi) atas kebersamaan dan kerjasamanya selama perkuliahan dan penelitian tesis serta semua pihak yang tidak bisa disebutkan satu-persatu yang telah membantu penulis dalam mengerjakan tesis ini.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari kesempurnaan, oleh karenanya kritik dan saran yang membangun selalu diharapkan demi kesempurnaan di masa mendatang, semoga karya ilmiah ini bermanfaat bagi perkembangan dan kemajuan ilmu pengetahuan.
Bogor, Februari 2011
Lombok Timur pada tanggal 21 April 1979. Penulis merupakan anak ke enam dari tujuh bersaudara dari Pasangan H. Syamsuddin dan Hj. Mertisah .
Pendidikan dasar diselesaikan di Sekolah Dasar Negeri (SDN) 01 Penedagandor pada tahun 1991. Pendidikan lanjutan tingkat pertama diselesaikan di Sekolah Menengah Pertama Negeri (SMPN) 06 Selong pada tahun 1994. Pendidikan lanjutan menengah tingkat atas diselesaikan di Sekolah Menengah Kejuruan Negeri (SMKN) 1 Sakra Lombok Timur pada tahun 1997. Pendidikan strata satu (S1) diselesaikan di jurusan Ilmu Produksi Ternak, Fakultas Peternakan, Universitas Mataram pada tahun 2001. Penulis melanjutkan pendidikan strata dua (S2) dan diterima di sekolah Pascasarjan Mayor Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor tahun 2009/2010.
Saat ini penulis bekerja sebagai staf pengajar di Fakultas Peternakan Universitas Mataram sejak tahun 2005. Selama mengikuti studi program master penulis aktif mengikuti kegiatan seminar.
DAFTAR TABEL ... xiii
DAFTAR GAMBAR... xiv
DAFTAR LAMPIRAN ... xv
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 3
Manfaat... 3
TINJAUAN PUSTAKA Domba Ekor Gemuk (DEG) – Lombok... 4
Reproduksi Domba... 5
Jumlah Anak Sekelahiran (Litter Size)... 5
Gen Bone Morfogenetic Protein Receptor-IB (BMPR-1B)... 6
Gen Bone Morfogenetic Protein-15 (BMP-15)... 9
Gen Growth Differentiation Factor 9 (GDF-9)... 11
Mekanisme Molekuler Peningkatan Laju Ovulasi pada Domba 12 MAS (Marker Assisted Selection) ... 14
MATERI DAN METODE Tempat dan Waktu ... 16
Materi Penelitian... 16
Metodologi Penelitian... 17
Analisis Data... 22
HASIL DAN PEMBAHASAN Amplifikasi Gen BMPR-1B dan BMP-15... 25
Genotiping Gen BMPR-1B ... 26
Genotiping Gen BMP-15 ... 27
Keragaman Gen BMPR-1B dan Gen BMP-15 ... 28
Keseimbangan Gen dalam populasi ... 29
Pendugaan Nilai Heterozigositas 30 Pendugaan Nilai PIC 31 Pengaruh Genetik Gen BMPR-1B dan BMP-15 terhadap Litter Size.. 32
Pengaruh Lingkungan terhadap Litter Size... 35
KESIMPULAN Simpulan... 39
Saran... 39
DAFTAR PUSTAKA ... 40
LAMPIRAN ... 45
1. Kondisi reproduksi ternak domba... 5 2. Rataan jumlah anak sekelahiran (litter size) pada berbagai jenis domba 6 3. Beberapa variasi mutasi sekuen pada gen BMP-15... 11 4. Mutasi gen BMP-15 dan pengaruhnya pada kecepatan ovulasi ... 11 5. Sekuen primer dari gen BMPR-1B dan BMP-15 ... 19 6. Frekuensi genotipe dan alel gen BMPR-1B dan BMP-15 pada
DEG-Lombok ...
28
7. Nilai heterozigositas pengamatan (Ho) dan nilai heterozigositas harapan (He) untuk fragmen gen BMPR-1B dan gen BMP-15 pada DEG-Lombok
30
8. Nilai PIC fragmen gen BMPR-1B dan BMP-15... 31 9. Rataan nilai litter size pada DEG-Lombok dengan gen BMPR-1B,
BMP-15 dan kombinasinya...
33
Halaman
1. Posisi gen BMPR-1B pada kromosom 6 domba ... 7
2. Rekonstruksi gen BMPR-1B pada manusia berdasarkan sekuen lengkap di Gen Bank ... 8 3. Posisi gen BMP-15 pada kromosom X domba ... 9
4. Struktur gen BMP-15 ..... 9
5. Struktur gen GDF-9... 12
6. Dampak gen fekunditas terhadap mekanisme follikulogenesis dan tingkat ovulasi pada domba (Fabre et al. 2006)... 14 7. Sekuens gen BMPR-1B partialpada kromosom 6... 19
8. Sekuens gen BMP-15 pada kromosom X ... 20
9. Produk PCR gen BMPR-1B pada DEG –Lombok... 25
10. Produk PCR gen BMP-15 pada DEG – Lombok ... 25
11. Perubahan (garis bawah) basa A pada alel + menjadi basa G pada alel B akibat mutasi pada gen BMPR-1B... 26 12. Genotipe gen BMPR-1B dengan enzim AvaII ... 27
13 Perubahan (garis bawah) basa C pada alel + menjadi basa T pada alel G akibat mutasi pada gen BMP-15... 27 14. Genotipe gen BMP-15 dengan enzim HinfI ... 27
15. Tipe kelahiran triplets pada DEG-Lombok dengan genotipe B+/G+... 35
Halaman
1. Sekuen gen BMPR-IB partial cds domba pada exon 8... 45
2. Sekuen lengkap gen bone morphogenetic protein 15 (BMP15) pada kambing...
46
3. Sekuen lengkap gen bone morphogenetic protein receptor- IB (BMPR-1B) manusia pada kromosom 4 ...
49
4. Data rataan litter size DEG berdasarkan gen BMPR-1B dan BMP-15 51 5. Menghitung rataan litter size ... 54 6. Hasil Uji t test rataan litter size pada genotipe berbeda... 55 7. Karakteristik wilayah dan aspek tekhnis peternakan DEG –Lombok. 57
PENDAHULUAN
Latar Belakang
Domba ekor gemuk (DEG) (Fat tailed sheep) dikenal dari bentuk ekornya yang gemuk, sehingga digolongkan ke dalam domba ekor gemuk. DEG banyak terdapat di daerah Madura, Jawa Timur dan wilayah Indonesia Timur seperti di Lombok, Sumbawa, Kisar dan Sawa. Populasi ternak domba sebagian besar berada pada petani peternak di pedesaan yang merupakan tulang punggung produksi pangan hewani asal ternak. Populasi ternak domba di Indonesai tidak menyebar secara merata di seluruh propinsi, umumnya umumnya terkonsentrasi di pulau Jawa terutama di daerah Jawa Barat yaitu sebanyak 5 524 209 ekor (52.75%), Jawa Tengah 2 661 731 (25.42%), Jawa Timur 740 667 (7.07%) dan Banten 637 072 (6.08%), sedangkan di luar pulau Jawa populasi domba adalah sebesar 908 312 (7.38%) yang tersebar diberbagai pulau di Indonesia (Dirjen Peternakan 2009).
Nusa Tenggara Barat (NTB) yang terdiri atas dua pulau yaitu Lombok dan Sumbawa dikenal sebagai daerah kantong ternak, terutama ternak ruminansia besar seperti sapi Bali dan kerbau. Selain itu terdapat juga komoditas peternakan lainnya seperti kuda, kambing dan domba. Berdasarkan data Dinas Peternakan NTB tahun (2007), jumlah ternak ruminansia yaitu sapi 507 856 ekor (44%), kerbau 153 822 ekor (13.33%), kuda 75 042 ekor (6.50%), kambing 388 693 ekor (33.68%) dan domba 28 662 ekor (2.48%). Khusus untuk ternak domba populasi terbesar berada di kabupaten Lombok Timur yaitu sebesar 11 898 ekor (41.51%) dari total jumlah domba yang ada di NTB. Kurang berkembangnya peternakan domba di NTB disebabkan oleh kebijakan pemerintah setempat untuk mengembangkan ternak sapi Bali khususnya sebagai komoditas andalan, disatu sisi ternak domba dianggap sebagai karier bagi penyakit mulut dan kuku (PMK)
(Aphthae epizooticae) yang sangat rentan bagi ternak sapi, terutama bagi sapi Bali. Domba yang ada di Lombok dikembangkan oleh masyarakat pedesaan dan daerah-daerah terpencil pada lahan marginal yang dilakukan secara tradisional tanpa didukung oleh program pengembangan dari pemerintah.
disebut sebagai sifat peridi. Biasanya domba betina melahirkan anak satu ekor (single), namun yang paling sering adalah melahirkan dua ekor (twin), kadangkala tiga ekor (triplets) bahkan ada yang empat ekor (quadruplets) (Fahmy 1996). Menurut Gatenby (1991) jumlah anak yang dilahirkan dalam satu kali kelahiran dihitung sebagai satuan litter size. Sifat peridi pada domba diatur oleh berbagai faktor yaitu genetik, pakan, tata laksana dan lingkungan (Fahmy 1996).
Davis (2005) menyatakan bahwa sifat prolifik pada domba diatur oleh tiga gen utama (major gene) yaitu: Bone morphogenetic protein receptor IB ( BMPR-1B), Bone morphogenetic protein 15 (BMP-15) dan Growth differentiation factor 9 (GDF9). Gen BMPR-1B dan gen BMP-15 disebut juga gen FecB dan FecX
ditemukan terekspresi khusus pada oosit yang sedang berkembang pada ovarium di beberapa spesies mamalia seperti rodentia (Laitinen et al. 1998), ruminansia (Galloway et al. 2002) dan primata (termasuk manusia) (Aaltonen et al. 1999). Kedua gen tersebut berhubungan dengan sifat prolifikasi pada berbagai jenis domba. Gen BMPR-1B merupakan gen autosomal yang terletak di kromosom 6 dengan efek aditif terhadap kecepatan ovulasi, sedangkan BMP-15 adalah gen yang terpaut kromosom X yang menyebabkan kenaikan laju ovulasi pada betina dalam keadaan heterozygot dan menyebabkan infertill pada betina dalam keadaan homozigot. Mutasi yang terjadi pada kedua gen ini menyebabkan meningkatnya kecepatan ovulasi dan jumlah anak sekelahiran (litter size) pada ternak domba (Davis 2005).
Mekanisme genetik yang terjadi akibat mutasi pada gen BMPR-1B dan
BMP-15 yang memiliki hubungan terhadap rataan jumlah ovulasi dan prolifikasi pada ternak domba masih belum banyak diketahui. Kecenderungan untuk domba beranak kembar dua (twin) maupun tiga (triplets) adalah sama walaupun terdapat perbedaan pada tingkat pengaturan gen. Berdasarkan uraian di atas penelitian ini dilakukan untuk mengetahui potensi gen BMPR-1B dan BMP-15 sebagai MAS terhadap jumlah anak sekelahiran pada DEG yang ada di pulau Lombok.
Tujuan Penelitian
Penelitian ini bertujuan (1) mengidentifikasi keragaman gen BMPR-1B
dan BMP-15 pada DEG-Lombok di NTB dan (2) mengetahui hubungan polimorfisme variasi genotipe gen BMPR-1B dan BMP-15 dengan jumlah anak sekelahiran (Litter size) DEG- Lombok.
Manfaat Penelitian
TINJAUAN PUSTAKA
Domba Ekor Gemuk (DEG) - Lombok
Menurut Gatendby (1991) di Asia Tenggara ditemukan dua tipe domba yaitu domba ekor tipis (DET) atau Thin tailed sheep, terdapat di daerah Jawa Barat, (Indonesia) Kelantan (Malaysia) dan Thailand, sedangkan domba ekor gemuk (DEG) atau Fat tailed sheep terdapat di Jawa Tengah dan Jawa Timur. DEG diperkirakan masuk ke Indonesia pada abad ke-18, dibawa oleh pedagang dari Persia yang membeli rempah-rempah di Indonesia (Bradford dan Inounu 1996). Sekitar tahun 1731 sampai 1779 pemerintah Belanda telah mengimpor domba Kirman, yaitu domba ekor gemuk dari Persia, sehingga masih dipertanyakan bila DEG merupakan keturunan dari domba-domba tersebut masih belum jelas diketahui (Hardjosubroto 1994).
DEG dikenal dari bentuk ekornya yang gemuk, berbulu putih dengan kualitas wol dan kulit relatif baik, pada jantan maupun betina tidak bertanduk, telinga umumnya berukuran medium dengan posisi agak menggantung atau
semipendulous (Devendra dan Leroy 1992). Ciri spesifik yang dimiliki oleh domba ekor gemuk adalah bentuk ekor yang lebar dan panjang sehingga terlihat gemuk dan besar yang berfungsi sebagai tempat penimbunan lemak, sedangkan bagian ujung ekor kecil dan tidak terdapat timbunan lemak. Panjang ekor mencapai 14 ruas tulang dan lemak terdapat di tengah dan bagian bawah ekor, sehingga ekor kelihatan lebar (Bradford dan Inounu 1996). Keistimewaan yang terdapat pada DEG adalah kemampuan beradaptasi yang sangat baik terhadap lingkungan kering dan terhadap lingkungan panas (Hardjosubroto 1994).
Reproduksi Domba
Kondisi reproduksi domba dipengaruhai oleh faktor genetik (bangsa domba) dan beberapa faktor lain yaitu jenis kelamin, iklim dan pakan yang diberikan (Fahmy 1996). Secara umum kondisi reproduksi dari ternak domba dapat dilihat pada Tabel 1.
Tabel 1 Kondisi reproduksi ternak domba
No. Indikator Reproduksi Keterangan
1. Dewasa kelamin - Betina
- Jantan
Umur 5-7 bulan Umur 7-8 bulan
2. Siklus birahi 18 hari
3. Tingkat ovulasi 1-4 sel telur
4. Jumlah anak sekelahiran (litter size) 1-4anak Sumber: Blakely dan Bade (1992).
Domba termasuk kedalam hewan poliesterus musiman yaitu domba betina mengalami siklus birahi yang berulang-ulang pada saat domba betina mengalami kebuntingan. Domba-domba betina dari tipe pedaging dapat mencapai pubertas (masak kelamin) pada umur 5-7 bulan dan dapat dikawinkan pertama kali pada umur 8 bulan atau lebih. Siklus birahi pada domba rata-rata terjadi setiap 16 hari sekali (dengan kisaran antara 14-20 hari), dengan lama esterus rata-rata 30 jam. Selama esterus ovulasi terjadi di ovari sekitar 24-30 jam setelah awal esterus, oleh karena itu kebuntingan sangat mungkin terjadi apabila perkawinan terjadi pada saat akhir masa birahi (Blakely dan Bade 1992).
Jumlah Anak Sekelahiran (Litter Size)
peridi. Sifat-sifat tersebut belum dipertimbangkan dengan baik dalam program seleksi domba karena memiliki nilai heritabilitas dan ripitabilitas rendah terutama disebabkan oleh ekspresi fenotipeik yang berbeda-beda (Matos et al. 1997).
Domba dikelompokkan sebagai peridi apabila induk mempunyai paling tidak rataan jumlah anak sekelahiran 1.75 ekor yang diperoleh dari minimal tiga kali kelahiran, dengan potensi menghasilkan rataan anak dilahirkan adalah 2.00 ekor. Beberapa jenis segregasi domba peridi diketahui antara lain yang diatur oleh gen mayor, diatur secara kuantitatif oleh banyak gen dan gen yang terdapat pada kromosom X (Fahmy 1996). Rataan jumlah anak sekelahiran pada sejumlah domba peridi di dunia yang diperoleh dari berbagai hasil penelitian dapat dilihat pada Tabel 2.
Tabel 2 Rataan litter size pada berbagai jenis domba
Jenis Domba Kisaran rataan litter size (ekor)
Finnsheep 1.6 – 3.2
Romanov 1.9 – 4.4
Chio Greece 1.5 – 2.2
East Friesien 1.3 – 1.7
Avranchin 1.4 – 2.0
Bergschaf 1.6 – 2.2
Charollais 1.2 – 1.8
D’man 1.7 – 2.2
Barbados Blackbelly 1.3 – 2.2
Priangan 1.5 – 2.4
Hu 1.9 – 2.7
Booroola -Merino 2.5
Cambridge 1.4 - 2.8
Sumber: Fahmy (1996)
DEG memiliki sifat prolifikasi yang tinggi akan tetapi juga memiliki mortalitas anak yang tinggi. DEG-Lombok betina biasanya melahirkan anak seekor (single), namun yang paling sering melahirkan dua anak (twin), kadangkala tiga ekor (triplets) bahkan ada yang empat ekor (quadruplets).
Gen Bone Morfogenetic Protein Receptor - IB (BMPR-1B)
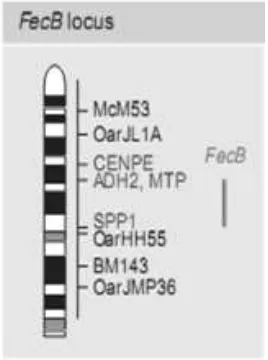
Lokus gen FecB (Gambar 1) terletak di kromosom 6 pada ternak domba (Lumsden et al. 1999), kromosom 4 pada manusia (Lanneluc et al. 1996) dan kromosom 8 pada babi (Rohrer 1999; Wilkie et al. 1999).
Gambar 1 Posisi gen BMPR-1B pada kromosom 6 pada domba (Lord et al. 1996; Lumsden et al. 1999).
Mutasi FecB pertamakali diidentifikasi tahun 1978 oleh Dr. Helen Newton Turner di Australia yaitu pada domba Boroola Merino (BM) di daerah Cooma, New South Wales Australia (Davis 2008). Gen fekunditas juga ditemukan pada domba ekor tipis (DET) di Indonesia yang dikenal sebagai gen FecJ (Bradford et al. 1991). Davis et al. (2002) menyatakan bahwa titik mutasi pada FecJ yang ada pada DET di Indonesia memiliki kesamaan dengan gen FecB pada domba BM.
Hasil penelitian terbaru berdasarkan pada teknologi penanda DNA telah mengungkapkan bahwa gen FecB pada BM berasal dari domba Asia yaitu domba Garole yang diimpor ke daratan Australia pada ahir abad ke 18 (Davis 2008). Domba Garole berasal dari daerah Tanjung Harapan Bengal Barat berdekatan dengan Calcuta di India (Ghalsasi dan Nimbkar 1993). Sementara itu untuk memperbaiki domba di Indonesia Belanda juga telah mengimpor sejumlah ternak dari Tanjung Harapan dan dan domba Merino dari Spanyol (Fahmy 1996), sehingga kemiripan antara gen FecJ dengan gen FecB kemungkinan besar terjadi karena adanya asal usul nenek moyang yang sama.
pada basa ke 746, yaitu subtitusi basa nitrogen A menjadi G yang akan mengubah asam amino glutamin menjadi arginin. Gen BMPR-1B pada manusia (Gambar 2) terdiri atas tiga belas exon dan dua belas intron dengan panjang sekuens 407 474
bp, dapat diakses di GenBank dengan kode akses NG_009245.1
http://www.ncbi.nlm.nih.gov/nuccore/219521908) [20 Apr 2010].
Lokus : NG_009245.1 Panjang : 407474
Gen : 5001..5092, 122855..122924, 243064..243158, 351432..351591, 361744..361846, 362709..362811, 370834..370930, 372007..372145, 376886..377078, 378239..378536, 395772..395947, 399667..399797, 401572..405474
Sekuens depan : 1 - 5000
Exon 1 = 5001 - 5092 = 92 bp Intron 1 = 5093 - 122854 = 117761 bp Exon 2 = 122855 - 122924 = 69 bp Intron 2 = 122925 - 243063 = 120138 bp Exon 3 = 243064 - 243158 = 94 bp Intron 3 = 243159 - 351431 = 108272 bp Exon 4 = 351432 - 351591 = 159 bp Intron 4 = 351592 - 361743 = 10151 bp Exon 5 = 361744 - 361846 = 102 bp Intron 5 = 361847- 362708 = 861 bp Exon 6 = 362709 - 362811 = 102 bp Intron 6 = 362812 - 370833 = 8021 bp Exon 7 = 370834 - 370930 = 96 bp Intron 7 = 370931 - 372006 = 1075 bp Exon 8 = 372007 - 372145 = 138 bp Intron 8 = 372146 - 376885 = 4739 bp Exon 9 = 376886 – 377078 = 192 bp Intron 9 = 377079 - 378238 = 1159 bp Exon 10 = 378239 – 378536 = 297 bp Intron 10 = 378537 - 395771 = 17234 bp Exon 11 = 395772 – 395947 = 175 bp Intron 11 = 395948 - 395666 = 3718 bp Exon 12 = 395667 – 399797 = 130 bp Intron 12 = 399798 - 401571 = 1773 bp Exon 13 = 401572 – 405474 = 3902 bp Sekuens belakang = 2000 bp
Keterangan: = Exon; = Intron
Gambar 2 Rekonstruksi gen BMPR-1B pada manusia berdasarkan sekuens lengkap
di Gen Bank (GenBank dengan kode akses NG_009245.1).
Pengaruh mutasi gen BMPR-1B bersifat aditif untuk laju ovulasi dan setiap
copy dapat meningkatkan laju ovulasi sekitar 1.6 pada domba Merino (Fahmy 1996). Setiap copy gen FecB dapat meningkatkan laju ovulasi sekitar 1.5 dan dua
copy meningkatkan laju ovulasi 3.0 dan ekstra ovulasi ini meningkatkan jumlah anak sekelahiran berturut-turut sekitar 1.0 dan 1.5 (Davis 2004). Prolifikasi yang tinggi pada domba disebabkan oleh suatu mutasi non-konservatif (Q249R) pada domain intraselluler kinase dari BMPR-1B yang terekspresi pada ovari dan sel granulosa (Mulsant et al. 2001; Wilson et al. 2001). Gen BMPR-1B juga
Falnking
diketahui sebagai ALK-6 dan anggota dari Transforming growth factor-β (TGF- β) yang berperan dalam regulasi pertumbuhan dan differensiasi sel (Davis et al. 1991)
Gen Bone Morfogenetic Protein-15 (BMP-15)
Gen Bone morfogenetic protein-15 (BMP-15 ) atau dikenal juga dengan gen
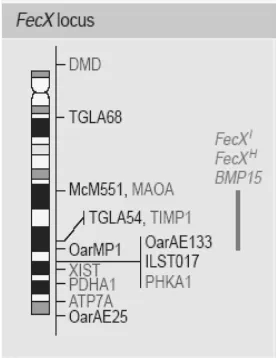
Fecunditas chromosome X (FecX) adalah gen major yang berlokasi pada kromosom X. Pemetaan menggunakan fluorescence in situ hybridization (FISH) menunjukkan bahwa pada manusia dan domba gen BMP-15 berlokasi pada sentromer kromosom X pada posisi XpII.2 (Gambar 3) (Dube et al. 1998) dan posisi ini menunjukkan homologi dengan tikus (Aaltonen et al. 1999).
Gambar 3 Posisi gen BMP-15 pada kromosom X pada domba (Galloway et al. 2000).
Dube et al. (1998) melaporkan bahwa pada tikus dan manusia protein BMP-15 disandi oleh gen mayor BMP-15. Sekuens pengkode gen BMP-15 meliputi 1179 nukleotida yang terdiri atas 2 exon yang dipisahkan oleh sebuah intron.
Exon pertama mengkode sekitar 17 asam amino dan exon kedua sekitar 125 asam amino. (Gambar 4) (Davis et al. 2006).
Gambar 4 Struktur gen BMP-15 (Davis et al. 2006).
Exon 2
Gen BMP-15 berperan dalam mengontrol laju ovulasi dan jumlah anak sekelahiran pada beberapa jenis domba disamping gen BMPR-1B. Gen BMP-15
juga diketahui sebagai Growth differentiation factor 9B (GDF9B) yang merupakan anggota Transforming growth factor-β (TGF-β) (Moore et al. 2003). Mutasi pada gen BMP-15 ditemukan empat jenis yang berbeda tetapi memberikan fenotipe yang sama pada berbagai jenis domba. Mutasi pertama teridentifikasi pada domba Inverdel dan Hanna. Mutan dari gen BMP-15 pada domba Inverdel disimbolkan dengan allel FecXI dan pada domba Hanna dengan alel FecXH(Davis
et al. 1991). Allel FecXI berhubungan dengan mutasi transisi T menjadi A pada nukleotida 896 pada sekuens pengkode BMP-15. Mutasi ini menyebabkan mutasi non-konservatif substitusi valin dengan asam aspartat asam amino 299 dari peptida yang belum diproses (asam amino 31 pada protein yang matang V31D) (Davis et al. 1992 ; Braw et al. 1993). Alel FecXH juga berhubungan dengan mutasi transisi C menjadi T pada nukleotida 871 pada sekuens pengkode BMP-15. Mutasi ini menghasilkan prematur stop kodon pada posisi asam amino 291 dari peptida yang belum diproses yang mengakibatkan protein BMP-15 yang dihasilkan kehilangan aktivitas biologisnya (Galloway et al. 2000).
Dua mutasi baru pada gen BMP-15 ditemukan pada domba Belclare dan Cambridge, mutasi ini kemudian disimbolkan dengan FecXG (Galway) dan FecXB
(Belclare) (Hanrahan et al. 2004). Mutasi FecXG adalah mutasi transisi C menjadi T pada nukleotida 718, yang menghasilkan prematur stop kodon pada asam amino 239 dari peptida yang belum diproses (protein belum matang) (McNatty et al. 2005). Mutasi pada FecXB adalah mutasi transisi G menjadi T pada nukleotida 1100, yang menyebabkan substitusi serin dengan isoleusin pada asam amino 367 dari peptida yang belum diproses (asam amino 99 pada protein matang) (McNatty
et al. 2005). Fenotipe ovarium pada hewan homozigot untuk mutasi ini tidak dapat dibedakan dengan fenotipe Inverdel (Hanrahan et al. 2004).
Konsekuensi fungsional mutasi pada aktivitas biologi secara normal adalah terhadap produksi protein oleh gen. Mutasi pada gen BMP-15 (FecXHdan FecXG)
menghasilkan stop kodon sehingga tidak menghasilkan peptida yang lengkap dan kemudian menghilangkan sama sekali fungsi dan aktivitas biologi dari BMP-15.
formasi asam amino, walaupun menghasilkan peptida yang komplit mutasi ini merusak aktivitas biologi dari BMP-15 (Tabel 3). Keempat mutasi pada BMP-15
ini menunjukkan fenomena yang menarik yaitu fenotipe pada ovarium antara satu mutasi dengan lainnya tidak dapat dibedakan (Liao et al. 2004).
Tabel 3 Beberapa variasi mutasi sekuens pada gen BMP-15
Gen Allel Posisi
Nucleotida
Perubahan Basa
Perubahan asam amino
BMP-15 FecXI FecXH FecXG FecXB 896 871 718 1100 T-A C-T C-T G-T Val-Asp Glu-stop Gln-stop Ser-Ile Sumber : Galloway et al. (2000) dan Hanrahan et al. (2004).
Mutasi pada gen BMP-15 memberikan efek dominan terhadap prolifikasi pada domba. Mutasi pada gen ini berassosiasi dengan laju ovulasi dan jumlah anak sekelahiran (Tabel 4). Satu copy dari alel FecXI dan FecXH meningkatkan laju ovulasi sekitar 0.8 anak setiap kelahiran, sebaliknya genotipe homozigot adalah steril dengan ovarium berukuran kecil yang belum berkembang (Davis et al. 2001).
Tabel 4 Mutasi gen BMP-15 dan pengaruhnya pada laju ovulasi Gen Nama
domba
Allel Kro mo-som
Efek terhadap rataan ovu-lasi (OR) danLitter size (LS)
Bangsa domba
BMP-15 Inver-dale
FecXI X I+ : OR+1.0 ; LS +0.6 II : Infertile
Romney
BMP-15 Hanna FecXH X H+ : OR+1.0; LS+0.6 HH: Infertile
Romney
BMP-15 Beclare FecXB X B+: OR+1.0 BB: infertile
Beclare
BMP-15 Galway FecXG
X G+: OR+0.7 GG: infertile
Beclare & Cambridge Sumber: Davis (2004).
Keterangan: OR : Ovulation rate/laju ovulasi LS : litter size
Gen Growth Differentiation Factors 9 (GDF-9)
(Gambar 5) pada domba terletak pada kromosom 5 yang terdiri atas 2 exon dan 1
intron dengan panjang 5644 bp. Exon 1 terdiri atas 396 bp, intron terdiri atas 1126 bp dan exon 2 terdiri atas 964 bp (Sadighi et al. 2002).
Gambar 5 Struktur gen GDF-9 (Sadighi et al. 2002).
Ekspresi GDF-9 berpengaruh terhadap perkembangan sel-sel spesifik pada ovarium dalam tahapan folikuler normal, perkembangan granulosa cells dan perkembangan oosit. Pengaruh dari ekspresi GDF-9 juga terlihat setelah ovulasi terjadi dan 1.5 hari setelah terjadinya fertilisasi, selanjutnya mengatur perkembangan awal dari embrio (Davis et al. 1999).
Mutasi pada GDF-9 terjadi pada basa 1184, yaitu perubahan basa C menjadi T sehingga mengakibatkan perubahan asam amino dari serine menjadi phenylalanine dan menghasilkan alel FecGH. Domba betina yang mengalami mutasi gen GDF-9 dan memiliki alel FecGH homozigot berhubungan dengan sterilitas pada domba betina. Mutasi gen GDF-9 dengan alel FecGH/FecG+ dalam keadaan heterozigot mengakibatkan peningkatan rata-rata ovulasi (Hanrahan et al. 2004). Mutasi yang terjadi pada gen GDF-9 berassosiasi dengan mutasi yang terjadi pada gen BMP-15 pada kromosom X yaitu pada keadaan homozigot maupun heterozigot, memberikan dampak yang sama terhadap kondisi reproduksi pada domba (Galloway et al. 2000).
Mekanisme Molekuler Peningkatan Laju Ovulasi pada Domba
Penelitian mengenai pengaruh mutasi pada gen BMPR-1B dan BMP-15
telah banyak dilaporkan oleh peneliti-peneliti dari berbagai negara. Analisis DNA terhadap gen BMPR-1B dan BMP-15 pada berbagai bangsa domba termasuk Domba Ekor Tipis (DET) dari Indonesia menunjukkan adanya mutasi yang menyebabkan sifat prolifik pada domba-domba tersebut (Davis et al. 2001).
Ekspresi gen FecB terjadi pada ovarium dan kelenjar pituitary, tetapi beberapa mekanisme belum bisa dijabarkan secara pasti apakah ekspresi tersebut
langsung berpengaruh atau tidak terhadap sirkulasi FSH pada ovarium. Mutasi
FecB pada titik Q249R diduga sebagai penyebab kehilangan fungsi secara partial pada gen BMPR-1B yang berkaitan dengan hilangnya kemampuan reaksi terhadap
BMP-4. Mutasi ini menyebabkan kehilangan aktivitas pada receptor BMP, kejadian ini dapat diilustrasikan sebagai fakta bahwa sel granulosa dari domba betina yang tidak membawa mutasi FecB kurang sensitif terhadap aksi dari BMP-4 pada perkembangan dan penghambatan produksi progesterone (Fabre et al.
2006).
Begitu juga dengan mekanisme molekuler terhadap kerusakan aktivitas
BMP-15 akibat mutasi FecX masih belum bisa dijelaskan secara pasti. Beberapa hasil penelitian pada ternak domba menunjukkan bahwa peningkatan laju ovulasi berhubungan dengan kehilangan fungsi pada sistem BMP-15 dengan efek aditif pada mutan FecXI, FecXH, FecXG dan FecXB. Hubungan antara mutasi BMP-15
dengan laju ovulasi didasarkan pada konsep bahwa semakin aktivitas BMP-15
direduksi, laju ovulasi akan semakin meningkat, akan tetapi apabila level BMP-15
terlalu rendah akan menyebabkan tidak berfungsi secara total, maka follikulogenesis akan dihambat pada tahap awal, seperti yang ditemukan pada domba betina homozigot FecXmut (alel I, H, B dan G) (Fabre et al. 2006).
Berdasarkan konsep tersebut sebuah mekanisme molekuler dari sistem BMP dapat dikemukakan untuk menjelaskan peranan dari molekul BMP-15 dan
BMPR-1B selama follikulogenesis. Mutasi pada BMP-15 menyebabkan fungsi terhadap pengaturan sirkulasi ekspresi FSH pada granulose cells menurun, sedangkan mutasi BMPR-1B berkaitan dengan hilangnya kemampuan reaksi terhadap BMP-4 yang memainkan peran sentral dalam menentukan formasi
primordial germ cells (PGC) pada ovarium (Mulsant et al. 2001; Wilson et al. 2001). Kerusakan sistem BMP selama perkembangan folikel dapat meningkatnya rata-rata ovulasi, yang diakibatkan oleh kehilangan fungsi pada sistem BMP yang diakibatkan oleh mutasi.
tinggi. Sensifitas terhadap FSH mendukung perkembangan dan differensiasi
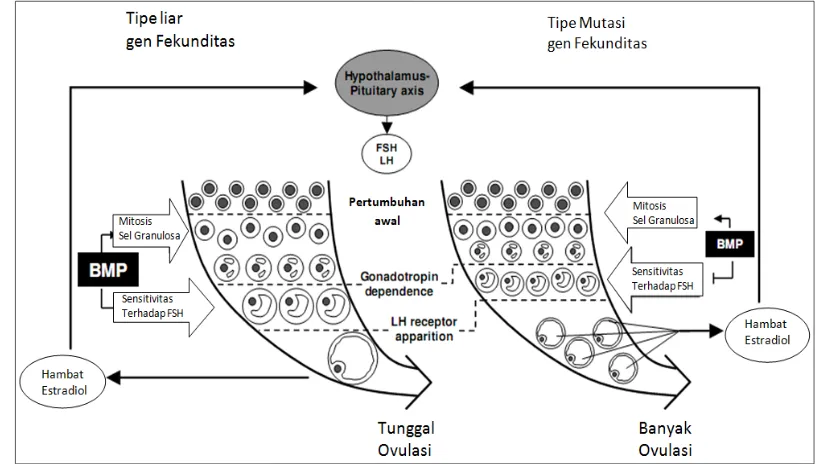
granulosa cells dan teca cells pada ovarium yang semakin aktif dan mendorong terjadinya seleksi folikel dominan dalam ovarium. Kondisi tersebut mengakibatkan sel-sel ovarium semakin aktif membelah dan menyebabkan folikel ovarium menjadi cepat dewasa dan matang. (Shackell et al. 1993; Fabre et al. 2006).) Jumlah granulosa cells yang banyak di dalam folikel ovarium menandakan semakin banyak pula folikel ovarium dominan yang terbentuk, kemudian dapat menyebabkan terjadinya super ovulasi (Davis 2005). Perkembangan dan differensiasi granulosa cells pada ternak yang membawa mutasi gen fekunditas ditandai dengan ukuran folikel yang lebih kecil dan lebih banyak bila dibandingkan dengan ternak yang tidak mengalami mutasi pada sistem BMP (Gambar 6) (Fabre et al. 2006).
Gambar 6 Dampak gen fekunditas terhadap mekanisme follikulogenesis dan tingkat ovulasi pada domba (Fabre et al. 2006).
Marker Assited Selection (MAS)
[image:30.595.107.516.334.566.2]penciri DNA menyebabkan keragaman genetik dalam populasi ternak, sehingga akan semakin mudah teridentifikasi, hal ini penting untuk efektifitas program seleksi karena program seleksi akan sangat efektif apabila populasi dalam kondisi sangat beragam (Quali dan Talmant 1990).
Munculnya gagasan penggunaan MAS adalah adanya gen yang memiliki hubungan nyata dan menjadi target secara spesifik dalam seleksi (Werf 2000). Penerapan MAS paling tepat digunakan untuk kegiatan seleksi pada sifat produksi atau reproduksi dengan nilai heritabilitas rendah. Identifikasi terhadap beberapa gen yang memiliki pengaruh utama (major gene) terhadap sifat-sifat komersial pada ternak telah banyak dilakukan. Beberapa gen utama seperti gen
Booroola merupakan gen yang mengatur sifat prolifik pada domba, gen Thoka inverdale dan Woodland merupakan gen yang berpengaruh pada laju ovulasi, gen
Callypyge berpengaruh pada produksi daging domba, gen double muscling
berpengaruh pada produksi daging sapi dan gen Nacked Neck berpengaruh pada toleransi panas pada ayam (Davis et al. 1998)
Pemanfaatan teknik Restriction fragmen length polymorfism (RFLP) sebagai MAS menjadi semakin diminati setelah dikembangkannya teknik
Polymese chain reaction (PCR) untuk amplifikasi fragmen DNA. Kombinasi teknik PCR dan RFLP merupakan teknik pertama yang dikembangkan untuk memvisualisasikan perbedaan level DNA yang didasarkan pada penggunaan enzim restriksiyang dapat memotong pada sekuens nukleotida spesifik (Montaldo dan Herera 1998). Jumlah dan ukuran fragmen DNA hasil pemotongan dengan enzim restriksi memiliki pola pita ada atau tidak adanya tempat retriksi. Apabila terpotong ada indikasi terjadi mutasi pada situs tersebut sehingga tidak ada variasi hasil pemotongan dan ekspresinya bersifat kodominan (Meghen et al.
MATERI DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Mikrobiologi dan Bioteknologi Fakultas Peternakan Universitas Mataram dan Laboratorium Pemuliaan Genetika Molekuler, Fakultas Peternakan Institut Pertanian Bogor. Penelitian dilakukan dari Agustus 2009 sampai dengan September 2010. Sampel darah dan catatan kelahiran DEG-Lombok diperoleh dari kecamatan Sambelia, kabupaten Lombok Timur, propinsi Nusa Tenggara Barat.
Materi
Sampel Darah
Sampel darah DEG-Lombok yang digunakan berasal dari 137 ekor induk yang diambil melalui vena jugularis sebanyak 5 ml. Pengambilan sampel darah menggunakan alat-alat yaitu tabung venoject vakum, spuit, rak tabung dan larutan
ethylene diaminetetra acetic acid (EDTA) konsentrasi 0.5 M sebagai pengawet agar darah tidak membeku.
Bahan dan Alat Isolasi DNA
Isolasi DNA menggunakan beberapa bahan atau pelarut seperti Tris EDTA,
lysis buffer, digestion buffer, rinse buffer, etanol absolut, etanol 70% dan larutan pengencer DNA (Master mix).
Peralatan yang digunakan untuk isolasi DNA adalah mikro pipet dengan ukuran 20 µl, 200 µl, 1000 µl, tabung mikrotube volume 1.5 ml, Refrigerated microcentrifuge, inkubator dan vortex.
Bahan dan Alat Analisis PCR
Beberapa bahan yang digunakan untuk Polymerase chain reaction (PCR) adalah deionized water, templete DNA, primer forward dan reverse fragmen gen
Peralatan yang digunakan dalam analisis PCR adalah mikropipet dengan ukuran 2.5 µl, 10 µl, 20 µl dan 200 µl, tabung mikrotube 0.15 ml dan mesin PCR (Eppendorf) serta stabilizer.
Bahan dan Alat Analisis PCR-RFLP
Bahan yang digunakan dalam analisis Polymerase chain reaction-Fragment length polymorphism (PCR-RFLP) adalah produk PCR fragmen gen
BMPR-1B, fragmen gen BMP-15, deionized water, bufer dan enzim pemotong (restriction enzym) yaitu enzim AvaII(G|GWCC) untuk gen BMPR-1B dan enzim
HinfI (G|ANTC) untuk gen BMP-15. Peralatan yang digunakan dalam analisis PCR-RFLP adalah mikropipet ukuran 2.5 µl - 10 µl, mikrotube ukuran 0.2 ml dan inkubator.
Bahan dan Alat Elektroforesis
Bahan yang digunakan untuk elektroforesis adalah agarose, loading dye, TBE 1x (1 M Tris, 0.9 M asam borat, 0.01 M EDTA pH 8.0) dan ethidium bromide (EtBr). Peralatan yang digunakan untuk elektroforesis adalah mikro pipet 10 µl, elektroforesis, power supply elektroforesis dan alat foto DNA.
Metodologi Penelitian
Pengambilan Sampel darah
Sampel darah domba diambil melalui vena jugularis dengan tabung venoject
vakum sebanyak 5 ml, setelah itu sampel darah tersebut ditambahkan dengan larutan EDTA (konsentrasi 0.5 M dosis 1 µl/1 ml darah) agar darah tidak membeku dan disimpan pada freezer dengan temperatur -20oC .
Ekstraksi dan Purifikasi DNA Genom
secara perlahan-lahan. Setelah campuran merata dilanjutkan dengan sentrifugasi pada 2000 rpm selama 15 menit. Supernatan dibuang (jangan sampai pelet terbawa) dan pelet disimpan pada temperatur -200C apabila tidak segera digunakan.
Pelet yang diperoleh pada ekstraksi pertama kemudian dilarutkan dengan 800 l larutan II yang terdiri atas 10 mM Tris pH 7.6 ; 10 mM KCl ; 10 mM MgCl2 + 0.5 M NaCl ; 0.5 % Sodium Dodecyl Sulfate (SDS) ; 2 mM EDTA. Homogenisasi pelet dilakukan berulang kali dengan alat vorteks sehingga dapat dipastikan pelet sudah terlarutkan semua. Larutan kemudian dipindahkan ke tabung microtube ukuran 1.5 ml dan ditambahkan 400 l SS-fenol untuk denaturasi protein-protein yang masih tersisa dan dicampur dengan baik. Sentrifugasi dilakukan pada 12 000 rpm selama 10 menit dan larutan bagian atas dipindahkan ke tabung baru. Ekstraksi selanjutnya dilakukan dengan penambahan 400 l campuran larutan yang terdiri atas SS-fenol ; kloroform dan isoamilalkohol dengan perbandingan (25 : 24 : 1), masing-masing untuk memastikan degradasi protein secara sempurna dan pelarutan lemak. Pencampuran dilakukan dengan sentrifugasi pada 12 000 rpm selama 10 menit untuk pemisahan ekstrak cair dari filtratnya. Jika lapisan bagian atas masih keruh (protein belum terekstraksi sempurna), maka ekstraksi dilakukan sekali lagi dengan larutan yang sama dan disentrifugasi pada 12.000 rpm selama 10 menit.
tampak oleh mata, maka presipitasi dapat dilakukan selama satu malam pada temperatur -200C dan dilanjutkan dengan sentrifugasi pada 12 000 rpm selama 10 menit untuk pengendapan DNA. Setelah dilakukan pencucian, etanol ditiriskan (jangan sampai pelet terbawa) dan dikeringkan selama 10 menit dengan pompa vakum agar sisa etanol hilang. DNA dilarutkan dalam 100 l tris/salt buffer (TE buffer), dan dibiarkan selama beberapa jam sampai satu malam sehingga DNA terlarut semua.
Amplifikasi Gen BMPR-1B dan BMP-15
Amplifikasi fragmen gen BMPR-1B dan BMP-15 menggunakan mesin PCR, dilakukan dengan proses siklus 3 langkah, yaitu (1) denaturasi, (2)
annealing/renaturasi dan (3) extension/Sintesis. Amplifikasi gen BMPR-1B dan
BMP-15 menggunakan dua set primer mengikuti Chu et al. (2007) (Tabel 5). Khusus untuk primer BMP-15 disusun berdasarkan metode penyusunan primer
Polymerase introduce restriction analyze-Polymerasi chain reaction (PIRA– PCR), metode tersebut memiliki ciri khusus yaitu (1) adanya perbedaan basa pada sekuens primer yang diperoleh, biasanya terjadi pada basa ke tiga di ujung primer, (2) situs mutasi tidak dikenali oleh enzim restriksi yang digunakan untuk mendeteksi adanya mutasi (Jacobsons dan Moskovits 1991) (Gambar 8).
Tabel 5 Sekuens primer dari gen BMPR-1B dan BMP-15
Nama
Lokus Sekuens Primer
BMPR-1B Forward: 5’-GTCGCTATGGGGAAGTTTGGATG-3’
Reverse : 5’-CAAGATGTTTTCATGCCTCATCAACACGGTC-3’
BMP-15 Forward: 5’-CACTGTCTTCTTGTTACTGTATTTCAATGAGAC-3’
Reverse : 5’-GATGCAATACTGCCTGCTTG-3’
Sumber : Chu et al. (2007).
Fragmen gen BMPR-1B dan BMP-15 memiliki panjang produk PCR masing-masing 140 bp dan 141 bp (Gambar 6 dan 7 )
1 gtcgctatgg ggaagtttgg atgggaaagt ggcgtggcga aaaggtagct gtgaaagtgt 61 tcttcactac agaggaggcc agctggttcc gagagacaga aatatatcgg accgtgttga 121 tgaggcatga aaacatcttg ca
Keterangan: huruf yang diarsir sebagai situs pemotongan enzim AvaII (G|GWCC).
6121 tggcacttca tcattggaca ctgtcttctt gttactgtat ttcaatgaca ctcagagtgt 6181 tcagaagacc aaacctctcc ctaaaggcct gaaagagttt acagaaaaag acccttctct 6241 tctcttgagg agggctcgtc aagcaggcag tattgcatct gaagttcctg gcccctccag Keterangan: huruf yang diarsir sebagai situs pemotongan enzim HinfI (G|ANTC)
Gambar 8 Sekuens gen BMP-15 pada kromosom X (Gen Bank dengan kode akses: EU743938).
Pereaksi yang digunakan untuk amplifikasi ruas gen BMPR-1B dan BMP-15
adalah 1 l sampel DNA, masing-masing primer 1, 25 l, campuran dNTP 1,5l, buffer + MgCl2 2,0 l, Taq Polymerase 0,15 l dan destilated water (dH2O) dalam larutan total 15 l. Mesin PCR kemudian dijalankan dengan kondisi temperatur yaitu: (1) gen BMPR-1B, siklus pertama adalah pemisahan/denaturasi untai DNA awal pada 940C selama 5 menit, diikuti dengan 35 siklus yang masing-masing terdiri atas denaturasi (940C selama 30 detik), penempelan/annealing primer (600C selama 30 detik), perpanjangan/extension (720C selama 30 detik) dan diakhiri satu siklus berikutnya yaitu perpanjangan akhir (final extension) pada 720C selama 5 menit; (2) gen BMP-15, siklus pertama adalah denaturasi awal pada 950C selama 5 menit, diikuti dengan 30 siklus yang masing-masing terdiri atas denaturasi (950C selama 45 detik), penempelan (annealing) primer (630C selama 45 detik), perpanjangan (extension) (720C selama 60 detik) dan diakhiri satu siklus berikutnya yaitu perpanjangan akhir (final extension) pada 720C selama 10 menit (Chu et al. 2007). Setelah siklus terakhir selesai, mesin PCR dimatikan kemudian tabung diambil dan disimpan pada temperatur 40C untuk dianalisa lebih lanjut.
Analisis PCR-RFLP
Produk PCR yang diperoleh dari hasil amplifikasi fragmen gen BMPR-1B
dan BMP-15 dipotong masing-masing dengan enzim pemotong AvaII(G|GWCC) dan HinfI (G|ANTC). Volume dan bahan pereaksi yang digunakan untuk setiap enzim pemotong adalah 2.0 l deionized water, 0.5 l enzim pemotong, buffer
Elektroforesis
Elektroforesis DNA total, produk PCR, dan produk pemotongan (PCR-RFLP) dilakukan pada media gel agarose dengan konsentrasi yang berbeda. Konsentrasi agarose 1% digunakan untuk elektroforesis DNA total (0.3 g/30 ml TBE 0.5 x), produk PCR 1.5% (0.75 g/30 ml TBE 0.5 x) dan produk pemotongan 3% (0.9 g/30 ml TBE 0.5 x). Gel agarose dibuat sesuai dengan konsentrasi yang dibutuhkan, kemudian dipanaskan di microwave sampai mendidih (larutan terlihat bening), kemudian ditambahkan EtBr sebanyak 3 l (10 mg/ml) dan dibiarkan sebentar agar dingin. Sebelum membeku gel agarose dituangkan ke dalam cetakan yang telah disiapkan, kemudian sisir untuk sampel diletakkan di dalam gel agarose dan dibiarkan sampai membeku (Sulandari dan Zein 2003).
Sebelum piranti elektroforesis dijalankan, sampel dimasukkan ke setiap sumur sampel, larutan atau buffer TBE 0.5 x (1 M Tris: 0.9 M asam borat: 0.01 M EDTA pH 8.0) volumenya sudah cukup dan sampel siap dijalankan. Alat elektroforesis yang digunakan adalah Mupid Elektrophoresis yang dimigrasikan dari kutub negatif (katoda) kepositif (anoda) dengan arus 100 volt selama 45 menit. Hasil elektroforesis diamati dengan bantuan alat foto DNA. Terlihatnya pita (band) pada gel agarose menunjukkan keberhasilan dari isolasi DNA total, amplifikasi PCR atau ada tidaknya variasi (keragaman) fragmen gen BMPR-1B
dan BMP-15. Penentuan posisi pita DNA pada gel agarose dilakukan secara manual berdasarkan asumsi bahwa semakin kecil ukuran molekul nukleotida maka laju migrasi didalam gel agarose semakin cepat menuju elektrode positif (Muladno 2002).
Penghitungan Litter Size
Analisis Data
Frekuensi Alel
Frekuensi alel gen BMPR-1B dan BMP-15 dihitung dengan rumus (Nei dan Kumar 2000):
mnKeterkkkkkkkkkkkmm
Keterangan:
Xi = frekuensi alel ke-i
nii = jumlah individu bergenotipe AiAi nij = jumlah individu bergenotipe AiAj n = jumlah total sampel
Keseimbangan Hardy Weinberg
Keseimbangan Hardy Weinberg diuji dengan uji χ2 (Hartl dan Clark 1997):
Keterangan: χ2
= uji Chi- Kuadrat
Obs = jumlah pengamatan genotip ke-i Exp = jumlah harapan genotip ke-i
Nilai Heterozigositas
Keragaman genetik (genetic variability) dilakukan melalui estimasi frekuensi heterozigositas pengamatan (Ho), heterozigositas harapan (He) dan standar eror heterozigositas harapan (Weirs 1997):
Nilai heterozigositas pengamatan dihitung dengan rumus sebagai berikut:
Keterangan:
Ho=frekuensi heterozigositas pengamatan
Nilai heterozigositas harapan dihitung dengan rumus sebagai berikut:
Keterangan:
He = heterozigasitas harapan
P1i = frekuensi alel ke I pada lokus 1 n = jumlah alel pada lokus ke-1
Nilai Standar eror heterozigositas harapan dihitung dengan menentukan ragam heterozigositas harapan:
Keterangan:
(He) = ragam heterozigositas harapan Xi = frekuensi gen ke -i
Standar eror (SE) heterozigositas harapan diperoleh dari
Nilai
Polymorphic Informative Content (PIC)Tingkat informasi suatu alel dihitung dengan pendekatan nilai Polymorphic informative content (PIC):
Keterangan
Pi= frekuensi alelke i
n = jumlah alel per perinci (marker)
Perbedaan Rataan Litter size
Nilai rataan litter size dari setiap induk DEG-Lombok diperoleh dengan cara membagi nilai akumulasi jumlah anak dengan jumlah periode melahirkan. Perhitungan rataan litter size dilakukan terhadap induk yang telah melahirkan anak minimal sebanyak tiga kali periode kelahiran. Perbedaan rataan litter size
antara genotipe fragmen gen BMPR-1B dan BMP-15 dianalisis dengan uji t (Mendenhall 1987) ;
Keterangan:
1
x dan x2 = rataan litter size genotipe 1 dan 2 n1 dan n2 = jumlah individu genotipe 1 dan 2
22
2 1 2
2 2
1 2 1
;
2
1
n
s
n
s
s
s
x x g
1
1
2
2
n
x
x
s
n
HASIL DAN PEMBAHASAN
Amplifikasi Gen BMPR-1B dan BMP-15
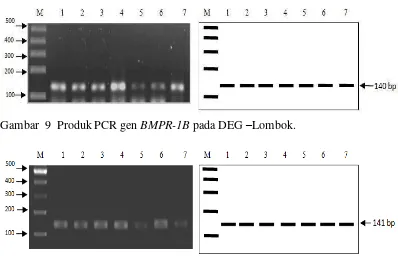
[image:41.595.113.511.218.480.2]Amplifikasi fragmen gen BMPR-1B dan BMP-15 pada DEG-Lombok menghasilkan DNA target dengan masing-masing panjang produk 140 bp (base pair/pasangan basa) dan 141 bp. Hasil produk PCR dapat dilihat pada Gambar 9 dan 10.
Gambar 9 Produk PCR gen BMPR-1B pada DEG –Lombok.
Gambar 10 Produk PCR gen BMP-15 pada DEG – Lombok.
Amplifikasi gen BMPR-1B diperoleh dengan penempelan/annealing
primer pada temperatur 60oC selama 30 detik, temperatur yang sama digunakan oleh Davis et al. (2002) untuk mengamplifikasi gen BMPR-1B pada domba Garole dan persilangan Garole X Malpura (GM), sedangkan amplifikasi gen
Genotiping Gen BMPR-1B
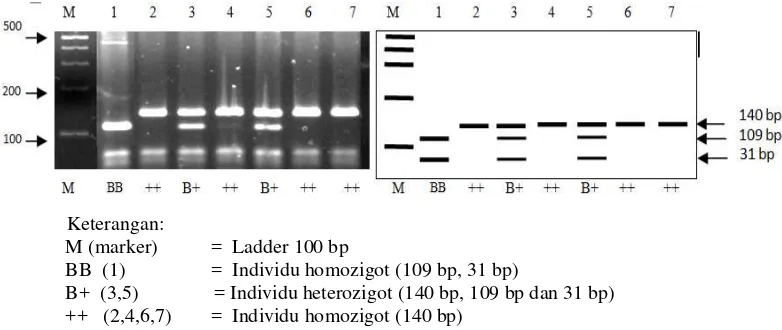
Genotiping terhadap gen BMPR-1B dilakukan dengan pendekatan metode PCR-RFLP menggunakan enzim AvaII (G|GWCC) sebagai enzim pemotong, enzim AvaII mengenali situs pemotong G|GWCC. Mutasi FecB disebabkan oleh perubahan (transisi) basa dari adenin (A) menjadi guanin (G) pada posisi basa ke 746 (Mulsant et al. 2001; Souza et al. 2001; Wilson et al. 2001). Perubahan basa A menjadi G pada sekuens gen BMPR-1B dapat dilihat pada Gambar 11.
Gambar 11 Perubahan (garis bawah) basa A pada alel + menjadi basa G pada alel B akibat mutasi pada gen BMPR-1B.
Hasil amplifikasi gen BMPR-1B (140 bp) (produk PCR) yang diperoleh kemudian dipotong dengan enzim AvaII, diperoleh tiga macam genotipe pada gen
BMPR-1B yaitu genotipe ++ (140 bp dan 140 bp), B+ (109 bp;31 bp dan 140 bp) dan BB (109 bp dan 31 bp) disajikan pada Gambar 12.
Keterangan:
M (marker) = Ladder 100 bp
BB (1) = Individu homozigot (109 bp, 31 bp)
[image:42.595.116.507.437.602.2]B+ (3,5) = Individu heterozigot (140 bp, 109 bp dan 31 bp) ++ (2,4,6,7) = Individu homozigot (140 bp)
Gambar 12 Genotipe gen BMPR-1B dengan enzim AvaII .
Hasil penelitian ini menunjukkan bahwa domba betina DEG-Lombok mengalami mutasi pada gen yang sama (genotipe BB dan B+) seperti yang ditemukan pada domba Boroola Merino di Australia dan domba ekor tipis Han di Cina yaitu mutasi FecB pada gen BMPR-1B (Chu et al. 2007). Mutasi FecB yang terjadi mengakibatkan keragaman pada gen BMPR-1B pada DEG-Lombok. Mulsant et al. (2001) menyatakan bahwa mutasi yang terjadi pada alel + yaitu
Alel + : 5’...AATATATCAGACCGTGTTGA...3’
perubahan (transisi) basa adenin (A) menjadi guanin (G) pada posisi basa ke 746 pada asam amino 249 (Q249R) yang mengakibatkan perubahan asam amino glutamine (CAG) menjadi asam amino arginin (CGG). Mutasi yang terjadi pada gen BMPR-1B terekspresi pada ovari yang menstimulasi perkembangan dan differensiasi granulosa Cells dan teca cells yang menyebabkan meningkatnya laju ovulasi pada domba.
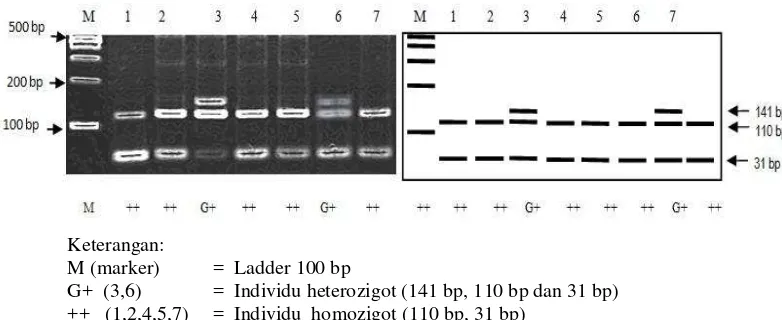
Genotiping Gen BMP-15
Genotiping terhadap gen BMP-15 dilakukan dengan pendekatan metode PCR-RFLP menggunakan enzim HinfI (G|ANTC) sebagai pemotong, enzim HinfI mengenali situs pemotong G|ANTC. Mutasi pada gen BMP-15 terjadi disebabkan oleh perubahan basa yaitu perubahan (transisi) basa sitosin (C) menjadi timin (T) pada posisi basa ke 718. Perubahan basa C menjadi T pada sekuens gen BMP-15
dapat dilihat pada Gambar 13.
Gambar 13 Perubahan (garis bawah) basa C pada alel + menjadi basa T pada alel G akibat mutasi pada gen BMP-15.
Hasil amplifikasi gen BMP-15 (141 bp) (produk PCR) kemudian dipotong dengan menggunakan enzim HinfI (G|ANTC), diperoleh dua macam genotipe yaitu genotipe ++ (110 bp dan 31) dan G+ (141 bp, 110 bp dan 31 bp) (Gambar 14).
Keterangan:
M (marker) = Ladder 100 bp
[image:43.595.115.506.555.715.2]G+ (3,6) = Individu heterozigot (141 bp, 110 bp dan 31 bp) ++ (1,2,4,5,7) = Individu homozigot (110 bp, 31 bp)
Gambar 14 Genotipe gen BMP-15 dengan enzim HinfI.
Genotipe GG merupakan genotipe yang mengalami mutasi dan tidak ditemukan pada DEG-Lombok. Chu et al. (2007) menyatakan bahwa pada gen
BMP-15 terdapat mutasi yaitu perubahan (transisi) basa sitosin (C) menjadi timin (T) pada posisi basa ke 718 yang menyebabkan terjadinya premature akibat stop codon pada asam amino ke 239 (Q239R). Mutasi tersebut menyebabkan hilangnya aktivitas dan tidak sempurnanya fungsi dari gen BMP-15 (Montgomery
et al.1992).
Keragaman Gen BMPR-1B dan Gen BMP-15
Analisis keragaman gen BMPR-1B menghasilkan alel + dan B dengan genotipe ++, B+ dan BB, sedangkan pada gen BMP-15 menghasilkan alel G dan + yang memiliki dua genotipe yaitu genotipe G+ dan ++ (Tabel 6).
Tabel 6 Frekuensi genotipe dan alel gen BMPR-1B dan BMP-15 pada DEG– Lombok .
Gen Frekuensi
Genotipe Alel
BMPR-IB ++ B+ BB B +
0.701(96) 0.277 (38) 0.02 (3) 0.161 0.839
BMP-15 GG G+ ++ G +
0.00 (0) 0.109 (15) 0.891 (122) 0.054 0.946
Hasil penelitian (Tabel 6) menunjukkan bahwa gen BMPR-1B dan BMP-15 memiliki frekuensi alel + yang lebih tinggi dibandingkan dengan alel B dan G. Frekuensi alel + pada gen BMPR-1B sebesar 0.893 dan pada gen BMP-15 sebesar 0.946. Hasil penelitian ini menunjukkan bahwa gen BMPR-1B dan BMP-15
bersifat polimorfik . Nei dan Kumar (2000) menyatakan bahwa nilai frekuensi alel yang lebih besar dari 1% dalam populasi dapat dikatakan sebagai gen yang bersifat polimorfik.
Hasil penelitian ini berbeda dengan yang dilaporkan Chu et al. (2007) pada domba ekor tipis Han di Cina yaitu pada gen BMPR-1B alel B lebih tinggi daripada alel +, sedangkan pada gen BMP-15 menunjukkan pola yang sama dengan DEG-Lombok. Analisis keragaman genetik pada gen BMPR-1B dan
GG pada gen BMP-15 tidak ditemukan pada DEG-Lombok. Frekuensi genotipe ++, B+ dan BB pada gen BMPR-1B masing-masing sebesar 0.70, 0.28 dan 0.02, sedangkan genotipe ++ dan G+ pada gen BMP-15 memiliki frekuensi masing-masing sebesar 0.89 dan 0.11. Berbeda dengan hasil yang diperoleh Kumar et al. (2006), pada domba Garole, frekuensi genotipe homozigot (BB) sebesar 0.859, heterozigot (B+) sebesar 0.125 dan genotipe ++ sebesar 0.016
Hanrahan et al. (2004) menyatakan bahwa pada domba betina Camridge dengan genotipe GG ditemukan infertil (steril), sehingga betina yang membawa genotipe GG tidak bisa menghasilkan keturunan. Genotipe GG tidak ditemukan pada DEG-Lombok diduga karena sampel domba yang digunakan jumlahnya sedikit sehingga genotipe GG tidak ditemukan, pejantan yang tersedia sebagai pemacek jumlahnya sangat terbatas pada populasi, selain itu juga diduga pejantan yang ada membawa genotipe ++.
Keseimbangan Gen dalam Populasi
Uji chi-square (χ2) terhadap gen BMPR-1B dan BMP-15 telah dilakukan, hasil yang diperoleh tidak berbeda terhadap populasi DEG-Lombok. Hal ini mengindikasikan bahwa proporsi genotipe kedua gen pada populasi DEG-Lombok masih dalam keadaan seimbang (keseimbangan Hardy-Weinberg) yang menunjukkan bahwa pada populasi DEG-Lombok belum pernah dilakukan seleksi, terutama berdasarkan pada kedua gen tersebut. Hasil uji χ2 sesuai dengan data yang diperoleh dari hasil survey (Lampiran 7) bahwa peternak tidak memahami prinsip-prinsip seleksi dan inbreeding pada ternak sehingga peternak DEG-Lombok tidak pernah melakukan seleksi terhadap ternak yang akan mereka pelihara, seperti seleksi berdasarkan jumlah kelahiran anak domba. Bibit domba yang dipelihara petani biasanya diperoleh dari orang lain melalui sistem bagi hasil (masyarakat Lombok menyebutnya dengan sistem kadasan) sehingga tidak bisa memilih domba sesuai degan keinginannya, selain itu bibit domba juga diperoleh dengan cara membeli dari pasar yang dipilih berdasarkan ukuran besar tubuh dan kesehatan tanpa menanyakan bahwa domba yang dipilih berasal dari induk yang memiliki tipe kelahiran tunggal atau kembar.
dari penggabungan gamet yang terjadi secara acak pada populasi yang besar (Vasconcellos et al. 2003). Keseimbangan gen dalam populasi terjadi jika tidak adanya seleksi, mutasi, migrasi dan genetic drift. Sebaliknya, jika terjadi akumulasi genotipe, mutasi, seleksi, migrasi dan perkawinan dalam kelompok/populasi yang sama (endogami) maka dapat menimbulkan terjadinya ketidakseimbangan frekuensi genotipe atau alel dalam populasi tersebut (Noor 2004).
Pendugaan Nilai Heterozigositas
[image:46.595.114.517.379.423.2]Keragaman genetik (genetic variation) dalam suatu populasi dapat diukur dengan menghitung nilai heterozigositas (H) dari fragmen gen yang diamati. Pendugaan nilai heterozigositas pengamatan (Ho) dan nilai hetrozigositas harapan (He) untuk fragmen gen BMPR-1B pada DEG – Lombok disajikan pada Tabel 7. Tabel 7 Nilai heterozigositas pengamatan (Ho) dan nilai heterozigositas harapan
(He) untuk fragmen gen BMPR-1B dan gen BMP-15 pada DEG-Lombok
Gen N H pengamatan Hharapan±SE
BMPR-IB 137 0.277 0.270 ± 0.025
BMP-15 137 0.109 0.103 ± 0.030
Tabel diatas menunjukkan bahwa pada fragmen gen BMPR-1B memiliki nilai heterozigositas pengamatan sebesar 0.277 dan nilai heterozigositas harapan sebesar 0.270 ± 0.025, sedangkan nilai heterozigositas dari fragmen gen BMP-15
yaitu nilai heterozigosiats pengamatan sebesar 0.109 dengan nilai heterozigositas harapan sebesar 0.103 ± 0.030.
Hasil analisis nilai heterozigositas pengamatan (Ho) dan nilai heterozigositas harapan (He) pada DEG-Lombok tidak menunjukkan adanya perbedaan yang besar dari kedua fragmen gen tersebut. Kondisi ini mengindikasikan bahwa frekuensi genotipe dari populasi DEG-Lombok dalam keadaan keseimbangan baik pada penciri PCR-RFLP fragmen gen BMPR-1B
(Ho) lebih rendah dari heterozigositas harapan (He) dapat mengindikasikan adanya derajat endogami (perkawinan dalam kelompok) sebagai akibat dari adanya proses seleksi yang intensif. Hart dan Clark (1997) menyatakan bahwa nilai heterozigositas pengamatan (Ho) dan heterozigositas harapan (He) juga dapat digunakan sebagai salah satu cara untuk menduga nilai koefisien biak dalam (inbreeding) pada suatu kelompok ternak. Secara umum nilai heterozigositas harapan (He) merupakan indikator yang baik sebagai penciri genetik yang dapat menjelaskankeragaman genetik pada suatu populasi ternak domestik.
Pendugaan Nilai PIC
[image:47.595.110.515.434.483.2]Nilai PIC merupakan salah satu parameter yang menunjukkan tingkat informatifnya suatu penciri/marker. Nilai PIC dikategorikan dalam tiga kriteria yaitu rendah jika PIC ≤ 0.25, nilai PIC sedang 0.25-0.5 dan nilai PIC tinggi apabila ≥ 0.5 Botstein et al. (1980). Analisis nilai PIC terhadap penciri PCR-RFLP fragmen gen BMPR-1B dan BMP-15 terhadap DEG-Lombok disajikan pada Tabel 8.
Tabel 8 Nilai PIC fragmen gen BMPR-1B dan BMP-15
Gen N PIC
BMPR-1B 137 0.306
BMP-15 137 0.109
Keterangan : n = jumlah ternak
Tabel diatas menunjukkan bahwa pada DEG-Lombok nilai PIC gen
BMPR-1B termasuk dalam kategori sedang, sedangkan gen BMP-15 memilki nilai PIC yang tergolong dalam kategori rendah. Berdasarkan nilai PIC tersebut maka gen BMPR-1B memiliki potensi yang lebih tinggi dibandingkan dengan gen BMP-15 sebagai penciri genetik untuk sifat prolifik pada DEG-Lombok. Botstein et al.
Pengaruh Genetik Gen BMPR-1B dan BMP-15 terhadap Litter size Rataan jumlah anak sekelahiran atau ukuran litter size pada penelitian ini adalah sebesar 1.167 ekor/induk/kelahiran, diperoleh dari 8 kelompok ternak dengan total populasi sebesar 137 ekor. Sebaran data kelahiran yang diperoleh pada penelitian ini yaitu induk beranak antara 3-8 kali, diantaranya 64.22% (8