KRIOPRESERVASI SEMEN AYAM SK KEDU DALAM DUA
PENGENCER DENGAN KRIOPROTEKTAN
DIMETHILSULFOKSIDA
SIPORA PETRONELA TELNONI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Kriopreservasi Semen Ayam SK Kedu dalam Dua Pengencer dengan Krioprotektan Dimethilsulfoksida adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2016
Sipora Petronela Telnoni
RINGKASAN
SIPORA PETRONELA TELNONI. Kriopreservasi Semen Ayam SK Kedu dalam Dua Pengencer dengan Krioprotektan Dimethilsulfoksida. Dibimbing oleh R IIS ARIFIANTINI, TUTY LASWARDI YUSUF, dan SRI DARWATI.
Ayam lokal Indonesia merupakan rumpun unggas asli atau plasma nutfah unggas yang tersebar di beberapa wilayah Indonesia. Ayam SK kedu merupakan ayam hasil persilangan dari 3 rumpun ayam lokal Indonesia yaitu ayam sentul, ayam kampung, dan ayam kedu. Ayam SK kedu dapat memberikan kontribusi terhadap sumber daya keberagaman genetik unggas dan sumber pangan protein di Indonesia. Kontribusi dan keberadaan ayam SK kedu perlu dilestarikan dan dikembangkan melalui penerapan metode bioteknologi reproduksi yaitu kriopreservasi semen dan inseminasi buatan (IB). Keberhasilan kriopreservasi semen ayam dan IB pada ayam menggunakan semen beku masih memiliki tingkat keberhasilan yang rendah, hal ini dihubungkan dengan nilai motilitas, viabilitas, dan fertilitas spermatozoa. Kualitas semen beku ayam dipengaruhi oleh bahan pengencer dan krioprotektan yang digunakan.
Beltsville poultry semen extender (BPSE) dan pengencer ringer laktat kuning telur (RL-KT) dapat mempertahankan kualitas semen beku setelah
thawing. Disamping itu, Dimethilsulfoksida (DMSO) merupakan salah satu krioprotektan yang dapat melindungi spermatozoa selama kriopreservasi. Dalam upaya melestarikan dan mengembangkan ayam SK kedu menggunakan metode kriopreservasi semen dan IB dibutuhkan formulasi bahan pengencer semen beku ayam yang mampu menjaga kualitas semen beku oleh karena itu, guna pelaksanaan konservasi dan pengembangan ayam SK kedu menggunakan kriopreservasi semen dan IB, maka diperlukan formulasi bahan pengencer semen beku ayam yang dapat menjaga kualitas semen beku.
BPSE dan pengencer RL-KT digunakan dalam kriopreservasi semen ayam SK kedu yang ditambahkan krioprotektan DMSO dengan konsentrasi 8%, 10%, dan 12%. Perlakuan dibagi ke dalam 2 kelompok, masing-masing kelompok memiliki 3 perlakuan dari pengencer semen beku, sehingga diperoleh 6 perlakuan dalam penelitian: BPSE+DMSO 8% (BPSED8), BPSE+DMSO 10% (BPSED10),
BPSE+DMSO 12% (BPSED12) dan RL-KT+DMSO 8% (RL-KTD8), RL-KT+DMSO 10% (RL-KTD10), RL-KT+DMSO 12% (RL-KTD12). Koleksi
semen menggunakan metode pengurutan (masase) pada bagian punggung ayam menuju kloaka. Semen yang telah dikoleksi, dievaluasi secara makroskopis dan mikroskopis. Semen yang memenuhi kriteria yaitu motilitas spermatozoa >70%, abnormalitas <20%, dan konsentrasi > 3000 x 106 sel mL-1 diencerkan ke dalam 6 tabung sesuai perlakuan. Semen hasil pengenceran dievaluasi motilitas dan viabilitas spermatozoa. Semen selanjutnya dikemas menggunakan straw 0.25 mL, disegel, dilabel, dan diekuilibrasi pada suhu 5 ºC selama 2 jam. Semen hasil ekuilibrasi selanjutnya dievaluasi terhadap motilitas dan viabilitas spermatozoa, dibekukan menggunakan uap nitrogen cair (± -150 °C) selama 10 menit. Semen beku disimpan dalam kontainer N2 cair (-196 °C) sampai 24 jam untuk pengujian lebih lanjut. Evaluasi kualitas semen beku dilakukan dengan cara semen beku
spermatozoa. Persentase motilitas spermatozoa terbaik hasil kriopreservasi digunakan untuk IB.
Hasil penelitian menunjukkan semen ayam SK kedu secara makroskopis memiliki volume 0.15±0.02 mL berwarna putih susu dengan konsistensi kental, dan pH 6.93±0.06. Secara mikroskopis semen memiliki gerakan massa 3, motilitas dan viabilitas spermatozoa masing-masing 82.75±1.38% dan 90.78±1.59%. Abnormalitas spermatozoa cukup rendah hanya 2.44±0.63%, dengan konsentrasi spermatozoa yang cukup tinggi 4 161±685.45 x106 sel mL-1. Motilitas spermatozoa ayam SK kedu dalam BPSE dan pengencer RL-KT dengan DMSO konsentrasi 8%, 10%, dan 12% tidak berbeda setelah pengenceran dan setelah ekuilibrasi. Motilitas spermatozoa setelah thawing dalam pengencer RL-KTD10 (40.83±1.67%) memiliki nilai tertinggi (P<0.05) dibandingkan kombinasi pengencer dan kriprotektan lainnya. Viabilitas spermatozoa tidak menunjukkan adanya perbedaan antara perlakuan setelah pengenceran, setelah ekuilibrasi, dan setelah thawing. Recovery rate spermatozoa dalam RL-KTD10 (46.71±1.97%) lebih tinggi (P<0.05) dibandingkan dengan perlakuan lainnya. Fertilitas spermatozoa hasil IB menggunakan RL-KTD10 menunjukkan nilai yang cukup tinggi yaitu 77.22%
Berdasarkan hasil penelitian maka disimpulkan bahwa pengencer RL-KT menggunakan DMSO 10% lebih baik dalam mempertahankan motilitas spermatozoa dan recovery rate spermatozoa dalam kriopreservasi semen ayam SK kedu. BPSE dan pengencer RL-KT menggunakan DMSO konsentrasi 8%, 10%, dan 12 % memiliki kemampuan yang sama baik dalam mempertahankan viabilitas spermatozoa. Pengencer RL-KT menggunakan DMSO 10% menghasilkan nilai fertilitas spermatozoa sebesar 77.22%.
SUMMARY
SIPORA PETRONELA TELNONI. SK Kedu Chicken Semen Cryopreservation in Two Extenders with Dimethyl sulfoxide. Supervised by R IIS ARIFIANTINI, TUTY LASWARDI YUSUF and SRI DARWATI.
Indonesian native chicken is a original chicken or germplasm which spread in all of Indonesian region. SK kedu chicken is a chicken came from the cross breed of 3 Indonesian local chickens i.e sentul chicken, kampung chicken, and kedu chicken. SK kedu chicken can provide as genetic resources diversity of poultry and protein food source in Indonesia. The conservation and development of SK kedu chicken is very important for increase genetic resources diversity and protein sources, such as through semen cryopreservation and artificial insemination (AI). The success rate of chicken semen cryopreservation and AI using frozen semen is still low, correlated with sperm motility, sperm viability, and sperm fertility after cryopreservation and AI. Chicken frozen semen quality is influenced by extender and cryoprotective agent.
Beltsville Poultry Semen Extender (BPSE) and Lactate Ringer’s-Egg Yolk (LR-EY) extender was good to maintain frozen semen quality after thawing. In other side, Dimethyl sulfoxide (DMSO) is the one cryoprotectant can protect sperm cell during cryopreservation. Therefore, in an effort to converse and develop SK kedu chicken using semen cryopreservation and AI method, the formulation of chicken frozen semen diluent is related of maintain the quality of frozen semen and needed to develop.
Beltsville Poultry Semen Extender and LR-EY extender were used for SK kedu semen cryopreservation, add with 8%, 10%, and 12% concentration of DMSO. This study divided into two groups, each group have three treatments of frozen semen extender. Six treatments of extender was used in this study: BPSE+8% DMSO (BPSED8), BPSE+10% DMSO (BPSED10), BPSE+12% DMSO (BPSED12) and LR-EY+8% DMSO (LR-EYD8), LR-EY+10% DMSO (LR-EYD10), LR-EY+12% DMSO (LR-EYD12). Semen were collected from 5 SK kedu roosters using massage method and were evaluated macro and microscopically. Semen with more than 70% motility, less than 20% sperm abnormality, and concentration > 3000 x 106 cell mL-1 were pooled and divided into six tubes. The three of them were diluted with BPSED8, BPSED10 and BPSED12 and other three were diluted with LR-EYD8, LR-EYD10 and LR-EYD10. Semen were loaded into 0.25 ml straw, packed, and labeled, then equilibrated at 5 ºC for 2 hours. The straws were freeze above nitrogen vapor (± -150 °C) for 10 minutes, and stored in container of liquid nitrogen (-196 ºC) for further evaluation. Evaluation were conducted, after dilution, after equilibration, and after thawing. Thawing of frozen semen conducted in warm water (37 °C) for 30 seconds. The quality of frozen semen were evaluated on the sperm motility, viability, recovery rate and sperm fertility. The best percentage of sperm motility after thawing was inseminated to hen.
2.44±0.63% and sperm concentration was 4 161±685.45 x 106 cell mL-1. Sperm motility after dilution and equilibration in all treatments were not different, but the highest sperm motility (P<0.05) was showed in LR-EYD10 (40.83±1.67%) after thawing than other treatments. Sperm viability were not differ after dilution, equilibration as well as in after thawing. The sperm recovery rate in LR-EYD10 (46.71±1.97%) was higher than other treatments (P<0.05). Sperm fertility after inseminated with LR-EYD10 was 77.22%.
The result was concluded that LR-EY extender with 10% of DMSO was superior maintain sperm motility and sperm recovery rate of SK kedu frozen semen. BPSE and LR-EY extender had the same ability to maintain sperm viability in SK kedu semen cryopreservation. LR-EY extender with 10% of DMSO was showed 77.22% sperm fertility.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
KRIOPRESERVASI SEMEN AYAM SK KEDU DALAM DUA
PENGENCER DENGAN KRIOPROTEKTAN
DIMETHILSULFOKSIDA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Kriopreservasi Semen Ayam SK Kedu dalam Dua Pengencer dengan Krioprotektan Dimethilsulfoksida
Nama : Sipora Petronela Telnoni NRP : B352140161
Disetujui oleh Komisi Pembimbing
Prof Dr Dra R Iis Arifiantini, MSi Ketua
Prof Dr drh Tuty Laswardi Yusuf, MS
Anggota Anggota Dr Ir Sri Darwati, MSi
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr drh Mohamad Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari sampai Juli 2016 ini adalah semen ayam, dengan judul Kriopreservasi Semen Ayam SK Kedu dalam Dua Pengencer dengan Krioprotektan Dimethilsulfoksida.
Ucapan terima kasih penulis sampaikan kepada Institusi Pertanian Bogor (IPB) sebagai tempat menimbah ilmu dan memperoleh gelar Magister Sains (MSi) pada Program Studi Biologi Reproduksi (BRP). Terima kasih juga penulis sampaikan kepada Prof Dr Dra R. Iis Arifiantini, MSi, Prof Dr drh Tuty Laswardi Yusuf, MS, dan Dr Ir Sri Darwati, MSi selaku komisi pembimbing atas bimbingan dan arahan kepada penulis. Ucapan terima kasih juga disampaikan kepada drh Ni Wayan Kurniani Karja, MP PhD selaku penguji atas saran dan masukkan yang diberikan kepada penulis.
Ucapan terima kasih juga disampaikan kepada Prof Dr drh Mohamad Agus Setiadi selaku Ketua Program Studi Biologi Reproduksi (BRP). Ucapan terima kasih juga disampaikan kepada Lembaga Pengelola Dana Penelitian (LPDP) Kementrian Keuangan Republik Indonesia atas dukungan dana penelitian yang diberikan kepada penulis dalam menyelesaikan penelitian. Ucapan terima kasih juga disampaikan kepada semua staf dan pegawai Program Studi BRP dan staf Laboratorim Unit Rehabilitasi Reproduksi (URR), Departemen Klinik Reproduksi dan Patologi (KRP) Fakultas Kedokteran Hewan (FKH) Institut Pertanian Bogor (IPB) dan staf Laboratorium Lapang Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan (FAPET) IPB, atas pelayanan yang diberikan kepada penulis.
Ucapan terima kasih juga disampaikan kepada Dr Ir W Marlene Nalley, MSi selaku pembimbing skripsi saya, atas semua motivasi kepada penulis. Ucapan terima kasih juga penulis diberikan kepada teman-teman seperjuangan di Program Studi BRP 2014: Emilia K Hambu, Nila Pratiwi, Magfira, Nurbety Tarigan, Alvin Nur Aini, Kakak Elma Yessa, Siska A Ramadhani, Yuli Danofa, Nofri Zayani, Pak Dadang Priyoatmojo, Aji A Cahyaji, Musthamin Balumbi, Abang Surya Kusuma Wijaya, dan Syafri Nanda atas kebersamaannya. Ucapan terima kasih juga tak lupa diberikan kepada Kakak Nancy Diana Foeh, Kakak Yelly Mulik, Elisabeth Chan, Febtian C Nugroho, Ni Ketut Trisna Dewi, Kakak Nikolas Pati, Kakak Arnold Hendrik, dan Ardi Umbu Pandangara atas semua semangat dan bantuan.
Ungkapan terima kasih yang terdalam disampaikan kepada kedua pasangan orang tua tersayang, Bapa Theofilus Telnoni dan Bapa Julius Telnoni (Alm) serta Mama Bertha D Telnoni-DaE Panie dan Mama Milkha Telnoni-Nubatonis (Almh) dan atas kasih sayangnya. Ungkapan terima kasih juga disampaikan bagi Kakak, Adik, dan Keponakan tersayang serta seluruh keluarga.
Semoga karya ilmiah ini bermanfaat bagi para pembaca dan perkembangan ilmu pengetahuan dan teknologi yang ada di Indonesia.
Bogor, Oktober 2016
DAFTAR ISI
Tujuan dan Lingkup Penelitian 2
Manfaat Penelitian 2
Bahan Pengencer Semen Ayam 7
Beltsville Poultry Semen Extender (BPSE) 7
Ringer Laktat-Kuning Telur 8
Krioprotektan 9
Dimethilsulfoksida (DMSO) 10
Inseminasi Buatan Ayam 10
Fertilisasi Spermatozoa 11
3 MATERI DAN METODE PENELITIAN 12
Waktu dan Tempat Penelitian 12
Materi Penelitian 12
Alat Penelitian 12
Bahan Penelitian 12
Prosedur Kerja Penelitian 12
Kriopreservasi Semen Ayam SK kedu dalam BPSE dan Pengencer
RL-KT menggunakan DMSO konsentrasi 8%, 10%, dan 12% 12
Pemeliharaan Ayam 12
Penyiapan Bahan Pengencer 13
Koleksi dan Evaluasi Semen 14
Kriopreservasi Semen 15
Pengujian Kualitas Semen Beku 15
Uji Fertilitas Spermatozoa ayam SK kedu menggunakan Semen
Beku Terbaik Hasil Kriopreservasi 15
Pelakasanaan Inseminai Buatan (IB) 15
Koleksi Telur dan Pengamatan Daya Fertilitas Spermatozoa 16
Analisis Data Penelitian 16
4 HASIL DAN PEMBAHASAN 17
Karakteristik Semen Segar Ayam SK Kedu 17
Motilitas dan Viabilitas Spermatozoa Ayam SK kedu dalam BPSE
dan 12%
Recovery rate Spermatozoa Ayam SK kedu dalam BPSE dan Pengencer RL-KT menggunakan DMSO Konsentrasi 8%, 10%, dan 12%
22
Uji Fertilitas Spermatozoa Ayam SK kedu dalam Pengencer RL-KT
menggunakan DMSO 10% 23
5 SIMPULAN DAN SARAN 25
DAFTAR PUSTAKA 26
LAMPIRAN 32
DAFTAR TABEL
1 Komposisi larutan ringer laktat 8
2 Kandungan kuning telur 9
3 Komposisi larutan BPSE 13
4 Komposisi larutan RL-KT 13
5 Pengencer semen beku BPSE menggunakan DMSO konsentrasi 8%,
10%, dan 12% 14
6 Pengencer semen beku pengencer RL-KT menggunakan DMSO
konsentrasi 8%, 10%, dan 12% 14
7 Karakteristik semen segar ayam SK kedu 17
8 Motilitas spermatozoa ayam SK kedu dalam BPSE dan pengencer
RL-KT menggunakan DMSO 8%, 10%, dan 12% 20
9 Viabilitas spermatozoa ayam SK kedu dalam BPSE dan pengencer
RL-KT menggunakan DMSO 8%, 10%, dan 12% 22
10 Recovery rate spermatozoa ayam SK kedu dalam BPSE dan
pengencer RL-KT menggunakan DMSO 8%, 10%, dan 12% 23 11 Fertilitas spermatozoa ayam SK kedu dalam pengencer RL-KTD10 24
DAFTAR GAMBAR
1 Ayam silangan SK kedu jantan 4
2 Bentuk spermatozoa ayam 6
DAFTAR LAMPIRAN
1 Prosedur kerja kriopreservasi semen ayam SK kedu 32
2 Spermatozoa ayam normal dan abnormal 34
1
PENDAHULUAN
Latar Belakang
Ayam lokal Indonesia merupakan rumpun unggas asli atau plasma nutfah unggas yang tersebar di beberapa wilayah Indonesia dengan variasi tampilan dan ciri khas berbeda antar rumpun. Diantara berbagai jenis ayam lokal Indonesia yang ada, terdapat ayam silangan sentul kampung (SK) kedu. Ayam SK kedu merupakan persilangan dari 3 rumpun ayam lokal Indonesia yaitu ayam sentul, ayam kampung, dan ayam kedu. Keberadaan ayam SK kedu dapat memberikan kontribusi sebagai sumber daya keberagaman genetik unggas dan sumber pangan protein hewani di Indonesia.
Kontribusi dalam penyediaan keberagaman sumber daya genetik dan sumber pangan protein hewani berhubungan dengan pelestarian dan pengembangan jenis ayam silangan tersebut. Dalam upaya pelestarian dan pengembangan ayam silangan SK kedu dapat dilakukan melalui kriopreservasi semen dan inseminasi buatan (IB). Kriopreservasi semen berfungsi untuk menyimpan materi genetik dalam jangka waktu lama dan berguna untuk mendukung konservasi in situ yang dapat digunakan dalam program seleksi sedangkan IB merupakan teknik penting dalam produksi ternak dan memungkinkan penggunaan pejantan bergenetik unggul dalam peningkatan produksi ternak unggas (Getachew 2016).
Keberhasilan kriopreservasi semen ayam masih memiliki tingkat keberhasilan yang rendah didasarkan pada kualitas semen beku setelah thawing
dan IB. Rendahnya keberhasilan kriopreservasi semen ayam didasarkan pada beberapa parameter penilaian kualitas semen beku seperti motilitas, viabilitas,
recovery rate spermatozoa dan fertilitas setelah inseminasi. Keberhasilan kriopreservasi semen ayam saat ini menunjukkan motilitas spermatozoa berkisar antara 30.0%-37.22% (Sopiyana et al. 2007; Junaedi et al. 2016) dan memiliki fertilitas berkisar antara 30.4%-60.0% (Blesbois et al. 2007; Purdy et al. 2009). Rendahnya kualitas semen beku dapat disebabkan oleh faktor bahan pengencer dan krioprotektan serta konsentrasi krioprotektan yang digunakan dalam kriopreservasi semen ayam tersebut, oleh karena itu dibutuhkan formulasi pengencer semen beku yang mengandung bahan pengencer dasar, krioprotektan yang sesuai, dan konsentrasi krioprotektan yang optimum untuk kriopreservasi semen ayam.
Beltsville poultry semen extender (BPSE) dan pengencer ringer laktat kuning telur (RL-KT) merupakan 2 jenis bahan pengencer yang dikembangkan dengan tujuan menjaga keutuhan sel spermatozoa dalam preservasi dan kriopreservasi semen ayam. Penggunaan BPSE dalam pelaksanaan IB mampu menjaga sel spermatozoa dengan nilai fertilitas yang cukup tinggi yaitu 88% pada semen cair ayam White Leghorn (El-Gendy et al. 2012). Kriopresevasi semen menggunakan pengencer RL-KT mampu mempertahankan viabilitas spermatozoa dengan nilai sebesar 48%-49% pada berbagai semen ayam lokal Indonesia setelah
2
Dimethilsulfoksida (DMSO) merupakan krioprotektan yang sering digunakan dalam kriopreservasi semen ayam dan unggas lainnya (Herrera et al. 2005), selain gliserol, dimethyl acematide (DMA), ethylene glycol, dimethyl
formamide (DMF) dan propylene glycol. Krioprotektan DMSO memiliki
kemampuan melindungi spermatozoa melalui pemindahan air intraselular sehingga meminimalkan pembentukan kristal es dan mengurangi konsentrasi garam (Amann dan Pickett 1987).
Konsentrasi DMSO pada pembekuan semen bervariasi sehingga menjadi hal penting dalam keberhasilan kriopreservasi semen. Level optimum krioprotektan pada berbagai spesies berbeda (Kulaksiz et al. 2013). Penggunaan DMSO dengan level konsentrasi dan tingkat keberhasilan berbeda dilaporkan oleh Gee et al. (1993) dan Han et al. (2005) yaitu penggunaan DMSO dengan konsentrasi 6% pada kriopreservasi semen elang kecil Amerika dan konsentrasi 10% pada kriopreservasi semen itik menghasilkan nilai motilitas spermatozoa setelah thawing 62% dan 58%.
Dalam penelitian ini dilakukan pengenceran semen ayam SK kedu dengan BPSE dan pengencer RL-KT sebagai bahan pengencer dasar semen dan DMSO sebagai krioprotektan pada konsentrasi 8%, 10%, dan 12%. Pengenceran semen dilakukan untuk memperoleh formulasi bahan pengencer semen beku bagi kriopreservasi semen ayam silangan SK kedu.
Tujuan dan Lingkup Penelitian
1. Menentukan karakteristik semen ayam silangan SK kedu.
2. Mengevaluasi kualitas semen beku ayam silangan SK kedu dalam BPSE dan pengencer RL-KT dengan krioprotektan DMSO.
3. Menentukan konsentrasi DMSO terbaik pada pembekuan semen ayam silangan SK kedu.
4. Mengevaluasi kemampuan fertilitas spermatozoa ayam silangan SK kedu dalam pengencer terbaik pada kriopreservasi semen.
Manfaat Penelitian
1. Mendapatkan pengencer semen beku terbaik untuk digunakan dalam kriopreservasi semen ayam SK kedu.
2. Menjaga kelestarian sumber daya genetika ayam silangan SK kedu yang ada di Indonesia melalui teknik kriopreservasi semen.
Kerangka Pemikiran
BPSE merupakan bahan pengencer kompleks dengan komposisi:
3 Pengencer RL-KT merupakan bahan pengencer sederhana yang mengandung Na-Laktat, kandungan tersebut berfungsi untuk memenuhi kebutuhan ion bikarbonat, sebagai penyangga larutan dalam mempertahankan tekanan osmotik larutan dan kandungan sodium klorida untuk menjaga keberlangsungan spermatozoa. Kuning telur mengandung phospholipid dan lesitin yang berfungsi melindungi spermatozoa terhadap cold shock serta memiliki struktur lipoprotein mirip struktur membran plasma guna melindungi membran sel spermatozoa. DMSO sebagai bahan non elektrolit dengan konsentrasi optimum dibutuhkan untuk melindungi spermatozoa selama kriopreservasi. DMSO memiliki kemampuan melewati membran plasma dan memasuki sel spermatozoa saat perpindahan air intraselular guna meminimalkan pembentukan kristal es intraselular, mencegah pembekuan pengencer, dan mengurangi konsentrasi ion garam. Oleh karena itu, penggunaan BPSE dan pengencer RL-KT dengan krioprotektan DMSO konsentrasi 8%, 10%, dan 12% diharapkan dapat mempertahankan motilitas spermatozoa (%), viabilitas spermatozoa (%), dan
recovery rate permatozoa (%) setelah pembekuan dan fertilitas spermatozoa (%) setelah IB.
Hipotesis Penelitian
1. Pengencer RL-KT dan BPSE memiliki kemampuan yang sama dalam mempertahankan kualitas semen beku ayam SK kedu.
2. Makin tinggi konsentrasi DMSO maka kemampuan yang dimiliki lebih baik dalam mempertahankan kualitas semen beku ayam SK kedu.
4
2
TINJAUAN PUSTAKA
Ayam Silangan SK Kedu
Ayam lokal adalah ayam asli Indonesia, masih alami, dan belum banyak mengalami perbaikan mutu genetik. Ayam lokal yang ada di Indonesia merupakan hasil domestikasi ayam hutan merah (Gallus gallus) dan terdapat 31 rumpun ayam lokal yang sudah teridentifikasi di Indonesia (Sulandari et al. 2007; Nataamijaya 2000).
Ayam sentul merupakan ayam lokal Indonesia yang berasal dari wilayah Ciamis Jawa Barat. Karakteristik fenotipe yang khas dari ayam sentul adalah warna bulunya yang didominasi oleh warna abu abu. Pada bagian dada, bulu tersusun secara rapih seperti sisik naga, dengan warna sisik kaki berwarna kelabu, putih dan kuning (Widjastuti 1996). Ayam sentul jantan umumnya mempunyai bentuk jengger tunggal (single comb) dan pea comb (Nataamijaya 2005). Ayam sentul mempunyai keunggulan yaitu sebagai penghasil daging dan telur (tipe dwi guna), bobot badan ayam sentul jantan 1.3 kg sampai dengan 3.5 kg dan ayam betina 0.8 kg sampai dengan 2.2 kg, produksi telur 118 butir per tahun (Diwyanto
et al. 2011).
Ayam kampung merupakan salah satu ayam lokal Indonesia dan memiliki warna bulu yang bervariasi. Ayam kampung jantan memiliki warna bulu leher dan sayap lurik kuning, bulu punggung dan dada berwarna lurik hitam dan bulu ekor berwarna hitam kehijauan sedangkan bulu leher, punggung dan sayap berwarna lurik abu-abu, bulu dada berwarna putih dan bulu ekor berwarna hitam keabuan (Moniharapon 1997). Ayam kampung dapat memiliki bobot badan 1 815 g (jantan) dan 1 382 g (betina) (Mulyono dan Pangestu 1996). Produksi telur ayam kampung 80 butir per induk per tahun (Sinurat et al. 1992).
5 Ayam kedu merupakan ayam lokal yang berasal dari daerah Kedu, Kabupaten Temanggung. Ayam kedu sering disebut ayam cemani yang diambil dari bahasa jawa artinya hitam legam. Bobot badan ayam kedu jantan dewasa adalah 2.0 kg sampai dengan 4.0 kg. Ayam kedu memiliki keunggulan sebagai produksi telur yang tinggi yaitu 124 butir per tahun (Krista dan Harianto 2013).
Ayam SK kedu merupakan ayam silangan dari 3 rumpun ayam lokal Indonesia yaitu ayam sentul, ayam kampung, dan ayam kedu. Tampilan ayam SK kedu secara umum adalah bervariasi diantara ke 5 individu pejantan (Gambar 1). Perbedaan tampilan ayam SK kedu dapat dipengaruhi oleh adanya variasi genetik yang diturunkan oleh ayam sentul, ayam kampung, dan ayam kedu. Kusnadi et al. (2014) menjelaskan penampilan ternak ditentukan oleh faktor genetik dan faktor lingkungan. Faktor genetik didapatkan dari induk betina dan pejantan tetuanya, sedangkan faktor lingkungan salah satunya adalah pakan.
Tampilan ciri fisik yang diwarisi terletak pada warna bulu yang bervariasi, jengger, ukuran badan, dan berat badan. Warna bulu ayam SK kedu didominasi oleh warna abu-abu, hitam, kuning keemasan, putih, merah kecoklatan, dan hijau dengan susunan yang rapih.Variasi warna bulu yang dimiliki ayam SK kedu dipengaruhi oleh genetik hasil persilangan yang diturunkan oleh ketiga ayam lokal Indonesia.Warna abu-abu yang dimiliki ayam SK kedu diturunkan oleh genetika yang dimiliki oleh ayam sentul.Warna hitam pada ayam SK kedu diturunkan oleh genetik dari ayam kedu hitam. Ayam kedu relatif hitam, berbulu hitam, berparuh, dan berkaki hitam. Pertama kali dikenal masyarakat tahun1926.Warna lain yang dimiliki ayam SK kedu diwariskan oleh ayam kampung yang memiliki variasi warna yang lebih banyak dibandingkan ayam sentul dan ayam kedu.
Bentuk jengger ayam SK kedu adalah tipe single dan rose. Tipe jengger yang berbeda dipengaruhi oleh sifat genetik ketiga rumpun ayam. Ukuran dan berat badan yang dimiliki ayam SK kedu bervariasi antara ke 5 individu. Ayam SK kedu memiliki bobot tubuh 1 844 g sampai dengan 3 089 g. Ukuran dan bobot badan yang berbeda dipengaruhi oleh genetik yang diturunkan dari ketiga rumpun ayam lokal.
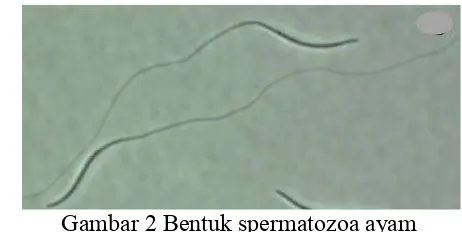
Spermatozoa Unggas
Spermatozoa unggas terdiri atas 2 bagian yaitu kepala dan ekor (Gambar 2). Pada kepala (head) terdapat akrosom dan nuklues dan ekor terbagi atas bagian yaitu bagian tengah (midpiece), bagian utama (principle piece), dan bagian ekor (endpiece). Bagian-bagian tersebut memiliki peranan penting dalam proses fertilisasi sel telur (Plessis 2010; Tarvis 2013).
6
Tudung akrosomal dan acrosomal spine terbentuk dari aparatus golgi selama spermatogenesis dan akrosom mengandung enzim-enzim proteolitik yang dibutuhkan selama fertilisasi (Amann dan Graham 1993). Bagian tengah, bagian utama, dan bagian ekor dari spermatozoa mengandung mitokondria dan sitoskeleton sel yang berguna mendukung pergerakan spermatozoa (Etches 1996); mitokondria pada bagian tengah spermatozoa unggas menyediakan energi bagi kapasitasi, reaksi akrosom, dan kebutuhan pergerakan (motilitas) pada spermatozoa ayam (Madeddu et al. 2010).
Panjang ekor spermatozoa unggas delapan kali panjang dari kepala dengan ukuran (90-100μm) serta relatif lebih panjang daripada panjang ekor spermatozoa sapi (Thurston dan Hess 1987; Donoghue dan Wishart 2000). Spermatozoa unggas memiliki kisaran volume per ejakulat 0.1-0.3 mL dengan rata-rata konsentrasi sel spermatozoa adalah 6-10×109 sel mL-1, konsentrasi tersebut lebih tinggi dibandingkan dengan konsentrasi spermatozoa pada sapi (Long 2006). Toelihere (1993) melaporkan rata-rata pH semen unggas antara 7.0-7.6 dan tingkat osmolaritas semen ayam berkisar 250-460 mOsmol per kg. Tekanan osmolaritas ideal yang direkomendasikan yaitu kisaran 325-350 mOsmol per kg (Sexton dan Fewlass 1978).
Kriopreservasi Semen Ayam
Kriopreservasi semen ayam merupakan salah satu metode bioteknologi reproduksi yang berguna untuk mendukung pelestarian spesies ayam lokal melalui penyimpanan semen sebagai materi genetik. Blesbois et al. (2007) dan Roushdy et al. (2014) menyatakan bahwa kriopreservasi semen merupakan metode yang paling praktis bagi penyimpanan sumber-sumber genetik atau material genetik. Selain itu, kriopreservasi semen juga bermanfaat bagi perlindungan materi genetik
ex situ secara in vitro guna menjaga keanekaragaman hayati genetik unggas dan dapat menghilangkan kesulitan terkait pengangkutan ternak ataupun semen segar dari tempat berjarak jauh dan waktu yang lama.
Kriopreservasi semen dipengaruhi oleh beberapa faktor diantaranya bahan pengencer, tipe dan konsentrasi krioprotektan, metode pembekuan, dan suhu
thawing yang digunakan. Keberhasilan kriopreservasi semen ayam dipengaruhi oleh beberapa faktor diantaranya pemilihan bahan pengencer semen yang sesuai, krioprotektan yang tepat, maupun pemilihan metode pembekuan-thawing
(Suidzinska dan Lukaszewicz 2008).
Selama proses kriopreservasi semen, spermatozoa mengalami cekaman yang diakibatkan oleh adanya perubahan suhu selama pembekuan dan thawing
serta perubahan tekanan osmotik yang memengaruhi sel spermatozoa sehingga menurunkan nilai viabilitas dan motilitas. Proses kriopreservasi semen dapat menyebabkan kerusakan organel sel spermatozoa secara permanen, perubahan fluiditas membran, dan terganggunya aktivitas enzimatik yang dapat menurunkan motilitas dan viabilitas spermatozoa (Sariozkan et al. 2009).
7 membeku. Holt (1999) menjelaskan bahwa ketika sel dibekukan, sel menjadi stres yang disebabkan karena interaksi air-zat terlarut yang meningkat melalui kristalisasi es dan kondisi sel spermatozoa dalam pengencer yang beku menunjukkan adanya penghambatan masuk keluar ion sel yang tejadi akibat adanya kristal es dan menyebabkan lingkungan sel menjadi tidak seimbang.
Selain pembentukan kristal es, peroksidasi lipid dan radikal bebas juga dapat menyebabkan terjadinya penurunan kualitas semen. Peroksidasi lipid merupakan reaksi berantai dengan pembentukan peroksida lipid dan akhirnya pembentukan aldehida sitotoksik (Aitken 1995). Peroksidasi lipid pada spermatozoa disebabkan tingginya kandungan polyunsaturated fatty acids
(PUFAs) terutama arakhidonat (AA) (20:4n-6) dan dokosatetraenoik (DTA) (22:4n-6) pada phospholipid membran spermatozoa unggas termasuk ayam. Reaksi oksidasi pada biomembrane menyebabkan amplifikasi reactive oxygen species (ROS), perubahan fluiditas membran, dan hilangnya integritas membran plasma, gangguan ion gradien, penurunan interaksi lipid-protein, modifikasi deoxyribonucleic acid (DNA) dan protein (Long dan Kramer 2003). Peroksidasi pada membran plasma menyebabkan kerusakan morfologi dan penurunan motilitas spermatozoa.
Bahan Pengencer Semen Ayam
Bahan pengencer bagi semen ayam yang tersedia adalah bahan berbentuk larutan siap pakai atau masih merupakan bahan dasar berupa serbuk dan cairan yang harus diformulasi terlebih dahulu menjadi larutan bahan pengencer (Supriatna 2000). Terdapat berbagai macam larutan garam buffer tersedia yang dapat digunakan sebagai bahan pengencer dari semen ayam, baik bahan pengencer komersial dan bahan pengencer yang dikembangkan berdasarkan penelitian individu. Bahan pengencer yang ditambahkan saat preservasi semen berfungsi menyediakan nutrisi, melindungi spermatozoa terhadap cekaman dingin (cold shock), bahan penyangga (buffer), mampu menekan pertumbuhan kuman, dan perlindungan selama pembekuan (krioprotektan) guna menunjang kehidupan spermatozoa (Yusuf 2015).
Bahan pengencer semen ayam yang sesuai merupakan bahan yang mampu menyediakan sumber energi bagi spermatozoa dan mempertahankan pH serta tingkat osmolaritas yang sesuai dengan keadaan plasma seminal sebagai medium alami spermatozoa (Siudzinska dan Lukaszewicz 2008) dan juga berfungsi dalam meningkatkan volume semen, menaikkan jumlah ayam betina yang akan diinseminasi per satuan volume serta memaksimalkan penggunaan pejantan unggul dalam perbaikan genetik (Bootwalla dan Miles 1992). Beberapa jenis bahan pengencer unggas yang telah dikembangkan untuk preservasi dan
kriopreservasi semen adalah Lake extender, EK extender, BPSE,
Ringer Solutions, Skim-milk extender dan beberapa bahan pengencer lainnya. Beltsville Poultry Semen Extender (BPSE)
8
bervariasi, baik setelah preservasi semen dan setelah thawing pada kriopreservasi semen unggas. BPSE telah banyak digunakan dalam preservasi dan kriopreservasi semen unggas dengan nilai motilitas setelah thawing yang bervariasi pada spesies unggas berbeda (Douard et al. 2000; Sood et al. 2012; El-Gendy et al. 2012).
BPSE mengandung sejumlah bahan kimia yaitu potassium diphosphate, sodium glutamate, fruktosa, sodium acetate, dan ditambahkan sejumlah buffer dan garam (Shaverdi et al. 2015). Komposisi sejumlah bahan kimia yang terkandung dalam BPSE berfungsi dalam menjaga kualitas semen cair dan beku.
Ringer Laktat-Kuning Telur (RL-KT)
Ringer laktat merupakan larutan steril, bebas pirogen bagi cairan dan pengganti elektrolit dalam penggunaannya secara intravena, tidak mengandung agen anti mikroba. Ringer laktat mengandung sumber air dan elektrolit, menghasilkan efek metabolik alkalinizing, dan mengandung sejumlah senyawa kimia, air, nilai pH, osmolaritas, dan sumber energi (Tabel 1).
Tabel 1 Komposisi larutan ringer laktat (RL)
Bahan penyusun g L 0.5
Laktat yang terkandung dalam ringer laktat berfungsi menyediakan sumber energi bagi spermatozoa. Jones (1997) menjelaskan bahwa laktat yang terkandung dalam larutan ringer laktat merupakan salah satu sumber energi yang dapat digunakan untuk mengantikan glukosa dan fruktosa bagi spermatozoa. Selain itu, larutan ringer laktat juga mengandung zat-zat elektrolit seperti natrium klorida (NaCl), kalium klorida (KCl), dan kalsium klorida (CaCl) yang penting bagi sel.
Kuning telur merupakan komponen umum yang digunakan pada sejumlah bahan pengencer semen, baik dalam preservasi dan kriopreservasi. Kuning telur mengandung sejumlah nutrisi penting (Tabel 2) yang dapat digunakan oleh spermatozoa sebagai sumber energi dan melindungi membran plasma spermatozoa selama proses kriopreservasi. Kuning telur mengandung 86% low density lipoproteins (LDL), 16% high density lipoproteins (HDL), 10% livetins
dan 4% phosvitins (Pillet et al. 2011).
9 sejumlah triglycerides dan ester-ester kolesterol yang dibentuk oleh phospholipid
dan protein (Akal et al. 2014). LDL mengandung 84%-89% lemak dan 11%-17% protein. Protein utama yang membentuk LDL adalah Apo-B (apolipoprotein-B). LDL terdiri atas 69% triglycerides, 26% phospholipids, dan 5% kolesterol (Moussa et al. 2002). Kandungan kuning telur (KT) disajikan pada Tabel 2.
Tabel 2 Kandungan kuning telur (KT)
Nutrisi (per 100g) Basah/kering (Kuning telur)
Protein (g) 15.30
Neutral Lipids dan lainnya 3.70
American Egg Board (2006)
Penggunaan kuning telur menunjukkan adanya manfaat baik dalam kriopreservasi semen yakni sebagai pelindung membran plasma dan akrosom spermatozoa saat terjadi kejutan dingin (Amirat et al. 2004). Aboagla dan Terada (2004) menyatakan bahwa kuning telur secara umum telah digunakan menjadi agen penting dalam pengencer semen untuk melindungi spermatozoa dari kejutan dingin dan efek fase transisi lemak. Kuning telur mampu meningkatkan kemampuan fertilisasi spermatozoa saat ditambahkan dalam pengencer bagi penyimpanan semen di temperatur ruang dan berfungsi mencegah kerusakan sel spermatozoa selama pendinginan dan pembekuan (Manjunath 2012).
Krioprotektan
Krioprotektan adalah suatu zat kimia non elektrolit yang berfungsi mencegah pembentukan kristal es ekstraselular dan intraselular saat kriopreservasi (Purdi 2006). Salah satu faktor terpenting dalam pelaksanaan kriopreservasi semen ayam adalah pemilihan jenis krioprotektan dan penentuan konsentrasi optimum krioprotektan. Jenis dan konsentrasi krioprotektan yang sesuai diperlukan untuk meminimalkan efek kerusakan spermatozoa yang timbul selama proses kriopreservasi. Krioprotektan berfungsi didalam meminimalkan kerusakan sel selama pendinginan, pembekuan, dan thawing (Fuller 2004). Leibo (1992) menyatakan bahwa untuk mengatasi cold shock dan terbentuknya kristal es, maka dalam proses pembekuan semen perlu ditambahkan zat pelindung yang disebut sebagai krioprotektan dengan kegunaan mencegah terbentuknya kristal es dan menstabilkan membran plasma spermatozoa selama proses pembekuan.
10
(etilen glikol, gliserol, dan lain-lain) dan kelompok amida (dimetilformamid, asetamid, metilformamid, dan lain-lain) (Alvarenga et al. 2005). Berdasarkan cara kerjanya krioprotektan dikelompokkan menjadi penetrating cryoprotectant yaitu krioprotektan yang bekerja di dalam dan luar sel, sebagai contoh ethylene glycol
(EG), propylene glycol (PG;1,2-propanediol), dimethyl sulfoxide (DMSO), glycerol (GLY), formamide (FMD), methanol (METH), dan butanediol (BD;2,3-butanedio) (Best 2015) dan non penetrating cryoprotectant yang bekerja di luar sel, sebagai contoh sukrosa, glukosa, atau fruktosa (Barcelo-Fimbres dan Seidel 2007). Kandungan-kandungan krioprotektan non permeating seperti protein, asam amino, dan gula, memiliki fungsi sebagai osmoprotektan yang dapat mengurangi efek cryodamage yang disebabkan oleh krioprotektan tipe permeating (Rosato dan Iaffaldano 2013).
Dimethilsulfoksida (DMSO)
Dimethilsulfoksida dengan rumus kimia [(CH3)2SO] memiliki berat molekul 78.13 g·mol-1 dan berat jenis 1.1004 g cm-3. DMSO merupakan molekul ampilik kecil dengan 1 gugus hydrophilic sulfoxide dan 2 gugus hydrophobic methyl yang secara luas digunakan dalam sel biologi sebagai peningkat efektivitas penetrasi, cell fusogen, dan krioprotektan (Andrey et al. 2007). DMSO sebagai krioprotektan telah digunakan dalam kriopreservasi organ, jaringan, dan sel. Mandumpal et al. (2011) menyatakan DMSO dikenal sebagai larutan yang secara luas digunakan dalam pelestarian jaringan biologi pada kondisi beku dan bersifat koligatif guna menekan titik beku air dan fungsi penting lainnya, yaitu menginisiasi vitrifikasi air untuk mencegah kristalisasi air dan kerusakan selanjutnya yang timbul dari pembentukan es intraselular.
Dalam kriopreservasi semen unggas, DMSO dan DMA telah digunakan sebagai krioprotektan selain gliserol. DMSO memiliki bobot molekul kecil dan efek toksisitas yang rendah pada saat pembekuan, selain itu penggunaan DMSO dalam kriopreservasi semen ayam bertujuan mengatasi efek kontrasepsi dari gliserol serta menyederhanakan tahapan inseminasi dengan tidak memerlukan adanya tahapan penghilangan gliserol sebelum inseminasi (Tai et al. 2001). Penggunaan DMSO sebagai krioprotektan terhadap plasma membran sel (phospholipid membranes) memiliki aktivitas sebagai berikut: DMSO menyebabkan membrane sel lebih floppy sehingga dapat memfasilitasi terjadinya proses fusi membran, sel lebih siap dalam menerima efek stres akibat kriopreservasi, mengurangi hambatan transpor molekul, dan membantu pembentukan pori (Notman et al. 2006).
Inseminasi Buatan (IB) Ayam
Inseminasi buatan (IB) pada ayam merupakan metode penyaluran semen (plasma semen dan spermatozoa) ke saluran reproduksi betina. Inseminasi buatan pada unggas dilaporkan pertama kali pada tahun 1936 (Getachew 2016). IB pada ayam didasarkan pada 2 tahap prosedur yaitu 1). Semen dikoleksi dari pejantan dan 2). Semen diinseminasikan pada betina, dengan tujuan akhir adalah menghasilkan telur-telur fertil (Bakst dan Dymond 2013).
11 dilakukan pada bagian belakang abdomen menuju daerah kloaka untuk pengeluaran phallus, selanjutnya diikuti dengan memijat wilayah sekitar kloaka untuk mengeluarkan semen. Setelah inseminasi, sejumlah spermatozoa yang terseleksi akan ditranspor menuju bagian utama tempat penyimpanan spermatozoa pada sperm storage tubules (SST). Spermatozoa akan meninggalkan SST dan ditranspor ke infundibulum sebagai tempat fertilisasi dan juga berfungsi sebagai tempat penyimpanan spermatozoa kedua. Telur yang berhasil difertilisasi akan ditransfer ke magnum sebagai tempat sekresi albumin, dan menuju ke isthmus
sebagai tempat pembentukan membran cangkang, dan pembentukkan cangkang telur pada uterus hingga telur dioviposisikan. Ayam memerlukan waktu 24-26 jam untuk menghasilkan folikel matang (Folikel 1) yang akan diovulasikan (Bakst dan Dymond 2013).
Fertilisasi Spermatozoa Unggas
Fertilitas merupakan suatu manifestasi dari proses mekanisme fertilisasi spermatozoa dalam saluran reproduksi betina. Motilitas spermatozoa merupakan salah satu parameter penting dalam penilaian kualitas semen semen segar, semen cair, dan semen beku. Penilaian motilitas dipengaruhi oleh struktur dan fungsi integritas spermatozoa serta memungkinkan prediksi terhadap keberhasilan fertilisasi spermatozoa (Froman 2007; Blesbois et al. 2008). Keberhasilan fertilisasi pada ayam bergantung pada beberapa faktor termasuk kemampuan spermatozoa untuk menjalani reaksi akrosom pada saat fertilisasi. Reaksi akrosom merupakan proses exocytotic yang melibatkan fusi membran dan dibutuhkan untuk mencapai fertilisasi (Lemoine et al. 2011; Nguyen et al. 2014).
12
3
MATERI DAN METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Februari sampai Juli 2016. Penelitian dilaksanakan di Laboratorium Lapang Bagian Pemuliaan dan Genetika Ternak, Fakultas Peternakan, Institut Pertanian Bogor (IPB) dan Unit Rehabilitasi Reproduksi (URR), Divisi Reproduksi dan Kebidanan, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, IPB. Penelitian yang dilakukan telah disetujui oleh komisi etik hewan IPB dengan SKEH Nomor: 028/ACUC/10/2016.
Materi Penelitian
Materi penelitian menggunakan 5 ekor pejantan ayam silangan SK kedu umur ± 1-1.5 tahun dan telah divaksinasi sebagai sumber semen dan 3 ekor ayam arab betina umur 21 minggu.
Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian yaitu BPSE, ringer laktat, kuning telur, krioprotektan DMSO, aquabidestilata, zat pewarna eosin nigrosin, nitrogen cair (-196 ºC), formolsaline, NaCI fisiologis, antibiotik (penisilin dan streptomisin), alkohol, kertas tissue, dan kertas saring.
Alat Penelitian
Mikroskop cahaya (Olympus CH 20), timbangan digital, tabung semen 2 cc, tabung eppendorf 1.5 mL, potensial Hidrogen (pH) indicator paper (Merck scala 6.4-8), gelas objek, gelas penutup, Neubauer chamber, straw semen beku 0.25 mL, heating table, waterbath, spuit 1 cc, labu erlenmeyer, pipet ukur dan karet penghisap, rak tabung semen, pipet plastik, gunting/cutter, lemari es, tabung reaksi 5 cc, mikropipet, tip mikropipet, rak straw semen beku, kotak styrofoam, kontainer nitrogen cair (N2 cair) dilengkapi dengan konektor straw, wadah plastik, termometer, dan jam/alat penghitung waktu.
Prosedur Kerja Penelitian
Kriopreservasi Semen Ayam SK kedu dalam BPSE dan Pengencer RL-KT Menggunakan Krioprotektan DMSO Konsentrasi 8%, 10%, dan 12%
Pemeliharaan Ayam
13
Penyiapan Bahan Pengencer
Larutan BPSE dan RL-KT disiapkan ± 3 jam sebelum penampungan semen. Larutan BPSE dibuat dengan cara menimbang bahan-bahan (Tabel 3) dan ditambahkan 100 mL aquabidest, larutan dihomogenkan, dan pH larutan diukur.
Tabel 3 Komposisi larutan beltsville poultry semen extender (BPSE) Bahan penyusun g L 1
Keterangan: 1Tris (hydroxymethyl)-aminomethan menggantikan TES (N-Tris[hydroxymethyl]
methyl-2 aminoethanesulfonic acid); Sumber: El-Gendy et al. (2012)
Pembuatan larutan RL-KT dibuat dengan cara mencampur RL dan kuning telur (Tabel 4), larutan dihomogenkan menggunakan magnetic stirrer selama 10 menit, disentrifugasi pada kecepatan 3 000 x g selama 15 menit, dan pH larutan di-ajust menggunakan Tris (hydroxymethyl-aminomethan) hingga pH 6.8.
Tabel 4 Komposisi larutan ringer laktat kuning telur (RL-KT) Bahan Penyusun Jumlah
14
Tabel 5 Pengencer semen beku BPSE menggunakan DMSO konsentrasi 8%, 10%, dan 12%
Bahan penyusun BPSED8 BPSED10 BPSED12
BPSE (%) 92 90 88
Tabel 6 Pengencer semen beku RL-KT menggunakan DMSO konsentrasi 8%, 10%, dan 12%5
Bahan penyusun RL-KTD8 RL-KTD10 RL-KTD12
RL-KT (%) 92 90 88
Koleksi semen dilakukan menggunakan teknik pengurutan (masase) pada bagian punggung ayam menuju kloaka yang telah dibersihkan menggunakan NaCI fisiologis dan semen diambil menggunakan spuit 1 mL. Semen dievaluasi secara makroskopis dan mikroskopis. Evaluasi makroskopis semen meliputi volume (mL) semen per ejakulat, warna semen, konsistensi semen (sedang dan sangat kental), dan pH semen (pH indicator paper Merck scala 6.4-8). Evaluasi mikroskopis semen meliputi gerakan massa, motilitas spermatozoa (%), viabilitas spermatozoa (%), morfologi spermatozoa (%), konsentrasi (106 sel spermatozoa per mL).
Gerakan massa dievaluasi dengan cara semen diteteskan ke atas gelas objek dan diamati di bawah mikroskop perbesaran 10 x 10. Penilaian diberikan dengan kriteria sangat baik (+++) berupa gelombang massa tebal dan cepat berpindah tempat, baik (++) gelombang massa tebal tetapi lambat berpindah tempat atau gelombang massa sedang tetapi cepat berpindah tempat, sedang (+) yaitu gelombang massa tipis dan lambat berpindah tempat.
Motilitas spermatozoa (%) dinilai dengan melihat perbandingan antara spermatozoa yang bergerak progresif dengan gerakan spermatozoa lainnya pada lima lapangan pandang. Penilaian dilakukan dengan cara semen diteteskan diatas objek gelas, ditambahkan NaCl fisiologis, dihomogenkan. Campuran semen dengan NaCl fisiologis diteteskan di atas objek gelas dan diamati di bawah mikroskop perbesaran 40 x 10.
Viabilitas spermatozoa (%) diamati dengan menggunakan zat pewarna
eosin nigrosin. Semen diteteskan di atas objek gelas, ditambahkan eosin nigrosin, dihomogenkan, dibuat preparat ulas tipis, dan dikeringkan diatas heating table
15 Spermatozoa dihitung minimal sebanyak 200 sel spermatozoa pada 10 lapang pandang. Persentase viabilitas spermatozoa = Jumlah spermatozoa hidup: Total spermatozoa X 100%. Morfologi spermatozoa (%) dievaluasi dengan zat pewarnaan eosin nigrosin, preparat ulas dibuat dari semen segar dan eosin nigrosin dengan metode yang sama pada pemeriksaan viabilitas.
Morfologi spermatozoa dihitung dengan mengamati spermatozoa yang normal dan abnormal minimal 200 sel spermatozoa pada 10 lapang pandang di bawah mikroskop perbesaran 40 x 10. Persentase abnormalitas spermatozoa = Jumlah spermatozoa abnormal : Total spermatozoa X 100%.
Konsentrasi spermatozoa (106 sel mL-1) dihitung menggunakan Neubauer
chamber. Semen diencerkan 500 kali (998 µL formolsaline dan 2 µL semen). Jumlah spermatozoa dari 5 kotak hitung pada Neubauer chamber diamati di bawah mikroskop perbesaran 40 x 10 dan jumlah sel spermatozoa dikalikan 25 X 106.
Recovery rate spermatozoa dihitung menggunakan formulasi: motilitas spermatozoa (%) setelah thawing : motilitas spermatozoa (%) semen segar X 100%.
Kriopreservasi Semen
Semen yang diperoleh dari 5 ekor ayam jantan dievaluasi, digabungkan menjadi 1 dalam tabung eppendorf 1.5 mL, dan dihomogenkan. Semen selanjutnya dievaluasi secara makroskopis dan mikroskopis. Semen yang memiliki motilitas >70% dan abnormalitas <20% digunakan dalam penelitian ini. Semen dibagi ke dalam 6 tabung perlakuan (BPSED8, BPSED10, BPSED12, RL-KTD8, RL-KTD10, RL-KTD12) dengan volume (mL) yang sama dan diencerkan. Pengenceran semen dilakukan menggunakan formulasi umum: volume semen (mL) x motilitas spermatozoa (%) x konsentrasi spermatozoa (juta sel mL 1) : dosis inseminasi (100 x106) x volume inseminasi (0.25 mL). Semen yang telah diencerkan dikemas dalam straw 0.25 mL dan diberi label. Semen diekuilibrasi dalam lemari es (5 °C) selama 2 jam (Bearden et al. 2004).
Pembekuan semen dilakukan dengan cara menempatkan straw 6 cm di atas permukaan N2 cair (± -150 °C) selama 10 menit (Han et al. 2005) selanjutnya disimpan dalam kontainer N2 cair (-196 °C) untuk pengujian lebih lanjut. Pengujian kualitas semen dilakukan terhadap motilitas spermatozoa (%) dan viabilitas spermatozoa (%) setelah pengenceran dan setelah ekuilibrasi.
Pengujian Kualitas Semen Beku
Semen beku dithawing dalam air hangat (37 °C) selama 30 detik. Semen dikeluarkan dari straw dan disimpan dalam tabung eppendorf. Evaluasi dilakukan terhadap motilitas spermatozoa (%) dan viabilitas spermatozoa (%), serta dihitung
recovery rate spermatozoa (%).
Uji Fertilitas Spermatozoa ayam SK kedu menggunakan Pengencer Semen Beku Terbaik Hasil Kriopreservasi
Pelaksanaan Inseminasi Buatan
16
konsentrasi 100 juta sel spermatozoa motil 0.25 mL-1 digunakan 2 straw dan dideposisikan ke dalam saluran reproduksi betina menggunakan gun IB. Gun IB dimasukkan sepanjang 7 cm dalam uteri (intra uterin) secara cepat.
Koleksi Telur dan Fertilitas Spermatozoa
Koleksi telur dilakukan pada hari ke-2 setelah IB hingga hari ke-14 disertai pemberian label pada telur. Fertilitas spermatozoa (%) diukur dengan cara: jumlah telur yang memperlihatkan adanya perkembangan embrio atau fertil dibagi total telur yang dikoleksi X 100%, tanpa memperhatikan telur tersebut akan menetas atau tidak. Pemerikasaan fertilitas telur dilakukan setelah 5 hari masa inkubasi.
Analisis Data Penelitian
Data kualitatif meliputi volume, warna, konsistensi, dan pH semen dianalisis secara deskriptif. Data kuantitatif meliputi gerakan massa, motilitas, viabilitas, konsentrasi, dan morfologi spermatozoa dianalisis menggunakan
17
4
HASIL DAN PEMBAHASAN
Karakteristik Semen Segar Ayam SK Kedu
Evaluasi karakteristik semen segar ayam bertujuan untuk mengetahui nilai beberapa parameter makroskopis dan mikroskopis semen sebelum preservasi dan kriopreservasi semen dilakukan. Hasil evaluasi karakteristik semen segar ayam SK kedu secara makroskopis dan mikroskopis disajikan pada Tabel 7.
Evaluasi makroskopis semen segar menunjukkan volume semen ayam SK berkisar antara 0.10±0.01 mL sampai dengan 0.23±0.04 mL dengan nilai rerata volume semen ayam SK kedu adalah 0.15±0.02 mL. Volume semen yang diperoleh lebih tinggi dari volume semen ayam sentul yaitu 0.13 mL yang diperoleh Junaedi et al. (2006) akan tetapi lebih rendah dibandingkan volume semen segar ayam kampung 0.31 mL (Danang et al. 2012). Perbedaan nilai rerata volume semen ayam yang dihasilkan dapat dipengaruhi oleh perbedaan breed, umur, ukuran tubuh, nutrisi pakan, suhu lingkungan, dan juga dapat disebabkan oleh kekurangan vitamin A dan E (Almahdi et al. 2014). Warna semen ayam SK kedu yang diperoleh adalah putih susu, sama dengan warna semen ayam kampung dan ayam sentul yang diperoleh Junaedi et al. (2016) dan Wiyanti et al. (2013). Warna putih susu yang dimiliki semen ayam berhubungan dengan tingginya kepadatan spermatozoa dalam semen per ejakulat (Peters et al. 2008).
Konsistensi semen ayam SK kedu yang diperoleh dalam penelitian adalah kental. Konsistensi semen yang diperoleh sama dengan konsistensi semen ayam sentul dan ayam kampung yang diperoleh Hidayat dan Sopiyana 2010 dan Sopiyana et al. (2006). Konsistensi semen mencerminkan konsentrasi spermatozoa, bahwa konsistensi semen kental menunjukkan konsentrasi spermatozoa yang tinggi (Tambing et al. 2003).
Tabel 7 Karakteristik semen ayam SK kedu
Parameter Kisaran±SEM Rerata±SEM
Makroskopis
Volume (mL) 0.10±0.01-0.23±0.04 0.15±0.02
Warna Putih susu Putih susu
Konsistensi Kental Kental
pH 6.90±0.06-6.98±0.05 6.93±0.06
Mikroskopis
Gerakan Massa 2-3 3
Motilitas (%) 81.25±1.55-85.00±1.29 82.75±1.38 Viabilitas (%) 89.76±1.61-92.58±1.36 90.78±1.59 Abnormalitas (%) 1.59±0.33-3.53±0.98 2.44±0.63 Konsentrasi (106 sel mL-1) 2 890±391.19-5 265±717.07 4 161±685.45
18
al. (2013), dan pH semen ayam kedu (6.98) yang diperoleh Almahdi et al. (2014). Perbedaan nilai pH semen antar jenis ayam dapat dipengaruhi oleh perbedaan individu, motilitas spermatozoa, dan metabolisme. pH semen dihubungkan dengan motilitas spermatozoa dan laju metabolisme (Masindi et al. 2016).
Evaluasi mikroskopis semen segar menunjukkan gerakan massa spermatozoa ayam SK kedu berada pada kisaran 2 sampai 3 dengan nilai rerata gerakan massa spermatozoa adalah 3. Gerakan massa spermatozoa yang diperoleh sama dengan gerakan massa spermatozoa ayam kampung yang dilaporkan Sopiyana et al. (2006) yaitu 3. Konsentrasi spermatozoa mL-1 ayam SK kedu berkisar 2 890±391.19 x 106 sel mL-1 sampai dengan 5 265±717.07 x 106 sel mL-1 dengan nilai rerata 4 161±685.45 x 106 sel mL-1. Konsentrasi spermatozoa ayam SK kedu lebih tinggi dari konsentrasi spermatozoa ayam sentul yang diperoeh Hidayat dan Sopiyana (2010) yaitu 3 031 x 106 sel mL-1 dan ayam kampung yang diperoleh Junaedi et al. (2016) yaitu 3 126 x 106 sel mL-1. Rerata konsentrasi semen ayam yang diperoleh berada pada kisaran konsentrasi semena ayam menurut Hafez dan Hafez (2000) yaitu 3 000-7 000 x 106 sel mL-1 dan adanya perbedaan konsentrasi spermatozoa ayam dipengaruhi oleh umur, bangsa, bobot badan, dan frekuensi penampungan (Partodihardjo 1982).
Motilitas spermatozoa ayam SK kedu hasil penelitian berada pada kisaran 81.25% sampai dengan 85.00% dengan nilai rerata motilitas spermatozoa 82.75±1.38%, motilitas spermatozoa yang diperoleh lebih tinggi dari motilitas spermatozoa ayam sentul dan ayam kampung yang dilaporkan Hidayat dan Sopiyana (2010) dan Junaedi et al. (2016) yaitu 71.95% dan 83.88%. Motilitas spermatozoa berkaitan dengan volume semen, bahwa adanya peningkatan terhadap volume dapat diartikan rendahnya konsentrasi spermatozoa (Almahdi et al. 2014).
Rerata viabilitas spermatozoa ayam SK kedu diperoleh nilai rerata 90.78±1.59% dengan kisaran viabilitas spermatozoa yaitu 89.76% sampai dengan 92.58%. Viabilitas spermatozoa ayam SK kedu lebih rendah dari viabilitas spermatozoa ayam kampung yaitu 92.50±2.36% yang dilaporkan Wiyanti et al.
(2013) dan lebih tinggi dari viabilitas spermatozoa ayam sentul yaitu 73.68% yang diperoleh Hidayat dan Sopiyana (2010).
Abnormalitas semen segar ayam SK kedu berada pada kisaran 1.59% sampai dengan 3.53% dengan nilai rerata 2.44±0.63%. Abnormalitas spermatozoa ayam SK kedu lebih rendah dari abnormalitas spermatozoa pada ayam kampung 7.33% yang dilaporkan Junaedi et al. (2016) dan pada ayam sentul yaitu 5.10% yang dilaporkan Wiyanti et al. (2013). Perbedaan nilai persentase abnormalitas antara jenis ayam dapat disebabkan ketidakseimbangan nutrisi dan endokrin (Arifiantini et al. 2005).
19 Kualitas semen juga tergantung dari banyak faktor, termasuk spesies dan breed
dari bangsa unggas (Siudzinska dan Lukaszewicz 2008).
Motilitas dan Viabilitas Spermatozoa Ayam SK Kedu dalam BPSE dan Pengencer RL-KT Menggunakan Krioprotektan DMSO Konsentrasi 8%,
10%, dan 12%
Motilitas spermatozoa ayam SK kedu setelah thawing dalam pengencer RL-KTD10 (40.83±1.67%) memiliki persentase motilitas tertinggi (P<0.05) dibandingkan pengencer lainnya. Motilitas dalam RL-KTD10 berbeda dengan BPSED8, BPSED10, BPSED12, dan RL-KTD12 akan tetapi tidak berbeda dengan RL-KTD8 (38.75±1.25%). Hal ini menunjukkan kombinasi RL-KTD10 dan RL-KTD8 memiliki kemampuan lebih baik untuk melindungi membran plasma spermatozoa selama pembekuan, penyimpanan, dan setelah thawing. Kemampuan yang dimiliki RL-KTD10 dan RL-KTD8 diduga karena adanya kandungan kuning telur yang mampu melindungi membran plasma spermatozoa terhadap efek cold shock. Amira et al. (2004) dan Akal et al. (2014) menjelaskan manfaat kuning telur dalam kriopreservasi semen yakni sebagai pelindung membran plasma dan menjaga dari cold shock.
Perlindungan terhadap membran plasma spermatozoa dari kuning telur dihubungkan dengan kandungan low density lipoprotein (LDL) sebagai bagian terbesar penyusun kuning telur. Moussa et al. (2002) menjelaskan bahwa aktivitas perlindungan terbesar dari kuning telur dimiliki oleh LDL. Kandungan LDL terpenting dalam melindungi membran plasma spermatozoa berupa phospholipid.
Phospholipid merupakan fraksi lemak terbesar dari membran sel spermatozoa yang mengandung phosphatidylcholine (lesitin), phosphatidylethanolamine, dan
sphingomyelin. Kandungan phospholipid penyusun membran sel spermatozoa yang sama dengan kandungan phospholipid dalam kuning telur diduga mampu menggantikan phospholipid membran sel spermatozoa dengan membentuk lapisan pelindung pada permukaan membran spermatozoa selama proses kriopreservasi. Hu et al. (2006) menjelaskan bahwa phospholipid membentuk lapisan pelindung bagi membran spermatozoa dan sebagai pengganti phospholipid yang rusak atau hilang selama kriopreservasi semen.
Kuning telur juga diperkirakan mempunyai efek penyangga yang baik dalam menjaga tekanan osmotik spermatozoa. Kuning telur mempunyai manfaat lain dalam penggunaannya sebagai pengencer semen yaitu sifat penyangga tekanan osmotik sehingga spermatozoa lebih toleran terhadap lingkungan yang hipotonik atau hipertonik (Khalifa dan El-Saidy 2006). Kandungan penting lainnya dalam pengencer RL-KT yang dapat menjaga motilitas spermatozoa yaitu laktak. Laktat yang ada dalam pengencer RL-KT diduga mampu menyediakan sumber energi bagi pergerakan spermatozoa. Komponen laktat berperan sebagai substrat energi yang secara aktif dioksidasi oleh setiap sel yang mengandung mitokondria (Christianty et al. 2013).
20
organel mitokondria mempunyai peranan sebagai sumber energi yang akan menggertak mikrotubul sehingga terjadi pergesekan diantara mikrotubul dan akibatnya spermatozoa dapat bergerak. Mitokondria menyediakan energi bagi motilitas spermatozoa melalui sintesis ATP, sintesis ATP terjadi dibawah kontrol aktivitas mitokondria, dan kerusakan mitokondria menyebabkan tidak adanya sintesis ATP (Eddy E dan O’Brien 2006; Ravagnan et al. 2002).
Konsentrasi DMSO 10% dalam pengencer RL-KT merupakan konsentrasi optimum dalam melindungi membran plasma spermatozoa selama pembekuan, penyimpanan, dan setelah thawing pada ayam SK kedu. DMSO konsentrasi 10% diperkirakan mampu meningkatkan fluiditas membran spermatozoa setelah
thawing dan memiliki kemampuan yang baik untuk meminimalkan efek
osmolaritas saat pada saat pembekuan. Rosato dan Iaffaldano (2013) menjelaskan krioprotektan yang masuk ke membran sel dibutuhkan untuk meningkatkan fluiditas membran dan sebagian dehidrasi sel. Mekanisme kerja DMSO dalam pembekuan semen yaitu DMSO berdifusi dan menembus masuk ke dalam sel spermatozoa, mengganti air dalam sel spermatozoa, mencegah pembentukan kristal-kristal es intraselular sehingga mengurangi tekanan mekanik dalam sel, dan mengurangi konsentrasi garam atau sejumlah elektrolit intraselular. Selain itu, di dalam sel DMSO bekerja meningkatkan fluiditas membran (Andrey et al. 2007)
Beberapa penelitian melaporkan keberhasilan penggunaan DMSO dengan konsentrasi berbeda. Junaedi et al. (2016) melaporkan pada ayam kampung konsentrasi DMSO terbaik adalah 7% pada bahan pengencer yang sama. Han et al.
(2005) melaporkan konsentrasi DMSO terbaik dalam pembekuan semen itik adalah 10%, tetapi pengencer yang digunakan berbeda. Hal ini menunjukkan semen ayam atau unggas lainnya mempunyai toleransi terhadap konsentrasi dan jenis krioprotektan berbeda.
Tabel 8 Motilitas spermatozoa ayam SK Kedu dalam BPSE dan pengencer RL-KTmenggunakan DMSO konsentrasi 8%, 10%, dan 12%
Pengencer DMSO
(%) Setelah (Rerata±SEM) Motilitas Spermatozoa (%) pengenceran Ekuilibrasi Setelah thawingSetelah
BPSE 8 63.48±1.57 62.03±1.04 34.58±1.36bc
10 63.77±0.75 60.33±1.69 34.17±1.06c 12 62.34±1.21 61.16±2.07 34.58±1.01bc
RL-KT 8 63.52±1.21 59.77±1.13 38.75±1.25ab
10 63.86±1.41 62.10±1.49 40.83±1.67a 12 60.91±1.61 60.88±1.65 34.29±1.95c Angka-angka yang diikuti oleh huruf berbeda pada kolom yang sama menunjukkan perbedaan nyata (P<0.05)
21 osmotik pada kisaran normal sehingga tidak memengaruhi motilitas spermatozoa. Pengencer memiliki peranan yang penting yakni sebagai pengatur tekanan osmotik, pH, dan komponen ionik yang memengaruhi motilitas spermatozoa (Lim dan Le 2013; Alavi dan Cosson 2006) dan diperkirakan spermatozoa dapat beradaptasi dengan bahan pengencer saat ekuilibrasi. Waktu ekuilibrasi dibutuhkan oleh spermatozoa untuk beradaptasi dengan bahan pengencer.
Penelitian juga menunjukkan penurunan motilitas spermatozoa dari saat setelah pengenceran hingga setelah ekuilibrasi sangat kecil. Penurunan setelah ekuilibrasi ke setelah thawing sangat tinggi antara 21.02% sampai dengan 27.45%. Penurunan yang sangat tinggi tersebut dapat dipahami, karena spermatozoa mengalami perubahan suhu yang ekstrim dari 5 oC ke uap nitrogen cair (± -150 ºC) dan ke suhu nitrogen cair (-196 ºC). Spermatozoa juga mengalami perubahan suhu yang ekstrim pada saat thawing (37 ºC). Penurunan motilitas spermatozoa dihubungkan dengan peroksidasi lipid yang dialami sel spermatozoa saat pembekuan dan thawing. Proses peroksidasi mengakibatkan perubahan struktur sel, terutama pada bagian akrosom spermatozoa, kehilangan motilitas secara cepat, perubahan metabolik yang besar, dan kebocoran unsur intraselular spermatozoa (Tabatabaei dan Aghaei 2012), juga akibat cryoinjury sel saat
thawing (Sieme et al. 2008; Said et al. 2010).
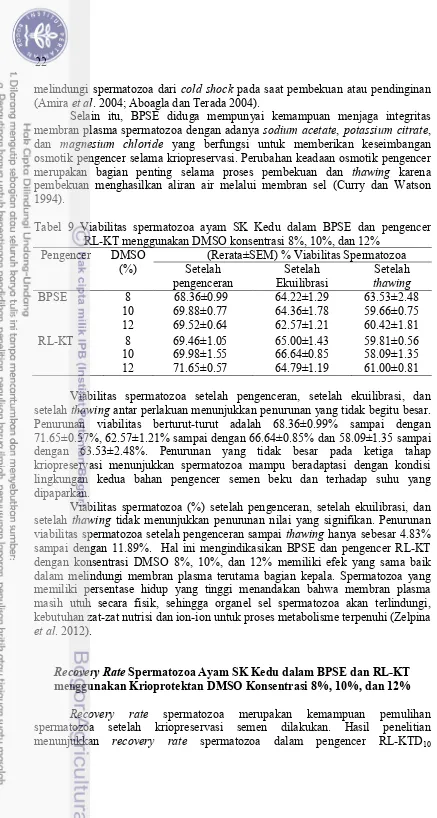
Viabilitas spermatozoa setelah pengenceran, setelah ekuilibrasi, dan setelah
thawing tidak berbeda (P>0.05) antar perlakuan (Tabel 9). Viabilitas spermatozoa yang tidak berbeda antar perlakuan menunjukkan optimalisasi tahapan kriopreservasi. Keberhasilan kriopreservasi dipengaruhi oleh optimalisasi semua tahapan kriopreservasi, mulai dari koleksi semen dan pengenceran, ekuilibrasi dengan krioprotektan yang sesuai, pembekuan pada uap nitrogen cair, penyimpanan dalam nitrogen cair, dan thawing sebelum inseminasi pada ayam betina (Sood et al. 2012). Pengujian viabilitas dilakukan menggunakan pewarnaan
eosin-nigrosin yang mengandung nigrosin dan ion natrium (Na+). Prinsip pewarnaan eosin-nigrosin didasarkan pada kemampuan spermatozoa hidup dalam menolak pewarna yang dipaparkan dan spermatozoa mati dalam menyerap warna sehingga kepala spermatozoa akan terwarnai. Hal ini dikaitkan dengan sel spermatozoa dalam menunjang kemampuan pompa ion masuk dan keluar sel. Mekanisme yang terjadi pada pengujian viabilitas spermatozoa didasarkan pada kemampuan pompa ion masuk dan keluar sel. Ion Na+ akan dipompa keluar sel dan K+ masuk sel. Ion Na+ yang tidak dapat dipompa keluar melewati membran sel menandakan hilangnya permeabilitas spermatozoa. Graham (2001) menjelaskan bahwa eosin nigrosin yang dipaparkan pada spermatozoa akan
masuk ke dalam sel yang mempunyaipermeabilitas membran tinggi. Spermatozoa
yang masih hidup akan mencegah atau memompa kembali eosin nigrosin yang dipaparkan sehinggaspermatozoa tidak menyerap warna.
22
melindungi spermatozoa dari cold shock pada saat pembekuan atau pendinginan (Amira et al. 2004; Aboagla dan Terada 2004).
Selain itu, BPSE diduga mempunyai kemampuan menjaga integritas membran plasma spermatozoa dengan adanya sodium acetate, potassium citrate, dan magnesium chloride yang berfungsi untuk memberikan keseimbangan osmotik pengencer selama kriopreservasi. Perubahan keadaan osmotik pengencer merupakan bagian penting selama proses pembekuan dan thawing karena pembekuan menghasilkan aliran air melalui membran sel (Curry dan Watson 1994).
Tabel 9 Viabilitas spermatozoa ayam SK Kedu dalam BPSE dan pengencer RL-KT menggunakan DMSO konsentrasi 8%, 10%, dan 12%
Pengencer DMSO
(%) Setelah (Rerata±SEM) % Viabilitas Spermatozoa pengenceran Ekuilibrasi Setelah thawingSetelah
BPSE 8 68.36±0.99 64.22±1.29 63.53±2.48 Viabilitas spermatozoa setelah pengenceran, setelah ekuilibrasi, dan setelah thawing antar perlakuan menunjukkan penurunan yang tidak begitu besar. Penurunan viabilitas berturut-turut adalah 68.36±0.99% sampai dengan 71.65±0.57%, 62.57±1.21% sampai dengan 66.64±0.85% dan 58.09±1.35 sampai dengan 63.53±2.48%. Penurunan yang tidak besar pada ketiga tahap kriopreservasi menunjukkan spermatozoa mampu beradaptasi dengan kondisi lingkungan kedua bahan pengencer semen beku dan terhadap suhu yang dipaparkan.
Viabilitas spermatozoa (%) setelah pengenceran, setelah ekuilibrasi, dan setelah thawing tidak menunjukkan penurunan nilai yang signifikan. Penurunan viabilitas spermatozoa setelah pengenceran sampai thawing hanya sebesar 4.83% sampai dengan 11.89%. Hal ini mengindikasikan BPSE dan pengencer RL-KT dengan konsentrasi DMSO 8%, 10%, dan 12% memiliki efek yang sama baik dalam melindungi membran plasma terutama bagian kepala. Spermatozoa yang memiliki persentase hidup yang tinggi menandakan bahwa membran plasma masih utuh secara fisik, sehingga organel sel spermatozoa akan terlindungi, kebutuhan zat-zat nutrisi dan ion-ion untuk proses metabolisme terpenuhi (Zelpina
et al. 2012).
Recovery Rate Spermatozoa Ayam SK Kedu dalam BPSE dan RL-KT
menggunakan Krioprotektan DMSO Konsentrasi 8%, 10%, dan 12%
Recovery rate spermatozoa merupakan kemampuan pemulihan