PRESERVASI DAN KRIOPRESERVASI SEMEN BABI
DALAM PENGENCER BTS DAN MIII YANG
DISUPLEMENTASI DENGAN DAN TANPA TREHALOSA
RENI RATNI DAPAWOLE
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Preservasi dan Kriopreservasi Semen Babi dalam Pengencer BTSdan MIII yang Disuplementasi dengan dan Tanpa Trehalosa adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Reni Ratni Dapawole
RINGKASAN
RENI RATNI DAPAWOLE. Preservasi dan Kriopreservasi Semen Babi dalam Pengencer BTS dan MIII yang Disuplementasi dengan dan Tanpa Trehalosa. Dibimbing oleh R IIS ARIFIANTINI, TUTY LASWARDI YUSUF dan WILMIENTJE MARLENE NALLEY.
Teknologi IB menggunakan semen beku pada ternak babi masih kurang diaplikasikan secara luas, hal ini disebabkan oleh komposisi membran plasma spermatozoa babi mudah mengalami cold shock. Trehalosa dilaporkan dapat meningkatkan fluiditas (kelenturan) dari membran plasma agar tidak mudah rusak pada saat pembekuan ataupun saat thawing. Penelitian ini bertujuan untuk mendapatkan komposisi bahan pengencer yang dapat mempertahankan kualitas spermatozoa dalam semen cair maupun semen beku babi.
Penelitian ini dilaksanakan dalam dua tahap: 1) Preservasi semen cair terdiri dari dua bagian yaitu pengaruh holding time (HT) dalam pengencer BTS®, dan menentukan konsentrasi trehalosa terbaik dalam pengencer BTS® dan BTSM (BTS Modifikasi) dalam mempertahankan semen cair babi 2) Kriopreservasi semen babi menggunakan pengencer BTS® dan BTS®-Trehalosa (BTS®-T) serta MIII® dan MIII®-Trehalosa (MIII®-T)
Pada tahap pertama bagian 1, semen dikoleksi dari tiga (3) ekor babi jantan bangsa Landrace berumur 2-3 tahun satu minggu dua kali menggunakan glove hand method. Semen dievaluasi secara makroskopis dan mikroskopis kemudian semen dibagi dalam tiga bagian dan diencerkan dengan menggunakan pengencer BTS® dan dilakukan HT selama 0, 1 dan 3 jam. Semen yang telah mengalami HT
0, 1 dan 3 dibagi masing-masing ke dalam dua tabung disimpan pada suhu 18°C dan 5°C. Pengamatan terhadap persentase motilitas dan viabilitas spermatozoa setiap tiga jam (18°C) dan setiap satu jam (5°C).
Pada tahap pertama bagian 2, koleksi dan evaluasi semen dilakukan sama dengan pada bagian 1. Semen segar dibagi menjadi delapan tabung, empat tabung pertama diencerkan menggunakan pengencer BTS® yang disuplementasi trehalosa 0 mM (BTS®
-T0), 50 mM (BTS®-T50), 100 mM (BTS®-T100) dan 150 mM (BTS®-T150) dan empat tabung kedua masing-masing diencerkan dengan BTS modifikasi (BTSM) yang disuplementasi dengan trehalosa 0 mM (BTSM-T0), 50 mM (BTSM-T50), 100 mM (BTSM-T100) dan 150 mM (BTSM-T150). Masing-masing pengencer dibagi dua tabung dan disimpan pada suhu 18°C dan 5°C. Pengamatan terhadap persentase motilitas dan viabilitas spermatozoa dilakukan setiap tiga jam (18°C) dan setiap satu jam (5°C).
Tahap kedua, semen dikoleksi dari sembilan (9) ekor babi jantan dari breed
disuplementasi trehalosa 0 mM (BTS®
-T0) dan 100 mM (BTS®-T100) dua tabung lainnya menggunakan MIII® yang disuplementasi trehalosa 0 mM (MIII®-T0) dan 100 mM ( MIII®-T100) keempat pengencer ditambahkan dengan gliserol 4%. Larutan lalu dikemas ke dalam macrotube 5 ml, diekuilibrasi pada suhu 5oC selama dua jam, dibekukan dalam uap nitrogen cair dan disimpan dalam kontainer nitrogen cair untuk pengujian lebih lanjut. Pengujian kualitas semen beku diawali dengan thawing macrotube pada suhu 52oC selama 45 detik. Keberhasilan pembekuan diuji dari persentase motilitas dan viabilitas spermatozoa.
Semen segar yang dihasilkan pada tahap I dan II menunjukkan kualitas yang baik dengan volume semen 242.86±34.50 ml dan 225.71±58.84 ml, pH 6.74±0.11 dan 6.79±0.15, berwarna putih keruh dengan konsistensi encer. Secara mikroskopis motilitas spermatozoa 73.57±3.78% dan 74.29±4.50%, konsentrasi spermatozoa 278.57±81.33x106 sel/ml dan 214.86±42.49x106 sel/ml, viabilitas spermatozoa 86.91±1.89% dan 86.74±6.45% dengan abnormalitas spermatozoa hanya 7.18±0.91% dan 7.15±1.42%.
Hasil penelitian menunjukkan motilitas dan viabilitas spermatozoa dengan HT 0 jam lebih baik (P<0.05) dibandingkan dengan HT selama 1 dan 3 jam. Motilitas spermatozoa semen cair babi lebih bertahan dalam pengencer BTSM (43.50±4.12%) selama 18 jam dibandingkan dengan BTS® (44.00±3.94%) hanya 12 jam. Konsentrasi trehalosa terbaik adalah 100 mM dengan motilitas 42.50±4.86% selama 21 jam pada BTSM dibandingkan konsentrasi lainnya.
Pada percobaan kedua kualitas semen setelah HT pada suhu 20-22oC menunjukkan motilitas spermatozoa yang sama antar pengencer antara 70.83±2.04 sampai dengan 71.67±2.58%. Setelah sentrifugasi spermatozoa pada pengencer BTS®
-T100 menunjukkan motilitas (69.17±2.04%) dan viabilitas (85.28±2.70%) lebih tinggi (P<0.05) dibandingkan dengan MIII®
-T0, tidak ada perbedaan kualitas antara MIII®
-T100 dan BTS®-T0 (P>0.05). Setelah ekuilibrasi motilitas spermatozoa dalam pengencer MIII®
-T0 hanya 57.50±5.24%, paling rendah (P<0.05) dibandingkan tiga pengencer lainnya. Motilitas spermatozoa setelah thawing dalam pengencer BTS®
-T100 adalah 30.00±4.47%, lebih tinggi (P<0.05) dibandingkan dengan MIII®
-T0 (21.67±7.53%), spermatozoa dalam BTS®
-T0 dan MIII®-T100 mM menunjukkan motilitas yang sama yaitu 24.17±9.17% dan 26.67±8.16%. Tidak terdapat perbedaan viabilitas spermatozoa pada keempat pengencer dengan nilai antara 68.20±2.06 sampai dengan 70.80±0.70%.
Kesimpulan dari penelitian ini adalah holding time tidak diperlukan untuk semen cair dan konsentrasi trehalosa 100 mM lebih baik dibandingkan konsentrasi lainnya. Kualitas semen beku dalam pengencer BTS® yang disuplementasi 100 mM trehalosa lebih baik dibandingkan BTS® tanpa trehalosa ataupun dan MIII® dengan ataupun tanpa trehalosa.
SUMMARY
RENI RATNI DAPAWOLE. Preservation and Cryopreservation of Boar Semen in BTS and MIII Extender Supplemented with and without Trehalose. Supervised by R. IIS ARIFIANTINI, TUTY LASWARDI YUSUF and WILMIENTJE MARLENE MESANG NALLEY.
Artificial Insemination (AI) is one of the efforts to increase the productivity and quality of live stock and known as the first generation of reproductive technology. Artificial insemination with frozen semen of boar is not widely applied; due to the plasma membrane composition of boar spermatozoa are extremely sensitive to cold shock. Trehalose has been reported increased the fluidity of plasma membrane during freezing and thawing. This research aimed to study supplementation of trehalose in BTS and MIII extender on the quality of chilled and frozen boar semen.
This research consists of two experiments. In experiment I, divided into two step. Step 1st was determination of holding time (HT) on the quality of chilled semen. Semen was collected from three Landrace boars age 2-3 years using glove hand method. The semen than evaluate macro and microscopically and divided into three equal tubes and diluted with BTS® than hold for 0, 1 and 3 hours at room temperature (27-28oC). Immediately after HT, each tube divided in two other tubes and stored at 18oC and 5oC. The qualities of semen were evaluated every three hours (18oC) and every hour for semen stored at (5oC). At the second step, the research aim to find out the best trehalose concentration on commercial and modification BTS extender. Semen collection and evaluation conducted as first step. immediately after evaluation semen divided into eight equal tubes, four of them diluted with BTS® supplemented with 0 mM trehalose BTS®-T0, 50 mM
(BTS®-T50), 100 mM (BTS®-T100) and 150 mM (BTS®-T150) and four other tubes
diluted with modified BTS (BTSM) supplemented with trehalose 0 mM (BTSM-T0), 50 mM (BTSM-T50), 100 mM (BTSM-T100) and 150 mM (BTSM-T150).
All diluted semen than divided into two tubes and than stored at 18°C and 5°C.
Semen quality were evaluate every three hours (18oC) and every hours for semen stored at (5oC).
In experiment II, boar semen cryopreservation using BTS® and MIII® with
submerged in liquid nitrogen (-196◦C) for further evaluation. After 24 hours of storage the semen than thawed at 52oC for 45 seconds.
The quality of fresh semen in the first and second step were normal with the average of semenvolume were 225.71±58.84 to 242.86±34.50 ml, pH 6.74±0.15 to 6.79±0.1, white-cloudyin color and wateryin consistency. Microscopically semen demonstrated 73.57±3.78% and 74.29±4.50% in motility, 86.91±1.89% and 86.74±6.45% in spermatozoa viability. The concentrations of spermatozoa were 214.86±42.49x106 to 278.57±81.33x106 cells/ml with only
7.15±1.42% and 7.18±0.91% spermatozoa abnormalities.
This research demonstrated that spermatozoa motility and viability with 0 holding time were significantly higher (P<0.05) than 1 or 3 h holding time. The motility of spermatozoa in the BTSM extender (43.50±4.12%) for 18 hours compared with BTS® (44.00±3.94%) for 12 hours. The best trehalose concentration was 100 mM compare to other.
In the second experiment, spermatozoa motility after two hours HT decreased by 2.04 to 2.58 % as well as after centrifugation decreased by 2.50 to 5.83%. After centrifugation spermatozoa motility and viability in BTS®-T100 were
69.17±2.04% and 85.28±2.70%, this was higher (P<0.05) compared to MIII®-T0.
Spermatozoa motility on MIII®
-T100 and BTS®-T0 were no different (P>0.05).
After equilibration the spermatozoa motility in MIII®-T0 extender was
57.50±5.24%, significantly lowest (P<0.05) compared to others extender. No differences on the viability of spermatozoa in all extenders. After thawing motility spermatozoa in BTS®-T100 was 30.00±4.47%, this was higher (P<0.05)
than MIII®-T0 (21.67±7.53%). Spermatozoa in BTS®-T0 (24.17±9.17%) were the
same with MIII®-T100 (26.67±8.16%). The spermatozoa viability after thawing
were 68.20±2.06 to 70.80±0.70% and there were no significant differences among four extenders.
In conclusion, this study reported holding time of chilled semen is not required; supplementation of 100 mM trehalose was the best concentration in BTSM. Post thawing motility of boar semen in BTS® supplemented 100 mM
trehalose was the best than other three extenders.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PRESERVASI DAN KRIOPRESERVASI SEMEN BABI
DALAM PENGENCER BTS DAN MIII YANG
DISUPLEMENTASI DENGAN DAN TANPA TREHALOSA
RENI RATNI DAPAWOLE
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Preservasi dan Kriopreservasi Semen Babi dalam Pengencer BTS dan MIII yang Disuplementasi dengan dan Tanpa Trehalosa
Nama : Reni Ratni Dapawole
NIM : B352110011
Program Studi : Biologi Reproduksi
Disetujui oleh Komisi Pembimbing
Prof Dr Dra R Iis Arifiantini, MSi Ketua
Prof Dr Drh Tuty L Yusuf, MS Dr Ir W Marlene Nalley, MS Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Biologi Reproduksi
Prof Dr Drh Mohamad Agus Setiadi Dr Ir Dahrul Syah, MScAgr
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas Anugrah dan Kasih-Nya sehingga penelitian dan penulisan tesis Preservasi dan Kriopreservasi Semen Babi dalam Pengencer BTS dan MIII yang Disuplementasi dengan dan Tanpa Trehalosa dapat diselesaikan. Tesis disusun sebagai salah satu syarat untuk menyelesaikan pendidikan Program Magister Sains pada Program Studi Biologi Reproduksi, Sekolah Pascasarjana Institut Pertanian Bogor.
Selama penelitian ini hingga selesainya tesis ini penulis banyak mendapat bantuan dari berbagai pihak, untuk itu penulis menyampaikan rasa terima kasih tulus kepada Komisi Pembimbing Prof Dr Dra Raden Iis Arifiantini, MSi, Prof Dr Drh Tuty Laswardi Yusuf, MS dan Dr Ir Wilmientje Marlene Nalley, MS atas bimbingan serta fasilitas dan pengarahan yang telah diberikan. Terima kasih juga kepada Prof Dr Drh Bambang Purwantara, MSc sebagai penguji dari luar komisi atas masukkan untuk perbaikan tesis ini. Terima kasih kepada UPTD Peternakan Tarus, Yayasan Williams dan Laura di Kupang-NTT, Unit Pelaksana Teknis Daerah (UPTD), Dinas Peternakan dan Kesehatan Hewan Provinsi Bali di Baturiti-Tabanan yang telah memberikan fasilitas dan ternak babi.
Terima kasih dan penghargaan sebesar-besarnya kepada kedua orang tua tercinta papa Piet Ng Dapawole dan mama Rosalin Dapawole-Leoanak serta kakak tersayang Wesly Christofel dan adik tersayang Melky Ratno dan Ryan Chresendo serta ponakan tersayang Tasya, beby Hulk, Inna, dan Keluaga Besar Dapawole-Leoanak dan Riupassa yang senantiasa memberikan do’a, semangat dan dukungan kepada penulis selama ini. Terima kasih yang spesial kepada tunangan tercinta John Riupassa yang selalu menemani dengan sabar dan mendukung sepenuh hati dalam penyelesaian studi ini. Tak lupa penulis ucapkan terima kasih kepada seluruh Staf dan Pegawai di bagian Divisi Reproduksi dan Kebidanan, Departemen Klinik Reproduksi dan Patologi, FKH-IPB, teman-teman BRP dan IBH angkatan 2011 dan 2012 FKH-IPB, teman-teman Flobamora-NTT dan PD. Hidup Baru, serta semua pihak yang tidak bisa disebutkan satu persatu.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Namun demikian, penulis berharap tesis ini bermanfaat bagi para pembaca dan perkembangan ilmu pengetahuan dan teknologi pada umumnya.
Bogor, 2014
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiv
I. PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 3
Tujuan Penelitian 3
Manfaat Penelitian 4
Hipotesis 4
II. TINJAUAN PUSTAKA 6
Ternak Babi 6
Fisiologi Semen Babi 6
Bahan Pengencer Semen Babi 8
Preservasi Semen Babi 9
Kriopreservasi Semen Babi 10
Trehalosa 11
Ekuilibrasi, Pembekuan dan Thawing 12
III. MATERI DAN METODE 13
Waktu dan Tempat Penelitian 13
Sumber Semen 13
Rancangan Penelitian dan Analisis Data 17
IV. HASIL DAN PEMBAHASAN 18
Simpulan 30
Saran 30
DAFTAR PUSTAKA 31
DAFTAR TABEL
1. Karakteristik Semen Babi 7
2. Komposisi Plasma Semen Babi 8
3. Komposisi Bahan Pengencer Semen Cair dengan Suplementasi
Trehalosa 15
4. Komposisi Pengencer Dasar BTS® dan MIII® 16
5. Komposisi Bahan Pengencer Semen Beku 16
6. Karakteristik Semen Segar Babi 18
7. Pengaruh Holding Time terhadap Persentase Motilitas Spermatozoa
Semen Cair Babi dalam Pengencer BTS® 20
8. Pengaruh Holding Time terhadap Persentase Viabilitas Spermatozoa
Semen Cair Babi dalam Pengencer BTS® 21
10. Pengaruh Suplementasi Trehalosa dalam Pengencer BTS® dan BTS Modifikasi terhadap Persentase Viabilitas Spermatozoa 24 11. Motilitas dan Viabilitas Spermatozoa Babi dalam Pengencer BTS®
dan MIII® setelah Dua Jam Holding Time 26 12. Motilitas dan Viabilitas Spermatozoa Babi dalam Pengencer BTS®
dan MIII® setelah Sentrifugasi 26
13. Motilitas dan Viabilitas Spermatozoa Babi dalam Pengencer BTS®
dan MIII® setelah Ekuilibrasi 27
14. Motilitas dan Viabilitas Spermatozoa Babi dalam Pengencer BTS®
dan MIII® setelah Thawing 28
DAFTAR GAMBAR
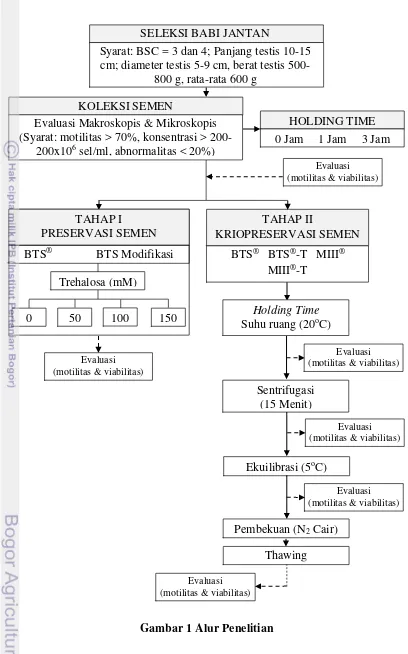
1. Alur Penelitian 5
1
I.
PENDAHULUAN
Latar Belakang
Ternak babi mempunyai peranan penting untuk menopang ketahanan pangan dan sebagai pelengkap sosial budaya pada masyarakat Nusa Tenggara Timur (NTT), sehingga memiliki potensi yang cukup besar untuk dikembangkan. Populasi babi pada tahun 2012 di NTT sebanyak 1.724.316 ekor, dengan jumlah pemotongan di RPH sebanyak 774.260 ekor, jumlah tersebut lebih besar dibandingkan jumlah pemotongan pada ternak kambing 205.732 ekor, domba 23.524 ekor dan sapi 72.709 ekor (Direktorat Jendral Peternakan 2012).
Salah satu upaya peningkatan produktivitas dan perbaikan mutu genetik ternak dapat dipercepat dengan penerapan berbagai teknologi di bidang peternakan diantaranya adalah teknologi reproduksi generasi pertama yaitu inseminasi buatan (IB). Teknologi ini sudah dilakukan secara intensif pada sapi, terutama sapi perah. Pada ternak lain, seperti pada kambing, domba, kuda dan babi sudah dilakukan tetapi masih dalam skala kecil dan terbatas. Inseminasi buatan pada babi telah dilakukan di Bali, Sumatera Utara, Kalimantan, dan Sulawesi. Pengembangan ternak babi di beberapa daerah sudah menerapkan pemeliharaan babi unggul yang berasal dari luar negeri, seperti Landrace, Duroc dan Yorkshire, maupun persilangannya yang digunakan sebagai induk atau pejantan tetapi pengembangbiakan sebagian besar masih dilakukan melalui perkawinan alami, sedangkan perkawinan melalui IB dilakukan secara terbatas menggunakan semen cair dengan mutu dan kualitas semen yang digunakan belum dikaji secara ilmiah.
Di Indonesia IB pada ternak babi masih menggunakan semen cair. Penggunaan semen beku untuk babi baru dilakukan di beberapa peternakan besar menggunakan semen beku impor dari Kanada dengan harga yang sangat mahal. Penggunaan semen beku memiliki keunggulan antara lain dapat digunakan dalam jangka waktu yang panjang serta mudah ditransportasikan. Untuk menghasilkan semen beku yang berkualitas diperlukan bahan pengencer yang dapat menjamin kebutuhan fisik dan kimia selama proses pendinginan, pembekuan maupun pada saat thawing.
Semen babi bersifat voluminous, memiliki ejakulat dengan volume yang banyak dapat mencapai 100-500 ml dengan konsentrasi spermatozoa yang rendah yaitu 200-300x106 sel/ml dibandingkan dengan semen ternak lainnya. Semen babi mempunyai komposisi asam lemak membran plasma spermatozoa pada yang berbeda dengan ternak lain dengan komposisi phosphatidylethanolamine dan
sphingomyelin sangat tinggi masing-masing mencapai 24% dan 14%, karena perbedaan ini menyebabkan semen babi sangat sensitif terhadap cold shock
2
Pada pengolahan semen cair berbagai aspek harus diperhatikan di antaranya komposisi bahan pengencer harus dapat memenuhi kebutuhan nutrisi dan dapat mempertahankan fungsi fisiologik spermatozoa selama penyimpanan. Bahan pengencer untuk semen babi tersedia di pasaran seperti Beltsville Thawing Solution (BTS®) dan MIII®. Pengencer BTS® merupakan bahan pengencer
berdaya simpan pendek/short-term dengan daya tahan 1-3 hari, sedangkan MIII®
merupakan bahan pengencer berdaya simpan sedang/medium-term dengan daya tahan 5-7 hari (Zhou et al. 2004). Pengencer MIII® mengandung Bovine Serum
Albumin (BSA) dan glisin. Peranan BSA adalah untuk mencegah perubahan pH, tekanan osmotik, serta melindungi spermatozoa selama proses pembekuan. Sedangkan Glisin berperan sebagai sumber nutrisi dan protein bagi kelangsungan metabolisme spermatozoa selama penyimpanan. Selain bahan pengencer komersial ada juga bahan pengencer modifikasi yang dibuat sesuai dengan komposisi yang dibutuhkan (Johnson et al. 2000).
Pada pengolahan semen beku, selain larutan penyangga (buffer) dan karbohidrat, komponen utama yang harus diperhatikan adalah krioprotektan. Komponen ini akan melindungi spermatozoa selama proses pembekuan dengan meminimalkan pembentukan kristal es intra maupun ekstra-seluler. Krioprotektan yang umum digunakan pada pembekuan semen mamalia adalah gliserol. Gliserol ini dikenal sebagai krioprotektan intra-seluler. Gliserol dapat melindungi sel spermatozoa pada bagian dalam pada saat pembekuan dari kristal es yang akan merusak spermatozoa (Holt 2000; Watson 2000). Konsentrasi gliserol yang digunakan untuk pembekuan semen babi adalah 4% (Buhr et al. 2001) atau 6% (Yi et al. 2002). Selain krioprotektan intra-seluler juga dikenal krioprotektan ekstra-seluler yang dapat melindungi spermatozoa dari pembentukan kristal es di luar sel. Krioprotektan ekstra-seluler yang biasa ditambahkan dalam pembekuan semen adalah karbohidrat bermolekul besar seperti trehalosa (Aisen et al. 2000).
Trehalosa adalah salah satu disakarida yang memiliki struktur paling baik dalam menstabilkan membran sel spermatozoa yang berfungsi sebagai krioprotektan ekstra-seluler, di samping sebagai sumber energi (Ahmad dan Aksoy 2012). Trehalosa memiliki peran penting untuk mencegah terjadinya dehidrasi sel pada membran plasma spermatozoa. Mekanisme kerja trehalosa adalah sebagai stabilisator membran sel dan membuat membran lebih stabil, serta melindungi membran sel dengan cara mengikat air ke protein dan ujung polar dari
phospholipid sehingga tidak mengalami kerusakan selama proses pembekuan (Aboagla dan Terada 2003). Molekul trehalosa dapat menyisip di antara
phospholipid penyusun membran plasma sehingga meningkatkan fluiditas (kelenturan) dari membran plasma agar tidak mudah rusak pada saat pembekuan ataupun saat thawing (Ahmad dan Aksoy 2012). Penelitian mengenai trehalosa dilaporkan dapat meningkatkan kualitas semen beku ternak di antaranya pada kuda (Arifiantini et al. 2010), anjing (Yildiz et al. 2000), domba (Aisen et al.
2000), kambing (Aboagla dan Terada 2004; Naing et al. 2010) dan babi (Hu et al.
2009).
3
menggunakan pengencer BTS® dan MIII® yang disuplementasi dengan trehalosa terbaik pada tahap I dengan tambahan krioprotektan gliserol 4%.
Kerangka Pemikiran
Semen babi mempunyai komposisi membran yang berbeda dengan ternak lainnya yaitu memiliki phosphatidylethanolamine dan sphingomyelin sangat tinggi mencapai 24% dan 14%, selain itu mudah cold shock dan hanya bisa disimpan pada suhu 18oC. Untuk mengurangi efek cold shock dilakukan holding
time dengan cara menyimpan semen pada suhu ruang (27-28oC) agar spermatozoa dapat beradaptasi pada suhu penyimpanan 18oC maupun 5oC. Pengaruh bahan pengencer menentukan kualitas spermatozoa selama proses penyimpanan.
Pengencer BTS® merupakan bahan pengencer berdaya simpan pendek/short-term (1-3 hari), sedangkan MIII® merupakan bahan pengencer berdaya simpan sedang/medium-term (5-7 hari). Pengencer MIII® mengandung
Bovine Serum Albumin (BSA) dan glisin. Pengencer BTS® dan MIII® bersifat sebagai buffer dan sumber energi berupa glukosa. Glukosa merupakan karbohirat yang biasanya dijumpai di dalam plasma semen dan umumnya ditambahkan ke dalam pengencer semen berbagai ternak yang paling mudah dimetabolisme oleh spermatozoa.
Trehalosa adalah disakarida yang terdiri atas dua glukosa dan merupakan struktur paling stabil dalam menjaga membran sel. Oleh karena itu pada penelitian ini dilakukan suplementasi trehalosa dalam bahan pengencer BTS® dan MIII®. Dengan adanya suplementasi tersebut diharapkan trehalosa dapat menstabilkan membran sel spermatozoa sehingga pada saat pendinginan dapat mengurangi efek
cold shock dan juga sebagai cadangan sumber energi bagi spermatozoa selama masa penyimpanan. Dengan holding time dan konsentrasi trehalosa yang tepat, akan dapat dihasilkan teknik dan komposisi bahan pengencer semen beku babi yang dapat digunakan untuk inseminasi buatan yang sampai saat ini belum dilaporkan di Indonesia.
Mengingat komposisi membran plasma babi yang mudah mengalami cold shock dan fungsi trehalosa yang bisa melindungi membran plasma, maka penelitian bertujuan untuk mempelajari lama waktu holding time terhadap kualitas semen cair babi, dan mengevaluasi pengencer BTS® dan BTS Modifikasi (BTSM) yang disuplementasi trehalosa untuk mempertahankan kualitas semen cair, serta membandingkan pengencer BTS® dan MIII® yang disuplementasi trehalosa dalam mempertahankan kualitas semen beku babi.
Tujuan Penelitian
Tujuan Umum :
4
Tujuan Khusus :
Tujuan khusus dari penelitian ini adalah untuk : 1. Membandingkan waktu holding time yang tepat
2. Menguji kualitas semen cair pada pengencer BTS® dan BTS modifikasi yang disuplementasi trehalosa
3. Membandingkan kualitas semen beku dalam pengencer BTS® dan MIII® dengan suplementasi trehalosa terbaik.
Manfaat Penelitian
Dari penelitian ini diharapkan akan memperoleh teknik pengolahan semen cair dan semen beku agar dihasilkan semen yang berkualitas untuk diinseminasikan pada babi betina dalam rangka peningkatan mutu genetik ternak.
Hipotesis
1. Holding time 3 jam lebih baik dibandingkan dengan 0 dan 1 jam terhadap kualitas semen cair babi
2. Suplementasi trehalosa pada pengencer BTS® dan BTS modifikasi dapat mempertahankan motilitas spermatozoa selama preservasi
5
Gambar 1 Alur Penelitian
KOLEKSI SEMEN
SELEKSI BABI JANTAN
Syarat: BSC = 3 dan 4; Panjang testis 10-15 cm; diameter testis 5-9 cm, berat testis
500-800 g, rata-rata 600 g
Evaluasi (motilitas & viabilitas) Evaluasi Makroskopis & Mikroskopis
(Syarat: motilitas > 70%, konsentrasi > 200-200x106 sel/ml, abnormalitas < 20%)
6
II.
TINJAUAN PUSTAKA
Ternak Babi
Ternak babi yang dikembangkan di Indonesia termasuk di NTT dan Bali adalah bangsa Landrace, Yorkshire, Duroc, Hampshire dan Berkshire. Babi Landrace berasal dari Denmark, dan termasuk tipe bacon yang berkualitas tinggi dan dikembangkan di tiga negara yaitu Belgia, Amerika dan Inggris, sehingga disebut juga American Landrace, Belgia Landrace dan British Landrace (Holden dan Ensminger 2006). Ciri-ciri babi Landrace ini adalah babi Landrace lebih panjang dari pada bangsa babi lainnya karena memiliki tulang punggung yang panjang, bulunya berwarna putih, rata dan halus, produksi daging tinggi, tubuh panjang dan lebar, kepala agak panjang dengan telinga terkulai, leher panjang, punggung berbentuk seperti busur, puting susu pada satu sisi enam sampai tujuh buah, kaki letaknya baik dan kuat dengan paha yang padat serta tumit yang kuat. Babi jantan dewasa berbobot sekitar 320-410 kg dan induk berbobot sekitar 250-340 kg (Anderson 2000). Babi Yorkshire berasal dari Inggris dan di beberapa negara lain dinamakan Large White. Ciri-cirinya berwarna tubuh putih tapi adakalanya terdapat totol pigmen hitam di kulit, telinga tegak dan badan berisi (memiliki kualitas daging tinggi). Babi jantan dewasa berbobot sekitar 320-455 kg dan induk berbobot sekitar 225-365 kg. Sedangkan babi Duroc merupakan persilangan dari dua bangsa babi yaitu Jersey Reds dan Duroc dari New York. Ciri-ciri warna tubuh merah terang hingga gelap, kuku hitam, tubuhnya padat dan prolifik. Babi jantan dewasa berbobot sekitar 295-455 kg dan induk berbobot sekitar 275-320 kg (Sihombing 2006).
Fisiologi Semen Babi
Semen Babi
Semen adalah cairan semi-gelatin yang disekresikan oleh organ reproduksi hewan jantan pada saat ejakulasi. Terdiri atas dua bagian, yaitu sel gamet yang disebut spermatozoa dan cairan plasma (plasma semen). Semen babi bersifat
voluminous, memiliki ejakulat dengan volume yang banyak dapat mencapai 100-500 ml dengan konsentrasi spermatozoa yang rendah yaitu 200-300x106 sel/ml (Shipley 1999; Garner dan Hafez 2000). Hal ini disebabkan karena pejantan menaiki betina secara berulang sebelum terjadinya ejakulasi yang sempurna. Proses ejakulasi pada babi jantan berlangsung relatif lama yaitu dapat berkisar 3-20 menit untuk satu proses ejakulasi yang sempurna. Awal dari gerakan-gerakan memasukan penis akan berakhir beberapa menit dan disertai oleh sekresi cairan yang terlihat hampir bening, agak lengket dan mengandung sejumlah bahan gelatin yang menyerupai jelly. Segera setelah gerakan-gerakan memasukkan penis selesai, pejantan menjadi tenang dan volume semen meningkat drastis.
7
tidak mengandung spermatozoa, hanya berupa gelatin dari kelenjar bulbouretralis (kelenjar Cowper) yang mencapai 20% dari total volume semen. Fraksi kaya-spermatozoa (Fraksi kaya kaya-spermatozoa berisi gel) merupakan fraksi semen yang memiliki komponen spermatozoa dan plasma semen dengan konsentrasi 600-1000x106 sel/ml, fraksi ini biasanya memiliki volume sekitar 100-300 ml. Pada babi jantan muda mengandung 20-30 % spermatozoa dan sekitar 100-500 ml pada babi jantan dewasa. Sedangkan fraksi pasca-spermatozoa mengandung sedikit spermatozoa, lebih banyak mengandung cairan dari kelenjar assesoris lainnya, yaitu kelenjar prostat dan kelenjar vesicularis (Tabel 1).
Tabel 1 Karakteristik Semen Babi
Parameter Jumlah
Volume Semen (ml) 150-400
Konsentrasi Spermatozoa (106 sel/ml) 150-300
Motilitas Spermatozoa (%) 50-80
Morfologi Spermatozoa Normal (%) 70-90
Protein (%) 3.7
pH 7.3-7.8
Sumber : Garner dan Hafez (2000)
Spermatozoa babi
Spermatozoa merupakan gamet jantan yang diproduksi oleh tubuli seminiferi testis. Spermatozoa sebagai hasil akhir proses spermatogenesis merupakan sel yang berbentuk memanjang dengan bagian kepala pipih dan ekor yang panjang (Garner dan Hafez 2000). Spermatozoa normal terdiri atas bagian kepala dan ekor dimana kepala berbentuk oval memanjang, lebar dan datar. Menurut Hirai et al. (2001) panjang dan lebar kepala spermatozoa babi (Sus Scrofa Domestica) masing-masing adalah 9.27±0.05 µm dan 4.66±0.02 µm.
Bagian kepala spermatozoa memegang peranan sangat penting dalam keberhasilan fertilisasi, karena terdapat enzim hyaluronidase yang dapat menembus dinding sel telur dan membawa kromosom (heredity) yang mengandung deoxy-ribonucleid acid (DNA) serta dilindungi oleh tudung akrosom.
Ekor spermatozoa dibagi menjadi tiga bagian yaitu mid piece, principal piece dan end piece. Bagian ekor ini terdiri dari aksonema, aksonema itu sendiri dibungkus oleh banyak mitokondria. Mitokondria ini digunakan sebagai sumber energi bagi motilitas spermatozoa, oleh karena itu ekor berperan sebagai sarana penggerak bagi spermatozoa untuk mencapai fertilisasi dengan bantuan sel-sel mitokondria yang terdapat pada pangkal ekor spermatozoa dengan memanfaatkan karbohidrat sebagai sumber energi (Garner dan Hafez 2000).
Pada proses fertilisasi, spermatozoa harus mempunyai energi yang cukup untuk pergerakkan, protein dan senyawa lain yang penting selama dalam saluran kelamin betina, dan plasma membran yang baik sehingga dapat melakukan fertilisasi tepat waktu (Purdy et al. 2010). Abnormalitas spermatoa pada babi yang digunakan dalam program IB tidak boleh lebih dari 20% (Johnson et al.
8
Plasma Semen Babi
Plasma semen merupakan campuran sekresi dari epididimis dan kelenjar- kelenjar assesoris seperti vesikularis dan kelenjar prostat. Plasma semen babi berbeda komposisinya dengan ternak lain, di dalamnya banyak mengandung senyawa kimia (anorganik) dan biokimia (organik). Senyawa anorganik seperti Na, Cl, Ca, Mg dan K yang berperan dalam menjaga integritas membran dan tekanan osmotik. Sedangkan senyawa organik seperti fruktosa, asam sitrat, serbitol, inositol, glycerylphosphoryl-choline (GPC), ergotionin dan prostaglandin (Garner dan Hafez 2000).
Di dalam plasma semen juga terkandung protein kasar sekitar 3.7% yang terdiri atas asam-asam amino, peptida dan mucoprotein, serta terdapat berbagai enzim, vitamin, lipid dan asam lemak (Tabel 2).
Tabel 2 Komposisi Plasma Semen Babi
Untuk menjamin kebutuhan fisik dan kimia agar spermatozoa dapat mempertahankan kelangsungan hidupnya selama proses preservasi harus ditambahkan bahan pengencer. Syarat bahan pengencer antara lain mengandung unsur-unsur yang hampir sama dengan sifat fisik dan kimia semen, tidak boleh mengandung zat-zat yang bersifat racun baik terhadap spermatozoa maupun terhadap seluran kelamin betina dan tetap mempertahankan daya hidup serta tidak membatasi daya fertilitas spermatozoa (Purdy 2006).
9
Bahan pengencer semen babi telah banyak diteliti dan dikembangkan untuk mendukung program IB di antaranya adalah susu skim, tris, maupun pengencer laktosa, karbohidrat dan kuning telur. Bahan pengencer semen babi berdasarkan daya simpannya, diklasifikasikan menjadi tiga tipe yaitu berdaya simpan pendek/short-term extender 1-3 hari, berdaya simpan sedang/medium-term extender dengan daya tahan 5-7 hari (Johnson et al. 2000; Gadea 2003; Robert 2006), serta berdaya simpan panjang/long-term extender dengan daya tahan 7-12 hari (Zhou et al. 2004).
Bahan pengencer tipe pendek/short-term extender di antaranya adalah
Beltsville Liquid (BL–1), BeltsvilleThawing Solution (BTS®), Illinois Variable Temperature (IVT), tipe sedang/medium-term extender adalahMIII® (Zhou et al.
2004), dan tipe Long-term extender adalah Acromax®, Androhep®, Modena, X-Cell®, Zorlesco dan Zorpva (Johnson et al. 2000; Gadea 2003; Sumardani 2007).
Penggunaan BTS® sebagai bahan pengencer sangat bermanfaat dalam preservasi spermatozoa babi. Pengencer BTS® merupakan pengencer tipe
short-term/berdaya simpan pendek. Penelitian oleh Kommisrud et al. (2002) menggunakan pengencer BTS® selama enam jam penyimpanan pada suhu 16-18oC menunjukkan persentase motilitas spermatozoa 79.8%. Hasil penelitian Kardivel et al. (2005) melaporkan bahwa pengencer BTS® dan Modena® dapat digunakan sebagai pengencer semen babi dengan daya simpan selama empat hari pada suhu 17oC, dengan motilitas spermatozoa pada pengamatan hari keempat mencapai 64.43% dengan pengencer BTS® dan 61.87% dengan pengencer Modena®.
Penggunaan MIII® sebagai bahan pengencer karena mengandung bahan bersifat buffer, berfungsi sebagai pengatur tekanan osmotik dan juga menetralisis asam laktat yang dihasilkan dari sisa metabolisme spermatozoa. Pengencer MIII® juga mengandung BSA dan glisin. BSA sebagai penyangga (buffer) berperan untuk mencegah efek membahayakan terhadap perubahan pH akibat terbentuknya asam laktat, tekanan osmotik, menghambat pertumbuhan bakteri, dan melindungi sel spermatozoa selama proses pembekuan. Sedangkan glisin berperan sebagai sumber nutrisi dan protein bagi spermatozoa selama penyimpanan dan sebagai bahan yang mampu melindungi membran spermatozoa dari pengaruh cold shock.
Preservasi Semen Babi
Preservasi semen adalah usaha untuk mempertahankan kualitas semen dan memperbanyak ejakulat dari pejantan unggul dengan melakukan pengenceran semen menggunakan beberapa bahan pengencer (Garner dan Hafez 2000). Pengenceran dapat memperbanyak volume semen sehingga memungkinkan untuk melakukan inseminasi terhadap betina dalam jumlah lebih banyak dari satu ejakulat. Syarat setiap bahan pengencer adalah harus dapat menyediakan nutrisi bagi kebutuhan spermatozoa selama penyimpanan dan memungkinkan spermatozoa dapat bergerak secara progresif, tidak bersiafat racun, menjadi penyangga bagi spermatozoa, dan dapat melindungi spermatozoa dari cold shock
dalam semen cair maupun semen beku (Hafez 2000).
10
penurunan suhu dapat mengakibatkan perubahan pada struktur phospholipid
membran plasma dari fase cair menjadi fase gel, sehingga menyebabkan kerusakan membran plasma secara permanen. Semen babi yang telah diencerkan hanya dapat disimpan pada suhu rendah dengan kisaran 15-20°C (Paulenz et al. 2000) dalam waktu rata-rata 3-7 hari tergantung dari pengencer yang digunakan (Johnson et al. 2000; Gadea 2003; Robert 2006).
Dalam pengolahan semen babi, diperlukan pemisahan gel yang umum dilakukan dengan hanya mengoleksi fraksi kaya-spermatozoa. Hal tersebut dilakukan dengan tujuan untuk meningkatkan jumlah spermatozoa per ml. Spermatozoa akan mengalami berbagai perubahan lingkungan seperti perubahan tekanan osmotik, pH maupun suhu yang ekstrim sehingga akan mengganggu daya tahan hidupnya. Oleh karena itu, berbagai aspek harus diperhatikan di antaranya komposisi bahan pengencer harus dapat memenuhi kebutuhan dan dapat mempertahankan fungsi fisiologik spermatozoa selama penyimpanan. Penggunaan disakarida dan oligosakarida pada beberapa ternak bertujuan untuk mempertahankan kualitas semen cair maupun semen beku (Yildiz et al. 2000). Perlu diketahui bahwa tingkat keberhasilan dalam preservasi semen babi tidak hanya dipengaruhi oleh faktor bahan pengencer akan tetapi juga dari holding time.
Untuk mengurangi pengaruh cold shock, sebelum disimpan pada suhu preservasi semen harus disimpan pada suhu ruang selama beberapa jam yang dikenal dengan istilah holding time. Menurut Casas dan Althouse (2013) holding time adalah waktu antara koleksi semen sampai suhu diturunkan menjadi suhu preservasi (15-20oC). Selanjutnya dikatakan, bahwa semen babi yang mengalami
holding time memiliki kualitas spermatozoa dan membran plasma yang baik, dibandingkan dengan spermatozoa babi yang tanpa perlakuan holding time.
Menurut Eriksson et al. (2001) sebelum dipreservasi holding time perlu dilakukan dengan tujuan agar spermatozoa tidak mengalami cold shock ketika berada pada suhu preservasi 15-20oC.
Kriopreservasi Semen Babi
Kriopreservasi semen babi telah dimulai sejak tahun 1960 sampai sekarang, namun, perkembangannya belum sebaik kriopresevasi pada spesies lain, karena spermatozoa babi lebih sensitif terhadap cold shock (Buhr et al. 2001). Kriopreservasi merupakan suatu teknik penyimpanan sel hewan, tumbuhan ataupun materi genetika lain (termasuk semen) dalam keadaan pada suhu yang sangat rendah (-196oC) dalam nitrogen cair (Boediono 2003), melalui reduksi aktivitas metabolisme tanpa memengaruhi organel-organel di dalam sel sehingga fungsi fisiologis, biologis, dan morfologi tetap ada (Gazali dan Tambing 2002). Tujuan utama kriopreservasi semen ialah untuk melestarikan plasma nutfah yang mendekati kepunahan dan mendukung program teknologi IB pada ternak. Oleh karena itu, kriopreservasi sangat penting dilakukan agar dapat memanfaatkan semen dalam jangka waktu yang lama.
11
penurunan suhu saat proses pembekuan berlangsung (Jonhson et al. 2000) dan perubahan intra-seluler akibat pengeluaran air akibat adanya pembentukan kristal-kristal es. Dengan terbentuknya kristal-kristal-kristal-kristal es, maka akan berakibat terjadinya penumpukan elektrolit dan bahan terlarut lainnya di dalam larutan atau di dalam sel. Kristal-kristal es intra-seluler tersebut ternyata dapat merusak spermatozoa secara mekanik.
Kriopreservasi menyebabkan terjadinya penurunan suhu yang mengakibatkan terjadinya kerusakan membran plasma. Selain itu, konsentrasi elektrolit yang berlebihan akan dapat menyebabkan larutnya selubung lipoprotein dinding sel spermatozoa dan apabila saat pencairan kembali semen beku (thawing) untuk proses inseminasi, maka permeabilitas membran sel akan berubah dan menyebabkan kematian sel spermatozoa. Untuk mencegah terjadinya masalah tersebut, maka perlu diberikan krioprotektan selama proses pembekuan.
Krioprotektan adalah zat kimia non elektrolit yang berfungsi mereduksi pengaruh letal akibat proses kriopreservasi. Kerusakan akibat kriopreservasi diantaranya berupa efek larutan dan pembentukan kristal es ekstra serta intra-seluler sehingga dapat menjaga viabilitas sel (Purdy 2006). Penambahan krioprotektan dapat melindungi spermatozoa dari efek yang mematikan selama proses pembekuan dengan memodifikasi kristal-kristal es yang dapat terbentuk dalam medium sewaktu pembekuan menjadi lebih kecil sehingga mampu menghambat kerusakan sel secara mekanis pada waktu penurunan suhu (cooling rate).
Trehalosa
Trehalosa (C12H22O11) yang merupakan gula nonpereduksi golongan disakarida (α-D-glukopiranosil-α-D-glucopyranoside) dari dua molekul glukosa yang terikat melalui ikatan α-1.1, trehalosa bukan merupakan gula pereduksi, karena dua atom karbon anomerik berikatan satu sama lain (Ahmad dan Aksoy 2012). Trehalosa merupakan disakarida yang memiliki struktur paling baik yang berperan dalam menstabilkan membran sel (Higashiyama 2002), sehingga menunjukkan kemampuan yang optimal dalam melindungi sel.
Trehalosa yang ditambahkan di dalam pengencer diduga akan berasosiasi dengan karbohidrat yang ada pada selubung sel dan meningkatkan fluiditas membran pada suhu rendah, sehingga membran plasma dapat terlindungi dari kerusakan secara mekanik selama proses pengolahan berlangsung terutama saat penyimpanan pada suhu rendah (Aboagla dan Terada 2003). Sebagai krioprotektan ekstra-seluler, trehalosa berperan dalam melindungi membran plasma sel spermatozoa dari proses perusakan akibat pengaruh cold shock selama penyimpanan pada suhu rendah, dan cold shock tersebut berkaitan dengan perubahan phospholipid yang menyusun membran plasma sel.
12
Ekuilibrasi, Pembekuan dan Thawing
Ekuilibrasi adalah waktu yang dibutuhkan oleh spermatozoa untuk menyesuaikan diri sebelum pembekuan, dilakukan dengan cara menempatkan semen pada pada suhu kulkas 5oC selama dua jam. Ekuilibrasi pada sapi dan domba dilakukan empat jam (Arifiantini et al. 2010; Herdis et al. 2005). Pada babi menurut Yi et al. (2008) ekulibrasi dilakukan selama dua jam pada temperatur 5oC. Setelah ekuilibrasi selesai dilakukan, tahap selanjutnya adalah pembekuan semen. Pembekuan semen dilakukan pada uap nitrogen N2 cair, menggunakan kotak Styrofoam. Macrotube ditempatkan pada rak pembekuan dengan jarak 4 cm dari permukaan N2 cair. Pada sapi selama 10 menit (Arifiantini
et al. 2010) sedangkan pada babi selama 20 menit bergantung kemasan yang digunakan (Yi et al. 2008). Semen beku tersebut disimpan dalam kontainer N2 cair (-196oC) sampai dilakukan evaluasi lebih lanjut.
Thawing atau pencairan kembali merupakan periode kritis karena berhubungan dengan perubahan suhu yang sangat menentukan daya fertilisasi spermatozoa yang dapat memengaruhi motilitas spermatozoa. Selama thawing
13
III.
MATERI DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di dua tempat yaitu 1) Laboratorium Peternakan milik Yayasan Williams dan Laura di Tilong-Kupang, Nusa Tenggara Timur (NTT) untuk semen cair, 2) Unit Pelaksana Teknis Daerah (UPTD), Dinas Peternakan dan Kesehatan Hewan Provinsi Bali di Baturiti-Tabanan untuk semen beku, mulai dari bulan Juli 2013 sampai dengan bulan Febuari 2014.
Sumber Semen
Sumber semen untuk semen cair berasal dari tiga (3) ekor babi jantan bangsa Landrace yang telah dewasa kelamin, umur berkisar antara 2-3 tahun dalam kondisi yang sehat dan merupakan hasil seleksi dari beberapa ekor babi jantan. Sedangkan untuk semen beku berasal dari sembilan (9) ekor babi jantan dari dua breed (Duroc dan Landrace) yang telah dewasa kelamin, umur berkisar antara 5-6 tahun dalam kondisi yang sehat.
Babi tersebut dipelihara dalam kandang individual yang dilengkapi dengan tempat pakan dan minum. Pakan yang diberikan berupa pakan yang mengandung protein 18% dan energi 16 kkal, dengan bahan pakan yang terdiri dari dedak padi, dedak jagung, polar, gandum, konsentrat 152, mineral dan starbio, dengan total pemberian pakan sebanyak 2,5 kg/ekor/hari, serta air minum yang diberikan secara ad libitum.
Metodologi Penelitian
Penelitian ini dilaksanakan dalam dua tahap, yaitu :
1. Preservasi semen cair terdiri dari dua bagian yaitu pengaruh Holding Time
dalam pengencer BTS®, dan perbandingan pengencer BTS® dan BTS Modifikasi yang disuplementasi dengan dan tanpa.
2. Kriopreservasi semen menggunakan pengencer BTS®, BTS®-Trehalosa dan MIII®, MIII®-Trehalosa dengan penambahan gliserol 4%.
Preservasi Semen Babi
Pengaruh Holding Time dalam Pengencer BTS®
14
Penyiapan Bahan Pengencer Semen
Pengencer semen yang digunakan adalah BTS® 50 g (Minitub, Germany), diencerkan sampai 1 liter aquadest, selanjutnya pengencer disimpan pada suhu 27oC.
Koleksi Semen
Penampungan semen babi dilakukan dengan metode manual (glove hand method) menggunakan dummy sow pada pagi hari dengan periode dua (2) kali dalam seminggu. Semen hasil koleksi ditampung dalam tabung penampung yang dilengkapi dengan kain kasa untuk menyaring fraksi gelatin.
Evaluasi Semen
Evalusi semen dilakukan secara makroskopis dan mikroskopis. Evaluasi secara makroskopis meliputi pengukuran volume semen (ml), warna: krem-putih kekuningan, konsistensi: encer dan sedang, derajat keasamaan (pH) diukur menggunakan indikator pH. Sedangkan evaluasi secara mikroskopis meliputi motilitas spermatozoa (%), konsentrasi spermatozoa (106), viabilitas spermatozoa (%), morfologi spermatozoa (%). Penilaian mikroskopis meliputi:
Persentase Motilitas Spermatozoa: dinilai dengan cara meneteskan satu tetes semen dengan satu tetes NaCl fisiologis 0.9%, kedua larutan dihomogenkan dan diambil satu tetes kemudian dipindahkan ke gelas objek dan ditutup dengan cover glass kemudian diamati menggunakan mikroskop cahaya pembesaran 10x40. Persentase motilitas dapat dinilai secara subjektif dengan membandingkan spermatozoa motil bergerak ke depan (progresif) dan yang tidak progresif. Penilaian diberikan dari angka 0% (tidak motil) sampai 100% (motil semua).
Konsentrasi Spermatozoa: per ml dihitung menggunakan Neubauer Chamber
dengan pengenceran 100 kali (10 µL dalam 990 µL dalam formol saline).
Persentase Viabilitas: menggunakan zat pewarna eosin-nigrosin (Arifiantini 2012), kemudian dilakukan ulasan cepat dan dikeringkan. Pemeriksaan dilakukan di bawah mikroskop cahaya pembesaran 10x40. Spermatozoa dihitung minimal 200 sel dari 10 lapang pandang. Spermatozoa yang hidup tidak menyerap warna (transparan) dan yang mati akan menyerap warna merah pada bagian kepala.
Morfologi Spermatozoa: dievaluasi dengan pewarnaan eosin-nigrosin, dilanjutkan dengan pemeriksaan di bawah mikroskop cahaya dengan pembesaran 10x40.
Syarat semen yang diproses selanjutnya harus memiliki motilitas >70% dengan konsentrasi >200x106 sel/ml dengan abnormalitas < 20%, diproses untuk semen cair. Semen yang memenuhi persyaratan, diencerkan dengan BTS® menggunakan dosis inseminasi 3000x106 sel/100 ml dengan perhitungan pengenceran sebagai berikut:
Total Vol = Vol. Semen x Konsentrasi Spermatozoa x Motilitas x Vol/Tube Konsentrasi / dosis
Vol. Pengencer = Total Volume-Volume Semen.
Pengenceran Semen
27-15 motilitas progresif dan viabilitas spermatozoa dilakukan setiap tiga jam untuk suhu 18oC dan setiap satu jam untuk suhu 5oC, hingga motilitas spermatozoa sampai 40%.
Perbandingan Pengencer BTS® (Commercial Extender) dan BTS Modifikasi (BTSM) yang Disuplementasi dengan dan Tanpa Trehalosa
Penyiapan bahan pengencer semen
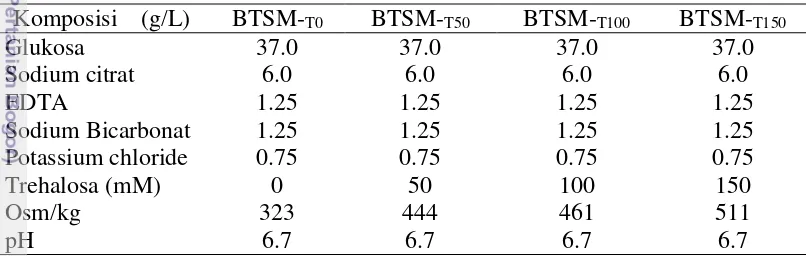
Pengencer semen BTS®, diperoleh dari minitub Indonesia, sedangkan BTS modifikasi, dibuat sesuai resep Johnson et al. (2000) disajikan pada Tabel 3. Tabel 3 Komposisi Bahan Pengencer Semen Cair dengan Suplementasi Trehalosa
Komposisi (g/L) BTSM-T0 BTSM-T50 BTSM-T100 BTSM-T150
(BTS Modifikasi-Trehalosa 100 mM), BTSM-T150 (BTS Modifikasi-Trehalosa 150 mM).
2.Untuk BTS komersial juga disuplementasi dengan trehalosa seperti pada BTS Modifikasi.
Koleksi Semen dan Evaluasi Semen
Sumber semen yang digunakan untuk penelitian tahap ini sebanyak tiga (3) ekor dengan ulangan tiga kali. Koleksi dan evaluasi semen babi yang dilakukan sama seperti pada penelitian tahap I.
Pengenceran Semen
16
Penyimpanan dan Evaluasi Semen
Semen cair disimpan pada suhu 18oC (kotak styrofoam) dan 5oC (lemari es). Kualitas semen yang diuji adalah motilitas dan viabilitas spermatozoa yang dilakukan setiap tiga jam untuk suhu18oC dan setiap satu jam untuk suhu 5oC hingga motilitas spermatozoa sampai 40%.
Kriopreservasi Semen Babi
Kriopreservasi semen babi dilakukan menggunakan dua pengencer yang disuplementasi dengan dan tanpa trehalosa yang ditambahkan gliserol 4% (Buhr
et al. 2001) dengan suplementasi trehalosa. Penyiapan bahan pengencer semen
Bahan pengencer yang digunakan pada penelitian ini adalah pengencer komersial BTS® dan MIII®. Bahan pengencer terdiri atas pengencer dasar (Tabel 4) dan pengencer semen beku yaitu pengencer dasar yang disuplementasi dengan trehalosa 100 mM (konsentrasi terbaik pada penelitian tahap I) dengan krioprotektan gliserol 4% (Tabel 5).
Tabel 4 Komposisi Pengencer Dasar BTS® dan MIII® Bahan BTS® MIII®
BTS (g) 50 -
MIII (g) - 60
Aquadest ad (ml) 1000 1000
Tabel 5 Komposisi Bahan Pengencer Semen Beku
Bahan BTS® BTS®-T MIII® MIII®-T dalam seminggu penampungan. Semen hasil koleksi ditampung dalam tabung penampung yang dilengkapi dengan kain kasa untuk menyaring fraksi gelatin.
Semen yang diperoleh dievaluasi secara makroskopis dan secara mikroskopis. Semen yang memiliki motilitas >70% dengan konsentrasi >200x106 sel/ml dengan abnormalitas <20% digunakan dalam penelitian ini.
Pengenceran dan Pembekuan Semen
Semen dibagi ke dalam empat tabung, dimana dua tabung pertama ditambah dengan pengencer dasar BTS® dan dua tabung lainnya ditambah pengencer dasar
17
suhu ruang (20-22oC) selama dua jam (holding time), selanjutnya disentrifugasi dengan kecepatan 2000 RPM selama 15 menit. Setelah disentrifugasi, supernatan dibuang dan pellet (spermatozoa) diencerkan kembali sesuai perlakuan. Dua tabung pertama yang disentrifugasi menggunakan pengencer BTS® diencerkan menggunakan BTS® semen beku dan BTS®-T, sedangkan dua tabung lainnya menggunakan pengencer MIII diencerkan menggunakan MIII® dan MIII®-T.
Semen yang telah diencerkan dikemas dalam macrotube 5 ml (Minitüb. Tiefenbach, Germany) kemudian disusun dalam rak pembekuan dan diekuilibrasi pada suhu 5oC selama dua jam. Pembekuan semen dilakukan pada uap nitrogen N2 cair dengan jarak 4 cm dari permukaan N2 cair selama 20 menit (Yi et al. 2008), semen beku disimpan di dalam kontainer N2 cair (-196oC) untuk pengujian lebih lanjut.
Evaluasi Pasca Pembekuan
Pengujian semen beku dilakukan dengan cara mencairkan kembali semen beku (thawing) dalam air hangat (52oC) selama 45 detik. Setelah itu dilakukan pemeriksaan kualitas semen meliputi persentase motilitas dan viabilitas spermatozoa.
Pengujian Motilitas
Spermatozoa dinilai dengan cara meneteskan satu tetes semen di atas gelas objek yang telah dihangatkan dan ditutup dengan cover glass, kemudian diamati menggunakan mikroskop cahaya dengan pembesaran 10x40. Persentase motilitas spermatozoa dinilai secara subjektif kuantitatif dengan membandingkan spermatozoa motil yang bergerak ke depan (progresif) dan yang tidak progresif dari 5 lapangan pandang. Penilaian diberikan dari angka 0% (tidak motil) sampai 100% (motil seluruhnya).
Rasio Spermatozoa Hidup dan Mati (viabilitas)
Satu tetes semen dengan dua tetes pewarnaan eosin-nigrosin dihomogenkan, lalu dibuat preparat ulas pada gelas objek dan difiksasi di atas
heating table. Pemeriksaan dilakukan di bawah mikroskop cahaya pembesaran 10x40. Spermatozoa dihitung minimal 200 sel dari 10 lapang pandang. Spermatozoa yang hidup ditandai dengan tidak menyerap warna (bening) dan yang mati akan menyerap warna (merah) pada bagian kepala.
Rancangan Penelitian dan Analisis Data
Penelitian tahap I (bagian 1) dan tahap II dirancang dengan menggunakan Rancangan Acak Lengkap (RAL) sedangkan tahap I (bagian 2) dirancang dengan menggunakan Rancangan Acak Lengkap (RAL) pola faktorial. Setiap perlakuan pada penelitian tahap I dan II terdiri dari tiga ulangan dan setiap ulangan terdiri dari tiga sampel semen.
18
IV.
HASIL DAN PEMBAHASAN
Karakteristik Semen Segar
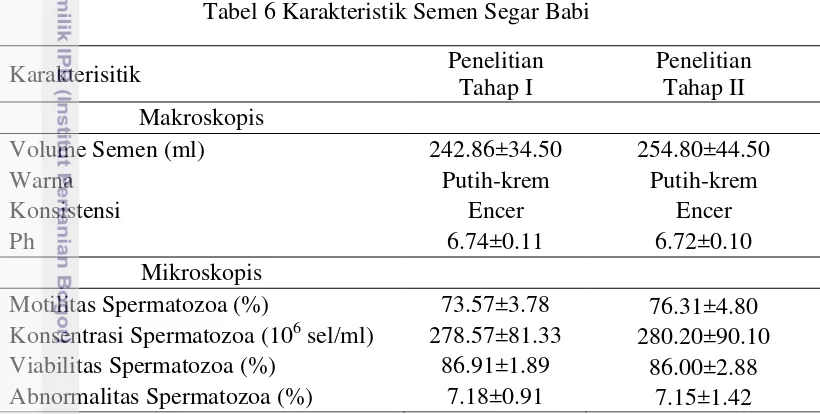
Kualitas semen segar sangat menentukan apakah semen tersebut layak atau tidak untuk diproses lebih lanjut. Kualitas semen yang dihasilkan pada penelitian tahap I dan II berada pada kisaran normal dan layak untuk digunakan. Pemeriksaan makroskopis pada tahap I dan II masing-masing menunjukkan volume semen berkisar 242.86±34.50 ml dan 225.71±58.84 ml, pH 6.74±0.11 dan 6.79±0.15, warna putih-krem, konsistensi encer. Secara umum, karakteristik semen segar yang dihasilkan tidak berbeda dengan hasil penelitian dari Robert (2006) dan Ax et al. (2000) yang menyatakan volume babi tanpa gelatin berkisar 200-250 ml, dengan warna putih dan konsistensi encer (Tabel 6).
Tabel 6 Karakteristik Semen Segar Babi
Volume Semen (ml) 242.86±34.50 254.80±44.50
Warna Putih-krem Putih-krem
Konsistensi Encer Encer
Ph 6.74±0.11 6.72±0.10
Mikroskopis
Motilitas Spermatozoa (%) 73.57±3.78 76.31±4.80 Konsentrasi Spermatozoa (106 sel/ml) 278.57±81.33
280.20±90.10 Viabilitas Spermatozoa (%) 86.91±1.89 86.00±2.88 Abnormalitas Spermatozoa (%) 7.18±0.91 7.15±1.42
Hasil pemeriksaan secara mikroskopis menunjukkan bahwa motilitas spermatozoa masing-masing adalah 73.57±3.78% dan 74.29±4.50%, hasil tersebut lebih tinggi dari penelitian Sumardani (2007) yang melaporkan motilitas spermatozoa adalah 65.56±2.55%. Konsentrasi spermatozoa adalah 278.57±81.33x106 sel/ml dan 214.86±42.49x106 sel/ml, hasil tersebut tidak jauh berbeda dibandingkan dengan hasil Garner dan Hafez (2000) serta Robert (2006) yakni berkisar antara 200-600x106 sel/ml. Beberapa faktor yang memengaruhi konsentrasi spermatozoa antara lain jumlah ejakulat, interval penampungan, kondisi pejantan dan lingkungan (Johnson et al. 2000).
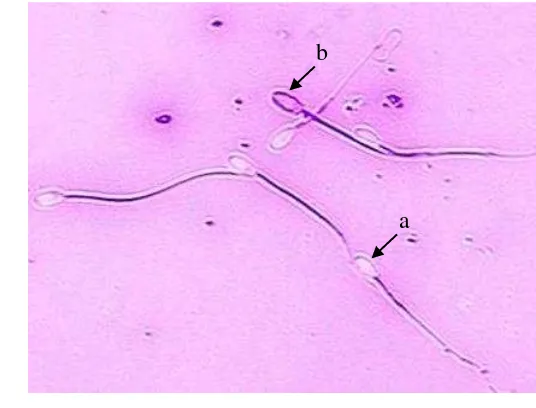
Hasil pemeriksaan viabilitas spermatozoa yang hidup diidentifikasikan dengan tidak menyerap warna (transparan) pada bagian kepala spermatozoa, sedangkan spermatozoa yang yang mati ditandai dengan menyerap warna merah pada bagian kepala spermatozoa karena permeabilitas spermatozoa yang meningkat (Gambar 2). Rataan viabilitas spermatozoa dari penelitian ini adalah 86.91±1.89% dan 86.74±6.45%, hasil penelitian ini tidak berbeda jauh dengan hasil penelitian Sumardani (2007) dimana rataan viabilitas spermatozoa mencapai 87.76±2.87%, namun hasil penelitian ini lebih tinggi dari hasil penelitian Johnson
19
spermatozoa hidup lebih tinggi dari pada spermatozoa motil karena dari jumlah spermatozoa yang hidup belum tentu semuanya motil progresif (Kostaman dan Sutama 2006).
Pemeriksaan morfologi spermatozoa yang abnormal penting dilakukan sebab abnormalitas yang tinggi akan mengganggu fertilitas jantan secara umum, hal tersebut diungkapkan oleh Garner dan Hafez (2000). Hasil penelitian menunjukkan bahwa persentase abnormalitas spermatozoa mencapai 11.1±4.0% dan 8.0±4.1%. Hasil ini masih baik karena menurut Johnson et al. (2000) persentase abnormalitas babi per ejakulat tidak boleh lebih dari 20%. Secara umum, abnormalitas pada spermatozoa dapat disebabkan oleh berbagai faktor antara lain genetik, stres, suhu lingkungan, penyakit dan bahkan perlakuan pada saat pembekuan semen (Arifiantini dan ferdian 2006).
Preservasi Semen Babi
Pengaruh Holding Time dalam Pengencer BTS®
Usaha untuk memperoleh semen cair babi dengan kualitas yang baik dalam mempertahankan motilitas dan viabilitas spermatozoa maka dilakukan proses holding time (HT). Holding time adalah waktu antara koleksi semen sampai suhu diturunkan menjadi suhu preservasi (15-20oC). Holding time perlu dilakukan dengan tujuan agar spermatozoa tidak mengalami cold shock ketika berada pada suhu preservasi. Hasil penelitian menunjukkan adanya perbedaan penurunan motilitas spermatozoa antara perlakuan HT 0 jam, HT 1 jam dan HT 3 jam baik pada suhu18oC maupun 5oC (Tabel 7).
Gambar 2 Spermatozoa hidup dan mati dengan pewarnaan eosin-nigrosin (a) spermatozoa hidup dan (b) spermatozoa mati.
20
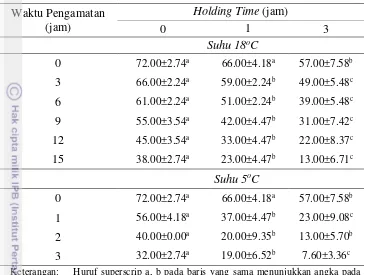
Tabel 7 Pengaruh Holding Time terhadap Persentase Motilitas Spermatozoa Semen Cair Babi dalam Pengencer BTS®
0 72.00±2.74a 66.00±4.18a 57.00±7.58b 3 66.00±2.24a 59.00±2.24b 49.00±5.48c 6 61.00±2.24a 51.00±2.24b 39.00±5.48c 9 55.00±3.54a 42.00±4.47b 31.00±7.42c 12 45.00±3.54a 33.00±4.47b 22.00±8.37c 15 38.00±2.74a 23.00±4.47b 13.00±6.71c
Suhu 5oC
0 72.00±2.74a 66.00±4.18a 57.00±7.58b 1 56.00±4.18a 37.00±4.47b 23.00±9.08c 2 40.00±0.00a 20.00±9.35b 13.00±5.70b 3 32.00±2.74a 19.00±6.52b 7.60±3.36c Keterangan: Huruf superscrip a, b pada baris yang sama menunjukkan angka pada
baris tersebut berbeda nyata dengan tingkat signifikan 5%
Pada Tabel 7 di atas menunjukkan bahwa HT 0 jam pada suhu 18oC mampu mempertahankan motilitas spermatozoa 45.00±3.54% selama 12 jam pengamatan lebih tinggi dibandingkan dengan HT 1 jam menunjukkan motilitas spermatozoa 42.00±4.47% selama sembilan jam pengamatan, sedangkan pada HT 3 jam menunjukkan motilitas spermatozoa 49.00±5.48% selama tiga jam pengamatan. Hasil penelitian ini tidak berbeda jauh dari hasil penelitian Casas dan Althouse (2013) yang melaporkan bahwa kualitas spermatozoa babi setelah dilakukan HT6 jam masih dapat mempertahankan motilitas spermatozoa sampai 24 jam.
Pada suhu 5oC menunjukkan hasil yang berbeda dimana pada HT 0 jam dengan motilitas spermatozoa 40.00±0.00% selama dua jam pengamatan, sedangkan untuk HT 1 dan HT 3 jam menunjukkan motilitas spermatozoa adalah 66.00±4.18% dan 57.00±7.58% selama 0 jam pengamatan. Hasil penelitian berbeda jauh dari hasil penelitian sebelumnya yang melaporkan bahwa penyimpanan semen cair babi pada suhu 5oC menunjukkan motilitas spermatozoa masih 32.5% selama tiga hari (Dziekonska dan Strzezek 2011).
21
asam laktat sebagai sisa metabolisme dengan konsentrasi lebih tinggi yang bersifat toksik bagi spermatozoa. Menurut Vishwanath dan Shannon (2000) sumber utama peroksidasi yang terjadi pada suhu ruang adalah oksidatif deaminase dari asam amino aromatik oleh enzim aromatic amino acid aminase
(AAAO). Semakin tinggi suhu penyimpanan menyebabkan jumlah enzim ini akan meningkat. Enzim AAAO ini tidak aktif pada spermatozoa yang masih hidup. Selain itu, penurunan motilitas spermatozoa juga dapat terjadi sebagai akibat penurunan suhu yang rendah yang menyebabkan terjadinya perubahan
phospholipid sehingga menyebabkan terjadinya kerusakan membran plasma secara permanen akibat cold shock.
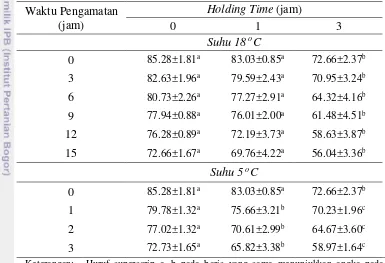
Tabel 8 Pengaruh Holding Time terhadap Persentase Viabilitas Spermatozoa Semen Cair Babi dalam Pengencer BTS®
0 85.28±1.81a 83.03±0.85a 72.66±2.37b 3 82.63±1.96a 79.59±2.43a 70.95±3.24b 6 80.73±2.26a 77.27±2.91a 64.32±4.16b 9 77.94±0.88a 76.01±2.00a 61.48±4.51b 12 76.28±0.89a 72.19±3.73a 58.63±3.87b 15 72.66±1.67a 69.76±4.22a 56.04±3.36b
Suhu 5 oC
0 85.28±1.81a 83.03±0.85a 72.66±2.37b 1 79.78±1.32a 75.66±3.21b 70.23±1.96c 2 77.02±1.32a 70.61±2.99b 64.67±3.60c 3 72.73±1.65a 65.82±3.38b 58.97±1.64c Keterangan: Huruf superscrip a, b pada baris yang sama menunjukkan angka pada
baris tersebut berbeda nyata dengan tingkat signifikan 5%
Viabilitas spermatozoa dengan perlakuan HT 0, HT 1dan HT 3 jam pada suhu penyimpanan 18oC maupun 5oC masih menunjukkan nilai yang tinggi dibandingkan dengan motilitas spermatozoa. HT pada suhu 18oC selama 15 jam pengamatan HT 0, HT 1 dan HT 3 jam menunjukkan viabilitas spermatozoa masing-masing adalah 72.66±1.67%, 69.76±4.22% dan 56.04±3.36%. Pada suhu 5oC selama tiga jam pengamatan menunjukkan viabilitas spermatozoa masing-masing perlakuan adalah 72.73±1.65%, 65.82±3.38% dan 58.97±1.64%.
22
masih memungkinkan spermatozoa tetap melakukan aktivitas seluler. Oleh karena itu spermatozoa memerlukan energi untuk proses metabolisme.
Perbandingan Pengencer BTS® (Commercial Extender) dan BTS Modifikasi (BTSM) yang Disuplementasi dengan dan Tanpa Trehalosa
Pengencer semen merupakan media bagi spermatozoa selama penyimpanan, sehingga komponen yang terdapat di dalam bahan pengencer semen tersebut akan secara langsung memengaruhi spermatozoa. Pengencer BTS® dan BTS modifikasi yang digunakan pada penelitian ini sangat nyata memengaruhi kualitas semen cair (P<0.05). Tanpa melihat karbohidrat yang digunakan, pengencer BTSM pada suhu 18oC menunjukkan motilitas dan viabilitas spermatozoa yakni 43.50±4.12% dan 61.36±8.15% selama 18 jam pengamatan lebih tinggi dibandingkan dengan pengencer BTS® 44.00±3.94 dan 65.79±11.19% selama 12 jam pengamatan (Tabel 9).
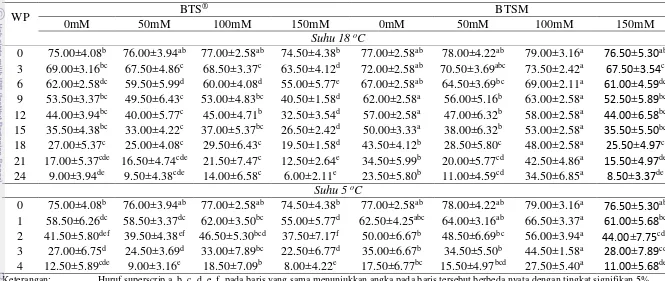
Peranan karbohidrat trehalosa dalam pengencer yang digunakan, nyata memengaruhi motilitas spermatozoa selama penyimpanan baik pada suhu 18oC maupun suhu 5oC. Hasil penelitian ini menunjukkan bahwa pada pengencer BTS® dan BTSM yang disuplementasi trehalosa dengan konsentrasi yang berbeda-beda menunjukkan hasil yang berbeda pula. Pengencer BTSM-T100 mM pada suhu 18oC mampu mempertahankan motilitas spermatozoa hingga 42.50±4.86% selama 21 jam pengamatan. Hasil ini lebih tinggi dibandingkan pengencer BTSM-T50 dan BTSM-T150 mM adalah 47.00±6.32% dan 44.00±6.58% maupun pengencer BTS® -T50 dan BTSM-T100 mM adalah 40.00±5.77% dan 45.00±4.71% selama 12 jam pengamatan. Sedangkan pada pengencer BTS®-T150 mM hanya mampu mempertahankan motilitas spermatozoa 40.50±1.58% selama sembilan jam pengamatan.
Pada suhu 5oC pengencer BTSM-T100 mM mampu mempertahankan spermatozoa 44.50±1.58% selama tiga jam pengamatan. Sedangkan untuk pengencer BTSM-T50 dan BTSM-T150 Mm adalah 48.50±6.69% dan 44.00±7.75% hanya dua jam pengamatan. Pengencer BTS®-T100 mM mampu mempertahankan motilitas spermatozoa 46.50±5.30% selama dua jam, sedangkan pada BTS®-T50 dan BTS®-T150 mM mampu mempertahankan motilitas spermatozoa 58.50±3.37% dan 55.00±5.77% selama satu jam pengamatan.
23
Tabel 9 Pengaruh Suplementasi Trehalosa dalam Pengencer BTS® dan BTS Modifikasi terhadap Persentase Motilitas Spermatozoa
WP BTS
® BTSM
0mM 50mM 100mM 150mM 0mM 50mM 100mM 150mM
Suhu 18 oC
0 75.00±4.08b 76.00±3.94ab 77.00±2.58ab 74.50±4.38b 77.00±2.58ab 78.00±4.22ab 79.00±3.16a 76.50±5.30ab 3 69.00±3.16bc 67.50±4.86c 68.50±3.37c 63.50±4.12d 72.00±2.58ab 70.50±3.69abc 73.50±2.42a 67.50±3.54c 6 62.00±2.58dc 59.50±5.99d 60.00±4.08d 55.00±5.77e 67.00±2.58ab 64.50±3.69bc 69.00±2.11a 61.00±4.59dc 9 53.50±3.37bc 49.50±6.43c 53.00±4.83bc 40.50±1.58d 62.00±2.58a 56.00±5.16b 63.00±2.58a 52.50±5.89bc 12 44.00±3.94bc 40.00±5.77c 45.00±4.71b 32.50±3.54d 57.00±2.58a 47.00±6.32b 58.00±2.58a 44.00±6.58bc 15 35.50±4.38bc 33.00±4.22c 37.00±5.37bc 26.50±2.42d 50.00±3.33a 38.00±6.32b 53.00±2.58a 35.50±5.50bc 18 27.00±5.37c 25.00±4.08c 29.50±6.43c 19.50±1.58d 43.50±4.12b 28.50±5.80c 48.00±2.58a 25.50±4.97c 21 17.00±5.37cde 16.50±4.74cde 21.50±7.47c 12.50±2.64e 34.50±5.99b 20.00±5.77cd 42.50±4.86a 15.50±4.97de 24 9.00±3.94de 9.50±4.38cde 14.00±6.58c 6.00±2.11e 23.50±5.80b 11.00±4.59cd 34.50±6.85a 8.50±3.37de
Suhu 5 oC
0 75.00±4.08b 76.00±3.94ab 77.00±2.58ab 74.50±4.38b 77.00±2.58ab 78.00±4.22ab 79.00±3.16a 76.50±5.30ab 1 58.50±6.26dc 58.50±3.37dc 62.00±3.50bc 55.00±5.77d 62.50±4.25abc 64.00±3.16ab 66.50±3.37a 61.00±5.68bc 2 41.50±5.80def 39.50±4.38ef 46.50±5.30bcd 37.50±7.17f 50.00±6.67b 48.50±6.69bc 56.00±3.94a 44.00±7.75cde 3 27.00±6.75d 24.50±3.69d 33.00±7.89bc 22.50±6.77d 35.00±6.67b 34.50±5.50b 44.50±1.58a 28.00±7.89cd 4 12.50±5.89cde 9.00±3.16e 18.50±7.09b 8.00±4.22e 17.50±6.77bc 15.50±4.97bcd 27.50±5.40a 11.00±5.68de Keterangan: Huruf superscrip a, b, c, d, e, f pada baris yang sama menunjukkan angka pada baris tersebut berbeda nyata dengan tingkat signifikan 5%.