STATUS AKROSOM DAN KUALITAS SPERMATOZOA
DOMBA LOKAL (
Ovis aries
) YANG DIBEKUKAN DALAM
PENGENCER TRIS KUNING TELUR DENGAN JENIS GULA
BERBEDA
PRISTA AYU NURJANAH
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Status Akrosom dan Kualitas Spermatozoa Domba Lokal (Ovis aries) yang Dibekukan dalam Pengencer Tris Kuning Telur dengan Jenis Gula Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
PRISTA AYU NURJANAH. Status Akrosom dan Kualitas Spermatozoa Domba Lokal (Ovis aries) yang Dibekukan dalam Pengencer Tris Kuning Telur dengan Jenis Gula Berbeda. Dibimbing oleh NI WAYAN KURNIANI KARJA dan I KETUT MUDITE ADNYANE.
Tujuan penelitian ini adalah untuk mengkaji status akrosom (intak dan tidak intak) dan kualitas (motilitas, viabilitas, keutuhan membran plasma) spermatozoa domba lokal yang dikriopreservasi dalam pengencer tris kuning telur dengan jenis gula berbeda. Semen domba dikoleksi dengan vagina buatan kemudian dievaluasi. Semen diencerkan dengan jenis gula fruktosa, glukosa, atau laktosa dan diekuilibrasi dalam tube dan straw. Seluruh sampel semen dibekukan dalam nitrogen cair. Motilitas post thawing kelompok tris-fruktosa straw lebih tinggi dibandingkan kelompok lainnya, tetapi tidak berbeda nyata (P>0.05). Viabilitas dan MPU post thawing tidak berbeda nyata (P>0.05) antar kelompok perlakuan. Status akrosom post thawing tidak berbeda nyata (P>0.05) kecuali pada kelompok tris-fruktosa tube dan tris-laktosa tube. Berdasarkan hasil penelitian disimpulkan bahwa jenis gula tidak berpengaruh terhadap status akrosom dan kualitas spermatozoa domba kecuali pada motilitas.
Kata kunci: akrosom, fruktosa, glukosa, laktosa
ABSTRACT
PRISTA AYU NURJANAH. Acrosome Status and Quality of Local Ram’s Spermatozoa Cryopreserved in Tris-Egg Yolk Extender with Different Types of Carbohydrates. Supervised by NI WAYAN KURNIANI KARJA and I KETUT MUDITE ADNYANE.
This research was conducted to study the acrosome status (intact and not intact) and quality (motility percentage, viability, plasma membrane integrity) of local ram’s spermatozoa cryopreserved in tris egg yolk extender with different types of carbohydrates. Semen was collected by using artificial vagina and then evaluated. Semen was extended with fructose, glucose, or lactose and equilibrated in straw and tube. All semen samples were then cryopreserved in liquid nitrogen. Post-thawed motility of spermatozoa in tris-fructose straw group was highest than others, but was not significantly different (P>0.05). Post-thawed viability and plasma membrane integrity of spermatozoa were not significantly different (P>0.05) among groups. Post-thawed acrosome status was not significantly different (P>0.05) except in tris-fructose tube and tris-lactose tube. In conclusion, the type of sugar and packging did not affect the acrosome status and quality of ram’s spermatozoa, but affected the motility of spermatozoa.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
STATUS AKROSOM DAN KUALITAS SPERMATOZOA
DOMBA LOKAL (
Ovis aries
) YANG DIBEKUKAN DALAM
PENGENCER TRIS KUNING TELUR DENGAN JENIS GULA
BERBEDA
PRISTA AYU NURJANAH
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul Status Akrosom dan Kualitas Spermatozoa Domba Lokal (Ovis aries) yang Dibekukan dalam Pengencer Tris Kuning Telur dengan Jenis Gula Berbeda.
Penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada: 1. Drh Ni Wayan Kurniani Karja, MP, PhD dan Drh I Ketut Mudite
Adnyane, MSi, PhD, PAVet selaku dosen Pembimbing atas segala bimbingan, masukan, nasehat, dan dukungannya selama proses penelitian dan penulisan skripsi ini.
2. Dr Drh Chairun Nisa, MSi, selaku dosen Pembimbing Akademik yang telah memberikan nasehat dan dukungannya selama ini dalam kegiatan akademik.
3. Bapak, Ibu, Adik (Sholihah Dwi Nuraini, Muhammad Nurudin, Muhammad Nurhidayah) dan seluruh keluarga besar atas semua dukungan, baik moral maupun materi yang telah diberikan selama ini kepada penulis.
4. Kak Aisyah, Mbak Umul, Kak Aras, dan Kak Eki atas semua bantuan dan arahan yang diberikan kepada penulis pada saat penelitian.
5. Teknisi Unit Rehabilitasi Reproduksi, Pak Bondan dan Selly Anggraeni atas bantuan yang diberikan kepada penulis pada saat penelitian.
6. Rekan satu penelitian sperma domba (Devi Anianti, Citra Ayu Lestari, dan Faisal Amri Satrio) atas semangat, dukungan dan bantuannya selama penelitian.
7. Sahabat-sahabat (penghuni Rumah Apel dan Wisma Balsem) atas kebersamaan, dukungan, dan bantuan yang diberikan selama ini kepada penulis.
8. Rekan seperjuangan, rekan Ganglion 48, dan semua pihak yang turut serta membantu penulis sehingga penulis mampu menyelesaikan skripsi ini.
Penulis menyadari bahwa tulisan ini sangat jauh dari kesempurnaan. Oleh karena itu, adanya kritik dan saran yang membangun sangat diharapkan oleh penulis untuk kesempurnaan tulisan ini.
Semoga bermanfaat bagi semua pihak, khususnya bagi penulis sendiri.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Waktu dan Tempat 2
Alat 2
Bahan 2
Metode Penelitian 3
Prosedur Analisis Data 5
HASIL DAN PEMBAHASAN 6
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
DAFTAR TABEL
1 Kualitas semen segar domba lokal (Ovis aries) 6
DAFTAR GAMBAR
1 Motilitas spermatozoa semen segar, setelah ekuilibrasi, dan post
thawing 7
2 Viabiltas spermatozoa semen segar, setelah ekuilibrasi, dan post
thawing 9
3 Keutuhan membran plasma (MPU) spermatozoa semen segar, setelah
ekuilibrasi, dan post thawing 11
4 Persentase status akrosom spermatozoa semen segar dan post thawing 12 5 Status akrosom spermatozoa domba dengan pewarnaan histokimia
PENDAHULUAN
Latar Belakang
Domba lokal (Ovis aries) merupakan ternak ruminansia kecil yang banyak dikembangkan di Indonesia. Jenis ternak ini mampu beranak dua sampai tiga ekor dalam satu siklus reproduksi (Sutiyono et al. 2010). Domba jantan memiliki bobot badan 60–80 kg, sedangkan domba betina 30–50 kg (Rizal et al. 2013). Potensi domba lokal ini perlu didukung dengan adanya teknologi reproduksi yang tepat agar menghasilkan bibit domba unggul.
Teknologi reproduksi yang sudah lama dikembangkan untuk hewan ternak adalah Inseminasi Buatan (IB) (Utomo dan Rasminati 2012). Semen yang dihasilkan oleh seekor pejantan dimungkinkan untuk mengawini lebih dari seekor betina. Prinsip pengolahan semen adalah meningkatkan volume ejakulat dengan penambahan pengencer. Semen tersebut dapat diproses menjadi semen cair, semen beku, dan semen kering. Semen beku menjadi pilihan utama karena memiliki daya simpan yang lebih lama dibandingkan semen cair. Dalam proses pengolahannya, semen beku dapat mengalami penurunan motilitas, peningkatan jumlah spermatozoa yang mati, kerusakan membral sel, dan kerusakan tudung akrosom. Perubahan pH, kejutan dingin (cold shock), tekanan osmotik, dan menurunnya sumber energi menjadi penyebab kerusakan spermatozoa selama proses pengolahan dan pembekuan semen (Medeiros et al. 2002).
Komposisi pengencer sangat menentukan daya hidup dan kualitas spermatozoa dalam proses pembekuan. Pengencer semen beku terdiri dari buffer, sumber energi, dan krioprotektan. Sumber energi diperoleh dari gula, baik monosakarida (fruktosa, glukosa, manosa) dan disakarida (maltosa) (Ponglowhapan et al. 2004). Monosakarida merupakan jenis gula yang dapat digunakan langsung sebagai sumber energi bagi spermatozoa. Selain berfungsi sebagai sumber energi, gula juga berperan sebagai krioprotektan ekstraseluler (Yulnawati dan Herdis 2009). Krioprotektan ekstraseluler diperlukan untuk mempertahankan integritas membran sel dan melindungi tudung akrosom dari kerusakan (Yulnawati et al. 2008).
2
Kerusakan pada tudung akrosom menyebabkan menurunnya fertilitas karena spermatozoa tidak mampu menembus sel ovum sehingga tingkat keberhasilan inseminasi buatan menurun. Tudung akrosom mengandung enzim hidrolitik seperti hyaluronidase dan acrosyn. Enzim tersebut diperlukan untuk menembus zona pelusida dan memungkinkan sperma dapat berpenetrasi ke ruang vitelin pada reaksi akrosomal (Tulsiani et al. 1998).
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengkaji status akrosom dan kualitas spermatozoa domba yang dibekukan pada pengencer tris kuning telur dengan jenis gula berbeda.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai jenis gula yang tepat untuk pembekuan spermatozoa domba pada pengencer tris-kuning telur.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari sampai April 2015. Koleksi semen dilakukan di Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan Institut Pertanian Bogor. Evaluasi spermatozoa dan kriopreservasi dilakukan di Laboraturium Fertilisasi In Vitro Bagian Reproduksi dan Kebidanan, Departemen Klinik, Reproduksi, dan Patologi. Evaluasi pewarnaan histokimia dilakukan di Laboratorium Histologi Bagian Anatomi, Histologi dan Embriologi, Departemen Anatomi, Fisiologi, dan Farmakologi, Fakultas Kedokteran Hewan Institut Pertanian Bogor.
Alat
Peralatan yang digunakan dalam penelitian antara lain hot plate, inkubator CO2, mikropipet (10 µl, 100 μl, dan 1000 µl), Eppendorf 2.5 ml, pipet Pasteur, tube 15 ml, straw 0.25 ml, gunting, gelas objek, kaca penutup, mikroskop cahaya, mikroskop epifluorescens (Nikkon, Eclipse E600, Japan), rak tube, water bath, Neubaur chamber, termometer, vagina buatan, timbangan digital, gelas ukur, gelas beker (100 ml dan 250 ml), dan wadah preparat.
Bahan
3 alkohol absolut, nitrogen cair, phosphate buffer saline (PBS), pewarna propidium iodine (PI), pewarna lektin peanut agglutinin (PNA) yang dilabel fluorescein isothiocyanate (FITC), kapas, kertas tisu, dan aluminium foil.
Metode Penelitian
Pengencer Tris Kuning Telur
Penelitian ini menggunakan buffer tris yang terdiri atas 0.3025 g tris (hidroxymethyl) amino methane (Merck, Germany) dan 0.17 g asam sitrat (Merck, Germany) yang dilarutkan dalam 8 ml aquades (Wittayarat et al. 2012). Buffer tris kemudian ditambah dengan 2 ml kuning telur, 0.3 ml gliserol, streptomycin 1000 μg/ml dan penicillin 1000 IU/ml dan 0.0625 g fruktosa (Merck, Germany) atau 0.0625 g glukosa (Merck, Germany) atau 0.0625 g laktosa (Merck, Germany). Seluruh pengencer disimpan dalam suhu ruang.
Koleksi Semen
Semen dikoleksi dari seekor domba lokal jantan dewasa kelamin berumur 1–2 tahun dengan bobot badan berkisar antara 25–30 kg. Domba dipelihara dalam kandang individual yang berada di Unit Rehabilitasi Reproduksi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pakan yang diberikan berupa hijauan dan konsentrat, serta air minum yang diberikan secara ad libitum. Penampungan semen dilakukan sebanyak dua kali seminggu pada pagi hari menggunakan vagina buatan yang bersuhu 40–42 °C.
Kriopreservasi Spermatozoa
4
penyimpanan semen. Semen beku dicairkan kembali pada suhu 37 °C selama 30 detik untuk dievaluasi kembali.
Evaluasi Karakteristik dan Status Akrosom
1. Motilitas spermatozoa
Pada penelitian ini motilitas spermatozoa dievaluasi secara visual. Penilaian persentase motilitas spermatozoa ditentukan dengan cara menempatkan satu tetes semen yang telah diencerkan dengan larutan NaCl 0.9% pada gelas objek dan ditutup dengan gelas penutup. Pengamatan terhadap spermatozoa yang bergerak progresif dilakukan secara subjektif dengan mikroskop cahaya menggunakan pembesaran 400x. Penilaian yang diberikan berkisar antara 0 sampai 100%.
2. Spermatozoa Hidup (Viabilitas)
Pengamatan viabilitas spermatozoa dilakukan dengan menggunakan metode pewarnaan eosin-negrosin (Cocchia et al. 2011). Sebanyak 10 µl sampel semen ditambah dengan 40 µl eosin-negrosin kemudian dicampur di atas gelas objek dan dibuat preparat ulas. Setelah itu, preparat dikeringkan menggunakan heating table selama 15 detik. Sebanyak 200 spermatozoa diamati dengan mikroskop cahaya pembesaran 400x. Spermatozoa yang dikategorikan hidup adalah spermatozoa yang tidak menyerap warna sehingga bagian kepala spermatozoa tidak terwarnai (berwarna putih). Spermatozoa yang dikategorikan mati adalah spermatozoa yang menyerap warna sehingga bagian kepala spermatozoa akan terwarnai (berwarna merah).
3. Membran Plasma Utuh (MPU)
Penilain keutuhan membran plasma spermatozoa diperiksa menggunakan metode Hypoosmotic Swelling Test (HOS-Test) dengan komposisi 0.135 g fruktosa (Merck, Germany) dan 0.0737 g trisodium citrate 2H2O dalam 10 ml air mili-Q. Sampel semen sebanyak 20 µl diencerkan dengan 80 µl larutan HOS dan dibiarkan selama 10 menit dalam water bath bersuhu 37 ºC. Sebanyak 10 µl sampel semen diteteskan pada gelas objek yang ditutup dengan gelas penutup dan dilakukan evaluasi dengan mikroskop cahaya pembesaran 400x pada 200 spermatozoa. Spermatozoa yang memiliki membran plasma utuh akan ditandai dengan ekor yang melingkar, sedangkan spermatozoa yang membran plasmanya tidak utuh akan ditandai dengan ekor yang lurus (Pérez-Llano et al. 2006).
4. Status Akrosom dengan Metode FITC
5 propidium iodine (PI) (Sigma, St. Luis MO) sebanyak 5 µl (konsentrasi 10 µg/ml) dan diinkubasi selama 5 menit. Setelah diinkubasi, preparat dicuci dalam larutan phosphate buffer saline (PBS) sebanyak dua kali untuk membersihkan sisa pereaksi yang tidak berikatan, kemudian ditutup dengan gelas penutup ukuran 24 24 mm. Pemeriksaan status akrosom dilakukan menggunakan mikroskop epifluorescens (Nikkon, Eclipse E600, Japan) pada panjang gelombang 380–420 nm dalam ruang gelap. Jumlah spermatozoa yang diamati pada setiap perlakuan adalah 200 spermatozoa. Hasil pemeriksaan dengan metode FITC dibedakan menjadi dua, yaitu spermatozoa dengan akrosom berwarna hijau dikategorikan sebagai akrosom intak (utuh), sementara spermatozoa yang tidak berwarna hijau dikategorikan sebagai akrosom rusak (tidak utuh) (Partyka et al. 2011).
Analisis Data
6
HASIL DAN PEMBAHASAN
Hasil pengamatan terhadap semen segar domba tersaji dalam Tabel 1. Menurut Garner dan Hafez (2000) semen segar yang memiliki motilitas 60–80% layak untuk diproses menjadi semen beku. Motilitas merupakan penentu kelayakan dalam pengolahan semen karena berhubungan dengan kemampuan spermazoa untuk mencapai ovum sebelum proses fertiliasi. Berdasarkan hasil evaluasi makroskopis dan mikroskopis ejakulat tersebut layak diproses menjadi semen beku.
Tabel 1 Kualitas semen segar domba lokal (Ovis aries)
Parameter Rata-rata±SD*
Volume (ml) 0.89±0.4
Warna Putih susu
Konsentrasi (juta/ml) 2614.3±872.7
Motilitas (%) 78.6±3.8
Viabilitas (%) 91.0±3.3
Membran Plasma Utuh/ MPU (%) 91.1±4.6
Status akrosom (%) 86.5±5.4
*Data diperoleh dengan 5 kali pengulangan
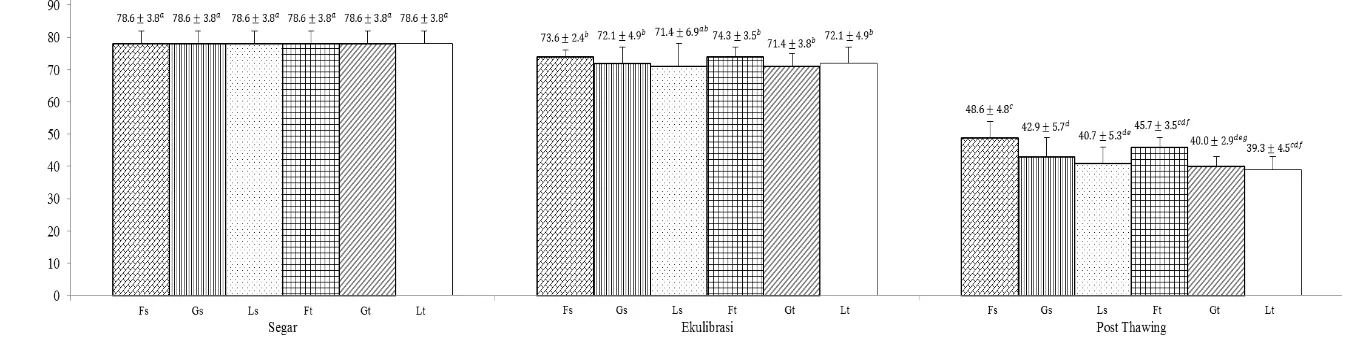
Gambar 1 Motilitas spermazoa semen segar, setelah ekuilibrasi, dan post thawing. Superscript dengan huruf berbeda (a, b, c, d, e, f, g) pada bar yang sama menunjukkan perbedaan yang nyata (P<0.05). Fs=tris-fruktosa straw, Gs=tris-glukosa straw, Ls=tris-laktosa straw, Ft=tris-fruktosa tube, Gt=tris-glukosa tube, Lt=tris-laktosa tube.
8
Penurunan motilitas pada kriopreservasi dipengaruhi oleh ketersedian energi (Ondho et al. 2008). Energi diperlukan untuk proses pergerakan spermatozoa. Kelompok straw mampu mempertahankan motilitas ekulibrasi lebih tinggi dibandingkan kelompok tube namun tidak menunjukkan perbedaan nyata (P>0.05). Pengemasan dalam straw sebelum ekuilibrasi mampu mengurangi paparan udara luar yang mengakibatkan stres oksidatif seperti pada spermatozoa sapi Simental (Said et al. 2005).
Fruktosa dan glukosa merupakan monosakarida yang masuk ke dalam sel melalui mekanisme transpor aktif dan difusi (Mansjur 2001). Menurut Rizal (2008) molekul karbohidrat akan dimetabolisir melalui jalur glikolisis atau dilanjutkan dengan reaksi asam trikarboksilat dalam siklus Krebs sehingga menghasilkan energi berupa Adenosine triphosphate (ATP). Senyawa ATP diperlukan untuk kontraksi fibril-fibril pada ekor spermatozoa sehingga menimbulkan pergerakan (motilitas). Meskipun berasal dari kelompok karbohidrat yang sama, pengencer tris-fuktosa straw mampu mempertahankan motilitas post thawing lebih tinggi dibandingkan pengencer tris-glukosa straw, tris-laktosa straw, dan tris-glukosa tube, akan tetapi tidak menunjukkan perbedaan nyata (P>0.05) pada pengencer tris-fruktosa tube dan tris-laktosa tube. Hal tersebut disebabkan fruktosa merupakan karbohidrat alami yang terkandung dalam plasma semen domba. Karbohidrat jenis ini paling sesuai sebagai sumber energi bagi spermatozoa seperti yang terjadi pada spermatozoa entok (Hernawati et al. 2010).
Laktosa termasuk jenis gula disakarida. Sebelum dimetabolisir melalui jalur glikolisis, laktosa dihidrolisis oleh enzim lactate dehydrogenase (LDH) menjadi glukosa dan galaktosa. Enzim LDH merupakan enzim intraseluler yang dihasilkan oleh sitosol dan mitokondria sel spermatozoa (Passarella et al. 2008). Hidrolisis laktosa menyebabkan ketersediaan ATP lebih lambat sehingga mempengaruhi motilitas spermatozoa sapi Bali (Mukminat 2014).
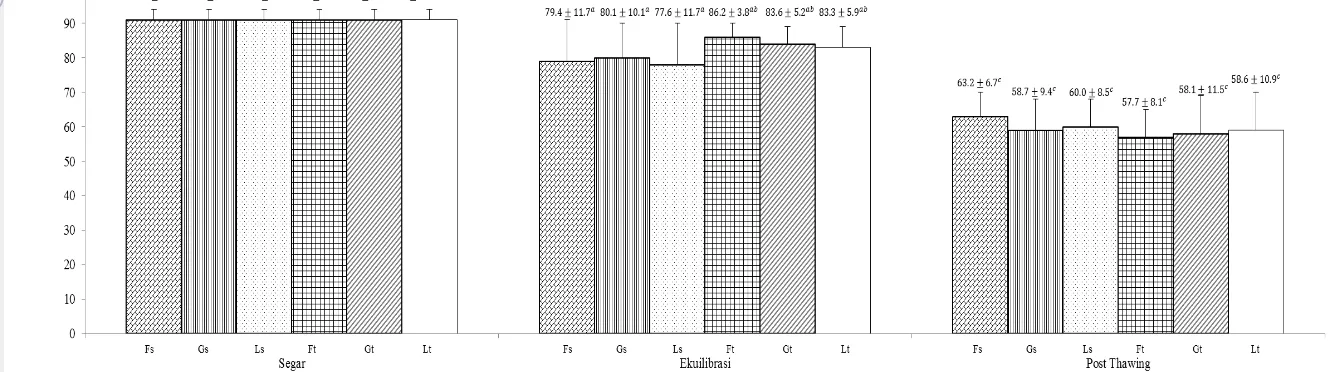
Persentase viabilitas post thawing pada seluruh kelompok pengencer berkisar 57–63%. Hasil tertinggi diperoleh pengencer tris-fruktosa straw sebesar 63.2±6.7%, sedangkan hasil terendah sebesar 57.7±8.1% diperoleh pengencer tris-fruktosa tube (Gambar 2). Penurunan viabilitas selama proses kriopreservasi dipengaruhi oleh kejutan dingin (cold shock) dan perubahan intraseluler akibat pengeluaran air. Penambahan gliserol pada pengencer berfungsi sebagai krioprotektan intraseluler. Gliserol memiliki molekul kecil yang dapat berdifusi dengan cepat ke dalam spermatozoa. Gugus hidroksil pada gliserol mampu mengikat air intraselular sehingga mencegah terbentuknya kristal es yang tajam. Kristal es ini dapat merusak struktur membran sel dan mengakibatkan kematian spermatozoa (Gazali dan Tambing 2002).
Gambar 2 Viabilitas spermazoa semen segar, setelah ekuilibrasi, dan post thawing. Superscript dengan huruf yang berbeda (a, b, c) pada bar yang sama menunjukkan perbedaan yang nyata (P<0.05). Fs=tris-fruktosa straw, Gs=tris-glukosa straw, Ls=tris-laktosa straw, Ft=tris-fruktosa tube, Gt=tris-glukosa tube, Lt=tris-laktosa tube.
10
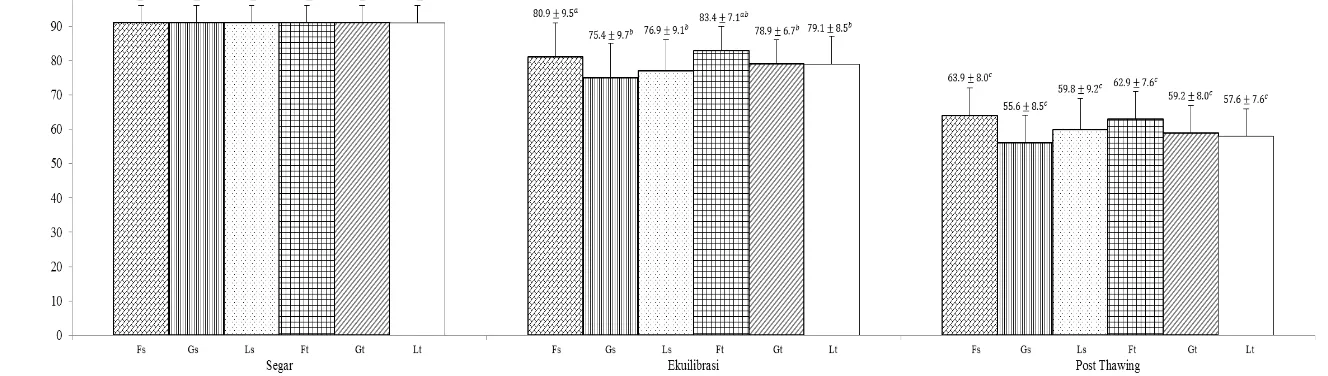
Variasi gula dalam menjaga keutuhan membran plasma pada masing-masing pengencer tris-kuning telur tidak menunjukkan perbedaan nyata (P>0.05) (Gambar 3). Pengencer tris-fruktosa straw dan tris-fruktosa tube memiliki persentase membran plasma utuh (MPU) lebih tinggi dibandingkan tris-glukosa straw (55.6±8.5%), tris-laktosa straw (59.8±9.2%), tris-glukosa tube (59.2±8.0%), dan tris-laktosa tube (57.6±7.6%). Ikatan hidrogen antara gugus hidroksil gula dan bagian kepala polar fosfolipid membran sel menimbulkan efek krioprotektif. Gula menggantikan posisi molekul air selama proses dehidrasi berlangsung saat kriopreservasi semen domba (Aisen et al. 2002). Dengan demikian, fluiditas membran plasma tetap terjaga dan proses metabolisme sel terjaga.
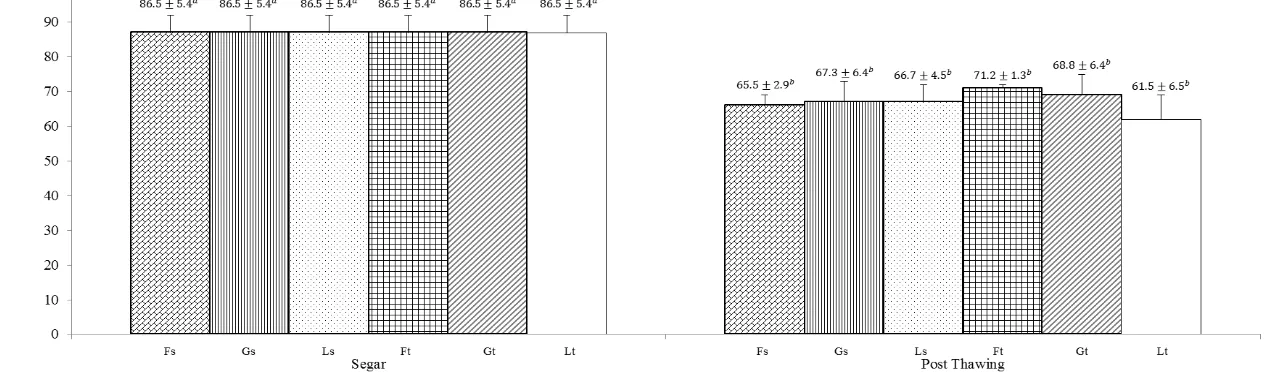
Hasil evaluasi tudung akrosom utuh (TAU) post thawing dari masing-masing pengencer tidak menunjukkan adanya perbedaan nyata (P>0.05) (Gambar 4). Persentase TAU tertinggi diperoleh pada kelompok pengencer fruktosa. Karbohidrat sebagai krioprotektan ektraseluler berfungsi menjaga kestabilan membran plasma yang berkaitan dengan keutuhan tudung akrosom. Secara morfologi membran plasma tersusun atas dua struktur utama yaitu nukleus dan akrosom. Bagian nukleus mengandung kromosom DNA sedangkan akrosom terletak di bagian ujung depan kepala spermatozoa. Akrosom merupakan sebuah kantung tipis dengan membran ganda yang mengandung acrosyn, hyaluronidase, dan enzim hidrolitik lain yang berperan dalam penembusan corona radiata dan zona pelusida pada proses fertilisasi mamalia (Toshimori dan Ito 2003).
Gambar 3 Keutuhan membran plasma (MPU) spermatozoa semen segar, setelah ekuilibrasi, dan post thawing. Superscript dengan huruf yang berbeda (a, b, c) pada bar yang sama menunjukkan perbedaan yang nyata (P<0.05). Fs=tris-fruktosa straw, Gs=tris-glukosa straw, Ls=tris-laktosa straw, Ft=tris-fruktosa tube, Gt=tris-glukosa tube, Lt=tris-laktosa tube.
Gambar 4 Persentase status akrosom spermazoa semen segar dan post thawing. Superscript dengan huruf yang berbeda (a, b) pada bar yang sama menunjukkan perbedaan yang nyata (P<0.05). Fs=tris-fruktosa straw, Gs=tris-glukosa straw, Ls=tris-laktosa straw, Ft=tris-fruktosa tube, Gt=tris-glukosa tube, Lt=tris-laktosa tube.
13
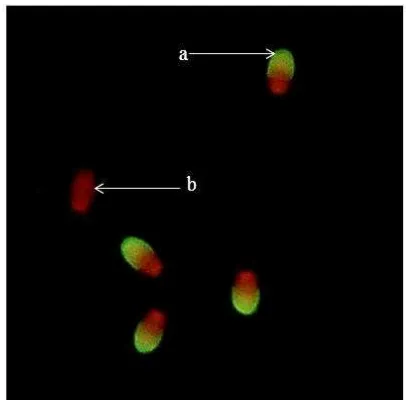
Gambar 5 Status akrosom spermatozoa domba dengan pewarnaan histokimia lektin metode FITC; a) spermatozoa dengan tudung akrosom utuh (intak); b) inti spermatozoa dengan tudung akrosom tidak utuh.
Hasil pewarnaan lektin PNA yang dilabel FITC dan propidium iodine (PI) menunjukkan tudung akrosom yang utuh (intak) tampak berwarna hijau dengan inti berwarna merah (a) (Gambar 5). Pewarna lektin PNA yang dilabel FITC berikatan dengan glikokonjugat pada membran akrosom sehingga tampak spektrum warna hijau. Spermatozoa dengan tudung akrosom tidak utuh hanya tampak inti selnya saja yang berwarna merah (b). Pewarna PI akan mewarnai DNA dan memunculkan spektrum warna merah saat pengamatan di bawah mikroskop (Saili et al. 2009).
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian disimpulkan bahwa jenis gula tidak berpengaruh terhadap status akrosom dan kualitas spermatozoa domba kecuali pada motilitas spermatozoa.
Saran
14
DAFTAR PUSTAKA
Aisen EG, Medina VH, Venturino A. 2002. Cryopreservation and post-thawed fertility of ram frozen semen in different trehalose concentrations. Theriogenology. 57(7):1801-1808.
Arifiantini RI, Purwantara B, Yusuf TL, Sajuthi D. 2009. Peranan fruktosa, raffinosa, dan trehalosa pada kriopreservasi semen kuda. Media Peternakan. 32(3):171-178.
Cocchia N, Pasolinia M, Mancinib R, Petrazzuoloc O, Cristofarod I, Rosapane I. 2011. Effect of SOD (superoxide dismutase) protein supplementation in semen extenders on motility, viability, acrosome status and ERK (extracellular signal-regulated kinase) protein phosphorylation of chilled stallion spermatozoa. Theriogenology. 75(1):1201-1210.
Garner DL, Hafez ESE. 2000. Reproduction in Farm Animal 7th ed. Philadelphia (US): Lea and Febiger.
Gazali M, Tambing SN. 2002. Kriopreservasi sel spermatozoa [ulasan]. Hayati. 9(1):27-32.
Dutta GC, Deka BC, Borgohain BN, Ahmed K. 1991. Effect of glycrolization methods on the quality of frozen buffalo semen. Indian Veterinary Journal. 68:1080-1081. motilitas spermatozoa entok (Cairina Moschata) dalam kombinasi bahan pengencer susu skim, fruktosa, dan kuning telur. Veterinaria Medika. 3(1):49-52.
Hu JH, Li QW, Li G, J ZL, Bu S, Yang H, Wang LQ. 2009. The cryoprotective effect of trehalose supplementation on boar spermatozoa quality. Animal ReproductionScience. 112(1-2):107-118.
Khalili B, Farshad a, Zamiri MJ, Rashidi A, Fazeli P. 2009. Effects of sucrose and trehalose on the freezability of Markhoz goat spermatozoa. Asian-Australia Journal Animal Science. 22(12):1614-1619.
Mansjur. 2001. Metabolisme: Karbohidrat, Protein, Asam Nukleat. Bogor (ID): Institut Pertaian Bogor.
Mayesta DDM, Trilaksana IGNB, Bebas W. 2014. Motilitas dan daya hidup spermatozoa ayam dalam pengencer glukosa kuning telur fosfat pada penyimpanan 3–5 °C. Indonesia Medicus Veterinus. 3(1):43-52.
Medeiros CM, Forell F, Oliveira AT, Rodrigues JL. 2002. Current status of sperm cryopreservation: why isn't it better? Theriogenology. 57: 327-344.
15 Mumu MI. 2009. Viabilitas semen sapi Simental yang dibekukan menggunakan
krioprotektan gliserol. Journal Agroland. 16(2):172-179.
Ondho YS, Wuwuh MIS, Sutopo, Samsudewa D, Suryawijaya A. 2008. Pengaruh Jenis Pengencer Terhadap Kualitas Semen Beku Dombos Texel di Kabupaten Wonosobo. Inovasi Teknologi Mendukung Pengembangan Agribisnis Peternakan Ramah Lingkungan; 2008 Nov 11-12; Bogor , Indonesia. Bogor (ID):416-420.
Partyka A, Lukaszewicz E, Ni-zanski W, Twardon J. 2011. Detection of lipid peroxidation in frozen-thawed avian spermatozoa using C11-BODIPY. Theriogenology. 75(9):1623-1629.
Ponglowhapan S, Essén-Gustavsson B, Forsberg CL. 2004. Influence of glucose and fructose in the extender during long-term storage of chilled canine semen. Theriogenology. 62(8):1498-1517.
Rizal M. 2008. Peningkatan kualitas spermatozoa epididimis kerbau belang yang dikriopreservasi dengan beberapa konsentrasi sukrosa. Jurnal Ilmu Ternak dan Veteriner. 8(4):188-183.
Rizal M, Herdis, Sangadji I. 2013. Fetal bovine serum dalam pengencer tris mempertahankan kehidupan dan keutuhan membran plasma spermatozoa semen beku domba garut. Jurnal Veteteriner. 14(4):437-443.
Said S, Gunawan M, Kaiin EM, Tappa B. 2005. Daya Tahan Hidup Sperma Cair Sapi Simmental yang Disimpan dalam Straw pada Temperatur 5 °C. Seminar Nasional Teknologi Peternakan dan Veteriner. Hlm 87-90.
Saili T, Adnyane IKM, Noor RR, Setiadi MA, Agungpriyono S, Boediono A. 2009. Perubahan viabilitas dan struktur subseluler spermatozoa domba setelah pengeringbekuan. Jurnal Veteriner. 10(4):213-218.
Sutiyono B, Johari S, Kurnianto E, Ondho YS, Sutopo, Ardian Y, Kusmuhernanda A, Darmawan. 2010. Hubungan penampilan induk anak domba dari berbagai tipe kelahiran. Jurnal Ilmu-Ilmu Peternakan. 20(2):24-30.
Toshimori K, Ito C. 2003. Formation and organization of the mammalian sperm head. Archives of Histology and Cytology Journal. 66(5):383-396.
Tulsiani DRP, Abou-Haila A, Loeser CR, Pereira BMJ. 1998. The biological and functional significance of the sperm acrosome and acrosomal enzymes in mammalian fertilization. Experimental Cell Research. 240(2):151-164. Utomo S, Rasminati N. 2012. Penerapan teknologi inseminasi buatan pada ternak
domba. Inotek. 16(1):1-9.
Viswanath R, Shannon P. 2000. Storage of bovine semen in liquid frozen state. Animal Reproduction Science. 62(1-3):23-53.
16
Yulnawati, Herdis, Maheswari H, Rizal M. 2008. Kualitas spermatozoa epididimis kerbau Belang pada penambahan raffinosa sebagai krioprotektan ekstraseluler. Jurnal Ilmu Ternak dan Veteriner. 13(1): 30-34.
17
RIWAYAT HIDUP
Penulis dilahirkan di Sragen pada tanggal 4 Februari 1993 sebagai anak pertama dari empat bersaudara dari pasangan Mukriyanto dan Suwarti. Penulis menempuh pendidikan sekolah menengah pertama di SMP N 1 Sambungmacan Sragen pada tahun 2008. Pendidikan sekolah menengah atas diselesaikan di SMA N 1 Sragen pada tahun 2011. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor melalui jalur SNMPTN Undangan di Fakultas Kedokteran Hewan.
Selama menjadi mahasiswa, penulis pernah menjadi asisten mata kuliah Ilmu Teknologi Reproduksi (2014–2015). Penulis juga aktif di berbagai organisasi di IPB antara lain: anggota DKM An Nahl FKH IPB (2012–2013), anggota Himpro Ornitologi dan Perunggasan FKH IPB (2012–2014) dan bendahara DKM An Nahl FKH IPB (2013–2014).