DAYA TAHAN HIDUP SPERMATOZOA KAMBING BOER DALAM PENGENCER TRIS KUNING TELUR YANG
DISIMPAN PADA TEMPERATUR BERBEDA
(Survive ability of Boer Spermatozoa in Egg Yolk Tris Diluent Stored on Different Temperatures)
Fitra Aji Pamungkas, Anwar Loka Penelitian Kambing Potong PO Box 1 Sei Putih, Galang 20585 Sumatera Utara
ABSTRACT
The experiment was conducted to evaluate the survival of boer goat spermatozoa stored at room temperature and 35°C in Tris egg yolk extender. The semen was collected using artificial vagina from three male Boer goats, 2 years old with body weight of 50-55 kg. The semen was than evaluated microscopically after diluted with Tris egg yolk extender, with a concentration of 200 x 106 /ml, and then stored at room temperature and 35°C. The sperm motility, viability and membrane integrity were evaluated every 1.5 hours.
Result of the experiment showed that the initial quality of Boer goat spermatozoa diluted with Tris egg yolk extender obtained percentage motility 79.09±3.75%, viable sperm was 91.70±4.41 with membrane integrity 75.13±4.34%. After 6 hours of storage, the percentage of sperm motility of liquid semen stored at room temperature (61.62±8.52%) were higher (P<0.05) compare to stored at 35°C (17.00±6.08%). The percentage of sperm viability and membrane integrity showed the same pattern. It is concluded that Boer goat spermatozoa in Tris egg yolk extender and stored at room temperature up to 6 hours of storage time is better than 35°C.
Key Words: Chilled Semen, Goats, Boer, Room Temperature
ABSTRAK
Tujuan penelitian ini adalah mengkaji daya tahan hidup spermatozoa kambing Boer dalam pengencer Tris kuning telur yang disimpan pada suhu ruang dan 35°C. Ternak yang digunakan adalah tiga ekor kambing pejantan Boer berumur 2 tahun dengan bobot hidup 50-55 kg. Penampungan semen menggunakan vagina buatan, semen yang diperoleh dievaluasi secara mikroskopis selanjutnya diencerkan dengan Tris kuning telur hingga konsentrasi 200x106 ml-1, lalu disimpan pada suhu ruang dan 35oC. Pengamatan semen cair dilakukan terhadap persentase motilitas, viabilitas dan integritas membran spermatozoa setiap 1,5 jam. Hasil penelitian menunjukkan bahwa kualitas awal spermatozoa kambing Boer dalam pengencer Tris kuning telur diperoleh persentase motilitas 79,09±3,75%, viabilitas spermatozoa 91,70±4,41% dengan integritas membran 75,13±4,34%. Setelah 6 jam penyimpanan, semen cair yang disimpan pada suhu ruang (61,62±8,52%) menunjukkan persentase motilitas yang lebih tinggi (P<0,05) dibandingkan dengan disimpan pada suhu 35°C (17,00±6,08%), demikian juga dengan viabilitas dan integritas membran spermatozoa. Kesimpulan dari penelitian ini adalah spermatozoa kambing Boer dalam pengencer Tris kuning telur yang disimpan pada suhu ruang selama 6 jam lebih baik dibandingkan dengan disimpan pada suhu 35°C.
Kata Kunci: Semen Cair, Kambing Boer, Suhu Ruang
PENDAHULUAN
Penerapan teknologi Inseminasi Buatan (IB) pada kambing hingga saat ini masih belum sesuai dengan yang diharapkan, ditandai dengan angka kebuntingan rendah terutama
apabila menggunakan semen beku. Berbagai
hasil penelitian menunjukkan bahwa angka
kebuntingan pada kambing yang diperoleh
dengan menggunakan semen beku bervariasi
dari 30-70% (Salvador et al. 2005; Dorado et
al. 2007). Selain itu, permasalahan dalam
penanganan semen beku yang sering dijumpai di lapangan adalah keterbatasan kontainer, kesulitan dan keterlambatan dalam memperoleh nitrogen cair, serta mahalnya harga nitrogen cair (Situmorang 2003).
Keuntungan utama menggunakan semen cair yaitu proses preservasi dan distribusi yang mudah dan murah karena tidak ada peralatan khusus yang diperlukan (Verstegen et al. 2005;
Shahiduzzaman dan Linde-Forsberg 2007).
Penggunaan pengencer Tris pada semen cair karena keunggulan dalam mempertahankan:
perubahan pH, tekanan osmotik, keseimbangan elektrolit dan osmolaritas (Yoshida 2000).
Penggunaan kuning telur umumnya digunakan sebagai agen yang efektif untuk melindungi membran plasma dan akrosom spermatozoa dari efek kejutan dingin karena kandungan fosfolipid, low density lipoproteins dan kandungan kolesterolnya (Aboagla dan Terada 2004; Amirat et al. 2004).
Aplikasi penggunaan semen cair dibatasi oleh longivitas atau daya tahan hidup spermatozoa. Longivitas atau daya tahan hidup adalah kemampuan spermatozoa bertahan dalam temperatur tertentu (Arifiantini et al.
2005). Menurut Birkhead et al. (2009), longivitas merupakan respon adaptasi spermatozoa yang ditentukan dengan mengetahui kapan metabolisme spermatozoa kembali aktif menggunakan sumber energinya.
Balai Inseminasi Buatan Lembang melakukan uji longivitas spermatozoa pada suhu 35-37°C, dimana selama 4 jam masih harus memiliki motilitas spermatozoa sebanyak 10% untuk bisa didistribusikan semen bekunya ke peternak. Daya tahan hidup spermatozoa dari semen beku sapi FH dengan berbagai bahan pengencer dapat bertahan sampai dengan 9 jam (Arifiantini 2005). Daya tahan hidup spermatozoa dari semen cair yang disimpan pada suhu 5
oC pada sapi Simmental (Said et al.
2005), sapi Friesian Holstein (Kusumaningrum et al. 2004) dan kambing Peranakan Ettawah (Rizal et al. 2008) dapat dipertahankan selama 3 hari. Sedangkan penggunaan semen cair yang disimpan pada suhu ruang masih membutuhkan penelitian yang panjang mengingat daya hidup dan waktu simpan yang didapat masih rendah.
Oleh karena itu, tujuan dari penelitian ini adalah untuk mengetahui daya tahan hidup semen cair kambing Boer yang disimpan pada
suhu ruang dan 35°C di dalam pengencer Tris kuning telur.
MATERI DAN METODE
Penelitian dilakukan di Laboratorium Reproduksi Loka Penelitian Kambing Potong Sei Putih, Sumatera Utara. Materi ternak untuk penelitian adalah kambing pejantan Boer berjumlah 3 ekor yang berumur antara 2-3 tahun dengan bobot badan berkisar antara 50- 55 kg. Kambing ditempatkan dalam kandang individu yang dilengkapi dengan tempat pakan dan minum. Pemberian sumber bahan makanan dalam bentuk konsentrat dan hijauan pakan ternak. Pemberian konsentrat berkisar antara 400-500 gram per ekor per hari dilakukan pada waktu pagi hari, sedangkan hijauan pakan berupa rumput dengan jumlah pemberian berkisar antara 3-4 kg segar per ekor per hari diberikan pada waktu siang dan sore hari.
Pemberian air minum secara ad libitum.
Koleksi semen
Penampungan semen menggunakan vagina buatan dengan inner liner pada bagian dalamnya untuk selanjutnya diberi air bersuhu 40-42°C dan udara melalui katup, diberi pelumas dengan kedalaman tidak lebih dari 3 cm sehingga vagina buatan menyerupai kondisi sebenarnya, kemudian pada salah satu bagian ujung vagina buatan dipasang tabung penampung spermatozoa. Semen ditampung secara reguler dengan interval 1 minggu sekali dan 1 ejakulat per setiap periode penampungan.
Pengolahan dan preservasi semen
Semen segar hasil penampungan dibawa ke
laboratorium, lalu diencerkan menggunakan
bahan pengencer Tris kuning telur dengan
komposisi yaitu 2,96 g Tris aminomethane,
1,65 g asam sitrat, 2,16 g laktosa, 6 ml gliserol,
1.000 IU/ml penisilin, 1.000 µg/ml streptomisin,
20 ml kuning telur dan aquabidest ad 100 ml
(Kostaman et al. 2000). Konsentrasi
spermatozoa dalam bahan pengencer adalah
200 x 10
6ml
-1. Penyimpanan semen cair
dilakukan pada suhu ruangan dan di water bath
bersuhu 35°C. Pengamatan semen cair
dilakukan setiap 1,5 jam dengan parameter
yang diamati adalah persentase motilitas, integritas membran dan viabilitas spermatozoa.
Evaluasi semen
Evaluasi dilakukan secara mikroskopis (motilitas, viabilitas dan integritas membran).
Penilaian persentase motilitas spermatozoa ditentukan dengan cara menempatkan satu tetes semen yang telah diencerkan dengan larutan 0,9% NaCl pada gelas objek dan ditutup dengan gelas penutup. Pengamatan terhadap spermatozoa yang bergerak progresif dilakukan secara subjektif pada enam lapang pandang yang berbeda di bawah mikroskop dengan pembesaran 400x. Penilaian yang diberikan mulai nol persen (tidak ada spermatozoa yang bergerak ke depan) sampai 100 persen (semua spermatozoa bergerak ke depan).
Penentuan persentase viabilitas dari spermatozoa dilakukan dengan menggunakan metode pewarnaan eosin-negrosin dengan komposisi pewarna eosin-negrosin untuk 300 ml air mili-Q terdiri dari 3,3 g eosin yellow (Wako Pure chemical Industries, 058-00062), 20 g nigrosin (Sigma-Aldrich 198285) dan 1,5 g sodium sitrat, menurut prosedur Barth dan Oko (1989). Sebanyak 10 μl sampel semen dan 40 μl eosin-negrosin dicampur di atas gelas obyek kemudian dibuat preparat ulas dan dikeringkan menggunakan bunsen selama 15 detik sebelum dilakukan pengamatan di bawah mikroskop dengan pembesaran 400x.
Spermatozoa yang dikategorikan hidup adalah spermatozoa yang tidak menyerap zat warna sehingga pada bagian kepala spermatozoa tidak terwarnai (putih), sedangkan spermatozoa yang dikategorikan mati adalah spermatozoa yang menyerap zat warna sehingga pada bagian kepalanya akan berwarna merah. Persentase viabilitas spermatozoa ditentukan berdasarkan perbandingan antara jumlah spermatozoa hidup dengan jumlah total spermatozoa. Jumlah total spermatozoa yang dihitung adalah 200 spermatozoa.
Penilaian persentase integritas membran spermatozoa diperiksa menggunakan Hypoosmotic Swelling Test (HOS-Test) dengan komposisi larutan HOS untuk 10 ml air mili-Q ditambah dengan 0,135 g fruktosa (Merck, Germany) dan 0,0735 g trisodium citrate 2H
2O. Sampel semen sebanyak 20 µl diencerkan dengan 80 µl larutan HOS dan
dibiarkan selama 10 menit pada suhu kamar.
Untuk keperluan pengamatan, diteteskan 10 μl sampel semen pada gelas objek yang ditutup dengan gelas penutup dan evaluasi dilakukan di bawah mikroskop dengan pembesaran 400x.
Perhitungan dilakukan pada lima lapang pandang secara acak terhadap spermatozoa yang mempunyai ekor melingkar (membran plasma utuh) maupun yang mempunyai ekor lurus (membran plasma tidak utuh). Jumlah total spermatozoa yang dihitung adalah 200 spermatozoa.
Analisis data
Data dianalisis menggunakan rancangan acak lengkap dengan dua perlakuan, dengan jumlah ternak 3 ekor dan masing-masing diulang sebanyak lima kali. Apabila terdapat perbedaan antar perlakukan dilanjutkan dengan Duncan’s Multiple Range Test (DMRT) menurut Steel dan Torrie (1993). Data diolah menggunakan program SPSS versi 19.
HASIL DAN PEMBAHASAN Karakteristik spermatozoa kambing boer dalam pengencer tris kuning telur
Karakteristik spermatozoa kambing Boer setelah penambahan pengencer Tris kuning telur menunjukkan kualitas baik dengan persentase motilitas, viabilitas dan integritas membran spermatozoa seperti pada Tabel 1.
Hasil ini menunjukkan bahwa motilitas spermatozoa yang progresif sebesar 79,09±3,75%. Nilai ini tidak jauh berbeda dengan yang dilaporkan oleh Naing et al.
(2010) pada kambing Boer dengan persentase motilitas spermatozoa 73,8±1,9%. Hal yang kurang lebih sama juga dilaporkan Kusumaningrum et al. (2004) bahwa persentase motilitas spermatozoa sapi FH setelah penambahan kuning telur sebesar 75,00±5,34%. Tambing et al. (2003) melaporkan bahwa persentase motilitas spermatozoa kambing Peranakan Ettawah sebesar 71,67±2,58%. Begitu pula Said et al.
(2005) melaporkan persentase motilitas
spermatozoa sapi Simmental setelah
penambahan kuning telur sebesar 76,25%.
Tabel 1. Kualitas awal spermatozoa kambing Boer dalam pengencer Tris kuning telur Karakteristik semen Rataan±SD (%)
Motilitas 79,09±3,75
Viabilitas 91,70±4,41
Integritas membran 75,13±4,34
Persentase viabilitas dan integritas membran spermatozoa setelah penambahan pengencer Tris kuning telur pada penelitian ini berturut-turut sebesar 91,70±4,41% dan 75,13
±4,34%. Hasil yang diperoleh pada penelitian ini menunjukkan persentase motilitas, viabilitas dan integritas membran spermatozoa masih cukup tinggi. Penggunaan pengencer Tris kuning telur dengan kandungan Tris dan kuning telur diduga dapat melindungi spermatozoa selama proses penyimpanan.
Penggunaan pengencer tris pada semen cair karena keunggulan dalam mempertahankan:
perubahan pH, tekanan osmotik, keseimbangan elektrolit dan osmolaritas (Salamon dan Maxwell 2000; Yoshida 2000). Begitu pula
kuning telur yang didalamnya terdapat lesitin dapat mempertahankan motilitas spermatozoa karena kandungan phosphatidylcholine (Kikuchi et al. 1998). Kandungan phovitin, ceruloplasmin, ovalbumin dan ovotransferrin yang terdapat pada kuning telur dapat menghilangkan ion logam bebas yang dapat mengkatalisis produksi Reactive Oxygen Species (ROS). Begitu pula protein yang mirip dengan ekstraselular superoksida dismutase dan plasma glutathione peroksidase pada kuning telur dapat berkontribusi dalam meningkatkan kapasitas antioksidan (Mann dan Mann 2008).
Selain itu, keberadaan seminal plasma merupakan media isotonis mengandung sumber energi yang langsung dapat dipergunakan oleh spermatozoa seperti fruktosa dan sorbitol (Hafez 2000). Menurut Hammerstedt (1993), spermatozoa hanya dapat hidup tergantung pada seminal plasma sebagai sumber energi dan tidak dapat mensintesa sendiri energi yang diperlukan untuk proses metabolisme maupun memperbaiki kerusakan sel.
(*) Menunjukkan perbedaan yang nyata (P<0,05) pada persentase motilitas spermatozoa di antara suhu penyimpanan
Gambar 1. Persentase motilitas spermatozoa kambing Boer selama penyimpanan. Dalam setiap lamanya penyimpanan, bar dengan huruf yang berbeda (a,b; x,y,z) menunjukkan perbedaan yang nyata untuk spermatozoa yang disimpan pada suhu ruang dan suhu 35°C (P<0,05)
% Motilitas
90 80 70 60 50 40 30 20 10 0
Suhu ruang Suhu 35°C
Lama penyimpanan (jam)
1,5 3 4,5 6
Karakteristik spermatozoa kambing boer selama proses penyimpanan pada temperatur berbeda
Preservasi semen cair umumnya dilakukan pada suhu 3-5°C. Pada kondisi tidak terdapat lemari es, maka tidak ada pilihan lain selain menyimpan semen cair pada suhu ruang. Suhu ruang di daerah tropis berbeda dengan di daerah sub tropis. Di daerah sub tropis suhu ruang umumnya adalah 20°C. Suhu ruang ditempat penelitian ini berkisar antara 27°C (pagi hari) sampai dengan 30°C (sore hari).
Persentase motilitas merupakan gambaran dari aktifitas spermatozoa yang progresif dan berkorelasi sangat erat dengan fertilitas. Hasil penelitian menunjukkan bahwa persentase motilitas spermatozoa kambing Boer yang disimpan pada suhu ruang menunjukkan perbedaan yang nyata (P<0,01) dengan suhu 35°C pada lama penyimpanan 1,5-6 jam.
Penurunan persentase spermatozoa motil pada suhu 35°C lebih cepat dibandingkan dengan suhu ruang. Hal ini dapat dipahami mengingat pada suhu 35°C metabolisme berlangsung hampir optimal, sehingga fruktosa ataupun glukosa sebagai sumber energi bagi pergerakan spermatozoa cepat habis dan menghasilkan hasil sampingan berupa asam laktat yang dapat menurunkan pH bahan pengencer (Nalley 2007).
Penyimpanan dalam jangka waktu lama menyebabkan penurunan motilitas spermatozoa akibat adanya asam laktat sisa metabolisme sel yang menyebabkan kondisi medium menjadi semakin asam karena penurunan pH dan kondisi ini dapat bersifat racun terhadap sepermatozoa yang akhirnya menyebabkan kematian spermatozoa (Sugiarti et al. 2004). Apabila sumber cadangan energi lain telah habis, spermatozoa akan menggunakan cadangan energi yang terdapat dalam plasmalogen yang diuraikan terlebih dahulu oleh O
2dan asam lemak yang dibebaskan akan di oksidasi menjadi CO
2(Hafez 2000). Menurut Gazali dan Tambing (2002), peroksida lipid berperan utama dalam proses penuaan, memperpendek daya hidup spermatozoa, menginduksi perubahan struktur terutama pada daerah akrosom dan penurunan motilitas secara cepat.
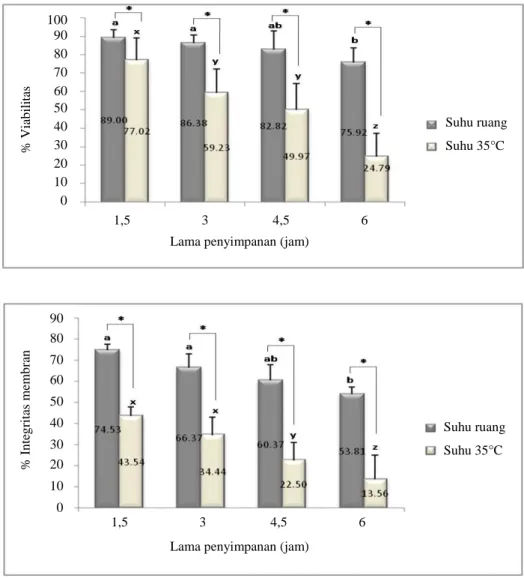
Persentase viabilitas dan integritas membran spermatozoa kambing Boer dalam pengencer Tris kuning telur yang di simpan pada temperatur yang berbeda menunjukkan pola yang sama dengan persentase motilitas spermatozoa. Hasil penelitian menunjukkan bahwa persentase viabilitas spermatozoa kambing Boer yang disimpan pada suhu ruang menunjukkan perbedaan yang nyata (P<0,01) dengan suhu 35°C pada lama penyimpanan 1,5-6 jam, begitu pula pada persentase integritas membran spermatozoa. Penurunan persentase viabilitas dan integritas membran spermatozoa pada suhu 35°C lebih cepat dibandingkan dengan suhu ruang, hal ini dikarenakan metabolisme spermatozoa berjalan hampir optimal dibandingkan dengan suhu ruang. Pada suhu ruang, menurut Vishwanath dan Shannon (2000) spermatozoa mempunyai daya tahan hidup yang sangat pendek, apalagi jika spermatozoa disimpan melebihi suhu ruang.
Selama proses metabolisme spermatozoa akan dihasilkan radikal bebas dinamakan reactive oxygen species (ROS) yang dapat merusak ikatan rangkap pada asam lemak sehingga dapat menyebabkan kerusakan pada DNA dan protein (Best 2006). Hal ini selain disebabkan sumber nutrisi yang cepat habis dan dihasilkannya ROS, penyebab lain adalah enzim aromatic amino acid aminase (AAAO) yang dilepaskan dari membran plasma spermatozoa yang mati. Semakin tinggi suhu dan semakin lama penyimpanan spermatozoa, jumlah enzim ini akan meningkat. Substrat energi yang menurun, penimbunan asam laktat, ROS dan dilepaskannya enzim AAAO oleh membran spermatozoa yang mati, menyebabkan spermatozoa hanya bertahan selama 24 jam saja (Nalley 2007). Hal ini terjadi karena adanya sisa metabolisme spermatozoa yang bersifat asam dan mengakibatkan pH menjadi turun, dan inilah yang menjadi toksik bagi spermatozoa.
Situmorang et al. (2001) menyatakan
bahwa keasaman akan mempengaruhi struktur
kimia kuning telur dan kemungkinan besar
protein maupun lipid protein akan
terdenaturasi, sehingga tidak efektif lagi
berfungsi sebagai bahan yang dapat
melindungi spermatozoa dari lingkungan yang
kurang baik.
(*) Menunjukkan perbedaan yang nyata (P<0,05) pada persentase viabilitas dan integritas membran spermatozoa diantara suhu penyimpanan
Gambar 2. Persentase viabilitas dan integritas membran spermatozoa kambing Boer selama penyimpanan.
Dalam setiap lamanya penyimpanan, bar dengan huruf yang berbeda (a,b; x,y,z) menunjukkan perbedaan yang nyata untuk spermatozoa yang disimpan pada suhu ruang dan suhu 35°C (P<0,05)
KESIMPULAN
Persentase motilitas, viabilitas dan integritas membran spermatozoa kambing Boer dalam pengencer Tris kuning telur yang disimpan pada suhu ruang hingga lama penyimpanan 6 jam lebih baik dibandingkan dengan suhu 35°C.
UCAPAN TERIMA KASIH
Terima kasih diucapkan kepada Bapak Mikael Situmorang, Bapak Wagiman, yang telah membantu dalam pemeliharaan kambing Boer di Kandang Percobaan Loka Penelitian Kambing Potong. Kepada Bapak Imaniyanto dan Bapak Yousep, kami mengucapkan terima
% Viabilitas
100 90 80 70 60 50 40 30 20 10 0
1,5 3 4,5 6
Lama penyimpanan (jam)
1,5 3 4,5 6
Lama penyimpanan (jam) 90
80 70 60 50 40 30 20 10 0
% Integritas membran
Suhu ruang Suhu 35°C
Suhu ruang Suhu 35°C
kasih atas bantuannya dalam melakukan koleksi dan evaluasi karakteristik spermatozoa di Laboratorium Reproduksi Loka Penelitian Kambing Potong.
DAFTAR PUSTAKA
Aboagla EM, Terada T. 2004. Effects of egg yolk during the freezing step of cryopreservation on the viability of goat spermatozoa.
Theriogenology. 62:1160-1172.
Amirat L, Tainturier D, Jeanneau L, Thorin C, Gerard O, Courtens JL, Anton M. 2004. Bull semen in vitro fertility after cryopreservation using egg yolk LDL: a comparison with optidyl, a commercial egg yolk extender.
Theriogenology. 61:895-907.
Arifiantini I, Yusuf TL, Graha N. 2005. Longivitas dan recovery rate pasca thawing semen beku sapi Fresian Holstein menggunakan bahan pengencer yang berbeda. Buletin Peternakan.
29:53-61.
Barth AD, Oko RJ. 1989. Abnormal morphology of bovine spermatozoa. Ames: Iowa State University Press. p. 136-143.
Best B. 2006. Aging mechanism. http:
//www.benbest.com/cryonics/agingmechanism .html. [(4 September 2006)].
Birkhead TR, Hosken DJ, Pitnick S. 2009. Sperm biology. An Evolutionary Perspective, Burlington, MA: Academic Press.
Dorado J, Rodriguez I, Hidalgo M. 2007.
Cryopreservation of goat spermatozoa:
comparison of two freezing extenders base on post-thaw sperm quality and fertility rates after artificial insemination. Theriogenology.
68:168-177.
England GCW. 1993. Cryopreservation of dog semen:
A review. J Reprod Fertil. 37:243-255.
Gazali M, Tambing SN. 2002. Kriopreservasi sel spermatozoa. Hayati. 9:27-32.
Hafez ESE. 2000. Reproduction in farm animals.
Philadelphia. Lea and Febiger.
Hammerstedt RH. 1993. Maintenance of bioenergietic balance in sperm and prevention of lipid peroxidation: A review of the effects on design and storage preservation system.
Reprod Fert Div. 5:675-690.
Kikuchi K, Nagai T, Kashiwazaki N, Ikeda H, Noguchi J, Shimada A, Soloy E, Kaneko H.
1998. Cryopreservation and ensuing in vitro fertilization ability of boar spermatozoa from epididymides stored at 4°C. Theriogenology.
50:615-623.
Kostaman T, Sutama IK, Situmorang P, Budiarsana IGM. 2000. Pengaruh jenis pengencer dan waktu ekuilibrasi terhadap kualitas semen beku kambing peranakan etawah. Dalam:
Haryanto B, Darminto, Hastiono S, Sutama IK, Partoutomo S, Subandriyo, Sinurat AP, Darmono, Supar, Oloan Butar butar S, Penyunting. Teknologi Peternakan dan Veteriner dalam Upaya Meningkatkan Ketahanan Pangan Nasional. Prosiding Seminar Nasional Peternakan dan Veteriner.
Bogor, 18-19 September 2000. Bogor (Indonesia): Pusat Penelitan dan Pengembangan Peternakan. hlm. 156-163.
Kusumaningrum DA, Triwulaningsih E, Situmorang P, Sugiarti T, Sianturi RG. 2004. Pengaruh seminar plasma dan konsentrasi kuning telur terhadap kualitas semen cair yang disimpan pada suhu ruang. Dalam: Thalib A, Sendow I, Purwadaria T, Tarmudji, Darmono, Triwulanningsih E, Beriajaya, Natalia L, Nurhayati, Ketaren PP, Priyanto D, Iskandar S, Sani Y, penyunting. Iptek Sebagai Motor Penggerak Pembangunan Sistem dan Usaha Agribisnis Peternakan. Prosiding Seminar Nasional Peternakan dan Veteriner. Bogor, 4-5 Agustus 2004. Bogor (Indonesia): Pusat Penelitan dan Pengembangan Peternakan.
hlm. 207-213.
Mann K, Mann M. 2008. The chicken egg yolk plasma and granule proteomes. Proteomics.
8:178-191.
Naing SW, Wahida H, Mohd Azam K, Rosnin Y, Zuki AB, Kazhal S, Bukar MM, Thein M, Kyaw T, San MM. 2010. Effect of sugars on characteristics of Boer goat semen after cryopreservation. Anim Reprod Sci.
122:23-28.
Nalley WMM. 2007. Karakteristik semen rusa Timor (Cervus timorensis). Dalam: darmono, Wina E, Nurhayati, Sani Y, Prasetyo LH, Triwulanningsih E, Sendow I, Natalia L, Priyanto D, Indraningsih, Herawati T, penyunting. Akselerasi Agribisnis Peternakan Nasional Melelui Pengembangan dan Penerapan IPTEK. Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner.
Bogor, 21-22 Agustus 2007. Bogor (Indonesia): Pusat Penelitan dan Pengembangan Peternakan. hlm. 829-836.
Rizal M, Herdis, Surachman M, Nalley WMM.
2008. Pengaruh plasma semen domba priangan terhadap daya hidup spermatozoa kambing peranakan etawah yang disimpan pada suhu 3-5oC. JITV. 13:23-29.
Said S, Gunawan M, Kaiin EM, Tappa B. 2005.
Daya tahan hidup sperma cair sapi Simmental yang disimpan dalam straw pada temperature 5°C. Dalam: Mathius IW, Bahri S, Tarmudji, Prasetyo LH, Triwulanningsih E, Tiesnamurti B, Sendow I, Suhardono, penyunting. Inovasi Teknologi Peternakan untuk Meningkatkan Kesejahteraan Masyarakat dalam Mewujudkan Kemandirian dan Ketahanan Pangan Nasional.
Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner. Bogor, 12-13 September 2005. Bogor (Indonesia): Pusat Penelitan dan Pengembangan Peternakan.
hlm. 87-90.
Salomon S, Maxwell WMC. 2000. Storage of ram semen. Anim Reprod Sci. 62:77-111.
Salvador I, Viudes de Castro MP, Bernacer J, Gomez EA, Silvestre MA. 2005. Factors affecting pregnancy rate in artificial insemination with frozen semen during non- breeding season in Murciano-Granadina goats:
a field assay. Reprod Domest Anim. 40:526- 529.
Situmorang P, Triwulaningsih E, Lubis A, Caroline W, Sugiarti T. 2001. Pengaruh proline, carnitine terhadap daya hidup spermatozoa yang disimpan dalam suhu 5°C (chilling semen). JITV. 6:1-6.
Situmorang P. 2003. The effects of inclusion of exogenous phospholipid in Tris diluents containing different level of egg yolk on the viability of bull spermatozoa. JITV.
7:181-187.
Steel RGD, Torrie JH. 1993. Prinsip dan prosedur statistika: suatu pendekatan biometrik. Alih Bahasa: B. Sumantri. Jakarta (Indonesia):
Gramedia Pustaka Utama.
Sugiarti T, Triwulaningsih E, Situmorang P, R.G.
Sianturi RG, Kusumaningrum DA. 2004.
Penggunaan katalase dalam produksi semen dingin sapi. Dalam: Thalib A, Sendow I, Purwadaria T, Tarmudji, Darmono, Triwulanningsih E, Beriajaya, Natalia L, Nurhayati, Ketaren PP, Priyanto D, Iskandar S, Sani Y, penyunting. Iptek Sebagai Motor Penggerak Pembangunan Sistem dan Usaha Agribisnis Peternakan. Prosiding Seminar Nasional Teknologi Peternakan dan Veteriner.
Bogor, 4-5 Agustus 2004. Bogor (Indonesia):
Pusat Penelitan dan Pengembangan Peternakan. hlm. 215-220.
Tambing SN, Toelihere MR, Yusuf TL, Purwantara B, Sutama IK, Situmorang P. 2003. Kualitas semen beku kambing saanen pada berbagai jenis pengencer semen. Hayati. 10:146-150.
Verstegen EJK, Kloosterboer JG, Lub J. 2005 Synthesis and photopolymerization of oxetanes derived from bisphenol A. J Appl Polymer Sci. 98:1697-1707.
Vishwanath R, Shannon P. 2000. Storage of bovine semen in liquid and frozen state. Anim Reprod Sci. 62:23-53.
Yoshida M. 2000. Conservation of sperms: current status and new trends. Anim Reprod Sci.
60/61:349-355.