KERAGAMAN CENDAWAN ENDOFIT ASAL TANAMAN
KUNYIT (
Curcuma longa
) DAN AKTIVITAS
PENGHAMBATANNYA TERHADAP PEMBENTUKAN
HISTAMIN
ERIS SEPTIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Cendawan Endofit Asal Tanaman Kunyit (Curcuma longa) dan Aktivitas Penghambatannya terhadap Pembentukan Histamin adalah benar karya saya bersama-sama dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor
Bogor, Agustus 2014
(Curcuma longa) dan Aktivitas Penghambatannya terhadap Pembentukan Histamin. Dibimbing oleh NAMPIAH SUKARNO, SUKARNO, dan PARTOMUAN SIMANJUNTAK
Kunyit (Curcuma longa) merupakan tanaman obat yang umum digunakan sebagai bumbu dan pengawet. Cendawan endofit memiliki kemampuan untuk mensintesis metabolit sekunder dari inangnya yang memiliki aktivitas untuk meningkatkan ketahanan tanaman inang dari serangan hama dan penyakit dan lingkungan yang kurang menguntungkan. Tujuan penelitian ini ialah mempelajari keragaman cendawan endofit dari tanaman kunyit dan menguji kemampuannya dalam menghambat pembentukan histamin pada ikan segar. Isolasi cendawan dilakukan dari seluruh organ tanaman yaitu akar, rimpang, batang, infloresen, bunga, dan daun.
Identifikasi cendawan endofit dilakukan dengan menganalisis karakteristik morfologi dan molekuler menggunakan daerah ITS dari rDNA. Metode dual culture digunakan untuk penapisan aktivitas antibakteri terhadap Morganella morganii yang dikenal sebagai bakteri penghasil histamin. Metode difusi cakram kertas digunakan untuk menguji aktivitas fraksi air dari filtrat cendawan endofit terpilih untuk menghambat pertumbuhan M. morganii. Kromatografi lapis tipis dua dimensi digunakan untuk mengetahui penghambatan pembentukan histamin.
Sebelas cendawan endofit berhasil diisolasi dari seluruh bagian tanaman kunyit. Cendawan tersebut ialah Arthrobotrys foliicola, Cochliobolus kusanoi, Daldinia eschscholzii, Fusarium oxysporum, F. proliferatum, F. solani, F. verticillioides, Phaeosphaeria ammophilae dan Phanerochaete chrysosporium. Lima dari 11 isolat yaitu A. foliicola, C. kusanoi, F. proliferatum, F. verticillioides, dan P. ammophilae memiliki aktivitas penghambatan terhadap pertumbuhan bakteri M. morganii dengan metode dual culture. Berdasarkan metode difusi cakram kertas, dua dari 5 isolat yaitu A. foliicola dan F. verticillioides memiliki aktivitas penghambatan pertumbuhan bakteri M. morganii dan pembentukan histamin pada ikan segar. Hasil penelitian menunjukkan bahwa aktivitas terbaik diperoleh dari fraksi air dari filtrat F. verticillioides dalam menghambat pertumbuhan bakteri penghasil histamin, M. morganii (1x102 cfu/g) dan pembentukan histamin pada ikan segar (3.12 ppm) tercapai pada suhu inkubasi 0 °C.
SUMMARY
ERIS SEPTIANA. Diversity of Endophytic Fungi Associated with Turmeric (Curcuma longa) and Their Histamine Formation Inhibitor Activity. Supervised by NAMPIAH SUKARNO, SUKARNO and PARTOMUAN SIMANJUNTAK.
Turmeric (Curcuma longa) is a medicinal plant commonly used as a spice and preservative. Endophytic fungi have ability to synthesize secondary metabolites which has activity to increase the resistance of plants host from pests and diseases and unfavorable enviroment. This research investigated the diversity of endophytic fungi on turmeric plant and determined their effects in inhibiting histamine formation in fresh fish. Fungal isolation was carried out from all plant organs such as root, rhizome, stem, inflorescence, flower, and leaf.
Identification of endophytic fungi was done by morphological and molecular analyses using ITS region of rDNA. Dual culture method was used to screen antibacterial activity of the fungi against Morganella morganii known as common histamine-producing bacteria. Disc diffusion method was used to test water fraction of selected endophytic fungi to inhibit M. morganii growth. Two dimension thin layer chromatography (TLC) was used to determine fungal extract inhibition activity on histamine formation.
Eleven endophytic fungi were successfully isolated from all parts of turmeric plant. The fungi were Arthrobotrys foliicola, Cochliobolus kusanoi, Daldinia eschscholzii, Fusarium oxysporum, F. proliferatum, F. solani, F. verticillioides, Phaeosphaeria ammophilae, and Phanerochaete chrysosporium. Five out of 11 isolates, A. foliicola, C. kusanoi, F. proliferatum, F. verticillioides, and P. ammophilae had inhibition activity againts M. morganii in dual culture method. Based on disc diffusion assay, two out of 5 isolates, A. foliicola, and F. verticillioides inhibited the growth of M. morganii and histamine formation in fresh fish. Furthermore, the best activity of F. verticillioides was observed from water fraction in inhibiting growth of histamine-producing bacteria (1x102 cfu/g), and histamine formation inhibition in fresh fish (3.12 ppm) was achieves by incubation at 0 °C.
©
Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KERAGAMAN CENDAWAN ENDOFIT ASAL TANAMAN
KUNYIT (
Curcuma longa
) DAN AKTIVITAS
PENGHAMBATANNYA TERHADAP PEMBENTUKAN
HISTAMIN
ERIS SEPTIANA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Keragaman Cendawan Endofit Asal Tanaman Kunyit (Curcuma longa) dan Aktivitas Penghambatannya terhadap Pembentukan Histamin
Nama : Eris Septiana NIM : G351110131
Disetujui oleh Komisi Pembimbing
Dr Ir Nampiah Sukarno Ketua
Dr Ir Sukarno, MSc Anggota
Prof (R) Dr Partomuan Simanjuntak, MSc Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan dari bulan November 2012 sampai dengan November 2013 ini ialah identifikasi cendawan endofit asal tanaman kunyit dan potensinya sebagai bahan pengawet alami, dengan judul keragaman cendawan endofit asal tanaman kunyit (Curcuma longa) dan aktivitas penghambatannya terhadap pembentukan histamin.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Nampiah Sukarno sebagai ketua komisi pembimbing, Bapak Dr Ir Sukarno MSc dan Bapak Prof (R) Dr Partomuan Simanjuntak, MSc sebagai anggota komisi pembimbing, yang telah banyak memberikan nasehat, saran, motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Ibu Dr Nancy Dewi Yuliana, Ibu Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB yang telah memberikan motivasi selama studi dan Ibu Prof Dr Okky Setyawati Dharmaputra atas masukan pada saat ujian sidang tesis. Kepada Kementrian Riset dan Teknologi terima kasih atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB, dan terima kasih kepada Food and Nutrition Culture Collection (FNCC), PAU Pangan dan Nutrisi, Universitas Gadjah Mada dalam menyediakan isolat bakteri penghasil histamin Morganella morganii FNCC 0122 serta Ibu Yuningsih dari Balai Penelitian Veteriner Bogor atas bantuannya dalam analisis kadar histamin sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penulis juga mengucapkan terima kasih kepada Ibu Emi, Pak Kusnadi, Sepriyadi Rihi S.Si, dan Aldi selaku staf Laboratorium Mikologi IPB, kepada rekan-rekan Laboratorium Kimia Bahan Alam P2 Bioteknologi LIPI, juga kepada Ivan, Nicho, Ibu Tatik, mbak Mala, Sari, Isra, Oktan, serta seluruh teman-teman di Laboratorium Mikologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis ucapkan kepada, ibu, dan adikku tercinta Resi dan Inez, serta sahabat-sahabatku tersayang, atas doa, dukungan, kasih sayang, dan semangat yang diberikan. Terima kasih untuk kebersamaan yang singkat, penuh makna, dan sangat indah teruntuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2011 serta seluruh pihak yang telah memberikan doa dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN x
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA 3
Mikrob Endofit, Hubungan dengan Inangnya, serta Peran bagi Manusia 3
Kunyit (Curcuma longa) 4
Identifikasi Cendawan Endofit 5
Histamin dan Bakteri Pembentuk Histamin 6
METODE 7
Kerangka Penelitian 7
Waktu dan Tempat Penelitian 8
Isolasi Cendawan Endofit 8
Identifikasi Cendawan Endofit 8
Penapisan Aktivitas Antibakteri dari Cendawan Endofit Hasil Isolasi 10 Uji Penghambatan Histamin dan Bakteri Pembentuk Histamin pada
Ikan Segar 10
Penapisan Fitokimia Fraksi Air Filtrat Cendawan Endofit Terpilih 11
HASIL DAN PEMBAHASAN 12
Hasil 12
Keragaman dan Distribusi Cendawan Endofit pada Tanaman Kunyit 12 Uji Penghambatan Pertumbuhan Bakteri Penghasil Histamin 19 Uji Penghambatan Pembentukan Histamin pada Ikan Segar 21
Pembahasan 24
Keragaman dan Distribusi Cendawan Endofit pada Tanaman Kunyit 24 Uji Penghambatan Pertumbuhan Bakteri Penghasil Histamin 26 Uji Penghambatan Pembentukan Histamin pada Ikan Segar 28
SIMPULAN DAN SARAN 31
Simpulan 31
Saran 31
DAFTAR PUSTAKA 31
LAMPIRAN 37
DAFTAR TABEL
1 Karakter morfologi cendawan endofit asal seluruh organ tanaman kunyit 12 2 Cendawan endofit asal tanaman kunyit berdasarkan identifikasi
molekuler menggunakan daerah ITS 17
3 Diameter zona hambat (mm) fraksi air cendawan endofit terhadap Morganella morganii FNCC 0122 menggunakan metode dual culture
setelah inkubasi 24 jam 20
4 Diameter zona hambat (mm) fraksi air cendawan endofit terhadap Morganella morganii FNCC 0122 menggunakan metode difusi cakram
kertas setelah inkubasi 24 jam 21
5 Nilai log TPC bakteri penghasil histamin dari filet ikan tongkol setelah kombinasi perlakuan (hubungan antara perlakuan perendaman dengan
suhu penyimpanan) setelah inkubasi 24 jam 22
6 Kadar histamin (ppm) filet ikan tongkol setelah kombinasi perlakuan (hubungan antara perlakuan perendaman dengan suhu penyimpanan)
setelah inkubasi 24 jam 23
7 Uji penapisan fitokimia fraksi air filtrat cendawan endofit terpilih 24
DAFTAR GAMBAR
1 Morfologi tanaman kunyit (Curcuma longa) 4
2 Diagram alur penelitian 7
3 Keragaman morfologi koloni cendawan endofit tanaman kunyit umur
14 hari pada media PDA. 14
4 Keragaman struktur mikroskopis morfologi cendawan endofit tanaman
kunyit dengan perbesaran 1000x 15
5 Amplifikasi PCR daerah ITS rRNA cendawan endofit kunyit
menggunakan primer ITS1 dan ITS4 16
6 Pohon filogenetik cendawan endofit asal tanaman kunyit 18 7 Sebaran cendawan endofit pada setiap organ tanaman kunyit 19 8 Kurva pertumbuhan cendawan endofit terpilih asal tanaman kunyit
pada media PDB inkubasi pada suhu kamar 20
DAFTAR LAMPIRAN
1 Organ tanaman kunyit yang digunakan dalam penelitian 38 2 Aktivitas antibakteri isolat A. foliicola, C. kusanoi, F. proliferatum,
F. verticillioides, dan P. ammophilae terhadap M. morganii dengan metode dual culture pada media Nutrient Agar setelah inkubasi
3 Aktivitas antibakteri fraksi air filtrat isolat A. foliicola dan F. verticillioides terhadap M. morganii dengan metode difusi cakram kertas pada media
Mueller Hinton Agar setelah inkubasi selama 24 jam pada suhu kamar 40 4 Populasi bakteri penghasil histamin asal filet ikan tongkol segar pada
media Niven yang dimodifikasi setelah inkubasi selama 24 jam pada
variasi suhu penyimpanan 41
PENDAHULUAN
Latar Belakang
Kunyit (Curcuma longa) merupakan tanaman Famili Zingiberaceae yang tumbuh di kawasan Asia Tenggara. Masyarakat Indonesia telah lama memanfaatkan tanaman kunyit untuk berbagai keperluan seperti bumbu masakan, pewarna alami makanan, dan menyembuhkan beberapa penyakit. Penggunaan tanaman kunyit baik tunggal maupun dikombinasikan dengan garam juga digunakan sebagai pengawet alami untuk daging ikan segar guna memperpanjang masa simpan daging ikan (Akter et al. 2013). Tanaman obat telah diketahui merupakan sumber potensial cendawan endofit yang memiliki kemampuan untuk menghasilkan senyawa bioaktif (Ginting et al. 2013). Tanaman kunyit sebagai tanaman obat mengandung berbagai cendawan endofit yang memiliki aktivitas biologis yang sama atau mirip dengan inangnya (Zhao et al. 2011). Cendawan endofit merupakan cendawan yang hidup di dalam jaringan tanaman yang mempunyai peranan menguntungkan kepada inangnya dengan cara menghasilkan senyawa bioaktif untuk perlindungan terhadap cekaman biotik dan abiotik (Dai et al. 2008). Lebih lanjut, tanaman inangnya menyediakan lingkungan yang sesuai untuk pertumbuhan dan perkembangan endofit (Barrow et al. 2008).
Histamin merupakan senyawa kimia yang secara normal diproduksi dari hasil dekarbokilasi senyawa histidin bebas dengan bantuan enzim L-histidine decarboxylase yang dihasilkan oleh bakteri pembentuk histamin yang biasa ditemukan pada ikan golongan Skombroid (Bjornsdottir et al. 2009). Pada kondisi normal, orang yang memakan ikan yang mengandung kadar histamin rendah hanya akan menyebabkan efek ringan, namun dalam asupan besar akan menyebabkan keracunan histamin seperti diare, sakit kepala, tekanan darah rendah, dan alergi kulit (Wohrl et al. 2004). Oleh karena itu, kadar histamin perlu dikendalikan untuk mengurangi kejadian keracunan histamin, khususnya setelah mengkonsumsi ikan yang mengandung histamin. Selain itu, Indonesia sebagai Negara pengekspor produk perikanan perlu memperhatikan permasalahan kandungan histamin pada ikan. Terlebih pada tahun 2004 dalam laporan Rapid Alert System for Feed and Food (RASFF) Uni Eropa, Indonesia mengalami 27 kasus penolakan ekspor tuna akibat kandungan histamin yang melebihi ambang batas yang telah ditetapkan oleh Uni Eropa (European Communities, 2004). Jumlah kasus penolakan komoditas tuna dari Indonesia merupakan yang tertinggi, karena dalam tahun tersebut terdapat total 32 kasus penolakan ikan tuna dari seluruh Negara pengekspor ikan tuna ke Eropa.
tanaman obat, garam, dan asam-asam organik. Sampai saat ini belum ada laporan yang menyebutkan penggunaan cendawan endofit untuk menghambat pertumbuhan bakteri penghasil histamin dan pembentukan histamin pada ikan. Oleh karena itu, penelitian berupa aplikasi ekstrak cendawan endofit asal tanaman kunyit akan memberikan informasi tentang kemampuan cendawan endofit sebagai bahan alam alternatif untuk menurunkan kadar histamin dalam ikan.
Perumusan Masalah
1. Setiap tumbuhan mengandung cendawan endofit yang memiliki keragaman hayati yang tinggi dan berpeluang sebagai novel spesies.
2. Rimpang tanaman kunyit telah banyak dimanfaatkan sebagai pengawet alami ikan
3. Cendawan endofit asal tanaman kunyit dapat menjadi agens penghasil senyawa antimikrob penyebab kerusakan makanan
4. Penelitian mengenai keragaman cendawan endofit dari seluruh organ tanaman kunyit belum banyak dilakukan.
Tujuan Penelitian
Tujuan dari penelitian ini ialah untuk mengetahui keragaman cendawan endofit asal tanaman kunyit, dan menguji kemampuan isolat cendawan endofit tersebut dalam menghambat pembentukan histamin pada ikan segar.
Manfaat Penelitian
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini adalah meliputi identifikasi cendawan endofit tanaman kunyit berdasarkan karakteristik morfologi dan daerah ITS rRNA, serta analisis kemampuannya dalam menghambat pertumbuhan bakteri penghasil histamin serta penghambatan pembentukan histamin. Karakteristik morfologi meliputi morfologi secara mikroskopis, sedangkan analisis daerah 18S rRNA meliputi isolasi DNA genom, amplifikasi, hingga konstruksi pohon filogenetik. Untuk mengetahui kemampuannya dalam menghambat pertumbuhan bakteri penghasil histamin, dilakukan dengan uji in vitro dengan metode dual culture dan difusi cakram kertas. Sedangkan untuk mengetahui kemampuannya dalam menghambat pembentukan histamin pada ikan dilakukan dengan metode kromatografi lapis tipis dua dimensi.
TINJAUAN PUSTAKA
Mikrob Endofit, Hubungan dengan Inangnya, serta Peran bagi Manusia
Pengertian endofit mengacu kepada organisme yang seluruhnya atau sebagian siklus hidupnya mengkolonisasi jaringan tumbuhan hidup, kolonisasi bersifat netral atau mutualisme dan tidak menimbulkan gejala penyakit. Peneliti pertama yang mengenalkan istilah endofit ialah De Bary tahun 1866 dengan istilah awalnya epifit untuk cendawan yang hidup di permukaan inangnya dan endofit untuk yang hidup di dalam jaringan tumbuhan. Mikrob endofit merupakan mikrob yang hidup di dalam jaringan tanaman pada periode tertentu tanpa membahayakan inangnya (Hallmann et al. 1997).Oleh karena itu hampir di dalam semua jaringan tanaman yang sehat terdapat mikrob endofit. Selain tidak membahayakan inangnya, mikrob endofit juga dapat memberikan manfaat bagi inangnya. Mikrob endofit sangat sinergis dengan inangnya dan mikrob endofit mampu menghasilkan senyawa khusus, seperti metabolit sekunder, untuk melindungi inangnya dari serangan hama dan penyakit (Taechowisan et al. 2005) dan membantu inangnya untuk beradaptasi pada kondisi cekaman (Khan 2007).
Selain itu, cendawan endofit juga mampu untuk melakukan proses metabolisme dan biotransformasi senyawa kimia tertentu menjadi senyawa turunannya (Prana et al. 2010). Cendawan endofit Diaporthe sp. dapat mengubah senyawa kurkumin menjadi senyawa turunannya yaitu (3R,5R)-tetrahidrokurkumin, (3R,5S)-heksahidrokurkumin, neoheksahidrokurkumin, (3S,5S)-oktahidrokurkumin, dan meso-oktahidrokurkumin yang memiliki nilai IC50 lebih rendah dari kurkumin dalam penghambatan peroksidasi lipid pada mikrosom hati tikus sehingga memiliki kemampuan antioksidan yang lebih baik dari kurkumin (Maehara et al. 2011). Selain itu cendawan endofit HF4 dan HF6 yang terdapat di dalam rimpang kunyit mempunyai kemampuan sebagai antimikrob terhadap bakteri Escherichia coli, Salmonella typhi, Bacillus subtilis, Staphylococcus aureus, dan Proteus vulgaris (Jalgaonwala et al. 2010).
Kunyit (Curcuma longa)
Curcuma longa Linn. syn. C. domestica Valeton (Gambar 1) merupakan tumbuhan tropis yang banyak ditanam di kawasan Asia dan kawasan lain yang mempunyai iklim yang sesuai. Tumbuhan ini merupakan golongan herba yang merupakan anggota Zingiberaceae. Tumbuhan ini dapat tumbuh sampai tinggi 1 m, dengan daun berbentuk oval dan tersususn dalam rumpun (Wickenberg et al. 2010)
Gambar 1 Morfologi tanaman kunyit (Curcuma longa): daun (a); bunga (b); infloresen (c); akar (d); batang (e); rimpang (f)
Kunyit merupakan salah satu tumbuhan Famili Zingiberaceae yang paling sering diteliti kandungan fitokimianya. Sedikitnya terdapat 235 senyawa fitokimia yang berhasil diisolasi dari daun, bunga, dan rimpang. Senyawa-senyawa tersebut diantaranya ialah golongan senyawa fenolik, terpen, sterol, alkaloid, dan senyawa lainnya. Kandungan kurkuminoid pada kunyit sangat beragam bergantung pada
f
d b
a
c
varietas, lokasi, kondisi pertumbuhannya (Li et al. 2011), dan umur tanaman (Paryanto dan Srijanto 2006). Secara umum, kunyit banyak digunakan sebagai bumbu masakan, pewarna alami, dan sebagai obat untuk berbagai macam penyakit. Rimpang kunyit juga digunakan sebagai bahan pengawet alami untuk daging dan ikan yang dapat memperpanjang masa simpan dan mengurangi populasi bakteri pembusuk (Purwani dan Muwakhidah 2008). Cikrikci et al. (2008) melaporkan bahwa senyawa dalam kunyit yang berperan sebagai antimikrob adalah kurkumin.
Identifikasi Cendawan Endofit
Kultur cendawan endofit dapat diidentifikasi melalui karakter morfologi dan molekuler. Karakter molekuler dapat melengkapi data morfologi dalam identifikasi karena lebih spesifik. Salah satu pendekatan analisis molekuler yang telah banyak digunakan ialah dengan menggunakan sekuens daerah internal transcribed spacer (ITS) yang terdiri atas daerah ITS1 dan ITS2. Daerah ITS1 terletak diantara gen 18s rRNA dan 5.8s rRNA, sedangkan daerah ITS2 terletak diantara gen 5.8s rRNA dan 28s rRNA (Fujita et al. 2001). Kedua daerah ITS merupakan DNA non-coding yang terletak pada nukleus (White et al. 1990). Gen 5.8s merupakan gen yang conserve (Hillis dan Dixon 1991), sedangkan daerah ITS (ITS1 dan ITS2) merupakan daerah yang memiliki keragaman sekuens diantara spesies sehingga dapat digunakan untuk identifikasi hingga tingkat spesies (Lee et al. 1998). Beberapa studi terbaru menunjukkan bahwa daerah ITS rDNA berhasil digunakan dalam identifikasi cendawan endofit. Ukuran gen 5.8s relatif identik untuk semua spesies cendawan, sedangkan ukuran daerah ITS bervariasi bergantung pada spesies cendawan (Fujita et al. 2001). Pada cendawan, ukuran daerah ITS1 sangat beragam sekitar 180 pb dan ITS2 sekitar 170 pb, sedangkan ukuran subunit 5.8s sekitar 160 pb (Nilsson et al. 2010).
Histamin dan Bakteri Pembentuk Histamin
Histamin merupakan senyawa yang terbentuk dari dekarboksilasi histidin oleh enzim L-Histidine Decarboxylase (LHD) yang terdapat secara alamiah dalam jaringan daging ikan. Jumlah histamin yang dihasilkan melalui aktivitas enzim selama proses autolisis sangat rendah jika dibandingkan dengan histamin yang dihasilkan oleh aktivitas bakteri selama proses pembusukan berlangsung (Kusmawarti dan Indriati 2008). Pada kadar histamin yang rendah, senyawa ini tidak terlalu berbahaya bagi yang mengkonsumsinya. Tubuh manusia mempunyai sistem untuk menetralkan racun yang masuk lewat saluran pencernaan. Enzim pencerna histamin yang berperan dalam tubuh manusia antara lain monoamin oksidase, diamin oksidase, dan histamin-N-metiltransferase yang bekerja mengubah histamin menjadi senyawa yang tidak toksik. Namun kinerja enzim tersebut hanya pada keadaan asupan histamin yang normal (Heruwati et al. 2008) yaitu di bawah 100 mg/ 100 g (Mc Lauchlin et al. 2005), sehingga perlu diwaspadai terutama pada kasus asupan histamin yang melebihi ambang batas normal yang dapat dicerna oleh enzim penetral histamin (Heruwati et al. 2008).
Ikan skombroid (tuna, tongkol, kembung, haring, marlin, bonito, dan cakalang) secara alami mengandung kadar histidin (senyawa tidak toksik) yang diubah menjadi histamin (senyawa toksik) oleh enzim LHD yang dihasilkan oleh bakteri pencemar produk ikan jika kondisi penyimpanan produk tidak layak. Histamin merupakan senyawa yang tahan panas, dan bertahan hingga proses pengolahan selanjutnya setelah penyimpanan serta pengalengan. Konsumsi ikan yang mengandung kadar histamin melebihi 100 mg/ 100 g dapat menyebabkan keracunan histamin.
Ada dua macam histidin dalam daging ikan yaitu histidin bebas dan histidin terikat dalam protein. Hanya histidin bebas yang dapat mengalami dekarboksilasi menjadi histamin. Histidin bebas yang terdapat pada daging ikan erat sekali hubungannya dengan terbentuknya histamin dalam daging. Semua daging ikan yang berwarna merah seperti cakalang, marlin dan sardin, tinggi kandungan histidin bebasnya (Pan 1984). Menurut Lehane dan Olley (2000); Tsai et al. (2007) bahwa jumlah histamin yang dihasilkan dari aktivitas bakteri lebih banyak daripada hasil reaksi autolisis. Jumlah histamin yang dikandung oleh ikan dipengaruhi oleh jumlah mikrob atau bakteri yang terdapat pada ikan tersebut. Menurut Kim et al. (2003) akumulasi histamin dimulai ketika populasi bakteri melebihi 5 x 105 koloni/g.
antibakteri atau melalui proses pembekuan (Clucas dan Ward 1996). Pengaturan suhu penyimpanan produk yang tepat dapat mencegah pertumbuhan bakteri dan pembentukan histamin (Mc Lauchlin et al. 2005).
METODE
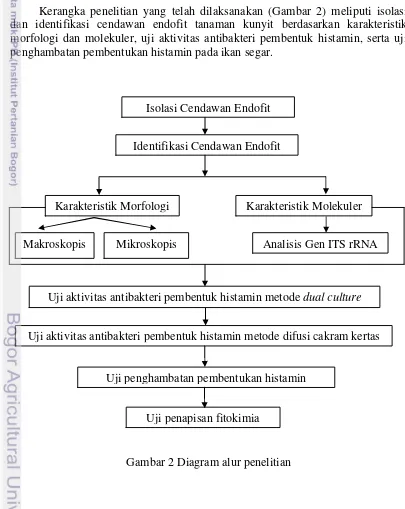
Kerangka Penelitian
Kerangka penelitian yang telah dilaksanakan (Gambar 2) meliputi isolasi dan identifikasi cendawan endofit tanaman kunyit berdasarkan karakteristik morfologi dan molekuler, uji aktivitas antibakteri pembentuk histamin, serta uji penghambatan pembentukan histamin pada ikan segar.
Gambar 2 Diagram alur penelitian Isolasi Cendawan Endofit
Karakteristik Morfologi Karakteristik Molekuler
Makroskopis Mikroskopis Analisis Gen ITS rRNA
Uji penghambatan pembentukan histamin Identifikasi Cendawan Endofit
Uji aktivitas antibakteri pembentuk histamin metode dual culture
Uji aktivitas antibakteri pembentuk histamin metode difusi cakram kertas
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan November 2012 hingga November 2013 di Laboratorium Mikologi, Departemen Biologi, FMIPA IPB dan Laboratorium Kimia Bahan Alam, Puslit Bioteknologi LIPI.
Isolasi Cendawan Endofit
Tanaman kunyit yang digunakan berasal dari kecamatan Tanah Sareal, Bogor, Jawa Barat. Organ tanaman yang digunakan sebagai sumber isolasi meliputi akar, rimpang, batang, daun, infloresen, dan bunga. Isolasi cendawan endofit mengikuti metode Hallmann et al. (2006). Masing-masing potongan organ tanaman dipotong sepanjang 2 cm untuk akar, rimpang, dan batang, sedangkan bagian daun, infloresen, dan bunga dipotong sebesar 2x2 cm. Seluruh organ yang telah dipotong kemudian dibilas dengan air leding mengalir untuk membersihkan dari debu dan selanjutnya dikeringudarakan di suhu ruang menggunakan kertas saring steril. Sterilisasi permukaan masing-masing organ dilakukan dengan merendam organ dalam etanol 70% selama 1 menit, sodium hipoklorit 5.3 % selama 5 menit, etanol 70% selama 30 detik dan dibilas secara aseptis menggunakan akuades steril 3 kali. Seluruh sampel dikeringkan selama 6 jam di atas kertas saring steril di dalam laminar. Sampel kemudian dipotong sepanjang 1 cm untuk akar, rimpang, dan batang, sedangkan untuk daun, infloresen, dan bunga dipotong dengan ukuran 1x1 cm. Tiga potongan masing-masing organ diletakkan di atas media agar-agar Low Carbon Agar (LCA) di dalam cawan Petri (diameter 9 cm) yang mengandung rose bengal (25 mg/L) sebagai fungistatik dan juga kloramfenikol (250 mg/L) sebagai penekan pertumbuhan bakteri. Masing-masing organ dilakukan 3 kali pengulangan. Sebagai kontrol negatif, sebanyak 1 mL akuades steril bilasan terakhir juga disebar di atas media agar-agar LCA. Cawan Petri kemudian diinkubasi pada suhu kamar. Seluruh koloni cendawan yang tumbuh kemudian dimurnikan dengan cara mengambil sekelumit hifa dan ditanam pada media agar-agar LCA tanpa rose bengal dan kloramfenikol, selanjutnya diinkubasi pada suhu kamar selama 7 hari.
Identifikasi Cendawan Endofit
hari dan pengamatan spora secara mikroskopis sediaan preparat berumur 14 hari dengan pewarnaan lactophenol cotton blue untuk mengamati hifa, konidiofor, dan tipe konidianya. Isolasi DNA menggunakan metode CTAB (Sambrook dan Russel 2001). Miselium fungi ditumbuhkan di dalam Erlenmeyer 50 mL yang berisi media Potato Dextrose Broth (PDB) dan diinkubasi di atas shaker dengan kecepatan 120 rpm pada suhu 29 °C selama 7 hari. Miselium dipanen dengan menyaring hasil fermentasi dengan menggunakan kertas saring steril dan dicuci dengan akuades steril, kemudian dimasukkan dalam mortar steril dan digerus dengan penggerus steril dengan ditambahkan nitrogen cair. Sekitar 0.5 g biomassa kering dipindahkan ke dalam 1.5 mL tabung mikro yang berisi 600 µL larutan buffer CTAB. Tabung kemudian dibolak-balik dan diinkubasi selama 30 menit pada suhu 65 °C dan selanjutnya diinkubasi di dalam es selama 5 menit. Sebanyak
600 µL campuran kloroform:isoamilalkohol (24:1) ditambahkan ke dalam tabung.
Tabung kemudian dibolak-balik dan disentrifugasi pada 25,000 x g pada suhu 4 °C selama 10 menit. Supernatan dipindahkan ke dalam tabung baru dan
diekstraksi dengan 600 µL campuran fenol:kloroform:isoamilalkohol (25:24:1).
Tabung dibolak-balik dan disentrifugasi pada 25,000 x g pada suhu 4 °C selama 10 menit. Supernatan dipindahkan ke dalam tabung baru dan ditambahkan dengan 0.1 x volume 2M NaOAc pH 5.2 dan 3 x volume etanol dan diinkubasi pada suhu -20 °C selama 2 jam. Pelet DNA cendawan didapatkan dengan cara sentrifugasi pada 25,000 x g pada suhu 4 °C selama 25 menit. Pelet DNA cendawan dicuci
dengan 500 µL 70% etanol, kemudian disentrifugasi pada 25,000 x g pada suhu 4
°C selama 5 menit. Pelet DNA cendawan dikeringkan di dalam ruang kedap udara selama 5 menit dan dilarutkan dengan 0.2 x volume RNAse dan 30 µL buffer TE steril dan selanjutnya diinkubasi pada suhu 37 °C selama 10 menit dan 70 °C selama 10 menit.
Amplifikasi DNA dilakukan dengan membuat volume 30 µL yang
mengandung 10.5 µL air bebas basa, 15 µL 2x PCR mastermix (Promega), 0.75
µL 10 pmol masing-masing primer ITS1 dan ITS4, dan 3 µL (sekitar 250 ng/ µL)
templat DNA. Reaksi amplifikasi dilakukan sebanyak 35 siklus sebagai berikut: pre-denaturasi pada 95 °C selama 15 menit, denaturasi pada 95 °C selama 30 menit, annealing pada 55 °C selama 30 detik, pemanjangan pada 72 °C selama 1.5 menit, pemanjangan ulang pada 72 °C selama 5 menit, dan terakhir disimpan pada
suhu 25 °C selama 10 menit. Sebanyak 5 µL hasil PCR dielektroforesis
menggunakan 1% agarosa selama 30 menit, diwarnai dengan etidium bromida selama 25 menit dan diamati di bawah lampu UV.
Pemurnian dan sekuensing hasil PCR menggunakan primer yang sama dilakukan oleh PT FirstBase (Malaysia). Hasil sekuensing dianalisis menggunakan program Chromas Pro dan dicocokkan dengan sekuens DNA cendawan yang tersedia di MycoBank (http://www.mycobank.org) dan BLAST (http://www.blast.ncbi.nlm.nih.gov/blast). Analisis filogeni dilakukan dengan metode neighbor joining (NJ) dengan program MEGA5 (Tamura et al. 2011), dan pohon filogenetik dibuat menggunakan model Tamura 3-parameter.
Penapisan Aktivitas Antibakteri dari Cendawan Endofit Hasil Isolasi
Bakteri uji penghasil histamin Morganella morganii FNCC 0122 didapatkan dari Food and Nutrition Culture Collection, PAU Pangan dan Nutrisi UGM. Bakteri kemudian ditumbuhkan pertama kali di media agar-agar Niven yang dimodifikasi untuk meyakinkan bahwa bakteri uji tersebut menghasilkan histamin. Metode dual culture (Zhang et al. 2009) digunakan untuk mengetahui aktivitas antibakteri. Masing-masing isolat murni cendawan endofit berumur 7 hari yang ditumbuhkan di dalam cawan Petri dilubangi dengan pelubang steril (diameter 6 mm) dan diletakkan di permukaan media Nutrient Agar (NA) yang telah mengandung bakteri uji berumur 24 jam. Cawan Petri diinkubasi pada suhu ruang selama 24 jam. Zona bening yang terbentuk disekitar potongan cendawan endofit kemudian diukur dan dicatat.
Isolat cendawan endofit yang memberikan hasil positif pada uji dual culture yang ditandai terbentuknya zona penghambatan dipilih untuk pengujian aktivitas antibakteri dengan metode difusi cakram kertas. Isolat cendawan endofit terpilih kemudian difermentasi dalam 100 mL media PDB dalam labu Erlenmeyer, digoyang dengan kecepatan 120 rpm selama 22 hari pada suhu ruang dengan tiga kali ulangan. Setiap dua hari sekali dilakukan pemanenan biomassa miselium untuk pembuatan kurva pertumbuhan cendawan endofit sekaligus pengukuran pH media. Isolat kemudian ditumbuhkan kembali di dalam 2 L media PDB di dalam labu Erlenmeyer, digoyang pada 120 rpm selama 15 hari (awal fase stasioner) pada suhu ruang. Masing-masing isolat dilakukan sebanyak 3 kali ulangan. Pada saat pemanenan, miselium disaring menggunkan saringan hampa udara yang dilewatkan pada kertas saring steril untuk memisahkan antara filtrat dan biomassa. Filtrat kemudian diekstraksi dengan etil asetat dan dipartisi dengan akuades untuk mendapatkan ekstrak etil asetat dan fraksi air, biomassa juga diekstrak dengan etil asetat dan air. Metode difusi cakram kertas Kirby-Bauer digunakan untuk ekstrak uji terhadap M. morganii FNCC 0122. Masing-masing ekstrak dengan seri konsentrasi 10 000, 20 000, dan 40 000 ppm digunakan untuk menghambat pertumbuhan bakteri uji di dalam media Mueller Hinton Agar (MHA). Masing-masing perlakuan dilakukan dengan 3 kali ulangan. Diameter zona hambat (mm) di sekitar cakram kertas setelah inkubasi selama 24 jam pada suhu ruang diukur dan dicatat. Isolat yang memiliki aktivitas tertinggi serta konsentrasi tertinggi ekstrak yang menghasilkan hasil positif pada uji antibakteri digunakan untuk uji penghambatan pembentukan histamin dan bakteri pembentuk histamin pada ikan segar.
Uji Penghambatan Histamin dan Bakteri Pembentuk Histamin pada Ikan Segar
endofit terpilih selama 30 menit dan kelompok kedua tidak direndam. Pada penelitian ini hanya fraksi air cendawan endofit yang digunakan karena ekstrak etil asetat tidak mencukupi untuk dilakukan uji lebih lanjut. Masing-masing kelompok dibagi menjadi 3 untuk perlakuan suhu penyimpanan pada suhu 0, 4, dan 29 °C selama 24 jam. Seluruh filet kemudian diekstraksi dengan metanol. Pengukuran kandungan histamin dilakukan oleh laboratorium toksikologi, Balai Penelitian Veteriner, Bogor. Kandungan histamin yang terbentuk diukur secara semi kuantitatif menggunakan metode kromatografi lapis tipis 2 dimensi. Pelarut pengembang yang digunakan ialah campuran aseton dan amonia (95:5) dan etanol dan amonia (80:20). Lempeng kemudian disemprot dengan 0.1 % larutan ninhidrin dan dipanaskan di dalam oven pada suhu 105 °C selama 5 menit (Wortberg dan Gerd 1981). Bercak sampel yang terbentuk kemudian dibandingkan dengan bercak standar. Angka lempeng total dari bakteri penghasil histamin dari masing-masing filet ikan tongkol juga dianalisis dengan menggunakan media modifikasi agar-agar Niven. Analisis data nilai log TPC bakteri penghasil histamin dan kadar histamin setelah perlakuan dilakukan dengan menggunakan sidik ragam (ANOVA) dan dilanjutkan dengan uji beda nyata Duncan (DMRT) pada taraf kepercayaan 95%.
Penapisan Fitokimia Fraksi Air Filtrat Cendawan Endofit Terpilih
Uji penapisan fitokimia meliputi uji alkaloid, flavonoid, saponin, tanin, kuinon, kumarin dan steroid/triterpenoid (Fransworth 1996). Uji alkaloid dilakukan dengan menambahkan sampel dengan NH4OH 25% dan kloroform. Filtrat berupa larutan organik diekstraksi dengan HCl pekat. Lapisan asam kemudian ditambah beberapa tetes pereaksi Dragendorff. Terbentuknya endapan merah bata dengan pereaksi Dragendorff menunjukkan adanya alkaloid. Uji steroid/triterpenoid sampel dimaserasi dengan eter selama 2 jam, lalu disaring. Filtrat kemudian diuapkan dalam cawan penguap. Ke dalam residu ditambahkan asam asetat glasial dan 1 tetes asam sulfat pekat. Terbentuknya warna merah, hijau ungu dan akhirnya biru menunjukkan adanya kandungan steroid/triterpenoid. Uji kumarin dilakukan dengan cara sampel ditambahkan eter, kemudian disaring dan filtrat diuapkan. Setelah kering, ditambahkan air panas dan didinginkan. Setelah dingin ditambahkan larutan amoniak 10%. Adanya fluoresensi hijau atau biru pada sinar UV menunjukkan adanya kumarin
HASIL DAN PEMBAHASAN
Hasil
Keragaman dan Distribusi Cendawan Endofit pada Tanaman Kunyit
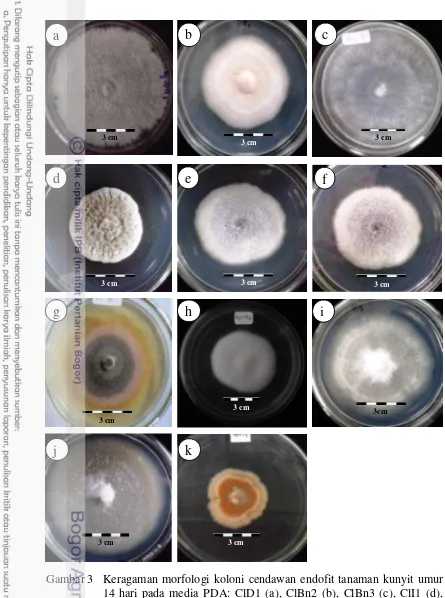
Sebelas isolat cendawan endofit berhasil diperoleh dari seluruh organ tanaman kunyit. Kesebelas isolat tersebut didapatkan dari organ akar (1 isolat), batang (1 isolat), bunga (2 isolat), daun (1 isolat), infloresen (2 isolat), dan rimpang (4 isolat). Berdasarkan karakter morfologi, 11 isolat cendawan endofit yang berhasil didapatkan dalam penelitian ini terdiri atas 4 genus yang didominasi oleh Fusarium dengan persentase lebih dari 50% dari seluruh isolat dan 2 isolat hanya teramati sebagai miselium sterilia (Tabel 1). Pada penelitian ini juga dapat diamati bahwa tidak terdapat pertumbuhan cendawan pada kontrol negatif sehingga dapat diyakini bahwa seluruh isolat yang berhasil didapatkan merupakan cendawan endofit bukan epifit. Berdasarkan pengamatan makroskopis cendawan endofit pada media PDA, Fusarium yang merupakan genus yang mendominasi menunjukkan tipe miselium yang seperti kapas, berwarna putih, kemerahan, atau ungu dengan pola pertumbuhan miselium yang cepat dan hampir memenuhi cawan pada umur 7 hari (Gambar 3). Pengamatan secara mikroskopis dengan pewarna lactophenol cotton blue pada perbesaran 1000x didapatkan bagian-bagian cendawan endofit meliputi hifa, konidiofor, dan konidium (Gambar 4).
Tabel 1 Karakter morfologi cendawan endofit asal seluruh organ tanaman kunyit (Curcuma longa)
Cendawan endofit Karakter morfologi Organ
Athrobotrys sp.
(ClA3)
Konidiofor panjang, ramping, sederhana, hialin,
konidium hialin, kadang bersekat 2, oval memanjang,
ukuran 5.49-10.50 x 2.31-3.52 µm
akar
Daldinia sp. (ClD1) konidiofor hialin, kasar, bercabang tiga, dengan pohon
sel konidiogen muncul di setiap ujung, konidium
hialin, lembut, elips, dengan dasar yang rata, ukuran
4.54-6.54 x 2.05-2.93 µm
daun
Drechslera sp.
(ClI1)
konidiofor kecoklatan, sederhana, konidium terbenam
di ujung, gelap, beberapa sekat, silinder.
infloresen
Fusarium sp. 1
(ClBn2)
konidiofor hialin, ramping, dan sederhana, konidium
hialin, makrokonidia, beberapa sekat, sedikit
melengkung, 1-2 sekat, mikrokonidia sekat tunggal,
oval, ukuran makrokonidia 12-20.11 x 2.35-3.45 µm,
mikrokonidia 6.23-11.06 x 2.42-4.06 µm
Tabel 1 Karakter morfologi cendawan endofit asal seluruh organ tanaman kunyit (Curcuma longa) (lanjutan)
Cendawan endofit Karakter morfologi Organ
Fusarium sp. 2
(ClBt1)
konidiofor hialin, ramping, dan sederhana, konidium
hialin, makrokonidia, beberapa sekat, sedikit
melengkung, 1-2 sekat, mikrokonidia sekat tunggal,
oval, ukuran makrokonidia 10.52-19.21 x 2.15-3.33
µm, mikrokonidia 6.38-10.58 x 1.83-3.05µm
Batang
Fusarium sp. 3
(ClI2)
konidiofor hialin, ramping, dan sederhana, konidium
hialin, makrokonidia, beberapa sekat, sedikit
melengkung, 1-2 sekat, mikrokonidia sekat tunggal,
oval, ukuran makrokonidia 9.22-18.31 x 2.05-2.74
µm, mikrokonidia 3.61-5.53 x 1.14-2.29 µm
infloresen
Fusarium sp. 4
(ClR2)
konidiofor hialin, ramping, dan sederhana, konidium
hialin, makrokonidia, beberapa sekat, sedikit
melengkung, 1-2 sekat, mikrokonidia sekat tunggal,
oval, ukuran makrokonidia 10.12-21.21 x 2.25-3.44
µm, mikrokonidia 6.12-14.02 x 1.76-3.07 µm
rimpang
Fusarium sp. 5
(ClR3)
konidiofor hialin, ramping, dan sederhana, konidium
hialin, makrokonidia, beberapa sekat, sedikit
melengkung, 1-2 sekat, mikrokonidia sekat tunggal,
oval, ukuran makrokonidia 11.13-22.22 x 2.35-3.55
µm, mikrokonidia 4.19-7.75 x 1.93-2.42 µm
rimpang
Fusarium sp. 6
(ClR4)
konidiofor hialin, ramping, dan sederhana, konidium
hialin, makrokonidia, beberapa sekat, sedikit
melengkung, 1-2 sekat, mikrokonidia sekat tunggal,
oval, ukuran makrokonidia 29.12-29.44 x 4.61-4.77
µm, mikrokonidia 13.34-16.96 x 3.95-4.28 µm
rimpang
Miselium sterilia 1
(ClBn3)
Konidium tidak teramati bunga
Miselium sterilia 2
(ClR1)
Gambar 3 Keragaman morfologi koloni cendawan endofit tanaman kunyit umur 14 hari pada media PDA: ClD1 (a), ClBn2 (b), ClBn3 (c), ClI1 (d), ClBt1 (e), ClI2 (f), ClR1 (g), ClR2 (h), ClR3 (i), ClR4 (j), ClA3 (k)
a
3 cm
3 cm 3 cm
3 cm 3 cm 3 cm
3 cm
3 cm
3cm
3 cm 3 cm
b
c
d
e
f
g
h
i
Gambar 4 Keragaman struktur mikroskopi morfologi koloni cendawan endofit tanaman kunyit dengan perbesaran 1000x: ClD1 (a), ClBn2 (b), ClBn3 (c), ClI1 (d), ClBt1 (e), ClI2 (f), ClR1 (g), ClR2 (h), ClR3 (i), ClR4 (j), ClA3 (k). Hifa (1); konidiofor (2); konidium/mikrokonidia (3); makrokonidia (4)
1
50 µm 50 µm 50 µm
50 µm 50 µm 50 µm
50 µm 50 µm 50 µm
50 µm 50 µm
2
3
1
2 3
1
1 2
3
1
2
3 4
1 2 3
4
1
1 2
3
1
2 3
1 2
3
1
2
3
a
b
c
d
e
f
g
h
i
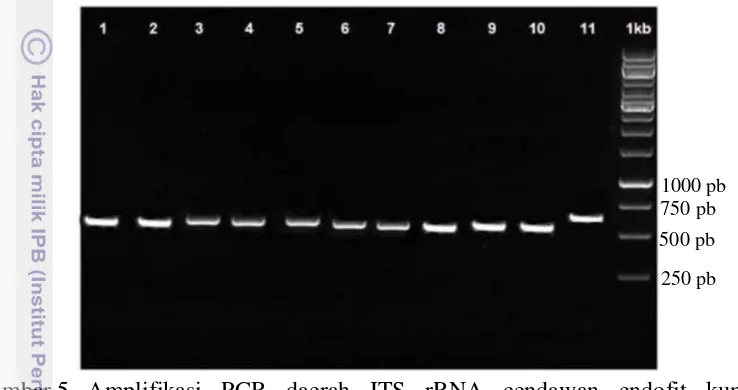
Terbentuknya pita tunggal pada hasil elektroforesis produk PCR DNA cendawan endofit menunjukkan bahwa proses isolasi DNA cendawan endofit berhasil dilakukan pada kesebelas isolat cendawan endofit asal tanaman kunyit (Gambar 5). Kesebelas pita tunggal yang terbentuk berada pada kisaran pasang basa yang hampir mirip. Selain itu, jika disejajarkan dengan DNA marker 1Kb maka letak pita tunggal kesebelas isolat cendawan endofit berada di antara 500 dan 750 pb.
Gambar 5 Amplifikasi PCR daerah ITS rRNA cendawan endofit kunyit menggunakan primer ITS1 dan ITS4: Marker 1 Kb, sumur ke-1 s/d 11 yaitu ClA3, ClBn2, ClBn3, ClBt1, ClD1, ClI1, ClI2, ClR1, ClR2, ClR3, ClR4
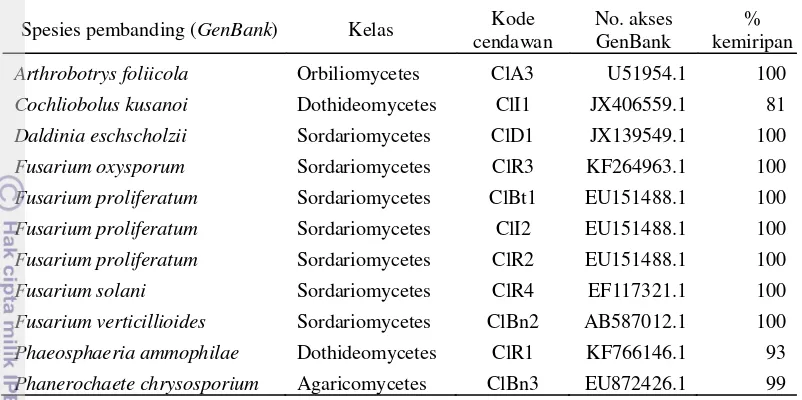
Berdasarkan hasil analisis blast, kesamaan isolat cendawan endofit dengan spesies yang ada di MycoBank dan GenBank bervariasi mulai dari 81 sampai dengan 100% yang diidentifikasi ke dalam 9 spesies (Tabel 2). Delapan isolat cendawan endofit yang didapatkan dari hasil isolasi pada penelitian ini memiliki kemiripan sekuen sebesar 100% dengan sekuen spesies pembanding di GenBank. Kedelapan isolat tersebut yaitu isolat ClA3 yang memiliki kemiripan dengan Arthrobotrys foliicola, isolat ClD1 dengan Daldinia eschscholzii, isolat ClR3 dengan Fusarium oxysporum, isolat ClBt1, ClI2, dan ClR2 yang ketiganya memiliki kemiripan dengan Fusarium proliferatum, isolat ClR4 dengan Fusarium solani, dan isolat ClBn2 dengan Fusarium verticillioides. Isolat yang lain yaitu isolat ClBn3 memiliki kemiripan sekuen sebesar 99% dengan Phanerochaete chrysosporium. Sedangkan dua isolat memiliki kemiripan sekuen dibawah 95% dengan sekuen spesies pembanding yaitu isolat ClR1 dengan kemiripan sekuen sebesar 93% dengan Phaeosphaeria ammophilae dan isolat ClI1 dengan kemiripan sekuen sebesar 81% dengan Cochliobolus kusanoi.
1000 pb 750 pb 500 pb
Tabel 2 Cendawan endofit asal tanaman kunyit (Curcuma longa) berdasarkan identifikasi molekuler menggunakan daerah ITS
Spesies pembanding (GenBank) Kelas Kode cendawan
No. akses GenBank
% kemiripan
Arthrobotrys foliicola Orbiliomycetes ClA3 U51954.1 100
Cochliobolus kusanoi Dothideomycetes ClI1 JX406559.1 81
Daldinia eschscholzii Sordariomycetes ClD1 JX139549.1 100
Fusarium oxysporum Sordariomycetes ClR3 KF264963.1 100
Fusarium proliferatum Sordariomycetes ClBt1 EU151488.1 100
Fusarium proliferatum Sordariomycetes ClI2 EU151488.1 100
Fusarium proliferatum Sordariomycetes ClR2 EU151488.1 100
Fusarium solani Sordariomycetes ClR4 EF117321.1 100
Fusarium verticillioides Sordariomycetes ClBn2 AB587012.1 100
Phaeosphaeria ammophilae Dothideomycetes ClR1 KF766146.1 93
Phanerochaete chrysosporium Agaricomycetes ClBn3 EU872426.1 99
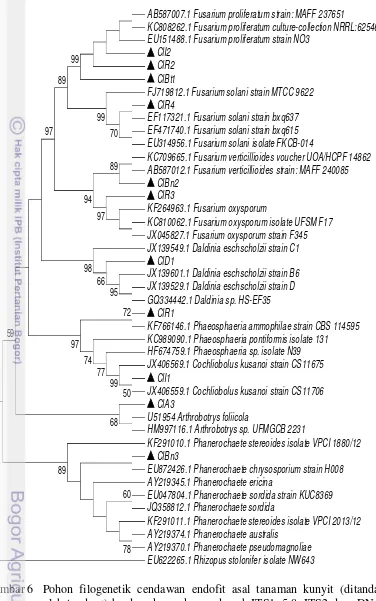
Data analisis konstruksi pohon filogenetik menunjukkan bahwa kesebelas isolat cendawan endofit yang diperoleh dari hasil isolasi didominasi oleh isolat yang berkerabat dengan Fusarium dengan Rhizopus stolonifer isolat NNW643 digunakan sebagai outgroup (Gambar 6). Terdapat 3 isolat yang teridentifikasi sebagai spesies yang sama karena memiliki kemiripan sekuen dengan spesies pembanding Fusarium proliferatum. Ketiga isolat tersebut yaitu ClI2, ClR2, dan ClBt1. Isolat ClI2 menunjukkan hubungan kekerabatan yang lebih dekat dengan Fusarium proliferatum dibandingkan dengan dua isolat yang lain pada konstruksi pohon filogenetik yang dibuat. Isolat ClR4 memiliki hubungan kekerabatan yang dekat dengan Fusarium solani strain bxq637, sedangkan isolat ClR3 memiliki hubungan kekerabatan yang dekat dengan Fusarium oxysporum. Isolat ClBn2 dan isolat ClD1 masing-masing memiliki hubungan kekerabatan dengan Fusarium verticillioides dan Daldinia eschscholzii. Isolat ClA3 dan ClI1 memiliki hubungan kekerabatan yang lebih dekat masing-masing dengan Arthrobotrys foliicola dan Cochliobolus kusanoi strain Cs11675. Dua isolat yang pada pengamatan mikroskopis hanya teramati sebagai miselium sterilia yaitu ClR1 dan ClBn3 masing-masing memiliki hubungan kekerabatan yang lebih dekat dengan Phaeosphaeria ammophilae strain CBS 114595 dan Phanerochaete chrysosporium strain H008.
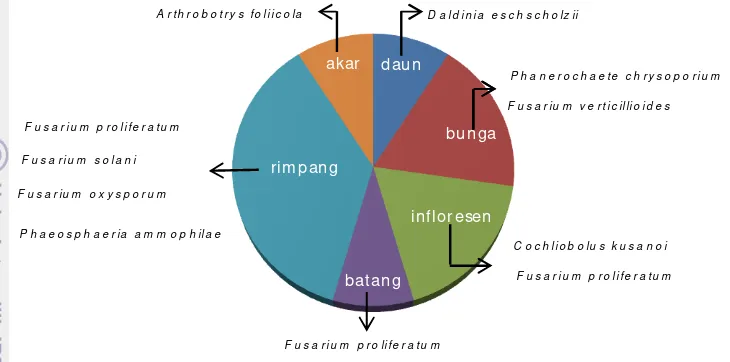
Keberadaan cendawan endofit ditemukan pada seluruh organ tanaman kunyit. Persebaran cendawan endofit asal tanaman kunyit didominasi oleh Fusarium. Genus ini ditemukan pada organ bunga, infloresen, batang dan rimpang. Selain itu, genus Fusarium juga memiliki anggota yang paling banyak dibandingkan dengan genus lain yaitu terdiri atas F. oxysporum, F. proliferatum, F. solani, dan F. verticillioides. Genus lainnya yaitu A. foliicola ditemukan pada organ akar, D. eschscholzii pada organ daun, C. kusanoi pada organ infloresen, P. chrysosporium pada organ bunga, dan P. ammophilae pada organ rimpang. (Gambar 7).
Gambar 6 Pohon filogenetik cendawan endofit asal tanaman kunyit (ditandai oleh tanda ) berdasarkan sekuens daerah ITS1, 5.8, ITS2 dan rDNA dengan metode Neighbor Joining dengan model Tamura 3-parameter. Nilai bootstrap yang ditunjukkan pada percabangan didapatkan dari 1000 kali pengulangan. Isolat Rhizopus stolonifer NW643 (EU622265.1) digunakan sebagai outgroup
AB587007.1 Fusarium proliferatum strain: MAFF 237651
KC808262.1 Fusarium proliferatum culture-collection NRRL:62546 EU151488.1 Fusarium proliferatum strain NO3
ClI2 ClR2 ClBt1
FJ719812.1 Fusarium solani strain MTCC 9622 ClR4
EF117321.1 Fusarium solani strain bxq637 EF471740.1 Fusarium solani strain bxq615 EU314956.1 Fusarium solani isolate FKCB-014
KC709665.1 Fusarium verticillioides voucher UOA/HCPF 14862 AB587012.1 Fusarium verticillioides strain: MAFF 240085
ClBn2 ClR3
KF264963.1 Fusarium oxysporum
KC810062.1 Fusarium oxysporum isolate UFSM F17 JX045827.1 Fusarium oxysporum strain F345 JX139549.1 Daldinia eschscholzii strain C1
ClD1
JX139601.1 Daldinia eschscholzii strain B6 JX139529.1 Daldinia eschscholzii strain D GQ334442.1 Daldinia sp. HS-EF35
ClR1
KF766146.1 Phaeosphaeria ammophilae strain CBS 114595 KC989090.1 Phaeosphaeria pontiformis isolate 131 HF674759.1 Phaeosphaeria sp. isolate N39 JX406569.1 Cochliobolus kusanoi strain CS11675
ClI1
JX406559.1 Cochliobolus kusanoi strain CS11706 ClA3
U51954 Arthrobotrys foliicola
HM997116.1 Arthrobotrys sp. UFMGCB 2231
KF291010.1 Phanerochaete stereoides isolate VPCI 1880/12 ClBn3
EU872426.1 Phanerochaete chrysosporium strain H008 AY219345.1 Phanerochaete ericina
EU047804.1 Phanerochaete sordida strain KUC8369 JQ358812.1 Phanerochaete sordida
KF291011.1 Phanerochaete stereoides isolate VPCI 2013/12 AY219374.1 Phanerochaete australis
[image:30.595.99.475.85.686.2]Gambar 7 Sebaran cendawan endofit pada setiap organ tanaman kunyit
Uji Penghambatan Pertumbuhan Bakteri Penghasil Histamin
Uji antimikrob dari cendawan endofit menggunakan teknik dual culture terhadap M. morganii FNCC 0122 menunjukkan bahwa lima dari sebelas isolat
yaitu A. foliicola (ClA3), C. kusanoi (ClI1), F. proliferatum (ClBt1), F. verticillioides (ClBn2), dan P. ammophilae (ClR1) memiliki kemampuan untuk
menghambat pertumbuhan bakteri penghasil histamin yang ditandai dengan terbentuknya zona bening di sekitar potongan isolat cendawan endofit (Tabel 3). Kelima isolat tersebut masing-masing diisolasi dari akar, rimpang, bunga, infloresen, dan batang.
Hasil yang didapatkan menunjukkan bahwa hampir seluruh organ tanaman kunyit, kecuali daun, mengandung cendawan endofit yang mampu menekan pertumbuhan bakteri uji. Hal ini menunjukkan bahwa kemampuan cendawan endofit untuk mengontrol M. morganii FNCC 0122 tidak bergantung pada jenis organ sebagai sumber isolasi cendawan. Lebih lanjut, terdapat spesies cendawan endofit yang sama yang berasal dari organ yang berbeda dari tanaman kunyit mempunyai kemampuan yang berbeda pada uji aktivitas antibakteri. Hal ini dapat dilihat pada isolat F. proliferatum ClBt1 yang berasal dari organ batang mempunyai kemampuan aktivitas antibakteri, sedangkan isolat F. proliferatum ClI2 yang berasal dari organ infloresen tidak mempunyai aktivitas antibakteri meskipun kedua isolat ini berhasil diidentifikasi sebagai spesies cendawan yang sama yaitu F. proliferatum.
daun
bunga
inf lor esen
bat ang rim pang
akar
Sebaran cendaw an endofit menurut asal organ tanaman kunyit
D a l d i n i a e s c h s c h o lz i i
P h a n e r o c h a e t e c h r y s o p o r iu m
F u s a r i u m v e r t i c il li o id e s
C o c h l i o b o l u s k u s a n o i
F u s a r i u m p r o li f e r a t u m
F u s a r i u m p r o li f e r a t u m A r t h r o b o t r y s f o l ii c o la
F u s a r i u m p r o li f e r a t u m
F u s a r i u m s o l a n i
F u s a r i u m o x y s p o r u m
Tabel 3 Diameter zona hambat (mm) fraksi air cendawan endofit terhadap Morganella morganii FNCC 0122 menggunakan metode dual culture setelah inkubasi 24 jam
Cendawan endofit Kode isolat organ Diameter zona
hambat (mm)
Arthrobotrys foliicola ClA3 akar 15
Cochliobolus kusanoi ClI1 infloresen 7
Daldinia eschscholzii ClD1 daun 0
Fusarium oxysporum ClR3 rimpang 0
F. proliferatum ClBt1 batang 10
F. proliferatum ClI2 infloresen 0
F. proliferatum ClR2 rimpang 0
F. solani ClR4 rimpang 0
F. verticillioides ClBn2 bunga 17
Phanerochaete chrysosporium ClBn3 bunga 0
Phaeosphaeria ammophilae ClR1 rimpang 9
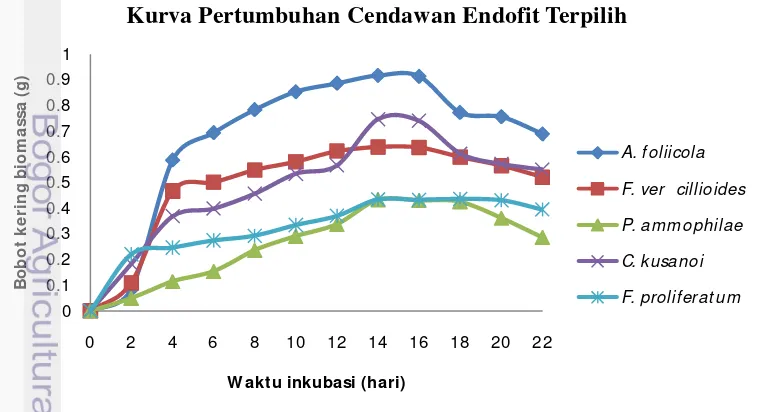
[image:32.595.106.464.128.278.2]Data kurva pertumbuhan cendawan endofit terpilih pada media fermentasi PDB bertujuan untuk mengetahui fase stasioner yang terbentuk guna mendapatkan metabolit sekunder pada ekstraksi. Kurva pertumbuhan yang dibuat menunjukkan bahwa selama 22 hari fermentasi, cendawan endofit mengalami beberapa fase pertumbuhan. Fase pertumbuhan awal terjadi pada hari ke-0 sampai ke-2, fase ini dinamakan fase lag atau fase penyesuaian. Fase selanjutnya ialah fase pertumbuhan optimal atau fase logaritmik yang ditandai oleh pertumbuhan cendawan endofit yang terus meningkat seiring waktu fermentasi, fase ini terjadi pada hari ke-2 sampai ke-14. Fase stasioner ditandai oleh pertumbuhan yang cenderung tetap yang terjadi pada hari ke-14 sampai ke-16. Fase terakhir yaitu fase kematian yang ditunjukkan pada hari ke-16 sampai akhir fermentasi pada hari ke-22, fase ini ditandai oleh kurva yang menurun seiring bertambahnya waktu fermentasi (Gambar 8).
Gambar 8 Kurva pertumbuhan cendawan endofit terpilih asal tanaman kunyit pada media PDB inkubasi pada suhu kamar
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
0 2 4 6 8 10 12 14 16 18 20 22
B o b o t k e ri n g b io m a s sa ( g )
W akt u inkubasi (hari)
Kurva Pertumbuhan Cendawan Endofit Terpilih
A. foliicola
F. ver cillioides
P. am m ophilae
C. kusanoi
[image:32.595.94.477.519.725.2]Tabel 4 Diameter zona hambat (mm) fraksi air cendawan endofit terhadap Morganella morganii FNCC 0122 menggunakan metode difusi cakram kertas setelah inkubasi 24 jam
Isolat
Diameter zona hambat (mm)
10 000 ppm
20 000 ppm
40 000
ppm Air
steril
kloramfenikol 32 ppm
F B F B F B
Arthrobotrys foliicola 6.5 0 7.7 0 8 0 0
12.3
Cochliobolus kusanoi 0 0 0 0 0 0 0
Fusarium proliferatum 0 0 0 0 0 0 0
F. verticillioides 7 0 8.3 0 9.3 0 0
Phaeosphaeria ammophilae 0 0 0 0 0 0 0 filtrat (F), biomassa (B)
Uji antibakteri dengan metode difusi cakram kertas dari hasil fermentasi cair isolat cendawan endofit terpilih umur 15 hari menunjukkan bahwa hanya dua fraksi air filtrat dari A. foliicola dan F. verticillioides yang memberikan hasil yang positif terhadap bakteri uji M. morganii yang ditunjukkan oleh terbentuknya zona bening di sekitar cakram kertas. Hasil positif ini tidak didapatkan pada ekstrak air dari biomassa pada seluruh isolat cendawan endofit terpilih (Tabel 4). Isolat cendawan edofit terpilih yang lain tidak menunjukkan adanya kemampuan antibakteri pada fase ekstrak air, meskipun sebelumnya memiliki kemampuan antibakteri pada uji dengan metode dual culture. Pemilihan fraksi air didasarkan pada ketersediaan fraksi etil asetat yang sangat sedikit dan tidak mencukupi untuk uji selanjutnya. Meskipun fraksi etil asetat menunjukkan hasil yang lebih baik dalam menghambat pertumbuhan mikrob uji dibandingkan dengan fraksi air, namun mengingat keterbatasan penggunaan fraksi etil asetat dalam uji selanjutnya, maka fraksi etil asetat tidak digunakan pada penelitian ini.
Senyawa metabolit sekunder yang didapatkan dari fraksi air cendawan endofit tidak dipengaruhi oleh jenis organ tanaman kunyit sebagai inang cendawan. Kedua isolat yang positif yaitu A. foliicola merupakan cendawan endofit yang diisolasi dari organ akar sedangkan F. verticillioides diisolasi dari organ bunga. Lebih lanjut, fraksi air dari F. verticillioides memiliki aktivitas yang lebih tinggi dibandingkan dengan A. foliicola dalam menghambat pertumbuhan bakteri M. morganii (Tabel 4). Dikarenakan hanya fraksi air dari filtrat saja yang memiliki hasil yang positif dalam menghambat pertumbuhan bakteri uji dibandingkan dengan ekstrak air biomassa, maka dapat dikatakan bahwa metabolit sekunder yang dihasilkan oleh cendawan endofit dalam penelitian ini bersifat ekstraseluler.
Uji Penghambatan Pembentukan Histamin pada Ikan Segar
fraksi air filtrat A. foliicola dan F. verticillioides dan penyimpanan pada variasi suhu selama 24 jam menunjukkan pola yang sama dengan kontrol. Peningkatan populasi bakteri penghasil histamin sejalan dengan peningkatan suhu penyimpanan. Akan tetapi, terdapat perbedaan antara kedua perlakuan perendaman dengan kontrol.
Perlakuan perendaman dalam fraksi air filtrat F. verticillioides menunjukkan bahwa tidak terdapat perbedaan peningkatan populasi bakteri penghasil histamin yang signifikan pada suhu penyimpanan 0 °C dan 4 °C. Populasi bakteri penghasil histamin mulai signifikan pada suhu penyimpanan 29 °C. Kenaikan populasi bakteri penghasil histamin pada perendaman dalam fraksi air filtrat F. verticillioides meningkat hampir satu setengah kali lipat pada suhu 29 °C dibandingkan dengan pada suhu 0 °C. Pada perlakuan perendaman dalam fraksi air filtrat A. foliicola terjadi peningkatan populasi bakteri penghasil histamin pada suhu 29 °C hampir dua kali lipat dibandingkan dengan pada suhu penyimpanan 0 °C. Sedangkan pada kontrol, peningkatan populasi bakteri penghasil histamin mengalami kenaikan yang signifikan mulai suhu penyimpanan 4 °C dan berlanjut pada suhu penyimpanan 29 °C (Tabel 5).
Pada suhu penyimpanan yang sama, populasi bakteri penghasil histamin pada perlakuan perendaman fraksi air filtrat dari kedua cendawan endofit secara umum lebih rendah dari kontrol. Pada suhu penyimpanan 0 °C, populasi bakteri penghasil histamin antara kedua fraksi air filtrat cendawan endofit dan kontrol tidak terdapat perbedaan yang signifikan, akan tetapi pada kontrol memiliki populasi bakteri penghasil histamin yang paling tinggi. Pada suhu penyimpanan 4 °C, populasi bakteri penghasil histamin pada kedua fraksi air filtrat cendawan endofit berbeda signifikan dengan kontrol. Sedangkan pada suhu penyimpanan 29 °C, populasi bakteri penghasil histamin tidak terdapat perbedaan yang signifikan antara perlakuan perendaman dalam fraksi air filtrat A. foliicola dengan kontrol. Namun keduanya berbeda signifikan dengan perlakuan perendaman dalam fraksi air filtrat F. verticillioides (Tabel 5).
Lebih lanjut, interaksi antara perlakuan perendaman dan suhu penyimpanan secara signifikan berdampak pada populasi bakteri penghasil histamin pada ikan tongkol segar (Tabel 5). Interaksi antara perendaman dalam fraksi air filtrat F. verticillioides pada suhu penyimpanan 0 °C menunjukkan populasi bakteri penghasil histamin yang terendah yaitu dengan nilai log TPC 2.00 (1.102 cfu/g), namun demikian data tersebut tidak berbeda nyata dengan perlakuan pada suhu penyimpanan 0 °C dan 4 °C kecuali pada perlakuan kontrol pada suhu 4 °C. Tabel 5 Nilai log TPC bakteri penghasil histamin dari filet ikan tongkol setelah
kombinasi perlakuan (hubungan antara perlakuan perendaman dengan suhu penyimpanan) setelah inkubasi 24 jam
Perlakuan perendaman Nilai log TPC bakteri penghasil histamin
0 ºC 4 ºC 29 ºC
Arthrobotrys foliicola 2.11a 2.20a 3.90d
Fusarium verticillioides 2.00a 2.18a 3.11c
Kontrol 2.15a 2.78b 4.00d
a
Penghambatan pembentukan histamin pada daging ikan tongkol segar menggunakan fraksi air filtrat cendawan endofit A. foliicola dan F. verticillioides menunjukkan bahwa kedua fraksi tersebut mampu menghambat pembentukan histamin pada ikan tongkol segar (Tabel 6). Penghambatan pembentukan histamin pada ikan tongkol segar memiliki pola yang sama dengan penghambatan pertumbuhan bakteri penghasil histamin. Semakin tinggi populasi bakteri penghasil histamin, semakin tinggi pula kadar histamin yang terbentuk. Perlakuan perendaman dalam fraksi air filtrat F. verticillioides menunjukkan bahwa terdapat perbedaan kenaikan kadar histamin yang signifikan pada suhu penyimpanan 0, 4, dan 29 °C. Pola ini juga terjadi pada perendaman dalam fraksi air filtrat A. foliicola dan kontrol. Peningkatan kadar histamin yang terbentuk pada suhu penyimpanan 4 °C hampir tiga kali lipat dibandingkan dengan suhu penyimpanan 0 °C baik pada perlakuan maupun kontrol. Peningkatan kadar histamin yang drastis baik pada perlakuan maupun kontrol terjadi pada suhu penyimpanan 29 °C. Kadar histamin yang terukur pada suhu tersebut lebih dari dua puluh lima kali dibanding pada suhu penyimpanan 0 °C dan lebih dari sepuluh kali pada suhu penyimpanan 4 °C (Tabel 6).
Pada suhu penyimpanan yang sama, kadar histamin pada perlakuan perendaman fraksi air filtrat dari kedua cendawan endofit secara umum lebih rendah dibandingkan dengan kontrol. Pada suhu penyimpanan 0 °C, kadar histamin pada kedua perlakuan perendaman dan kontrol berbeda signifikan dengan kontrol memiliki kadar tertinggi. Pola ini juga terlihat pada suhu penyimpanan 4 dan 29 °C. Pada masing-masing suhu penyimpanan, perlakuan perendaman dalam fraksi air filtrat F. verticillioides memiliki kadar histamin terendah (Tabel 6). Lebih lanjut, interaksi antara suhu penyimpanan dengan perlakuan perendaman menunjukkan pengaruh yang signifikan terhadap pembentukan histamin pada ikan tongkol segar. Interaksi antara perendaman dalam fraksi air filtrat F. verticillioides dengan suhu penyimpanan 0 °C menghasilkan kadar histamin terendah yaitu sebesar 3.12 ppm (Tabel 6).
Tabel 6 Kadar histamin (ppm) filet ikan tongkol setelah kombinasi perlakuan (hubungan antara perlakuan perendaman dengan suhu penyimpanan) setelah inkubasi 24 jam
Perlakuan perendaman Kadar histamin (ppm)
0 ºC 4 ºC 29 ºC
Arthrobotrys foliicola 3.22b 8.31e 124.71h
Fusarium verticillioides 3.12a 7.98d 83.20g
Kontrol 3.30c 8.68f 149.73i
a
Angka yang berada pada setiap baris dan kolom yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf 0.05 (uji nilai berganda Duncan).
antara fraksi air filtrat cendawan endofit A. foliicola dengan F. verticillioides (Tabel 7).
Tabel 7 Uji penapisan fitokimia fraksi air filtrat cendawan endofit terpilih
Senyawa fitokimia Arthrobotrys foliicola Fusarium verticillioides
Alkaloid - -
Flavonoid + +
Kuinon - -
Kumarin - -
Saponin + +
Steroid/triterpenoid + +
Tanin - -
(+): terdeteksi; (-): tidak terdeteksi
PEMBAHASAN
Keragaman dan Distribusi Cendawan Endofit pada Tanaman Kunyit
Pita tunggal yang terbentuk pada hasil elektroforesis produk PCR kesebelas isolat cendawan endofit menggunakan primer ITS1 dan ITS4 berada pada kisaran antara 500 sampai 750 pb jika disejajarkan dengan marker 1 Kb. Meskipun daerah ITS pada cendawan sangat bervariasi, namun secara rata-rata panjang daerah ITS cendawan berkisar antara 450 sampai 750 pasang basa (Blaalid et al. 2013). Penggunaan primer ITS1 dan ITS4 bertujuan untuk mengamplifikasi daerah ITS1, 5.8S, dan ITS2 pada DNA cendawan. Primer ITS merupakan primer yang umum digunakan untuk analisis molekuler pada cendawan (White et al. 1990). Selain itu, penggunaan primer ITS juga mempunyai keuntungan diantaranya ialah lebih efisien dalam amplifikasi dan lebih mudah dalam proses sekuensing (Alvarez dan Wendel 2003). Amplifikasi daerah ITS1, 5.8S, dan ITS2 menggunakan primer ITS dapat digunakan untuk identifikasi cendawan secara umum hingga tingkat spesies (Nilsson et al. 2008). Oleh karena itu analisis molekuler cendawan dengan menggunakan daerah ITS dapat digunakan untuk analisis keragaman cendawan hingga tingkat spesies.
pb (Passarini et al. 2013). Isolat ClR3 yang teridentifikasi sebagai F. oxysporum memiliki amplikon yang masuk dalam kisaran amplikon daerah ITS1, 5.8s, dan ITS2 F. oxysporum yang diisolasi dari akar tanaman jambu asal India yaitu sebesar 570 pb (Mishra et al. 2013). Isolat ClBt1, ClI2, dan ClR2 yang ketiganya teridentifikasi sebagai F. proliferatum memiliki ukuran amplikon yang sama dengan penelitian Quazi et al. (2013) yang melaporkan bahwa F. proliferatum yang diidentifikasi daerah ITS1, 5.8s, dan ITS2 menggunakan primer ITS 1 dan 4 mempunyai amplikon yang berukuran sekitar 550 pb. Isolat ClR4 yang teridentifikasi sebagai F. solani memiliki amplikon yang masih dalam kisaran yang sama dengan beberapa F. solani pada penelitian Alymanesh et al. (2009) yang memiliki ukuran berkisar antara 580 sampai 625 pb. Isolat ClBn2 yang teridentifikasi sebagai F. verticillioides memiliki amplikon yang mirip dengan cendawan F. verticillioides penghasil fumonisin yang berukuran sekitar 540 pb (Ghazvini et al. 2011). Isolat ClBn3 yang teridentifikasi sebagai P. chrysosporium memiliki amplikon dengan ukuran yang masih di dalam rentang ukuran amplikon P. chrysosporium pada penelitian yang dilakukan oleh De Koker et al. (2003) yaitu sekitar 600 pb. Isolat ClR1 yang teridentifikasi sebagai P. ammophilae memiliki ukuran amplikon yang masih masuk dalam kisaran sekuens daerah ITS1, 5.8s, dan ITS2 beberapa Phaosphaeria yaitu antara 468 sampai 533 pb (Camara et al. 2002).
Penelitian tentang keragaman cendawan endofit asal seluruh bagian tanaman Zingiberaceae di Indonesia juga telah dilakukan oleh Ginting et al. (2013) yang melakukan penelitian pada tanaman jahe merah. Pada penelitian cendawan endofit asal jahe merah, ditemukan 30 isolat dari seluruh organ tanaman, sedangkan pada penelitian ini berhasil didapatkan 11 isolat cendawan endofit dari seluruh bagian tanaman kunyit. Sebelas isolat yang didapatkan pada penelitian ini masuk ke dalam cendawan bermitospora yang didominasi oleh genus Fusarium. Hasil penelitian ini didukung oleh data yang dilaporkan oleh Xu et al. (2007) yang menemukan bahwa Fusarium merupakan genus yang paling sering ditemukan sebagai cendawan endofit pada organ rimpang tanaman obat dari Tiongkok Dioscorea zingiberensis.
cendawan endofit dengan similaritas 99% dengan pembanding di GenBank (Paul et al. 2006). Dalam penelitian ini, isolat ClD1 memiliki similaritas 100% dengan Daldinia eschscholzii. Sawmya et al. (2013) melaporkan bahwa Daldinia eschscholzii merupakan cendawan endofit yang diisolasi dari organ daun tanaman anggrek Pholidota pallid dengan similaritas 100%.
Isolat cendawan endofit ClA3 memiliki similaritas sebesar 100% dengan Arthrobotrys foliicola. Vieira et al. (2012) melaporkan bahwa cendawan endofit A. foliicola dengan similaritas 98% terhadap spesies pembanding di GenBank telah berhasil diisolasi dari organ daun tanaman Solanum cernuum. Cendawan ini umumnya merupakan cendawan yang masuk ke dalam golongan cendawan pemangsa nematoda (nematophagous fungi) yang biasa ditemukan di organ tanaman yang berada atau dekat dengan tanah, misalnya akar (Lopez-Llorca et al. 2006). Pada penelitian ini, didapatkannya cendawan pemangsa nematoda pada hasil isolasi cendawan endofit diduga karena cendawan ini telah masuk ke dalam jaringan tanaman hanya untuk mengendalikan nematoda yang masuk ke dalam jaringan tanaman tanpa menyerang organ tanamannya. Oleh karena itu, cendawan ini muncul saat isolasi cendawan endofit dari akar tanaman kunyit.
Cendawan endofit lainnya yang berhasil diisolasi dari tanaman kunyit ialah Cochliobolus kusanoi, Phanerochaete chrysosporium, dan Phaeosphaeria ammophilae. Isolat ClI1 memiliki similaritas 81% dengan C. kusanoi. Cendawan C. kusanoi juga berhasil diisolasi sebagai cendawan endofit dari organ daun tanaman mentimun Cucumis sativus dengan similaritas 99% terhadap spesies pembanding di GenBank (Bael et al. 2012). Isolat ClBn3 memiliki similaritas 99% dengan P. chrysosporium. Brum et al. (2012) melaporkan bahwa Phanerochaete dengan similaritas 99% terhadap spesies pembanding di GenBank yang diisolasi dari organ daun tanaman Vitis labrusca merupakan cendawan endofit. Isolat cendawan endofit lainnya ialah ClR1 yang memiliki similaritas 93% dengan P. ammophilae. Beberapa penelitian sebelumnya telah melaporkan genus Phaeosphaeria sebagai cendawan endofit. Salah satu diantaranya ialah cendawan Phaeosphaeria dennisiana yang dilaporkan sebagai cendawan endofit dengan similaritas 98% yang diisolasi dari tanaman Deschampsia antarctica (Rosa et al. 2009).
Uji Penghambatan Pertumbuhan Bakteri Penghasil Histamin
batang, rimpang, infloresen, dan bunga. Lebih lanjut, tidak semua isolat yang didapatkan dari organ rimpang dapat menghambat pertumbuhan bakteri M. morganii. Rimpang tanaman kunyit merupakan bagian yang umum digunakan sebagai obat, bumbu masakan, pengawet, dan bahan antimikrob dibandingkan dengan bagian tanaman lainnya. Akar, infloresen, dan bu