KINERJA ELEKTRODE PASTA KARBON TERMODIFIKASI
NANOMAGNETIT PADA TEKNIK VOLTAMETRI SIKLIK
ESTY OCTIANA SARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Kinerja Elektrode Pasta Karbon Termodifikasi Nanomagnetit pada Teknik Voltametri Siklik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
iii
ABSTRAK
ESTY OCTIANA SARI. Kinerja Elektrode Pasta Karbon Termodifikasi Nanomagnetit pada Teknik Voltametri Siklik. Dibimbing oleh DEDEN SAPRUDIN dan ZULHAN ARIF.
Kinerja elektrode pasta karbon (EPK) termodifikasi nanomagnetit dipengaruhi oleh sifat nanomagnetit. Penelitian ini menentukan kinerja EPK yang dimodifikasi dengan nanomagnetit hasil sintesis secara hidrotermal dari bahan FeCl3, urea, dan natrium sitrat pada suhu 200 ºC selama 3 jam. Kinerja elektrode
ditentukan dengan teknik voltametri siklik menggunakan analit iodida dalam elektrolit pendukung KCl pada daerah pemayaran 0.0–1.2 V. Analisis voltametri memberikan 2 pasang puncak redoks yang bersifat kuasireversibel. Nanomagnetit mampu meningkatkan respons arus puncak oksidasi iodida sebesar 1.4 kali lipat dibandingkan dengan EPK. Sensitivitas elektrode 16.04 µA/mM, limit deteksi 0.0462 mM, dan limit kuantitasi 0.154 mM. Selektivitas elektrode tetap baik hingga penambahan 10 kali lipat ion pengganggu. Demikian pula linearitas hubungan konsentrasi iodida dengan arus puncak anodik cukup baik. Namun, elektrode mengalami penurunan respons arus 7.32 µA setelah disimpan selama 1 bulan. Secara keseluruhan, kinerja elektrode belum sebaik kinerja EPK termodifikasi nanomagnetit yang disintesis selama 12 jam.
Kata kunci: elektrode, hidrotermal, iodida, nanomagnetit, voltametri
ABSTRACT
ESTY OCTIANA SARI. The Performance of Nanomagnetite-Modified Carbon Paste Electrode in Cyclic Voltammetry Technique. Supervised by DEDEN SAPRUDIN and ZULHAN ARIF.
The performance of nanomagnetite-modified carbon paste electrodes (CPE) are influenced by the characteristics of nanomagnetite. This study determined the performance of a CPE modified with nanomagnetite synthesized by hydrothermal technique from FeCl3, urea, and sodium citrate at 200 °C for 3 hours. The
electrode performance was determined by cyclic voltammetry technique by using iodide as analyte in KCl as supporting electrolyte at potential range of 0.0 to 1.2 V. Voltammetric analysis provided two pairs of oxidation and reduction peaks, both of them quasireversible. Nanomagnetite improved the response of iodide oxidation peak current 1.4 fold compared with the unmodified CPE. The electrode sensitivity was 16.04 mA/mM, the detection limit was 0.0462 mM, and the quantitation limit was 0.154 mM. The electrode selectivity was still good until 10-times addition of interference ion. The linearity of correlation of iodide concentration with oxidation peak current was good as well. However the electrode current response decreased after being stored for a month. Overall, the electrode performances were not as good as CPE modified with nanomagnetite synthesized for 12 hours previously reported.
v
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
KINERJA ELEKTRODE PASTA KARBON TERMODIFIKASI
NANOMAGNETIT PADA TEKNIK VOLTAMETRI SIKLIK
ESTY OCTIANA SARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kinerja Elektrode Pasta Karbon Termodifikasi Nanomagnetit pada Teknik Voltametri Siklik
Nama : Esty Octiana Sari NIM : G44104003
Disetujui oleh
Dr Deden Saprudin, MSi Pembimbing I
Zulhan Arif, SSi, MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
ix
PRAKATA
Segala puji bagi Allah atas segala limpahan rahmat dan karunia-Nya yang senantiasa mengalir sehingga penulis dapat menyelesaikan karya ilmiah dengan judul Kinerja Elektrode Pasta Karbon Termodifikasi Nanomagnetit pada Teknik Voltametri Siklik. Penelitian ini dilakukan dari bulan April sampai Desember 2012 di Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor dan Laboratorium Bersama Departemen Kimia Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Dr Deden Saprudin, MSi dan Zulhan Arif, SSi, MSi yang telah memberikan arahan dan bimbingan kepada penulis selama penelitian. Ucapan terima kasih juga diberikan kepada seluruh staf Laboratorium Kimia Analitik (Bapak Eman, Ibu Nunung, dan Bapak Kosasih) yang telah banyak memberikan saran dan bantuan kepada penulis selama penelitian. Terima kasih kepada Bapak Yani (Departemen Fisika) yang telah memberikan bantuan dalam menyediakan beberapa peralatan untuk penelitian. Terima kasih kepada Hanifah Fauziah, SSi, Uun Sundari, SSi, dan Budi Arifin, SSi, MSi yang telah memberikan beberapa saran dalam penelitian ini. Terima kasih penulis ucapkan kepada teman-teman Kimia Alih Jenis angkatan 44 dan teman-teman seperjuangan di Laboratorium Kimia Analitik yang telah memberikan semangat dan dukungan kepada penulis.
Ucapan terima kasih tak terhingga penulis ucapkan kepada Ibu, Ayah (alm), dan adik-adikku tercinta Ade Dwiana Sari dan Dimas Rian Anugerah atas doa, dukungan, dan kasih sayang yang telah diberikan. Penulis juga mengucapkan terima kasih kepada saudari-saudariku dalam barisan dakwah yang senantiasa menguatkan.
Akhir kata, penulis berharap semoga karya ilmiah ini dapat bermanfaat dan memberikan sumbangan bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
BAHAN DAN METODE ... 2
Bahan dan Alat ... 2
Lingkup Penelitian ... 2
Sintesis Nanomagnetit Pencirian dengan XRD Pembuatan Elektrode Pasta Karbon Pengukuran Arus Latar Belakang Elektrolit (KCl) Pengaruh Komposisi Nanomagnetit Pengaruh Kecepatan Payar Pengaruh Komposisi Iodida Penentuan Pengaruh Ion Halogen lain Pengaruh Waktu Penyimpanan HASIL DAN PEMBAHASAN ... 4
Nanomagnetit ... 4
Kinerja Elektrode Pasta Karbon Termodifikasi Nanomagnetit ... 8
SIMPULAN DAN SARAN ... 14
DAFTAR PUSTAKA ... 14
LAMPIRAN ... 17
DAFTAR GAMBAR
1 Bagan alir penelitian 2
2 Kompleks sitrat dengan ion besi(II) (a) dan besi(III) (b) 6 3 Ilustrasi pembentukan nanomagnetit secara hidrotermal 6 4 Serbuk hitam nanomagnetit hasil sintesis berinteraksi dengan magnet 6 5 Citra SEM nanomagnetit hasil sintesis perbesaran 30 000 kali (a) dan 50
000 kali (b) 7
6 Difraktogram nanomagnetit hasil sintesis 3 jam 7 7 Voltamogram siklik KCl 0.1 M diukur dengan EPK (—) dan M3(—) 8 8 Voltamogram siklik KI 1 mM dalam KCl 0.1 M diukur dengan EPK
(— ) dan M3 (—) 9
9 Grafik arus puncak KI 1 mM dalam KCl 0.1M diukur dengan EPK dan M3 9 10 Voltammogram siklik KI 1 mM dalam KCl 0.1 M pada berbagai
komposisi nanomagnetit 10
11 Grafik hubungan komposisi magnetit dengan arus puncak anodik (■)
dan katodik(●) 10
12 Voltamogram KI 1 mM pada berbagai kecepatan payar diukur dengan
M3. 11
13 Kurva hubungan V1/2 dengan arus puncak anodik (■) dan katodik(●) 12 14 Kurva hubungan antara konsentrasi iodida dengan arus puncak anodik
(■) dan katodik (●)
12 15 Voltamogram KI diukur dengan elektrode baru (—) dan elektrode
yang telah disimpan selama 1 bulan (—) 13
DAFTAR LAMPIRAN
1 Reaksi stoikiometri pembentukan nanomagnetit 17
2 Standar magnetit JCPDS No. 19-0629 17
3 Penentuan kristalinitas nanomagnetit 18
PENDAHULUAN
Teknik voltametri siklik lazim digunakan untuk penelitian awal dalam pembuatan sensor. Teknik ini dapat secara cepat memberikan daerah potensial redoks suatu komponen elektroaktif dan dapat mengevaluasi pengaruh media terhadap suatu proses redoks (Wang 2000). Umumnya teknik voltametri yang sensitif menggunakan elektrode merkuri (Harvey 2000). Namun, saat ini elektrode merkuri sudah mulai ditinggalkan karena kurang ramah lingkungan. Sebagai alternatif, dikembangkan elektrode pasta karbon (EPK) yang lebih ramah lingkungan, memiliki kisaran potensial yang cukup luas, arus latar belakang yang rendah, biaya rendah, lembam, serta cocok untuk berbagai aplikasi deteksi dan pengukuran. Namun, pengumpulan ion pada permukaan EPK kurang terkendali dan lebih lambat dibandingkan dengan elektrode logam (Wang 2000). Oleh karena itu, perlu ditambahkan pemodifikasi pada EPK untuk meningkatkan sensitivitasnya.
Sensitivitas suatu sensor elektrokimia berkaitan erat dengan kemampuannya untuk menciptakan ruang mikro bagi biomolekul atau analit untuk bertukar elektron langsung dengan elektrode (Loh et al. 2008). Dibutuhkan material yang berukuran nano untuk menciptakan ruang mikro tersebut. Beberapa metode populer untuk menciptakan nanopartikel di antaranya ialah ko-presipitasi, dekomposisi termal, emulsi, hidrotermal, dan teknik pirolisis laser (Laurent et al. 2008). Salah satu metode yang mudah diaplikasikan dan menghasilkan nanopartikel dengan ukuran yang seragam ialah metode hidrotermal (Lu et al. 2007; Wu et al. 2008).
Salah satu nanopartikel yang saat ini sedang dipelajari ialah nanomagnetit (Fe3O4). Nanomagnetit memiliki beberapa kelengkapan sifat, meliputi sifat
kemagnetan, katalitik, konduktivitas, dan kompatibilitas biologis (Matsura et al. 2004). Nanomagnetit telah dimanfaatkan sebagai pemodifikasi pada EPK seperti oleh Loh et al. (2008) dan Fauziah (2012). Magnetit yang berukuran nano efektif meningkatkan sensitivitas sensor. Hal ini sesuai dengan prinsip adsorpsi: semakin kecil ukuran partikel, semakin luas bidang sentuh untuk melakukan reaksi sehingga semakin banyak analit yang mengalami reaksi redoks (Roonasii 2007).
2
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan ialah FeCl3·6H2O (Nacalai Tesque),
akuabidestilata, urea (Merck), natrium sitrat (C6H5O7Na3·2H2O) (Merck), serbuk
grafit, parafin cair, gas N2, KCl, KBr, dan etanol (Merck).
Peralatan yang digunakan antara lain neraca analitik, wadah hidrotermal, difraktometer sinar-X (XRD) Shimadzu Philips, pinggan porselen, mortar, alat kaca, elektrode pembanding Ag/AgCl, elektrode pembantu kawat platinum, pengaduk magnet, batang magnetik, dan galvanostat-potensiostat (E-Chem).
Lingkup Penelitian
Penelitian ini terdiri atas 4 tahap, yaitu (1) sintesis nanomagnetit dengan metode hidrotermal selama 3 jam, (2) pencirian dengan XRD, (3) pembuatan dan (4) pengujian EPK termodifikasi-nanomagnetit. Parameter pengujian meliputi komposisi, kecepatan payar, konsentrasi iodida, ion pengganggu, dan waktu penyimpanan. Berdasarkan parameter-parameter tersebut, linearitas, sensitivitas, selektivitas, dan ketahanan elektrode ditentukan (Gambar 1).
3
Sintesis Nanomagnetit (Cheng et al. 2010)
Nanomagnetit disintesis menggunakan metode hidrotermal. Sebanyak 0.5406 g FeCl3·6H2O (2 mmol/0.05 M), 1.1764 g natrium sitrat (4 mmol/0.10 M),
dan 0.3604 g urea (6 mmol/0.15 M) dilarutkan dalam 40 mL akuades, diaduk hingga larut sempurna, lalu dimasukkan ke dalam wadah teflon. Wadah tersebut dimasukkan ke dalam oven dan diatur pada suhu 200 °C selama 3 jam. Setelah itu, wadah didinginkan pada suhu ruang. Endapan hitam yang terbentuk dipisahkan, dicuci dengan air dan etanol, lalu dikeringkan pada oven suhu 40 °C semalam.
Pencirian dengan XRD
Sekitar 200 mg sampel dicetak langsung pada aluminium berukuran 2 × 2.5 cm. Sampel dicirikan menggunakan alat XRD dengan lampu radiasi Cu (λ 1.54 Ǻ) dengan tegangan 40 kV dan arus 30 mA.
Pembuatan Elektrode Pasta Karbon (Qiong et al. 2003 dengan modifikasi)
Grafit digerus dengan mortar, kemudian dicampurkan dengan minyak parafin dan nanomagnetit dengan 4 variasi komposisi nanomagnetit, yaitu 0, 5, 10, dan 15 mg. Komposisi parafin dan karbon dibuat tetap, yaitu 0.35 µL parafin dan 100 mg karbon. Setelah terbentuk pasta yang homogen, pasta dipadatkan pada badan elektrode dan permukaannya dihaluskan dengan kertas minyak.
Pengukuran Arus Latar Belakang Elektrolit (KCl) (Fauziah 2012)
Arus latar belakang yang ditimbulkan oleh media elektrolit ditentukan dengan mengukur respons arus elektrolit KCl 0.1 M dengan EPK dan EPK termodifikasi-nanomagnetit dengan komposisi 10 mg pada selang potensial 0–1.2 V dengan kecepatan payar 100 mV/det.
Pengaruh Komposisi Nanomagnetit
4
Pengaruh Kecepatan Payar (Fauziah 2012)
Larutan KI 1 mM dalam KCl 0.1 M diukur dengan EPK termodifikasi- nanomagnetit dengan komposisi 10 mg. Respons arus diamati pada selang potensial 0–1.2 V. Kecepatan payar yang digunakan berkisar antara 10 dan 160 mV/det.
Pengaruh Konsentrasi Iodida (Fauziah 2012)
Kurva kalibrasi dibuat dengan mengalurkan konsentrasi iodida (0–0.8 mM) dengan arus puncak. Pengujian voltametri siklik dilakukan dengan menggunakan EPK termodifikasi-nanomagnetit dengan komposisi 10 mg. Respons arus diamati pada selang potensial 0–1.2 V dengan kecepatan payar 100 mV/det. Linearitas kurva ditentukan berdasarkan koefisien korelasi kurva standar. Berdasarkan kurva standar yang diperoleh, ditentukan pula sensitivitas, limit deteksi, dan limit kuantitasi elektrode.
Penentuan Pengaruh Ion Halogen Lain (Zhu et al. 2010)
Gangguan ion halogen lain terhadap pengukuran iodida ditentukan dengan mengukur KI 1 mM dengan penambahan KBr 2 mM dan 10 mM dalam KCl 0.1 M. Arus puncak yang dihasilkan dibandingkan dengan arus puncak KI 1 mM tanpa penambahan KBr.
Pengaruh Waktu Penyimpanan
Larutan KI 1 mM dalam KCl 0.1 M diukur dengan EPK termodifikasi- nanomagnetit yang baru dibuat dan elektrode yang sudah disimpan selama 1 bulan. Respons arus yang dihasilkan dibandingkan.
HASIL DAN PEMBAHASAN
Nanomagnetit
Nanomagnetit disintesis dengan metode hidrotermal dari larutan FeCl3·6H2O, natrium sitrat, dan urea. Kristal Fe3O4 terdiri atas Fe3+ dan Fe2+,
maka diperlukan reduktor untuk mereduksi sebagian Fe3+ dari FeCl3. Sitrat
berperan sebagai pereduksi Fe3+ menjadi Fe2+ dalam pembentukan magnetit pada suhu tinggi. Tanpa adanya sitrat, hanya akan terbentuk α-Fe2O3 (Cheng et al.
5 Bersamaan dengan reaksi tersebut, suhu tinggi mengakibatkan terjadinya hidrolisis urea yang memberikan suasana basa. Menurut Lv et al. (2009), reaksi hidrolisis urea ialah sebagai berikut:
(NH2)2CO (aq) + 3H2O (aq)Æ2NH4OH(aq) + CO2 (g)...(2)
Kondisi basa tersebut mendukung terbentuknya endapan Fe(II) hidroksida dan Fe(III) hidroksida dengan reaksi sebagai berikut:
Fe2+(aq) + 2 NH4OH (aq)ÆFe(OH)2 (s) + 2NH4+(aq)...(3)
Fe3+(aq) + 3 NH4OH (aq)ÆFe(OH)3(s) + 3NH4+(aq)...(4)
Proses hidrotermal mendorong terbentuknya magnetit dengan terjadinya reaksi antara 1 molekul Fe(II) hidroksida dan 2 molekul Fe(III) hidroksida, dengan reaksi sebagai berikut:
Fe(OH)2(s) + 2Fe(OH)3(s) Æ Fe3O4(s) + 4H2O(aq) ...(5)
Secara stoikiometri, kristal nanomagnetit terbentuk dari Fe3+ dan Fe2+ dengan nisbah 2:1, maka Fe3+ tidak boleh tereduksi seluruhnya. Reaksi reduksi (1) diharapkan menghasilkan FeCl3 dan FeCl2 dengan nisbah mol 2:1.
2Fe3+Æ 2Fe2+ FeCl3 yang digunakan untuk sintesis nanomagnetit pada metode ini sebesar 2
mmol, maka dibutuhkan 0.33 mmol sitrat untuk mereduksi sepertiga molekul FeCl3 menjadi FeCl2 . Reaksi stoikiometri lengkap disajikan pada Lampiran 1.
C6H5O73- + 2Fe3+ Æ C5H4O52- + CO2 + H+ + 2Fe2+ Mula-mula 0.33 mmol 2.00 mmol
Reaksi -0.33 mmol -0.66 mmol 0,33 mmol 0,33 mmol 0.33 mmol 0.66 mmol Setimbang - 1.33 mmol 0.33 mmol 0.33 mmol 0.33 mmol 0.66 mmol(7)
Meskipun reduksi Fe3+ hanya memerlukan 0.33 mol sitrat, sitrat ditambahkan sebesar 4 mmol (0.1 M). Hal ini dikarenakan sitrat tidak hanya berperan sebagai reduktor, tetapi juga berperan penting dalam pembentukan morfologi kristal dan pencegahan agregasi. Cheng et al. (2010) melaporkan bahwa penambahan sitrat dengan konsentrasi di bawah 0.1 M menghasilkan nanopartikel dengan bentuk dan agregasi tidak beraturan. Sebaliknya, penambahan sitrat sebanyak 0.1 M menghasilkan nanopartikel dengan morfologi dan agregasi yang teratur, karena sitrat dapat membentuk kompleks yang stabil dengan Fe3+ dan Fe2+ (Cheng et al. 2010). Fe3+ membentuk kompleks bidentat
6
1993; Wu et al. 2008). Pembentukan kompleks dapat mereduksi keberadaan ion besi bebas dalam larutan. Dengan demikian, dihasilkan reaksi lambat yang sangat baik dalam pembentukan kristal (Cheng et al. 2010).
(a) (b)
Gambar 2 Kompleks sitrat dengan ion besi(II) (a) dan besi(III) (b)
Cheng et al. (2010) mengilustrasikan proses pembentukan nanomagnetit secara hidrotermal menjadi 2 tahap (Gambar 3). Tahap pertama, partikel amorf pertama ternukleasi dari larutan jenuh, lalu terbentuk agregat menjadi partikel amorf berbentuk bola yang didorong oleh minimalisasi energi permukaan total. Selanjutnya pada tahap kedua, padatan amorf yang terbentuk pada tahap pertama tumbuh terus-menerus dan mulai mengkristal.
Gambar 3 Ilustrasi pembentukan nanomagnetit secara hidrotermal (Cheng et al. 2010)
Terbentuknya nanomagnetit dicirikan dengan endapan berwarna hitam yang dapat berinteraksi dengan medan magnet (Gambar 4). Sifat magnet endapan muncul saat didekatkan dengan medan magnet luar kemudian hilang pada saat medan magnet tersebut dijauhkan. Hal ini menunjukkan bahwa nanomagnetit memiliki sifat paramagnetik.
7
Sifat paramagnetik Fe3O4 disebabkan oleh adanya transfer elektron antara
Fe3+ dan Fe2+ dalam kisi oktahedral (Chen et al. 2008) dan adanya pasangan spin antiparalel yang tidak seimbang pada kisi kristal (Lu et al. 2007). Ukuran juga menjadi faktor penting yang menentukan sifat paramagnetik. Partikel magnetit berukuran kurang dari 30 nm akan memiliki sifat paramagnetik (Cheng et al 2010; Lu et al. 2007). Nanomagnetit yang dihasilkan dengan metode hidrotermal ini berukuran lebih dari 30 nm, yaitu 68–200 nm (Cheng et al. 2010; Fauziah 2012), namun tetap memiliki sifat paramagnetik. Hal ini disebabkan magnetit yang dihasilkan terdiri atas partikel magnetit tunggal berukuran 20 nm (Cheng et al. 2010; Fauziah 2012) (Gambar 5).
(a) (b)
Gambar 5 Citra SEM nanomagnetit hasil sintesis perbesaran 30 000 kali (a) dan 50 000 kali (b) (Fauziah 2012)
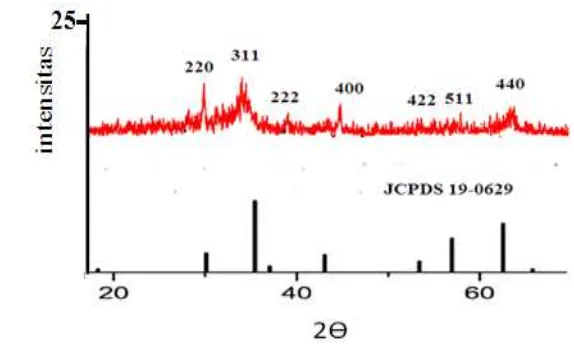
Difraktogram sinar-X menunjukkan keberhasilan sintesis nanomagnetit, ditunjukkan dengan kemiripan dengan pola standar magnetit JCPDS No. 19-0629 (Lampiran 2), yaitu munculnya puncak dengan intensitas tertinggi pada 2Ө 35.54°; 57.0564°; dan 62.66° (Gambar 6). Intensitas puncak yang tidak terlalu tinggi menunjukkan tingkat kristalinitas yang rendah, yaitu 47.81% (Lampiran 3).
8
Kinerja Elektrode Pasta Karbon Termodifikasi-Nanomagnetit
Hasil Pengujian Awal
Pengujian awal dilakukan untuk memperoleh kondisi pengukuran yang optimum sehingga meminimumkan galat yang bersumber pada metode analisis. Pengujian awal yang dilakukan antara lain penentuan daerah pemayaran, pengukuran arus blangko (KCl 0.1 M), Penentuan komposisi elektrode yang optimum untuk pengukuran, dan pengukuran respons arus yang dihasilkan oleh analit (iodida).
Daerah pemayaran idealnya berada pada daerah potensial redoks analit, tetapi tidak berada pada daerah potensial redoks elektrolit pendukung. Hal ini dimaksudkan agar arus puncak yang dihasilkan hanya berasal dari analit. Elektrolit pendukung digunakan untuk menurunkan efek migrasi sehingga meningkatkan arus difusi (Faraday) yang sebanding dengan konsentrasi analit (Wang 2000). Fauziah (2012) melaporkan bahwa analisis KI dalam elektrolit KCl 0.1 M menghasilkan respons yang baik pada daerah pemayaran 0.0–1.2 V. Pengukuran arus KCl 0.1 M pada daerah pemayaran 0.0–1.2 V dengan EPK maupun EPK termodifikasi-nanomagnetit yang disintesis selama 3 jam (M3) didapati tidak menghasilkan arus puncak (Gambar 7). Hal ini mengindikasikan kisaran potensial tersebut cocok digunakan untuk pengukuran KI. Potensial redoks Cl– 1.36 V sementara K+ 2.92 V maka KCl tidak mengalami reaksi redoks pada daerah potensial 0.0–1.2 V.
9
Pengukuran KI 1 mM dalam larutan KCl 0.1 M menghasilkan voltamogram yang memiliki 2 pasang puncak oksidasi dan reduksi (Gambar 8). Puncak anodik (Epa) dan katodik (Epc) pertama lebih tinggi daripada puncak kedua dan bentuknya lebih lancip sehingga lebih sesuai untuk digunakan sebagai sinyal pengukuran. 0,0 0,2 0,4 0,6 0,8 1,0 1,2 Diduga reaksi redoks yang terjadi adalah sebagai berikut : Awal :KIÆK+ + I–...(1)
Adanya logam Fe pada magnetit mengakibatkan terjadinya proses elektrokatalisis sebagai berikut: Epa1 :2I– + 2Fe3+Æ I2 + 2Fe2+...(7)
Epa2 :2I3– + 2Fe3+Æ 3I2 + 2Fe2+...(8)
Epc1 :I2 + 2Fe2+Æ 2I– + 2Fe3+...(9)
Epc2 :3I2 + 2Fe2+Æ2I3– + 2Fe3+...(10)
Proses elektrokatalisis oleh Fe tersebut mampu meningkatkan respons EPK. Nanomagnetit yang disintesis selama 3 jam meningkatkan respons arus sebesar 1.4 kali EPK (Gambar 9).
10
Peningkatan respons arus oleh nanomagnetit yang disintesis selama 3 jam masih lebih kecil dibandingkan dengan nanomagnetit yang disintesis selama 12 jam, meskipun luas permukaan nanomagnetit yang disintesis selama 3 jam lebih besar. Fauziah (2012) melaporkan bahwa nanomagnetit yang disintesis selama 12 jam mampu meningkatkan respons arus iodida sebesar 10 kali lipat EPK. Menurut Cheng et al. (2010), nanomagnetit yang disintesis selama 12 jam memiliki kristalinitas dan sifat paramagnetik yang paling besar. Hal ini mengindikasikan bahwa kinerja elektrode tidak hanya dipengaruhi oleh luas permukaan pemodifikasi, tetapi juga dipengaruhi oleh sifat lainnya, yaitu kristalinitas dan sifat paramagnetik.
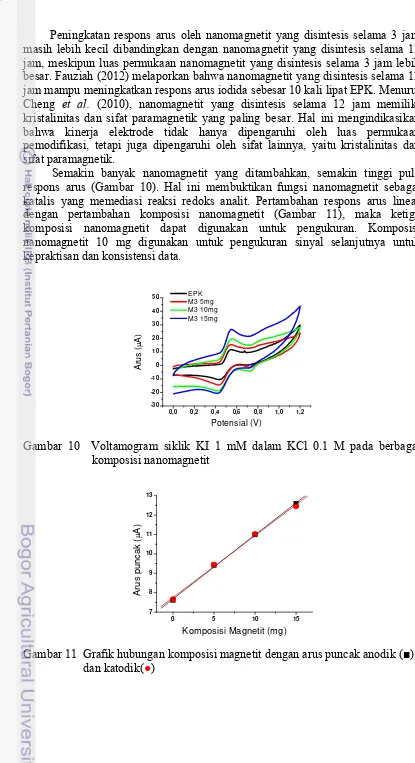
Semakin banyak nanomagnetit yang ditambahkan, semakin tinggi pula respons arus (Gambar 10). Hal ini membuktikan fungsi nanomagnetit sebagai katalis yang memediasi reaksi redoks analit. Pertambahan respons arus linear dengan pertambahan komposisi nanomagnetit (Gambar 11), maka ketiga komposisi nanomagnetit dapat digunakan untuk pengukuran. Komposisi nanomagnetit 10 mg digunakan untuk pengukuran sinyal selanjutnya untuk kepraktisan dan konsistensi data.
11
Mekanisme Elektrokatalisis
Reversibilitas reaksi redoks yang terjadi pada analit diketahui dari selisih antara potensial puncak redoks (Tabel). Berdasarkan persamaan energi bebas gibbs, jika beda potensial antara puncak anodik dan katodik lebih kecil atau sama dengan 59 mV, maka reaksi redoks tersebut reversibel (Scholz 2010). Dengan demikian, pasangan redoks pertama dan kedua, baik pada EPK dan EPK termodifikasi-nanomagnetit adalah reaksi kuasireversibel karena beda potensialnya lebih besar dari 59 mV.
Tabel Potensial puncak redoks
Potensial EPK M3
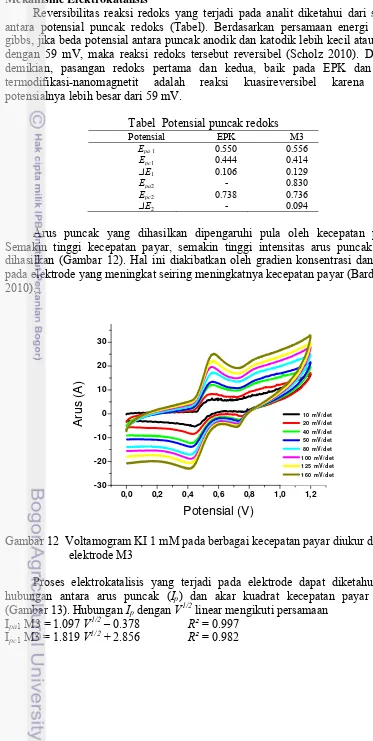
Arus puncak yang dihasilkan dipengaruhi pula oleh kecepatan payar. Semakin tinggi kecepatan payar, semakin tinggi intensitas arus puncak yang dihasilkan (Gambar 12). Hal ini diakibatkan oleh gradien konsentrasi dan fluks pada elektrode yang meningkat seiring meningkatnya kecepatan payar (Bard et al. 2010).
Gambar 12 Voltamogram KI 1 mM pada berbagai kecepatan payar diukur dengan elektrode M3
Proses elektrokatalisis yang terjadi pada elektrode dapat diketahui dari hubungan antara arus puncak (Ip) dan akar kuadrat kecepatan payar (V1/2)
(Gambar 13). Hubungan Ip dengan V1/2 linear mengikuti persamaan
Ipa1 M3 = 1.097 V1/2 – 0.378 R² = 0.997
12
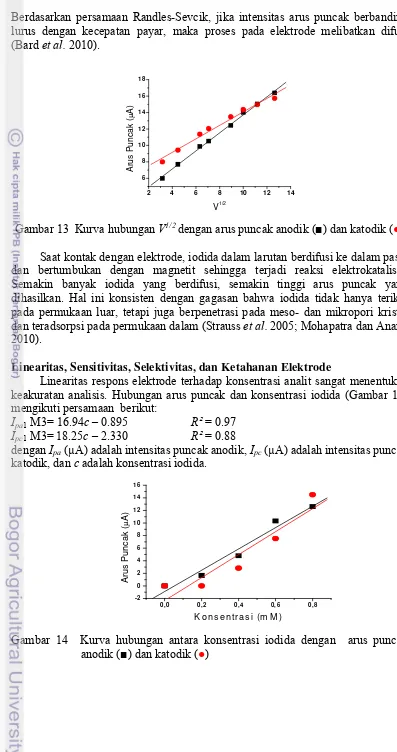
Berdasarkan persamaan Randles-Sevcik, jika intensitas arus puncak berbanding lurus dengan kecepatan payar, maka proses pada elektrode melibatkan difusi (Bard et al. 2010). Saat kontak dengan elektrode, iodida dalam larutan berdifusi ke dalam pasta dan bertumbukan dengan magnetit sehingga terjadi reaksi elektrokatalisis. Semakin banyak iodida yang berdifusi, semakin tinggi arus puncak yang dihasilkan. Hal ini konsisten dengan gagasan bahwa iodida tidak hanya terikat pada permukaan luar, tetapi juga berpenetrasi pada meso- dan mikropori kristal dan teradsorpsi pada permukaan dalam (Strauss et al. 2005; Mohapatra dan Anand 2010).
Linearitas, Sensitivitas, Selektivitas, dan Ketahanan Elektrode
Linearitas respons elektrode terhadap konsentrasi analit sangat menentukan keakuratan analisis. Hubungan arus puncak dan konsentrasi iodida (Gambar 14) mengikuti persamaan berikut:
Ipa1 M3= 16.94c – 0.895 R² = 0.97
Ipc1 M3= 18.25c – 2.330 R² = 0.88
dengan Ipa (µA) adalah intensitas puncak anodik, Ipc (µA) adalah intensitas puncak
katodik, dan c adalah konsentrasi iodida.
0 ,0 0 ,2 0 ,4 0 ,6 0 ,8
13
Berdasarkan koefisien korelasi, linearitas puncak anodik lebih baik dibandingkan dengan puncak katodik. Berdasarkan SNI 06-6989 (2005), linearitas pengukuran dikatakan baik bila R2 lebih besar atau sama dengan 0.97. Jadi, arus puncak anodik memenuhi kriteria untuk digunakan pada pengukuran secara kuantitatif.
Sensitivitas, limit deteksi, dan limit kuantitasi ditentukan berdasarkan persamaan kurva standar (Lampiran 4). Sensitivitas ialah besarnya perubahan respons yang ditimbulkan oleh perubahan 1 satuan konsentrasi analit (Harvey 2000). Limit deteksi ialah konsentrasi analit terendah yang dapat dideteksi oleh instrumen, sedangkan limit kuantitasi ialah konsentrasi analit terendah yang dapat diukur secara akurat oleh instrumen (Harmita 2004). Sensitivitas, limit deteksi, dan limit kuantitasi elektrode M3 berturut-turut ialah 16.04 µA/mM, 0.0462 mM, dan 0.154 mM.
Selektivitas merupakan kemampuan suatu alat atau metode untuk membedakan sinyal analit dengan sinyal yang berasal dari pengganggu (Harvey 2000). Selektivitas diamati dari pengaruh ion halogen lain yang lazimnya mengganggu pengukuran iodida. Ion pengganggu yang digunakan dalam studi selektivitas ini ialah Br– yang berasal dari KBr dengan nisbah molar 2 dan 10 (Lampiran 5). Recovery pengukuran diperoleh sebesar 96.85% pada penambahan KBr 2 mM dan 103.99% pada penambahan KBr 10 mM.
Persen recovery yang mendekati 100% berarti Br– dalam jumlah yang cukup besar (hingga 10 kali lipat iodida) tidak mengganggu pengukuran iodida. Hal ini dikarenakan potensial reduksi bromium jauh berbeda dengan potensial reduksi iodium. Potensial reduksi bromium 1.09 V sementara potensial reduksi iodium 0.535 V.
Ketahanan (rudgedness) elektrode selama penyimpanan diuji dengan membandingkan respons arus yang diberikan oleh elektrode yang baru dibuat dengan elektrode yang telah disimpan selama 1 bulan. Penyimpanan elektrode didapati menurunkan respons arus puncak (Gambar 15).
0,0 0,2 0,4 0,6 0,8 1,0 1,2
14
Penurunan respons arus akibat penyimpanan elektrode cukup besar, yaitu 7.23 µA. Menurut Lu et al. (2007), penyimpanan yang cukup lama dalam keadaan ambien dapat mengoksidasi magnetit menjadi magemit (Fe2O3). Selain itu,
pengotor berupa sisa sitrat diduga memicu degradasi kristal nanomagnetit selama penyimpanan. Hal ini menyebabkan penurunan katalisis sehingga menurunkan respons arus puncak. Nanomagnetit dapat dicegah dari oksidasi dan aglomerasi dengan cara penyalutan (Laurent et al. 2008; Lu et al. 2007).
SIMPULAN DAN SARAN
Elektode termodifikasi nanomagnetit yang disintesis selama 3 jam menunjukkan kinerja yang cukup baik. Nanomagnetit hasil sintesis secara hidrotermal selama 3 jam berhasil meningkatkan respons arus sebesar 1.4 kali lipat elektrode pasta karbon. Linearitas respons elektrode baik pada puncak anodik. Selektivitas elektrode juga baik hingga penambahan 10 kali lipat ion pengganggu. Sensitivitas elektrode 16.04 µA/mM, limit deteksi 0.0462 mM, dan limit kuantitasi 0.154 mM. Respons elektrode menurun 7.23 µA setelah disimpan selama 1 bulan.
Bagaimanapun, sensitivitas elektrode tersebut masih lebih rendah dibandingkan dengan elektrode termodifikasi nanomagnetit yang disintesis selama 12 jam. Oleh karena itu, untuk pengembangan selanjutnya disarankan menggunakan nanomagnetit yang disintesis selama 12 jam. Selain itu, diperlukan upaya meningkatkan ketahanan elektrode terhadap penyimpanan, antara lain dengan penyalutan.
DAFTAR PUSTAKA
Bard AJ, Stratmann M, Unwin PR, editor. 2010. Encyclopedia of Electroanalytical Techniques. New York (US): Marcell-Dekker.
Chen J, Wang F, Huang K, Liu Y, Liu S. 2008. Preparation of Fe3O4 nanoparticles
with adjustable morphology. J Alloys & Compounds [internet]. [diunduh 2012 Des 1]. 475:898-902. Tersedia pada: http://144.206.159.178/ft/ 537/607077/12605005.pdf.
Cheng W, Gellings T, Tang K, Qi Y, Sheng J, Liu Z. 2010. One-step synthesis of superparamagnetic monodisperse porous Fe3O4 hollow and core-shell
spheres. J Mater Chem. 20(1):1799-1805.doi: 10.1039/b919164j.
15
Francis AJ, Dodje CJ. 1993. Influence of complex structure on the biodegradation of iron-citrate complex. Appl Environ Microbiol [internet]. [diunduh 2012 Des 1]. 59(1):109-113. Tersedia pada: http://journals.asm.org/site/misc/repri nts.xhtml.
Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya. Majalah Ilmu Kefarmasian [internet]. [diunduh 2012 Sept 1]. 1(3):117-135. Tersedia pada: http://jurnal.farmasi.ui.ac.id/pdf/2004/v01n03Harmita 01030 1.pdf.
Harvey D. 2000. Modern Analytical Chemistry. New York (US): Mc Graw Hill. Laurent S, Forge D, Port M, Roch A, Robic C, Elst LV, Muller RN. 2008.
Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physichochemica, characterizations, and biological applications. Chem Rev [internet]. [diunduh 2012 Jul 31]. 10:2064-2110. Tersedia pada: http://www.ncbi.nlm.nih.gov/pubmed/18543879.
Loh KS, Lee YH, Musa A, Salmah AA, Zamri I. 2008. Use of Fe3O4
nanoparticles for enhancement of biosensor response to the herbicide 2,4-dichlorophenoxyacetic acid. Sensors. 8:5775-5791. doi: 10.3390/s8095775 Lu AH, Salabas E, Scutch F. 2007. Magnetic nanoparticles: synthesis, protection,
functionalization, and application. Angew Chemie. 46(1):1222-1244. doi: 10.1002/anie.200602866.
Lv Y, Wang H, Wang X, Bai J. 2009. Synthesis, characterization and growing mechanism of monodisperse Fe3O4 microspheres. J Crystal Growth
[internet]. [diunduh 2012 Jul 21]. 311(13):3445-3450. Tersedia pada: http://www.sciencedirect.com/science/article/pii/S0022024809004084. Matsura V, Guari Y, Larionova I, Gue´rin C, Caneschi A, Sangregorio C,
Lancelle-Beltran E, Mehdi A, Corriu RJP. 2004. Synthesis of magnetic silica-based nanocomposites containing Fe3O4 nanoparticles. J Mater Chem.
14:3026-3033. doi: 10.1039/B409449B
Mohapatra M, Anand S. 2010. Synthesis and applications of nano-structured iron oxides/hydroxides. Int J Eng Sci Technol [internet]. [diunduh 2012 Apr 21]. 2(8):127-146. Tersedia pada: http://www.ajol.info/index.php/ijest/article /view/63846.
Novianto D, Susanti D, Purwaningsih H. 2012. Aplikasi tungsten trioksida nano partikel dengan metode sol gel dan proses kalsinasi sebagai kapasitor elektrokimia. Jurnal Teknik Material dan Metalurgi Institut Sepuluh Nopember Surabaya [internet]. [diunduh 2012 Jul 11]. Tersedia pada: http://digilib.its.ac.id/public/ITS-Undergraduate-20403-Paper-2166626.pdf Qiong H, Junjie F, Sengshui H. 2003. Voltammetric method based on an ion-
pairing reaction for the determination of trace amount of iodide at carbon-paste electrode. Anal Sci [internet]. [diunduh 2012 Jan 3]. 19:681-686. Tersedia pada: https://www.jstage.jst.go.jp/article/analsci/19/5/19_5_681/ _pdf.
Roonasi P. 2007. Adsorption and surface reaction properties of synthesized magnetite nanoparticles [tesis]. Luleå (SE): Luleå University of Technology. Scholz F, editor. 2010. Electroanalytical Methods Guide to Experiments and
16
Strauss R, Brummer GW, Barrow NJ. 1997. Effects of crystallinity of goethite: II. rates of sorption and desorption of phospate. Eur J Soil Sci. 48(1):101-114. doi: 10.1111/j.1365-2389.1997.tb00189.x.
Wang J. 2000. Analytical Electrochemistry. Ed ke-2. New York (US): J Wiley. Wu W, He Q, Jiang C. 2008. Magnetic iron oxide nanoparticles: synthesis and
surface functionalization strategies. Nanoscale Res Lett. 3:397-415. doi: 10.1007/s11671-008-9174-9.
Lampiran 1 Reaksi stoikiometri pembentukan nanomagnetit I Reduksi Fe3+ oleh sitrat
C6H5O73- + 2Fe3+ Æ C5H4O52- + CO2 + H+ + 2Fe2+ Mula-mula 0.33 mmol 2.00 mmol
Reaksi -0.33 mmol -0.66 mmol 0.33 mmol 0.33 mmol 0.33 mmol 0.66 mmol Setimbang - 1.33 mmol 0.33 mmol 0.33 mmol 0.33 mmol 0.66 mmol
II Reaksi hidrolisis urea
(NH2)2CO + 3H2O Æ2NH4OH + CO2
III Pembentukan Fe(II) hidroksida dan Fe(III) hidroksida Fe2+ + 2NH4OH ÆFe(OH)2 + 2NH4+
0.66 mmol 0.66 mmol
Fe3+ + 3NH4OH ÆFe(OH)3 + 3NH4+ 1.33 mmol 1.33 mmol
IV Reaksi pembentukan magnetit
Fe(OH)2 + 2Fe(OH)3 Æ Fe3O4 + 4H2O Mula-mula 0.66 mmol 1.33 mmol
Reaksi 0.66 mmol 1,33 mmol 0,66 mmol 2,4 mmol Setimbang - - 0.66 mmol 2.4 mmol
18
Lampiran 3 Penentuan kristalinitas nanomagnetit
Waktu sintesis magnetit (jam)
Luas daerah kristalin (kcps*deg)
Luas daerah amorf (kcps*deg)
Kristalinitas (%)
3 0.1985 0.2167 47.81
Contoh perhitungan :
Kristalinitas = Luas daerah kristalin/(luas daerah amorf + kristalin) × 100% kristalinitas M3 0.1985
0.1985 + 0.2167 % 4 . %
Lampiran 4 Penentuan limit deteksi dan limit kuantisasi
Ulangan Persamaan linear puncak oksidasi M3
1 y = 17.19x – 0.66 R² = 0.981 2 y = 16.83x – 0.85 R² = 0.971 3 y = 16.80x – 1.176 R² = 0.943 Rerata y = 16.94x – 0.895±0.2609 R² = 0.968
SD intersep 0.2609
LOD( 3*SD intersep)/slope 0.0462
LOQ (10*SD intersep)/slope 0.1540
Lampiran 5 Penentuan persen recovery KI setelah penambahan ion pengganggu.
Elektrode M3 % recovery
Ipa Ipc Ipa Ipc
KI 1 mM 16.54 8.94
KI 1 mM + KBr 2 mM 16,02 14.72 96.85 164.65
KI 1 mM + KBr 10 mM 16.12 16.12 103.99 192.39
Contoh perhitungan:
% recovery = (arus puncak KI 1 mM + KBr)/(arus puncak KI 1 mM) × 100%
RIWAYAT HIDUP
Penulis dilahirkan di Sei Lala (Riau) pada tanggal 21 Oktober 1989 dari Ayah Sarijo dan Ibu Rukana. Penulis adalah anak pertama dari 3 bersaudara. Pada tahun 2007, penulis lulus dari SMA Negeri 1 Rengat dan pada tahun yang sama, penulis diterima di Program Keahlian Analisis Kimia D3 Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Pada bulan Maret hingga April 2010 penulis melaksanakan praktik kerja lapangan di Laboratorium Analisis Tanah Seameo Biotrop, Bogor, Jawa Barat dengan judul tugas akhir Penetapan Tanah Standar sebagai Internal Quality Control pada Analisis Tanah. Pada bulan Oktober 2010 penulis dinyatakan lulus sebagai ahli madya analisis kimia dan pada tahun yang sama diterima di Program Alih Jenis Departemen Kimia, Institut Pertanian Bogor.