ELEKTROOKSIDASI REDUKSI TEMBAGA(II) DAN
PERAK(I) PADA ELEKTRODE PASTA KARBON
TERMODIFIKASI KUERSETIN
IKA RACHMAWATI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Elektrooksidasi Reduksi Tembaga(II) dan Perak(I) pada Elektrode Pasta Karbon Termodifikasi Kuersetin adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
IKA RACHMAWATI. Elektrooksidasi Reduksi Tembaga(II) dan Perak(I) pada Elektrode Pasta Karbon Termodifikasi Kuersetin. Dibimbing oleh DEDEN SAPRUDIN dan BUDI RIZA PUTRA.
Kuersetin merupakan salah satu senyawa dari golongan flavonoid yang dapat membentuk senyawa kompleks dengan ion logam sehingga dapat digunakan sebagai pemodifikasi elektrode pasta karbon. Langkah awal untuk mengetahui kinerja elektrode pasta karbon termodifikasi kuersetin adalah dengan mencari pola elektrookidasi reduksinya dengan metode voltammetri siklik. Voltammogram siklik dari ion Cu(II) dan Ag(I) menghasilkan satu puncak anodik dan katodik yang bersifat kuasireversibel. Peningkatan intensitas arus anodik dan katodik berturut turut adalah 7.55% dan 60.89% untuk Cu(II) sedangkan untuk Ag(I) berturut turut 41.52% dan 194.46%. Voltammogram campuran Cu(II) dan Ag(I) menghasilkan dua pasang puncak anodik dan katodik sehingga dapat digunakan untuk analisis campuran Cu(II) dan Ag(I).
Kata kunci: elektrode, kuersetin, tembaga(II), perak(I), voltammetri
ABSTRACT
IKA RACHMAWATI. Electrooxidation Reduction Copper(II) and Silver(I) Using Quercetin Modified Carbon Paste Electrodes. Supervised by DEDEN SAPRUDIN and BUDI RIZA PUTRA.
Quercetin is one of flavonoids that can form complexes with metal ions to be used as a modifier of carbon paste electrodes. The initial step to determine the performance of quercetin modified carbon paste electrode is by looking for patterns of elektrooxidation reduction with cyclic voltammetry method. Voltammogram cyclic of ions Cu(II) and Ag(I) produces anodic and cathodic peaks that are quasireversible. The increase in the anodic and cathodic current intensity were 7.55% and 60.89%, respectively, for Cu (II), while those for Ag (I) were 41.52% and 194.46%, respectively. Voltammogram of mixture of Cu(II) and Ag(I) produced two pairs of anodic and cathodic peaks that can be used for analysing mixture of Cu(II) and Ag(I).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
ELEKTROOKSIDASI REDUKSI TEMBAGA(II) DAN
PERAK(I) PADA ELEKTRODE PASTA KARBON
TERMODIFIKASI KUERSETIN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Elektrooksidasi Reduksi Tembaga(II) dan Perak(I) pada Elektrode Pasta Karbon Termodifikasi Kuersetin
Nama : Ika Rachmawati NIM : G44100023
Disetujui oleh
Dr Deden Saprudin, MSi Pembimbing I
Budi Riza Putra, MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah yang berjudul Elektrooksidasi Reduksi Tembaga(II) dan Perak(I) pada Elektrode Pasta Karbon Termodifikasi Kuersetin dapat diselesaikan. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada 4 Februari sampai 1 Juli 2014 di Laboratorium Analitik dan Laboratorium Bersama Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr Deden Saprudin, MSi dan Bapak Budi Riza Putra, MSi selaku pembimbing yang telah memberikan arahan dan saran selama penelitian dan penulisan karya ilmiah ini. Di samping itu, ungkapan terima kasih penulis sampaikan kepada Bapak Eman, Bapak Kosasih, Bapak Dede, dan Ibu Nunung dari Laboratorium Analitik, Ibu Dr Henny Purwaningsih, MSi dan Bapak Eko dari Laboratorium Bersama beserta seluruh staf Departemen Kimia yang telah memberikan bantuan dan fasilitas selama penelitian. Ungkapan terima kasih juga penulis sampaikan kepada Ayah, Ibu, Adik, Yuditya, Ghozali, Sari, Qomariyah, Yuniarti, Ferinda, dan Jannah atas bantuan dan dukungan selama penelitian dan penyusunan karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Tujuan 3
Hipotesis Penelitian 3
METODE 3
Bahan 3
Alat 3
Prosedur Penelitian 3
HASIL DAN PEMBAHASAN 5
Kuersetin sebagai Bahan Pemodifikasi EPK 5
Respon Elektrode Terhadap Ion Cu(II) dan Ag(I) 6
Pengaruh Laju Payar 9
Pengaruh Konsentrasi Analat 13
Pengaruh Ion Ag(I) pada Penentuan Ion Cu(II) 15
Perbandingan Konsentrasi terhadap Pengaruh Ion Ag(I) pada Penentuan
Ion Cu(II) 19
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 21
LAMPIRAN 22
DAFTAR TABEL
1 Potensial dan arus puncak hasil analisis CuCl2 1 mM 7 2 Potensial dan arus puncak hasil analisis AgNO3 1 mM 9 3 Arus dan potensial puncak dari analisis Cu:Ag 1:1 mM 16 4 Arus dan potensial puncak dari Cu:Ag, Ag(I), dan Cu(II) 17 5 Arus dan potensial puncak oksidasi Cu:Ag, Cu(II), dan Ag(I) 18 6 Arus dan potensial puncak dari Cu:Ag dengan perbandingan konsentrasi 20
DAFTAR GAMBAR
1 Struktur molekul kuersetin 1
2 Potensi posisi pembentukan kompleks ion logam dengan kuersetin
(Symonowicz dan Kolanek 2012) 2
3 Voltammogram siklik larutan penyangga fosfat pH 4.7 dengan EPK
larutan penyangga fosfat pH 4.7 dengan EPKQ 10
7 Hubungan akar laju payar dan arus puncak hasil analisis CuCl2 1 mM
dengan EPKQ 10
8 Pengaruh laju payar pada voltammogram siklik AgNO3 1 mM dalam
larutan penyangga fosfat pH 4.7 dengan EPKQ 11
9 Hubungan akar kuadrat laju payar dan arus puncak hasil analisis AgNO3
1 mM dengan EPKQ 11
10Pengaruh laju payar pada voltammogram siklik Cu:Ag 1:1 mM dalam
larutan penyangga fosfat pH 4.7 dengan EPKQ 12
11Hubungan akar kuadrat laju payar dan arus puncak hasil analisis Cu:Ag
1:1 mM dengan EPKQ 12
12Pengaruh konsentrasi pada voltammogram siklik CuCl2 dalam larutan
penyangga fosfat pH 4.7 dengan EPKQ 13
13Hubungan konsentrasi CuCl2 dan arus puncak 14
14Pengaruh konsentrasi pada voltammogram siklik AgNO3 dalam larutan
penyangga fosfat pH 4.7 dengan EPKQ 14
15Hubungan konsentrasi AgNO3 dan arus puncak 15
16Voltammogram siklik simultan Cu:Ag 1:1 mM dalam larutan penyangga
fosfat pH 4.7 dengan EPK dan EPKQ 15
17Voltammogram siklik Cu:Ag 1:1 mM, Cu(II) 1.0 mM, dan Ag(I)
1.0 mM dengan EPKQ 17
18Voltammogram lucutan pulsa diferensial dari Cu:Ag, Ag(I), dan Cu(II) 18 19Voltammogram siklik perbandingan konsentrasi Cu:Ag dalam larutan
DAFTAR LAMPIRAN
1 Diagram alir penelitian 22
2 Voltammogram siklik K3Fe(CN)6 pada EPK dan EPKQ 23
3 Potensial dan arus puncak K3Fe(CN)6 23
PENDAHULUAN
Voltammetri menjadi alternatif metode dalam analisis penentuan logam, selain Spektrofotometer Serapan Atom (SSA) dan Plasma Gandeng Induktif-Spektrofotometer Emisi Atom (PGI-SEA). Voltammetri siklik merupakan teknik voltammetri yang memberikan hasil kualitatif dan kuantitatif dalam bentuk voltammogram siklik dari respon arus yang dihasilkan dari proses reaksi oksidasi reduksi dengan menerapkan suatu potensial (Xia et al. 2010). Voltammetri lucutan merupakan teknik voltammetri yang sensitif untuk analisis penentuan logam, salah satunya adalah voltammetri lucutan pulsa diferensial. Voltammetri lucutan terdiri dari dua tahap reaksi, yaitu tahap prakonsentrasi dan tahap pemayaran potensial (Wang 2006).
Elektrode pasta karbon (EPK) telah menjadi alternatif elektrode kerja pada sel elektrokimia voltammetri sebagai pengganti dari elektrode kerja merkuri yang kurang ramah lingkungan. Elektrode pasta karbon dipilih sebagai elektrode kerja karena lebih ramah lingkungan, lembam, biaya bahan yang relatif murah, dapat digunakan dalam berbagai aplikasi voltammetri, kisaran potensial yang cukup luas, dan mudah dimodifikasi. Modifikasi EPK dilakukan untuk menambah selektivitas, sensitivitas, stabilitas elektrokimia, dan mengurangi kelemahan EPK yang lebih lambat dalam pengumpulan ion dibandingkan dengan elektrode logam (Wang 2006).
Kuersetin (3’,4’,3,5,7-pentahidroksiflavonol) (Gambar 1) merupakan salah satu bahan pemodifikasi EPK yang berasal dari flavonoid dari kelompok flavonol yang paling melimpah pada tumbuhan. Kuersetin memiliki nama IUPAC 2-(3’,4’ -dihidroksifenil)-3,5,7-trihidroksi-4H-kromen-4-on yang tergolong dalam bentuk aglikon dari sejumlah flavonoid lain, termasuk rutin, kuersitrin, isokuersetin, dan hiperosida (Brett dan Ghica 2003).
Gugus hidroksil dan karbonil yang terdapat dalam struktur kuersetin memiliki kemampuan antioksidan dan pembentukan kompleks dengan berbagai ion logam dengan mendonorkan elektron pada ion logam sehingga kuersetin dapat meningkatkan sensitivitas pada permukaan elektrode termodifikasi (Xia et al. 2010). Ada 3 bagian sisi aktif pada kuersetin yang berpotensi membentuk kompleks dengan ion logam, yaitu antara 5-hidroksi dan karbonil, antara 3-hidroksi dan
2
karbonil, dan antara 3' dan 4'-hidroksi pada cincin B (Gambar 2) (Symonowick dan Kolanek 2012). Gugus 7-hidroksi pada cincin A, pasangan elektron bebas dari atom O pada cincin C, dan elektron-elektron � pada cincin aromatik pada kuersetin juga memiliki peluang interaksi dengan kation logam.
Kuersetin sebagai bahan pemodifikasi EPK diharapkan dapat meningkatkan sensitivitas analisis dalam peningkatan respon intensitas arus puncak anodik dan katodik dan mempercepat proses transfer elektron reaksi oksidasi dan reduksi analat. Beberapa hasil penelitian telah melaporkan pemanfaatan kuersetin sebagai bahan pemodifikasi EPK dan pengompleks dalam penentuan logam, diantaranya Taufik (2013) melaporkan terjadi peningkatan intensitas arus puncak pada EPK termodifikasi kuersetin pada analisis ion tembaga(II), penentuan timbal (Pb) dan tembaga (Cu) pada serum manusia (Fei et al. 2001), penentuan simultan ion logam Sb(III) dan Mo(VI) menggunakan kuersetin sebagai ligan pengompleks (Rojas et al. 2012), dan Xia et al. (2010) telah melakukan penentuan simultan dari logam tembaga (Cu), timbal (Pb), dan cadmium (Cd) pada sampel tanah menggunakan elektrode termodifikasi kuersetin dengan teknik voltammetri.
Logam perak (Ag) dan tembaga (Cu) merupakan beberapa logam transisi yang dimanfaatkan dalam bidang industri logam, seperti pertambangan, metalurgi, dan industri pelapisan, elektronik, dan pencampuran logam Ag dan Cu dalam pembuatan uang koin sehingga ada potensi cemaran limbah logam ke lingkungan yang mengganggu kesehatan manusia jika terakumulasi dalam konsentrasi tinggi. Giyatmi et al. (2008) telah melakukan penentuan kandungan tembaga (Cu), perak (Ag), dan kromium (Cr) dalam limbah industri perak dengan Spektrofotometer Serapan Atom (SSA).
Analisis penentuan logam juga dapat dilakukan dengan metode lain, seperti voltammetri yang dapat membedakan tingkat oksidasi logam, mendeteksi logam secara simultan, preparasi sampel lebih mudah, peralatan lebih praktis, lebih murah, dan respon cepat. Dalam penelitian ini dilakukan pengajian pola oksidasi reduksi tembaga(II) dan perak(I) dengan metode voltammetri pada elektrode pasta karbon termodifikasi kuersetin (EPKQ) untuk meningkatkan sensitivitas respon elektrode.
Gambar 2 Potensi posisi pembentukan kompleks ion logam dengan kuersetin (Symonowicz dan Kolanek 2012)
B
3
Tujuan
Tujuan penelitian ini adalah mengkaji pola oksidasi reduksi tembaga(II) dan perak(I) pada elektrode pasta karbon termodifikasi kuersetin (EPKQ) dengan metode voltammetri.
Hipotesis Penelitian
Kuersetin sebagai bahan pemodifikasi EPK dapat digunakan untuk meningkatkan sensitivitas pada analisis ion tembaga(II) dan perak(I) dengan metode voltammetri
METODE
Bahan
Bahan-bahan yang digunakan adalah standar Kuersetin (Sigma Aldrich), serbuk grafit, parafin cair, akua-bidestilata, K3Fe(CN)6 (Wako), KCl (Merck), AgNO3 (Merck), CuCl2·2H2O (Merck), Na2HPO4·2H2O (Merck), dan NaH2PO4·2H2O (Merck).
Alat
Peralatan yang digunakan pada penelitian ini adalah neraca analitik empat desimal, pipet mikro, pengaduk magnet, pH meter (HM-20S), galvanostat-potensiostat (e-DAQ), perangkat lunak pengolah data Echem v2.1 dan Origin 7.0, elektrode pembanding Ag/AgCl, elektrode tambahan kawat platina, kawat tembaga, pipa kapiler kaca, kertas minyak, amplas, dan alat-alat gelas.
Prosedur Penelitian
4
Preparasi Elektrode Pasta Karbon (Xia et al. 2010 dengan modifikasi)
Sebanyak 100 mg grafit dan 45 µL minyak parafin dicampurkan ke dalam mortar hingga campuran homogen. Kawat tembaga sebagai penghubung elektrode ke sumber listrik dimasukkan ke dalam tabung kaca hingga tersisa ruang kosong sekitar 5 mm pada ujung tabung untuk pasta karbon.Pasta dimasukkan ke ujung tabung hingga penuh dan padat. Permukaan elektrode dihaluskan dengan kertas minyak hingga licin dan berkilau.
Preparasi Elektrode Pasta Karbon Termodifikasi Kuersetin (Xia et al. 2010
dengan modifikasi)
Elektrode ini dibuat dengan cara standar kuersetin dengan komposisi 5% (b/b) dicampurkan dengan 95 mg serbuk grafit di dalam mortar. Sebanyak 45 µL minyak parafin ditambahkan dan diaduk merata hingga terbentuk pasta yang homogen. Kawat tembaga sebagai penghubung elektrode ke sumber listrik dimasukkan ke dalam tabung kaca hingga tersisa ruang kosong sekitar 5 mm pada ujung tabung untuk pasta karbon.Pasta dimasukkan ke ujung tabung hingga penuh dan padat. Permukaan elektrode dihaluskan dengan kertas minyak hingga licin dan berkilau.
Karakterisasi Elektrode dengan K3Fe(CN)6 (Reddaiah et al. 2012 dengan
modifikasi)
Respon elektrode diamati dalam larutan elektrolit KCl 0.1 M dengan teknik voltammetri siklik dengan laju payar 0.1 V dtk-1 pada selang potensial dari -0.5 sampai 1.0 V kemudian dikarakterisasi dengan larutan K3Fe(CN)6 1 mM secara voltammetri siklik pada selang potensial dari -0.5 sampai 1.0 V dengan laju payar 0.1 V dtk-1.
Respon Elektrode Terhadap Ion Cu(II) dan Ag(I) (Taufik 2013 dengan modifikasi)
Respon elektrode diamati dalam larutan elektrolit pendukung berupa larutan penyangga fosfat pH 4.7 dan larutan analat berupa larutan AgNO3 1 mM dan larutan CuCl2 1 mM dalam larutan penyangga fosfat pH 4.7 dengan voltammetri siklik pada laju payar 0.1 V dtk-1 dan selang potensial dari -0.5 sampai 1.0 V.
Pengaruh Ion Ag(I) pada Penentuan Ion Cu(II) (Xia et al. 2010 dengan
modifikasi)
Campuran larutan AgNO3:CuCl2 1:1 mM dalam larutan penyangga fosfat pH 4.7 dianalisis dengan voltammetri siklik. Arus puncak diamati pada laju payar 0.1 V dtk-1 dan selang potensial dari -0.5 sampai 1.0 V dengan EPK dan EPKQ. Analisis simultan dengan voltammetri lucutan pulsa diferensial dilakukan dengan selang potensial -0.5 sampai 1.0 V, laju payar 50 mV dtk-1, potensial deposisi 0 mV, dan waktu deposisi 20 detik.
Perbandingan Konsentrasi Terhadap Pengaruh Ion Ag(I) pada Penentuan Ion Cu(II) (Xia et al. 2010 dengan modifikasi)
5
Pengaruh Laju Payar (Taufik 2013 dengan modifikasi)
Respon arus analat dalam larutan penyangga fosfat pH 4.7 diamati dengan teknik voltammetri siklik pada selang potensial dari -0.5 sampai 1.0 V dengan EPKQ. Laju payar yang digunakan, diantaranya 0.05; 0.10; 0.15; 0.20; dan 0.25 V dtk-1.
Pengaruh Konsentrasi Analat (Taufik 2013 dengan modifikasi)
Respon arus analat dalam larutan penyangga fosfat pH 4.7 diamati dengan teknik voltammetri siklik pada laju payar 0.1 V dtk-1 dan selang potensial dari -0.5 sampai 1.0 V dengan EPKQ. Konsentrasi yang digunakan, diantaranya 0.1; 0.5; dan 1.0 mM.
HASIL DAN PEMBAHASAN
Kuersetin sebagai Bahan Pemodifikasi EPK
Kuersetin digunakan sebagai bahan pemodifikasi EPK untuk meningkatkan sensitivitas pada pengujian pola oksidasi reduksi tembaga(II) dan perak(I) dengan teknik voltammetri. Karakterisasi elektrode dilakukan sebelum elektrode digunakan untuk analisis analat. Larutan K3Fe(CN)6 1 mM dalam KCl 0.1 M digunakan untuk karakterisasi EPK dan EPKQ dengan voltammetri siklik dalam selang potensial -0.5 sampai 1.0 V dan laju payar 0.1 mV (Lampiran 2).
Voltammogram siklik K3Fe(CN)6 1 mM dari pengukuran dengan EPKQ menunjukkan peningkatan puncak arus anodik sebesar 5.49% dan katodik sebesar 9.10%. Potensial anodik yang dihasilkan sebesar 0.400 V pada EPK dan 0.322 V pada EPKQ sedangkan potensial katodik -0.108 V pada EPK dan -0.032 V pada EPK. Beda potensial pada EPK sebesar 0.508 V sedangkan pada EPKQ sebesar 0.354 V yang menunjukkan bahwa proses reaksi bersifat kuasireversibel yang didukung oleh nilai Ia/Ic yang lebih besar dari 1 (Lampiran 3). Reaksi oksidasi reduksi bersifat reversibel jika beda potensial lebih kecil atau sama dengan 0.0592 V dan Ia/Ic mendekati 1 (Bott dan Jackson 1996). Elektrode yang telah dipreparasi dapat digunakan untuk analisis analat dengan selang potensial -0.5 sampai 1.0 V karena dapat menunjukkan arus puncak anodik dan katodik saat digunakan untuk analisis analat yang mengalami reaksi oksidasi reduksi dan EPKQ dapat digunakan untuk meningkatkan sensitivitas pengukuran analat.
Larutan penyangga fosfat pH 4.7 digunakan sebagai pelarut analat yang berfungsi sebagai larutan elektrolit pendukung. Elektrolit pendukung berfungsi untuk melindungi ion-ion analat dan menghilangkan efek elektromigrasi. Larutan elektrolit pendukung dapat berupa asam mineral, garam anorganik, dan larutan penyangga yang bersifat murni, dan tidak mudah teroksidasi dan tereduksi agar tidak berpotensi sebagai kontaminan dan tidak memberi arus latar belakang saat analisis analat (Wang 2006).
6
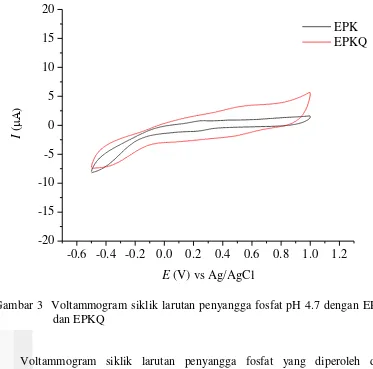
sifat elektrooksidasi kuersetin (Brett dan Ghica 2003). Voltammogram siklik dari larutan penyangga fosfat pH 4.7 (Gambar 3) tidak dihasilkan puncak arus oksidasi dan reduksi dari hasil pengukuran dengan EPK dan EPKQ. Hasil ini menunjukkan bahwa larutan buffer fosfat pH 4.7 tidak mengalami oksidasi dan reduksi pada selang potensial -0.5 sampai 1.0 V dan kuersetin dalam EPKQ tidak memberi puncak arus oksidasi dan reduksi.
Voltammogram siklik larutan penyangga fosfat yang diperoleh dari pengukuran dengan EPKQ menunjukkan peningkatan arus latar belakang dibandingkan pengukuran dengan EPK. Hasil ini menunjukkan bahwa kuersetin dapat meningkatkan sensitivitas pengukuran dan dapat digunakan sebagai pemodifikasi EPK untuk analisis analat dalam larutan penyangga fosfat pH 4.7 dalam selang potensial -0.5 sampai 1.0 V.
Respon Elektrode Terhadap Ion Cu(II) dan Ag(I)
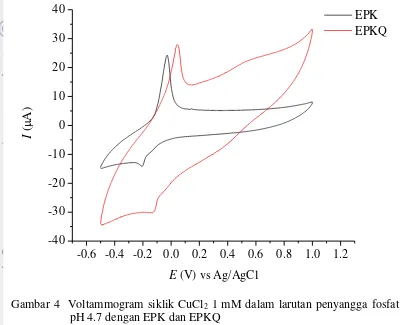
Voltammogram siklik dari larutan CuCl2 1 mM dalam larutan penyangga fosfat pH 4.7 (Gambar 4) menunjukkan satu puncak oksidasi dan satu puncak reduksi pada analisis dengan EPK dan EPKQ dalam selang potensial -0.5 sampai 1.0 V. Potensial negatif yang diberikan pada awal pemayaran diduga mengakibatkan reaksi reduksi ion Cu2+ menjadi ion Cu+. Reaksi oksidasi terjadi Gambar 3 Voltammogram siklik larutan penyangga fosfat pH 4.7 dengan EPK
7 karena pemayaran ke arah potensial positif sehingga puncak anodik yang terjadi pada -0.028 V dengan EPK dan 0.044 V dengan EPKQ diduga hasil oksidasi kembali ion Cu+ menjadi ion Cu2+. Pembalikan arah payar menuju potensial negatif diduga hasil reduksi dari ion Cu2+ menjadi ion Cu+. Puncak katodik yang dihasilkan dengan EPK berada pada -0.208 V dan -0.128 V pada EPKQ.
Tabel 1 Potensial dan arus puncak hasil analisis CuCl2 1 mM
Puncak E (V) E (V) I (µA) Ia/Ic (µA) Peningkatan dihasilkan menunjukkan bahwa reaksi oksidasi reduksi CuCl2 bersifat kuasireversibel karena beda potensial yang dihasilkam lebih besar dari 0.0592 V dan Ia/Ic lebih besar dari 1. Intensitas arus puncak anodik dan katodik mengalami Gambar 4 Voltammogram siklik CuCl2 1 mM dalam larutan penyangga fosfat
8
peningkatan pada EPKQ. Peningkatan intensitas arus puncak katodik CuCl2 lebih besar dibandingkan anodik yang menunjukkan lebih banyak ion Cu(II) yang mengalami reduksi pada EPKQ.
Voltammogram siklik dari larutan AgNO3 1 mM dalam larutan penyangga fosfat pH 4.7 (Gambar 5) menunjukkan satu puncak oksidasi dan satu puncak reduksi pada analisis dengan EPK dan EPKQ dalam selang potensial -0.5 sampai 1.0 V. Reduksi Ag+ menjadi Ag terjadi akibat pemberian potensial negatif diawal pemayaran sehingga saat potensial semakin ke arah positif terjadi reaksi oksidasi dari Ag menjadi Ag+ yang ditandai dengan puncak anodik.
Puncak anodik yang dihasilkan dengan EPK berada pada 0.364 V dan 0.378 V dengan EPKQ. Radulescu et al. (2010) melaporkan bahwa potensial puncak oksidasi Ag dalam larutan penyangga asetat pH 5.2 berada pada kisaran 0.23 sampai 0.35 V dengan elektrode karbon termodifikasi N-(2-aminoetil)-4,4'-bipiridina. Pemayaran kembali ke arah potensial negatif mengakibatkan reaksi reduksi Ag+ menjadi Ag yang ditandai dengan puncak katodik. Puncak katodik yang dihasilkan dengan EPK berada pada 0.142 V dan 0.226 V dengan EPKQ.
Tabel 2 menunjukkan potensial dan arus puncak oksidasi reduksi hasil analisis AgNO3 1 mM dengan EPK dan EPKQ. Beda potensial yang dihasilkan menunjukkan bahwa reaksi oksidasi reduksi AgNO3 bersifat kuasireversibel karena beda potensial yang dihasilkan lebih besar dari 0.0592 V dan nilai Ia/Ic lebih besar dari 1. Peningkatan intensitas arus puncak katodik AgNO3 lebih besar dibandingkan Gambar 5 Voltammogram siklik AgNO3 1 mM dalam larutan penyangga fosfat pH
4.7 dengan EPK dan EPKQ
9 anodik yang menunjukkan lebih banyak ion Ag(I) yang mengalami reduksi pada EPKQ.
Tabel 2 Potensial dan arus puncak hasil analisis AgNO3 1 mM
Puncak E (V) E (V) I (µA) Ia/Ic (µA) Peningkatan
Proses transfer elektron pada proses kuasireversibel berjalan lebih lambat dibandingkan proses reversibel yang ditandai dengan potensial puncak anodik dan katodik dengan selisih beda potensial lebih besar dari 0.0592 V dan Ia/Ic lebih besar dari 1. Reaksi oksidasi reduksi bersifat reversibel jika beda potensial lebih kecil atau sama dengan 0.0592 V dan Ia/Ic mendekati 1 (Bott dan Jackson 1996). Penurunan beda potensial dan nilai Ia/Ic pada hasil analisis CuCl2 dan AgNO3 pada EPKQ menunjukkan proses transfer elektron terjadi semakin cepat dibandingkan pada EPK tanpa kuersetin.
Penurunan beda potensial, Ia/Ic, dan peningkatan intensitas arus puncak anodik dan katodik yang terjadi pada voltammogram siklik CuCl2 dan AgNO3 hasil analisis dengan EPKQ menunjukkan bahwa kuersetin dapat digunakan sebagai pemodifikasi EPK untuk meningkatkan sensitivitas hasil analisis dalam bentuk peningkatan intensitas arus dan mempercepat proses transfer elektron reaksi okdidasi dan reduksi. Ion logam pada EPKQ lebih terakumulasi dibandingkan pada EPK karena kuersetin memiliki sisi aktif yang dapat bereaksi membentuk kompleks dengan ion logam sehingga ion logam yang teradsorpsi pada permukaan EPKQ berpeluang lebih besar untuk mengalami reaksi oksidasi reduksi.
Pengaruh Laju Payar
Voltammogram siklik yang dihasilkan dari pemberian pengaruh laju payar dapat menunjukkan tingkat sensitivitas dan proses elektromigrasi analat yang terjadi pada elektrode. Laju payar memengaruhi intensitas arus puncak oksidasi dan reduksi yang dihasilkan pada voltammogram siklik CuCl2 (Lampiran 4) dan AgNO3 (Lampiran 5).
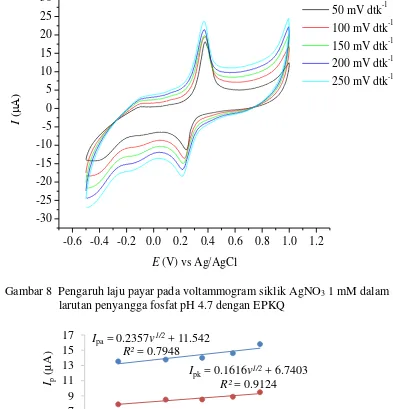
Pengaruh laju payar memengaruhi arus puncak pada voltammogram siklik pada analisis CuCl2 1 mM dalam larutan penyangga fosfat pH 4.7 (Gambar 6). Hubungan akar kuadrat laju payar (v1/2) dan arus puncak (Ip) adalah linear dengan persamaan Ipa = 2.1371 v1/2 – 1.2883 dengan R2 sebesar 0.9715 untuk arus puncak oksidasi dan Ipk = 0.8600 v1/2 – 3.0452 dengan R2 sebesar 0.9294 untuk arus puncak reduksi. (Gambar 7).
10
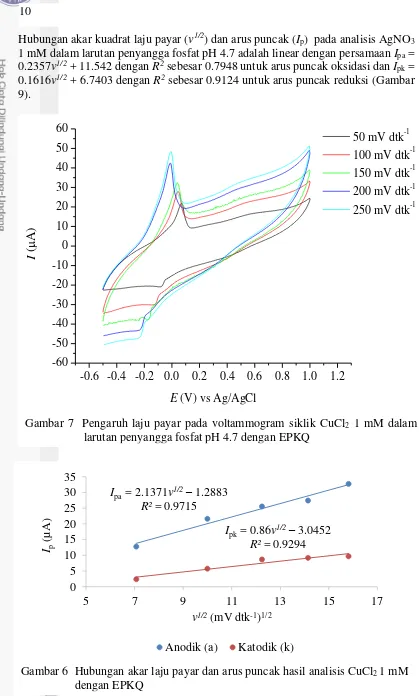
Hubungan akar kuadrat laju payar (v1/2) dan arus puncak (Ip) pada analisis AgNO3 1 mM dalam larutan penyangga fosfat pH 4.7 adalah linear dengan persamaan Ipa = 0.2357v1/2 + 11.542 dengan R2sebesar 0.7948 untuk arus puncak oksidasi dan Ipk = 0.1616v1/2 + 6.7403 dengan R2 sebesar 0.9124 untuk arus puncak reduksi (Gambar 9).
Gambar 6 Hubungan akar laju payar dan arus puncak hasil analisis CuCl2 1 mM dengan EPKQ larutan penyangga fosfat pH 4.7 dengan EPKQ
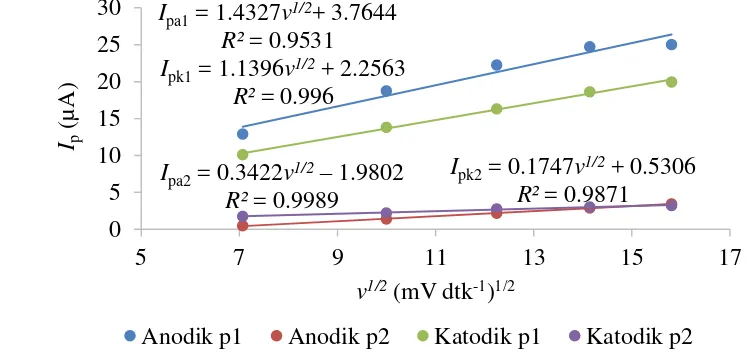
11 Peningkatan laju payar juga memengaruhi intensitas arus puncak anodik dan katodik pada voltammogram siklik yang dihasilkan dari analisis pengaruh ion Ag+ pada penentuan ion Cu2+ dengan EPKQ (Gambar 10). Intensitas arus puncak anodik dan katodik 1 dan 2 meningkat seiring peningkatan laju payar (Lampiran 6). Hubungan akar kuadrat laju payar (v1/2) dan arus puncak (Ip) pada analisis Cu:Ag 1:1 mM dalam larutan penyangga fosfat pH 4.7 adalah linear dengan persamaan Ipa1 = 1.4327v1/2 + 3.7644 dengan R2 sebesar 0.9531 dan Ipa2 = 0.3422v1/2 – 19.802 dengan R2 sebesar 0.9989 untuk arus puncak anodik 1 dan 2 sedangkan Ipk1 = 1.1396v1/2 + 2.2563 dengan R2sebesar 0.9960 dan Ipk2 = 0.1747 + 0.5306 dengan R2sebesar 0.9871 untuk puncak katodik 1 dan 2 (Gambar 11).
Gambar 8 Pengaruh laju payar pada voltammogram siklik AgNO3 1 mM dalam larutan penyangga fosfat pH 4.7 dengan EPKQ
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2
Gambar 9 Hubungan akar kuadrat laju payar dan arus puncak hasil analisis AgNO3 1 mM dengan EPKQ
12
Berdasarkan persamaan Randles-Ševčik, jika intensitas arus puncak berbanding lurus dengan laju payar menunjukkan bahwa terjadi proses difusi analat pada elektrode (Bard et al. 2010). Semakin tinggi laju payar akan mempercepat proses difusi analat pada elektrode sehingga reaksi oksidasi dan reduksi semakin cepat dan intensitas arus pun meningkat.
Gambar 10 Pengaruh laju payar pada voltammogram siklik Cu:Ag 1:1 mM dalam larutan penyangga fosfat pH 4.7 dengan EPKQ
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2
Gambar 11 Hubungan akar kuadrat laju payar dan arus puncak hasil analisis Cu:Ag 1:1 mM dengan EPKQ
13 Kuersetin di dalam EPKQ juga berperan dalam meningkatkan sensitivitas pengukuran karena kuersetin memiliki kemampuan untuk membentuk kompleks dengan ion logam. Analat dalam bentuk Ag+ dan Cu2+ yang berdifusi pada elektrode dapat bereaksi dengan kuersetin sehingga terjadi peningkatan konsentrasi analat yang meningkatkan intensitas arus puncak. EPKQ yang digunakan dalam analisis respon elektrode terhadap analat, pengaruh konsentrasi, dan laju payar merupakan elektrode yang sama, baik untuk Cu(II) maupun Ag(I) sehingga menunjukkan bahwa EPKQ yang telah dipreparasi dapat digunakan tidak hanya untuk satu kali analisis analat.
Pengaruh Konsentrasi Analat
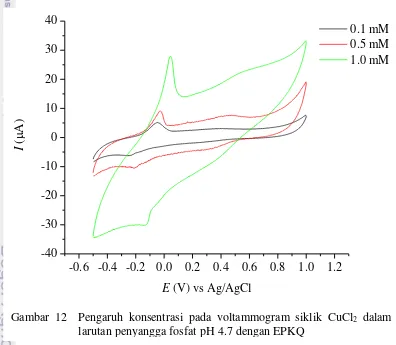
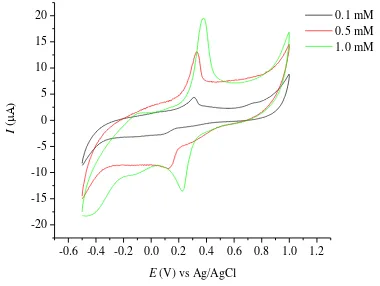
Konsentrasi analat memengaruhi intensitas arus puncak oksidasi dan reduksi yang dihasilkan pada voltammogram siklik CuCl2 (Lampiran 7) dan AgNO3 (Lampiran 8) dengan laju payar yang dibuat konstan 0.1 V dtk-1. Pengaruh konsentrasi memengaruhi arus puncak pada voltammogram siklik pada analisis CuCl2 dengan EPKQ (Gambar 12).
Hubungan konsentrasi CuCl2 dan arus puncak (Ip) adalah linear dengan persamaan Ipa = 20.4090[CuCl2]– 0.5115 dengan R2 sebesar 0.8785 untuk arus puncak oksidasi dan Ipk = 5.6656[CuCl2] – 0.3816 dengan R2 sebesar 0.8831 untuk arus puncak reduksi (Gambar 13).
Gambar 12 Pengaruh konsentrasi pada voltammogram siklik CuCl2 dalam larutan penyangga fosfat pH 4.7 dengan EPKQ
14
Peningkatan intensitas arus puncak terjadi seiring peningkatan konsentrasi AgNO3 yang dianalisis dengan EPKQ (Gambar 14). Hubungan konsentrasi AgNO3 dan arus puncak (Ip) adalah linear dengan persamaan Ipa = 12.7340[AgNO3] + 1.0556 dengan R2 sebesar 1.0000 untuk arus puncak oksidasi dan Ipk = 8.8605[AgNO3] – 0.6261 dengan koefisien determinasi (R2) sebesar 0.9822 untuk arus puncak reduksi (Gambar 15).
Gambar 13 Hubungan konsentrasi CuCl2 dan arus puncak Ipa= 20.409[CuCl2]–0.5115 larutan penyangga fosfat pH 4.7 dengan EPKQ
15
Peningkatan konsentrasi dapat meningkatkan intensitas arus puncak oksidasi dan reduksi pada hasil voltammogram siklik CuCl2 dan AgNO3. Semakin tinggi konsentrasi analat, semakin tinggi intensitas arus puncak oksidasi dan reduksi yang dihasilkan pada voltammogram siklik.
Pengaruh Ion Ag(I) pada Penentuan Ion Cu(II)
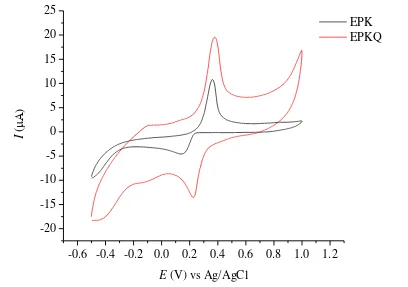
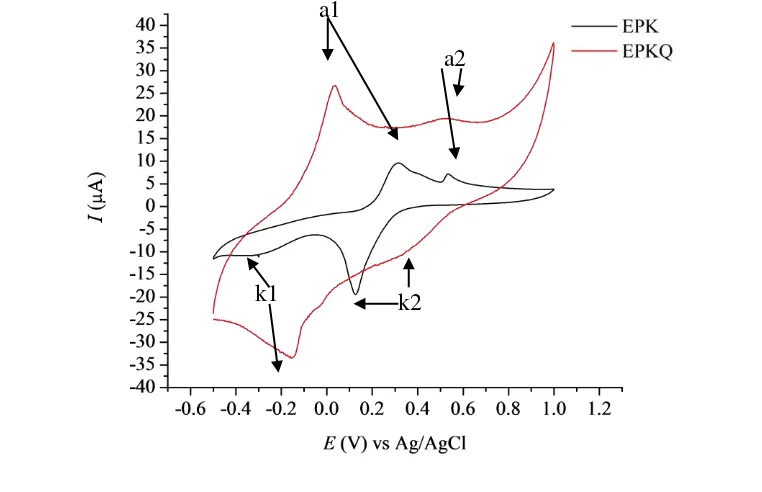
Ion Ag(I) memberikan pengaruh pada penentuan ion Cu(II) yang ditunjukkan dalam voltammogram yang dihasilkan dari analisis pencampuran CuCl2 dan AgNO3 dalam satu larutan dengan perbandingan konsentrasi 1:1 mM dalam larutan penyangga fosfat pH 4.7. Voltammogram siklik Cu:Ag 1:1 mM menghasilkan 2 pasang puncak oksidasi dan reduksi pada analisis dengan EPK dan EPKQ (Gambar 16).
Gambar 15 Hubungan konsentrasi AgNO3 dan arus puncak Ipa= 12.734[AgNO3] + 1.0556
R²= 1
Ipk= 8.8605[AgNO3]–0.6261 R²= 0.9822
0.00 5.00 10.00 15.00
0 0.5 1
Ip
(µ
A)
[AgNO3] (mM) Anodik (a) Katodik (k)
Gambar 16 Voltammogram siklik simultan Cu:Ag 1:1 mM dalam larutan penyangga fosfat pH 4.7 dengan EPK dan EPKQ
k1 a1
a2
16
Puncak anodik dan katodik 1 diduga berasal dari reaksi oksidasi dan reduksi Cu(II) sedangkan puncak anodik dan katodik 2 diduga berasal dari reaksi oksidasi dan reduksi Ag(I). Tabel 3 menunjukkan perbedaan arus dan potensial puncak anodik dan katodik yang dihasilkan dari analisis Cu:Ag 1:1 mM dengan EPK dan EPKQ. Intensitas arus yang dihasilkan dari analisis dengan EPKQ memilki intensitas yang lebih besar dibandingkan dengan EPK, kecuali puncak katodik 2 pada EPK. Puncak katodik 2 yang diduga berasal dari reduksi Ag(I) pada EPK lebih tinggi karena ion Ag(I) dan Cu(II) tidak bersaing untuk berinteraksi dengan sisi aktif kuersetin sehingga intensitas arus puncak katodik ion Ag(I) lebih tinggi.
Tabel 3 Arus dan potensial puncak dari analisis Cu:Ag 1:1 mM Elektrode
Puncak arus anodik dan katodik 1 pada EPKQ memiliki intensitas arus yang lebih besar daripada pasangan puncak anodik dan katodik 2. Hasil ini diduga berasal dari ion Cu2+ yang memiliki peluang lebih besar untuk teradsorpsi dan bereaksi dengan sisi aktif kuersetin pada permukaan elektrode daripada ion Ag+ sehingga ion Cu2+ lebih terakumulasi pada permukaan EPKQ dan sensitivitas pengukuran meningkat dengan ditandai oleh arus puncak anodik yang lebih tinggi. Torreggiani et al. (2004) dan Bukhari et al. (2009) melaporkan bahwa Cu2+ dan kuersetin dapat membentuk kompleks dengan 2 rasio logam:ligan, yaitu 1:2 dan 2:1.
Perbedaan voltammogram siklik Cu:Ag 1:1 mM, Cu(II) 1.0 mM, dan Ag(I) 1.0 mM ditunjukkan pada Gambar 17. Tabel 4 menunjukkan perbedaan arus dan potensial puncak anodik dan katodik pada voltammogram siklik Cu:Ag 1:1 mM, Ag(I) 1.0 mM, dan Cu(II) 1.0 mM yang diperoleh dengan EPKQ. Perbandingan voltammogram siklik antara Cu:Ag 1:1 mM, Cu 1.0 mM dari hasil analisis dengan EPKQ menunjukkan data potensial puncak anodik 1 pada Cu:Ag, yaitu 0.036 V berdekatan dengan puncak anodik Cu(II), yaitu 0.044 V. Puncak katodik 1 pada Cu:Ag juga berdekatan potensial katodik Cu(II), yaitu 0.156 V untuk Cu:Ag dan -0.128 V untuk Cu(II).
17
Tabel 4 Arus dan potensial puncak dari Cu:Ag, Ag(I), dan Cu(II)
Perbandingan voltammogram dari teknik voltammetri lucutan pulsa diferensial dari Cu:Ag 1:1 mM, Cu(II) 1.0 mM, dan Ag(I) 1.0 mM ditunjukkan pada Gambar 18. Voltammogram yang dihasilkan dari teknik voltammetri lucutan pulsa diferensial juga menunjukkan bahwa puncak anodik 1 Cu:Ag 1:1 mM pada -0.065 V berdekatan dengan puncak anodik Cu(II) pada -0.045 V. Puncak anodik 2 Cu:Ag 1:1 mM pada 0.355 V berdekatan dengan potensial puncak katodik Ag(I) pada 0.285 V (Tabel 5). Intensitas arus puncak anodik 1 yang diduga berasal dari Cu(II) pada voltammogram Cu:Ag 1:1 mM lebih tinggi daripada arus puncak anodik 2 yang berasal dari Ag(I).
Analat [Analat] (mM)
Ip (µA) Ep (V)
Anodik (a) Katodik (k) Anodik (a) Katodik (k)
1 2 1 2 1 2 1 2
Cu:Ag 1:1 26.72 19.44 14.14 9.50 0.036 0.518 -0.156 0.366
Ag 1.0 13.77 8.51 0.378 0.226
Cu 1.0 21.65 5.76 0.044 -0.128
Gambar 17 Voltammogram siklik Cu:Ag 1:1 mM, Cu(II) 1.0 mM, dan Ag(I) 1.0 mM dengan EPKQ
k1 a1
a2
18
h
Tabel 5 Arus dan potensial puncak oksidasi Cu:Ag, Cu(II), dan Ag(I) Analat [Analat]
(mM)
Ip (µA) Ep (V)
Anodik Anodik
1 2 1 2
Cu:Ag 1:1 2.02 0.23 -0.065 0.355
Cu 1.0 5.59 -0.045
Ag 1.0 6.16 0.285
Intensitas arus anodik Cu(II) yang lebih tinggi daripada arus anodik Ag(I) dan pergeseran potensial puncak anodik Cu(II) dan Ag(I) pada voltammogram Cu:Ag dengan perbandingan konsentrasi yang sama, yaitu 1:1 mM diduga terjadi akibat persaingan interaksi antara ion Cu(II) dan Ag(I) dengan sisi aktif kuersetin. Berdasarkan hasil analisis diduga ion Cu(II) memiliki peluang lebih besar untuk berinteraksi dengan sisi aktif kuersetin dibandingkan ion Ag(I) sehingga ion Cu(II) lebih terakumulasi dan berpeluang lebih untuk mengalami reaksi oksidasi di permukaan EPKQ.
Gugus hidroksil dan atom O dari karbonil pada kuersetin tergolong jenis basa keras sehingga interaksi dengan ion Cu2+ lebih mudah karena ion Cu2+ tergolong jenis asam batas (borderline) yang bersifat peralihan antara asam lunak dan asam keras sehingga ion Cu2+ bersifat lebih keras daripada ion Ag+. Peluang interaksi gugus hidroksil dan atom O dari karbonil pada kuersetin dengan ion Ag+ lebih
Gambar 18 Voltammogram lucutan pulsa diferensial dari Cu:Ag, Ag(I), dan Cu(II) a1
19 rendah karena ion Ag+ tergolong jenis asam lunak. Menurut Pearson (2005), asam keras akan berinteraksi lebih mudah dan kuat dengan basa keras sedangkan asam lunak akan berinteraksi lebih mudah dan kuat dengan basa lunak. Pengaruh anion-anion, seperti Cl-, NO3-, HPO42-, dan H2PO4- yang berasal dari analat dan larutan penyangga fosfat diduga berperan dalam penurunan intensitas arus puncak anodik dan reduksi karena anion-anion dapat berinteraksi dengan kation Cu2+ dan Ag+.
Perbandingan Konsentrasi terhadap Pengaruh Ion Ag(I) pada Penentuan Ion Cu(II)
Intensitas arus puncak anodik dan katodik masing-masing analat, baik ion Cu(II) maupun ion Ag(I) menunjukkan peningkatan arus seiring peningkatan konsentrasinya dalam larutan Cu:Ag 1:1; 1:0.5; dan 0.5:1 mM. Gambar 19 menunjukkan voltammogram siklik perbandingan konsentrasi Cu:Ag dalam larutan penyangga fosfat pH 4.7 dengan EPKQ, yaitu Cu:Ag 1:1; 0.5:1; dan 0.5:1 mM. Perbandingan komposisi Cu(II) dan Ag(I) berpengaruh pada arus dan potensial puncak anodik dan katodik yang dihasilkan pada voltammogram siklik Cu:Ag yang ditunjukkan pada Tabel 6.
Gambar 19 Voltammogram siklik perbandingan konsentrasi Cu:Ag dalam larutan penyangga fosfat pH 4.7 dengan EPKQ
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2 -40
-30 -20 -10 0 10 20 30
40 Cu:Ag 1:1 mM Cu:Ag 0.5:1 mM
Cu:Ag 1:0.5 mM
I
(
A)
20
Tabel 6 Arus dan potensial puncak dari Cu:Ag dengan perbandingan konsentrasi [Analat]
(mM)
Ip (µA) Ep (V)
Anodik Katodik Anodik Katodik
1 2 1 2 1 2 1 2
1:1 18.77 1.39 13.81 2.23 0.036 0.520 -0.156 0.336 1:0.5 12.39 0.70 4.14 0.19 -0.108 0.358 -0.288 0.246 0.5:1 1.53 0.55 1.06 0.23 -0.010 0.214 -0.098 0.360
Puncak anodik dan katodik 1 yang diduga berasal dari ion Cu(II) selalu menunjukkan intensitas arus lebih tinggi dalam larutan Cu:Ag 1:1; 1:0.5; dan 0.5:1 mM. Intensitas arus puncak anodik dan katodik Cu(II) yang lebih tinggi daripada arus puncak anodik dan katodik Ag(I) diduga terjadi akibat persaingan interaksi antara ion Cu(II) dan Ag(I) dengan sisi aktif kuersetin. Ion Cu(II) diduga tetap memiliki peluang lebih besar untuk berinteraksi dengan sisi aktif kuersetin dibandingkan ion Ag(I) meskipun konsentrasi ion Ag+ lebih besar sehingga ion Cu(II) lebih terakumulasi di permukaan EPKQ.
SIMPULAN DAN SARAN
Simpulan
Elektrode pasta karbon termodifikasi (EPKQ) dapat meningkatkan sensitivitas analisis dalam bentuk peningkatan intensitas arus puncak oksidasi reduksi dan proses transfer elektron reaksi oksidasi reduksi lebih cepat yang ditandai dengan penurunan beda potensial dan Ia/Ic pada hasil analisis CuCl2 dan AgNO3 dalam larutan penyangga fosfat pH 4.7. Voltammogran siklik dari ion Cu(II) dan Ag(I) masing-masing menghasilkan satu puncak anodik dan katodik yang bersifat kuasireversibel. Peningkatan laju payar dan konsentrasi analat berbanding lurus dengan peningkatan intensitas arus puncak anodik dan katodik, baik Cu(II) maupun Ag(I).
Pengaruh ion Ag(I) dalam penentuan ion Cu(II) juga dapat dilakukan dengan EPKQ. Voltammogram siklik dari larutan campuran Cu(II) dan Ag(I) menghasilkan 2 pasang puncak anodik dan katodik. Intensitas arus puncak anodik dan katodik Cu(II) selalu lebih tinggi daripada arus puncak anodik dan katodik Ag(I) meskipun konsentrasi ion Ag+ lebih besar. Peluang interaksi anion, seperti Cl-, NO3-, HPO42-, dan H2PO4- dengan kation (Cu2+ dan Ag+) dan persaingan interaksi antara Cu2+ dan Ag+ dengan sisi aktif kuersetin diduga berperan dalam perbedaan intensitas arus puncak anodik dan katodik yang dihasilkan.
Saran
21
DAFTAR PUSTAKA
Bard AJ, Stratmann M, Unwin PR, editor. 2010. Encyclopedia of Electroanalytical Techniques. New York (US): Marcell-Dekker.
Bott AW, Jackson BP. 1996. Study of ferricyanide by cyclic voltammetry using the cv-50w. Current Separations. 15(1):25–30.
Brett AMO, Ghica ME. 2003. Electrochemical oxidation of quercetin. Electroanalysis. 15(22):1745-1750.doi:10.1002/elan.200302800.
Giyatmi, Kamal Z, Melati D. 2008. Penurunan kadar Cu, Cr, dan Ag dalam limbah cair industri perak di kota gede setelah diadsorpsi dengan tanah liat dari daerah godean. Seminar Nasional IV SDM Teknologi Nuklir; 2008 Agustus 25–26; Yogyakarta, Indonesia. Yogyakarta (ID): Sekolah Tinggi Teknologi Nuklir-BATAN. Hlm 99 – 106.
Fei JJ, Wang JF, Li JN. 2001. Determination of copper in human serum by adsorptive stripping voltammetry at quercetin modified carbon paste electrode. Journal ofAnalytical Science. 17(5):375–378.
Fei JJ, Li JN, Yi FY. 2001. Determination of trace lead by adsorptive stripping voltammetry at quercetin modified carbon paste electrode. Chinese Journal of Analytical Chemistry. 29(8):916–918.
Pearson RG. 2005. Chemical hardness and density functional theory. J Chem Sci. 117(5):369–377.doi:10.1007/BF02708340.
Radulescu MC, Chira A, Radulescu M, Bucur B, Bucur MP, Radu GL. 2010. Determination of silver(I) by differential pulse voltammetry using a glassy carbon electrode modified with synthesized N-(2-aminoethyl-4,4'-bipyridine. Sensors. 10:11340–11351.doi:10.3390/s101211340.
Reddaiah K, Reddy TM, Raghu P, Swamy BEK. 2012. Electrochemical Determination of quercetin at β–cyclodextrin modified chemical sensor: a voltammetric study. Anal. Bioanal. Electrochem. 4(2):122–134.
Rojas C, Arancibia V, Gomez M, Nagles E. 2012. Simultaneous determination of antimony(III) and molybdenum(VI) by adsorptive stripping voltammetry using quercetin as complexing agent. Electroanalysis. 25(2):439–447.doi: 10.1002/elan.201200487.
Symonowicz M, Kolanek M. 2012. Flavonoids and their properties to form chelate complexes. Biotechnol Food Sci. 76(1):35–41.
Taufik M. 2013. Elektrode pasta karbon termodifikasi kuersetin untuk analisis ion tembaga (II) secara voltammetri [skripsi]. Bogor (ID): Institut Pertanian Bogor.
22
L
AMPIRAN
Voltammogram siklik dan lucutan pulsa diferensial Cu:Ag
-Respon elektrode terhadap Cu(II) dan Ag(I) dengan voltammetri siklik
Grafit + parafin Grafit + kuersetin
parafin
Elektrode pasta karbon (EPK)
-Karakterisasi dengan K3Fe(CN)6 Dihomogenkan di dalam
mortar secara terpisah
EPK dan EPKQ terkarakterisasi
EPK termodifikasi kuersetin (EPKQ)
Voltammogram siklik Cu(II) dan Ag(I)
-Analisis pengaruh Ag(I) pada penentuan Cu(II)
-Perbandingan konsentrasi terhadap pengaruh Ag(I) pada penentuan Cu(II)
-Pengaruh laju payar
-Pengaruh konsentrasi analat Voltammogram siklik Cu(II) dan Ag(I)
23 Lampiran 2 Voltammogram siklik K3Fe(CN)6 pada EPK dan EPKQ
Lampiran 3 Potensial dan arus puncak K3Fe(CN)6
Puncak Ep (V) Ep (V) Ip (µA) Ipa/Ipc (µA) Peningkatan arus (%) EPK EPKQ EPK EPKQ EPK EPKQ EPK EPKQ
Anodik
(a) 0.400 0.322
0.508 0.354
1.44 1.52
1.18 1.14
5.49 Katodik
(k) -0.108 -0.032 1.22 1.33 9.10
Contoh Perhitungan:
Ep EPK = |Epa-Epk| = |0.400 – (-0.108)| V = 0.508 V
Ipa/Ipc = (1.44/1.22) µA = 1.18 µA
Peningkatan arus = (Ipa EPKQ – Ipa EPK/Ipa EPK) × 100% = 5.49 % -0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2 -15
-10 -5 0 5 10 15 20
I
(
E (V) vs Ag/AgCl
24
Lampiran 4 Pengaruh laju payar pada analisis CuCl2 1.0 mM dengan EPKQ
v v1/2 Ip (µA) Ep(V)
Lampiran 5 Pengaruh laju payar pada analisis AgNO3 1.0 mM dengan EPKQ
v v1/2 Ip (µA) Ep (V)
Lampiran 6 Pengaruh laju payar pada analisis Cu:Ag 1:1 mM dengan EPKQ
v v1/2 Ip (µA) Ep (V) Lampiran 7 Pengaruh konsentrasi pada analisis CuCl2 dengan EPKQ
25 Lampiran 8 Pengaruh konsentrasi pada analisis AgNO3 dengan EPKQ
[AgNO3] (mM)
Ep (V) Ip (µA)
Anodik (a) Katodik (k) Anodik (a) Katodik (k)
0.1 0.308 0.076 2.30 0.60
0.5 0.328 0.126 7.47 3.18
1.0 0.378 0.226 13.77 8.51
26
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 28 maret 1992 dari ayah Abdul Azis dan ibu Kasiyati. Penulis merupakan anak pertama dari dua bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 73 Jakarta dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.