PENGEMBANGAN IMMUNOSTRIP DENGAN
MENGGUNAKAN PARTIKEL NANO EMAS UNTUK
MELACAK AFLATOKSIN M1 DALAM CONTOH SUSU
ANGRIANI FUSVITA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pengembangan Immunostrip dengan Menggunakan Partikel Nano Emas untuk Melacak Aflatoksin M1 dalam Contoh Susu adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2015
RINGKASAN
ANGRIANI FUSVITA. Pengembangan Immunostrip dengan Menggunakan Partikel Nano Emas untuk Melacak Aflatoksin M1 dalam Contoh Susu. Dibimbing oleh EKO SUGENG PRIBADI dan ROMSYAH MARYAM.
Aflatoksin M1 (AFM1) merupakan metabolit hasil hidroksilasi aflatoksin B1 (AFB1). Ketika hewan ruminansia diberi pakan yang mengandung AFB1, maka AFB1 akan termetabolisme menjadi AFM1. AFM1 bersifat toksik akut dan kronis untuk hewan dan manusia. Metabolit aflatoksin tersebut menyebabkan penyakit berbahaya, diantaranya kerusakan hati akut, sirosis hati, memicu pertumbuhan tumor dan juga teratogen. Meskipun toksisitas AFM1 lebih rendah dibandingkan senyawa induknya AFB1, tetapi senyawa ini juga bersifat karsinogenik sehingga pada tahun 2002 telah diklasifikasikan sebagai karsinogen grup 1 oleh International Agency for Research on Cancer (IARC). AFM1 ini dapat termakan oleh manusia, terutama bayi dan anak-anak melalui susu segar, susu pasteurisasi, susu UHT, susu formula, dan air susu ibu (ASI). Mengingat bahaya AFM1 terhadap kesehatan, maka melacak keberadaan AFM1 dalam susu dan hasil olahannya sangat diperlukan untuk mencegah dampaknya pada masyarakat. Teknik melacak yang digunakan berperan penting dalam menentukan aman tidaknya susu dan hasil olahannya untuk dimakan. Penelitian ini dilakukan untuk mengembangkan teknik penapisan awal dengan memurnikan antibodi, sintesis antigen AFM1-BSA, konjugasi antibodi AFM1-partikel nano emas, serta uji mutu immunostrip yang dikembangkan untuk melacak AFM1 pada contoh susu.
Kegiatan penelitian yang dilakukan meliputi pemurnian antibodi dari serum kelinci, sintesis antigen AFM1-BSA, pembuatan konjugat anti AFM1 dengan partikel nano emas, pengembangan dan uji mutu immunostrip. Antibodi yang digunakan merupakan antibodi poliklonal milik Balai Besar Penelitian Veteriner (BB LITVET) yang diperoleh dari serum kelinci yang diimunisasi dengan AFM1-BSA. Antibodi terhadap AFM1 diuji dengan teknik DBIA. Antibodi poliklonal dimurnikan melalui pengendapan menggunakan ammonium sulfat jenuh, kemudian dialisis dan difraksinasi menggunakan kolom HiTrap protein A HP. Kadar antibodi dihitung menggunakan spektrofotometer pada panjang gelombang 280 nm dan antibodi G (Ig G) dikarakterisasi menggunakan teknik SDS-PAGE. Selanjutnya, Ig G dikonjugasikan dengan partikel nano emas (AuNP). Antigen AFM1-BSA disintesis dengan cara mereaksikan AFM1 baku dan BSA melalui reaksi dengan CMO sebagai reaksi penghubung. Seluruh pereaksi yang terdiri dari antigen AFM1-BSA, konjugat anti AFM1-AuNP dan Ig G kambing anti-Ig G kelinci diterapkan pada bahan strip dan ditentukan kondisi optimumnya. Pengujian mutu immunostrip dan pelacakan AFM1 dilakukan menggunakan immunostrip yang dikembangkan dan dibandingkan dengan immunostrip komersial (Agrastrip®). Contoh susu yang digunakan pada percobaan ini sebanyak 19 contoh terdiri dari 15 contoh susu murni, lima contoh susu komersial impor dan empat contoh susu yang ditambahkan dengan 0 – 1 ng/ml AFM1 baku.
fraksinasi menunjukkan bahwa antibodi tersebut merupakan antibodi G (Ig G) dengan rantai berat dan memiliki berat molekul 150 kDa dan 168,993 kDa. Ig G yang dikonjugasikan dengan AuNP adalah fraksi ke-3 dengan kadar 1,952 mg/ml. Kondisi optimum untuk konjugasi antibodi AFM1 dengan AuNP terjadi pada pH 8,5 dan penambahan 135 µl Ig G ke dalam 100 µl AuNP (0,01M), warna yang dihasilkan sama dengan atau mendekati warna larutan AuNP sebelum direaksikan. Kandungan antibodi dan AuNP pada kondisi optimum tersebut selanjutnya digunakan sebagai dasar untuk reaksi konjugasi dengan volume yang lebih banyak, sehingga dihasilkan endapan berwarna merah keunguan setelah larutan konjugat disentrifugasi dengan kecepatan 10.000 g selama 10 menit pada suhu empat derajat Celcius. Antigen sebanyak 3,66 mg/ml diperoleh dari hasil sintesis AFM1-BSA. Berdasarkan hasil uji mutu, diketahui bahwa immunostrip yang dikembangkan dapat melacak AFM1 dengan batas terendah sebesar 0,25 ng/ml. Hasil pengujian 19 contoh susu dengan immunostrip tersebut memiliki tingkat kepekaan lebih rendah, namun memiliki tingkat kekhususan lebih tinggi dan waktu yang lebih cepat dibandingkan dengan Agrastrip®.
SUMMARY
ANGRIANI FUSVITA. Development of Immunostrip Using Nano Gold Particles for Aflatoxin M1 Detection in Milk Samples. Supervised by EKO SUGENG PRIBADI and ROMSYAH MARYAM.
Aflatoxin M1 (AFM1) is a hidroxyilated metabolite of aflatoxin B1 (AFB1) when AFB1-contaminated ratio consumed by ruminants. The metabolite will be found in milk. AFM1 have acute and chronic toxic properties for animal and human health and causes liver cancer, liver cirrhosis, and teratogenic. In 2002, the International Agency for Research on Cancer (IARC) classified AFM1 as Carcinogens Group I. Human may be intoxicated by AFM1 when consume AFM1 -contaminated milk and milk products, such as pasteurized milk, UHT milk, milk formula, and breast milk. Concerning the toxicity of AFM1, AFM1-contaminated fresh milk and milk products should be controlled importantly by farmers and milk producers. The research aimed to develop immunostrip using nano gold particles as a AFM1 screening detector in milk samples.
The research activities were conducted to purify polyclonal antibodies in immunized rabbits serum belong to Indonesian Research Center for Veterinary Sciences (BB LITVET), synthesized immunogenic AFM1 to BSA, and conjugated anti-AFM1 to nanogold particles, tested the immunostrip quality, and compared the immunostrip and commercial test strip (Agrastrip®) qualities. Polyclonal antibodies (Ig) used in the study belongs to the (BB LITVET) . The AFM1-BSA antibodies checked using DBIA and the reaction will be indicated by brown colour dot after drop dimetilaminobenzin (DAB) subtrate. The antibodies purified by ammonium sulfate precipitation technique, was dialyzed and fractinated using HiTrap protein A HP column. Antibody concentration was measured by spektrophotometer at 280 nm and was characterized by SDS-PAGE method. The Ig G was conjugated to nanogold particle (AuNP). The immunogenic AFM1-BSA was produced by synthesized AFM1 to BSA using CMO as intermediate reactions. The samples which were used in this experiment were 19 milk samples consisted of 15 local fresh milk samples, five imported milk samples, and four AFM1 spiked samples at concentration levels of 0-1 ng/ml. .
The polyclonal antibodies to antigen AFM1-BSA was detected. Antibody purification and fractination have been obtained the immunoglobulin with concentration level of 1.952 mg/ml (n=3). Using SDS-PAGE, the polyclonal antibodies were immunoglobulin G (Ig G) arranged by heavy chain with molecular weight of 150 kDa and 168.993 kDa. Antigen concentration of AFM1 -BSA synthesis were 3.66 mg/ml. The maximum composition for Ig G - nanogold particles conjugation were 135 µl of Ig G and 100 µl of nanogold particles (0.01M) at pH 8.5. Based on these result, a maximum concentration has been formulated after centrifugated by 10.000 g for 10 minutes. The AFM1-BSA synthesis obtained antigen of 3.66 mg/ml. The quality test showed the developed immunostrips were detected AFM1 with limit detection of 0.25 ng/ml. The experiment tests of 19 milk samples showed the developed immunostrips was lower sensitiviy, more specificity and shorter preparation time than Agrastrip®.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PENGEMBANGAN IMMUNOSTRIP DENGAN
MENGGUNAKAN PARTIKEL NANO EMAS UNTUK
MELACAK AFLATOKSIN M
1DALAM CONTOH SUSU
ANGRIANI FUSVITA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis :Pengembangan Immunostrip dengan Menggunakan Partikel Nano Emas untuk Melacak Aflatoksin M1 dalam Contoh Susu
Nama : Angriani Fusvita NIM : B253120021
Disetujui oleh Komisi Pembimbing
Dr. Drh. Eko S. Pribadi, MS. Ketua
Dr. Dra. Romsyah Maryam,M.Med.Sc. Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medik
Prof. Dr. Drh. Fachriyan H. Pasaribu
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2013 – November 2014 ini ialah Pengembangan immunostrip dengan Menggunakan Partikel Nano Emas untuk Melacak Aflatoksin M1 dalam Contoh Susu.
Terima kasih penulis ucapkan kepada Bapak Dr. Drh. Eko Sugeng Pribadi, MS. dan Ibu Dr. Dra. Romsyah Maryam, M.Med.Sc. yang telah banyak memberi saran dan masukan. Di samping itu, penghargaan penulis sampaikan kepada Bapak Prof. Dr. Drh. Fachriyan Hasmi Pasaribu selaku Ketua Program Studi Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan Institut Pertanian Bogor. Terima kasih kepada Kepala Balai Besar Penelitian, Bapak Dr. Drh. Hardiman, MM., yang telah memberikan kesempatan untuk penelitian di BB LITVET. Terima kasih untuk Ketua Kelti dan Staf serta teknisi Lab. Toksikologi Balai Besar Veteriner Bogor. Terima kasih untuk teman seperjuangan dalam penelitian, Drh. Ita Krisanti, atas bantuan dan dorongan semangat selama ini. Terima kasih kepada teman-teman MKM 2012 dan Forum Wacana Sultra. Semoga silaturrahim kita tetap terjalin. Ungkapan terima kasih juga saya sampaikan kepada Ayahanda Sudin, SKM. dan Ibunda Aswati Dakunde yang telah memberikan do’a dan dukungannya. Terima kasih untuk Adik-adikku Muhammad Fitrawan, ST. dan Nur Fatma Sari yang memberikan motivasi dan semangat, serta untuk teman kos pondok sholehah Neng Erlita, Setya Indra P.P., S.Kel., Suwarny Ruhi, S.Si., Drh. Murniati, Rosyunita, S.Si., dan Evi Nur Qolbaini, S.Pd., M.Si. yang telah mendukung selama penulis menyelesaikan pendidikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2015
v
Cendawan Penghasil Aflatoksin 3
Aflatoksin M1 4
Keberadaan Antibodi (Ig) Poliklonal 13
Pemurnian dan Penghitungan Kadar Ig-AFM1 14
Karakterisasi Antibodi G (Ig G) 15
Konjugasi Ig G dengan Partikel Nano Emas 16
vi
DAFTAR TABEL
Tabel 1 Batas maksimum aflatoksin M1 di beberapa negara 5
Tabel 2 Angka absorbansi dan kadar Ig G pada setiap fraksi serum kelinci yang diimunisasi dengan AFM1 15
Tabel 3 Konjugasi Ig G dengan partikel nano emas 17
Tabel 4 Hasil pengukuran spektrofotometer BSA baku dan antigen AFM1- BSA 18
Tabel 5 Analisis AFM1 pada susu menggunakan strip yang dikembangkan dengan Agrastrip® 21
Tabel 6 Perbandingan mutu strip yang dikembangkan dengan Agrastrip® pada pengukuran contoh susu 21
Gambar 9 Pola grafik fraksinasi Ig G dari serum kelinci pada kolom HiTrap Protein A HP 15
Gambar 10 Karakterisasi antibodi poliklonal yang diperoleh dengan penyuntikan AFM1 pada kelinci 16
Gambar 11 Konjugasi Ig G dengan AuNP 17
Gambar 12 Reaksi pengikatan antibodi dengan AuNP 17
Gambar 13 Persiapan konjugat AFM1-CMO dengan BSA 18
Gambar 14 Pelacakan pembentukan AFM1-CMO menggunakan kromatografi lapis tipis 18
Gambar 15 Kurva BSA baku dalam antigen AFM1-BSA 19
1
1 PENDAHULUAN
Latar Belakang
Indonesia yang beriklim tropis merupakan tempat yang sangat mendukung untuk pertumbuhan cendawan. Cendawan menyebar luas secara geografis dan bisa bersifat menguntungkan maupun merugikan bergantung pada substrat yang digunakan (Abbas 2005). Kapang Aspergillus flavus, A.parasiticus dan A.nomius menghasilkan aflatoksin yang mencemari tanaman dan hasil olahannya (Habibipour et al. 2010). Aflatoksin adalah jenis mikotoksin yang paling beracun diantara mikotoksin lainnya (Gorran et al. 2012). A.flavus hanya menghasilkan aflatoksin B, sedangkan A.parasiticus dan A. nomius menghasilkan aflatoksin B dan G (Creepy 2002;Tekinsen dan Tekinsen 2005).
Aflatoksin M1 (AFM1) merupakan hasil hidroksilasi aflatoksin B1 (AFB1). Ketika hewan ruminansia diberi pakan yang mengandung AFB1, maka toksin tersebut diubah menjadi AFM1 yang banyak ditemukan pada hasil peternakan, terutama susu. Dengan demikian, kadar AFM1 dalam susu dan hasil olahannya tergantung pada tingkat paparan dan jumlah AFB1 yang tertelan (Pei et al. 2009). AFB1 dan AFM1 bersifat toksik akut dan kronis untuk hewan dan manusia dan dapat menyebabkan penyakit berbahaya, diantaranya kerusakan hati akut, sirosis hati, memicu pertumbuhan tumor dan juga teratogen (Deshpande 2002). AFB1 dikenal sebagai hepatokarsinogen paling kuat pada mamalia (Virdis et al. 2008). Meskipun toksisitas AFM1 kurang dari senyawa induknya AFB1, akan tetapi senyawa ini juga bersifat hepatotoksik dan karsinogenik (Lee et al. 2009). Berdasarkan sifat toksisitasnya, awalnya AFM1 diklasifikasikan sebagai karsinogen grup 2B pada manusia, tetapi pada tahun 2002 diklasifikasikan sebagai karsinogen grup1 (IARC 1993; IARC 2002). Manusia dapat terpapar oleh AFM1 terutama bayi dan anak-anak, melalui susu segar, susu pasteurisasi, susu UHT, susu formula bahkan air susu ibu (Abdulrazzaq et al. 2003; Galvano et al. 2005; Widiastuti et al. 2006).
Mengingat bahaya AFM1 terhadap kesehatan, maka melacak keberadaan AFM1 di dalam susu dan hasil olahannya sangat diperlukan untuk mencegah dampaknya pada masyarakat. Teknik melacak yang digunakan berperan penting dalam menentukan aman tidaknya susu dan hasil olahannya untuk dimakan. Oleh karena itu, dibutuhkan teknik penapisan awal untuk melacak keberadaan AFM1 yang cepat, akurat dan mudah digunakan. Salah satu teknik yang dapat digunakan untuk melacak AFM1 adalah penggunaan immunostrip. Immunostrip merupakan perangkat melacak berupa teknik imunokromatografi yang berbasis pada prinsip immunoasai yang membutuhkan antigen, antibodi, dan pelacak (Darwish 2006; Liu et al. 2013). Immunostrip menggunakan partikel nano emas (gold nano particle) yang dapat melacak zat yang memiliki berat molekul rendah. Proses pelacakan terjadi melalui perpindahan contoh uji yang bereaksi dengan konjugat antibodi (Ig) dan partikel nano emas, yang selanjutnya akan bersaing dengan antigen AFM1-BSA pada zona uji yang akan menghasilkan warna. Metode immunostrip ini lebih efisien dalam hal penggunaan bahan kimia, mudah digunakan, tidak membutuhkan peralatan dan keterampilan yang khusus (Liu et al. 2013).
2
Perumusan Masalah
Kanker hati merupakan penyakit kanker dengan urutan keenam di dunia dan tingkat kejadiannya yang tinggi, sekitar 82% dari 600.000 kasus baru setiap tahunnya (Parkin et. al. 2005; Paulin et al. 2011). Pang et al. (1974) melaporkan adanya 10 kasus penderita kanker hati primer di Jakarta dari hasil tes urin dan biopsi hati penderita ditemukan aflatoksin G1 (AFG1) dan AFM1. Hal ini disebabkan karena penderita mempunyai kebiasaan mengkonsumsi makanan yang mengandung AFB1 dan AFG1.
Oleh karena itu, diperlukan pengembangan teknik melacak yang peka, cepat dan ekonomis untuk digunakan sebagai teknik penapisan awal dalam upaya mencegah terjadinya intoksikosis AFM1 pada manusia yang mengkonsumsi susu dan hasil olahannya.
Tujuan Penelitian
Tujuan penelitian ini adalah mengembangkan teknik penapisan awal dengan memurnikan antibodi, sintesis antigen AFM1-BSA, konjugasi antibodi AFM1- partikel nano emas, serta uji mutu immunostrip yang dikembangkan untuk melacak AFM1 pada contoh susu.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat mengembangkan immunostrip yang menggunakan partikel nano emas untuk dimanfaatkan sebagai alat penapisan awal melacak AFM1 dalam susu sehingga dapat memberikan informasi secara cepat kepada industri pengolahan susu dan konsumen tentang keamanan susu yang dikonsumsi.
Ruang Lingkup Penelitian
3
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah
H0 : teknik immunostrip dengan partikel nano emas dapat melacak keberadaan AFM1 pada contoh susu dan hasil olahannya.
H1 : teknik immunostrip dengan partikel nano emas tidak dapat melacak keberadaan AFM1 pada contoh susu segar dan hasil olahannya.
2 TINJAUAN PUSTAKA
Cendawan Penghasil Aflatoksin
Cendawan terbagi atas dua golongan, yaitu kapang (mold) dan khamir (yeast). Kapang merupakan jasad renik yang terdiri dari banyak sel bergabung menjadi satu (multiseluler). Inilah yang membedakannya dari bakteri dan khamir yang uniseluler (Syarief et al. 2003). Salah satunya adalah genus Aspergillus sp yang struktur mikroskopiknya memiliki hifa bersepta (bersekat) dan bercabang. Aspergillus sp. memiliki struktur konidia berbentuk oval, semi bulat, atau bulat dalam rantaian yang melekat pada fialida (sel konidiogenus) di bagian ujung konidiofor yang mengalami pembengkakan (vesikel). Fialida dapat melekat langsung pada vesikel (tipe uniseriat) atau pada struktur metula (tipe biseriat) (Samson et al. 2004). Secara makroskopik, warna koloni Aspergillus sp. beragam, seperti berwarna kuning, hijau, putih, coklat, dan hitam (Ilyas 2006).
Gambar 1 Morfologi Aspergillus sp. (Aryantha et al. 2004).
4
kacang-kacangan (almond, kacang tanah), kopra dan susu (Syarief et al. 2003; Rachmawati 2005). Komoditi pertanian yang sering digunakan sebagai bahan baku pakan ternak, seperti bungkil jagung, bungkil kacang tanah, kopra, bungkil kelapa dan biji kapas, dinilai rentan tercemari aflatoksin (Rachmawati 2005). Kerugian akibat pencemaran kapang dan aflatoksin merupakan masalah utama yang menyebabkan komiditi pertanian banyak rusak secara fisik. Kerusakan fisik komiditi tersebut terjadi oleh peningkatan pertumbuhan dan populasi kapang sehingga warna, bentuk, dan bau mengalami perubahan kandungan kimiawi (Rachmawati et al. 2004). Aflatoksin menimbulkan risiko serius bagi kesehatan manusia dan hewan (CEC 2006).
Aflatoksin M1
Mikotoksin AFM1 memiliki rumus kimia C17H1207 dengan berat molekul 328 Dalton. Mikotoksin ini menghasilkan warna fluoresensi biru lempeng kromatografi lapis tipis yang disinari dengan UV, memiliki titik lebur 299 oC dan ratention factor (Rf) =
0,40 (Syarief et al. 2003).
Gambar 2 Struktur kimia aflatoksin AFM1 (Li et al. 2009).
Pembentukan AFM1 terjadi di hati dan disekresikan menjadi susu oleh sapi perah. AFB1 sekali dicerna oleh mamalia dengan cepat diserap oleh saluran pencernaan dan muncul sebagai metabolit AFM1 dalam darah setelah 15 menit (Moschini et al.2007; Pei et al. 2009). Jadi, ketika mamalia diberi makan dengan pakan yang mengandung AFB1, maka akan diubah menjadi AFM1. Tingkat perubahan AFB1 tertelan untuk AFM1 sangat beragam di antara spesies hewan, seperti dalam kisaran 0,5 sampai 5% , dan 6% pada sapi perah. Asupan harian ≥ 70 mg pada sapi yang teridiri dari kacang-kacangan dan biji kapas yang tercemar mikotoksin memberikan tingkat AFM1 dalam susu lebih besar dari batas yang diterima (Sangdokmai et al. 2011). Paparan AFM1 pada tingkat nanogram per hari terjadi terutama melalui minum susu yang tercemar AFM1. Pencemaran AFM1 pada susu dapat membahayakan kesehatan manusia yang mengkonsumsinya (IARC 2002).
5
Gambar 3 Jalur biotransformasi AFB1 oleh enzim sitokrom P-450 (Xia et al. 2013). Aflatoksin Mpertama kali ditemukan pada susu sehingga diberi nama aflatoksin M yang berasal dari kata milk. Aflatoksin M1 merupakan turunan dari 4-hidroksi aflatoksin B1 dan Aflatoksin M2 merupakan turunan dari 4-dihidroksi aflatoksin B2 (Syarief et al. 2003; Yu 2012). Aflatoksin M1 memiliki sifat yang stabil pada pemanasan pasteurisasi dan pensucihamaan (Prandini et al. 2009). AFM1 bersifat termotoleran sehingga pemanasan mencapai 200 oC belum mampu menghilangkan kandungan aflatoksin (Syarief et al. 2003). Sifat fisik seperti ini muncul karena aflatoksin merupakan senyawa yang tersusun atas kumarin dan cincin furan rangkap dua (Li et al. 2009).
Susu merupakan minuman paling digemari masyarakat di berbagai negara, termasuk di Indonesia. Laporan tercemarnya AFM1 dalam susu di Indonesia sangat terbatas. Nuryono et al. (2009) melaporkan 100% contoh susu segar yang diperiksa dari Provinsi Daerah Istimewa Yogyakarta mengandung AFM1, Namun kadar cemarannya masih rendah, yakni rata-rata 0,00853 ng/ml dan tidak ada contoh yang melampaui batas maksimum yang ditetapkan oleh Uni Eropa sebesar 0,05 ng/ml. Adanya cemaran AFM1 pada susu dan produk olahannya, walaupun dalam kadar rendah, menimbulkan risiko bagi kesehatan masyarakat yang mengkonsumsinya, terutama anak-anak (Sangdokmai et al. 2011). Batas maksimum AFM1 di beberapa negara tertera pada Tabel 1.
Tabel 1. Batas maksimum AFM1 di beberapa negara)
Negara Hasil olahan pangan AFM1 (µg/kg)
Uni Eropa Susu segar, susu pasteurisasi, dan
hasil olahannya 0,05*
Amerika serikat Susu 0,5*
China Susu dan hasil olahannya 0,5*
Brazil Susu cair 0,5*
Paraguay Susu bubuk 5,0*
Afrika Selatan Susu 0,05*
Indonesia Susu dan hasil olahannya 0,5**
6
Antibodi dan Antigen
Antibodi merupakan protein globulin yang dikenal sebagai immunoglobulin (Ig). Immunoglobulin berfungsi mengikat antigen dan mengantarkannya ke sistem efektor pemusnahan. Immunoglobulin dibentuk oleh sel plasma berasal dari proliferasi sel B yang terjadi setelah kontak dengan antigen. Semua molekul immunoglobulin mempunyai empat rantai polipeptida dasar yang terdiri atas dua rantai berat (heavy chain) dan dua rantai ringan (light chain) identik seperti yang terpapar pada Gambar 4. Setiap rantai ringan dihubungkan dengan rantai berat melalui ikatan disulfida (S-S) (Radji 2010; Baratawidjaja dan Rengganis 2012).
Gambar 4 Struktur antibodi (Burmester dan Pezzutto 2003).
Ada dua jenis rantai ringan, yakni kappa dan lambda, yang tersusun atas 230 asam amino dan lima jenis rantai berat yang tersusun atas 450-600 asam amino sehingga berat dan panjang rantai berat tersebut dua kali rantai ringan. Immunoglobulin terdiri dari lima kelas, yakni Ig M, Ig G, Ig E, Ig A dan Ig D. Rantai berat (Baratawidjaja dan Rengganis 2012).
Antibodi adalah bahan biologik yang digunakan untuk immunoassai. Ada tiga kelompok antibodi berdasarkan cara menghasilkannya, yaitu antibodi poliklonal antibodi monoklonal dan antibodi rekombinan. Antibodi poliklonal dihasilkan dari proses immunisasi dengan antigen. Antigen aflatoksin yang telah disintesis dengan protein pembawa digunakan untuk menghasilkan antibodi poliklonal pada hewan coba. Hewan coba yang sering digunakan untuk menghasilkan antibodi poliklonal, diantaranya kelinci, hamster, marmut, kuda, domba, kambing dan ayam. Antibodi poliklonal terhadap aflatoksin yang biasa dihasilkan adalah antibodi poliklonal terhadap aflatoksin B1, aflatoksin M1 dan aflatoksin G1 (Koivunen dan Krogsrud, 2006; Li et al. 2009). Antibodi monoklonal dihasilkan dari hibridoma positif yang dihasilkan dengan cara menggabungkan sel myeloma dengan sel-sel limfa tikus yang diimmunisasi. Antibodi monoklonal hanya memiliki satu jenis struktur yang dapat mengikat molekul. Antibodi rekombinan dihasilkan tanpa hewan coba karena dihasilkan dari gen fungsional yang dapat dikloning dan disisipkan ke dalam sel prokariotik atau eukariotik (Li et al. 2009).
7
disebut hapten. Antigen lengkap adalah antigen yang merangsang tanggap kebal dan bereaksi dengan hasilnya. Sedangkan antigen tidak lengkap atau hapten hanya dapat menginduksi tanggap kebal setelah terlebih dahulu berikatan dengan molekul besar. Namun hapten dapat bereaksi dengan hasilnya (Radji 2010; Baratawidjaja dan Rengganis 2012). Protein pembawa yang digunakan untuk merangsang tanggap kebal hewan agar dapat menghasilkan antibodi anti-aflatoksin, diantaranya bovine serum albumin (BSA), Ovalbumin (Ova) dan keyhole limpet hemocyanin (KLH) (Rachmawati 2005; Wang et al. 2011; Liu et al. 2013).
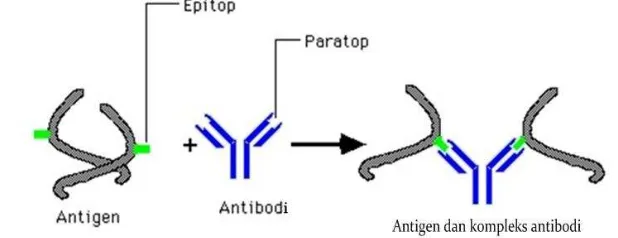
Hubungan antara antibodi dan antigen dapat diibaratkan seperti kunci dan gemboknya. Setiap antibodi spesifik berikatan dengan antigen tertentu seperti yang tertera pada Gambar 5. Setiap ujung dari “Y” antibodi mengandung paratop (strukturnya seperti gembok) yang bersifat spesifik untuk suatu epitop atau antigen determinan (bentuknya seperti kunci), yaitu suatu bagian dari antigen yang secara langsung berikatan dengan antibodi. Jadi, kedua bagian ini berikatan bersama secara tepat.
Gambar 5 Hubungan antibodi dan antigen (Perez 2015)
Partikel Nano Emas (AuNP)
8
kemampuan menghantarkan panas dengan baik, bersifat optik, penerapan katalitik dan afinitas tinggi untuk mengikat molekul amina atau molekul yang mengandung tiol (Cao et al. 2011).
Gambar 6 Ragam warna koloid partikel nano emas (AuNP) (Nanocomposix 2015) Saat ini, AuNP sedang menjadi perhatian serius untuk penerapan di bidang teknologi nano, elektronik nano, dan bioelektronik nano. Pembuatan label/konjugat untuk antibodi pun juga menggunakan AuNP sehingga meningkatkan peluang kepastian ikatan antara antibodi dan antigen.
Immunostrip
Immunostrip adalah alat yang cukup peka dan tepat untuk digunakan sebagai penapisan. Immunostrip dapat dijadikan sebagai perangkat melacak dengan menggunakan teknik imunokromatografi. Teknik ini dapat melacak ada atau tidaknya analit sasaran dalam suatu contoh yang diperiksa berdasarkan reaksi kapilaritas. Immunostrip biasanya menggunakan matriks membran nitroselulosa (Ijeh 2011). Perangkat ini sudah banyak diterapkan di bidang klinis, industri pertanian, industri makanan, dan laboratorium pertahanan biologi dan lingkungan. Sejumlah penyakit menular sudah dapat dilacak menggunakan immunostrip, seperti human immunodeficiency virus (HIV), sifilis, chikungunya. hepatitis B dan E.
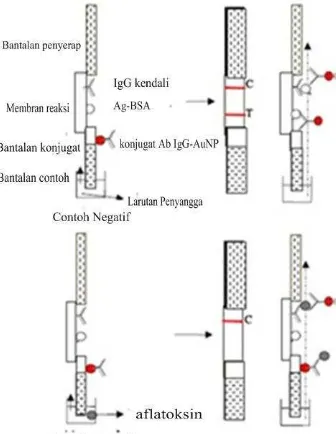
Immunostrip dapat melacak aflatoksin dengan berbagai metode dan salah satunya adalah dengan metode kompetitif tidak langsung yang terpapar pada Gambar 7. Komponen-komponen immunostrip terdiri dari
a. bantalan contoh (sample pad), yaitu bantalan penyerap untuk contoh uji yang akan diperiksa
b. bantalan konjugat (conjugated pad), yaitu bantalan yang mengandung antibodi khusus untuk menangkap analit sasaran, biasanya berkonjugasi dengan partikel nano emas.
c. membran reaksi, yaitu membran untuk reaksi immunologik yang terbuat dari nitroselulosa. Bagian ini terdiri dari zona uji mengandung antigen yang disintesis dengan BSA dan zona kendali yang mengandung antibodi spesifik.
9
Gambar 7 Komponen strip LFIA (Li et al. 2009)
3 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan September 2013 sampai November 2014 di Laboratorium Toksikologi dan Mikologi, Balai Besar Penelitian Veteriner Kementerian Pertanian Republik Indonesia (BB LITVET) Jl. RE. Martadinata Bogor, Jawa Barat.
Bahan
10
Alat
Alat yang digunakan adalah pipet mikro (eppendorf), spektrofotometri UV Vis DMS 80, lemari pendingin (SHARP®), kolom HiTrap Protein A HP (Amersham pharmacia biotech), Hitachi Micro Ultracentrifuge CS150NX, vortex mixer, hot plate, kantong dialisis MEMBRA-CEL® MD10 14 x 100 CLR, erlenmeyer, alat kocok (shaker), labu ukur, tabung eppendorf, mini vertical slab gel/ Biorad Laboratories, tabung reaksi, gelas ukur, Rotavapor, magnet pengaduk (magnetic stirrer), lemari pendingin (refrigerator) dan inkubator.
Metode Penelitian
Antibodi (Ig) Poliklonal
Antibodi (Ig) poliklonal yang digunakan adalah antibodi milik BB LITVET. Hewan coba kelinci yang digunakan untuk menghasilkan Ig poliklonal mendapatkan jadwal dan metode immunisasi yang sama seperti yang dijelaskan oleh Wang et al. (2011). Kelinci disuntik 250 µg konjugasi AFM1- Bovine Serum Albumin (BSA) dalam satu mililiter 0,01 M phosphat buffer saline (PBS) yang dicampur dengan satu mililiter Freund Complete Adjuvant (FCA) secara intradermal di sekitar 30 tempat di tubuhnya. Penyuntikan ke-2 untuk tujuan mendorong kerja antigen dilakukan secara subkutan di empat tempat di paha kelinci. Contoh darah dikumpulkan setiap bulan yang diambil melalui pembuluh darah vena dari telinga kelinci dalam jangka waktu sepuluh hari setelah penyuntikan ke-2. Serum dipisahkan dan selanjutnya dilakukan pengujian keberadaan Ig poliklonal menggunakan teknik dot blot immunoassay.
Pengujian Keberadaan Antibodi (Ig) Poliklonal
11
Pemurnian dan Penghitungan Kadar Antibodi
Pemurnian Ig poliklonal dilakukan dengan teknik dialisis dan fraksinasi menggunakan kolom HiTrap Protein A HP (Amersham Biosciences). Serum yang telah diendapkan dengan ammonium sulfat jenuh dimasukkan ke kantong dialisis dan direndam selama tiga hari di dalam PBS pH 7,6 pada suhu empat derajat Celcius. Larutan penyangga diganti setiap hari hingga tidak terdapat lagi ion sulfat di dalam larutan PBS terakhir yang diganti. Pemeriksaan ion sulfat dilakukan dengan cara menambahkan larutan barium klorida (BaCl2) 5%. Apabila larutan PBS yang ditambahkan larutan BaCl2 5% menjadi bening, hal ini menandakan tidak ada lagi ion sulfat.
Proses fraksinasi dilakukan menggunakan kolom HiTrap Protein A HP. Kolom diisi dengan 25 ml larutan penyangga fosfat dan membilas kembali dengan 50 ml larutan penyangga fosfat. Sebanyak dua mililiter larutan antibodi yang telah didialisis dimasukkan ke dalam kolom dan kemudian ditambahkan 8,0 ml larutan penyangga fosfat ke dalam kolom yang sama. Kolom yang sama dicuci dengan 35 ml larutan penyangga fosfat. Antibodi dielusi dengan 20 ml larutan penyangga sitrat dan sebanyak dua mililiter fraksi ditampung ke dalam botol penampung berisi larutan penyangga tris-HCL. Kadar antibodi (Ig G) yang telah dimurnikan dari tiap-tiap fraksi diukur dengan spektrofotometer UV Vis pada panjang gelombang 280 nm dan dihitung menggunakan rumus
Kadar Ig G = Absorbansi 280 x faktor pengenceran 1,35
(Garg 2008).
Karakterisasi Antibodi G (Ig G)
12
Konjugasi Ig G dengan Partikel Nano Emas (AuNP)
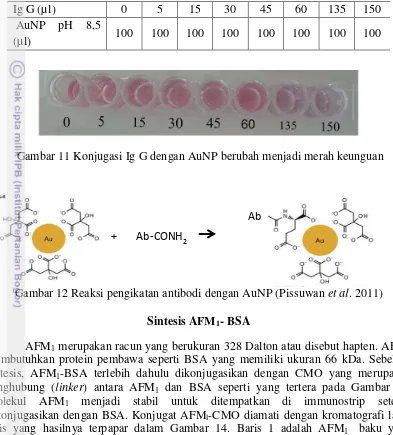
Kondisi optimum untuk konjugasi antibodi AFM1 dengan partikel nano emas (AuNP) terjadi pada pH 8,5 dan penambahan 135 µl Ig G ke dalam 100 µl AuNP (0,01M) sampai warna yang dihasilkan sama dengan atau mendekati warna larutan AuNP sebelum direaksikan. Kandungan antibodi dan AuNP pada kondisi optimum tersebut selanjutnya digunakan sebagai dasar untuk reaksi konjugasi dengan jumlah yang lebih banyak. Sebanyak 8,1 ml antibodi Ig G anti AFM1 dengan kadar 1,952 mg/ml dikonjugasikan ke dalam enam mililiter koloida emas (gold colloidal) (Fitzgerald®) pada titik isoelektrik dari antibodi yang digunakan. Antibodi akan terikat dengan partikel koloida emas pada sisi Fragment crytalizable (Fc). Selanjutnya menambahkan 720 µl BSA 10% pada tabung eppendorf dan mengocoknya selama satu jam dan mensentrifugasinya selama 45 menit dengan kecepatan 10.000 g pada suhu empat derajat Celcius. Mengambil pelet dan membuang supernatannya. Kemudian menambahkan 600 µl larutan penyangga borat pH 7,2 yang berisi 1% BSA, 1% sukrosa dan 0,05% sodium azide. AuNP yang telah terkonjugasi dengan antibodi anti AFM1 disimpan pada suhu empat derajat Celcius.
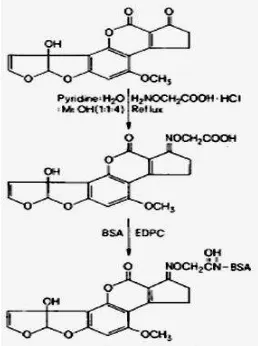
Sintesis AFM1- BSA
Pemeriksaan sintesis AFM1-BSA dilakukan menggunakan metode yang dikembangkan oleh Wang et al. (2011). 0,5 mg AFM1 ditambahkan 1,5 mg carboxymethoxylamine (CMO) dan dilarutkan dengan larutan reflux (satu mililiter piridin, empat mililiter metanol, satu mililiter air suling). Kemudian diaduk selama dua setengah jam menggunakan magnet pengaduk dan diinkubasi semalaman di suhu 30 oC. Setelah itu dikeringkan dan diputar dengan alat rotavavor sampai mendapatkan satu mililiter. Konjugasi AFM1-CMO di teteskan pada silika jel untuk diamati dengan kromatografi lapis tipis (KLT) pada panjang gelombang 365 nm. Pengerukan pada jel silika di titik retention factor (Rf) = 0,4 dan kemudian dilarutkan dalam kloroform serta
disentrifugasi pada kecepatan 4000 rpm. Supernatan diambil dan dimasukkan pada vial untuk dikeringkan. Vial berisi AFM1-CMO yang telah dikeringkan ditambah dengan 0,1 g carbodiimide (EDC), 0,08 g N hydroxysuccinimide (NHS), dua mililiter N’N Dimethylformamide (DMF) dan diaduk dengan magnetik stirer selama 2 jam pada suhu 30 oC. Setelah itu ditambahkan 0,15 g BSA dan satu mililiter natrium bikarbonat 0,1 M pH 8,3. Selanjutnya campuran reaksi dalam botol didialisis menggunakan larutan PBS selama 72 jam dengan dua kali pertukaran larutan penyangga. Setelah proses dialisis selesai, campuran dikumpulkan untuk diukur menggunakan spektrofotometer UV Vis pada panjang gelombang 280 nm. Rumus untuk mengetahui nilai Rf dengan
menggunakan rumus
Rf = jarak yang ditempuh oleh senyawa
13
Pelacakan AFM1 Menggunakan Immunostrip
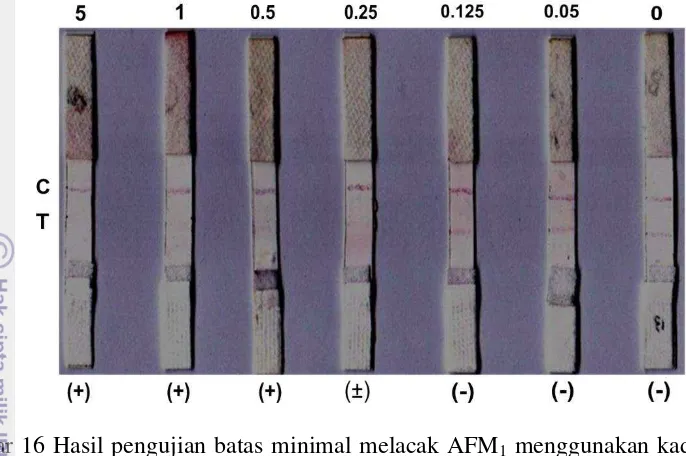
Kertas yang digunakan untuk pembuatan immunostrip adalah membran nitroselulosa atau kertas saring Whatman Fusion 5 (Kolosova et al. 2007; Shim et al. 2009). Strip imunokhromatografi terdiri dari tiga bantalan, yakni bantalan contoh, bantalan konjugat, dan bantalan penyerap; dan satu membran nitroselulosa (membran reaksi) dengan zona uji dan zona kendali. Sebanyak 0,5 ml AFM1-BSA (3,66 mg/ml) dan 1,0 ml Ig G kambing anti- Ig G kelinci (0,5 mg/ml) diteteskan di titik zona uji dan kendali di membran nitroselulosa. Contoh susu yang akan diperiksa diteteskan ke bantalan contoh dan dibiarkan selama 10-15 menit. Percobaan ini dilakukan juga dengan menggunakan AFM1 baku dengan kadar 0 – 5 ng/ml yang diterapkan pada immunostrip.
Pengujian mutu Immunostrip
Melacak AFM1 pada contoh susu diawali dengan memasukkan 10 ml contoh susu ke tabung sentrifus dan disentrifugasi pada suhu 10 oC selama 10 menit dengan kecepatan 3.000 g. Lapisan lemak dibuang dan lapisan jernih diteteskan pada immunostrip (Habibipour et al. 2010). Hasil pelacakan dengan immunostrip yang dikembangkan ini akan dibandingkan dengan immunostrip komersial, Agrastrip® dengan melihat parameter tingkat kepekaan (sensitivitas) dan kekhususan (spesifisitas). Pengujian selanjutnya dilakukan dengan statistik kappa terhadap dua uji yang dilakukan. Contoh uji yang digunakan dalam pengujian ini adalah 15 contoh susu murni, lima contoh susu komersil impor dan empat contoh susu yang diimbuhi dengan 0-1 ng/ml AFM1 baku. Penghitungan kepekaan dan kekhususan dilakukan
Data yang diperoleh dari penelitian ini akan dianalisa secara deskriptif dan statistik kappa.
4 HASIL DAN PEMBAHASAN
Keberadaan Antibodi (Ig) Poliklonal
14
terlihat warna coklat setelah bereaksi dengan substrat DAB. Aulanniam (2005) memaparkan bahwa kompleks antibodi yang terlarut dalam serum dengan antigen dapat terdeteksi dengan penambahan konjugat atau anti terhadap antibodi yang dilabel enzim. Hasil tersebut memperkirakan bahwa antibodi yang dihasilkan memiliki kadar yang tinggi karena warna coklat yang dihasilkan begitu pekat. Menurut Pertiwi et al. (2009), mutu dari warna dot blot yang ditampilkan menunjukkan seberapa tinggi kadar antibodi terhadap antigen yang dilapiskan pada membran nitroselulosa.
Gambar 8 Ig poliklonal dengan uji DBIA
Pemurnian dan Penghitungan Kadar Ig-AFM1
15
Tabel 2 Angka absorbansi dan kadar Ig G pada setiap fraksi serum kelinci yang diimunisasi dengan AFM1
Fraksi Absorbansi (280 nm) Kadar Ig G (mg/ml)
F1 0,630 0,467
F2 0,649 0,481
F3 2,639 1,952
F4 2,406 1,782
F5 1,187 0,879
F6 0,552 0,409
F7 0,273 0,202
F8 0,203 0,150
F9 0,139 0,103
F10 0,107 0,079
Total 6,504
Gambar 9 Pola grafik fraksinasi Ig G dari serum kelinci pada kolom HiTrap Protein A HP.
Karakterisasi Antibodi G (Ig G)
16
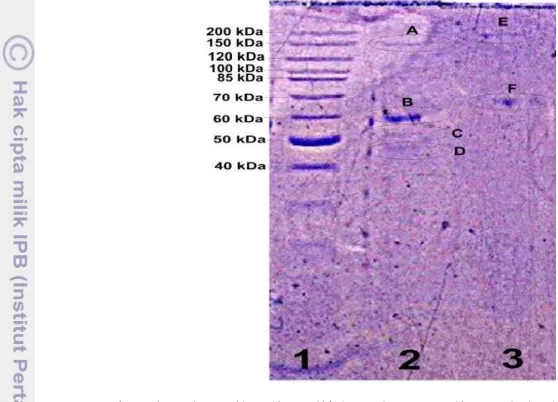
molekul 60 kDa dan 28 kDa juga pernah didapatkan oleh Nikolayenko et al. (2005). Copestake et al. (2006) melaporkan bahwa Ig G baku membentuk 5 pita dengan 2 pita dominan pada 60 kDa (rantai berat) dan 30 kDa (rantai ringan), dua pita berada pada ukuran >94 kDa, dan satu pita lainnya berada pada ukuran <60 kDa. Hasil elektroforesis ini menegaskan bahwa hanya ada satu jenis antibodi saja pada fraksi dari serum kelinci, yaitu Ig G dengan rantai berat.
Gambar 10Karakterisasi antibodi poliklonal yang diperoleh dengan penyuntikan AFM1 pada kelinci. penanda (Baris 1), Fraksi 3 (Baris 2), Fraksi 1 (Baris 3)
Konjugasi Ig G dengan Partikel Nano Emas
17
asam sitrat pada larutan partikel nano seperti yang tertera pada Gambar 12 (Zhao et al. 2010; Pissuwan et al. 2011).
Tabel 3 Konjugasi Ig G dengan partikel nano emas (AuNP)
Ig G (µl) 0 5 15 30 45 60 135 150
AuNP pH 8,5
(µl) 100 100 100 100 100 100 100 100
Gambar 11 Konjugasi Ig G dengan AuNP berubah menjadi merah keunguan
Gambar 12 Reaksi pengikatan antibodi dengan AuNP (Pissuwan et al. 2011)
Sintesis AFM1- BSA
AFM1 merupakan racun yang berukuran 328 Dalton atau disebut hapten. AFM1 membutuhkan protein pembawa seperti BSA yang memiliki ukuran 66 kDa. Sebelum sintesis, AFM1-BSA terlebih dahulu dikonjugasikan dengan CMO yang merupakan penghubung (linker) antara AFM1 dan BSA seperti yang tertera pada Gambar 13. Molekul AFM1 menjadi stabil untuk ditempatkan di immunostrip setelah dikonjugasikan dengan BSA. Konjugat AFMl-CMO diamati dengan kromatografi lapis tipis yang hasilnya terpapar dalam Gambar 14. Baris 1 adalah AFM1 baku yang memiliki Rf = 0,89 dan Baris 2 adalah AFM1-CMO yang terdiri dari dua spot. Penanda A adalah AFM1-CMO yang terbentuk sempurna karena memiliki Rf = 0,42. Harder dan
Chu (1979), memperoleh hasil perhitungan Rf yang hampir sama sebesar 0,43. Hasil
pengukuran BSA pada konjugasi AFM1-BSA menggunakan larutan baku BSA dengan kadar 0, 0,25, 0,5, 1,0 dan 2,0 ng/ml dan diukur dengan menggunakan spektrofotometer. Hasil pengukuran absorbansi dan penghitungan BSA terpapar pada Gambar 15 dan Tabel 4. Dari data tersebut diperoleh persamaan regresi linier y = 0,431x + 0,056 dan menggunakan persamaan itu, maka diperoleh kadar BSA dalam antigen AFMl-BSA sebesar 3,66 mg/ml.
+ Ab-CONH 2
18
Gambar 13 Persiapan konjugat AFM1-CMO dengan BSA
.
Gambar 14 Pelacakan pembentukan AFM1-CMO menggunakan kromatografi lapis tipis. 1 = AFM1 baku; 2 = AFM1-CMO
Tabel 4 Hasil pengukuran spektrofotometer BSA baku dan antigen AFM1-BSA Bahan yang dipakai Absorbansi (280 nm)
Blanko (PBS 0,01 M) 0
BSA (0,25 mg/ml) 0,183
BSA (0,5 mg/ml) 0,309
BSA (1 mg/ml) 0,511
BSA (2 mg/ml) 0,896
19
Gambar 15 Kurva BSA baku dalam antigen AFM1-BSA
Pengujian Mutu Immunostrip
20
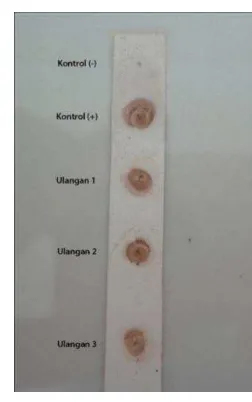
Gambar 16 Hasil pengujian batas minimal melacak AFM1 menggunakan kadar AFM1 baku. Keterangan: + = Positif; − = negatif; ± = dubius (antara positif dan negatif; C = zona kendali; T= zona uji
Pelacakan AFM1 pada Susu Menggunakan Immunostrip
21
Tabel 5 Analisis AFM1 pada susu menggunakan strip yang dikembangkan dengan Agrastrip®
Kode contoh Agrastrip® Strip yang
dikembangkan kepekaan dan kekhususan dari Agrastrip® sebesar 68,42% dan 31,58%. Sedangkan Nilai kepekaan dan kekhususan dari strip yang dikembangkan sebesar 63,16% dan 36,84%. Hasil tersebut menunjukkan Agrastrip® memiliki nilai kepekaan yang lebih tinggi dibandingkan dengan strip yang dikembangkan, tetapi berbeda dengan nilai kekhususan. Proses penyiapan strip yang dikembangkan untuk memeriksa contoh uji hingga pembacaan hasil membutuhkan waktu kurang lebih 25 menit dan dapat dilakukan dimana pun karena bentuk stripnya yang efisien. Sedangkan proses penyiapan Agrastrip® membutuhkan waktu kurang lebih 35 menit. Agrastrip® memiliki bentuk yang tidak efisien karena konjugat dan stripnya terpisah. Konjugat berada dalam sumur mikro dan membutuhkan inkubator untuk proses penghambatan dengan pemanasan. Tabel 6 Perbandingan mutu strip yang dikembangkan dengan Agrastrip® pada
pengukuran contoh susu
Pengujian Kepekaan Kekhususan Waktu
Agrastrip® 68,42% 31,58% ± 35 menit
22
mengurangi kadar AFM1 pada susu dan juga dapat memberikan informasi kepada peternak sapi perah untuk lebih memperhatikan dalam proses pemberian pakan. Menurut Gimeno dan Martins (2006), AFM1 memunculkan risiko bagi kesehatan manusia karena dapat menyebabkan kanker, gangguan perkembangan janin, dan mutasi gen. AFM1 dapat juga menekan sistem kekebalan tubuh karena menghambat proses fagositosis dan sintesis protein. Proses sintesis protein yang terjadi di ribosom, DNA dan RNA akan mengalami gangguan sehingga menyebabkan penyerapan asam amino di hati akan terganggu.
Pengujian statistik kappa digunakan apabila ada dua uji yang dilakukan dan tidak ada baku emas (gold standard) (Viera dan Garrett 2005). Berdasarkan hasil interpretasi nilai kappa bahwa perbandingan kedua strip hampir sempurna (almost perfect) karena nilainya > 0,81 seperti tertera pada Tabel 7. Hal ini berarti bahwa immunostrip yang dikembangkan dapat digunakan untuk pengujian AFM1 dan dapat menggantikan Agrastrip®.
Ig G yang dihasilkan cukup murni untuk di konjugasikan dengan partikel nano emas sehingga dapat digunakan sebagai penanda pada immunostrip. Hasil sintesis antigen AFMl-BSA memiliki kadar yang cukup tinggi untuk immunostrip pada zona uji. Immunostrip dengan menggunakan partikel nano emas yang dikembangkan memiliki batas melacak AFMl terendah sebesar 0,25 ng/ml. Strip yang dikembangkan memiliki tingkat kepekaan lebih rendah, tingkat kekhususan lebih tinggi dan waktu persiapan yang lebih sedikit dibandingkan Agrastrip®. Immunostrip yang dikembangkan dapat menggantikan Agrastrip® komersial untuk melacak AFM1.
Saran
Saran yang dapat diberikan dari informasi yang diperoleh dalam penelitian ini adalah:
1. Perlu pembacaan intensitas warna yang dihasilkan dengan strip pembaca kuantitatif. 2. Perlu dilakukan validasi lengkap immunostrip diantaranya pengujian reaksi silang, kecermatan, keseksamaan, linearitas mutu immunostrip untuk mengetahui batas tertinggi dan terendah melacak AFM1 sertamembandingkan dengan pengujian yang bersifat kuantitatif seperti High performance liquid chromatography (HPLC) atau enzyme-linked immunosorbent assay (ELISA).
23
6 DAFTAR PUSTAKA
Abbas HK. 2005. Aflatoxin and Food Safety. London:Taylor and Francis Group LLC.. Abdullah M. 2009. Pengantar Nanosains. Bandung: ITB Bandung.
Abdulrazzaq YM, Osman N, Yousif ZM, dan Al-Falahi S. 2003. Aflatoxin M1 in breastmilk of UAE women. J Ann. Trop. Paediatr. 23(3): 173 – 179.
Aryantha INP, Widayanti S, Yuanita. 2004. Eksplorasi Fungi Deuteromycetes (Aspergillus sp. dan Penicillium sp.) Penghasil Senyawa Anti Kolesterol Lovastatin. Bandung : ITB. Diakses tanggal 26 Desember 2014 dari http://www.hayati.itb.ac.id/artikel/lovastatin_basic_research--report.pdf.
Aulanniam. 2005. Protein dan Analisisnya. Malang: Citra Mentari Group.
Baratawidjaja KG, Rengganis I. 2012. .Imunologi Dasar Edisi 10. Jakarta: Badan Penerbit FKUI.
Budiarto E. 2004. Metodologi Penelitian Kedokteran. Jakarta:EGC.
Burmester GR, Pezzutto A. 2003. Color Atlas of Immunology. New York: Thieme. [BPOM] Badan Pengawas Obat dan Makanan 2009. HK.00.06.1.52.4011. Jenis dan
Batas Maksimum Kandungan Mikotoksin dalam Makanan Jakarta (ID):BPOM. Diakses tanggal 23 Oktober 2014 dari http://www2.pom.go.id/public/hukum_
perundangan/pdf/SK%20cemaran%20final-verbal%20sep09.pdf.
Burgess GW. 1995. Teknologi ELISA dalam Diagnosis dan Penelitian. Edisi Indonesia. Artama WT penerjemah. Yogyakarta: Gadjah Mada University Press.
Cao B, Xi T, Hui D. 2011. Preparation of nanogold labeled goat-anti-rabbit Ig G and their application in an immunoassay.MJoM. 17 (2):79-85.
[CEC] Commission of the European Communities . 2006 . Setting maximum levels for certain contaminants in food stuffs. Official Journal of the European Union: Brussels. Diakses tanggal 1 Januari 2015 dari http://eur-lex.europa.eu/legal-content/en/ALL/?uri=CELEX:32006R1881.
Copestake DEJ, Indyk HE, and Otter DE. 2006. Affinity liquid chromatography method for the quantification of immunoglobulin G in colostrum powders. J AOAC Int. 89(5): 1249-1256.
Creepy EE. 2002. Update of survey regulation and toxic effects of mycotoxins in Europe.Toxicol Lett. 127:19–28.
Darwish IA. 2006. Immunoassay methods and their applications in pharmaceutical analysis: basic methodology and recent advances. Int J Biomed Science. 2(3): 217-235.
Deshpande SS. 2002. Fungal Toxins Handbook of Food Toxicology. New York: Marcel Decker.
[FAO]Food and Agriculture Organization. 2004. Food and Nutrition (p.81). Worldwide Regulations for Mycotoxins in food and feed in 2003.Diakses tanggal 8 September 2014 dari http://www.fao.org/3/a-y5499e.pdf.
Fauziyah B. 2012. Analisis kualitatif fenilalanin secara chromatography kertas dan chromatography lapis tipis (studi awal pengembangan metode deteksi penyakit phenylketonuria). Saintis. 1(2):10-18.
24
Garg A. 2008. The Role of The Brambell Receptor, FCRN, On the Absorption, Distribution and Elimination of Monoclonal Ig G Antibodies. United States: Proquest Information and Learning Company.
Gimeno A, Martins ML. 2006. Mycotoxins and Mycotoxicosis In Animals and Human. Miami, USA: Special Nutrients INC.
Gorran A, Farzaneh M, Shivazad M, Rezaeian M, Ghassempour A. 2012.Aflatoxin B1 -Reduction of Aspergillus flavus by Three Medicinal Plants (Lamiaceae). J Food Control. 31: 218-223.
Habibipour R, Khosravi AR, Amirkhani A, Bayat S. 2010. A Study on contamination of raw milk with aflatoxin M1 at the Hamedan Province. Global Veterinaria. 4 (5):489 -494.
Harder WO, Chu FS. 1979. Production and charaterization of antibody against AFM1. Experientia. 35: 1104-1107.
Haskard CA dan Chan ECYL. 1998. Hydrophobicity of bovine serum albumin and ovalbumin determined using uncharged (PRODAN) and anionic (ANS-) fluorescent probes. J Agric Food Chem. 46:2671-2677.
[IARC] International Agency for Research on Cancer. 1993. Monograph on the evaluation of carcinogenic risk to humans (p. 245). Vol. 56. Lyon, France: World Health Organisation.
[IARC] International Agency For Research On Cancer. 2002. Monograph on the evaluation of carcinogenic risk to humans (p. 171). Vol. 82. World health organization.
Ijeh M. 2011. Covalent gold nanoparticle-antibody conjugates for sensitivity improvement in LFIA [Disertasi].Germany :Hamburg University.
Ilyas M. 2006. Isolasi dan identifikasi kapang pada relung rizosfir tanaman di Kawasan Cagar Alam Gunung Mutis, Nusa Tenggara Timur.Biodiversitas.7(3):216-220. Koivunen ME and Krogsrud RL. 2006. Principles of immunochemical techniques used
in clinical laboratories. Labmedicine. 37 (8): 490-497..
Kolosova AY, De Saeger S, Sibanda L, Verheijen R, Peteghem CV. 2007. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of zearalenone and deoxynivaleno. J Anal Bional Chem. 389 (26):2103-2107.
Laura A, Gilda D, Marianna C, Cladio B, Cristina G, Gianfranco G. 2011. Development of a quantitative lateral flow immunoassay for the detection of Aflatoxins in maize. Food Addit Contam. 28(2): 226-234.
Lee JE, Kwak BM, Ahn JH, Jeon TH. 2009. Occurrence of aflatoxin M1 in raw milk in South Korea using an immunoaffinity column and liquid chromatography. J Food Control. 20: 136–138.
Lifetechnologies. 2015. Antibody Production (Immunogen Preparation). Diakses tanggal 19 April 2015 dari https://www.lifetechnologies.com/id/en/home/life- science/protein-biology/protein-biology-learning-center/protein-biology-resource-library/pierce-protein-methods/antibody-production-immunogen-preparation.html. Li P, Zhang Q, Zhang W. 2009. Immunoassays for aflatoxins. Trends in Analytical
Chemistry. 28(9):1115-1126.
25
Majdinasab MSZ, Peiwu SSZ, Zhang Q, Li X, Tang X , Li J. 2015. A reliable and sensitive time-resolved fluorescent immunochromatographic assay (TRFICA) for ochratoxin A in agro-products. J Food Control. 47: 126-134.
Moschini M, Masoero F, Gallo A, Diaz D. 2007. Mucosal absorption of aflatoxin B1 in lactating dairy cows. Ital J Anim Sci. 6(1):324–326.
Nanocomposix. 2015. Gold Nanoparticles. Diakses tanggal 18 Januari 2015 dari http://nanocomposix.com/collections/gold.
Nikolayenko IV, Galkin OY, Grabchenko NI, Spivak MY. 2005. Preparation of highly purified human Ig G, Ig M, and Ig A for immunization and immunoanalysis. Ukrainica Bioorganica Acta. 2: 3-11.
Nuryono N, Agus A, Wedhastri S, Maryudani YB, Sigitsetyabudi FMC, Bohm J, and Razzazi-Fazeli E. 2009. A limited survey of aflatoxin M1 in milk from Indonesia by ELISA. J Food Control .20: 721 – 724.
Pang RTL, Husaini, Karyadi D. 1974. Aflatoksin and primary hepatic cancer in Indonesia. Paper presented at the Fight World Congress of Gastroentererology. Oct. 13 -19.Mexico City.
Parkin MD, Bray F, Ferlay J, Pisani P. 2005. Global cancer statistics 2002. CA Cancer J Clin. 55(2):74-108.
Paulin EGL, Martinez EM, Castro SPM. 2011. Aflatoxins and their impact on human and animal health:an emerging problem Aflatoxins - Biochemistry and Molecular Biology, Dr. Ramon G. Guevara-Gonzalez (Ed.). Diakses tanggal 15 Maret 2015 dari http://cdn.intechopen.com/pdfs-wm/20394.pdf.
Pertiwi W, Sartono TR, Sumarno, Adi S. 2009. Sensitivitas dan spesifisitas metode dot blot menggunakan antigen outer membrane protein Klebsiella pneumoniae yang direspon secretory-immunoglobulin A sputum penderita terinfeksi Klebsiella pneumonia. J Respirologi:1-15.
Pissuwan D, Niidome T, Michael BC. 2011. The forthcoming applications of gold nanoparticles in drug and gene delivery systems. J Controlled Release.149: 65–71. Prandini A, Tansini G, Sigolo S, Filippi L, Laporta M, Piva G. 2009. On the occurrence
of aflatoxin M1 in milk and dairy products [review]. J Food Chem Toxicol.47:984-991.
Rachmawati S, Lee A,Murdiati TB, Kennedy I. 2004. Pengembangan Enzyme Linked Immunosorbent Assay (ELISA) Teknik Untuk Analisis Aflatoksin B1 Pada Pakan Ternak . Prosiding Seminar Parasitologi danToksikologi Veteriner : 133-148. Rachmawati S. 2005. Aflatoksin dalam pakan ternak di Indonesia persyaratan kadar dan
pengembangan teknik deteksinya. Wartazoa. 15 (1):26-37. Radji M. 2010. Imunologi dan Virologi. Jakarta: PT ISFI Penerbitan.
Rohiman A, Buchari, Amran MB, Juliastuti E, Idris E. 2014. Sintesis, karakterisasi, dan aplikasi gold nanoparticles (AuNPs) pada penumbuhan Silicon Nanowires (SiNWs). Research and Development on Nanotechnology in Indonesia.1:74-82. Samson R.A, Hoekstra ES, Frisvad JC. 2004. Introduction to Food and Airborne Fungi
26
Sangdokmai A, Pimpitak U, Buakeaw A. 2011. Production and characterization of monoclonal antibodies against aflatoxin M1. IPCBEE .16:141 – 145.
Shim W, Dzantief BB, Eremin SA, Chung D. 2009. One-Strip simultaneous immunochromatographic strip test for multianalysis of ochratoxin A and zearalenone. J Microbiol.Biotecnol. 19(27):83-92.
Syarief R, Ega LA, Nurwitri CC. 2003. Mikotoksin Bahan Pangan. Bogor:IPB Press. Tekinsen KK, Tekinsen OC. 2005. Aflatoxin M1 in white pickle and van otlu (herb)
cheeses consumed in southeastern in Turkey. J Food Control.7:565–568.
Tabrizi A, Fatma A, Hakan A. 2009. Gold nanoparticle synthesis and characterisation. J Biol & Chem.37(3): 217-226.
Viera AJ, Garrett JM. 2005. Understanding interobserver agreement: The Kappa Statistic. Family Medicine.37(5):360-363.
Virdis S, Corgiolu G, Scarano C, Pilo AL, De Santis EP L. 2008. Occurrence of aflatoxin M1, in tank bulk goat milk and ripened goat cheese. J Food Control. 19: 44–49.
Wang JJ, Liu BH, Hsu YT, Yu FY. 2011. Sensitive competitive direct enzyme-linked immunosorbent assay And gold nanoparticle immunochromatographic strip for detection aflatoksin M1 In milk. J Food Control. 22:64-969.
Wardah H. 2012. Pengembangan sensor BOD berbasis Rhodotorula mucilaginosa UICC Y-181 terimobilisasi dalam gelatin dan alginat menggunakan elektroda emas dan
Boron-Doped Diamond termodifikasi nanopartikel emas [Tesis]. Universitas Indonesia: Depok.
Widiastuti R, Maryam R, Bahri S, Firmansyah R. 2006. Aflatoxin Residues (AFM1) in
Fresh Dairy Milk in Pangalengan and Bogor District, West Java. Seminar Nasional Teknologi Peternakan and Veteriner.Bogor (ID): Balai Penelitian Veteriner.
Xia Q, Huang XY, Xue F, Zhang JJ, Zhai B, Kong DC, Wang C, Huang ZQ, Long XD. 2013. Genetic Polymorphisms of DNA Repair Genes and DNA Repair Capacity Related to Aflatoxin B1 (AFB1)-Induced DNA Damages. Diakses tanggal 1 Januari
2015 dari http://dx.doi.org/10.5772/53967.
Yu J. 2012. Current understanding on aflatoxin biosynthesis and future perspective in reducing aflatoxin contamination. Toxins. 4:1024-1057..
27
LAMPIRAN
Lampiran 1 perhitungan kepekaan (sensitivitas) dan kekhususan (spesifisitas) Kepekaan = proporsi hasil uji positif
total hasil contoh yang diperiksa Kekhususan = proporsi hasil uji negatif total hasil contoh yang diperiksa
Kepekaan Immunostrip Perhitungan
strip yang dikembangkan Agrastrip®
12/19 = 0,631 x 100 = 63,16 % 13/19 = 0,684 x 100 = 68,42 %
Kekhususan Immunostrip Perhitungan
strip yang dikembangkan Agrastrip®
7/19 = 0,368 x 100 = 36,84 % 6/19 = 0,315 x 100 = 31,58 %
Lampiran 2 Perhitungan retention factor (Rf)
Rf = jarak yang ditempuh oleh senyawa
jarak yang ditempuh oleh pelarut
retention factor (Rf) Perhitungan
Rf AFM1 baku
Rf AFM1-CMO
6,7/7,5 = 0,89 3,2/7,5 = 0,42
Lampiran 3 Konstruksi immunostrip
Bantalan Penyerap Ig G(zona kendali) Ag AFM1-BSA (zona uji) Ig G-AuNP
28 Observed Agreement untuk seluruh
29
Lampiran 5 Pemurnian dan penghitungan kadar antibodi poliklonal
Gambar 1 Proses dialisis Antibodi (Ab)
Gambar 2 Pemurnian Ig dengan kolom protein A HP
30
Lampiran 6 SDS-PAGE
Gambar 4 Proses pencetakan jel
Gambar 5 Proses running Ig G
31
Lampiran 7 Konjugasi Ig G dengan partikel nano emas (AuNP)
Gambar 7 Sentrifuse konjugasi partikel nano emas dan Ig G
Gambar 8 Hasil sentrifuse konjugasi partikel nano emas dan Ig G Lampiran 8 Konjugasi AFM1-CMO
32
Lampiran 9 Penyiapan contoh uji
33
RIWAYAT HIDUP
Penulis dilahirkan di Kendari, Sulawesi Tenggara pada tanggal 28 Juli 1987 sebagai anak pertama dari tiga bersaudara dari ayah Sudin, SKM dan seorang ibu Aswati Dakunde.