STATUS DEOXYRIBONUCLEIC ACID (DNA) DAN
KARAKTERISTIK SPERMATOZOA PASCA PENYIMPANAN
KAUDA EPIDIDIMIS PADA SUHU 4 ºC
UMMUL MASIR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Status Deoxyribonucleic acid (DNA) dan Karakteristik Spermatozoa Pasca Penyimpanan Kauda Epididmis pada Suhu 4 ºC adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
UMMUL MASIR. Status Deoxyribonucleic acid (DNA) dan Karakteristik Spermatozoa Pasca Penyimpanan Kauda Epididimis pada Suhu 4 ºC. Dibimbing oleh NI WAYAN KURNIANI KARJA dan MOHAMAD AGUS SETIADI.
Metode kriopreservasi sumber daya genetik dapat diterapkan sebagai bentuk pelestarian suatu jenis hewan melalui pengambilan spermatozoa bagian distal epididimis (kauda epididimis) sesaat hewan tersebut mati. Kematian hewan pada umumnya tidak terduga serta minimnya keberadaan laboratorium dan teknisi menjadi kendala dalam menindaklanjuti kauda epididimis, sehingga dibutuhkan metode preservasi (penyimpanan) pada suhu 4 ºC. Namun metode ini menyebabkan penurunan motilitas dan viabilitas spermatozoa. Proses freezing dan cooling akan berpengaruh terhadap kepadatan kromatin pada fase pertama prosedur pembekuan. Pemaparan spermatozoa pada suhu -196 °C menyebabkan kerusakan pada membran plasma dan akrosom dan berpotensi mengubah integritas kromatin dan DNA spermatozoa. Deoxyribonucleic acid (DNA) spermatozoa diketahui mempunyai kontribusi terhadap setengah dari material genom dari keturunan yang dihasilkan. Salah satu upaya yang digunakan agar dapat mencegah terjadinya kerusakan DNA serta dapat meningkatkan kualitas spermatozoa, pada penelitian ini digunakan media penyimpanan berupa NaCl fisiologis. Oleh karena itu, pada penelitian ini bertujuan untuk melihat status DNA spermatozoa yang dikoleksi dari kauda epididimis yang dipreservasi pada suhu 4 ºC selama tiga hari penyimpanan dengan atau tanpa media.
(P<0.05) kemudian menurun saat memasuki hari ke dua (38%). Berdasarkan metode penyimpanan, penggunaan media tidak dapat mempertahankan viabilitas hingga hari ke tiga (12%) (P<0.05). Status DNA spermatozoa sebelum kriopreservasi baik pada kelompok yang disimpan dengan atau tanpa media, secara berturut-turut diperoleh sebanyak 3 sel dan 5 sel yang mengalami kerusakan DNA. Akan tetapi setelah dikriopreservasi terjadi peningkatan kerusakan DNA menjadi 14 sel dan 15 sel. Data tersebut mengindikasikan bahwa kerusakan DNA akibat kriopreservasi (P<0.1). Tidak ditemukan adanya pengaruh media maupun periode penyimpanan kauda epididimis terhadap kerusakan DNA spermatozoa (P>0.1). Karakteristik spermatozoa kauda epididimis yang disimpan pada suhu 4 ˚C menurun seiring bertambahnya periode penyimpanan. Penggunaan media NaCl fisiologis sebagai media penyimpanan kauda epididimis tidak memberikan pengaruh yang lebih baik dalam mempertahankan kualitas spermatozoa. Lebih lanjut, terdapat kerusakan DNA spermatozoa meningkat setelah dilakukan kriopreservasi.
SUMMARY
UMMUL MASIR. Deoxyribonucleic acid (DNA) Status and Characteristic of Cauda Epididymal Ram Spermatozoa after Storage at 4 ºC. Under direction of NI WAYAN KURNIANI KARJA and MOHAMAD AGUS SETIADI.
As a method to preserve an animal species can be applied to a conservation of genetic materials from animal death or corpse. The death of animals was generally unpredictable and the existence of laboratories and technicians were slight, were become an obstacle in the collection of cauda epididymides. Thats way we need a method to preservation (storage) it at 4 ºC. However, this method causes a decrease in sperm motility and viability of spermatozoa. The process of freezing and cooling will affect the density of the chromatin in the first phase of the freezing procedure. Exposure spermatozoa at a temperature of -196 °C caused damage of the plasma membran and acrosome, that can be potentailly altering chromatin DNA integrity of spermatozoa. Deoxyribonucleic acid spermatozoa were known to have contributed a half of the genomic material of the resulting offspring. Therefore, this study was conducted to see the status of spermatozoa DNA collected from the cauda epididymis were preserved at a temperature of 4 ºC for three days of storage.
Twelve pairs of ram cauda epididymides were placed in media (isotonic NaCl solution) and the others were placed in zip lock without media and stored at 4 ºC for three days. Sperm sample was obtained and cryopreserved then were evaluated for motility, viability and DNA status by sperm sus halomax method. During of storage duration cauda epididymal at 4 ºC caused the decreasing of motility and viability either stored with or without the media, likewise after cryopreservation (P<0.05). Based on the method of storage there are real differences in motility percentage. The storage used the media had lower motility percentage (23%; 10%) compared with no use of the media (50%; 37%) (P <0.05). Likewise, after cryopreserved, motility in one day group of storage media (23%) had different values than the control (35%) (P <0.05), while the group without the media (33%) were still able to maintain motility with the control day (43%) (P <0.05). The viability of spermatozoa from the cauda epididymis stored at 4oC
period. The use of physiological saline media as the storage media cauda epididymis did not give a better effect in maintaining the quality of spermatozoa. Furthermore, there was increased spermatozoa DNA damage after cryopreservation.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
STATUS DEOXYRIBONUCLEIC ACID (DNA) DAN
KARAKTERISTIK SPERMATOZOA PASCA PENYIMPANAN
KAUDA EPIDIDIMIS PADA SUHU 4 ºC
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Segala puji dan syukur tak terkira kepada Allah SWT atas limpahan karunia-Nya dalam setiap proses penyusunan dari awal hingga akhir karya ilmiah ini. Penelitian ini menyajikan hasil evaluasi status DNA dan karakteristik spermatozoa yang dikoleksi dari kauda epididimis setelah penyimpanan kauda epididimis selama 3 hari pada suhu 4 ºC.
Penulis mengucapkan terima kasih kepada Drh Ni Wayan Kurniani Karja MP PhD dan Prof Dr drh Mohamad Agus Setiadi selaku dosen pembimbing yang telah meluangkan waktu dalam memberikan bimbingan serta masukan dan saran selama penelitian dan penulisan karya ilmiah. Kepada Prof Dr drh Iman Supriatna selaku Dosen Penguji Luar Komisi atas masukan dalam penyempurnaan tesis ini. Kepada Ketua Program Studi Biologi Reproduksi (BRP) Pascasarjana IPB, Prof Dr drh Mohamad Agus Setiadi beserta seluruh dosen pengajar dan staf yang bertugas. Kepada Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional yang telah memberikan kesempatan kepada penulis untuk melanjutkan pendidikan magister di Sekolah Pascasarjana IPB melalui program Beasiswa Pendidikan Pascasarjana dalam Negeri (BPPDN) tahun 2013. Kepada Instititut Pertanian Bogor melalui Hibah Penelitian Unggulan Perguruan Tinggi IPB Tahun Anggaran 2014 yang telah mendanai sebagian dari penelitian ini.
Selama penelitian berlangsung penulis mendapatkan banyak bantuan dari banyak pihak, baik di dalam maupun di luar akademik. Kepada bapak Daday pemilik rumah potong aqiqah Desa Cikarawang Kecamatan Dramaga Bogor atas kebaikannya dalam menyediakan sampel testis. Kepada seluruh rekan sejawat mahasiswa pascasarjana BRP terkhusus angkatan 2013, juga kawan-kawan seperjuangan di Laboratorium IVF FKH IPB. Kepada keluarga Rumpun Mahasiswa Pascasarjana Sulsebar IPB (Rumana). Kepada MUFRIDAH, penyemangatku dan sumber inspirasiku. Kepada kakak adik di rumah Bara 4/100, Kak Sumarni, Kak Marlina, Kasmiati, Masturi, Purnama, Tenri, Nia dan Inri. Terimakasih atas jalinan kekeluargaan yang akan penulis jaga selamanya.
Karya ilmiah ini didedikasikan kepada mereka yang telah membagi kasih sayangnya, mendoakan, memberi bantuan moral juga materi, dan selalu menyediakan ruang untuk berkeluh kesah. Tempat tertinggi bagi orang tuaku, (Alm) Singkir Alam dan Besse Maemunah. Kedua saudaraku, Husnul Masir dan Yaumul Masir beserta keluarga besarku. Terimakasih sudah memberikan dukungan penuh atas pilihan yang penulis jalani hingga saat ini.
Akhirnya, semoga karya ilmiah ini dapat memberikan informasi yang bermanfaat dan berguna bagi semua kalangan.
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Morfologi spermatozoa 3
Spermatozoa dari kauda epididimis 3
Kriopreservasi spermatozoa epididymis 4
Kerusakan struktur DNA 5
3 METODE 7
Tempat dan Waktu Penelitian 7
Metode Penelitian 7
Prosedur Analisis Data 9
4 HASIL DAN PEMBAHASAN 10
Karakteristik spermatozoa asal kauda epididimis setelah penyimpanan pada suhu 4 ºC sebelum dan setelah kriopreservasi 10 Status DNA spermatozoa asal kauda epididimis setelah penyimpanan pada suhu 4 ºC sebelum dan setelah kriopreservasi (post thawing) 13
5 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 16
DAFTAR GAMBAR
1 Penyimpanan kaudax epididimis dengan atau tanpa media 7 2 Motilitas spermatozoa kauda epididimis pasca penyimpanan kauda
epididimis selama tiga hari pada suhu 4 ºC dengan dan tanpa media 11 3 Viabilitas spermatozoa kauda epididimis pasca penyimpanan kauda
epidimis selama tiga hari pada suhu 4 ºC dengan dan tanpa media 12
1
PENDAHULUAN
Latar Belakang
Metode kriopreservasi sumber daya genetik dapat diterapkan sebagai salah satu pelestarian suatu jenis hewan. Hewan yang perlu dilestarikan materi genetiknya seperti hewan yang terancam punah atau pejantan unggul yang mengalami kematian tak terduga, perburuan liar atau serangan penyakit. Salah satu metode dalam pelestarian gamet jantan melalui pengambilan spermatozoa bagian distal epididimis (kauda epididimis) setelah hewan tersebut mati. Kaabi et al. (2003) melaporkan, spermatozoa yang berada pada kauda epididimis sudah dalam keadaan motil dan matang dengan kemampuan motilitas bergerak maju ke depan dan kemampuan fertilisasi sama dengan spermatozoa dari ejakulat. Setelah kematian hewan, spermatozoa dalam epididimis masih dapat bertahan hidup untuk periode waktu tertentu (Martinez-Pastor et al. 2005; Ganan et al. 2009; Malcotti et al. 2012). Kematian hewan yang pada umumnya tidak terduga serta minimnya keberadaan laboratorium dan teknisi menjadi kendala di lapangan untuk dapat segera mengolah spermatozoa. Dengan demikian dibutuhkan sebuah metode penyimpanan (preservasi) yang tepat ketika testis tidak dapat ditangani dengan segera guna mempertahankan viabilitas spermatozoa. Salah satu metode yang telah digunakan preservasi kauda epididimis pada suhu 4 ºC. Sebelumnya preservasi spermatozoa kauda epididimis telah diterapkan pada beberapa hewan seperti pada babi (Kikuchi et al. 1998); domba (Karja et al. 2010; Pamungkas et al. 2012); unta (Wani 2009), kuda (Love 2005) dengan pengembangan metode yang berbeda.
Meskipun spermatozoa masih bisa dikoleksi dari kauda epididimis yang telah disimpan pada suhu 4 ºC, spermatozoa akan mengalami penurunan kualitas seperti motilitas dan viabilitas (Karja et al. 2013). Menurut Gadea et al. (2011) proses freezing dan cooling akan berpengaruh terhadap kepadatan kromatin spermatozoa. Lebih lanjut, Vieira et al. (2013) berpendapat bahwa adanya pengaruh terhadap kepadatan kromatin terjadi di fase pertama prosedur pembekuan. Spermatozoa yang terpapar pada suhu ekstrim seperti dalam penelitian Saili (2006) yang melakukan pengeringbekuan spermaotozoa yang diawali dengan pemaparan pada suhu -196 ºC menyebabkan kerusakan pada membran plasma dan akrosom, bahkan berpotensi dapat mengubah integritas kromatin dan DNA spermatozoa.
2
mungkin tidak terjadi atau akan terjadi kegagalan pasca fertilisasi (Agarwal dan Allamaneni 2004).
Spermatozoa yang mengalami preservasi pada suhu 4˚C akan mengalami perubahan lingkungan seperti perubahan pH seiring bertambahnya periode penyimpanan yang menyebabkan penurunan motilitas spermatozoa (Sugiarti et al. 2004). Adanya asam laktat yang merupakan sisa hasil metabolisme sel menyebabkan kondisi medium menjadi semakin asam serta mengakibatkan stress terhadap jaringan sel. Selain itu penyimpanan pada suhu 4 ºC juga berdampak terhadap peningkatan ketebalan kapsula epididimis dan peningkatan kerusakan epitel epididimis (Satrio, 2015). Akan tetapi belum ada laporan tentang status DNA dari spermatozoa kauda epididimis pasca penyimpanan epididimis selama beberapa hari. Oleh karena itu penelitian ini dilakukan untuk melihat status DNA spermatozoa yang dikoleksi dari kauda epididimis yang dipreservasi pada suhu 4 ºC selama tiga hari penyimpanan.
Perumusan Masalah
Sebuah metode pelestarian gamet jantan pada hewan yang telah mati, menurut Kaabi et al. (2003) dapat dilakukan melalui preservasi kauda epididimis. Spermatozoa asal kauda epididimis memiliki kemampuan yang hampir sama dengan spermatozoa ejakulat. Untuk menghasilkan semen beku yang berkualitas hasil dari koleksi spermatozoa asal kauda epididimis, dapat dilakukan melalui penyimpanan kauda epididimis pada suhu 4 ºC dengan menggunakan media penyimpanan. Penggunaan media NaCl diharapkan dapat memberikan hasil yang lebih baik dalam mempertahankan kualitas spermatozoa karena NaCl 0.9% merupakan cairan fisiologis yang sesuai dengan tekanan osmotik dalam dalam tubuh. Adanya peristiwa pembekuan bisa mengakibatkan kristalisasi es yang mempengaruhi komposisi membran plasma hingga organel intra sel. Kajian penelitian ini adalah melihat kualitas spermatozoa hingga ke bagian DNA spermatozoa. oleh karena itu diharapkan penggunaan NaCl sebagai media penyimpanan dapat mendukung ketahanan DNA spermatozoa hingga tahap fertilisasi in vivo atau in vitro.
Tujuan Penelitian
Mengkaji status DNA dan karakteristik spermatozoa kauda epididimis yang disimpan pada suhu 4 ºC selama beberapa hari dengan dan tanpa media NaCl 0.9% fisiologis.
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Morfologi spermatozoa
Spermatozoa sebagai hasil akhir proses spermatogenesis merupakan sel dengan bagian kepala sedikit pipih dan ekor yang panjang. Secara keseluruhan spermatozoa diselubungi oleh membran plasma yang berfungsi untuk pemeliharaan integritas membran dan membentuk permukaan yang dinamis antar sel serta sebagai perlindungan terhadap lingkungan (Curry dan Watson 1995). Membran plasma bagian kepala spermatozoa memegang peranan pada saat kapasitasi, reaksi akrosom dan penetrasi. Bagian tengah ekor terdapat sejumlah mitokondria yang dipercaya dapat memberikan energi untuk kemampuan bergerak atau motilitas.
Kepala spermatozoa mengandung inti dengan DNA yang merupakan material genetik jantan yang akan ditransportasikan ke ovum, dan akrosom mengandung enzim hidrolitik yang dibutuhkan saat penetrasi terhadap cumulus oophorus dan zona pellusida ovum selama fertilisasi (Johnson et al. 1997). Kondisi yang ideal bagi spermatozoa pada saat fertilisasi adalah ketika spermatozoa memiliki cadangan energi yang cukup, protein dan senyawa lain selama berada di dalam saluran reproduksi betina (Garner dan Hafez 2000).
Spermatozoa dari kauda epididimis
Spermatogenesis merupakan proses pembelahan dan diferensiasi sel germinal yang diproduksi dalam tubulus semineferus di bawah kontrol mekanisme hormonal. Rata-rata spermatogenesis berlangsung selama 30-75 hari pada mamalia berdasarkan 4.5 siklus spermatogonia, sehingga pada domba membutuhkan waktu selama 47.7 hari untuk melakukan spermatogenesis (França et al. 2005). Proses spermatogenesis terdiri dari tiga fungsi dan morfologi yang berbeda akibat pembelahan mitosis dan meiosis. Pembelahan awal dimulai pada tahap spermatositogenesis (poliverasi atau mitosis) di mana spermatogonia yang bersifat diploid mengalami mitosis berulang kali pada epitelium semineferus yang kemudian membentuk spermatosit primer (2n). Tiap satu spermatosit primer mengalami meiosis I dan menghasilkan dua spermatosit sekunder bersifat haploid lalu dilanjutkan dengan meiosis II sehingga menghasilkan empat spermatid haploid. Tahapan meiosis pada setiap mamalia pada umumnya memiliki ukuran spermatosit yang mengalami penyusutan akibat perubahan kromatin dan kondensasi inti (tahap preleptoten dan diploten). Pada tikus misalnya, volume akhir dari inti sebelum spermiasi adalah 2% dari volume awal sebelum pembelahan (Russel dan de França 1995). Karateristik khusus yang membedakan pada beberapa spesies ditemui pada bentuk dan ukuran akrosom, flagela dan bentuk spermatid matang (Eddy dan O’Brien 1994). Tahap pembelahan diakhiri dengan spermiogenesis (diferensiasi). Spermatid kemudian mengalami diferensiasi menjadi spermatozoa melalui empat fase seperti fase golgi, fase tutup, fase akrosom dan fase pematangan.
4
spermatid dari tubular lumen, sekresi cairan, protein dan beberapa faktor pertumbuhan. Sel yang tidak berkembang dan sisa sitoplasma yang terdapat pada ekor spermatozoa akan difagositosis di dalam tubulu semineferus. Dari segi hormonal, sel sertoli mengatur sinergi antara FSH dan LH dalam menstimulasi testis untuk memproduksi testosteron (Johnson et al. 2008)
Proses modifikasi spermatogonia menjadi spermatid melibatkan perubahan biokimia. Kondensasi inti dan perkembangan dan pembentukan akrosom, teka perinuklear, fossa fibrosa dan sitoplasmik droplet serta komponen membran plasma mengalami modifikasi secara bertahap. Modifikasi tersebut terjadi selama proses spermatogenesis di dalam saluran testis, sedangkan proses pematangan terjadi di bagian luar testis (Toshimori 2003). Melalui vasa eferentia, spermatozoa terlebih dahulu ditransportasikan ke kaput dan korpus epididimis untuk mengalami pematangan. Spermatozoa yang fertil adalah spermatozoa berkemampuan untuk melakukan reaksi akrosom dengan zona pellusida hingga fusi terhadap inti oosit (Yoshinaga dan Toshimori 2003). Hal ini merupakan modifikasi pematangan yang dibutuhkan untuk spermatozoa menjadi fertil dan kompeten untuk kemudian disimpan di kauda epididimis.
Dalam setiap segmen epididimis dilapisi oleh epitel yang terdiri dari sel terminal dan sel basal (Hermo dan Robaire 2002). Hess et al. (2001) dalam penelitiannya melaporkan bahwa reabsorbpsi cairan luminal yang terjadi di ductus eferen dan di bagian awal epididimis diatur oleh estrogen. Reabsorpsi penting bagi fungsi sermatozoa untuk menjadi matang sempurna sehingga spermatozoa harus dalam keadaan lebih terkonsentrasi saat memasuki epididimis.
Kriopreservasi spermatozoa epididymis
Epididimis yang dikoleksi dari ternak yang disembelih atau pada hewan yang telah mati dapat dimanfaatkan secara optimal sebagai salah satu alternatif dalam mempertahankan materi genetik jantan. Pada beberapa penelitian disebutkan bahwa spermatozoa asal kauda epididimisi memiliki kualitas yang sama dengan spermatozoa ejakulat. Pada saat kauda epididimis dilepaskan dari testis, spermatozoa masih layak dikoleksi sebelum terkontaminasi oleh bakteri pada jaringan. Viabilitas spermatozoa dapat dipertahankan untuk waktu yang lama apabila disimpan pada suhu 5 ºC (Bruemmer et al. 2002). Maka dari itu dibutuhkan sebuah pengolahan spermatozoa asal kauda epididimis baik dalam bentuk cair maupun beku.
Spermatozoa beku dikemas dalam straw ukuran 0.25 atau 0.5 dengan konsentrasi yang berbeda. Pengemasan tersebut dapat mempermudah dalam aplikasi teknologi reproduksi (ATR) seperti inseminasi buatan (IB), fertilisasi in vitro hingga transfer embrio (TE). Untuk memperpanjang masa hidup spermatozoa dibutuhkan pengolahan lebih lanjut seperti kriopreservasi. Prinsip dasar dari kriopreservasi adalah pengeluaran air dari dalam sel (dehidrasi) untuk mencegah pembekuan intraseluler. Apabila dehidrasi tidak tercapai maka akan terbentuk kristal es intraseluler dan menyerang organel-organel sel yang penting seperti membran plasma dan mitokondria (Rodriguez-Martinez dan Wallgren 2010).
5 fertilitas. Kerusakan tersebut menggambarkan bahwa membran plasma mengalami kerusakan yang berat akibat kriopreservasi. Selain itu, pembekuan juga mengakibatkan dehidrasi sel, fase transisi termotropik dan lipotropik dalam membran phospoholipid serta tingginya konsentrasi zat terlarut dan pembentukan kristal es intraseluler (Parks dan Graham 1992).
Keberhasilan dalam metode kriopreservasi dapat dipengaruhi oleh penggunaan bahan pengencer dan krioprotektan (Melo et al. 2008). Penggunaan bahan pengencer berfungsi sebagai sumber energi bagi spermatozoa dan melindungi sel-sel dari kerusakan akibat paparan suhu yang rendah serta memelihara lingkungan yang sesuai bagi spermatozoa untuk bertahan hidup. Pengencer yang telah umum digunakan dalam proses kriopreservasi semen dan dikenal luas adalah pengencer murni (susu atau kuning telur), krioprotektan (gliserol, etilen glicol atau dimetil sulfida), buffer (tris), gula (gluosa, laktosa, rafinosa, sakrosa, atau teralosa), garam (natrium sitrat, asam sitrat) dan antibiotik (penisilin atau streptomisin) (Purdy 2006). Penambahan krioprotektan ke dalam media pengencer dapat bersifat hiperosmotik terhadap sel. Akibatnya, terjadi perubahan volumetrik yang ditandai dengan terjadinya peregangan dan penyusutan membran sel (Parks dan Graham 1992). Oleh karena itu, Watson et al. (1987) menekankan bahwa dehidrasi sel dan tekanan osmotik yang tinggi merupakan faktor utama dalam kerusakan setelah thawing.
Membran plasma spermatozoa berperan dalam mencegah terjadinya kristal es dari media ke dalam sel. Peningkatan gradien osmotik melewati membran plasma menyebabkan air intraseluler berdifusi keluar sel, sehingga terjadi dehidrasi baik sel maupun membran plasma. Karena adanya kristalisasi es di media ekstraseluler, sel menjadi terjebak di gap junction yang berada di antara kristal es pada saat thawing. Metode pembekuan lambat dapat memungkinkan terjadinya equilibrium pada air untuk melintasi membran, sehingga gap juntion pada sel bisa berada di bawah titik beku air (Parks dan Graham 1992).
Kerusakan struktur DNA
6
Kadar ROS yang tinggi dalam saluran reproduksi jantan dapat bersifat racun terhadap kualitas spermatozoa. Reactive oxygen species merupakan agen yang paling reaktif seperti hidrogen peroksida, superoksida dan radikal bebas. Metabolisme yang berlangsung optimal akan mengakibatkan terbentuknya ROS hasil metabolisme oksigen. Radikal bebas merupakan kelompok kimia yang tidak stabil, sangat reaktif dan mudah berikatan dengan satu atau lebih elektron yang tidak berpasangan. Secara fisiologis radikal bebas berperan positif pada jumlah yang seimbang, tapi akan memberi efek negatif pada jumlah yang berlebih. Pada umumnya, basa DNA dan ikatan fosfodiester sangat rentan terhadap peroksidasi. Spermatozoa sangat rentan terhadap kerusakan akibat stress oksidatif karena membran plasmanya mengandung banyak asam lemak tidak jenuh dan sitoplasmanya mengandung sedikit enzim yang dapat menangkal radikal bebas (Agarwal dan Said 2003).
Evaluasi Status DNA Spermatozoa
Kerusakan DNA dapat dievaluasi melalui beberapa cara seperti cryo sperm chromatin structure assay (SCSA). Teknik SCSA menentukan sensitivitas dari DNA spermatozoa yang menginduksi denaturasi DNA, memperlihatkan ukuran status kondensasi kromatin dan kerusakan DNA. Perangkat SCSA memberikan kontribusi dalam analisis integritas DNA spermatozoa, namun pemanfaatannya memerlukan penggunaan biaya yang tinggi dan membutuhkan alat yang khusus seperti flow cytometri (FCM). Sama seperti SCSA, terminal deoxynucleotidyl transferase nick and labeling (TUNNEL) juga menggunakan FCM dalam peningkatan sensitivitasnya. Uji integritas DNA yang terbaru yaitu Halosperm test (Sperma Sus Halomax) sebuah teknik yang dikembangkan dari teknik sebelumnya yaitu sperm chromatin dispersion (SCD). Pengukuran DNA rusak setelah lisis dengan protein terkait. Halosperm test merupakan prosedur sederhana, cepat dan diproduksi untuk menilai integritas DNA spermatozoa (Fraser dan Strzez˙ek 2007).
Sperm-sus-halomax merupakan tes sederhana untuk mempelajari tingkat fragmentasi DNA spermatozoa. Metode ini merupakan variasi dari protokol dispersi kromatin spermatozoa pada manusia. Metode ini menyediakan cara yang mudah untuk membedakan spermatozoa dengan dan tanpa fragmentasi DNA dengan menggunakan perbesaran rendah atau tinggi di bawah mikroskop cahaya atau fluoresens (Ferna´ndez et al. 2003).
7
3
METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Februari sampai Maret 2015. Tempat penelitian di Laboratorium Fertilisasi in Vitro Divisi Reproduksi dan Kebidanan, Departemen Klinik Reproduksi dan Patologi (KRP), Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Metode Penelitian
Pembuatan Media
Media yang digunakan untuk menyimpan kauda epididimis domba pada suhu 4 ºC adalah NaCl fisiologis 0.9% yang ditambahkan 0.06 IU/l penisilin (Sigma-Aldrich. Inc, P-4687) dan 0.1 mg/ml streptomisin(Sigma-Aldrich. Inc, S-9137).
Koleksi kauda epididimis dan spermatozoa
Testis diperoleh dari domba jantan berumur lebih dari dua tahun sesaat setelah disembelih. Kauda epididimis kemudian dipisahkan dari testis. Satu dari setiap pasang kauda epididimis dimasukkan ke dalam centrifuge tube 15 ml yang berisi media (Gambar 1A) dan pasangannya dimasukkan ke dalam plastik ziplock tanpa media (Gambar 1B). Seluruh sampel disimpan dalam kotak styrofoam dan dibawa ke laboratorium untuk pengujian dan pengolahan lebih lanjut.
Kauda epididimis yang disimpan dalam ziplock dan tube dibagi dalam empat kelompok. Pada kelompok kontrol (H0), satu pasang kauda epididimis segera dilakukan evaluasi dan kriopreservasi diikuti dengan evaluasi setelahnya. Sampel yang lain kemudian dibagi ke dalam kelompok berdasarkan lama penyimpanan satu hari (H1), dua hari (H2), dan tiga hari (H3) lalu dipreservasi dalam kulkas dengan suhu 4 ºC lalu dilanjutkan dengan kriopreservasi. Masing-masing evaluasi spermatozoa dilakukan setelah preservasi dan kriopreservasi. Parameter evaluasi berdasarkan persentase motilitas, viabilitas dan status DNA. Gambar 1 Penyimpanan kauda epididimis dengan (A) atau tanpa (B) media (NaCl
8
Koleksi Spermatozoa
Setiap akhir pemotongan, kauda epididimis disimpan pada suhu 4 ºC. Tiap pasang sampel dipisah antara bagian kiri dan bagian kanan lalu ditempatkan di cawan petri yang berbeda. Spermatozoa dikoleksi dengan cara kauda epididimis disayat sambil dibilas dengan pengencer NSF I hingga spermatozoa keluar dan mulai bercampur dengan pengencer. Dalam keadaan homogen, pipet 3 ml spermatozoa hasil koleksi lalu homogenkan dengan 7 ml NSF I dalam tube.
Persiapan bahan pengencer
Komposisi bahan pengencer yang digunakan dalam penelitian ini adalah pengencer Niwa dan Sasaki Freezing (NSF) (Kikuchi et al. 1998) untuk kriopreservasi spermatozoa dari kauda epididimis. Pada proses kriopreservasi, pemberian bahan pengencer dilakukan dengan metode two-step freezing. Komposisi medium freezing I (NSF I) terdiri dari 20% (v/v) kuning telur, 8.8% (w/v) laktosa (Merck, Germany) dan 200 μg/ml ampicillin (PT. Meiji Indonesian, Batch no. PAL. 09654), sedangkan medium freezing II (NSF II) terdiri dari 92.52% (v/v) medium freezing I, 1.48% (v/v) Orvus ES Paste, dan 6% (v/v) gliserol (Merck, Germany).
Kriopreservasi semen
Metode pembekuan spermatozoa yang digunakan dalam penelitian ini disesuaikan dalam Karja et al. (2013) dengan dua tahap penambahan pengencer. Pada tahap awal, spermatozoa yang telah dikoleksi bersama NSF I diequilibrasi pada suhu 4 ºC selama 2 jam. Selanjutnya pada tahap ke dua yaitu penambahan NSF II ke dalam tube lalu diequilibrasi lagi selama 5 menit pada suhu yang sama. Metode water jacket digunakan dalam tahap equilibrasi.
Perbandingan penambahan medium NSF I dengan NSF II sebesar 1:1 dengan konsentrasi akhir spermatozoa setelah penambahan NSF sebesar 100x106
spermatozoa/ml dan konsentrasi akhir gliserol sebesar 3%. Spermatozoa kemudian dikemas pada straw berukuran 0.25 ml lalu diletakkan di atas boat pada styrofoam yang berisi nitrogen cair selama 20 menit. Jarak boat dengan nitogen cair kurang lebih 4 cm dari permukaan nitrogen cair. Setelah itu, straw dicelupkan ke dalam nitrogen cair dan dibiarkan selama 20 menit dilanjutkan dengan menyimpan straw beku ke dalam kontainer. Pada proses evaluasi, spermatozoa beku diambil kemudian dithawing dalam water bath suhu 37 ºC selama 30 detik. Segera straw diangkat lalu dilakukan evaluasi karakterisitik spermatozoa dan status DNA.
Parameter evaluasi karakterisitik spermatozoa
Penilaian motilitas spermatozoa
9
Penilaian viabilitas
Penilaian viabilitas ditentukan dengan menggunakan metode pewarnaan eosin negrosin dengan komposisi 300 ml air mili-Q terdiri dari 3.3 g eosin yellow (Wako Pure chemical Industries, 058-00062), 20 g nigrosin (Sigma-Aldrich, 198285) dan 1.5 g natrium sitrat. Sebanyak 10µl sampel spermatozoa dan 40µl eosin negrosin diteteskan di atas gelas obek yang bersih lalu dihomogenkan. Preparat ulas dibuat dan dikeringkan di atas api bunsen selama 15 detik kemudian diamati di bawah mikroskop perbesaran 400x. Spermatozoa yang terwarnai (merah) dikategorikan sebagai spermatozoa yang mati, sedangkan spermatozoa yang tidak terwarna (putih) dikategorikan spermatozoa yang hidup. Total spermatozoa yang diamati adalah 200 spermatozoa untuk penentuan presentasi hidup mati spermatozoa yang diamati.
Pengujian status DNA
Pengujian status DNA digunakan teknik modifikasi sperm chromatin dispersion (SCD) sesuai dengan metode yang dikembangkan oleh Fernandez et al. (2003) yang melihat taerbentuknya halo pada kepala spermatozoa. Sampel spermatozoa yang diamati diencerkan hingga konsentrasi akhir 5-10x106/ml dalam
NaCl 0.9%. Agarose lalu dilelehkan dalam waterbath 90-100 ºC selama 5 menit, kemudian diinkubasi pada waterbath suhu 37 ºC selama 5 menit. Sebanyak 25 µl semen dimasukkan ke dalam tube berisi agarose (mixing) lalu diteteskan ke slide sebanyak 25 µl kemudian ditutup dengan cover glass ukuran 18x18 mm dan diinkubasikan selama 5 menit. Coverslip dilepas perlahan kemudian slide diteteskan dengan lysis solution (LS) hingga permukaan slide tertutup rata oleh LS, lalu diinkubasi pada suhu ruang selama 5 menit. Selanjutnya, preparat diinkubasi dalam aquades selama 5 menit. Setelah itu preparat diinkubasikan dalam wadah berisi etanol 70%, 90% dan 100% masing-masing dalam waktu 4 menit, kemudian preparat dikeringkan. Pewarnaan preparat: preparat diinkubasi dalam wadah berisi pewarna eosin selama 5 menit, kemudian dicuci menggunakan aquades selama 2 menit. Setelah itu diinkubasikan di dalam wadah incubator berisi methylen blue selama 5 menit, kemudian dicuci dengan aquades dalam wadah selama 2 menit, lalu dikering anginkan. Slide yang telah kering, kemudian diamati di bawah mikroskop perbesaran 400x dengan pengamatan 200 sel untuk setiap sampel. Spermatozoa yang memiliki halo di bagian tepi kepala diidentifikasi memiliki kerusakan DNA, sedangkan spermatozoa tanpa halo diidentifikasi sebagai spermatozoa dalam keadaan normal.
Prosedur Analisis Data
10
4
HASIL DAN PEMBAHASAN
Karakteristik spermatozoa asal kauda epididimis setelah penyimpanan pada suhu 4 ºC sebelum dan setelah kriopreservasi
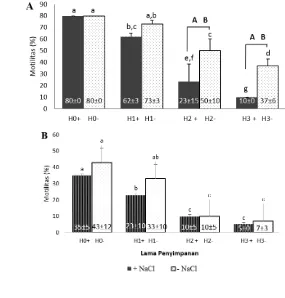
Hasil penelitian menunjukkan pengaruh penyimpanan kauda epididimis pada suhu 4 ºC mengalami penurunan persentase motilitas seiring bertambahnya periode penyimpanan (P<0.05) (Gambar 2A). Berdasarkan persentase motilitas, kauda epididimis saat memasuki hari ke dua dan ke tiga penyimpanan dengan menggunakan media memperlihatkan persentase motilitas spermatozoa yang lebih rendah (23%; 10%) dibanding dengan yang disimpan tanpa media (50%; 37%) (P<0.05). Data tersebut mengindikasikan bahwa penggunaan NaCl tidak memberikan pengaruh yang lebih baik dalam mempertahankan motilitas spermatozoa (P<0.05) daripada tanpa media. Hasil tersebut didukung oleh penelitian Karja et al. (2013) bahwa motilitas spermatozoa menurun seiring bertambahnya waktu penyimpanan. Menurut Sankai et al. (2001), epididimis yang disimpan pada suhu 5 ºC akan mempengaruhi morfologi ekor spermatozoa (bengkok) akibat terjadinya pengerasan phospholipid pada membran plasma. Akan tetapi preservasi pada suhu 5 ºC dapat mereduksi aktivitas metabolisme sel spermatozoa sehingga persentase motilitas dapat dipertahankan (Salomon dan Maxwell 2002).
Motilitas spermatozoa setelah kriopreservasi (post thawing) (Gambar 2B) mengalami penurunan pada hari ke dua dan ke tiga penyimpanan (P<0.05). Pada kauda epididimis yang disimpan selama 1 hari tanpa media (33%) memiliki motilitas spermatozoa yang masih bisa dipertahankan kualitasnya sama dengan kontrol (43%) (P<0.05). Selanjutnya, kauda epididimis yang disimpan selama 1 hari dengan NaCl memperlihatkan nilai yang berbeda dibandingkan dengan kontrol (35%) (P<0.05).
Zribi et al. (2010) melaporkan bahwa kriopreservasi menurunkan kualitas spermatozoa yang berkaitan dengan pembentukan kristal es dan tekanan osmotik yang tinggi selama pembekuan. Akibat dari kriopreservasi menyebabkan kerusakan fisik secara langsung menuju ke struktur spermatozoa atau fungsi sel. Beberapa penelitian terdahulu memperlihatkan mekanisme kerusakan spermatozoa dapat disebabkan oleh banyak faktor. Gadea et al. (2011) menyebutkan produksi ROS yang berlebih selama thawing berdampak pada perubahan membran dan sktruktur spermatozoa, terutama pada bagian kepala spermatozoa sehingga mengakibatkan konsentrasi phospholipase C zeta (PLCζ) tereduksi hinga 20 – 56% (Kashir et al. 2011).
Wang et al. (1997) menambahkan, cold shock selama kriopreservasi terkait dengan stress oksidatif dan ROS. Reactive oxygen species menginduksi kerusakan spermatozoa melalui stres oksidatif dari polyunsaturated fatty acids (PUFA) sehingga menyebabkan lipid peroksidasi. Stres oksidatif dapat didefinisikan sebagai ketidakseimbangan antara antioksidan dan prooksidan dan radikal bebas yang mengarah pada proses lipoperoxidatif (Aitken 1989).
11
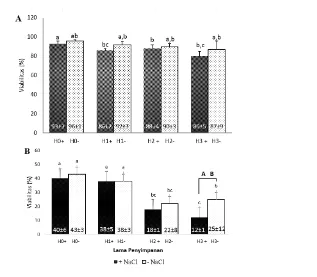
ini sesuai hasil Vieira et al. (2013) di mana presentasi viabilitas tidak dipengaruhi oleh perbedaan lama penyimpanan. Lebih lanjut, viabilitas spermatozoa yang dikoleksi dari kauda epididimis yang disimpan dengan media justru menurun (86%) setelah satu hari penyimpanan. Viabilitas dengan nilai tersebut kemudian dipertahankan hingga hari ke tiga penyimpanan. Tittarelli et al. (2006) menyebutkan bahwa spermatozoa yang mengalami preservasi lebih dari 24 jam tidak akan mempengaruhi persentase viabilitasnya secara signifikan.
Perubahan suhu ekstrim yang diakhiri dengan thawing suhu 37 ºC dapat mempengaruhi fungsi dan kinerja organel intraseluler sehingga berpengaruh pada kualitas spermatozoa. Viabilitas spermatozoa kauda epididimis selama transportasi dari tempat pemotongan sampai di laboratorium sebesar 40% dan 43% kemudian menurun setelah dua hari penyimpanan sebesar 38% (P<0.05) (Gambar 3B) baik yang disimpan dengan atau tanpa media.
12
kadar CO2 tinggi, ion Na+ dan K+ sehingga mendukung daya tahan hidup
spermatozoa di dalam kauda epididimis selama beberapa hari. Lebih lanjut dikatakan oleh Gatti et al. (2004) bahwa kauda epididimis memiliki kandungan cairan yang terdiri dari proteomes dan secretomes serta terdapatnya vesikle epididimosomes yang mengandung spesifik glikolipid protein yang kemudian mempengaruhi keadaan spermatozoa selama proses transportasi spermatozoa. Sostaric et al. (2008) menambahkan, epididimosomes berfungsi sebagai perantara masuknya protein-protein dari cairan kauda epididimis menuju membran plasma spermatozoa. Setelah kematian hewan, kondisi dalam tubuh secara in vivo kemungkinan berubah sehingga menyebabkan penurunan kualitas spermatozoa. Seperti yang telah dilaporkan oleh Garde et al. (1998) bahwa terjadi penurunan kualitas seiring dengan bertambahnya jarak sejak kematian hewan. Sankai et al. (2001) melaporkan bahwa motilitas spermatozoa mengalami penurunan ketika disimpan pada suhu 15-20 ºC akibat perubahan aktivitas metabolisme spermatozoa.
Penggunaan media NaCl fisiologis selama penyimpanan tidak menunjukkan hasil yang lebih baik daripada kualitas spermatozoa dari kauda epididimis yang disimpan tanpa media. Sankai et al. (2001) menyebutkan bahwa penggunakan media penyimpanan epididimis berbahan dasar cairan akan mengakibatkan cairan tersebut masuk menembus epididimis kemudian meningkatkan aktivitas metabolisme spermatozoa selama penyimpanan dilakukan. Gambar 3 Viabilitas spermatozoa kauda epididimis pasca penyimapan kauda
13 Faktor lain adalah adanya proses autolisis dalam kauda epididimis yang berpengaruh setelah 24 jam penyimpanan terhadap penurunan motilitas namun tidak pada viabilitas spermatozoa (Tittarelli et al. 2006). Myres et al. (2012) melaporkan bahwa setelah kematian hewan akan mengalami hipoksia jaringan. Gangguan pada pompa sodium potasium mengakibatkan peningkatan tekanan osmotik sehingga air berpindah secara pasif ke dalam sel melalui plasma membran sehinggal sel menjadi bengkak (Myres et al. 2012). Lebih lanjut, menurut Bishopric et al. (1999), asidosis dan kondisi hipoksia berpengaruh kuat dalam kematian sel. Kualitas spermatozoa pasca pembekuan terjadi penurunan akibat dari faktor pembekuan.
Status DNA spermatozoa asal kauda epididimis setelah penyimpanan pada suhu 4 ºC sebelum dan setelah kriopreservasi (post thawing)
Status DNA spermatozoa ditentukan oleh keberadaan kromatin dalam inti sel yang berikatan erat pada protamin sebagai pelindung DNA inti. Perubahan yang terjadi pada kromatin dapat dijadikan sebagai parameter kerusakan status DNA dengan melakukan pewarnaan pada kromatin tersebut. Salah satu teknik untuk mengetahui status DNA spermatozoa adalah melalui teknik sperm chromatin dispertion (SCD) yang selanjutnya dikembangkan menjadi teknik sperm sus halomax dengan prinsip dasar pewarnaan pada kromatin inti sel (Fernández et al. 2003). Spermatozoa yang menghasilkan halo di bagian tepi kepala diidentifikasi sebagai spermatozoa yang memiliki kerusakan DNA (tidak utuh) (Gambar 4B), sedangkan kepala spermatozoa yang tidak terdapat halo masih memiliki DNA yang utuh (Gambar 4A)
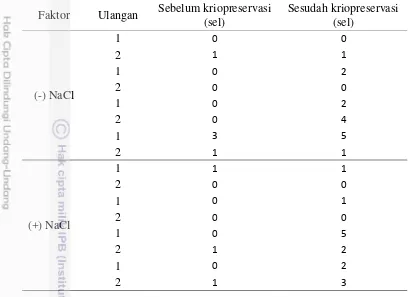
Hasil evaluasi kerusakan DNA spermatozoa kauda epididimis domba disajikan pada Tabel 1. Sebelum kriopreservasi baik pada kelompok yang disimpan dengan atau tanpa media, kerusakan DNA secara beruturut-turut ditemukan sebanyak 3 sel dan 5 sel. Akan tetapi setelah dikriopreservasi terjadi peningkatan Gambar 4 Status DNA spermatozoa setelah diwarnai melalui teknik sperm sus
14
kerusakan DNA menjadi 14 sel dan 15 sel. Data tersebut mengindikasikan bahwa terjadi peningkatan kerusakan DNA akibat proses kriopreservasi (P<0.1). Tidak ditemukan adanya pengaruh media maupun periode penyimpanan kauda epididimis terhadap kerusakan DNA spermatozoa (P>0.1). Hal ini kemungkinan disebabkan karena spermatozoa mempunyai struktur DNA yang kompleks dengan protein dasar kromatin yang kaya akan ariginin dan sistein sehingga mampu menjaga ketahanan DNA walau pada suhu yang rendah (Curry and Watson, 1995). Fuentes-Mascorro et al. (2000) melaporkan bahwa protamin yang terdapat pada DNA merupakan residu dari asam amino di mana apabila kemudian teroksidasi menyebabkan inti spermatozoa menjadi sangat kompak. Hal tersebut memungkinkan dapat mencegah terjadinya kerusakan DNA. Pada kebanyakan mamalia seperti pada hamster, kromatin spermatozoanya memiliki struktur yang lebih padat dan kompak sehingga mampu mempertahankan integritasnya selama proses ejakulasi (Ward and Coffey 1991). Akan tetapi Kromatin dari DNA spermatozoa rentan terhadap proses freezing-thawing seperti yang dilaporkan oleh Fraser dan Strzez˙ek (2007), spermatozoa post thawing yang dilabeli 3H-AMD terbukti rentan terhadap DNA strand break yang menunjukkan bahwa destabilisasi pada struktur kromatin spermatozoa dapat menyebabkan terjadinya fragmentasi DNA.Sakkas dan Alvarez (2010) mengemukakan beberapa faktor yang menyebabkan terjadinya kerusakan DNA atau fragmentasi DNA yaitu (1) apoptosis selama proses spermatogenesis; (2) kerusakan untaian DNA saat proses perubahan bentuk kromatin dalam spermiogenesis; (3) radikal oksigen, seperti radikal hidroksil dan nitric oxide, selama proses transportasi melalui tubulus seminiferus dan epididimis; (4) fragmentasi DNA yang disebabkan oleh kaspase endogenus dan endonuklease; (5) Tabel 1 Status kerusakan DNA spermatozoa sebelum dan setelah kriopreservasi
15 kerusakan DNA oleh radioteraphy dan kemoteraphy; dan (6) kerusakan DNA disebabkan oleh lingkungan yang toksik. Dari beberapa penelitian yang terkait dengan evaluasi status DNA spermatozoa, belum ditemukan standar kerusakan DNA yang dapat dijadikan tolak ukur kualitas spermatozoa.
5
SIMPULAN DAN SARAN
Simpulan
Karakteristik spermatozoa kauda epididimis yang disimpan pada suhu 4 ˚C menurun seiring bertambahnya periode penyimpanan. Penggunaan media NaCl fisiologis sebagai media penyimpanan kauda epididimis tidak memberikan pengaruh yang lebih baik dalam mempertahankan kualitas spermatozoa. Lebih lanjut, terdapat kerusakan DNA spermatozoa meningkat setelah dilakukan kriopreservasi.
Saran
16
DAFTAR PUSTAKA
Agarwal A, Allamaneni S. 2004. Role of free radicals in female reproductive disease and assisted reproduction. Reprod Biomed Online 9(3):338-347. Agarwal A, Said TM. 2003. Role of sperm chromatin abnormalities and DNA
damage in male infertility. Hum Reprod Update 9(4):331-345.
Aitken R. 1989. The role of free oxygen radicals and sperm function. Int J Androl 12(2):95-97.
Bearden HJ, Fuquay JW. 1984. Applied animal reproduction. Reston Publishing Company, Inc.
Bishopric NH, Discher DJ, Kaiser S, Hernandez O, Sato B, Zang J, Webster KA. 1999. Hypoxia-activated apoptosis of cardiac myocytes requires reoxygenation or a pH shift and is independent of p53. J Clin Invest 104(3):239.
Bruemmer J, Reger H, Zibinski G, Squires E. 2002. Effect of storage at 5 C on the motility and cryopreservation of stallion epididymal spermatozoa. Theriogenology 58(2-4):405-407.
Curry M, Watson P. 1995. Sperm structure and function In: Gametes -The Spermatozoon. Cambridge (GB): Cambridge Univ Pr.
Eddy EM, O’Brien DA. 1994. The Spermatozoon. Dalam The physiology of reproduction. Editor Knobil E, Neill JD. New York. Raven Press.
Evenson D, Jost L, Corzett M, Balhorn R. 2000. Characteristics of human sperm chromatin structure following an episode of influenza and high fever: case study. J Androl 21 (5).
Ferna´ndez JL, Muriel L, Rivero MT, Govanez V, Vazquiez R, Alvarez JG. 2003. The Sperm Chromatin Dispersion Test: A Simple Method for the Determination of Sperm DNA Fragmentation. J Androl 24:59–66.
França LR, Avelar GF, Almeida FF. 2005. Spermatogenesis and sperm transit through the epididymis in mammals with emphasis on pigs. Theriogenology 63(2):300-318.
Fraser L, Parda A, Filipowicz K, Strzezek J. 2010. Comparison of post-thaw DNA integrity of boar spermatozoa assessed with the neutral comet assay and Sperm-Sus Halomax test kit. Reprod Domest Anim 45(5):e155-160. Fraser L and Strzez˙ek J. 2007. Is there a relationship between the chromatin status
and DNA fragmentation of boar spermatozoa following freezing–thawing? Theriogenology 68:248-257.
Fuentes-Mascorro G, Serrano H, Rosado A. 2000. Sperm chromatin. Arch Androl 45(3):215-225.
Gadea J, Molla M, Selles E, Marco M, Garcia-Vazquez F, Gardon J. 2011. Reduced glutathione content in human sperm is decreased after cryopreservation: Effect of addition of reduced glutathione to the freezing and thawing extenders. Theriogenology 62:40-46.
17 Garde J, Ortiz N, Garcia A, Gallego L, Landete-Castillejos T, Lopez A. 1998. Postmortem assessment of sperm characteristics of the red deer during the breeding season. Arch Androl 41(3):195-202.
Garner D, Hafez E. 2000. Spermatozoa and Seminal Plasma. In: Hafez B and Hafez ESE, editors. Reproduction Farm Animals 7th Editions. Baltimore (Lippincott Williams and Wilkins
Gatti J-L, Castella S, Dacheux F, Ecroyd H, Metayer S, Thimon V, Dacheux J-L. 2004. Post-testicular sperm environment and fertility. Anim Reprod Sci 82:321-339.
Halotech D. Madrid chamber of commerse. [internet]. [diunduh pada Desember 2014] Tersedia pada: (http://www.halotechdna.com).
Hammerstedt R, Graham JK, Nolan JP. 1990. Cryopreservation of mammalian sperm: what we ask them to survive. J Androl 11(1):73-88.
Hermo L, Robaire B. 2002. Epididymal cell types and their functions. The epididymis: from molecules to clinical practice. Springer. hlm 81-102. Hess RA, Zhou Q, Nie R, Oliveira C, Cho H, Nakai M, Carnes K. 2001. Estrogens
and epididymal function. Reprod Fertil Dev 13(4):273-283.
Johnson L, Blanchard T, Varner D, Scrutchfield W. 1997. Factors affecting spermatogenesis in the stallion. Theriogenology 48(7):1199-1216.
Johnson L, DL Thompson Jr, DD Varner. 2008. Role of Sertoli Cell Number and Function on Regulation of Spermatogenesis. Anim Reprod Sci 105: 23-51. Jones R. 1997. Plasma membrane structure and remodelling during sperm
maturation in the epididymis. J Reprod Fertil Suppl 53:73-84.
Kaabi M, Paz P, Alvarez M, Anel E, Boixo J, Rouissi H, Herraez P, Anel L. 2003. Effect of epididymis handling conditions on the quality of ram spermatozoa recovered post-mortem. Theriogenology 60(7):1249-1259.
Karja NW, Respaty E, Nuraini I, Prihatno S, Gustari S. 2010. Characteristic of frozen-thawed epididymal spermatozoa and refrigerated storage of ram spermatozoa. J Indonesian Trop Anim Agric 35(1):63-67.
Karja NW, Fahrudin M, Setiadi MA. 2013. In vitro fertility of post-thawed epididymal ram spermatozoa after storage at 5 °C before cryopreservation. Media Petern 36(1).
Kashir J, Heynen A, Jones C, Durrans C, Craig J, Gadea J, Turner K, Parrington J, Coward K. 2011. Effects of cryopreservation and density-gradient washing on phospholipase C zeta concentrations in human spermatozoa. J Reprod Fertil Suppl 23(2):263-267.
Kikuchi K, Nagai T, Kashiwazaki N, Ikeda H, Noguchi J, Shimada A, Soloy E, Kaneko H. 1998. Cryopreservation and ensuing in vitro fertilization ability of boar spermatozoa from epididymides stored at 4 °C. Theriogenology 50(4):615-623.
Love CC. 2005. The sperm chromatin structure assay: a review of clinical applications. Anim Reprod Sci 89(1):39-45.
Malcotti V, Pelufo V, Bergamo N, Aisen E. 2012. Recovery of epididymal spermatozoa from bull and red deer, stored at different times and temperatures before freezing–thawing. Anim Reprod Sci 52(8):741-745. Martinez-Pastor F, Guerra C, Kaabi M, Diaz A, Anel E, Herraez P, De Paz P, Anel
18
Melo C, Papa FO, Fioratti E, Villaverde A, Avanzi B, Monteiro G, Dell’Aqua J, Pasquini D, Alvarenga MA. 2008. Comparison of three different extenders for freezing epididymal stallion sperm. Anim Reprod Sci 107(3):331. Myres R, Gavin M, Zacbary J. 2012. Cellular Adaptation, Injury, and Death:
Morphologic, Biochemist, and Genetics Disease. Misouri (US): Elsevier Science.
Pamungkas F, Setiadi MA, Karja NW. 2012. Characteristics and in Vitro Fertilization Ability of Ram Spermatozoa: Comparison of Epididymal and Ejaculated Spermatozoa. Med Pet 35 (1):38-44.
Parks J, Graham J. 1992. Effects of cryopreservation procedures on sperm membranes. Theriogenology 38(2):209-222.
Purdy P. 2006. A review on goat sperm cryopreservation. Small Rum Res 63(3):215-225.
Russell LD dan de França LR. 1995. Building a testis. Tissue Cell 27(2):129-147. Rodriguez-Martinez H, Wallgren M. 2010. Advances in boar semen
cryopreservation. Veterinary medicine international 2011.
Saili T, Setiadi MA, Agungpriyono S, Toelihere MR, Budiono A. 2006. Pengaruh pengeringbekuan terhadap perubahan morfologi spermatozoa domba. Agriplus 16.
Sakkas D dan Alvarez JG. 2010. Sperm DNA fragmentation: mechanisms of origin, impact on reproductive outcome, and analysis. Fertil Steril 93(4):1027-1036.
Salamon S, Maxwell W. 2000. Storage of ram semen. Anim Reprod Sci 62(1):77-111.
Satrio F. 2015. Gambaran histopatologi kauda epididimis domba lokal (ovis sp.) yang disimpan pada suhu 4 ºC dengan dan tanpa media DMEM [Skripsi]. Bogor: Institut Pertanian Bogor.
Sankai T, Tsuchiya H, Ogonuki N. 2001. Short-term nonfrozen storage of mouse epididymal spermatozoa. Theriogenology 55(8):1759-1768.
Seli E, Gardner DK, Schoolcraft WB, Moffatt O, Sakkas D. 2004. Extent of nuclear DNA damage in ejaculated spermatozoa impacts on blastocyst development after in vitro fertilization. Fertil Steril 82(2):378-383.
Sostaric E, Aalberts M, Gadella B, Stout TA. 2008. The roles of the epididymis and prostasomes in the attainment of fertilizing capacity by stallion sperm. Anim Reprod Sci 107(3):237-248.
Sugiarti T, Triwulanningsih E, Situmorang P, Sianturi R, Kusumaningrum D. Penggunaan katalase dalam produksi semen dingin sapi. [Internet]. Pros. Seminar Nasional Teknologi Peternakan dan Veteriner. Bogor; 2004. hlm 4-5.
Tittarelli C, Savignone CA, Arnaudín E, Stornelli MC, Stornelli MA, de la Sota RL. 2006. Effect of storage media and storage time on survival of spermatozoa recovered from canine and feline epididymides. Theriogenology 66(6):1637-1640.
Toshimori K. 2003. Biology of spermatozoa maturation: an overview with an introduction to this issue. Microscopy research and technique 61(1):1-6. Vieira L, Gadea J, García-Vázquez F, Avilés-López K, Matás C. 2013. Equine
19 successfully cryopreserved and maintain their fertilization capacity. Anim Reprod Sci 136(4):280-288.
Wang AW, Zhang H, Ikemoto I, Anderson DJ, Loughlin KR. 1997. Reactive oxygen species generation by seminal cells during cryopreservation. Urology 49(6):921-925.
Wani N. 2009. In vitro embryo production in camel (Camelus dromedarius) from in vitro matured oocytes fertilized with epididymal spermatozoa stored at 4 ˚C. Anim Reprod Sci 111:67-79.
Ward W, Coffey D. 1991. Minireview DNA packaging and organization in mammalian spermatozoa: comparison with somatic cells. Biol Reprod 44:569-574.
Watson P, Plummer J, Allen W. 1987. Quantitative assessment of membrane damage in cold-shocked spermatozoa of stallions. J Reprod Fertil 35:651-653.
Yoshinaga K, Toshimori K. 2003. Organization and modifications of sperm acrosomal molecules during spermatogenesis and epididymal maturation. Microscopy research and technique 61(1):39-45.
Zribi N, Chakroun NF, El Euch H, Gargouri J, Bahloul A, Keskes LA. 2010. Effects of cryopreservation on human sperm deoxyribonucleic acid integrity. Fertil Steril 93(1):159-166.
20