KEMBUNG (Rastrelliger spp.)
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASINYA
Dengan ini saya menyatakan bahwa tesis Studi Ketahanan Hidup Larva
Anisakidae dengan Suhu Pembekuan dan Penggaraman pada Ikan Kembung
(Rastrelliger spp.) adalah karya saya sendiri dan belum diajukan dalam bentuk
apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah
disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir
tesis ini.
Bogor, J u l i 2007
La Ode Baladin
LA ODE BALADIN. Study on Survival of Anisakidae Larvae in Frozen and Salted Indian mackerels (Rastrelliger spp.). Under the supervision of FADJAR SATRIJA and R. ROSO SOEJOEDONO.
Indian mackerels (Rastrelliger spp.) can act as intermediate hosts of the life cycle of the zoonotic parasite. Humans who consume raw or undercooked marine fish are at risk of ingesting live larval nematodes of the family Anisakidae, which can cause anisakiasis.
This study was designed to explore prevalence of Anisakidae larvae in Indian mackerels (Rastrelliger spp.) samples collected from fishermen of Muara Angke Harbour Jakarta, and survival of the larvae in frozen and salted and Indian mackerel fillets. Anisakidae larvae were collected from the alimentary tract and muscular tissues of Indian mackerel purchased from the fishermen. The larvae were subsequently placed in the fillets stored in freezer (-2 oC and -20 oC) or salted with 25% kitchen salt.
Results of this study showed that 58.7% of the samples had been infected with Anisakidae larvae 3 worms in each fish. Three genera of Anisakidae Family were found, i.e. Anisakis simplex (70.8%), Pseudoterranova sp (16.7%), and Contracaecum sp (12.5%). Most of the larvae were isolated from the alimentary tract and surounding abdominal cavity which consisted of mesenteries and visceral organs surface (47.6%), liver (29.8%), abdominal cavity (15.7%) and gut (6.9%). Percantage of larval survival reduced significantly by lowered freezing temperature. 40 percent of the larvae remained survive after 168 hours frozen storage at -2 oC, whereas all larvae were already death when stored at -20 oC. All larvae died after the fillets salted for 24 hours. These finding is suggested that freezing -2 oC for 168 hour did not kill Anisakidae larvae in Indian Mackerels. The fact that raw or under cooked fish are not safe for human consumption.
RINGKASAN
LA ODE BALADIN. Studi Ketahanan Hidup Larva Anisakidae dengan Suhu Pembekuan dan Penggaraman pada Ikan Kembung (Rastrelliger spp.). Dibimbing oleh FADJAR SATRIJA dan R. ROSO SOEJOEDONO.
Indonesia sebagai negara kepulauan menjadikan ikan sebagai salah satu sumber protein hewani utama. Sumbangan protein dari ikan terhadap konsumsi protein hewani nasional lebih besar (57.3%) dibandingkan dengan protein hewani yang lain seperti daging (27.3%), telur (10.9%) dan susu (4.5%). Tingkat konsumsi ikan meningkat karena ikan merupakan sumber protein termurah. Ikan kembung (Rastrelliger spp.) adalah salah satu jenis ikan laut yang pemasarannya tersebar luas dan digemari oleh sebagian besar masyarakat Indonesia.
Ikan kembung bisa berperan sebagai hospes perantara dalam siklus hidup cacing-cacing tertentu. Manusia yang mengkonsumsi ikan mentah atau kurang masak beresiko terinfeksi larva Anisakidae yang dapat menyebabkan Anisakiasis. Anisakiasis adalah penyakit yang disebabkan oleh cacing dari famili Anisakidae dan tergolong zoonosis yang berbahaya. Sumber infeksi utama pada manusia karena mengkonsumsi ikan mentah yang tidak disimpan dalam freezer lemari pendingin, ikan asin yang tidak sempurna penggaramannya dan ikan asap yang tidak sempurna pengasapannya.
Mengingat kemungkinan risiko penularan Anisakiasis melalui ikan kembung (Rastrelliger spp.) yang banyak dikonsumsi masyarakat maka diperlukan penelitian untuk mengidentifikasi keberadaan larva Anisakidae pada sampel ikan kembung selanjutnya pula dipelajari pengaruh waktu penyimpanan pada suhu pembekuan dan penggaraman terhadap daya tahan hidup larva Anisakidae pada daging ikan kembung (Rastrelliger spp.) sebagai dasar untuk merancang program pengendalian Anisakiasis.
Penelitian ini bertujuan untuk mempelajari keberadaan larva Anisakidae pada ikan kembung dari pelabuhan rakyat Muara Angke Jakarta, serta ketahanan hidup larva tersebut di dalam filet ikan pada suhu pembekuan -2 oC dan -20 oC serta penggaraman 25%. Rancangan percobaan penelitian ini dilakukan dalam dua tahap yaitu tahap pertama isolasi larva cacing (stadium infektif) dari sampel ikan untuk mengumpulkan/koleksi larva cacing Anisakidae pada ikan kembung (Rastrelliger spp.) yang diperoleh dari pelabuhan rakyat Muara Angke Jakarta, serta tahap kedua uji ketahanan hidup larva dalam filet ikan kembung yang diawetkan dengan pembekuan dan penggaraman. Pada tahap pertama dilakukan pemeriksaan keberadaan larva Anisakidae terhadap 104 ekor sampel ikan kembung yang didapatkan dari nelayan di pelabuhan rakyat Muara Angke Jakarta. Pemeriksaan larva cacing dilakukan dengan membedah ikan dan memeriksa organ pencernaan dan rongga abdomennya. Larva yang ditemukan pada setiap sampel diisolasi dan dicatat lokasi/habitatnya. Selanjutnya larva disimpan dalam NaCl 0.9% sebelum digunakan untuk penelitian tahap kedua.
yaitu penyimpanan dalam suhu pembekuan – 2 oC dan – 20 oC selama 24 jam, 48 jam dan 72 jam dan 168 jam (7 hari) serta penggaraman 25% selama 6 jam, 12 jam dan 24 jam dan 48 jam. Pada setiap akhir periode perlakuan dilakukan pengamatan terhadap kondisi larva yang diklasifikasikan sebagai larva hidup dan larva mati. diperiksa organ pencernaan dan ototnya untuk melihat adanya larva Anisakidae. Larva yang didapat selanjutnya dimasukkan dalam filet ikan yang disimpan dengan tiga perlakuan yaitu suhu pembekuan -2 oC dan -20 oC serta penggaraman 25%.
Hasil dari penelitian ini menemukan infeksi larva Anisakidae pada ikan kembung dari pelabuhan rakyat Muara Angke dengan prevalensi 58.7% dan intensitas 3 larva per ekor ikan. Famili Anisakidae yang berhasil dikoleksi adalah 191 ekor yang terdiri dari 3 spesies yaitu Anisakis simplex (70.8%), Pseudoterranova sp. (16.7%) dan Contracaecum sp. (12.5%). Sebagian besar larva yang diisolasi berasal dari organ pencernaan dan di sekitar rongga abdomen yaitu pada mesenterium dan permukaan organ viseral (47.6%), hati (29.8%), rongga abdomen (15.7%), dan usus (6.9%). Persentase ketahanan hidup larva Anisakidae di dalam fillet ikan kembung (Rastrelliger spp.) setelah penyimpanan beku -2 oC menurun secara linear, dengan waktu pembekuan 24 jam, 48 jam, 72 jam dan 168 jam. Persamaan regresi yang menggambarkan persentase ketahanan hidup (y dalam %) dan lama penyimpanan (x dalam jam) yakni y=113 - 0.428x dengan nilai (R2=0.82, P<0.05). Persentase ketahanan hidup larva Anisakidae di dalam fillet ikan kembung (Rastrelliger spp.) setelah penyimpanan beku -20 oC menurun secara linear pada waktu penyimpanan beku 24 jam, 48 jam, 72 jam dan 168 jam. Persamaan regresi yang menggambarkan persentase ketahanan hidup (y dalam persen) dan waktu penyimpanan (x dalam jam) yakni y=124 - 0.724x dengan nilai (R2=0.92, P<0.05) sedangkan analisis terhadap ketahanan hidup setelah proses penggaraman 25% menurun secara linear, dari waktu penggaraman dari 6 jam hingga 48 jam. Persamaan regresi yang menggambarkan persentase ketahanan hidup (x dalam persen) dan waktu penggaraman (y dalam jam) yakni y=54.8 - 1.32x dengan nilai (R2=0.67, P<0.05).
Penurunan suhu penyimpanan menurunkan secara signifikan persentase ketahanan hidup larva Anisakidae. Pada penyimpanan beku -2 oC selama 168 jam sebanyak 40% larva masih bertahan hidup, sedangkan pada saat yang sama semua larva yang disimpan pada -20 oC telah mati. Pada perlakuan penggaraman 25% semua larva telah mati setelah disimpan selama 24 jam. Dari percobaan ini dapat disimpulkan bahwa ikan mentah atau kurang masak yang disimpan beku -2 oC selama 168 jam belum aman untuk dikonsumsi jika pengolahannya tidak tepat dan pemasakkaanya tidak sempurna.
© Hak cipta milik IPB, tahun 2007
Hak cipta dilindungi
KEMBUNG (
Rastrelliger
spp
.
)
LA ODE BALADIN
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Judul Tesis : Studi Ketahanan Hidup Larva Anisakidae dengan Suhu
Pembekuan dan Penggaraman pada Ikan Kembung
(Rastrelliger spp.)
Nama : La Ode Baladin
NIM : B 054050081
Disetujui
Komisi Pembimbing
drh. Fadjar Satrija, MSc., Ph.D Ketua
drh. R. Roso Soejoedono, MPH, DEA Anggota
Diketahui
Ketua Program Studi Kesehatan
Masyarakat Veteriner
Dr. drh. Denny Widaya Lukman, M.Si.
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga penulis dapat menyelesaikan tesis dengan judul “ Studi Ketahanan
Hidup Larva Anisakidae dengan Suhu Pembekuan dan Penggaraman pada Ikan
Kembung (Rastrelliger spp.)”.
Terima kasih penulis ucapkan kepada Bapak drh. Fadjar Satrija, M.Sc., Ph.D
dan drh. R. Roso Soejoedono, MPH, DEA selaku pembimbing yang telah banyak
meluangkan waktu untuk membimbing, mengarahkan dan mendorong penulis
sejak awal usulan penelitian hingga selesainya tesis ini, serta Bapak Dr. drh.
Denny Widaya Lukman, M.Si selaku Ketua Program Studi KMV yang banyak
memberi saran dan dorongan kepada penulis untuk menyelesaikan tesis ini.
Disamping itu penghargaan penulis sampaikan penghargaan kepada Ibu Dr.
drh. A. Winny Sanjaya, MS, Ibu Dr. drh. Retno Damayanti Soejoedono, MS dan
Ibu drh. Risa Tiuria, MS, Ph.D beserta staf yang telah berkenaan memberikan
kesempatan kepada penulis untuk menggunakan laboratorium selama pelaksanaan
penelitian ini. Terima kasih pula yang sebanyak-banyaknya kepada pak Sulaeman,
ibu Djulaeha, pak Tedi Subarkah dan pak Yahendra yang telah banyak membantu
kerja penulis di laboratorium.
Akhirnya hanya kepada Allah jualah penulis kembalikan segala urusan, dan
hanya Allahlah yang akan memberikan balasan yang setimpal atas semua
kebaikan yang telah diberikan.
Amin ya Allah, ya Rabbal Alamiin.
Bogor, J u l i 2007
RIWAYAT HIDUP
Penulis dilahirkan di Raha Kabupaten Muna pada tanggal 12 Desember
1973 dari ayah La Ode Ndoasa (almarhum) dan ibu Wa Ode Nuriba. Penulis
merupakan putra pertama dari empat bersaudara.
Tahun 1992 penulis lulus dari Sekolah Perawat Kesehatan (SPK) PPNI
Kendari yang selanjutnya diangkat menjadi Pegawai Negeri Sipil dan bekerja
sebagai Perawat di Puskesmas dan Rumah Sakit Umum Daerah Kabupaten Muna.
Penulis berkesempatan melanjutkan pendidikan pada Akademi Keperawatan
Depkes Kendari pada tahun 1997 dan lulus tahun 2000 selanjutnya pada tahun
2004 penulis lulus pada Program Studi Ilmu Kesehatan Masyarakat Universitas
Haluoleo Kendari.
Ketertarikan penulis berawal ketika menyusun program perencanaan
kesehatan bidang pemberantasan penyakit menular dan didorong oleh keinginan
yang kuat untuk mempelajari penyakit menular infeksi pada manusia yang
bersumber dari hewan maka penulis memutuskan untuk melanjutkan pendidikan
pada Program Studi Kesehatan Masyarakat Veteriner (KMV) di Fakultas
Kedokteran Hewan (FKH) IPB Bogor.
Selama mengikuti program S2, kehausan akan organisasi tidak menyurutkan
niat penulis untuk berpartisipasi pada Musyawarah Kabupaten Persatuan Perawat
Nasional Indonesia (PPNI) dan Alhamdulillah penulis dipercayakan dan terpilih
sebagai ketua umum periode tahun 2007 – 2012.
Penulis menikah pada tahun 1995 dengan Nina S La Ede dan telah
dikaruniai 4 (empat) orang putra putri yaitu Sazkia Anissa, Al Ostaf Muhammad,
Halaman
DAFTAR TABEL... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
Hipotesis Penelitian... 4
TINJAUAN PUSTAKA ... 5
Deskripsi Ikan Kembung ... 5
Komposisi dan Nilai Gizi Ikan Kembung... 6
Proses Perubahan pada Ikan... 6
Pola Migrasi Mamalia Laut sebagai Inang Definitif Cacing Anisakidae.... 7
Morfologi dan Karakteristik Larva Anisakidae... 8
Siklus Hidup Larva Anisakidae... 9
Prevalensi dan Intensitas Larva Anisakidae... 11
Penyakit pada Manusia dan Pengendaliannya ... 13
Kemampuan Hidup Larva Anisakidae pada Suhu Dingin dan Suhu Beku14 BAHAN DAN METODE ... 15
Tempat dan Waktu Penelitian ... 15
Rancangan Percobaan ... 15
Koleksi dan Identifikasi Larva ... 17
xi
xi
Identifikasi Larva ... 22
Ketahanan Hidup Larva dengan Suhu Pembekuaan ... 28
Ketahanan Hidup Larva dengan Proses Penggaraman 25% ... 34
Pengamatan pH ... 36
SIMPULAN ... 39
SARAN ... 39
DAFTAR PUSTAKA ... 41
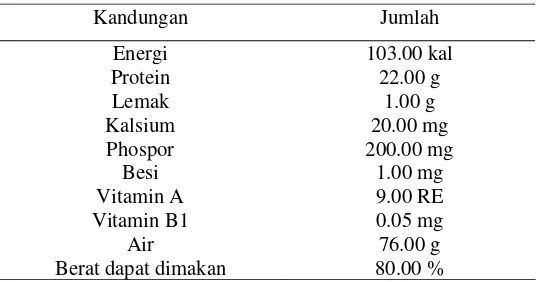
Halaman 1. Komposisi dan nilai gizi ikan kembung (dalam 100 gram daging) ... 6
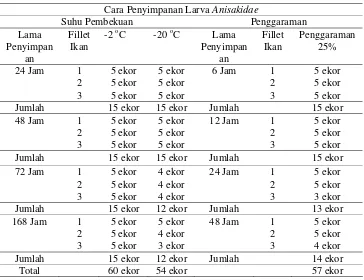
2. Penyimpanan larva Anisakidae pada suhu pembekuan dan penggaraman
berdasarkan lama penyimpanan ...16
3. Jumlah larva Anisakidae menurut lokasi parasit pada organ ikan
kembung (Rastrelliger spp.)...24
4. Hasil pengamatan larva Anisakidae pada penyimpanan -2 oC
berdasarkan lama penyimpanan ...28
5. Hasil pengamatan larva Anisakidae pada penyimpanan -20 oC
berdasarkan lama penyimpanan ...30
6. Hasil pengamatan larva Anisakidae pada penggaraman 25%
berdasarkan lama penyimpanan ...34
7. Hasil pengamatan perubahan pH pada ikan pada berbagai penyimpanan
DAFTAR GAMBAR
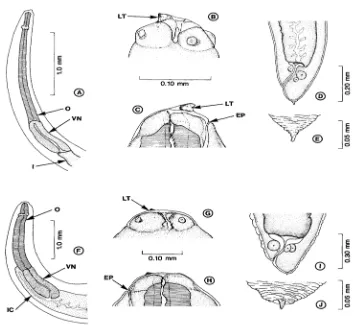
Halaman 1. Morfologi larva Anisakidae ... 9
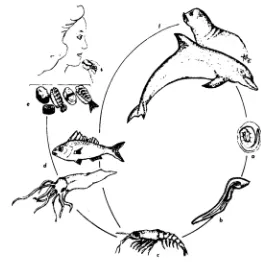
2. Siklus hidup larva Anisakidae... 11
3. Prosedur identifikasi larva dengan menggunakan pewarnaan minyak
cengkeh... 20
4. Sampel ikan yang dipersiapkan untuk dicobakan pada perlakuan
penyimpanan suhu pembekuan dan penggaraman... 21
5. Infeksi larva Anisakidae pada ikan kembung (Rastrelliger spp.)
menurut spesiesnya... 22
6. Larva Anisakidae berdasarkan spesiesnya... 23
7. Sejumlah larva berdasarkan lokasi pada organ ikan... 26
8. Rata-rata intensitas larva Anisakidae pada ikan kembung (Rastrelliger
spp.) menurut panjang ikan... 27
9. Ketahanan hidup larva pada penyimpanan suhu pembekuan -2 oC
terhadap waktu 24 jam, 48 jam, 72 jam dan 168 jam... 29
10. Ketahanan hidup larva pada penyimpanan suhu pembekuan -20 oC
terhadap waktu 24 jam, 48 jam, 72jam dan 168 jam... 31
11. Beberapa kerusakan pada membran, usofagus, intestinal, pada larva
cacing Anisakidae pada proses pembekuan dan penggaraman... 33
12. Ketahanan hidup Larva pada penggaraman 25% terhadap waktu 6 jam,
Halaman 1. Sejumlah ikan yang dicobakan larva Anisakidae pada penyimpanan
-2 oC dan -20 oC dan penggaraman 25% berdasarkan
ukurannya……….. 46
2. Hasil pengolahan data terhadap ketahanan hidup larva pada
penyimpanan suhu pembekuan -2 oC……….... 47
3. Hasil pengolahan data terhadap ketahanan hidup larva pada
penyimpanan suhu pembekuan -20 oC……….. 48
4. Hasil pengolahan data terhadap ketahanan hidup larva pada proses
PENDAHULUAN
Latar Belakang
Indonesia sebagai negara kepulauan menjadikan ikan sebagai salah satu
sumber protein hewani utama. Sumbangan protein dari ikan terhadap konsumsi
protein hewani nasional lebih besar (57.3%) dibandingkan dengan protein hewani
yang lain seperti daging (27.3%), telur (10.9%) dan susu (4.5%) (Deptan 1990).
Tingkat konsumsi ikan meningkat karena ikan merupakan sumber protein hewani
termurah. Ikan kembung (Rastrelliger spp.) adalah salah satu jenis ikan laut yang
pemasarannya tersebar luas dan digemari oleh sebagian besar masyarakat
Indonesia. Ikan kembung biasanya dimasak dan dihidangkan dalam bentuk ikan
bakar, ikan goreng, ikan gule, atau bentuk masakan lainnya.
Seperti jenis ikan lainnya, ikan kembung termasuk bahan makanan yang
mudah rusak apabila proses penanganan dan penyimpanannya tidak tepat.
Sebelum diolah ikan biasanya disimpan dalam beberapa cara, tergantung
kebiasaan dan kemampuan ekonomi masyarakat. Masyarakat yang memiliki
lemari es (refrigerator) menyimpan ikan dalam lemari es atau freezer untuk
beberapa hari dan bagi masyarakat yang tidak memilikinya menyimpan ikan pada
suhu kamar untuk beberapa waktu sebelum dimasak. Cara lain yang banyak
dilakukan oleh masyarakat Indonesia untuk mengawetkan ikan yaitu dengan
penggaraman.
Daging ikan yang dikonsumsi dalam keadaan matang tidak akan
menimbulkan masalah kesehatan, tetapi bila dikonsumsi dalam keadaan kurang
matang atau mentah maka kemungkinan adanya larva cacing zoonosis khususnya
larva Anisakidae akan berdampak pada kesehatan. Pada suku-suku tertentu di
Indonesia, terdapat jenis makanan berbahan daging ikan yang dikonsumsi dalam
keadaan tidak dimasak, cukup dengan memberi cuka atau asam beserta
bumbu-bumbu secukupnya, misalnya na niura di daerah Tapanuli dan lawara di Sulawesi
Selatan. Bangsa-bangsa lain juga mengenal hidangan-hidangan ikan mentah
seperti somfak di Thailand, sashimi di Jepang dan caviar di Siberia (Muller 1975).
Ikan kembung bisa berperan sebagai hospes perantara dalam siklus hidup
spp.) cacing masih dalam stadium larva, namun bila manusia makan daging ikan
mentah atau kurang masak, larva cacing dapat masuk ke tubuh manusia pada
mukosa lambung dan usus halus akan tetap hidup namun tidak mampu
berkembang menjadi dewasa dan tidak dapat hidup seperti cacing lainnya (Yman
2003).
Anisakiasis adalah penyakit yang disebabkan oleh cacing dari famili
Anisakidae dan tergolong zoonosis yang berbahaya. Sumber infeksi utama pada
manusia karena mengkonsumsi ikan mentah yang tidak disimpan dalam freezer
lemari pendingin, ikan asin yang tidak sempurna penggaramannya dan ikan asap
yang tidak sempurna pengasapannya (Acha dan Szifres 2003). Infeksi parasit pada
manusia akan menimbulkan reaksi alergis yang meliputi urtikaria, anafilaksis,
dermatitis, gastroenteritis, sampai gejala asma (Bircher et al. 2000). Pada
anisakiasis lambung (gastric anisakiasis) gejala-gejala muncul 12 – 24 jam
setelah mengkonsumsi ikan mentah atau kurang masak yang meliputi nyeri pada
daerah epigastrium disertai mual dan muntah. Anisakiasis usus (intestinal
anisakiasis) terjadi setelah 7 hari setelah masa inkubasi larva yang ditandai oleh
nyeri yang hebat pada perut bagian bawah, mual, muntah, demam, diare dan
kadang-kadang ada darah dalam faeses (Ortega dan Cocera 2000).
Kejadian anisakiasis pada manusia pertama kali dilaporkan tahun 1968 yaitu
160 kasus ditemukan di Belanda, sehingga sejak saat itu ikan wajib dibekukan
(freezing) selama 24 jam sebelum dipasarkan untuk mengurangi kejadian
anisakiasis pada manusia. Jepang merupakan negara dengan angka prevalensi
tertinggi kasus anisakiasis yaitu 487 kasus terjadi selama tahun 1976 dan rata-rata
infeksi tertinggi pada kelompok umur 20-50 tahun, sedangkan di Korea Selatan
pada tahun 1989–1992 ditemukan 107 kasus. Kasus paling banyak disebabkan
oleh Anisakis simplex dan sisanya adalah Pseudoteranova sp.(Acha dan Szyfres
2003).
Belum banyak informasi tentang kejadian penyakit Anisakiasis di Indonesia.
Studi seroepidemiologi terhadap 244 pasien yang berkunjung di Rumah Sakit
Sidoarjo menunjukkan 11% seropositif terhadap antigen Anisakis sp. (Uga et al.
1996). Pengamatan pada ikan di beberapa perairan Indonesia menunjukkan
3
3 Sunda (67%), Laut Bali (67%) dan Laut Nusa Tenggara Timur (17%), ikan Tuna
di Laut Bali (67%) dan Laut Nusa Tenggara Timur (17%) dan ikan Kerapu di
Selat Sunda (25%), Laut Bali (43%) dan Laut Nusa Tenggara Timur (17%)
(Hariyadi 2006).
Pada era globalisasi batas antar negara akan semakin kabur dan mobilitas
manusia semakin cepat. Bangsa-bangsa lain yang datang ke Indonesia tentu saja
juga membawa kebiasaan dan kebudayaanya, termasuk kebiasaan dan budaya
makan. Seiring dengan hal itu di Indonesia khususnya Jakarta, semakin banyak
restoran-restoran asing yang menghidangkan daging ikan mentah atau setengah
matang yang cepat atau lambat akan berpeluang timbulnya kasus penyakit
parasiter khususnya Anisakiasis pada manusia.
Hasil penelitian Adams et al (1999) menunjukkan bahwa ikan yang
mengandung larva Anisakissimplex yang dimasak dengan oven microwave adalah
rata-rata ketahanan hidupnya adalah 31% pada suhu 60 oC, 11% pada suhu 65 oC,
dan 3% pada suhu 74 oC serta 0% pada suhu 77 oC. Pada penelitian Dong et al.
(2003) larva Anisakidae dapat terbunuh semua pada tekanan high-hydrostatic 200
Mpa dengan suhu 0–15 oC selama 10 menit. Pada penelitian Adams et al. (2005)
yang lain menemukan bahwa ketahanan hidup larva Anisakis simplex dengan
pembekuan -20 oC selama 60 jam mampu membunuh semua larva. Hasil
Penelitian di atas menunjukkan bahwa dengan pemanasan 74 oC daging ikan
belum terbebas dari larva cacing Anisakis simplex jika dikonsumsi.
Mengingat kemungkinan risiko penularan Anisakiasis melalui ikan kembung
(Rastrelliger spp.) yang banyak dikonsumsi masyarakat maka diperlukan
penelitian untuk mengidentifikasi keberadaan larva Anisakidae pada sampel ikan
kembung selanjutnya pula dipelajari pengaruh waktu penyimpanan pada suhu
pembekuan dan penggaraman terhadap daya tahan hidup larva Anisakidae pada
daging ikan kembung (Rastrelliger spp.) sebagai dasar untuk merancang program
pengendalian Anisakiasis.
Tujuan Penelitian
Tujuan penelitian ini adalah
1. Mengidentifikasi keberadaan larva Anisakidae pada sampel ikan kembung
2. Mempelajari dampak penyimpanan beku dan penggaraman terhadap
ketahanan hidup larva Anisakidae pada daging ikan kembung (Rastrelliger
spp.).
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai
keberadaan larva Anisakidae pada ikan kembung (Rastrelliger spp.) dan pengaruh
waktu penyimpanan pada suhu pembekuan dan penggaraman terhadap daya tahan
hidup larva. Selanjutnya diharapkan tersedia bahan pangan dari daging ikan yang
aman untuk dikonsumsi agar terhindar dari penyakit parasit yang ditimbulkan
akibat mengkonsumsi daging ikan mentah atau kurang masak.
Hipotesis Penelitian
Hipotesis Penelitian ini adalah
1. Teridentifikasinya beberapa larva Anisakidae dari sampel ikan kembung yang
dikoleksi dari pelabuhan rakyat Muara Angke Jakarta.
2. Suhu penyimpanan beku -2 oC, -20 oC dan penggaraman 25% mempengaruhi
TINJAUAN PUSTAKA
Deskripsi Ikan Kembung
Ikan kembung(Rastrelliger Spp) merupakan spesies dengan populasi yang
terbanyak yang hidup hampir di seluruh wilayah perairan Indonesia. Oleh
karenanya ikan kembung sangat mudah didapat di pasaran dengan harga yang
relatif terjangkau dan banyak dikonsumsi oleh sebagian masyarakat Indonesia.
(Ditjen Perikanan 1990).
Klasifikasi ikan kembung adalah sebagai berikut:
Phylum : Chordata
Kelas : Pisces
Ordo : Percomorphi
Famili : Scombridae
Genus : Rastrelliger
Ciri-ciri ikan kembung ini meliputi badan tidak langsing, pendek, gepeng,
tapisan insang halus berjumlah 29-34 buah, dan terdapat pada bagian bawah busur
insang pertama. Sisik pada garis rusuk 120-131 buah. Panjang usus 3-3.4 kali
panjang badan. Sirip punggung pertama berjari-jari lemah 12 buah. Di belakang
sirip punggung dan sirip dubur terdapat 5 jari-jari lepas (filet) (Saanin 1984).
Ikan kembung termasuk ikan pemakan plankton halus dan habitatnya
mendekati pantai serta membentuk gerombolan besar. Ikan kembung dapat
mencapai panjang 30 cm, namun umumnya 15-20 cm. Ikan kembung berwarna
biru kehijauan bagian atas, putih perak bagian bawah, totol-totol hitam pada
bagian punggung (diatas garis rusuk). Sirip punggung pertama kuning keabuan,
dengan pinggiran gelap. Sirip dada, perut kuning maya-maya, sedikit gelap dan
lain-lain sirip kekuningan (Ditjen Perikanan 1990).
Menurut Ditjen Perikanan (1990) daerah penyebaran ikan kembung meliputi
pantai Indonesia dengan konsentrasi terbesar di Kalimantan, Sumatera Barat, Laut
Jawa, Selat Malaka, Muna-Buton, Arafuru. Ikan kembung merupakan spesies
epipelagic dan neritic yaitu ikan yang hidup pada permukaan laut, bergerombol
dan menyukai daerah dengan suhu permukaan minimum 17 oC, suhu optimum
Komposisi dan Nilai Gizi Ikan Kembung
Ikan kembung mengandung beberapa jenis senyawa kimia, antara lain yang
dominan yaitu air, protein, lemak dan mineral. Senyawa kimia yang bernilai gizi
yaitu protein, lemak dan mineral sedangkan air merupakan penyusun terbesar
yang kurang mempunyai nilai gizi. Selain senyawa bergizi tersebut, ikan
mengandung vitamin yang mempunyai nilai gizi yang cukup berarti. Komposisi
dan nilai gizi ikan kembung tercantum pada Tabel 1.
Ikan kembung termasuk jenis ikan mackerel. Ikan mackerel digolongkan
sebagai ikan kategori B yaitu mengandung minyak sedang (medium oil) 5-15%
dan berprotein tinggi (high protein) 15-20%. Namun juga dapat dikatakan tipe C
yaitu mengandung minyak tinggi (high oil) lebih dari 15% (Stansby 1982).
Proses Perubahan pada Ikan
Proses perubahan pada tubuh ikan terjadi karena adanya aktivitas enzim,
mikroorganisma, dan kimiawi (Hadiwiyoto 1993). Akibat dari ketiga perubahan
ini berbeda-beda menurut jenis ikan. Ikan-ikan yang berdaging putih yang
mempunyai kadar lemak rendah, proses oksidasi tidak begitu merupakan masalah
yang serius selama penyimpanan. Setelah ikan mati, berbagai proses perubahan
fisik maupun kimiawi berlangsung cepat. Semua proses perubahan ini akhirnya
mengarah ke pembusukan.
Tabel 1 Komposisi dan nilai gizi ikan kembung (dalam 100 gram daging)
Kandungan Jumlah
Sumber : Hardinsyah dan Briawan (1990)
Perubahan rigor mortis merupakan akibat dari suatu seri perubahan kimiawi
7
7 sirkulasi darah terhenti dan suplai oksigen berkurang sehingga terjadi perubahan
glikogen menjadi asam laktat. Perubahan ini menyebabkan pH tubuh ikan
menurun diikuti pula dengan penurunan jumlah ATP serta jaringan otot tidak
mampu mempertahankan kekenyalannya.
Setelah ikan mati, enzim masih mempunyai kemampuan untuk bekerja
secara aktif tetapi sistim kerja enzim menjadi tidak terkontrol karena organ
pengontrol tidak berfungsi lagi. Akibatnya enzim ini dapat merusak organ tubuh
lain. Peristiwa ini disebut autolisis dan berlangsung setelah ikan melewati fase
rigor mortis. Ciri terjadinya perubahan secara autolisis ini adalah dengan
dihasilkannya amoniak sebagai hasil akhir (Martin et al. 1986).
Pola Migrasi Mamalia Laut sebagai Inang Definitif Cacing Anisakidae
Mamalia laut seperti Lumba-lumba dan Paus merupakan inang definitif dari
cacing Anisakidae. Walaupun cacing ini merupakan parasit yang lazim ditemukan
dalam tubuh beberapa mamalia laut, pola migrasi dari Lumba-lumba ataupun Paus
dapat menjadi sarana penyebaran cacing parasitik tersebut kepada satwa lainnya.
Perairan Indonesia di sekitar Taman Nasional Komodo, pulau Alor, pulau Antar,
dan Lembata, Nusa Tenggara Timur merupakan jalur lintasan ikan Paus dari
Samudra Pasifik dan perairan Timur Indonesia ke Samudra Indonesia dan juga
sebaliknya melewati daerah ini disamping satwa setempat (residen) yang
menggunakan jalur lintasan ini sebagai daerah jelajah mereka (Kahn 2001;
Pet-Soede 2002).
Infestasi dan sebaran parasit ini pada ikan sangat terkait erat dengan
ketahanan inang definitifnya yaitu mamalia laut. Daya tahan inang yang rendah
akan meningkatkan infestasi parasit cacing pada ikan yang mengakibatkan
kerusakan jaringan tubuh ikan. Dalam ekosistim laut, satwa yang menempati
posisi atas dalam piramida makanan memiliki risiko infestasi yang tinggi oleh
berbagai macam parasit apabila sumber pakan (mangsa) mereka telah terinfeksi
oleh parasit.
Dengan karakteristik parasit cacing dan reaksi terhadap perubahan
lingkungan yang berbeda-beda, cacing parasit nematoda memiliki potensi sebagai
sebagai bio-indikator kondisi perairan dan juga status kesehatan satwa liar itu
sendiri.
Morfologi dan Karakteristik Larva Cacing Anisakidae
Famili Anisakidae sering disebut juga sebagai kelompok cacing anisakis
yang sebenarnya terdiri dari beberapa spesies. Sejauh ini spesies-spesies yang
sudah dilaporkan menginfeksi manusia adalah Anisakis simplex, Pseudoterranova
sp.dan Contracaecum sp. Kadang-kadang spesies Contracaecum sp. disebut juga
sebagai spesies Hysterothylscium. Dari keempat spesies ini yang paling banyak
menginfeksi manusia adalah Anisakis simplex (Sakanari dan McKerrow 1989;
Miyazaki 1991).
Keterkaitan antara panjang larva A. Simplex terhadap usia ikan telah
dilaporkan oleh Strømnes dan Andersen (2003) bahwa sejumlah larva 3 A.
simplex memiliki panjang lebih dari 28 mm dan terus bertambah panjangnya
seiring dengan bertambahnya usia ikan.
Larva Anisakis simplex mempunyai panjang 11.2–34.5 mm, lebar 0.44–0.55
mm usofagusnya relatif panjang dan disertai oleh jaringan kelenjar, tidak
mempunyai apendiks atau sekum, bibirnya tidak jelas, giginya menonjol ke depan
dan mempunyai saluran pencernaan yang sederhana yaitu usofagus, ventrikulus
dan usus halus (intestine) sedangkan Pseudoterranova sp mempunyai usofagus,
venrikulus, usus halus (intestine) dan sekum secara langsung berada pada bagian
anteriornya dengan total panjangnya 25–50 mm dan lebar 0.3–1.2 mm
sebagaimana terlihat pada Gambar 1 (Hurst 1984; Sakanari dan McKerrow 1989).
Berbeda dengan ukuran cacing dewasa anisakis mempunyai ukuran panjang untuk
cacing dewasa jantan yaitu 38-60 mm dan untuk cacing dewasa betina yaitu 45-
9
9 Gambar 1 Morfologi larva Anisakidae. A–E Larva 3 Anisakis simplex, F–J Larva
3 Pseudoterranova. A dan F dilihat dari anterior dan lateral; B dan G kepala dilihat dari lateral; C dan H kepala dilihat dari sagital; D dan I dilihat dari posterior dan lateral; E dan J ekstremitas posterior (mukron). LT (gigi); EP(ekskresi); I (intestin); IC (intestinalsekum); O (usofagus); VN (ventrikulus) (Hurst 1984).
Siklus Hidup Larva Anisakidae
Laporan menyebutkan bahwa angka infeksi pada Lumba-lumba bisa
mencapai 70% dan jumlah cacing pada seekor ikan Lumba-lumba bisa mencapai
1.200 ekor cacing. Survei yang dilakukan oleh Beron-Vera et al. (2001) pada
Lumba-lumba Commerson (Cephalorhynchus commersonii) di perairan Atlantik
Selatan menunjukkan bahwa nematoda dari spesies Anisakis memiliki prevalensi
yang tinggi (100% di Patagonia bagian tengah dan 87% di Tiera del Fuego)
dengan rata-rata intensitas yang berbeda (21 di Patagonia dan 9 di Tiera del
Fuego). Dengan demikian, nematoda zoonotik seperti Anisakis sp. memiliki
potensi untuk dijadikan indikator perairan, atau kondisi kesehatan satwa liar yang
Telur yang keluar bersama tinja hospes definitifnya akan menetas di air.
Larva stadium kedua yang keluar dari telur akan ditelan oleh hospes perantara
pertama lalu berkembang menjadi larva stadium ketiga awal. Hospes perantara
pertamanya adalah udang Thysanoessa dan Euphausia. Bila hospes perantara ini
dimakan oleh hospes perantara kedua, di dalam tubuhnya larva berkembang
menjadi larva stadium ketiga lanjut. Hospes perantara kedua dan hospes
parateniknya meliputi ikan (pisces) laut, cumi-cumi dari berbagai jenis, dan
membentuk rantai penularan satu dengan yang lain sedemikian kompleksnya.
Kedua kategori hospes ini (hospes perantara kedua dan paratenik) agak sulit
dibedakan, namun keduanya memegang peranan penting sebagai sumber infeksi
pada manusia. Diantaranya yang penting adalah: ikan pollack alaska, tengiri laut,
ikan hering, ikan forel (trout), ikan berkepala merah, ikan mackerel, ikan bonito
dan sebagainya. Larva terutama berparasit pada permukaan organ-organ di rongga
abdomen, demikian juga pada otot (Sakanari dan McKerrow 1989; Miyazaki
1991).
Cacing parasitik dari tiga perairan yang berbeda di Indonesia bagian selatan
telah diisolasi dan tercatat memiliki resiko zoonosis yaitu dari perairan Bali
adalah Anisakis sp., Pseudoterranova sp., dan Echinochasmus sp., dari perairan
Selat Sunda adalah Serrasentis sp. Bulbosona sp. dan Anisakis sp.
Pseudoterranova sp dan dari perairan Nusa Tenggara Timur genus Capillaria sp
(Hariyadi 2006).
Parasit yang masuk ke tubuh manusia adalah larva stadium ketiga yang
masuk bersama daging ikan yang dimakan. Dalam tubuh manusia larva akan
hidup dan pada umumnya tetap sebagai larva stadium ketiga, namun
kadang-kadang juga berkembang hingga larva stadium keempat atau larva yang sedang
berganti kulit. Dalam hal ini manusia berperan sebagai hospes paratenik.
Kebanyakan larva menyerang sub mukosa namun bisa juga mencapai organ-organ
di rongga abdomen (Miyazaki 1991).
Infeksi cacing parasitik akibat predasi dan juga ingesti larva telah dipelajari
dalam penelitian Køie (2001) yang menunjukkan bahwa jenis ikan Gasterosteus
aculeatus terinfeksi cacing Anisakis sp. akibat memakan inang (krustasea atau
11
11 melakukan enkapsulasi di jaringan otot ikan Gasterosteus aculeatus dan
Plathicthys flesus (ikan sebelah) dimana larva tersebut dapat bertahan hidup
sampai 2 tahun.
Gambar 2 Siklus hidup larva Anisakidae
Berdasarkan siklus hidup pada Gambar 2 dapat dijelaskan sebagai berikut
(a) telur anisakis dewasa dikeluarkan dari tubuh ikan mamalia laut melalui faeses.
Telur menetas menjadi larva (b) dimakan oleh udang Thysanoessa dan Euphausia
(c). Ikan dan cumi-cumi (d) menjadi terinfeksi setelah makan udang. Manusia
terinfeksi (e) jika makan ikan atau cumi mentah atau kurang masak (Sakanari dan
McKerrow 1989).
Prevalensi dan Intensitas Larva Anisakidae
Tingkat penularan suatu parasit pada ikan dinyatakan dalam prevalensi dan
intensitas. Prevalensi menggambarkan besarnya presentase ikan yang terserang
parasit pada suatu populasi ikan, sedangkan intensitas menggambarkan
suatu parasit dipengaruhi oleh berbagai faktor, seperti jenis ikan, ukuran ikan,
umur ikan, jenis kelamin ikan, waktu dan tempat serta kondisi perairan tempat
ikan itu berada. Intensitas larva nematoda yang tinggi dalam tiap gram daging
ikan disebabkan oleh kondisi sistim pertahanan inang (IL-4 dan IL-10) yang
menyebabkan larva Anisakidae bermigrasi ke luar saluran cerna dan memilih
jaringan lemak di mesenterium usus untuk bertahan hidup dan tumbuh (Schopf et
al. 2002; Stromnes dan Andersen 2003). Lokasi mesenterium ini berdekatan
dengan daging (otot) di sekeliling abdomen.
Dikatakan pula perubahan fauna parasit pada ikan bukan hanya disebabkan
oleh peningkatan daya tahan tubuh ikan (imunitas ikan), tetapi juga akibat faktor
ekologis seperti perubahan diet ikan dan migrasi ikan. Namun demikian secara
umum parasit lebih banyak ditemukan pada anak ikan baik jenis maupun besarnya
populasi parasit pada individu ikan. Hal ini beralasan mengingat anak ikan
mempunyai tubuh yang lebih lunak, rentan terhadap perubahan nutrisi dan
lingkungan selain daya resistensi masih rendah akibat sistim imunitas yang belum
berkembang (Hadiroseyani 1992).
Menurut Rocka (2004) dan Roepstorff et al. (1993) bahwa larva parasitik
nematoda stadium dewasa pada ikan mamalia laut pada umumnya ditemukan pada
usus, mesenterium dan otot ikan, larva anisakis terdapat juga di dalam daging ikan
(flesh), distribusi larva anisakis dalam jaringan ikan horse-mackerel adalah pada
rongga perut 61.2%, organ viseral 37% dan jaringan otot 1.8%, menurut laporan
Adroher et al. (1995) bahwa prevalensi infeksi anisakis menurut lokasi parasit
dalam jaringan ikan adalah rongga perut 83%, organ viseral 45.6% dan jaringan
otot 3.3%.
Cacing parasitik nematoda dapat menginfeksi semua jenis ikan dengan
variasi intensitas yang beragam, trematoda hanya menginfeksi ikan ekor kuning
dan kerapu dengan pengecualian pada beberapa ikan tuna dan acanthocephala
hanya menginfeksi ikan tuna, ini menunjukkan bahwa banyaknya nematoda dan
acanthocephala sangat bervariasi (Hariyadi 2006 ). Menurut laporan Nabib &
Pasaribu (1989) bahwa variasi intensitas disebabkan oleh banyaknya parasit
13
13 Penyakit pada Manusia dan Pengendaliannya
Anisakiasis dapat terjadi secara klinis dalam beberapa bentuk setelah larva
menembus jaringan mukosa usus berdasarkan penyebabnya, bentuk Anisakiasis
yang disebabkan oleh Pseudoterranova sp. kasus infeksinya pada umumnya tidak
menunjukkan gejala tetapi kadang-kadang larvanya bisa ditemukan ketika larva
hidup keluar melalui muntah atau dalam faeses.
Bentuk-bentuk invansif larva dapat menembus lambung atau sub mukosa
usus halus menyebabkan edema, erosi, ulser dan perdarahan. Gejala-gejala
Anisakiasis lambung terlihat 12 – 24 jam setelah mengkonsumsi ikan yang masih
mengandung larva hidup, yaitu tiba-tiba terjadi nyeri pada daerah epigastrium,
mual dan muntah. Gambaran klinis Anisakiasis gastrik mirip dengan peptik ulser,
tumor gaster, gastritis akut, kolesistitis dan gejala-gejala patologis gastro intestinal
yang lain (Acha dan Szyfres 2003). Masa inkubasi Anisakiasis intestinal adalah 7
hari dan menunjukkan beberapa gejala antara lain rasa sakit pada perut bagian
bawah, mual, muntah, demam, diare, dan adanya darah dalam faeses (Ortega dan
Cocera 2000).
Untuk mendiagnosa Anisakiasis dapat ditentukan dengan melihat
gejala-gejala klinis yang meliputi urtikaria akut, anafilaksis, mual dan muntah. Apabila
tidak menemukan adanya gejala-gejala klinis tersebut diagnosa dapat dilakukan
dengan dengan pemeriksaan endoskopi dan dilanjutkan dengan pemeriksaan
immunodiagnostik jika larva tidak dapat ditemukan di lambung dan usus halus
(Ortega dan Cocera 2000).
Sumber infeksi utama pada manusia adalah mengkonsumsi ikan mentah,
ikan penggaraman, dan pengasapan yang tidak sempurna serta tidak disimpan
dalam lemari pendingin (refrigerator dan freezer). Selanjutnya infeksi dapat
dicegah dengan tidak mengkonsumsi daging ikan mentah atau kurang masak.
Sebagian besar larva Anisakidae yang berbahaya bagi manusia mati jika disimpan
pada temperatur -20 oC selama 24-72 jam, ikan dimasak pada 70 oC atau
penggaraman dengan konsentransi garam yang merata pada semua permukaan
Kemampuan Hidup Larva Anisakidae pada Suhu Dingin dan Suhu Beku Proses pendinginan dan pembekuan banyak diaplikasikan untuk pengawetan
produk pangan segar dan olahan dengan tujuan untuk memperpanjang umur
simpannya. Pengawetan pada suhu rendah terjadi karena adanya penghambatan
aktivitas mikroorganisma, enzim dan reaksi kimia dan biokimia yang berperan
dalam kerusakan produk pangan. Pendinginan umumnya digunakan untuk
mengawetkan produk segar, seperti sayuran dan buah-buah, sedangkan
pembekuan digunakan untuk mengawetkan daging dan ikan segar dan produk
olahannya. Pembekuan (freezing) adalah penyimpanan bahan pangan di bawah
titik bekunya, dimana melibatkan proses perubahan fase air dari cair menjadi es
dan kristal es. Proses pembekuan dapat mencapai suhu -18 sampai -40 oC.
Menurut Palm et al. (1994) dalam Rocka (2004) prevalensi dan intensitas
infeksi pada ikan dengan P. decipiens di Laut Weddell lebih rendah dibandingkan
dengan dari Bagian Utara hal ini kemungkinan disebabkan oleh cacing
dipengaruhi oleh suhu dingin pada permukaan laut sehingga perkembangan telur
lebih lambat, temperatur air di bawah 0 oC menghambat L3 dalam ikan.
Menurut Wharton dan Aalders (2002) dan Doyle (2003) pembekuan
makanan yang dikonsumsi mentah seperti ikan dan daging lain pada temperatur
-20 oC selama 15 jam atau lebih dapat membunuh atau menginaktifkan beberapa
jenis parasit ikan. Penelitian Hilderbrand et al. (2003) dan penelitian Noble et al.
(1989) menunjukkan bahwa pembekuan pada temperatur -20 oC selama 24 jam
mampu membunuh larva anisakis. Pembekuan dengan temperatur yang lebih
rendah yaitu -35 oC selama 15 jam sudah dapat membunuh semua larva anisakis
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Bagian Parasitologi dan Entomologi Kesehatan
dan Bagian Kesehatan Masyarakat Veteriner Departemen Ilmu Penyakit Hewan,
Fakultas Kedokteran Hewan IPB Bogor, selama 7 bulan mulai bulan Desember
2006 sampai dengan Juni 2007.
Rancangan Percobaan
Penelitian ini dilakukan dalam dua tahap yaitu tahap pertama isolasi larva
cacing (stadium infektif) dari sampel ikan untuk mengumpulkan/koleksi larva
cacing Anisakidae pada ikan kembung (Rastrelliger spp.) yang diperoleh dari
pelabuhan rakyat Muara Angke Jakarta, serta tahap kedua uji ketahanan hidup
larva dalam filet ikan kembung yang diawetkan dengan pembekuan dan
penggaraman (Tabel 2).
Pada tahap pertama dilakukan pemeriksaan keberadaan larva Anisakidae
terhadap 104 ekor sampel ikan kembung yang didapatkan dari nelayan di
pelabuhan rakyat Muara Angke Jakarta. Pemeriksaan larva cacing dilakukan
dengan membedah ikan dan memeriksa organ pencernaan dan rongga
abdomennya. Larva yang ditemukan pada setiap sampel diisolasi dan dicatat
lokasi/habitatnya. Selanjutnya larva disimpan dalam NaCl 0.9% sebelum
digunakan untuk penelitian tahap kedua.
Dalam uji ketahanan hidup larva dibuat sebanyak 36 filet ikan kembung
yang bebas larva cacing. Di dalam masing-masing filet dimasukkan 3 – 5 ekor
larva Anisakidae hidup dan aktif yang dikoleksi dari percobaaan tahap pertama.
Larva tersebut ditempatkan sepanjang bagian filet atau diantara filet secara
horisontal.
Selanjutnya filet-filet tersebut secara acak dibagi menjadi 3 perlakuan yaitu
penyimpanan dalam suhu pembekuan -2 oC dan -20 oC selama 24 jam, 48 jam, 72
jam dan 168 jam serta penggaraman 25% selama 6 jam, 12 jam, 24 jam dan 48
jam. Pada setiap akhir periode perlakuan dilakukan pengamatan terhadap kondisi
Pada saat yang sama dilakukan pengamatan terhadap pH filet ikan menurut
metode Lukman et al. (2007) yaitu sebelum pengukuran, pH meter dikaliberasi
dengan menggunakan larutan standar ber pH 4.0 dan pH 7.0. Sebanyak 5 gram
contoh daging ikan ditambahkan 50 ml aqudest steril kemudian diblender dalam
stomacher selama 1 menit (60 detik). Kemudian gelas elektrode dimasukkan di
dalam ekstrak tersebut, setelah elektrode pH meter dimasukan ke dalam contoh,
dibiarkan beberapa waktu sampai nilai pH terbaca konstan. Pengukuran pH
dilakukan tiga kali pada tempat daging ikan yang berbeda.
Nilai pH diperoleh dari rata-rata ketiga hasil pengukuran. Setiap selesai
pencelupan atau pengukuran pada daging ikan, gelas elektrode dibilas secara
seksama dengan akuades, kemudian dikeringkan dengan kertas tisue. Kemudian
larva yang telah diamati difiksasi dalam alkohol 70% untuk diidentifikasi lanjutan
terhadap spesies larva.
Tabel 2 Penyimpanan larva Anisakidae pada suhu pembekuan dan penggaraman berdasarkan lama penyimpanan
Cara Penyimpanan Larva Anisakidae
Suhu Pembekuan Penggaraman
17
17 Koleksi dan Identifikasi Larva
Ikan yang akan diperiksa ditimbang beratnya dan diukur panjang serta
tebalnya lalu dibedah dengan membuat sayatan pada bagian ventral ikan. Sayatan
dimulai dari kloaka ke arah anterior sampai operkulum untuk memaparkan organ
pencernaan dan insang. Selanjutnya tubuh ikan disayat dari depan sampai ekor.
Sayatan dibuat sedemikian rupa sampai pisau menyentuh tulang-tulangnya agar
sisi daging yang telah tersayat itu nantinya dapat dibuka sehingga bentuk ikan
menjadi satu lembar. Dengan menggunakan kaca pembesar dilakukan pengamatan
untuk menemukan adanya larva di rongga abdomen dan organ pencernaan.
Dengan menggunakan metode Adams et al. (1999), organ pencernaan dan
peritoneum serta otot ikan di sekitar abdomen dikeluarkan dari dalam tubuh
dengan cara memisahkan antara usus, lambung, hati dan insang sebelum
dimasukkan dalam cawan petri berisi NaCl 0.9%. Organ pencernaan dibuka dan
dilakukan pengerokan mukosa dan otot sebelum diperiksa dengan mikroskop
dissecting untuk menemukan larva Anisakidae.
Larva Anisakidae yang ditemukan dicuci dan disimpan cawan petri berisi
NaCl 0.9%. Kondisi larva diperiksa dibawah mikroskop dan hanya larva yang
masih hidup, aktif serta kondisi morfologinya sempurna yang akan digunakan
untuk percobaan tahap kedua. Mengetahui apakah larva masih hidup larva cacing
Anisakidae diberikan rangsangan dengan sentuhan pinset. Larva hidup
memberikan reaksi terhadap rangsangan pinset atau forsep sedangkan larva mati
tidak memberikan reaksi atau kaku.
Identifikasi spesies larva yang telah digunakan dalam uji ketahanan hidup
selanjutnya diawetkan dalam etanol 70%. Larva yang telah diawetkan diwarnai
dengan minyak cengkeh. Pewarnaan KOH-minyak cengkeh dilakukan dengan
prosedur yaitu spesimen direndam dalam larutan KOH 1% (bubuk KOH
dilarutkan dalam akuades) selama 1-3 menit sampai kutikula/lapisan luar
spesimen terlihat agak melunak dan tembus pandang. Kemudian larva
dipindahkan ke dalam minyak cengkeh selama 1–3 menit sampai organ-organ
tubuh terlihat berwarna lebih jelas. Selanjutnya dilakukan dehidrasi spesimen
dengan alkohol bertahap (70%, 85%, 95%) sediaan dilekatkan (mounting)dengan
Identifikasi spesies larva Anisakidae menurut deskripsi Health Canada’s
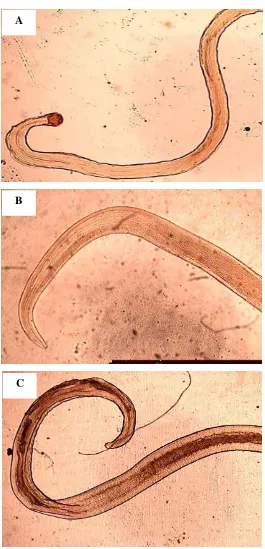
(1995) berdasarkan pada ciri warna, ukuran dan morfologi pencernaan yaitu larva
tiga (L3) Anisakis simplex berwarna putih kecil dengan panjang 9-36 mm, struktur
pencernaan terdiri dari usofagus, ventrikulus, dan usus halus. Larva stadium tiga
(L3) Pseudoterranova berwarna coklat dengan panjang 9-58 mm dan pada bagian
anteriornya mempunyai intestinal caecum. Sedangkan larva stadium tiga (L3)
Contracaecum berwarna hijau kecoklat-coklatan dengan panjang 7-30 mm pada
bagian anterior ada intestinal caecum dan pada bagian posterior nampak
ventrikulus appendix.
Pembekuan
Filet ikan yang akan dibekukan dikemas dalam kantung plastik kecil
sebelum disimpan. Pada penyimpanan -2 oC ikan dimasukan ke dalam freezer dari
lemari pendingin rumah tangga. Pengawetan ikan dengan pembekuan -20 oC
menggunakan mesin pembeku freezer biomedical model MDF – 436.
Penggaraman
Garam yang digunakan dalam penelitian ini adalah garam dapur (NaCl)
yang dibeli dari pasar tradisional di pelabuhan rakyat Muara Angke dan paling
banyak digunakan oleh masyarakat dalam pengawetan ikan. Proses penggaraman
ikan menggunakan sistem penggaraman kering 25% dengan menggunakan
keranjang yang tembus air, agar nantinya air yang berasal dari penggaraman dapat
terkuras sampai tuntas dengan langkah-langkah Irawan (1995) yaitu menyiapkan
filet ikan yang hendak digarami. Kemudian ikan diletakan satu persatu di atas
landasan kayu, satu persatu pula garam digosokan ke seluruh tubuh ikan jadi
seluruh tubuh ikan baik bagian luar dilumuri dengan garam. Selanjutnya memberi
lapisan garam pada dasar keranjang kemudian meletakan ikan-ikan yang telah
dilumuri garam di atas lapisan garam yang ada di dasar keranjang kemudian di
atasnya kembali diberi lapisan garam dan perlakuan dengan penggaraman 25%
dan dijemur dibawah sinar matahari serta diamati ketahanan hidup larvanya
19
19 Analisis Statistika
Analisis untuk identifikasi larva dianalisis secara deskriptif yaitu dengan
menyajikannya dalam bentuk tabel dan grafik sedangkan untuk analisis ketahanan
hidup larva menggunakan regresi linear sederhana. Suhu, penggaraman dan lama
penyimpanan sebagai variabel independen dan persentase ketahanan hidup larva
sebagai variabel dependen dengan minitab 14 pada tingkat kepercayaan 95% (F <
Gambar 3 Prosedur identifikasi larva dengan menggunakan pewarnaan minyak cengkeh (A) bahan-bahan yang digunakan (B) sediaan dilekatkan (mounting) dengan entellan pada kaca obyek (C) mikroskop video mikro meter untuk identifikasi
A
B
21
21 Gambar 4 Sampel ikan yang dipersiapkan untuk dicobakan pada perlakuan
penyimpanan suhu pembekuan dan penggaraman (A) sampel ikan yang dibedah dari kloaka ke arah anterior (B) persiapan filet yang akan dimasukan larva hidup (C) filet ikan yang akan dicobakan pada beberapa metode penyimpanan
B
Identifikasi Larva
Dari pemeriksaan terhadap sampel ikan kembung (Rastrelliger spp.) yang
didapatkan dari nelayan di Pantai Jakarta ditemukan adanya infeksi larva
Anisakidae dengan prevalensi 58.7%. Rataan intensitas infeksi 3 larva per ekor
ikan dengan kisaran jumlah larva cacing yang ditemukan pada setiap ekor ikan
antara 1 – 7 ekor.
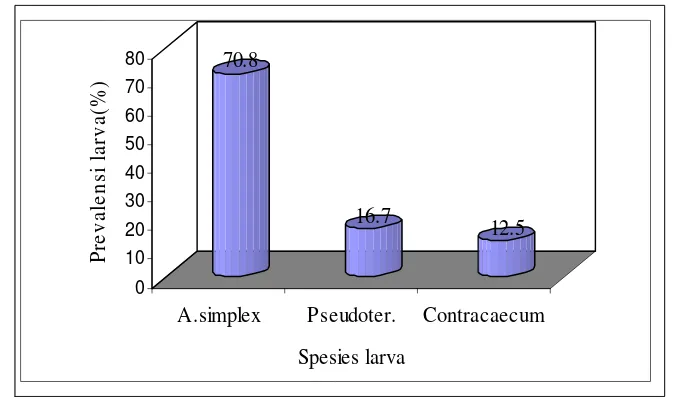
Dari 191 larva Anisakidae yang diteliti telah berhasil diidentifikasi
setidaknya tiga spesies yaitu Anisakis simplex (70.8%), Pseudoterranova sp.
(16.7%) dan Contracaecum sp. (12.5%) sebagaimana yang terlihat pada Gambar
5. Temuan ini sejalan dengan temuan Sakanari dan McKerrow (1989) dan
Miyazaki (1991) yang menyatakan bahwa famili Anisakidae sering disebut juga
sebagai kelompok cacing anisakis yang sebenarnya terdiri dari beberapa spesies.
Sejauh ini spesies-spesies yang sudah dilaporkan menginfeksi manusia
adalah Anisakis simplex, Pseudoterranova sp. dan Contracaecum sp.
Kadang-kadang spesies Contracaecum disebut juga sebagai spesies Hysterothylscium.
Identifikasi spesies larva Anisakidae menurut deskripsi Health Canada’s (1995)
berdasarkan pada ciri warna, ukuran dan morfologi pencernaan (Gambar 6).
23
23 Gambar 6 Larva Anisakidae berdasarkan spesiesnya (A) Anisakis simplex, (B)
Pseudoterranova sp.(C) Contracaecum sp (Pembesaran 40x). A
B
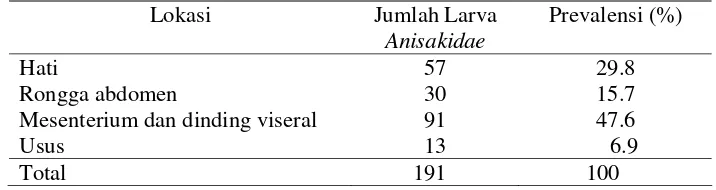
Tabel 3 Jumlah larva Anisakidae menurut lokasi parasit pada organ ikan kembung (Rastrelliger spp.)
Lokasi Jumlah Larva
Anisakidae
Prevalensi (%)
Hati
Rongga abdomen
Mesenterium dan dinding viseral Usus
Tingginya angka prevalensi larva anisakis simplex dalam penelitian ini yang
mencapai 70.8% dibandingkan dengan spesies-spesies yang lain merupakan suatu
indikasi bahwa hal ini perlu mendapatkan perhatian karena dari ketiga spesies dari
famili Anisakidae yang paling banyak menginfeksi manusia adalah Anisakis
simplex (Miyazaki 1991).
Larva Anisakidae ditemukan dan diisolasi pada organ pencernaan dan
rongga abdomen yang meliputi hati, peritoneum, mesenterium dan dinding organ
viseral serta dalam usus. Sebaran larva di setiap organ bervariasi yaitu
mesenterium dan dinding viseral (47.6%), kemudian hati (29.8%), rongga
abdomen (15.7%) dan usus 6.9% (Tabel 3). Pada rongga abdomen larva
menempel pada peritoneum. Dalam penelitian ini tidak ditemukan adanya larva
cacing Anisakidae dalam otot/filet, namun seringkali larva Anisakidae ini terlihat
menempel membentuk seperti kista pada permukaan otot disekitar rongga
abdomen atau organ peritoneum.
Hasil penelitian ini yang tidak menemukan adanya larva dalam otot sejalan
dengan temuan larva anisakis yang relatif sedikit dalam otot pada ikan Barracouta
oleh Wharton et al. (1999) yaitu 0.3% dan ikan horse-mackerel oleh Roepstorff et
al. (1993) dan Adroher et al. (1995) yaitu 1.8%. Temuan yang terbanyak pada
mesenterium dan peritoneum yaitu 88.3%. Kemudian jika membandingkan
keberadaan larva pada otot hypaxial dan epiaxial ditemukan hanya ada satu
anisakis sp. dan satu pseudoterranova sp. di dalam otot epiaxial selebihnya
terdapat pada otot hypaxial (Hereas et al. 2000 ; Levsen et al. 2004).
Tingginya jumlah larva pada mesenterium dan dinding viseral dibandingkan
dalam organ pencernaan sebagaimana yang dikemukakan oleh Schopf et al.
25
25 yang menyebabkan larva Anisakidae bermigrasi ke luar saluran cerna dan memilih
jaringan lemak di mesenterium usus dan dinding viseral untuk bertahan hidup dan
tumbuh.
Lokasi mesenterium berdekatan dengan daging (otot) di sekeliling abdomen
sehingga larva ditemukan pada otot di sekitar abdomen sesuai juga dengan hasil
penelitian Hurst (1984) Sakanari dan McKerrow (1989) melaporkan bahwa dalam
tubuh ikan larva cacing Anisakidae ini terlihat melingkar dalam suatu kista yang
mengandung jaringan ikan dan menempel pada permukaan organ-organ perut.
Meskipun sebagian besar larva ditemukan pada rongga abdomen dan lebih
sedikit ditemukan pada otot daging kondisi ini cukup mempengaruhi kualitas dan
keamanan pangan bersumber dari ikan (Gambar 7). Oleh karena itu penanganan
yang tepat dengan cara mengeluarkan insang dan organ pencernaan serta
membersihkan rongga abdomen dan di sekelilingnya sebelum diolah untuk
konsumsi. Bagi sebagian orang yang mengkonsumsi ikan mentah atau kurang
masak sebaiknya tidak mengkonsumsi daging di sekitar rongga abdomen untuk
menghindari risiko zoonosis.
Parasit yang masuk ke tubuh manusia adalah larva stadium ketiga yang
masuk bersama daging ikan yang dimakan. Dalam tubuh manusia larva akan
hidup dan pada umumnya tetap sebagai larva stadium ketiga, namun
kadang-kadang juga berkembang hingga larva stadium keempat atau larva yang sedang
berganti kulit. Dalam hal ini manusia berperan sebagai hospes paratenik.
Kebanyakan larva menyerang sub mukosa namun bisa juga mencapai organ-organ
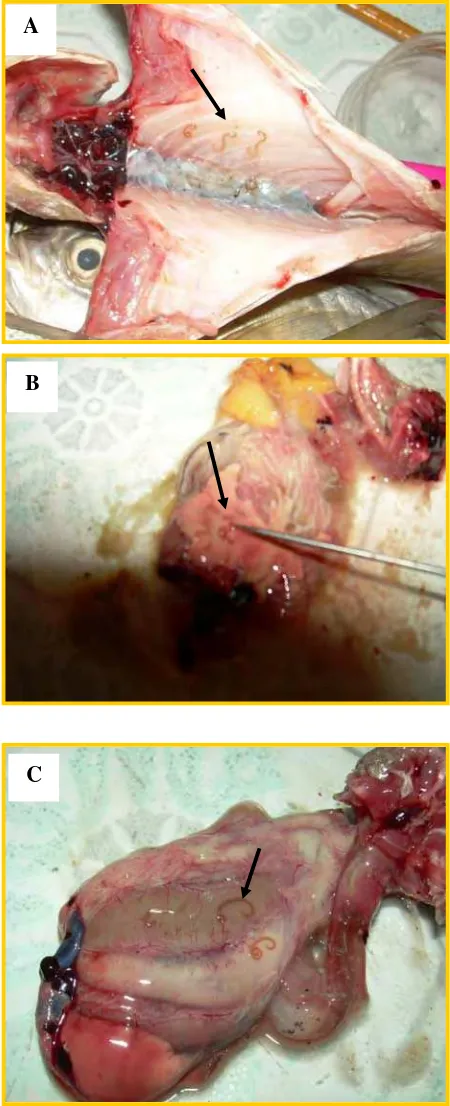
Gambar 7 Sejumlah larva berdasarkan lokasi pada organ ikan yaitu pada rongga abdomen (A), hati (B) dan permukaan organ pencernaan (C)
B
27
Gambar 8 Rata-rata intensitas larva Anisakidae pada ikan kembung (Rastrelliger spp.) menurut panjang ikan
Hasil pengamatan terhadap panjang dan berat badan ikan menunjukkan
bahwa intensitas infeksi larva Anisakidae tertinggi ditemukan pada ikan kembung
dengan kisaran panjang badan 18 – 19.5 cm dengan rata-rata intensitas 4 ekor
larva dalam tiap ekor ikan (Gambar 8). Intensitas infeksi sedikit lebih rendah pada
ikan-ikan dengan panjang badan yang lebih tinggi. Fenomena ini menunjukkan
bahwa intensitas infeksi tampaknya tidak terkait dengan ukuran tubuh ikan
kembung.
Keberadaan larva pada ikan mungkin lebih dipengaruhi oleh pola migrasi
mamalia laut sebagai inang definitif larva. Pada beberapa ikan kembung yang
diamati terdapat kelimpahan parasit yang lebih banyak jika menemukan udang
sebagai makanan ikan dalam saluran pencernaan ikan terutama pada lambung dan
usus. Hal ini terkait dengan siklus hidup larva yaitu telur cacing Anisakidae yang
keluar bersama tinja mamalia laut seperti ikan Lumba-lumba dan Paus akan
menetas di air (Sakanari dan McKerrow 1989). Larva stadium kedua yang keluar
dari telur akan ditelan oleh hospes perantara pertama lalu berkembang menjadi
larva stadium ketiga awal. Hospes perantara pertamanya adalah udang
Thysanoessa dan Euphausia. Bila hospes perantara ini dimakan oleh hospes
ketiga lanjut. Hospes perantara kedua dan hospes parateniknya meliputi ikan laut,
cumi-cumi dari berbagai jenis, dan membentuk rantai penularan satu dengan yang
lain sedemikian kompleksnya. Kedua kategori hospes ini (hospes perantara kedua
dan paratenik) agak sulit dibedakan, namun keduanya memegang peranan penting
sebagai sumber infeksi pada manusia.
Ketahanan Hidup Larva dengan Suhu Pembekuan
Untuk menganalisis ketahanan hidup larva, ikan yang dicobakan dipilih dari
ukuran atau karakteristik yang hampir sama (Lampiran 1). Hasil uji ketahanan
hidup larva Anisakidae dalam filet ikan kembung yang disimpan dalam kondisi
suhu pembekuan -2 oC disajikan dalam Tabel 4.
Semua larva Anisakidae masih dapat bertahan hidup setelah disimpan dalam
freezer dari lemari pendingin pada suhu -2 oC selama 24 jam. Selanjutnya
persentase larva yang hidup semakin menurun seiring dengan bertambahnya
waktu penyimpanan yaitu rata-rata 93.3% (48 jam) dan rata-rata 87% (72 jam).
Pada akhir percobaan sebanyak rata-rata 40% larva masih hidup setelah disimpan
selama 168 jam .
Tabel 4 Hasil pengamatan larva Anisakidae pada penyimpanan -2 oC berdasarkan lama penyimpanan
29
29 Persentase ketahanan hidup larva Anisakidae di dalam fillet ikan kembung
(Rastrelliger spp.) setelah penyimpanan beku -2 oC menurun secara linear, dengan
waktu pembekuan 24 jam, 48 jam, 72 jam dan 168 jam (Gambar 9). Persamaan
regresi yang menggambarkan persentase ketahanan hidup (y dalam %) dan lama
penyimpanan (x dalam jam) yakni y=113 - 0.428x dengan nilai (R2=0.82,
P<0.05).
Semua larva Anisakidae masih dapat bertahan hidup setelah disimpan dalam
freezer pada suhu -20 oC selama 24 jam. Selanjutnya persentase larva yang hidup
semakin menurun seiring dengan bertambahnya waktu penyimpanan sebagaimana
tergambar dalam Tabel 5 yaitu rata-rata 93.3% (48 jam) dan rata-rata 75% (72
jam). Pada akhir percobaan semua larva telah mati, sedangkan pada penelitian lain
Adams et al. (2005) melaporkan bahwa ketahanan hidup larva Anisakis simplex
dengan pembekuan -20 oC selama 60 jam dapat membunuh semua larva .
Lama Penyimpanan (Jam)
Gambar 9 Ketahanan hidup larva pada penyimpanan suhu pembekuan -2 oC terhadap waktu 24 jam, 48 jam, 72 jam dan 168 jam.
y=113-0.428x R2
Tabel 5 Hasil pengamatan larva Anisakidae pada penyimpanan -20 oC berdasarkan lama penyimpanan
Cara Penyimpanan larva Anisakidae Lama
Persentase ketahanan hidup larva Anisakidae di dalam fillet ikan kembung
(Rastrelliger spp.) setelah penyimpanan beku -20 oC menurun secara linear pada
waktu penyimpanan beku 24 jam, 48 jam, 72 jam dan 168 jam (Gambar 10).
Persamaan regresi yang menggambarkan persentase ketahanan hidup (y dalam
persen) dan waktu penyimpanan (x dalam jam) yakni y=124 - 0.724x dengan nilai
31
Gambar 10 Ketahanan hidup larva pada penyimpanan suhu pembekuan -20 oC terhadap waktu 24 jam, 48 jam, 72 jam dan 168 jam.
Kematian larva dalam proses pembekuan terjadi akibat kerusakan struktur
internal larva yang diperlihatkan pada kerusakan usofagus dan usus dari larva.
Menurut Deardorff dan Throm (1988) hal ini terjadi karena pembekuan
mengakibatkan perubahan bentuk cairan intraseluler larva menjadi kristal es.
Kerusakan lain juga terjadi pada membran larva yang mengakibatkan
berkurangnya cairan pada larva sebagai akibat meningkatnya konsentrasi cairan
terlarut pada larva (Gambar 11 A dan B).
Proses pembekuan yang disebabkan penurunan suhu ditandai oleh dengan
semakin meningkatnya suhu pembekuan maka mempercepat pembentukan es
sehingga air akan ditarik dalam cairan sel daging ikan yang mengandung kadar air
antara 60–80% dan cairan itu akan semakin menjadi kental dan dapat merubah
cairan tubuh ikan menjadi kristal-kristal es sehingga kegiatan larva cacing akan
terganggu dan sulit menyerap makanan.
Larva Anisakidae lebih sensitif terhadap kondisi pembekuan (freezing)
dibandingkan dengan Trichinella dimana kondisi suhu dan lama penyimpanan
yang diperlukan untuk membunuh larva Trichinella spiralis yaitu -24 oC selama
20 hari dan -29 oC selama 12 hari (Rieman dan Bryan 1979).
y=124-0.724x R2
Menurunnya ketahanan hidup larva setelah penyimpanan 72 jam dan 168
jam terjadi setelah dalam proses pembekuan pada ikan kembung yakni panas
terenyahkan dari ikan, mengakibatkan suhu menurun hingga jauh di bawah 0 oC.
Menurut Ilyas (1983) proses pembekuan pada ikan melalui tiga tahap yaitu
pertama berlangsung cepat mencapai sedikit di bawah 0 oC kedua tahap
penahanan panas antara -1 oC hingga -6 oC (wilayah kritikal) bagian terbesar air
(80–90%) diubah jadi kristal es ketiga penurunan suhu relatif cepat mencapai titik
pembekuan akhir yang sama dengan suhu penyimpanan beku (-18 oC atau lebih
rendah) suhu turun cepat karena sisa air atau panas pada ikan tinggal sedikit.
Ketahanan hidup larva pada -2 oC sampai dengan 168 jam kemungkinan
disebabkan oleh bahwa pada penyimpanan pada -2 oC menurut Ilyas (1983) hanya
mampu membekukan cairan yang ada dalam tubuh ikan sebesar 61%. Masih ada
39% cairan yang ada dalam tubuh ikan yang belum diubah menjadi kristal-kristal
es yang dapat dijadikan larva sebagai media makanan. Sebaliknya pada
penyimpanan -20 oC dapat mengubah 90% cairan dalam tubuh ikan menjadi
kristal-kristal es, sehingga larva akan sulit menyerap makanan dalam tubuh ikan
33
33 Gambar 11 Beberapa kerusakan pada kutikula/membran (c/m), usofagus (u),
intestinal (i), pada larva Anisakidae karena proses pembekuan -2 oC (A), -20 oC (B), dan Penggaraman 25% (C) serta tanpa perlakuan (D) (Pembesaran 40x)
A
B
C
D
c/m i
u
c/m
i
u
u
i c/m
i
u
Ketahanan Hidup Larva dengan Proses Penggaraman 25%
Hasil penelitian menunjukkan bahwa kenaikan waktu penggaraman terhadap
ketahanan hidup larva Anisakidae ikan kembung (Rastrelliger spp.) menyebabkan
ketahanan hidup larva menurun ditunjukkan dengan persentase kematian yang
meningkat. Pada waktu penggaraman 6 dan 12 jam larva Anisakidae pada ikan
kembung (Rastrelliger spp.) masih mampu bertahan hidup yakni dengan
persentase masing-masing rata-rata 53.3% dan rata-rata 46.7%, sementara untuk
waktu penggaraman 48 dan 72 jam, semua larva Anisakidae ikan kembung
(Rastrelliger spp.) telah mati sebagaimana terlihat dalam Tabel 6.
Menurut Afrianto dan Liviawaty (1989) selama proses penggaraman 25%
telah terjadi penetrasi garam ke dalam tubuh ikan dan pengeluaran cairan dari
dalam tubuh ikan karena terjadi perbedaan konsentrasi. Cairan ini dengan cepat
akan melarutkan kristal garam atau mengencerkan larutan garam. Bersamaan
dengan keluarnya cairan ini dalam tubuh ikan, partikel garam memasuki tubuh
ikan.
Tabel 6 Hasil pengamatan larva Anisakidae pada penggaraman 25% berdasarkan lama penyimpanan
Cara Penyimpanan larva Anisakidae Lama
35
35 Lama kelamaan kecepatan proses pertukaran garam dan cairan tersebut
semakin lambat dengan menurunnya konsentrasi garam di luar tubuh ikan dan
meningkatnya konsentrasi garam di dalam tubuh ikan, bahkan akhirnya
pertukaran garam dan cairan tersebut berhenti sama sekali setelah terjadi
keseimbangan antara konsentrasi garam di dalam tubuh ikan dengan konsentrasi
garam di luar tubuh ikan.
Analisis terhadap ketahanan hidup Gambar 12 larva menunjukkan bahwa
presentase ketahanan hidup larva Anisakidae di dalam filet ikan kembung
(Rastrelliger spp.) setelah proses penggaraman 25% menurun secara linear, dari
waktu penggaraman dari 6 jam hingga 48 jam. Persamaan regresi yang
menggambarkan persentase ketahanan hidup (x dalam persen) dan waktu
penggaraman (y dalam jam) yakni y=54.8 - 1.32x dengan nilai (R2=0.67, P<0.05).
Lama Penyimpanan (Jam)
Gambar 12 Ketahanan hidup larva pada penggaraman 25% terhadap waktu 6 jam, 12 jam, 24 jam dan 48 jam.
Dengan penggaraman 25% pada ikan kembung ini sampai dengan 48 jam
dimana ikan dijemur di bawah sinar matahari langsung sampai kering untuk
membantu menurunkan kadar air sehingga menyebabkan air yang berada di dalam
tubuh ikan akan semakin kental dan kadar proteinnya menggumpal serta sel-sel
daging ikan mengkerut. Proses osmosis yang terjadi pada daging ikan juga terjadi
pada larva-larva Anisakidae sehingga mengakibatkan terjadinya plasmolisis yaitu
berkurangnya kadar air yang ada pada larva sehingga lama kelamaan larva
tersebut akan mati (Gambar 11 C).
Ketahanan hidup larva selama 6 sampai 12 jam kemungkinan disebabkan
oleh belum terjadinya plasmolisis secara sempurna baik pada ikan maupun pada
larva itu sendiri sehingga pada waktu pengamatan tersebut masih ada larva yang
masih bertahan hidup.
Pengamatan pH
Dari pengamatan perubahan pH didapatkan hasil bahwa ketiga jenis
perlakuan pembekuan -2 oC dan -20 oC serta penggaraman 25% meningkatkan
nilai pH pada daging ikan. Pada penyimpanan -20 oC selama 24 jam dari pH 6.6
naik menjadi 6.8, 6.8 dan 6.9 pada penyimpanan selama 48 jam, 72 jam dan 7 hari
ternyata kenaikan pHnya lebih tinggi jika dibandingkan dengan penyimpanan -2
o
C dan penggaraman 25% sebagaimana terlihat dalam Tabel 7.
Perubahan pH ini berkaitan dengan perubahan rigormortis pada ikan yang
merupakan akibat dari suatu seri perubahan kimiawi yang kompleks di dalam otot
ikan sesudah kematiannya. Setelah ikan mati, sirkulasi darah terhenti dan suplai
oksigen berkurang sehingga terjadi perubahan glikogen menjadi asam laktat.
Perubahan ini menyebabkan pH tubuh ikan menurun diikuti pula dengan
penurunan jumlah ATP serta jaringan otot tidak mampu mempertahankan
kekenyalannya.
Menurut Ilyas (1983) pada fase rigor mortis maksimum pH menurun sampai
sekitar 6.2 sampai 6.6. Adapun nilai pH mula-mula pada ikan laut sekitar 6.1
sampai 7.0. Tinggi rendahnya pH ikan mula-mula sangat tergantung pada jumlah
glikogen yang ada dan kekuatan penyangga (buffering power) pada daging ikan.
37
37 laktat, asam fosfat, TMAO, dan basa menguap (volatile base). Setelah fase rigor
mortis berakhir dan pembusukan bakteri berlangsung, maka pH daging ikan naik
mendekati netral, lalu sekitar 7.5 sampai 8.0 atau dapat lebih tinggi bila
pembusukan telah sangat parah, hal ini disebabkan senyawa-senyawa yang
bersifat basa. Oleh karena itu mula-mula pH naik dengan perlahan dan semakin
banyak senyawa-senyawa basa yang terbentuk maka semakin cepat kenaikan pH
itu (Hadiwiyoto 1993).
Kenaikan pH dalam penelitian ini menurut Ashie et al. (1996) berhubungan
dengan perubahan suhu, penurunan suhu yang cepat melalui pembekuan
(freezing) sampai dibawah -2 oC dan penggaraman 25% menghambat rusaknya
senyawa nitrogen untuk mengurangi pembusukan dimana sebelumnya telah
terjadi penurunan pH akibat dekomposisi (penguraian) nitrogen. Tetapi pada
kondisi seperti ini akan meningkatkan akumulasi amoniak dalam daging ikan
sehingga dapat mengakibatkan peningkatan pH karena bersifat basa.
Tabel 7 Hasil pengamatan perubahan pH pada ikan pada berbagai penyimpanan berdasarkan lamanya penyimpanan
Pengamatan pH
Suhu Pembekuan Penggaraman