KAJIAN KERAGAMAN GEN MYF5 DAN MSTN SERTA
ASOSIASINYA TERHADAP SIFAT PERTUMBUHAN
DAN PERDAGINGAN PADA SAPI BALI
HIMMATUL KHASANAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Saya dengan ini menyatakan bahwa tesis berjudul ” Kajian Keragaman Gen Myf5 dan MSTN serta Asosiasinya terhadap Sifat Pertumbuhan dan Perdagingan pada Sapi Bali” adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan atau tidak diterbitkan dari Penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka pada bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
RINGKASAN
HIMMATUL KHASANAH. Kajian Keragaman Gen Myf5 dan MSTN Serta Asosiasinya terhadap Sifat Pertumbuhan dan Perdagingan pada Sapi Bali. Dibimbing oleh JAKARIA, ASEP GUNAWAN dan RUDY PRIYANTO.
Sapi bali (Bos javanicus) adalah sapi asli Indonesia yang merupakan hasil domestikasi dari banteng (Bibos banteng). Sapi bali memiliki keunggulan dalam sifat produksi, reproduksi dan dapat berkembang pada lingkungan marginal. Gen Myogenic Factor 5 (Myf5) dan gen Myostatin (MSTN) memiliki peranan penting dalam perkembangan myogenesis dan diketahui berhubungan dengan sifat pertumbuhan dan perdagingan. Penelitian ini bertujuan untuk menganalisis polimorfisme dan distribusi alel berbasis SNP (Single Nucleotide Polymorphism) pada gen Myf5 dan MSTN di sapi bali. Selain itu, tujuan penelitian ini juga mengetahui hubungan gen-gen tersebut terhadap sifat pertumbuhan dan perdagingan pada sapi bali.
Sapi bali yang digunakan sebanyak 48 ekor terdiri atas 24 ekor jantan dan 24 ekor betina yang berumur 12-15 bulan yang dipelihara pada kondisi lingkingan yang sama di pusat pembibitan BPTU-HMT sapi bali Provinsi Bali. Identifikasi SNP pada gen Myf5 dan MSTN dilakukan menggunakan metode direct-sequencing. Polimorfisme kedua gen tersebut dianalisis berdasarkan frekuensi genotipe, frekuensi alel dan heterozigositas. Keseimbangan genotipe dalam populasi dideteksi dengan uji keseimbangan Hardy-Weinberg (χ2). Asosiasi SNP gen Myf5 dan MSTN dengan sifat pertumbuhan (bobot lahir, bobot 205 hari, bobot 365 hari, tinggi pundak, panjang badan dan lebar dada) dan sifat perdagingan yang diukur dengan USG (tebal otot longissimus dorsi, tebal lemak punggung, tebal rump, tebal lemak rump, marbling score dan persentase lemak intramuskuler) pada sapi bali dilakukan dengan uji ANOVA GLM dan dilanjutkan dengan uji Duncan Multiple Range Test (DMRT).
Amplifikasi gen Myf5 dan gen MSTN dihasilkan panjang produk PCR yaitu masing-masing 285 bp dan 535 bp. Hasil identifikasi SNP pada kedua gen tersebut diperoleh 2 SNP polimorfik (c.1172T>A dan c.1205G>A) dan 20 SNP polimorfik (g.-8350C>T, g.-8310A>C, g.-8299G>A, g.-8283A>G, g.-8216G>A, g.-8205A>G, g.-8168A>G, g.-8109T>G, g.-8078C>T, g.-8077G>A, g.-8029T>C, g.-7799T>C, g.-7996G>C, g.-7953C>T, g.-7941C>T, g.-7930A>G, g.-7905T>C dan g.-7942C>G) pada sapi bali. SNP gen Myf5 memiliki nilai heterozigositas <0.5 dan ditemukan dalam keadaan seimbang. Adapun SNP gen MSTN memiliki nilai heterozigositas <0.5 dan ditemukan 17 SNP (8350C>T, 8310A>C, g.-8299G>A, g.-8283A>G, g.-8216G>A, g.-8205A>G, g.-8168A>G, g.-8109T>G, g.-8077G>A, g.-8029T>C, g.-7799T>C, g.-7953C>T, g.-7941C>T, g.-7905T>C dan g.-7942C>G) dalam keadaan tidak seimbang, sedangkan tiga SNP berada dalam keadaan keseimbangan (g.-8078C>T, g.-7996G>C and g.-7930A>G). Asosiasi SNP gen Myf5 dengan sifat pertumbuhan dan perdagingan pada sapi bali tidak nyata. Adapun SNP gen MSTN tidak berasosiasi nyata dengan sifat pertumbuhan, namun berasosiasi nyata (P≤0.05) dengan persentase lemak intramuskuler yaitu SNP g.-7799T>C dan g.-7941C>T. Kedua SNP pada gen MSTN tersebut dapat dijadikan sebagai kandidat marka genetik sifat perdagingan pada sapi bali.
SUMMARY
HIMMATUL KHASANAH. A Study on Polymorphism Myf5 and MSTN Genes
and It’s Association with Growth and Muscling Characteristics in Bali Cattle. Supervised by JAKARIA, ASEP GUNAWAN dan RUDY PRIYANTO.
Bali cattle (Bos javanicus) is one of indigenous cattle of Indonesia origin that had been domesticated fom Banteng (Bos bibos). Bali cattle has good production and reproduction even in marginal environment. Myogenic Factor 5 (Myf5) and Myostatin (MSTN) genes have a role in myogenesis development and associated with growth and muscling traits. The objective of this research was to identify genetic polymorphism and allele distribution of SNP in Myf5 and MSTN genes in Bali cattle. Moreover, this research was to elucidate the association between Myf5 and MSTN genes with growth and muscling traits in bali cattle .
A total 48 heads of bali cattle consisting of 24 steers and 24 heifers 12-15 months of age were maintened under same environment in bali cattle breeding center (BPTU-HMT) Bali Province. SNPs identification were analyzed using direct sequencing method. Polymorphism of Myf5 and MSTN genes were analysed by allele frequency, genotipe frequency and hetozygosity. Equilibrium of each SNP in bali cattle population was analysed using Hardy-Weinberg equilibrium
(χ2
). Association genotype in each SNP with growth traits (birth weight, 205 day weight, 365 day weight, average daily gain, shoulder height, body length and chest circumstance) and muscling traits (longissimus dorci thickness, back fat thickness, rump thickness, rump fat thickness, marbling score and intramuscular fat percentage) performed using ANOVA GLM and followed by Duncan Multiple Range Test (DMRT).
Amplification of Myf5 and MSTN genes resulted band with length 285 bp and 535 bp, respectively. SNPs identification in Myf5 gene resulted of 2 polymorphic SNPs (c.1172T>A dan c.1205G>A) and MSTN gene resulted 20 polymorphic SNPs (8350C>T, 8310A>C, 8299G>A, 8283A>G, g.-8216G>A, g.-8205A>G, g.-8168A>G, g.-8109T>G, g.-8078C>T, g.-8077G>A, g.-8029T>C, g.-7799T>C, g.-7996G>C, g.-7953C>T, g.-7941C>T, g.-7930A>G, g.-7905T>C dan g.-7942C>G). Both of SNPs in Myf5 gene have heterozygosities value less than 0.5 and three SNP (g.-8078C>T, g.-7996G>C and g.-7930A>G) having equilibrium condition in Hardy-Weinberg analysis. Moreover, SNPs in MSTN gene have heterozygosities value less than 0.5 and 17 SNPs (g.-8350C>T, g.-8310A>C, g.-8299G>A, g.-8283A>G, g.-8216G>A, g.-8205A>G, g.-8168A>G, g.-8109T>G, g.-8077G>A, g.-8029T>C, g.-7799T>C, , g.-7953C>T, g.-7941C>T, g.-7905T>C dan g.-7942C>G) having disequilibrium condition, while three SNPs having equilibrium condition in Hardy-Weinberg analysis. Association analyses showed that Myf5 has no significant effect to growth and muscling traits. Furthermore SNPs in MSTN gene has no significant association with growth traits, while two SNPs having significant association with intramuscular fat percentage
(P≤0.05). Both of SNPs in MSTN gene may be used as candidate gene for genetic marker in muscling traits in Bali cattle.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dil arang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Thesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
KAJIAN KERAGAMAN GEN MYF5 DAN MSTN SERTA
ASOSIASINYA TERHADAP SIFAT PERTUMBUHAN
DAN PERDAGINGAN PADA SAPI BALI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul penelitian : Kajian Keragaman Gen Myf5 dan MSTN serta Asosiasinya terhadap Sifat Pertumbuhan dan Perdagingan pada Sapi Bali
Nama : Himmatul Khasanah
NRP : D151140211
Disetujui oleh Komisi Pembimbing
Dr Jakaria, SPt MSi Ketua
Dr agr Asep Gunawan, SPt MSc Anggota
Dr Ir Rudy Priyanto Anggota
Diketahui oleh
Ketua Program Studi Ilmu Produksi dan Teknologi Peternakan
Dr Ir Salundik, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian:
PRAKATA
Puji syukur Penulis panjatkan kepada Allah SWT, atas segala rahmat dan karunia-Nya Penulis berhasil menyelesaikan tesis dengan judul “Kajian Keragaman Gen Myf5 dan MSTN serta Asosiasinya terhadap Sifat Pertumbuhan dan Perdagingan pada Sapi Bali”. Shalawat dan salam Penulis sampaikan kepada Nabi Muhammad SAW dan para sahabatnya yang menjadi suri tauladan umat manusia.
Tesis ini menggunakan data hasil pengukuran bobot dan ukuran tubuh serta hasil ultrasonografi pada bagian longissimus dorsi dan rump yang dilaksanakan sejak bulan Juni 2015 sampai Desember 2015 berlokasi di Kabupaten Jembrana, Bali. Penelitian bertujuan untuk mengidentifikasi keragaman dan asosiasi gen Myf5 dan MSTN pada sapi bali sehingga memperkaya informasi karakteristik fenotipik dan genetik serta hubungan keduanya pada sapi bali.
Terima kasih Penulis ucapkan kepada Dr Jakaria, SPt MSi, Dr agr Asep Gunawan, SPt MSi dan Dr Ir Rudy Priyanto sebagai komisi pembimbing yang telah mengarahkan dan memotivasi penulis. Terima kasih juga penulis sampaikan kepada Dr Ir Niken Ulupi MS atas kesediannya menjadi penguji luar komisi pada ujian sidang tesis dan atas masukan serta saran untuk perbaikan tesis ini. Kepada BPTU-HMT Sapi Bali Provinsi Bali penulis mengucapkan terimakasih atas bantuan dalam pemeliharaan dan pelaksanaan penelitian di lapang. Ucapan terimakasih juga penulis sampaikan kepada Lembaga Pengelola Dana Pendidikan (LPDP) yang telah memberikan kesempatan dan telah menjadi sponsor bagi penulis selama masa studi magister di IPB.
Ungkapan terimakasih juga penulis sampaikan kepada kepada Bapak Khanif (Alm), Ibu (Siti Munawaroh), keluarga dan teman-teman satu tim penelitian (Nurul dan Nawal), teman-teman Laboratorium Genetika Molekuler Ternak (Shelvi, Isyana, Alit, Furqon, Rindang, Saleh, Ami) yang telah memberikan dukungan dan doa serta terimakasih kepada Prof Dr Ir Cece Sumantri, MSc yang telah memberikan dukungan moril sehingga penulis dapat menyelesaikan program masgister.
Penulis menyadari bahwa dalam penyusunan tesis ini masih ada kekurangan yang harus disempurnakan. Penulis berharap kiranya ada masukan, saran, pemikiran dan gagasan untuk menyempurnakan tesis dan pelaksanaan penelitian kedepan. Penulis ucapkan terima kasih dan penghargaan atas segala masukan, saran, pemikiran dan gagasan untuk menyempurnakan penelitian ini.
Bogor, Juni 2016 Penyusun
DAFTAR ISI
DAFTAR ISI vi
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
PerumusanMasalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 METODE 4
Waktu dan Tempat Penelitian 4
Materi 4
Prosedur 6
Analisis Data 10
3 HASIL DAN PEMBAHASAN 12
Karakteristik Sifat Pertumbuhan dan Ultrasonografi Sifat Perdagingan pada
Sapi Bali 12
Amplifikasi Gen Myf5 dan MSTN pada Sapi Bali 14 Polimorfisme Gen Myf5 dan MSTN pada Sapi Bali 14 Heterozigositas dan Keseimbangan Hardy-Weinberg 18 Asosiasi gen MYF5 terhadap Sifat Pertumbuhan dan Perdagingan 19 Asosiasi Gen MSTN terhadap Sifat Pertumbuhan dan Perdagingan 21
4 SIMPULAN DAN SARAN 25
Simpulan 25
Saran 25
DAFTAR PUSTAKA 25
LAMPIRAN 31
DAFTAR TABEL
1. Primer gen Myf5 dan gen MSTN 4
2. Rataan sifat pertumbuhan dan perdagingan pada sapi bali 13 3. Karakteristik perdagingan sapi bali di kabupaten Barru dan Bone 13 4. Frekuensi genotipe dan alel gen Myf5 dan MSTN pada sapi bali 16 5. Heterosigositas dan keseimbangan Hardy-Weinberg SNP gen Myf5 dan
MSTN sapi bali 19
6. Asosiasi pengaruh genotipe SNPs gen Myf5 terhadap sifat pertumbuhan
sapi bali 20
7. Asosiasi pengaruh genotipe SNPs gen Myf5 terhadap sifat perdagingan
sapi bali 20
8. Asosiasi genotipe SNP gen MSTN terhadap sifat bobot sapi bali 22 9. Asosiasi genotipe SNP gen MSTN terhadap ukuran tubuh sapi bali. 23 10.Asosiasi genotipe SNP gen MSTN terhadap sifat perdagingan sapi bali 24
DAFTAR GAMBAR
1. Posisi penempelan primer pada fragmen gen Myf5 (285 bp) 5 2. Posisi penempelan primer pada fragmen gen MSTN (535 bp) 5 3. Paddock pemeliharaan sapi bali di BPTU-HMT Sapi Bali Provinsi Bali
pada musim hujan (kanan) dan pada musim kemarau (kiri). 6 4. Posisi pengukuran ultrasonografi karakteristik perdagingan otot
longissimus dorsi (kiri) dan otot rump (kanan). 7 5. Ilustrasi USG otot longissimus dorsi pada sapi, c = kutan, sc = subkutan,
tm = tebal otot, o = tulang 8
6. Citra Ultrasonografi pada otot longissimus dorsi rusuk ke 12-13 sapi bali (A dan B), citra USG otot rump (C dan D), lapisan lemak (a), tebal otot (b), daerah pengukuran PIMF 30x30 mm (c), tulang (d), deposisi
lemak intramuskuler (e). 12
7. Hasil amplifikasi gen Myf5 (A) dan MSTN (B) pada elektroforesis gel
1.5%, M: Marker. 14
8. SNP gen Myf5 pada sapi bali 15
9. SNP gen MSTN pada sapi bali 17
10.Tidak ditemukan CpG island di sapi bali (A) dan CpG island di Bos
taurus (B). 18
DAFTAR LAMPIRAN
1. Sekuen gen Myogenic Factor 5 (MYF5) berdasarkan genbank kode
akses M95684 32
1
PENDAHULUAN
Latar Belakang
Sapi bali (Bos javanicus) adalah sapi asli Indonesia yang merupakan hasil domestikasi dari banteng (Bibos banteng) (Purwantara et al. 2012) dan merupakan salah satu sumber daya genetik (SDG) ternak Indonesia yang perlu dilestarikan, dikembangkan dan dimanfaatkan. Sapi bali digunakan sebagai sapi pedaging karena memiliki keunggulan dalam produksi dan reproduksi. Meskipun pada kondisi lingkungan marginal, sapi bali masih mampu berproduksi (Thalib 2002). Keunggulan pada sifat reproduksi sapi bali yaitu fertilitas tinggi dan cepat berkembangbiak (Purwantara et al. 2012). Sapi bali memiliki kemampuan dapat bertahan pada kondisi lingkungan yang kurang baik, cepat beradaptasi pada lingkungan yang baru, dan memiliki kandungan lemak karkas yang rendah (Hardiwirawan dan Subandriyo 2004). Hafid dan Rugayah (2009) menjelaskan bahwa persentase karkas sapi bali antara 52.72-57.59% lebih tinggi dibanding sapi lokal lainnya seperti PO (peranakan ongole) sebesar 46.96% (Yosita et al. 2012), sapi madura sebesar 47% (Wiyatna 2007) dan sapi SO (sumba-ongole) sebesar 55.25% (Yantika et al. 2016). Sapi bali juga memiliki lapisan lemak subkutan yang lebih kecil dibanding sapi PO (Yosita et al. 2012). Menurut USDA (2014) karkas grade yield sangat dipengaruhi oleh lapisan lemak pada area rib, loin, rump, clod, flank, cod/udder dan ribeye area.
Sapi bali sebagai penghasil daging berkonstribusi terhadap pemenuhan kebutuhan daging nasional yaitu sebesar 27% dari total daging yang diproduksi lokal (Purwantara et al. 2012) dengan populasi sebanyak 4 658 781 ekor yang tersebar hampir di seluruh Indonesia (PSPK 2011). Meskipun memiliki potensi yang unggul, pemanfaatan SDG sapi bali masih belum optimal, terutama untuk menghasilkan daging baik secara kualitas maupun kuantitas.
Upaya untuk meningkatkan mutu genetik dan produktivitas sapi bali khususnya terkait dengan pertumbuhan dan perdagingan, secara konvensional dapat dilakukan dengan seleksi (Thalib et al. 2003, Supriyantono dan Irianti 2007, Patmawati et al. 2013). Seleksi secara tradisional berdasarkan sifat fenotipe memiliki kelemahan yaitu adanya pengaruh lingkungan yang tidak terkontrol sebagaimana konsep P=G+L, dengan P adalah fenotipe, G adalah faktor genetik dan L adalah faktor lingkungan (Noor 2010). Pesatnya perkembangan teknologi molekuler berbasis DNA, memungkinkan seleksi didasarkan pada penciri (marker) genetik atau disebut MAS (Marker Assisted Selection) dengan harapan seleksi dapat lebih lebih akurat, efektif dan efesien (Gerbens et al. 2000, Van Werf dan Kinghorn 2003).
MRFs lainnya. Gen ini diatur oleh satu set enhancer pada regulatory region yang ekspresinya ditemukan pada otot dan jaringan adiposa (Ott et al. 1991, Francetic dan Li 2011). Gen Myf5 memiliki peranan penting dalam penentuan dan diferensiasi myocyte (Braun dan Gautel 2011, Li et al. 2004) dan juga mengontrol myogenesis serta pertumbuhan myoblast (sel otot yang dapat melebur dengan sel otot lain menjadi serat otot immature) selama perkembangan embrio saat prenatal (Guo et al. 2015). Ketiadaan gen Myf5 telah diidentifikasi menyebabkan kematian setelah lahir pada tikus ( et al. 1992). Gen ini juga diketahui berasosiasi dengan bobot satu tahun (Li et al. 2004), PBBH (Chung dan Kim 2005), bobot sirloin (Robakowska-Hyzorek et al. 2010), tebal lemak punggung dan tenderness (Ujan et al. 2011).
Gen myostatin (MSTN) atau biasa dikenal sebagai growth and differentiation factor 8 (GDF8) merupakan anggota dari superfamili gen
transforming growth factor β (TGF-β.) yang terletaak di kromosom tiga, terdiri dari tiga ekson dan dua intron. Gen MSTN ini diketahui terlibat dalam mediasi pertumbuhan dan perkembangan sel melalui signal transduksi (Lee dan McPherron 2001, Arnorld et al. 2001, Rios et al. 2002). Menurut Thomas et al. (2000) myostatin mengikat reseptor permukaan sel dan menghambat poliferasi dan dan diferensiasi myoblast (Langley et al. 2002. Rios et al. 2000). Gen myostatin menyandi 375 asam amino (Taylor et al. 2001). Asam amino menghasilkan protein myostatin dengan berat molekul sebesar 26 kDa (Taylor et al. 2001). Gen MSTN bekerja sebagai inhibitor (negative regulator) dari myogenesis dan menghambat poliferasi myoblast selama siklus sel dan diferensiasi myogenic (Thomas et al. 2000, Taylor et al. 2001, Rios et al. 2002, Langley et al. 2002, Miyake et al. 2010). Berdasarkan sturktur gen, gen MSTN memiliki daerah CpG island yaitu daerah yang kaya ulangan sekuen GC di bagian promoter (Illingworth et al. 2010). Menurut Carninci et al. (2006) yang menyatakan bahwa panjang sekuen CpG island adalah 50-100 bp dan berfungsi sebagai pengaturan transkripsi (Deaton dan Bird. 2011). Daerah CpG island ini juga berhubungan dengan pola metilasi seperti kejadian pemadatan kromatin dan gene silencing (Sellner et al. 2007). Metilasi ini dapat menurunkan atau meningkatkan tingkat transkripsi bergantung dari sifat metilasi apakah positif (suppressor) atau negatif (repressor) (Jones dan Takai 2001). Mutasi pada CpG island juga dapat merubah regulasi pola ekspresi dengan cara merubah posisi target transcriptional regulatory (Doherty et al. 2014).
PerumusanMasalah
Upaya seleksi pada sapi bali saat ini masih dilakukan secara tradisional dengan menggunakan data fenotipe yang masih dipengaruhi oleh genetik dan lingkungan. Penggunaan marka genetik diharapkan dapat menjadi alternatif seleksi di tataran genom yang lebih akurat, efektif dan efisien. Namun data dan informasi genetik dari gen-gen pengontrol sifat pertumbuhan dan perdagingan seperti Myf5 dan MSTN pada sapi bali masih sangat terbatas dan perlu dilakukan kajian terhadap gen-gen tersebut.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji polimorfisme dan distribusi alel pada gen Myf5 dan MSTN berbasis SNP di daerah sumber bibit sapi bali yaitu BPTU-HMT sapi bali Provinsi Bali dengan menggunakan metode sequencing. Selain itu, tujuan dari penelitian ini juga menganalisis hubungan gen-gen tersebut terhadap sifat pertumbuhan dan perdagingan pada sapi bali.
Manfaat Penelitian
Manfaat dari penelitian ini adalah sebagai data dasar informasi genetik gen Myf5 dan MSTN pada sapi bali di BPTU-HMT sapi bali Provinsi Bali. Informasi keragman genetik yang diperoleh dapat dijadikan sebagai acuan untuk menentukan arah strategi pemuliaan sapi bali. Hasil penelitian ini juga dapat dijadikan sebagai kandidat marka genetik berbasis SNP untuk seleksi bibit pada sifat pertumbuhan dan perdagingan sapi bali.
Ruang Lingkup Penelitian
2
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Balai Pembibitan Ternak Unggul dan Hijauan Makanan Ternak (BPTU-HMT) sapi bali Provinsi Bali dan Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika, Fakultas Peternakan, Institut Pertanian Bogor. Penelitian ini berlangsung dari bulan Juli 2015 sampai dengan Maret 2016.
Materi
Ternak
Ternak yang digunakan adalah sapi bali sebanyak 48 ekor berumur 12 sampai 15 bulan dengan jenis kelamin jantan (24 ekor ) dan betina (24 ekor) berasal dari BPTU-HMT sapi bali, Pulukan, Kabupaten Jembrana, Provinsi Bali. Bahan
Bahan-bahan yang digunakan untuk ekstraksi DNA adalah Geneaid DNA kit ekstraksi yang terdiri dari RBC lysis buffer, GT buffer, GB buffer, W1 buffer, Wash buffer dan Elution buffer. Bahan yang digunakan untuk amplifikasi fragment target adalah sampel DNA hasil ekstraksi, distilled water (DW), Promega master mix, pasangan primer forward dan reverse fragmen gen Myf5 dan MSTN, sedangkan bahan yang digunakan untuk elektroforesis adalah serbuk agarosa, 0.5 x Tris-Borax EDTA (TBE), Ethidium Bromide (EtBr), marker 100 pb.
Adapun primer yang digunakan untuk mengamplifikasi fragment target pada masing-masing gen yang diamat dapat dilihat pada Tabel 1. Gambar 1 dan 2 menunjukkan ilustrasi posisi fragment target dan posisi penempelen primer gen Myf5 dan MSTN.
Tabel 1 Primer gen Myf5 dan gen MSTN
SNP Genbank Sekuens Primer produk
Gambar 1 Posisi penempelan primer pada fragmen gen Myf5 (285 bp)
Gambar 2 Posisi penempelan primer pada fragmen gen MSTN (535 bp)
Alat
vortex, inkubator, rotary mixer, microsentrifuge, refrigerator, freezer, mesin PCR Applied Biosystems, dan tabung PCR 0.2 ml, satu set geltray, magnetic stirrer, microwave, power supply electrophoresis 100 volt, dan UV Transiluminator.
Prosedur
Pemeliharaan Sapi Bali
Seluruh sampel penelitian ditempatkan dalam satu paddock seluas ± 3 Ha dan diberi pakan rumput lapang sebanyak 10% dari bobot badan ditambah konsentrat 1% dari bobot badan serta diberi air minum secara ad libitum. Jenis rumput yang diberikan adalah rumput gajah (Pennisetum purpureum) yang diperoleh dari hasil budidaya rumput di area pastura dan rumput kompetidor (Phaspalum notatum) yang tumbuh dilahan paddock. Penempatan ternak dalam satu paddock bertujuan untuk menyeragamkan kondisi lingkungan. Paddock area pemeliharaan ditunjukkan oleh Gambar 3. Kondisi georafis BPTU-HMT Provinsi Bali terletak di Kabupaten Jembrana, Kecamatan Pakutatan, Desa Pulukan. Secara geofrafis Kabupaten Jembrana terletak pada 8°09’30” sampai dengan 8°28’02” LS dan 114°25’35” sampai dengan 114°56’38” BT. Curah hujan rata-rata sekitar 1.750 mm/tahun dengan lama hari hujan 112 hari/tahun. Suhu udara di daerah tersebut antara 20 °C sampai 39 °C dengan temperatur optimal antara 29 °C dan 32 °C dan kelembapan udara antara 74 dan 87% (Bappeda Jembrana 2011).
Gambar 3 Paddock pemeliharaan sapi bali di BPTU-HMT Sapi Bali Provinsi Bali pada musim hujan (kiri) dan pada musim kemarau (kanan).
Pengukuran Sifat Pertumbuhan dan Perdagingan
menggunakan rumus Hardjosubroto (1994). Pengukuran bobot menggunakan timbangan elektrik dan pengukuran ukuran tubuh menggunakan pita ukur dan tongkat ukur berdasarkan BSN (2015). Rumus bobot sapih terkoreksi umur 205 hari dan bobot setahun terkoreksi umur 365 hari serta PBBH disajikan sebagai berikut:
PBBH=[Bumur i-B0 ] Keterangan: PBBH = Pertambahan Bobot Badan Harian
Bi = Bobot pada saat peningbangan ke-i
B0 = Bobot lahir
B205=[Bumur x 205i-B0 ] +B0
Keterangan:
B 0 = Bobot sapih terkoreksi umur 205 hari
Bi = Bobot pada saat peningbangan ke-i
B0 = Bobot lahir
B365=[Bumur x 365i-B0 ] +B0
Keterangan:
B = Bobot sapih terkoreksi umur 365 hari
Bi = Bobot pada saat peningbangan ke-i
B0 = Bobot lahir
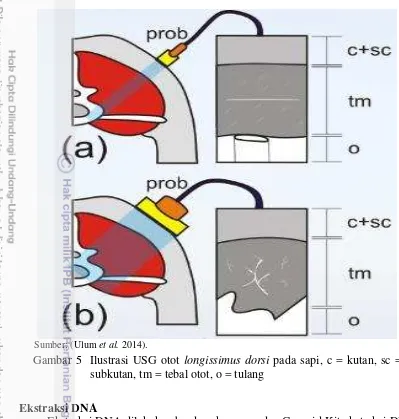
Sifat perdagingan diukur menggunkan alat ultrasonografi dengan frekuensi 6.5 Hz dan kedalaman 130 mm. Pengukuran tebal otot longissimus dorsi dilakukan pada posisi tulang rusuk ke 12-13 (Ulum et al. 2014), sedangkan pengukuran tebal otot rump dilakukan pada posisi rump diantara tulang ischium dan illium (Silva et al. 2012). Pengururan otot longissimus dorsi dan rump
dilakukan secara transversal (vertikal) dan longitudinal (horizontal). Penentuan
marbling score dilakukan berdasarkan AUSTRALIAN MEAT dan MSA marbling reference standard (http://www.wagyu.org.au/marbling/). Data disimpan dalam bentuk JPEG yang selanjutnya dianalisis menggunakan software ImageJ (ImageJ, NIH, USA). Pengukuran persentase lemak intramuskuler dilakukan pada gambar hasil USG yang diambil secara transversal (vertikal) pada posisi tulang rusuk ke 12-13, kemudian diambil region of interest sebesar 30 mm x 30 mm (Deaton dan Rause 2000). Posisi pengukuran sifat perdagingan pada sapi bali disajikan pada Gambar 4. Ilustrasi hasil USG otot longissimus dorsi disajikan pada Gambar 5
Sumber: (Ulum et al. 2014).
Gambar 5 Ilustrasi USG otot longissimus dorsi pada sapi, c = kutan, sc = subkutan, tm = tebal otot, o = tulang
Ekstraksi DNA
Amplifikasi DNA
Amplifikasi terhadap fragmen gen MSTN dan Myf5 dilakukan dalam mesin PCR Applied Biosystems sesuai dengan primer yang telah disajikan pada Tabel 1. Kondisi amplifikasi DNA terdiri atas tiga tahap, yaitu denaturasi, annealing, dan ekstensi sesuai dengan kondisi PCR (Polymerase Chain Reaction) bagi masing-masing fragmen gen target. Persiapan amplikon dilakukan dengan cara sampel DNA hasil ekstraksi diambil sebanyak 1 µl kemudian dipindahkan ke tabung 0.2 ml. Pereaksi amplifikasi DNA yang terdiri dari 25 µl promega green master mix, 23.6 µl DW, 0.2 µl primer forward, 0.2 µl primer reverse, dimasukkan ke dalam tabung 1.5 µl kemudian dihomogenkan. Sebanyak 49 µl campuran pereaksi PCR tersebut didistribusikan ke masing-masing tabung yang telah berisi 1 µl sampel DNA kemudian di spin down selama 10 detik dan selanjutnya dimasukkan ke dalam mesin PCR.
Amplifikasi DNA dilakukan dengan kondisi suhu predenaturasi 95oC selama lima menit, 35 siklus untuk tahapan denaturasi pada suhu 95 oC selama 10 detik, annealing pada suhu 51 oC selama 20 detik untuk gen Myf5 dan 63 oC selama 20 detik untuk gen MSTN, dan ekstensi pada suhu 72 oC selama 30 detik. Kemudian dilanjutkan tahap ekstensi akhir pada suhu 72 oC selama lima menit dalam satu siklus. Produk PCR dielektroforesis menggunakan gel agarosa 1.5% untuk memverifikasi hasil PCR.
Elektroforesis
Pembuatan gel agarosa dilakukan dengan mencampurkan serbuk agarosea sebanyak 45 gram dan 30 ml larutan 0.5X TBE (Tris Borax EDTA) dimasukkan ke dalam gelas piala kemudian dipanaskan dalam mikrowave selama 3-5 menit. Setelah itu, larutan agarosa didinginkan dengan menggunakan stirrer berkecepatan 50 rpm sampai asap hilang (sekitar 2 menit). Kemudian EtBr sebanyak 2.5 µl dimasukkan ke dalam larutan dan ditunggu sampai homogen. Setelah homogen larutan dituang ke dalam cetakan dan sisir untuk membuat sumur dipasang, larutan didiamkan selama 20 menit pada suhu ruang. Gel yang sudah mengeras bersama dengan cetakan dipasang dalam bak elektroforesis dan direndam dalam 0.5X TBE. Amplikon sebanyak 5 µl dimasukkan ke dalam masing-masing sumur dan di migrasikan bersama 100 bp ladder dengan tegangan 100 Volt selama 40 menit. Setelah itu, gel difoto menggunakan UV Transiluminator.
Sekuensing
Analisis Data
Identifikasi SNP (Single Nucleotide Polymorphism)
Identifikasi SNP di promoter gen MSTN dianalisis berdasarkan hasil sekuen baik fragmen forward dan reverse menggunakan program BioEdit (Hall 1999), selanjutnya dilakukan pensejajaran menggunakan metode alignment clustalW dengan program MEGA6 (Tamura et al. 2011).
Frekuensi Genotipe dan Alel
Keragaman genotipe pada masing-masing sampel dari daerah sumber bibit sapi bali dapat ditentukan dari hasil SNP yang ditemukan. Frekuensi genotipe adalah rasio dari jumlah suatu genotipe terhadap suatu populasi dengan menghitung perbandingan antara jumlah genotipe tertentu pada setiap populasi. Rumus menghitung frekuensi genotipe menurut Nei dan Kumar (2000) sebagai berikut :
X =nN
Keterangan :
Xii = frekuensi genotipe ke-ii nii = jumlah individu bergenotipe ii
N = jumlah individu sampel
Frekuensi alel adalah rasio suatu alel terhadap keseluruhan alel pada suatu SNP dalam populasi. Frekuensi alel (X ) dihitung berdasarkan rumus Nei dan Kumar (2000):
Xi=2nii2N+Σnij Keterangan :
Xi = frekuensi alel ke-i
nii = jumlah individu bergenotipe ii
nij = jumlah individu bergenotipe ij
N = jumlah individu sampel
Heterozigositas
Keragaman genetik dapat diketahui melalui estimasi heterozigositas pengamatan (Ho) dan heterozigositas harapan (He) yang diperoleh dari populasi sapi bali di BPTU-HMT Provinsi Bali dengan menggunakan rumus Nei dan Kumar (2000):
H0=∑nNij i≠j Keterangan :
Ho = heterozigositas pengamatan (populasi) nij = jumlah individu heterozigot
He=1-∑xi2 q
i=1 Keterangan :
He = nilai heterozigositas harapan
Xi = frekuensi alel q = jumlah alel
Keseimbangan Hardy-Weinberg
Keseimbangan Hardy-Weinberg dianalisa menggunakan rumus Allendroft et al. (2013) dengan nilai df = (kemungkinan jumlah genotipe) – (jumlah alel).
χ2= ∑(obs-exp)2 exp Keterangan:
χ2
= Hardy-Weinberg equilibrium test
obs = nilai observasi genotipe ii
Exp = nilai harapan genotipe ii
Asosiasi Gen Myf5 dan MSTN terhadap sifat Pertumbuhan dan Perdagingan Hubungan keragaman gen Myf5 dan MSTN terhadap sifat pertumbuhan dan perdagingan dianalisis menggunakan prosedur rancangan acak kelompok (RAK) dan uji lanjut Duncan Multiple Range Test (DMRT) (SAS Institute Inc. 2008). Model matematika yang akan digunakan sebagai berikut:
Yijk= µ+ αi+βj+ εij Keterangan:
Y = nilai pengamatan µ = nilai rataan umum
3
HASIL DAN PEMBAHASAN
Karakteristik Sifat Pertumbuhan dan Ultrasonografi Sifat Perdagingan pada Sapi Bali
Hasil penelitian ini didapatkan karakteristik sifat pertumbuhan dan perdagingan sapi bali di BPTU-HMT Provinsi bali yang disajikan pada Tabel 2. Berdasarkan hasil pengukuran rataan sifat pertumbuhan sapi bali. Karakteristik fenotipe sapi bali sangat mirip dengan banteng namun berbeda dalam ukuran dan temperamen yang diakibatkan oleh domestikasi (Martojo 2012). Parameter sifat pertumbuhan hasil penelitian ini lebih rendah dibanding hasil Gunawan dan Jakaria (2011) yaitu bobot lahir mencapai 17.73-17.55 kg, bobot sapih mencapai 85.58-89.50 kg dan bobot satu tahun mencapai 130.25-142.3.25 kg sedangkan pada sapi hasil penelitian bobot lahir, bobot sapih (BB205 hari) dan bobot setahun berturut-turut sebesar 17.19 kg, 57.05 kg dan 88.10 kg
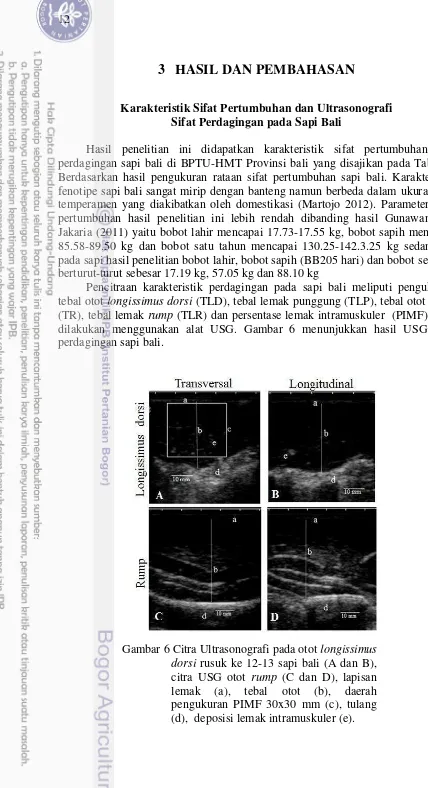
Pencitraan karakteristik perdagingan pada sapi bali meliputi pengukuran tebal otot longissimus dorsi (TLD), tebal lemak punggung (TLP), tebal otot rump (TR), tebal lemak rump (TLR) dan persentase lemak intramuskuler (PIMF) yang dilakukan menggunakan alat USG. Gambar 6 menunjukkan hasil USG sifat perdagingan sapi bali.
Ultrasonografi sebelumnya telah digunakan untuk memprediksi tebal lemak punggung dan lemak intramuskular (IMF) pada berbagai ternak seperti babi (Newcom et al. 2004, Jung et al. 2015), sapi (Miar et al. 2013), dan kelinci (Amalianingsih et al. 2014). Menurut Lambe et al. (2010) penentuan kualitas karkas dapat dilakukan dengan melihat karakteristik dari otot longissimus dorsi dan deposit lemak yang ada di dalam jaringan. Rataan sifat perdagingan hasil USG pada sai bali disajikan pada Tabel 2.
Tabel 2 Rataan sifat pertumbuhan dan perdagingan pada sapi bali
Phenotype n Rataan SD Maks Min
Bobot lahir (kg) 48 17.19 1.32 22.00 15.00
BB 205 hari (kg) 48 57.05 10.91 81.02 40.57
Bobot 365 hari (kg) 48 88.10 19.44 128.65 59.71
PBBH (kg) 48 0.18 0.08 0.30 -0.05
Tinggi pundak (cm) 48 91.91 5.48 106.00 82.00
Panjang badan (cm) 48 84.47 6.76 100.00 71.00
Lingkar dada (cm) 48 108.91 9.18 133.00 94.00
Tebal otot longiisimus dorsi (mm) 31 30.02 4.88 38.52 22.26 Tebal lemak punggung (mm) 31 1.27 0.29 2.04 0.83
Tebal rump (mm) 31 36.40 4.82 46.35 28.67
Tebal lemak rump (mm) 31 0.94 0.27 1.60 0.46
Marbling score 31 1.87 0.88 3.40 0.00
Persentase lemak intramuskuler (%) 31 3.13 1.62 6.71 0.51
Hasil penelitian ini didapatkan bahwa rataan keseluruhan tebal otot longissimus dorsi sebesar 30.02±4.88 mm, tebal lemak punggung sebesar 1.27±0.29 mm lebih besar dari pada hasil pengukuran Rachma dan Harada (2010) pada umur 12, 18 dan 24 bulan (Tabel 3).
Tabel 3 Karakteristik perdagingan sapi bali di kabupaten Barru dan Bone
Sifat/Umur 12 bulan 18 bulan 24 bulan
Luas longissimus thoracsis (cm2) 16.60-18.00 18.50-24.30 23.30-23.80
Marbling score 0.00-0.14 0.15-0.24 0.17-0.20
Tebal lemak subkutan (mm) 0.26-0.28 0.26-0.33 0.34 Tebal lemak inter muscular (mm) 0.97-1.13 1.06-1.24 1.14-1.31
Tebal rib (mm) 1.99-2.04 2.12-2.52 2.30-2.72
Sumber: Rachma dan Harada (2010).
pada kisaran umur 2.5 sampai 3.5 tahun sebesar 8.40 mm. Hasil penelitian ini menunjukkan nilai marbling score yang rendah dengan rataan 2.33±1.24 mm. Persentase IMF hasil USG sebesar 3.13±1.62%. Hasil penelitian ini menunjukkan bahwa marbling score sapi bali pada umur 12 sampai 15 bulan di BPTU-HMT Provinsi Bali tergolong dalam kategori III (1 sampai 4) (BSN 2015).
Amplifikasi Gen Myf5 dan MSTN pada Sapi Bali
Amplifikasi berhasil dilakukan pada gen Myf5 dan MSTN dengan suhu annealing 51°C dan 63°C dan menghasilkan produk masing-masing sebesar 285 bp dan 535 bp. Keberhasilan amplifikasi dipengaruhi oleh beberapa faktor yaitu konsentrasi sampel, konsentrasi primer, suhu annealing, waktu annealing, jumlah sampel, konsentrasi dNTPs dan konsentrasi MgCl2 (Viljoen et al. 2005). Suhu annealing kisaran 50 sampai 72°C tergantung dari sekuen primer dan konsentrasi Konsentrasi MgCl2. Konsentrasi DNA sampel hasil ekstrasi antara 40-88 ng/µl dengan kemurnian kisaran 1.81-2.4. Kemurnian DNA ditentukan oleh nilai rasio (OD260/OD280) yaitu pada kisaran 1.8-2.0. Apabila nilai rasio (OD260/OD280) lebih rendah dari 1.8 mengindikasikan adanya kontaminasi protein dan apabila nilai (OD260/OD280) lebih dari 2.0 mengindikasikan kontaminasi RNA (Ghatak et al. 2013). Gambar 7 menunjukkan hasil elektroforesis gen Myf5 dan MSTN sapi bali.
Gambar 7 Hasil amplifikasi gen Myf5 (A) dan MSTN (B) pada elektroforesis gel 1.5%, M: Marker.
Polimorfisme Gen Myf5 dan MSTN pada Sapi Bali
polimorfik pada sapi qinchuan. Homologi sekuen gen Myf5 sapi bali dengan genbank disajikan pada Gambar 8.
Gambar 8 SNP gen Myf5 pada sapi bali
Frekuensi genotipe menunjukkan rasio dari jumlah suatu genotipe terhadap suatu populasi dengan menghitung perbandingan antara jumlah genotipe tertentu pada setiap populasi sedangkan frekuensi alel adalah rasio suatu alel terhadap keseluruhan alel pada suatu SNP dalam populasi (Noor 2010). SNP dikatakan polimorfik apabila memiliki frekuensi alel ≤0.99 untuk populasi yang besar dan
≤0.95 untuk populasi yang lebih kecil (Alendrof et al. 2013).
tidak ditemukan, hasil tersebut berbeda dengan Ujan et al. (2011) yang menemukan polimorfisme pada SNP c.1172T>A dengan frekuensi genotipe TT lebih besar dari AA pada sapi cina (B. taurus).
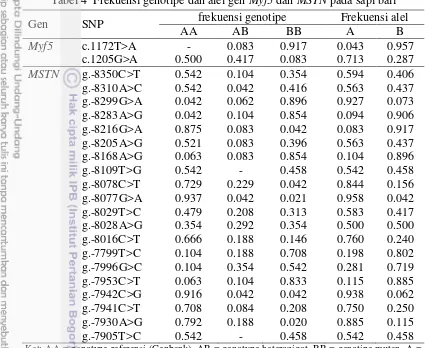
Tabel 4 Frekuensi genotipe dan alel gen Myf5 dan MSTN pada sapi bali
Gen SNP frekuensi genotipe Frekuensi alel
AA AB BB A B
Ket: AA = genotype referensi (Genbank), AB = genotype heterozigot, BB = genotipe mutan, A = alel referensi (Genbank), B = alel mutan.
Homologi sekuen promoter gen MSTN sapi bali dengan genbank disajikan pada Gambar 9. Hasil pensejajaran ditemukan 20 SNPs pada sekuen gen MSTN yang termasuk dalam SNP tranversi (18 SNPs) dan transisi (2 SNP). Hampir semua SNP gen MSTN memiliki tiga genotipe kecuali pada SNP g.-8109T>G dan g.-7905T>C hanya ditemukan dua genotipe homozigot genotipe heterozigot tidak ditemukan. Distribusi frekuensi alel terendah terdapat pada SNP g.-7942C>G pada alel G yaitu sebesar 0.062 sedangkan frekuensi alel tertinggi terdapat pada SNP g.-7942C>G alel C sebesar 0.938. Sarti et al. (2014) menyatakan bahwa polimorfisme pada daerah promoter gen MSTN pada sapi marchiagiana pada posisi SNP -37A>T dengan genotipe AA, AT dan TT sebesar 0.03, 0.26 dan 0.72, sedangkan pada SNP -805 bersifat monomorfik dengan genotipe GG .
persentase GC >50% dan Obs/Exp >0.6. Gambar 10 menunjukkan hasil prediksi CpG island pada sapi bali dan genbank. Pada daerah tersebut ditemukan 7 buah SNP yang mungkin menyebabkan CpG island di sapi bali tidak ditemukan. Daerah promoter diketahui memiliki fungsi yang menunjukkan adanya TSS (transcription start site) yang merupakan posisi awal transkripsi suatu gen (Illingworth et al. 2010). Mutasi di promoter gen MSTN dapat menyebabkan penurunan ekspresi yang berakibat pada perubahan perkembangan sel otot. Hal tersebut dapat terjadi karena perubahan pola splicing dan perubahan ekspresi gen (Santagostino et al. 2015). Adapun daerah genom yang berkaitan dengan metilasi DNA dibedakan menjadi dua bagian, 1) DNA termetilasi, sedikit CpG island, dan 2) tidak termetilasi, kaya CpG island (Deaton dan Bird 2011). Mutasi di daerah TATA box, CACCC dan AT1 secara signifikan dapat menurunkan aktivitas promoter, namun mutasi pada daerah AT2 dan PAL dapat meningkatkan aktivitas promoter (Allen dan Du 2008). Gambar 10 menunjukkan ketiadaan CpG island di promoter sapi bali (A) dan CpG island pada promoter Bos taurus (B). Ketiadaan CpG island pada sapi bali mungkin disebabkan oleh adanya 7 buah mutasi di daerah CpG island yaitu SNP 8078C>T, 8077G>A, 8029T>C, g.-8028A>G, g.-8016C>T, g.-7799T>C, g.-7996G>C.
Gambar 10 Tidak ditemukan CpG island di sapi bali (A) dan CpG island di Bos taurus (B).
Heterozigositas dan Keseimbangan Hardy-Weinberg
Heterozigositas menyatakan keragaman genetik suatu populasi yang dapat digunakan untuk program seleksi. Noor (2010) menjelaskan bahwa keragaman gen dapat digunakan sebagai acuan dalam menentukan program pemuliaan yaitu dilakukan seleksi apabila populasi beragam dan persilangan dilakukan apabila populasi seragam. Suatu SNP dikatakan memiliki keragaman tinggi apabila nilai heterosigositas >0.50 (Allendrof et al. 2013). Nilai heterosigositas observasi (Ho) tertinggi gen Myf5 terdapat pada SNP c.1205G>A yaitu sebesar 0.4167 sedangkan nilai heterosigositas observasi (Ho) terendah pada SNP c.1172T>A sebesar 0.0833. Heterosigositas tertinggi gen MSTN yaitu pada SNP g.-7996G>C sebesar 0.3542 dan nilai terendah pada SNP g.-8109T>G dan g.-7905T>C dengan heterosigositas sebesar 0.000. Heterosigositas 0.000 disebabkan tidak ditemukannya individu bergenotipe heterozigot. Nilai heterosigositas SNP gen Myf5 dan MSTN disajikan pada Tabel 5.
Tabel 5 Heterosigositas dan keseimbangan Hardy-Weinberg SNP gen Myf5 dan
Asosiasi gen MYF5 terhadap Sifat Pertumbuhan dan Perdagingan
marchigiana (Sarti et al. 2014). Gen Myf5 merupakan anggota MRF Family dan salah satu gen yang terlibat dalam mekanisme pembentukan otot rangka dan pembentukan lateral sciertome derivates (Braun et al. 1992). Gen Myf5 merupakan gen pertama yang diekspresikan oleh sel-sel progenitor pada tahapan myogenic selama masa perkembangan embrio (Francetic dan Li 2011). Gen Myf5 bersama dengan MyoD adalah bagian dari myogenic basis HLH transcription factor family yang diekspresikan pada poliferasi myoblast dan myotube (serat otot immature) yang belum terdiferensiasi yang dibutuhkan untuk determinasi myogenic dari prekusor otot dan menjaga populasi sel myogenic. Tajbakhsh et al. (1996) menyatakan bahwa tikus yang mempunyai mutasi pada gen Myf5 secara total kekurangan serat otot rangka dan prekusor myoblast. Braun (1992) juga menjelaskan bahwa mutasi pada gen Myf5 dapat menyebabkan kematian pada tikus karena kesulitan bernafas pada saat setelah dilahirkan yang diakibatkan oleh tidak terbentuknya otot pada tulang rusuk janin.
Tabel 6 Asosiasi pengaruh genotipe SNPs gen Myf5 terhadap sifat pertumbuhan sapi bali BB205 (kg) 56.75±10.48 57.05±10.90 56.50±10.53 57.04±0.41 59.00±10.26 BB365 (kg) 88.00±18.71 88.18±19.43 88.17±18.81 87.31±18.65 91.50±18.35 PBBH (kg) 0.19±0.052 0.19±0.054 0.19±0.052 0.19±0.05 0.20±0.05 TP (cm) 92.96±2.69 91.75±0.85 91.72±1.07 90.71±1.33 97.29±26 PB (cm) 87.11±3.30 84.15±1.05 84.05±1.39 84.16±1.73 87.69±3.43 LD (cm) 107.75±4.58 108.97±1.45 109.64±1.89 106.49±2.35 113.79±4.65
Ket: BL= Bobot lahir, BB205= Bobot sapih, BB365= BB 1 tahun, PBBH= pertambahan bobot badan harian, TP= Tinggi pundak, PB= panjang badan. LD= Lebar dada.
Meskipun tidak terlihat perbedaan yang nyata, namun secara keseluruhan pada sifat perdagingan apabila tebal otot longissimus dorsi besar maka tebal lemak punggung kecil dan begitu juga sebaliknya. Hal ini disebabkan karena pada saat embriogenesis terjadi penurunan tingkat poliferasi pada primary skeletal muscle cells yang menyebabkan rendahnya ekspresi gen Myf5 yang berperan menjaga satelite cell pool (prekusor sel otot yang dapat menambah myonuklei pada ternak dewasa) sehingga prekusor myogenic berubah menjadi adipogenic yang dapat meningkatkan deposisi intramuscular fat pada sapi (Coles et al. 2015).
Asosiasi Gen MSTN terhadap Sifat Pertumbuhan dan Perdagingan
Asosiasi SNPs pada gen MSTN dengan sifat pertumbuhan dan perdagingan disajikan pada Tabel 8, Tabel 9 dan Tabel 10. Hasil analisis tidak ditemukan asosiasi nyata antara perbedaan genotipe pada masing-masing SNPs dengan sifat pertumbuhan. Namun, hasil asosiasi SNP dengan sifat perdagingan ditemukan nyata pada persentase lemak intramuscular (PIMF) yaitu pada SNP g.-7799T>C dan g.-7941C>T (Tabel 10). Pada sapi qincuan juga tidak ditemukan asosiasi nyata pada polimorfisme gen MSTN terhadap sifat bobot lahir, bobot 6 bulan, bobot 12 bulan, bobot 18 bulan dan bobot 24 bulan, namun ditemukan asosiasi signifikan pada tinggi pundak pada umur 18 bulan (Zhang et al. 2007).
Ekpresi gen MSTN pada janin sapi sangat tinggi dan akan menurun seiring dengan kelahiran dan perkembangan ternak sampai umur 10 bulan. Kemudian pada umur sekitar 13 bulan ekspresi gen MSTN akan mengalami peningkatan kembali sampai puncaknya pada umur 16 bulan dan akan menurun kembali secara perlahan (Shibata et al. 2014). Daerah promoter gen MSTN diketahui terlibat dalam ekspresi gen namun tidak mempengaruhi ekspresi gen myogenic lainnya seperti Myog, Myf5, dan MyoD. Ekspresi gen MSTN berbanding terbalik dengan ekspresi Myogenic lainnya (Xu et al. 2003).
Myostatin adalah paracrine atau autocrine yang mutasinya mengakibatkan aktivitas atau ekspresi gen MSTN berubah dan menghasilkan peningkatan pada massa otot pada beberapa spesies (Allen dan Du 2008). Protein myostatin berfungsi menghambat proses proliferasi dan diferensiasi sel sehingga pertumbuhan sel yang dihasilkan tidak berlebihan dan sesuai dengan kebutuhan (Taylor et al. 2001; Bellinge et al. 2005). Adapun Han et al. (2012) menyatakan bahwa mutasi di promoter berasosiasi nyata pada indeks kualitas daging dan indeks warna lemak pada sapi hanwoo. Bellinge et al. (2005) menyatakan bahwa individu yang memiliki mutasi di gen MSTN mengalami dua sampai tiga kali perkembangan otot yang lebih besar yang diakibatkan oleh kombinasi hiperplasia (peningkatan jumlah otot) dan hiperthrophy (peningkatan massa otot) pada ternak.
Tabel 8 Asosiasi genotipe SNP gen MSTN terhadap sifat bobot sapi bali
SNP Genotype n BL (kg) BB205 (kg) BB365 (kg) PBBH (kg) g.-8350C>T CC 26 17.65±1.15 57.83±12.13 89.83±21.25 0.23±0.06
CT 5 17.00±0.00 63.60±11.17 100.60±19.89 0.20±0.05 TT 17 16.92±1.73 53.60±7.75 81.47±14.40 0.18±0.04 g.-8310A>C AA 26 16.92±1.15 57.83±12.13 89.83±21.25 0.20±0.06 AC 2 17.00±0.00 57.00±15.68 88.50±27.91 0.20±0.08 g.8216G>A GG 2 17.24±0.71 64.50±10.70 102.00±19.04 0.23±0.04 AG 4 17.00±0.00 62.75±12.88 98.75±22.94 0.22±0.06 AA 42 16.50±1.41 56.00±9.71 86.27±16.74 0.19±0.05 g.-8205A>G AA 25 17.92±1.18 57.68±12.40 89.59±21.72 0.22±0.06 AG 4 17.00±0.00 62.75±12.88 98.75±22.94 0.20±0.06 g.-8078C>T CC 35 18.50±1.39 57.58±10.82 89.10±19.44 0.20±0.05 CT 11 17.23±0.92 54.20±10.86 83.40±19.29 0.18±0.05 TT 2 16.82±2.12 62.50±16.31 97.50±27.39 0.22±0.07 g.-8077G>A GG 45 17.22±1.38 57.00±0.00 88.10±0.00 0.19±0.05 AG 2 17.00±0.00 57.00±15.68 88.50±27.91 0.20±0.08 AA 1 16.00±0.00 58.00±11.04 90.00±19.67 0.20±0.00 g.-8029T>C CC 15 17.60±1.76 55.67±10.52 85.47±18.71 0.19±0.05 CT 10 17.00±1.33 59.50±11.65 93.00±20.33 0.21±0.05 TT 23 17.00±0.90 56.78±11.20 87.72±20.15 0.19±0.06 g.-8028A>G AA 17 17.47±1.70 56.82±10.68 87.59±19.06 0.19±0.05 AG 17 17.12±1.14 59.77±11.75 93.62±20.64 0.21±0.06 GG 14 16.93±0.99 54.54±10.53 83.46±18.94 0.18±0.05 g.-8016C>T CC 32 17.20±1.33 56.93±10.06 87.93±18.36 0.19±0.05 CT 9 17.22±1.20 58.88±12.71 91.75±22.20 0.20±0.06 TT 7 17.14±1.57 55.29±13.40 85.00±22.93 0.19±0.06 g.-7799T>C CC 34 17.35±1.52 55.81±10.68 85.77±18.95 0.19±0.05 CT 9 16.89±0.33 58.88±10.67 92.00±19.18 0.21±0.05 g.-7942C>G CC 44 17.23±1.36 56.10±10.59 86.48±18.85 0.19±0.05 CG 2 17.00±0.00 68.50±11.11 109.00±19.78 0.25±0.05 GG 2 16.50±0.71 71.00±0.00 114.00±0.00 0.27±0.00 g.-7941C>T CC 34 17.18±1.40 57.58±11.29 89.23±20.09 0.20±0.06 CT 4 16.50±1.00 59.75±12.60 93.75±22.29 0.21±0.06 TT 10 17.50±1.08 53.50±8.88 81.25±15.84 0.17±0.04 g.-7930A>G AA 38 17.24±1.44 57.71±10.84 89.32±19.29 0.20±0.05 AG 9 17.00±0.71 56.13±10.96 86.75±19.73 0.19±0.05 GG 1 17.00±0.00 41.00±0.00 60.00±0.00 0.12±0.00 g.-7905T>C CC 22 17.00±1.20 57.04±12.63 88.35±22.10 0.19±0.06 TT 26 17.35±1.41 57.04±9.45 88.00±17.31 0.19±0.05 Ket: BL= Bobot Lahir, BB205= Bobot 205 hari, BB365= Bobot 365 hari, PBBH= Pertambahan
Tabel 10 Asosiasi genotipe SNP gen MSTN terhadap sifat perdagingan sapi bali
4
SIMPULAN DAN SARAN
Simpulan
Single Nucleotide Polymorphism (SNP) yang ditemukan pada gen Myf5 sebanyak dua buah bersifat polimorfik yaitu SNP c.1172T>A dan c.1205G>A. Kedua SNP tersebut tidak berasosiasi dengan sifat pertumbuhan dan perdagingan. Pada gen MSTN ditemukan 20 SNP yang bersifat polimorfik di promoter diantaranya 7 SNP berada di CpG island pada sapi bali di BPTU-HMT Provinsi Bali. Diperoleh 2 SNP yang berasosiasi nyata terhadap sifat perdagingan (PIMF) yaitu SNP pada posisi g.-7799T>C dan g.-7941C>T yang dapat digunakan sebagai kandidat untuk marka genetik sifat perdagingan pada sapi bali.
Saran
Single Nucleotide Polymorphism (SNP) yang nyata pengaruhnya terhadap sifat perdagingan (PIMF) perlu dilakukan validasi melalui analisis ekspresi gen (qPCR) pada sapi bali dan diperlukan sampel populasi sapi bali di luar wilayah pulau Bali. Evaluasi hasil USG dengan kualitas karkas sapi bali perlu dilakukan untuk mengetahui korelasi pengukuran hasil USG dengan pengukuran langsung.
DAFTAR PUSTAKA
Allen DL, M Du. 2008. Comparative functional analysis of the cow and mouse myostatin genes reveals novel regulatory elements in their upstream promoter regions. Compar Biochem and Physi. 150:432–439.
Allendrof FW, G Luikart, SN Aitken. 2013. Conservation and the Genetics of Populations. 2nd Ed. Wiley-Blackwell Publishing. Chicester. UK.
Amalianingsih TI. B Brahmantiyo, Jakaria. 2014. The variability of growth hormone gene associated with ultrasound imaging of longissimus dorsi muscle and perirenal fat in rabbits. Media Petern. 37(1):1-7.
Arnold H, M A Della-Fera CA Baile. 2001. Review of myostatin history. physiology and applications. The Univ. of Georgia. CAES. Dept. of Animal & Dairy Sci. 2001/2002 Annual Report: 1-12.
Badan Pusat Statistik. 2012. Pendataan Sapi Potong, Sapi Perah dan Kerbau 2011 (PSPK 2011). Jakarta (ID); Badan Pusat Statistik.
Bappeda dan Penanaman Modal Pemerintah Kabupaten Jembrana. 2011. Profil Kabupaten Jembrana Tahun 2011.
Bellinge RHS, DA Liberies, SPA Laschi, PA O’brien, GK Tay. 2005. Myostatin and its implications on animal breeding: a review. Anim Genet 36:1-6. Bentzinger CF, YX Wang, MA Rudnicki. 2012. Building muscle: molecular
Bhuiyan MSA, NK Kim, YM Cho, D Yoon, KS Kim, JT Jeon, JH Lee. 2009. Identification of snps in myoD gene family and their associations with carcass traits in cattle. J Livesto Sci. 126:292–297.
Braun T, M Gautel. 2011. Transcriptional mechanisms regulating skeletal muscle differentiation growth and homeostasis. Nature. 12:349-361.
Braun T, Rudnicki MA, Arnold HH, Jaenisch R. 1992. Targeted inactivation of the muscle regulatory gene myf-5 results in abnormal rib development and perinatal death. Cell. 71(3):369-82.
[BSN] Badan Standarisasi Nasional. 2015. Bibit Sapi potong. Bagian 4: Bali. SNI 7651.4:2015. Jakarta (ID): Badan Standarisasi Nasional.
Carninci P, A Sandelin, B Lenhard, S Katayama, K Shimokawa, J Ponjavic, CA Semple, MS Taylor, PG Engstrom, MC Frith. 2006. Genome-wide analysis of mammalian promoter architecture and evolution. Nat Genet. 38:626–635. Chung R, WT Kim. 2005. Association of snp marker in igf-I and myf5 candidate
genes with growth traits in lorean cattle. AJAS. 18(8):1061-1065.
Coles CA, Wadeson J, Leyton CP, Siddle JP, Greenwood PL, White JD, McDonagh MB. 2015. Proliferation rates of bovine primary muscle cells relate to liveweight and carcase weight in cattle. Plosone. 10(4):1-14.
Deaton AM, A Bird. 2011. CpG island and the regulation of transcription. Genes Dev. 25:1010-1022.
Deaton AVW, G Rouse. 2000. USOFT: An ultrasound image analysis software for beef quality research. Beef research report. A.S. Leaflet R1437. Iowa (USA): Iowa University.
Doherty R, O’ Farrelly C, Meade KG. 2014. Comparative epigenetics: relevance to the regulation of production and health traits in cattle. Anim Genet. 45(1):3–14.
Francetic T, Li Q. 2011. Skeletal myogenesis and myf5 activation. Transcription. 2(3):109-114.
Gerbens F, de koning DJ, Harders FL, Meuwissen THE, Janss LLG, Groenen MAM, Veerkamp JH, Van Arendonk JAM, Te Pas MF. 2000. The effect of adipocyte and heart fatty acid-binding protein genes on intramuscular fat and backfat content in Meishan crossbred pigs. J Anim Sci. 78:552-559. Ghatak S, Muthukumaran RB, Nachimuthu SK. 2013. A simple method of
genomic dna extraction from human sample for pcr-rflp analysis. J Biomol Technique. 24:224-231.
Gunawan A, Jakaria. 2011. Genetic and non-genetics effect on birth, weaning, and yearling weight of bali cattle. Media Petern. 34(2):93-98.
Guo B, Greenwood PL, Café LM, Zhou G, Zhang W, Dalrymple BO. 2015. Transcriptome analysis of cattle muscle identifies potential markers for skeletal muscle growth rate and major cell types. BMC Genomics. 16 (177): 1-16.
Hall TA. 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for windows 95/98/NT. Nucl Acids Symp. Ser. 41: 95-98. Han SH, Cho IC, Ko MS, Kim EY, Park SP, Lee SS, Oh HS. 2012. A promoter
polymorphism of mstn g.2371T>A and its associations with carcass traits in Korean cattle. Mol Bil Rep. 39:3767-3772.
Hardiwirawan E, Subandriyo. 2004. Potensi keragaman sumberdaya genetik sapi bali. Wartazoa.14(3):50-60.
Hardjosubroto. 1994. Aplikasi Pemuliabiakan Ternak di Lapangan. Jakarta (ID): Gramedia Widiasarana Indonesia.
He YL, YH Wu, FS Quan, YG Liu, Y Zhang. 2013. Comparative analysis of myostatin gene and promoter sequences of qinchuan and red angus cattle. Genet Mo. Res. 12 (3):3398-3406.
Illingworth RS, Gruenewald-Schneider U, Webb S, Kerr ARW, James KD, Turner DJ, Smith C, Harrison DJ, Andrews R, Bird AP. 2010. Orphan cpg islands identify numerous conserved promoters in the mammalian genome. PLoS Genet. 6(9):1-15.
Jones PA, Takai D. 2001. The role of dna methylation in mammalian epigenetics. AAS. 293:1068-1070. Myostatin inhibits myoblast differentiation by down-regulating MyoD expression. J Biol Chem. 277:49831–49840.
Lee SJ, McPherron A. 2001. Regulation of myostatin activity and muscle growth. PNAS. 98(16):9306–9311.
Li C, Basarab J, Snelling WM, Benkel B, Murdoch B, Hansen C, Moore SS. 2004. Assessment of positional candidate genes myf5 and igf-1 for growth on bovine chromosome 5 in commercial of bos taurus. J Anim Sci. 82:1-7. Li N, Yang Q, Ryan GW, Thomas B, Min D, Buel DR. 2015. Myostatin
attenuation in vivo reduces adiposity, but activates adipogenesis. Endocrinology. 157(1):1-10.
Martojo H. 2012. Indigenous bali cattle is most suitable for sustainable small farming in indonesia. Reprod Dom Anim. 47(1):10–14.
Miar Y, Plastow GS, Bruce HL, Moore SS, Durunna ON, Nkrumah JD, Wang Z. 2014. Estimation of genetic and phenotypic parameters for ultrasound and carcass merit traits in crossbred beef cattle. Can J Anim Sci. 94:273-280.
Miyake M, Hayashi S, Taketa Y, Iwasaki S, Watanabe K, Ohwada S, Aso H, Yamaguchi T. 2010. Myostatin down-regulates the igf-2 expression via alk-smad signaling during myogenesis in cattle. JAnim Sci. 81:223 –229.
factor expression in adult double-muscled japanese shorthorn cattle. JAnim Sci. 80: 678–685.
Nassiry MR, Javanmard A, Tohidi R. 2009. Application of tatistiscal procedures for analysis of genetic diversity in domestic animal populations. American J Anim Vet Sci. 4(4):136-141.
Noor R. 2010. Genetika Ternak. Jakarta (ID): Penebar swadaya.
Ott MO, Bober E, Lyons G, Aarnold H, Margaret B. 1991. Early expression of the myogenic regulatory gene myf-5.in precursor cells of skeletal muscle in the mouse embryo. Development. 111:1097-1107.
Patmawati NW, Trinayani NW, Siswanto M, Wandia IN, Puja IK. 2013.Seleksi awal pejantan sapi Bali berbasis uji perforans. JIKH. (1):29-33.
Purwantara B, Noor RR, Anderson G, Rodriguez-Martinez H. 2012. Banteng myogenic differentiation. American J Physi. 282:C993–C999.
Robakowska-Hyzorek D, Oprza J, Zelazowska B, Olbromski R, Zwierzchowski L. 2010. Effect of the g.–723G/T polymorphism in the bovine myogenic factor 5 (myf5) gene promoter region on gene transcript level in the longissimus dorsi muscle and on meat traits of Polish Holstein-Friesian cattle. Biochem Genet. 48:450–464.
Santagostino M, Khoriauli L, Gamba R, Bonuglia M, Klipstein O, Piras FM, Vella F, Russo A, Badiale C, Mazzagatti A, Raimondi E, Solomon G, Nergadze, Giulotto E. 2015. Genome-wide evolutionary and functional analysis of the equine repetitive element 1: an insertion in the myostatin promoter affects gene expression. BMC Genet . 16(126):1-16.
Sarti FM, Lasagna E, Ceccobelli S, di Lorenzo P, Filippini F, Sbarra F, Giontella A. 2014. Influence of single nucleotide polymorphism in myostatin and myogenic factor 5 muscle growth-related genes on the performance traits of Marchigiana beef cattle. J Anim Sci. 92:3804-3810.
SAS Institute Inc. 2008. SAS/STAT® 9.2 User’s Guide The GLM Procedure (Book Excerpt). Carolina (US): SAS Institute Inc. SAS Campus Drive. Sellner EM, Kim JW, Clure Mc, Taylor KH, Schnabel RD, Taylor JF. 2007.
Board-invited review: applications of genomic information in livestock. J Anim Sci. 85:3148-3158.
with growth and carcass traits in hanwoo (korean cattle). Genes Genom. 33:425-430.
Shibata M, Matsumoto K, Aikawa K, Muramoto T, Fujimura S, Kadowaki M. 2006. Gene expression of myostatin during development and regeneration skeletal muscle in japanese black cattle. J Anim Sci. 84:2983–2989.
Silva SL, Tarouco JU, Ferraz JBS, da C Gomes R, Leme PR, Navajas EA. 2012. Prediction of retail beef yield. trim fat and proportion of high-valued cuts in Nellore cattle using ultrasound live measurements. R Bras Zootec. 41(9):2025-2031.
Sun WX, Dodson V, Jiang ZH, Yu SG, Chu WW, Chen J. 2016. Myostatin inhibits porcine preadipocyte differentiation in vitro. Domes Anim Endoc. 55: 25-31.
Supriyantono A, Irianti BW. 2007. Peningkatan Mutu Genetik Sapi Bali Melalui Pengembangan Program Pemuliaan. J Prot UMM. (1):17-23.
Tajbakhsh S, Rocancourt D, Buckingham M. 1996. Muscle progenitor cell falling to respond to positional cues adopt non-my ogenic fates in myf-5 nullmice. Nature. 384(21):266-270.
Talib C, Siregar AR, Budiarti-Turner S, Diwyanto K. 2003. Strategies to improve bali cattle in eastern indonesia. Aciar Proceedings. Di dalam: K Entwistle. DR Lindsay. Implementation of a Breeding Program for Bali Cattle Technical issues at national and regional levels. 2002 Feb 4–7; Bali Indonesia. Canberra (AU): ACIAR. Hlm 82-85.
Talib C. 2002. Sapi bali di daerah sumber bibit dan peluang pengembangannya. Wartazoa. 12(3):100-107.
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. 2011. MEGA5: molecular evolutionary genetics analysis using maximum likelihood. evolutionary distance. and maximum parsimony methods. Mol Biol Evol 28(10):2731–2739.
Taylor WE, Bhasin S, Artaza J, Byhower F, Azam M, Jr Willard DH, Jr Cull FC, Gonzalez-Cadavid N. 2001. Myostatin inhibits cell proliferation and protein synthesis in C2C12 muscle cells. Am J Physiol Endo Metab. 280:E221– E228 .
Thomas M, Langley B, Berry C, Sharma M, Kirk S, Bass J, Kambadur R . 2000. Myostatin. a negative regulator of muscle growth. functions by inhibiting myoblast proliferation. Bio Chem. 275 (51):40235–40243.
Ujan JA, Zan LS, Ujan SA, Adoligbe C, Wang HB. 2011. Back fat thickness and meat tenderness are associated with a 526 T>A mutation in the exon 1 promoter region of the myf-5 gene in chinese bos taurus. GMR. 10(4):3070-3079.
Ulum MF, Suprapto E, Jakaria. 2014. Citra ultrasonografi otot punggung (longisimus dorsi) pada sapi bali. Proceeding. Konverensi Ilmiah Veteriner Nasional ke-13 Perhimpunan Dokter Hewan Indonesia (PDHI), 2014 Nov 23-26, Padang (ID): KIVNAS PDHI XIII. Hlm 368-369.
USDA. 2014. Carcass Beef Grades and Standards. [intenet] diakses tanggal 2016 Mei 20. Dapat diakses pada: https://www.ams.usda.gov/grades-standards/carcass-beef-grades-and-standards
Molecular Genetics and Their Place in Breeding Systems; 2002 Feb 4–7; Bali Indonesia. Canberra (AU): ACIAR. Hlm 34-40.
Viljoen GJ, Nel LH, Crowther JR. 2005. Molecular DiagnosticPCR Hanbook. Netherland (EN): Springer.
Wiyatna MF. 2007. Perbandingan Indek Perdagingan Sapi-sapi Indonesia (Sapi Bali, Madura, PO) dengan Sapi Australian Commercial Cross (ACC). 7(1):22-25.
Xu C, Wu G, Zohar Y, Du SJ. 2003. Analysis of myostatin gene structure. expression and function in zebrafish. J Experimen Bio. 206:4067-4079. Yantika SM, Alamsyari, Evvyernie D, Diapari D, Winaga K. 2016. performance,
carcass production, and meat quality of sumba ongole bulls fed ration supplemented velvet bean (mucuna pruriens). Media Petern. 39(1):20-26. Yosita M, Santosa U, Setyowati EY. 2012. Persentase karkas, tebal lemak
punggung dan indeks perdagingan sapi bali, peranakan ongole dan australian commercial cross. J Unpad. 1(1): 1-5.
Lampiran 1 Sekuen gen Myogenic Factor 5 (MYF5) berdasarkan genbank kode akses M95684
GenBank= M95684.1 Bos taurus myogenic factor (MYF5) gene. complete cds
LOCUS BOVMYF5A
5219 bp DNA linear MAM 30-OCT-1994
DEFINITION Bos taurus myogenic factor (MYF5) gene. complete cds.
ACCESSION M95684
VERSION M95684.1 GI=163403
KEYWORDS DNA-binding protein; myogenic factor; transcription factor.
AUTHORS Barth.J.L.. Worrell.R.A.. Crawford.J.M.. Morris.J. and Ivarie.R.
TITLE Isolation. sequence. and characterization of the bovine myogenic
factor-encoding gene myf-5 JOURNAL Gene 127 (2). 185-191 (1993) PUBMED 7684719
FDTLKRCTTTNPNQRLPKVEILRNAIRYIESLQELLREQVENYYSLPGQSCSEPTSPT
2281 aaccccaaag caagacaacc tgtaaataaa catttctttt ctgttgtaaa tttgtaaata 2341 gttatcttgc cactttataa gaaagtgtat ttaaaaagtc attattgcaa tttatacttt 2401 ctttttttct tcttttcctt catctttgct ttagatatat agttccaatg atattatttc 2461 ttataggggc cgttcatcaa aggtagtttg ttgcaatgct taacttatat atttttataa 2521 atattgctta tcaaaatatt acctctgatg tttagtgctt ttttttcttt aaaacattag 2581 aatagatgta aatcagttat agggagtttt aaatatattt aactgtcttg cttttctctt 2641 taatcttttg atttatattg tgttaagtaa aatataacaa tactgcctaa tggtatatat 2701 tttaacattt cttataagaa atacattttt aatctaagca caaaatagta ctttgtggat 2761 gatttcaaga tataagagat ttttggaaac tccaccataa ataaaattgt ttaagtgagg 2821 aaatattctg gtttatgatt ttgttaaaag aaccccctaa tggaattggc agtcactgat 2881 atggtgtctt taaggtgggg ctgaaagtac tgaaacagtg ggttttgaag ataaatctga 2941 atagcatctc gcggactcag tttaggtcct gttggtgtca cagatgaaaa taccacattt 3001 ctacttcaag catatttcaa aggtgtctgc taactaaaat ttttctttta tcttaatgtt 3061 gtaccatata acataaagtt gtgtgtatgt ggagcaaaag tagaaggtat tcaggacaat 3121 aacagatttt taaacaaaaa gaatgtacaa tattacatca ttataatatc tatagtacat 3181 tagaaatcat gagttaaggt gatatatatc tattttccca aaaatacctt gatacattag 3241 tatattaata ttgtcaataa aatatttaaa ggtattgagt tgttttttcc tatcactaaa 3301 gtgctggcat aagaaaattt acacaatgta tagtaaagtg aagcagactc taaattactt 3361 tcttcctttt cacagccttt tttattttat taattatatt ttatgattct gtgttgtgtg 3421 tgcatgatgg acatgtacct ttttgtttat cacttaaaaa tctcctttag aaattgagat 3481 gaaaatacaa caattaagtg gaaaattagg tagtcaatca ttggaagaat tctcacaaga 3541 tttattacct ttgagagaga tgaaaaggaa atatcattga agcatctgag ttggttgttc 3601 atctctatga gcagataaag ataattgtct tctcctctaa tcggttcaaa atttctaagg 3661 gtttgcagtt acgtgtaatc atcagccaaa gcatatgagc tctgctggag tttggcagtt 3721 gtactgttct cagggaggtt tgcccttatt tttgatatgc tttttctcct gctcgtccag 3781 tcaccagagt taaaagaata gacattattc cataaagaaa aggagagaag acaggatggg 3841 ttcaaaaaat actgtagcca ctgtcactct gttagcagca tgccctgata cgggatgctg 3901 acttttagca cacagataag tctttcttta tccatgattt gataatgtga ggatttgaag 3961 tagaaagaat ccaagagggc attataaaga ttcacatata atttcaactt cagtttgagt 4021 gattcacttc tgttaaacag tgtctcttac ttctatgaag aaattggaag tttgttgttc 4081 ctagtagaac tagaaaaaaa ggaactatct aaagactttt ttttaagttc aattttaaaa 4141 cacatgacca tattgttgca ttttaaaaaa gtaagcagaa aagctatgta atttttaatt 4201 caagtgaata aaaattaatt ttactaccaa accccagttg cttgcaaatg tacttgatat 4261 tctcagttaa tataataatg cctcaaagta tttagttttt cagtgctctg gattcagtac 4321 agatggtgat caatgtatga ttaaagacaa tactttccat gatagctttg cttaattaat 4381 ctcatttcca gtggactaat ggtgaaggct ggtatctgct cagtaaacag ctcagcacaa 4441 cacacatcac atccagtcat ataaactttt tgacaggggc ctttgggagt ttgttacagt 4501 aatccagacc cagaaaaatc ttcccttctc cacaaagtag gggagaagag cagagaaaca 4561 gtgatagtga caaaatattc aagtaaggac aggattttgc catcttacaa attccttgga 4621 gtgaacaggt gggctgccac taagactaca tcacatccac ctccattggt ggaaaacatg 4681 ccactgacag tcaatttata ggaaaacaag gaaaacattc cctttcccat ttgtagtctg 4741 attgggaggg ggttctctgg aaatgagagt caaaagagat tcctttctcc ttatgcctat 4801 gaaatgcaag ttcactgggc ctacataggt acataggaaa actgagtcca gtgaggttat 4861 ggaaattggg aagtactatt tggaagcaag ctgttatata gatcaaggtg tcttgattgc 4921 tcctattttt tttttcatct gaaaaatgca agtcagataa aattattggc tctattatgg 4981 ccctaaattc ttcattaagg tggcattcct aatctgagag tggtatttcc tgaaattctc 5041 tatttgaggt tacaacagtt actagattaa tgaagtaatt caattctctg actttcagag 5101 gtggtatttc tgggaatggt attagagtac agctatttgt aacttcagaa aagccctgct 5161 caaatggcaa agtatccctg aaaatatcac cactgaatat tcccacactg tcacaaaaa
Lampiran 2 Sekuen gen Myostatin (MSTN) berdasarkan genbank AF348479.1 GenBank= AF348479.1 Bos taurus myostatin gene. partial cds
LOCUS AF348479
10492 bp DNA linear MAM 10-APR-2001
REFERENCE 1 (bases 1 to 10492)
AUTHORS Sharma.M.. Jeanplong.F.. Bass.J. and Kambadur.R.
TITLE Bovine Myostatin promoter and repressor sequence
JOURNAL Unpublished
REFERENCE 2 (bases 1 to 10492)
AUTHORS Sharma.M.. Jeanplong.F.. Bass.J. and Kambadur.R. TITLE Direct Submission
JOURNAL Submitted (11-FEB-2001) Animal Genomics. AgResearch. East Street.