i
KINERJA ANTIKOROSI
MANGAN BIS(DISETILDITIOFOSFAT) DENGAN TEKNIK
POLARISASI POTENSIODINAMIK
CHAIRULY NUR LINDASARI
DEPARTEMEM KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
iii
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi yang berjudul Kinerja Antikorosi Mangan Bis(disetilditiofosfat) dengan Teknik Polarisasi Potensiodinamik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta karya saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015 Chairuly Nur Lindasari
v
ABSTRAK
CHAIRULY NUR LINDASARI. Kinerja Antikorosi Mangan Bis(disetilditiofosfat) dengan Teknik Polarisasi Potensiodinamik. Dibimbing oleh KOMAR SUTRIAH dan MOHAMMAD KHOTIB.
Mangan bis(dialkilditiofosfat) (MDTP) merupakan senyawa yang berfungsi sebagai antikorosi, antioksidan, dan antibakteri. Fungsi yang dikaji dalam penelitian ini adalah sebagai antikorosi yang diukur dengan teknik polarisasi potensiodinamik. MDTP16 dapat disintesis dari setil alkohol, P2S5, dan MnSO4.
Rendemen Mangan bis(disetilditiofosfat) atau MDTP16 sebesar 54% (segiempat
planar). Efektivitas inhibisi korosi MDTP16 optimum pada konsentrasi 2% (b/v)
dengan suhu 33ºC, yaitu 85% dengan derajat penutupan permukaannya sebesar 0.85. Energi Gibbs keadaan transisi (ΔG*) pada MDTP16 sebesar 89 kJ mol-1 serta
energi aktivasinya sebesar 27 kJ mol-1. Kedua nilai parameter tersebut lebih tinggi dibandingkan tanpa inhibitor yang menunjukkan terjadi penurunan laju korosi. Kata kunci: inhibisi, energi aktivasi, energi Gibbs keadaan transisi , mangan
bis(disetilditiofosfat), polarisasi potensiodinamik.
ABSTRACT
CHAIRULY NUR LINDASARI. The Performance Anti-corrosion of Manganese Bis(dicetyldithiophosphate) with Potentiodynamic Polarization Technique. Supervised by KOMAR SUTRIAH and MOHAMMAD KHOTIB.
Manganese bis(dicetyldithiophosphate) is a compound having function as anti-corrosion, antioxidant, and anti-bacteria. One of the functions, anti-corrosion is a subject of the present study which was investigated using potentiodynamic polarization technique. MDTP16 was synthesized by cetyl alcohol, P2S5, and
MnSO4, The manganese bis(dicetyldithiophosphate) or MDTP16 yield was 54%
(square planar). The effectiveness of MDTP16 as corrosion inhibitor at 2% (w/v)
and temperature 33ºC was 85%. The result was supported with surface coverage of 0.85. Gibbs energy on transition state (ΔG*) of MDTP16 was 89 kJ mol-1 with
activation was 27 kJ mol-1. Both parameters values were higher than that without inhibitor that implies a decreasing corrosion rate.
vii
KINERJA ANTIKOROSI
MANGAN BIS(DISETILDITIOFOSFAT)DENGAN TEKNIK
POLARISASI POTENSIODINAMIK
CHAIRULY NUR LINDASARI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
ix
Judul Skripsi :Kinerja Antikorosi Mangan Bis(disetilditiofosfat) dengan Teknik Polarisasi Potensiodinamik
Nama : Chairuly Nur Lindasari
NIM : G44110009
Disetujui oleh
Dr Komar Sutriah, MS Pembimbing I
Mohammad Khotib, SSi MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
xi
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat, hidayah, dan karunia-Nya sehingga penelitian ini dapat diselesaikan dengan baik. Penelitian ini dilaksanakan sejak bulan Maret sampai Juli 2015. Tema yang dipilih ialah antikorosi, dengan judul Kinerja Antikorosi Mangan Bis(disetilditiofosfat)dengan Teknik Polarisasi Potensiodinamik.
Penulis mengucapkan terima kasih kepada pihak-pihak yang telah membantu dalam penelitian serta dalam menyusun skripsi ini. Terima kasih kepada Bapak Komar Sutriah dan Mohammad Khotib selaku pembimbing yang banyak memberikan arahan, Denar Zuliandanu yang telah memberi arahan dan saran. Penghargaan juga disampaikan kepada Astrid Harfera Passadana telah
membantu penelitian. Terima kasih untuk Bapak Zainal Alim Mas’ud sebagai kepala divisi penelitian di Laboratorium Terpadu untuk semua fasilitas penelitian. Terima kasih juga untuk Lestari Ainun, Bapak Yono, Bapak Samsul, Ibu Ani di Laboratorium Terpadu IPB dan Bapak Yani dari Bengkel Fisika IPB yang telah membantu dalam pengumpulan data penelitian.
Ungkapan terima kasih penulis sampaikan kepada ayah, ibu, dan seluruh keluarga atas doa dan motivasinya. Terima kasih juga disampaikan kepada mahasiswa penelitian di Laboratorium Terpadu IPB, rekan-rekan mahasiswa Laboratorium Kimia Fisik, serta teman-teman angkatan Kimia 48 atas doa dan dukungannya.
Penulis berharap skripsi ini dapat bermanfaat bagi penulis pada khususnya dan pembaca pada umumnya.
Bogor, Agustus 2015
xiii
DAFTAR ISI
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xiv
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Waktu dan Lokasi 2
METODE 2
Bahan dan Alat 2
Prosedur 2
HASIL DAN PEMBAHASAN 5
Sintesis MDTP16 5
Pencirian Produk MDTP16 6
Pengaruh Konsentrasi dan suhu pada Efektivitas Inhibisi Korosi 8
Parameter Termodinamika dan Kinetika Korosi 10
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR GAMBAR
1 Rute Sintesis MDTP16 6
2 Produk MDTP16 6
3 Spektrum FTIR hasil sintesis 7
4 Struktur hipotetik MDTP16 berbentuk (a) segiempat planar
(b) oktahedral (Khajuria 2013) 7
5 Kurva polarisasi variasi konsentrasi log i terhadap potensial 8 6 Efektivitas inhibisi MDTP16 dan CR pada variasi konsentrasi 9
7 Efektivitas inhibisi MDTP16 dan CR pada variasi suhu 10
8 Kurva hubungan antara ln (i/T) terhadap 1000/T 10 9 Nilai parameter kinetika dan termodinamika keadaan transisi 11
10 Kurva hubungan antara ln i terhadap 1000/T 11
DAFTAR LAMPIRAN
1Bagan Alir Sintesis 16
2Bobot reaktan dan perhitungan sintesis MDTP16 17
3Perbandingan kadar Mn teori dengan hasil analisis SSA 18 4Data arus korosi MDTP16suhu 26 ˚C pada perbedaan kosentrasi 19
5Data arus korosi MDTP16 2.0%dengan perbedaan suhu 21
6Data parameter kinetika dan termodinamika keadaan transisi pada
1
PENDAHULUAN
Latar Belakang
Korosi merupakan suatu prosesoksidasi yang terjadi akibat adanya transfer elektron dari logam ke lingkungan. Lingkungan tersebut bisa berupa cairan ataugas. Lingkungan tersebut dalam kimia dikenal sebagai elektrolit karena memiliki konduktivitas yang menyebabkan adanya transfer elektron (Perez 2004). Suatu logam yang mengalami korosi akan menyebabkan penurunan kualitas akibat reaksi logam dengan lingkungan sekitarnya. Permukaan suatu logam sangat rentan mengalami korosi. Korosi yang berkepanjangan dapat menimbulkan kerugian ekonomi, kerusakan infrastuktur, dan dapat membahayakan keselamatan manusia. Peristiwa korosi tidak dapat dihentikan, tetapi prosesnya dapat diperlambat. Upaya perlindungan logam dari korosi terus ditingkatkan untuk meminimumkan terjadinya korosi dengan menambahkan zat-zat antikorosi atau yang lebih dikenal dengan zat inhibitor korosi (Atmadja 2010). Inhibitor korosi umumnya berasal dari senyawa-senyawa organik dan anorganik yang mengandung gugus-gugus yang memiliki pasangan elektron bebas. Beberapa contohnya adalah nitrit, kromat, fosfat, urea, fenilalanina, imidazolina, dan senyawa-senyawa amina (Haryono et al. 2010).
Senyawa koordinasi mangan (II)ditandai sebagai pilihan untuk atom donor elektron kuat seperti oksigen dan nitrogen (Chandra & Kumar 1983). Mangantelah dipelajarisebagai sifatantikorosikarenamemiliki beberapa bilangan oksidasi, karakteristik mirip dengankromium. Logam mangan juga memiliki beberapa keunggulan dibandingkan dengan logam seng yang juga sebagai logam inhibitor, diantaranya ialah ramah lingkungan,memiliki perilaku tribologi yang baik (koefisien gesekan yang rendah, sifat mekanik yang baik), cukup reaktif, serta harganya relatif murah. Oleh karena sifat-sifatnya tersebut, maka berbagai penelitian ditujukan mempelajari kinerja logam mangan, struktur serta sifatnya ketika ditambahkan sebagai inhibitor korosi (Triastuti & Arief 2013).
Senyawa Sengbis(dialkilditiofosfat) (ZDTP) telah diketahui sebagai inhibitor korosi pada penelitian Zuliandanu (2013). Penelitian ini mengganti logam pusat Zn dengan logam Mn sehingga senyawa kompleks inhibitor korosi yang digunakan penelitian ini adalah Mangan bis(disetilditiofosfat) (MDTP16).
Sebelumnya, Khajuria et al. (2013) telah mengaplikasikan senyawa MDTP sebagai antibakteri.
Pengukuran kinerja antikorosi dari MDTP16 dilakukan menggunakan
metode polarisasi potensiodinamik dengan ekstrapolasi Tafel. Teknik elektrokimia ini banyak digunakan untuk mengukur kinerja antikorosi berdasarkan pantauan arus korosi. Parameter polarisasi yang digunakan untuk menjadi parameter pengukur kinerja antikorosi tersebut, yaitu arus korosi, potensial korosi, dan kemiringan Tafel (Zuliandanu 2013).Sintesis MDTP16 akan
2
Tujuan Penelitian
Penelitian ini bertujuan menyintesis senyawa MDTP dengan alkil setil, mengukur kinerja sebagai inhibitor korosi melalui kinetika dan termodinamika terhadap aktivitas inhibisi korosi yang akan diaplikasikan pada logam tembaga.
Waktu dan Lokasi
Penelitian ini dilaksanakan pada bulan Maret sampai Juli 2015 di Laboratorium Kimia Terpadu IPB Baranangsiang.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah P2S5 (Merck), MnSO4(Merck), setil
alkohol (Merck), n-heptana (Merck), logam Zn, CH3COOH (Merck), akuades,
NaOH 50% (b/v), NaOH pelet (Merck), HCl 37% (b/b) (Merck), HNO3 pekat
(Merck). Bahan-bahan tersebut digunakan dalam sintesis MDTP16 sedangkan
untuk uji kinerja antikorosi bahan-bahan yang digunakan adalah aseton, ampelas silikon karbida, H2SO410% (v/v), dankupon tembaga (elektrode kerja). Alat-alat
yang digunakan dalam penelitian ini adalah termometer, labu didih, penangas minyak, pengaduk magnetik, corong pisah, neraca analitik, stopwatch, potensiostat DY 2300 yang dilengkapi program DY2300EN, ChemBio office 2008, penguap putar, spektrofotometer serapan atom (SSA) Shimadzu AA-6300, dan spektrofotometer inframerah transformasi fourier (FTIR) prestige-21 Shimadzu.
Prosedur
Sintesis MDTP16
Sintesis MDTP16 mengacu pada Dinoiu et al. (2007) dan Khotib (2011)
dengan sedikit modifikasi. Sintesis ini dilakukan 2 tahapan, tahap pertama adalah pembentukan asam dialkilditiofosfat (ADTP) dan tahap kedua merupakan sintesis MDTP16. Pembentukan ADTP dibuat dengan mereaksikan P2S5 dan setil alkohol
dengan nisbah 1:4 dalam pelarut n-heptana di dalam labu didih yang telah dilengkapi pendingin balik dan disambungkan pada penangkap gas H2S yang
berupa larutan Zn-asetat dengan penambahan NaOH 50%. Sintesis ADTP dilakukan pada suhu 80-90ºC di atas penangas minyak selama 12 jam sambil diaduk. ADTP yang dihasilkan direaksikan dengan NaOH pelet dengan jumlah nisbah yang sama dengan ADTP sambil diaduk dengan waktu 6 jam, kemudian ditambahkan akuades sebanyak 5 tetes. Setelah itu ditambahkan MnSO4 sebesar
jumlah mol P2S5 dan diaduk selama 6 jam. Produk yang dihasilkan diekstraksi
3
yang terkumpul dicuci dengan air untuk menghilangkan pengotor. Fraksi organik yang diperoleh diuapkan sampai semua pelarut n-heptana menguap dan tersisa fraksi MDTP16.
Pencirian Gugus Fungsi dengan FTIR
MDTP16 hasil sintesis dicirikan dengan menggunakan FTIR untuk
menentukan gugus fungsi atau ikatan kimia pada produk. Pengukuran dilakukan dengan menggerus produk dengan KBr kemudian dibuat pelet dan diukur.
Penetapan Kadar Mn dengan SSA
Sampel MDTP16 ditimbang sebanyak 0.5 g dan ditambahkan 10 mL HNO3
pekat: akuades (1:1). Campuran didestruksi dan ditambahkan sejumlah akuades hingga larut. Larutan hasil destruksi disaring ke labu takar 100 mL lalu ditera dengan akuades. Larutan ini kemudian diukur kadar Mn-nya dengan SSA Shimadzu.
Pengukuran dengan Teknik Polarisasi Potensiodinamik
Elektrode kerja tembaga (Cu) dipreparasi dengan cara diampelas permukaannya kemudian dibilas dengan akuades dan aseton. Setelah itu, elektrode Cu dimasukkan ke dalam reservoir yang berisi larutan uji NaCl 1%.Reservoir diberikan sirkulasi air pada dindingnya untuk memelihara kestabilan suhu.Elektrode Ag/AgCl dan kawat Pt berturut-turut dipasang sebagai elektrode pembanding dan elektrode pembantu.Kabel warna hitam, putih, dan merah dari potensiostat DY2300 berturut-turut disambungkan pada elektrode kerja, pembanding, dan pembantu.Larutan uji dibiarkan mencapai kesetimbangan dengan elektrode sekitar 5 menit.Setelah itu, program DY2300EN pada perangkat komputer dinyalakan dan dipilih teknik linear sweep voltammetripada kotak dialog. Pengukuran logam Cu tanpa MDTP16 (blangko) dilakukan pada rentang
potensial -100 sampai 200 mV dengan scan rate 1 mV/s. Setelah pengukuran blangko selesai, elektrode Cu dibersihkankembali dengan cara direndam dalam H2SO4 10% kemudian diampelas dengan ampelas silikon karbida dan dicuci
kembalidengan akuades. Setelah itu, elektroda dicuci kembali menggunakan aseton. Elektrode Cu yang telah dibersihkan kemudian dicelupkan ke dalam larutan MDTP16 dengan konsentrasi 0.5%, 1%, dan 2% selama 15 detik dan
ditiriskan beberapa saat. Elektrode kerja kemudian dirangkaikan kembali pada reservoir dan dilakukan lagi pengondisian selama 2 menit yang sama dengan blangko. Setelah pengondisian selesai, sampel diukur pada rentang potensial.Data yang didapatkan kemudian diproses menggunakan perangkat lunak DY2300EN Potensiostat dan Microsoft Excel sehingga didapat kurva polarisasi.Dari kurva tersebut, diperoleh informasi berupa potensial korosi (V korosi), arus korosi (i korosi). Efektivitas inhibitor dihitung sesuai persamaan berikut :
4
Derajat penutupan permukaan dapat dihitung dengan menggunakan persamaan berikut :
(2) (Morad& El-Dean 2006)
Parameter Termodinamika dan Kinetika pada Proses Korosi
Parameter termodinamika ditentukan berdasarkan persamaan Arrhenius keadaan transisi:
(3) Pengukuran dilakukan pada suhu 33, 37, dan 43ºC. Parameter ΔH* dan ΔS* berturut-turut merupakan perubahan entalpi dan entropi keadaan transisi, sedangkan NAh adalah tetapan Planck Molar (3.99 × 10-10 JSmol-1). Dengan
memvariasikan suhu (T), maka ΔH* dan ΔS*dapat ditentukan dari kurva ln (i korosi/T)vs 1000/T, sedangkan perubahan energy bebas Gibbs transisi (ΔG*) dihitung dengan persamaan berikut:
(4) `Parameter kinetika ditentukan melalui pengukuran energi aktivasi atau biasa dikenal sebagai energi pengaktifan merupakan energi minimum yang dibutuhkan untuk suatu reaksi dapat berjalan.
(5)
(6)
DenganA merupakan tetapan Arrhenius yang ditentukan secara empirik, Ea adalah
energi aktivasi proses korosi (kJ mol-1), R adalah tetapan gas ideal (8.314 J mol
-1
5
HASIL DAN PEMBAHASAN
S intesis MDTP16
Sintesis Mangan bis(disetilditiofosfat) dilakukan memalui 2 tahap yaitu tahap pembentukan ADTP kemudian baru dihasilkan MDTP16. Sintesis tahap
pertama dilakukan dengan mencampurkan setil alkohol dengan P2S5, P2S5yang
direaksikan harus dibuat berlebih agar alkohol habis terpakai. Jika terdapat alkohol yang tersisa pada tahap 1 akan berpengaruh pada nilai rendemen, karena dapat terjadi persaingan adisi pada tahap 2 antara alkohol sisa dan ADTP terhadap MnSO4 (Zuliandanu 2013). Di samping itu, unsur Fosfor (P) memliki peranan
penting sebagai antikorosi. Konsentrasi P yang tinggi dapat meningkatkan peluang terbentuknya MDTP16 yang akan dihasilkan (Dinoiu et al2007). Sintesis
tahap 1 dilakukan secara tertutup dan menggunakan pemanasan.Kondisi tertutup untuk mencegah terjadinya oksidasi pada ADTP yang dihasilkan (Hayati 2013).Pemanasan dilakukan untuk menghilangkan hasil samping H2S yang dapat
mengganggu jalan reaksi. Namun, apabila suhu terlalu tinggi maka produk ADTP akan terdekomposisi dan rendemen yang dihasilkan akan rendah (Rismawati 2013).
Sintesis ADTP dilakukan dengan merefluks P2S5dengan setil alkohol
menggunakan pelarut n-heptana pada suhu 80-90ºC selama 12 jam. Pelarut n-heptana bersifat nonpolar sehingga dapat mereaksikan dengan baik P2S5 dengan
setil alkohol yang bersifat nonpolar. Suhu sintesis ADTP 80-90ºC karena butuh energi yang lebih besar untuk mereaksikan P2S5dengan alkil setil yang merupakan
alkil meruah.Tahap selanjutnya ADTP yang terbentuk direaksikan dengan NaOH selama 6 jam.Penambahan NaOH ini bertujuan meningkatkan reaktivitas atom sulfur pada ADTP dan mengikat SO42-pada MnSO4sehingga adisi Mn lebih
mudah (Khotib 2011). Hasil dari reaksi tersebut berupagaram NaDTP kemudianlangsung direaksikan dengan MnSO4selama 6 jam, jika garam NaDTP
tidak langsung diadisi dengan Mn maka dialkilditiofofat akan teroksidasi sehingga akan terbentuk dimer dialkilditiofosfatyang menyebabkan tahap adisi Mn menjadisulit terjadi (Jaenudin 1998 & Rudnick 2009).MDTP16disintesis sebanyak
dua kali ulangan, namun pada ulangan 2 kadar Mn yang dihasilkan rendah sehingga penelitian ini menggunakan data pada ulangan 1.
Rendemensintesis MDTP16 diperoleh sebesar 54.45% (segiempat planar)
dan perhitungan dapat dilihat pada Lampiran 2.Rendahnya rendemen disebabkan 4 hal yaitu Mn berasal dari MnSO4, SO42- merupakan gugus pergi yang buruk
sehingga mempersulit adisi Mn pada ADTP, alkil setil merupakan alkil yang meruah sehingga keberadaannya dapat menghalangi proses adisi Mn pada ADTP, waktu reaksi tahap 2 antara NaDTP dan MnSO4 kurang panjang sehingga
MDTP16belum semua terbentuk, dan suhu reaksi belum mencapai suhu optimum
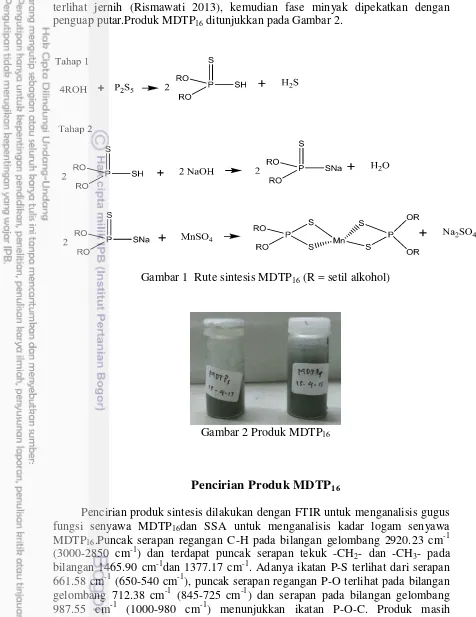
sehingga ADTP belum semuanya terbentuk.Waktu sintesis yang digunakan pada tahap kedua adalah 12 jam agar reaksi berjalan sempurna dan rendemen yang diperoleh besar (Rismawati 2013). Rute sintesis(Dinoiu et al. 2007 & Khotib 2011) ditunjukkan pada gambar 1.
Pemisahan produk sintesis dilakukan dengan teknik ekstraksi cair-cair untuk menghilangkan zat pengotor seperti P2S5, sisa setil alkohol tahap 1,dan
6
fase yaitu fase air, minyak, dan padatan.Pencucian dilakukan hingga fase air terlihat jernih (Rismawati 2013), kemudian fase minyak dipekatkan dengan penguap putar.Produk MDTP16 ditunjukkan pada Gambar 2.
Gambar 1 Rute sintesis MDTP16 (R = setil alkohol)
Gambar 2 Produk MDTP16
Pencirian Produk MDTP16
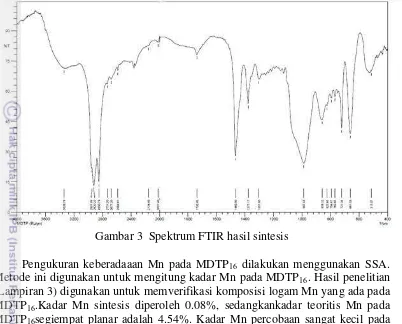
Pencirian produk sintesis dilakukan dengan FTIR untuk menganalisis gugus fungsi senyawa MDTP16dan SSA untuk menganalisis kadar logam senyawa
MDTP16.Puncak serapan regangan C-H pada bilangan gelombang 2920.23 cm-1
(3000-2850 cm-1) dan terdapat puncak serapan tekuk -CH2- dan -CH3- pada
7
pengukuran FTIR menyatakan gugus disetilditiofofat telah terbentuk namun masih ada setil alkohol yang tersisa dari reaksi tahap 1(Gambar 3).
Gambar 3 Spektrum FTIR hasil sintesis
Pengukuran keberadaaan Mn pada MDTP16 dilakukan menggunakan SSA.
Metode ini digunakan untuk mengitung kadar Mn pada MDTP16. Hasil penelitian
(Lampiran 3) digunakan untuk memverifikasi komposisi logam Mn yang ada pada MDTP16.Kadar Mn sintesis diperoleh 0.08%, sedangkankadar teoritis Mn pada
MDTP16segiempat planar adalah 4.54%. Kadar Mn percobaan sangat kecil pada
MDTP16 segiempat planar sehingga mengacu pada Khajuria et al.(2013), senyawa
MDTP16 dapat berbentuk oktahedraldan kadar teoritis Mn pada
MDTP16oktahedral (Gambar 4) adalah 3.08%.Kadar Mn sintesis sangat kecil
karena masih ada pengotor setil alkohol yang menghalangi reaksi adisi Mn pada NaDTP. Di samping itu senyawa disetilditiofosfat mudah teroksidasi menjadi dimer disetilditiofosfat.
(a)
(b)
Gambar 4 Struktur hipotetik MDTP16 berbentuk (a) segiempat planar (b)
8
Pengaruh Konsentrasi dan suhu pada Efektivitas Inhibisi Korosi
Pengujian inhibisi korosi menggunakan teknik polarisasi potensiodinamik dengan metode Tafel untuk melihat ketahanan dari logam yang ditambahkan MDTP16 terhadap reaksi oksidasi ketika diberi potensial dari luar.Adanya ion
klorida menyebabkan lingkungan korosi meningkat.Ion klorida dapat merusak lapisan oksida logam. Produk MDTP16 sebagai inhibitor akan mengurangi
kemungkinan permukaan logam kontak langsung dengan lingkungan. Proses pengendalian ini dapat memperlambat kecepatan korosi karena inhibitor secara kimia berinteraksi dengan permukaan logam untuk memberi tingkat perlindungan tertentu terhadap logam (Djatmiko & Budiarto 2009).
Elektoda Cu dicelupkan pada reservoir NaCl 1% yang dialiri arus listrik sehingga logam Cu akan teroksidasi menjadi Cu2+atau logam Cu terkorosi, namun saat ditambahkan MDTP16, proses oksidasi logam Cu dapat dihambat. Inhibitor
korosi MDTP16adalah inhibitor katodik karena MDTP16membentuk lapisan yang
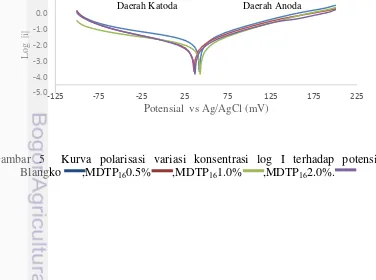
tak larutpada area katodesehingga menyebabkanterjadinya penutupan permukaan logam. Inhibitor katodik mempengaruhi potensial reaksi menjadi lebih kecil dibandingkan blangko (Dariva& Galio 2014). Gambar 5 adalah kurva polarisasi MDTP16pada variasi konsentrasi menunjukkan potensial MDTP16konsentrasi
0.5%, 0.1%, dan 2.0% lebih kecil dibandingkan potensial blangko.
Arus korosi dan potensial korosi ditentukan berdasarkan polarisasi potensiodinamik, dan pengukuran ditentukan dengan metode Tafel. Arus korosi blangko dan inhibitor dengan berbagai konsentrasi tercantumpada Lampiran 5.Arus korosi logam yang dilapisi menggunakan inhibitor lebih kecil dari padaarus korosi blangko. Semakin tinggi konsentasi inhibitor, arus korosinya semakin kecil juga (Gambar 5).Semakin kecil arus korosi menyebabkan efektivitas inhibisi MDTP16 semakin besar.Hal ini disebabkan semakin banyaknya
molekul MDTP16 yang melindungi permukaan logam pada konsentrasi inhibitor
tinggi. Peningkatan permukaan logam yang terlindungi ini menyebabkan difusi ion-ion dan elektron yang terlepas dari permukaan logam akan sulit terlepas sehingga arus yang dihasilkan kecil dan laju korosi akan berkurang (Djatmikom & Budiarto 2009).
9
Dalam suatu reaksi, konsentrasi dan orde reaksi tidak peka terhadap perubahan suhu, melainkan konstanta laju yang peka terhadap perubahan suhu (Atkins 1997), sedangkan dalam kinetika elektrokimia korosi, arus korosi peka terhadap terhadap perubahan suhu (Rafiquee et al. 2008).Kenaikan suhu dapat membuat efektivitas inhibisi semakin menurun dan arus korosi logam semakin meningkat (Lampiran 5). Kenaikan suhu dapat menyebabkan ion-ion Cl-akan menyerang lapisan logam yang mengakibatkan arus korosi pada anode dan katode semakin besar. MDTP16 tidak mampu lagi membentuk lapisan pada permukaan
logam seperti pada suhu kamar karena cenderung menurunkan kekuatan interaksi antara logam dengan MDTP16 sehingga kemampuan inhibisi korosi MDTP16
menurun (Ketis et al. 2010). Menurut Ebenso et al.(2008) mekanisme fisisorpsi ditunjukkan oleh adanya penurunan %EI dengan kenaikan suhu sedangkan untuk mekanisme kimisorpsi, nilai %EI meningkat dengan kenaikan suhu maka dari itu reaksi adsorpsi MDTP16 pada logam secara fisiorpsi. Laju korosi dapat
didefinisikan sebagai hilangnya massa atau bobot material atau logam dalam satuan waktu yang diakibatkan oleh penyerangan substituen korosif terhadap material. Pada umumnya, satuan laju korosi adalah mm per tahun (Iga & Ik 2007). Laju korosi MDTP16 terendah pada konsentrasi 2% suhu 33˚C yaitu 0.2742
mmpy. Gambar 6 menunjukkan efektivitas inhibisi MDTP16 dan laju korosi pada
variasi konsentrasi sedangkan Gambar 7 menunjukkan efektivitas inhibisi MDTP16dan laju korosi pada variasi suhu.
Adsorpsi MDTP16 pada permukaan logam juga merupakan faktor penting
dalam proses inhibisi korosi yang dapat diketahui dengan derajat penutupan
permukaan (Ɵ). Derajat penutupan permukaan dapat dievaluasi dari menggunakan
nilai efektivitas inhibitor korosi.Derajat penutupan permukaan meningkat dengan meningkatnya efektivitas inhibisi korosi (Sumijanto 2006).Derajat penutupan permukaan tertinggi MDTP16pada konsentrasi 2% dan suhu 33˚C yaitu 0.85.
10
Gambar 7 Efektivitas inhibisi MDTP16 dan CRpada variasi suhu. %EI( ), CR( ).
Parameter Termodinamika dan Kinetika Korosi
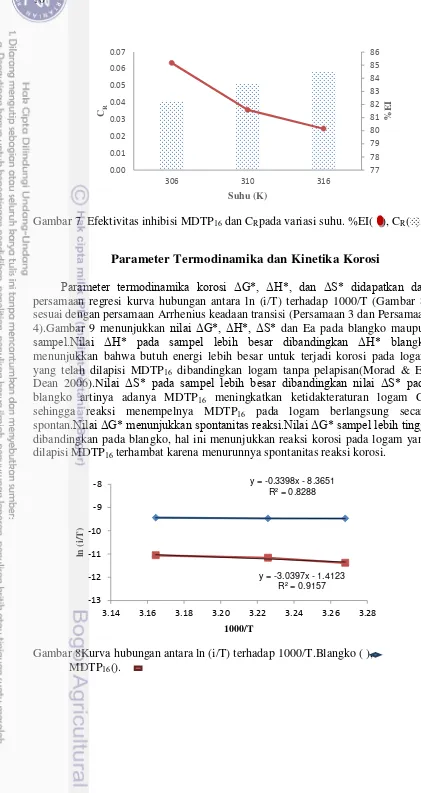
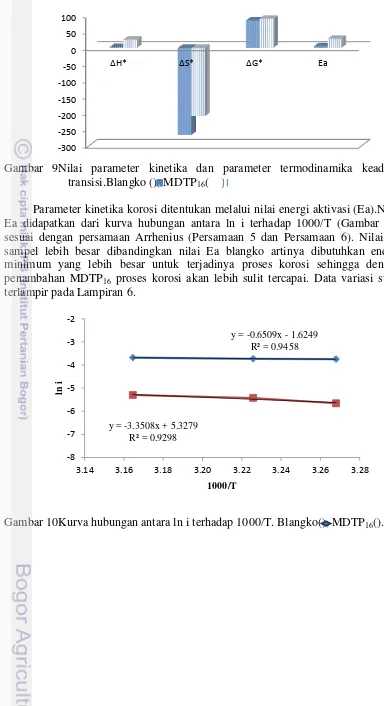
Parameter termodinamika korosi ΔG*, ΔH*, dan ΔS* didapatkan dari
persamaan regresi kurva hubungan antara ln (i/T) terhadap 1000/T (Gambar 8) sesuai dengan persamaan Arrhenius keadaan transisi (Persamaan 3 dan Persamaan 4).Gambar 9 menunjukkan nilai ΔG*, ΔH*, ΔS* dan Ea pada blangko maupun
sampel.Nilai ΔH* pada sampel lebih besar dibandingkan ΔH* blangko menunjukkan bahwa butuh energi lebih besar untuk terjadi korosi pada logam yang telah dilapisi MDTP16 dibandingkan logam tanpa pelapisan(Morad &
El-Dean 2006).Nilai ΔS* pada sampel lebih besar dibandingkan nilai ΔS* pada blangko artinya adanya MDTP16 meningkatkan ketidakteraturan logam Cu
sehingga reaksi menempelnya MDTP16 pada logam berlangsung secara
spontan.Nilai ΔG* menunjukkan spontanitas reaksi.Nilai ΔG* sampel lebih tinggi dibandingkan pada blangko, hal ini menunjukkan reaksi korosi pada logam yang dilapisi MDTP16 terhambat karena menurunnya spontanitas reaksi korosi.
Gambar 8Kurva hubungan antara ln (i/T) terhadap 1000/T.Blangko ( ), MDTP16().
3.14 3.16 3.18 3.20 3.22 3.24 3.26 3.28
ln (
i/T
)
11
Gambar 9Nilai parameter kinetika dan parameter termodinamika keadaan transisi.Blangko (), MDTP16( ).
Parameter kinetika korosi ditentukan melalui nilai energi aktivasi (Ea).Nilai Ea didapatkan dari kurva hubungan antara ln i terhadap 1000/T (Gambar 10) sesuai dengan persamaan Arrhenius (Persamaan 5 dan Persamaan 6). Nilai Ea sampel lebih besar dibandingkan nilai Ea blangko artinya dibutuhkan energi minimum yang lebih besar untuk terjadinya proses korosi sehingga dengan penambahan MDTP16 proses korosi akan lebih sulit tercapai. Data variasi suhu
terlampir pada Lampiran 6.
Gambar 10Kurva hubungan antara ln i terhadap 1000/T. Blangko(), MDTP16().
-300 -250 -200 -150 -100 -50 0 50 100
ΔH* ΔS* ΔG* Ea
y = -0.6509x - 1.6249 R² = 0.9458
y = -3.3508x + 5.3279 R² = 0.9298
-8 -7 -6 -5 -4 -3 -2
3.14 3.16 3.18 3.20 3.22 3.24 3.26 3.28
ln
i
12
SIMPULAN DAN SARAN
Simpulan
Sintesis MDTP16 pada medium n-heptana telah berhasil dilakukan dengan
rendemen sebesar 54.45% (segiempat planar) dengan komposisi Mn yang kecil.MDTP16 telah terbukti dapat menjadi antikorosi dengan menurunkan arus
korosi logam Cu. Efektivitas inhibisi korosi semakin meningkat seiring meningkatnya konsentrasi dan %EI menurun seiring meningkatnya suhu. Efektivitas inhibitor tertinggi pada konsentrasi 2% pada suhu 33ºC, yaitu 85.17% dengan derajat penutupan permukaan 0.85.Akivitas antikorosi MDTP16 mampu
menaikkan nilai parameter termodinamika keadaan transisi(ΔG*, ΔH*, dan ∆S*) dan parameter kinetika (Ea) sehingga reaksi korosi logam dapat dihambat.
Saran
Penelitian lebih lanjut mengenai suhu optimum reaksi, reaktan Mn yang lebih reaktif, pengondisian atmosfer inert ketika menyintesis mangan bis(disetilditiofosfat) agar mendapatkan rendemen MDTP16 dengan komposisi Mn
yang tinggi, dan perlu diuji dengan XRD agar struktur MDTP16 yang terbentuk
dalam sintesis diketahui.
DAFTAR PUSTAKA
Atkins PW. 1997. Kimia Fisika Jilid 2 Edisi Keempat. Irma I Kartohadiprodjo, penerjemah. Jakarta (ID): Erlangga. Terjemahan dari: Physical Chemistry. Atmadja ST. 2010. Pengendalian korosi pada sistem pendingin menggunakan
penambahan zat inhibitor. Rotasi. 12(2):7-13.
Chandra and Kumar Y. 1983.Manganese (II) Complexes of Some Nitogen-Oxygen and Nitrogen-Sulphur Donor Ligand.Proceedings of The Indian Academy of Sciences. 92(3):9847-9858.
Dariva CG dan Galio AF. 2014. Corrision inhibitor-principles, mechanisms and application. Licensee InTech.http://dx.doi.org/10.5772/57255
Dinoiu V, Danilian F, Bogatu L. 2007. The influence of synthesis method of zinc
dialkyldithiophosphates on the process of additivation. Rev Chim (Bucureoti).
58(2):183-185.
DjatmikoE, Budiarto. 2009. Analisis laju korosi dengan metode polarisasi dan potensiodinamik bahan baja SS 3041. Seminar Nasional ke-15 Teknologi dan Keselamatan PLTN serta fasilitas Nuklir; 2009 Oktober 17; Surakarta, Indonesia. Surakarta (ID): Universitas Pancasila. Hlm 182-194.
Ebenso EE, Eddy NO, Odiongenyi AO. 2008. Corrosion inhibitive properties and
adsorption behavior of ethanol extract of Piper guinensis as green corrosion
13
Haryono G et al. 2010. Ekstrak bahan alam sebagai inhibitor korosi. Pengembangan Teknologi Kimia untuk Pengolahan Sumber Daya Alam
Indonesia. Seminar Nasional Teknik Kimia “Kejuangan”; 2010 Januari 26; Yogyakarta, Indonesia. Yogyakarta (ID): UPN Veteran Yogyakarta. hlm 1-6. Hayati IK. 2013. Pengaruh pelarut terhadap rendemen hasil sintesis seng
dialkilditiofosfat (ZDTP) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Jaenudin.1998. Pembuatan Zn-diisobutilditiofosfat dan penggunaannya sebagai aditif minyak lumas otomotif.[Tesis]. Depok (ID): Universitas Indonesia. Iga KS, Ik S. 2007. Prediksi laju korosi dengan perubahan besar derajat deformasi
plastis dan media pengorosi pada material baja karbon. J Ilmiah Teknik Mesin Cakram. 1(1):1-8.
Ketis NK et al. 2010. Efektifitas asam glutamat sebagai inhibitor korosi pada baja karbon dalam larutan NaCl 1%. J. Matematika dan Sains. 15(1):1-8.
Khotib M. 2011. Density Functional Theory dalam Sintesis, Karakterisasi, dan
Prediksi Aplikasi. Kasus: Senyawa Zn-Dialkylditiokarbamat Rantai Panjang [thesis]. Bogor (ID): Institut Pertanian Bogor.
Khajuria R, Atiya S, Sandeep K, and Sushil KP. 2013. Spectroscopic, thermal, and antimicrobial studie of mononuclear manganese (II) ditolyldithiophosphates. Bioinorganic Chemistry and Applications. http://dx.doi.org/10.1155/2013/261731
Morad MS, El-Dean AMK. 2006. 2,2’-Dithiobis(3-cyano-4,6-dimethylpyridine): A new class of acid corrosion inhibitors for mild steel. Corr Sci. 48(11):3398-3412.
Pavia DL, Lapman GM, Kriz GS, Vyvyan JR. 2001.Introduction to Spectroscopy Ed ke-4. Washington (US): Thomson Learning.
Perez N. 2004. Electrochemistry and Corrosion Science. Boston (USA): Kluwer Academic Publishers.
Rafiquee MZA, SaxenaN, Khan S, Quraishi MA. 2008. Influence for Surfactants on the corrosion inhibition behavior of 2-aminophenyl-5-mercapto-1-oxa-3,4-diazole (AMOD) on mild steel. M Chem anh Phys. 107(2-3):528-533.
Rismawati. 2013. Pengaruh jenis alkohol pada rendemen sintesis zink dialkilditiofosfat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rudnick LR. 2009. Lubricant Additives Chemistry and applications Ed ke-2. Prancis: CRC Pr.
Sumijanto. 2006. Analisis efektivitas hidrazin sebaga alternatif inhibitor korosi pada system pendingin sekunder RSG-GASS. ISSN 0216-3128.96-102.
Triastuti WE dan Arief S. 2013. Karakteristik fisik dan korosi mangan hasil pelapisan pada baja AISI 1020. KAPAL. 9(1): 1-7.
15
16
Lampiran 1 Bagan alir sintesis
Setil Alkohol P2S5 NaOH MnSO4
Analisis kadar logam Mn dengan SSA Karakterisasi
dengan FTIR
Kinerja antikorosi (Potensiostat DY2300) Pencirian
produk MDTP16
1. Pemisahan 2. Pencucian CRUDE PRODUK
MDTP16
1 2 2
17
Lampiran 2 Bobot reaktan dan perhitungan sintesis MDTP16 Sampel
Bobot reaktan yang ditimbang (g) Bobot MDTP16
(g)
Rendemen Segiempat Planar (%)
Rendemen Oktahedral
(%) P2S5 Setil alkohol MnSO4
1 8.0045 34.9128 5.44 23.7362 54.45 36.81 2 4.0050 17.4500 2.77 12.9678 59.42 40.23
Contoh perhitungan :
Mol setil alkohol (pereaksi pembatas) = =
= 0.1443 mol Mol MDTP16 =
= = 0.03641 mol
Bobot MDTP16 teoritis =
= 0.0361 g 1209 g/mol = 43.6449 g
% Rendemen (segiempat planar) =
=
=
54.45 %% Rendemen (segiempat planar) =
18
19
Lampiran 4 Data arus korosiMDTP16suhu 26˚C pada perbedaan kosentrasi Konsentrasi
Persamaan garis tafel anoda y = 59.828x + 161.15 Persamaan garis tafel katoda y = -114.73x – 196.73 Arus korosi merupakan persamaan y1=y2
59.828x + 161.15 = -114.73x – 196.73 x = 0.0089
Keterangan : Anoda, Katoda Potensial Korosi
y1 = 59.828x + 161.1
21
Lampiran 5 Data arus korosi MDTP16 2.0% dengan perbedaan suhu Suhu
Larutan Arus korosi CR V EI (%) Ɵ
(ᵒC) (mA) (mmpy) (mV)
33 Blangko 0.0236 0.2742 47.9 85.17 0.85 MDTP16 2.0 % 0.0035 0.0407 28.0
37 Blangko 0.0239 0.2777 34.4 81.59 0.82 MDTP16 2.0 % 0.0044 0.0511 -15.9
22
Lampiran6Data parameter kinetika dan termodinamika keadaan transisi pada variasi suhu
Larutan Suhu
(K) 1000/T i (mA) ln i i/T ln (i/T)
Blangko
306 3.27 0.0236 -3.7465 0.0000771 -9.4701 310 3.23 0.0239 -3.7339 0.0000771 -9.4704 316 3.16 0.0252 -3.6809 0.0000797 -9.4367
MDTP16 2%
306 3.27 0.0035 -5.6550 0.0000114 -11.3786 310 3.23 0.0044 -5.4262 0.0000142 -11.1627 316 3.16 0.0050 -5.2983 0.0000158 -11.0541
Larutan ΔH* (kJmol-1) ΔS* (Jmol-1K-1) ΔG* (kJmol-1) Ea (kJmol-1)
Blangko 2.8251 -267.0881 84.5541 5.4116 Sampel 25.2721 -209.2825 89.3125 27.8586
Contoh Perhitungan pada sampel :
Diketahui persamaan garis ln (i/T) terhadap 1000/T adalah y = -0,3398x - 8,3651 ΔH* = a x R
= 0.3398 x 8.314 kJmol-1 = 2.8251 kJ mol-1
ΔS* = (
)
=
)
= -267,0881 kJmol-1 ΔG* = ∆H* - T∆S*/1000
= 2.8251 kJ mol-1 –81.7290 kJ mol-1 = 84.5542 kJ mol-1
Diketahui persamaan garis ln i terhadap 1000/T adalah y = -0,6509x - 1,6249 Ea = a x R
23
RIWAYAT HIDUP
Penulis dilahirkan di Sumenep pada tanggal 21 Mei 1993 sebagai putri pertama dari tiga bersaudara pasangan Nurul Hidayat dan Syari Yuliati. Tahun 2011 penulis lulus dari SMA Negeri 1 Sumenep dan pada tahun yang sama penulis diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) Undangan.