EKSPLORASI POTENSI DAUN, KULIT BATANG, DAN
KULIT RANTING
Rhizophora mucronata
(Lamarck)
SEBAGAI
BAHAN ANTIDIARE
YULIYANA MUBAROKAH
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Eksplorasi Potensi Daun, Kulit Batang, dan Kulit Ranting Rhizophora mucronata (Lamarck) sebagai BahanAntidiare adalah benar karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada Perguruan Tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
YULIYANA MUBAROKAH. Eksplorasi Potensi Daun, Kulit Batang, dan Kulit Ranting Rhizophora mucronata (Lamarck) sebagai Bahan Antidiare. Dibimbing oleh NEVIATY PUTRI ZAMANI dan EDY DJAUHARI PURWAKUSUMAH.
Rhizophora mucronata adalah salah satu tumbuhan yang mempunyai potensi sebagai obat antidiare yang dapat dikonsumsi oleh masyarakat pesisir. Penelitian ini bertujuan menentukan aktivitas antibakteri daun warna hijau muda (DM), daun warna hijau tua (DT), kulit batang (KB), dan kulit ranting (KR) mangrove jenis Rhizophora mucronata berdasarkan terhadap bakteri penyebab diare (Entheropathogenic Escheria coli dan Staphylococcus aureus). Sampel diektraksi dengan metode maserasi dan refluks serta dilakukan uji fitokimia. Metode difusi digunakan untuk menguji aktivitas antibakteri dan metode Fiolin-Ciocalteu dengan standar asam galat digunakan untuk penentuan kuantitatif total fenol. Ekstrak kulit ranting memiliki total fenol tertinggi sebesar 44.0204 mgg-1 dan dihasilkan aktivitas antibakteri yang tinggi terhadap bakteri EPEC dan S. aureus.
Kata kunci: antibakteri, daun, kulit batang, Rhizophora mucronata, kulit ranting.
ABSTRACT
YULIYANA MUBAROKAH. Exploration of the potency of Rhizophora mucronata (Lamarck) leaf, bark, and skin twigs as antidiarrheal agents. Supervised by NEVIATY PUTRI ZAMANI and EDY DJAUHARI PURWAKUSUMAH.
Rhizophora mucronata is one of plants with medicanal potency for diarrheal, consumed by coastal communities, This research aimed to evaluate the activity of antibacterial potential from Rhizophora mucronata young green leaf (DT), dark green leaf (DM), bark (KB) and skin twigs (KR) against bacteria which causes diarrhea (Entheropathogenic Escheria coli dan Staphylococcus aureus) and correlation by the quantity of total phenols. Samples were extracted by maceration method and reflux and phytochemical test. Diffusion methods used to investigate the activity of antibacteria and Fiolin-Ciocalteu methods with gallic acid standard used to measure the quantity of total phenols. The extract of skin twigs has the highest total phenols of 44.0204 mgg-1and has the highest activity of antibacteria against EPEC and S. aureus bacteria.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan
pada
Departemen Ilmu dan Teknologi Kelautan
EKPLORASI POTENSI DAUN, KULIT BATANG, DAN KULIT
RANTING
Rhizophora mucronata
(Lamarck) SEBAGAI BAHAN
ANTIDIARE
YULIYANA MUBAROKAH
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Eksplorasi Potensi Daun, Kulit Batang, dan Kulit Ranting Rhizophora mucronata (Lamarck)sebagai Bahan Antidiare Nama : Yuliyana Mubarokah
NIM : C54100053
Disetujui oleh
Dr Ir Neviaty P Zamani, MSc Pembimbing I
Drs Edy Djauhari P, MSi Pembimbing II
Diketahui oleh
Dr Ir I Wayan Nurjaya, MSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Tema yang dipilih dalam penelitian dan waktu dilaksanakan pada bulan Maret hingga bulan Mei 2014 ini ialah Etno Botani Kelautan, dengan judul Eksplorasi Potensi Daun , Kulit Batang, dan Kulit Ranting Rhizophora mucronata (Lamarck) sebagai Bahan Antidiare.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Neviaty P Zamani, M.Sc dan Bapak Drs Edy Djauhari P, M.Si selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Bapak Dr Ir I Wayan Nurjaya, MSc selaku ketua departemen, Bapak Dr Ir Henry M Manik, ST selaku ketua komisi pendidikan dan seluruh staf Departemen Ilmu dan Teknologi Kelautan. Ungkapan terima kasih juga disampaikan kepada orang tua, seluruh keluarga, serta teman-teman, atas segala doa dan kasih sayangnya.
Semoga usulan skripsi ini bermanfaat.
v
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2 Lokasi dan Waktu Penelitian 2
Deskripsi Sampel 3
Alat dan Bahan 3
Tahapan Penelitian 3
Pengambilan Sampel di Lapang 3
Penentuan Kadar Air 3
Proses Ekstraksi 4
Rendemen Ekstrak 4
Kandungan Fitokimia 4
Kuantitatif Total Fenol 5
Kultur dan Pengenceran Bakteri 5
Uji Aktivitas Antibakteri 5
Minimum Inhibitor Consentration 6
Analisis Data 6
HASIL DAN PEMBAHASAN 7 Kadar Air Simplisia 7
Rendemen Ekstrak 7
Kandungan Fitokimia 8
DAFTAR ISI (lanjutan)
Aktivitas Antibakteri 9
Minimum Inhibitor Consentration (MIC) 13
SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 14
LAMPIRAN 17
vii
DAFTAR TABEL
1 Kadar air sampel segar dan simplisia 7
2 Persentase rendemen terkoreksi dan tidak terkoreksi 8 3 Hasil uji fitokimia 8
2 Hasil uji aktivitas antibakteri empat sampel ekstrak Rhizophora mucronata dengan konsentrasi berbeda terhadap bakteri S. aureus 10
3 Hasil uji aktivitas antibakteri empat sampel ekstrak Rhizophora mucronata dengan konsentrasi berbeda terhadap bakteri EPEC 11
DAFTAR LAMPIRAN
1 Dokumentasi keempat sampel yang digunakan dalam penelitian 17 2 Dokumentasi hasil uji fitokimia 173 Grafik standar asam galat dalam uji kuantitatif total fenol 18
4 Dokumentasi hasil uji aktivitas zona hambat bakteri S.aureus 19
5 Dokumentasi hasil uji aktivitas zona hambat bakteri EPEC 20
6 Hasil analisis statistika data diameter zona hambat bakeri S.aureus terhadap empat ekstrak dengan beberapa konsentrasi 21
7 Hasil analisis Uji Tukey data diameter zona hambat bakeri S.aureus terhadap beberapa konsentrasi ekstrak 21
8 Hasil analisis Uji Tukey data diameter zona hambat bakeri S.aureus terhadap daunberwarna hijau muda, daun berwarna hijau tua, kulit batang tua, dan kulit ranting. 21
DAFTAR LAMPIRAN (lanjutan)
10 Hasil analisis Uji Tukey data diameter zona hambat bakeri
S.aureus terhadap beberapa konsentrasi ekstrak 22 11 Hasil analisis Uji Tukey data diameter zona hambat bakeri
EPEC terhadap daun muda berwarna hijau muda, daun berwarna
PENDAHULUAN
Latar Belakang
Mangrove adalah salah satu tumbuhan yang mempunyai banyak manfaat yang bersinggungan langsung dengan kehidupan manusia, mulai dari manfaat ekologi sampai sebagai sumber obat. Mangrove mempunyai potensi yang besar sebagai obat-obatan alami yang dapat dikonsumsi oleh masyarakat pesisir. Mangrove mengandung komponan bioaktif, seperti saponin, flavonoid dan tannin yang dapat dijadikan sebagai bahan baku obat (Sahoo et al. 2012). Beberapa jenis mangrove dapat berkhasiat sebagai obat diare, asma, rematik, antiseptik, dan hepatitis (Rameshkumar dan Ramakritinan 2013)
Penyakit diare merupakan salah satu masalah kesehatan masyarakat Indonesia. Sensus penderita penyakit diare yang dilakukan oleh Departemen Kesehatan dari tahun 2000 s/d 2010 kepada 1000 orang penduduk pada setiap tahunnya mengalami peningkatan (Kementerian Kesehatan RI 2011). Penyakit ini disebabkan oleh organisme renik seperti virus dan bakteri. Bakteri patogen seperti Entheropathogenic Escheria coli (EPEC), Bacillus cereus, Vibrio cholerae, Shigella sp., Salmonela sp., dan Staphylococcus aureus merupakan beberapa bakteri pemicu penyakit diare (Zein et al. 2004).
Masyarakat di sekitar Teluk Bintuni, Papua telah memanfaatkan mangrove khususnya jenis Rhizophora mucronata sebagai obat diare yang dikonsumsi dengan cara meminum air rebusan kulit batang pohon tersebut (Onrizal et al. 2003). Adanya pemanfaatan mangrove sebagai antidiare ini membuat para ilmuan melakuan penelitian mengenai komponen bioaktif dan uji antibakteri. Puspitasari et al. (2012) membuktikan bahwa daun Rhizophora mucronata sebagai antidiare seta memiliki komponen bioaktif, seperti tanin, saponin, dan flavonoid. Nurdiani et al. (2012) pun melakukan penelitian mengenai komponen bioaktif dan aktivitas antibakteri dari ekstrak tanaman Rhizophora mucronata, hasil yang didapatkan bahwa komponen bioaktif terbesar serta zona hambat aktivitas bakteri tertinggi terdapat pada bagian kulit batang.
Perumusan Masalah
Penelitian ini menentuan kuantitatif komponen bioaktif, yaitu total fenol dan uji aktivitas antibakteri pada bagian daun, kulit batang, dan ranting mangrove jenis Rhizophora mucronata. Penelitian ini dilakukan untuk menjawab beberapa pertanyaan, antara lain:
2. Apakah ada pengaruh antara konsentrasi sampel mangrove yang memiliki karakteristik yang berbeda dengan diameter zona hambat yang dibentuk oleh aktivitas antibakteri?
3. Apakah adanya interaksi antara sampel dan konsentrasi sampel mangrove yang memiliki karakteristik yang berbeda terhadap diameter zona hambat yang dibentuk oleh aktivitas antibakteri?
Pertanyaan nomor 1, 2, dan 3 akan dijawab melalui uji Analisis of Variance (ANOVA) two way menggunakan data diameter zona hambat aktivitas antibakteri Staphylococus aureus dan Entheropathogenic Escheria coli (EPEC), konsentrasi sampel ( 5 %, 10 %, dan 20), serta jenis sampel yang digunakan dalam pengujian aktivitas antibakteri (estrak daun berwarna hijau muda, daun berwarna hijau tua, kulit batang, dan kulit ranting Rhizophora mucronata), kemudian di uji lanjut mengunakan uji Tukey.
Tujuan
Penelitian ini bertujuan menentukan diameter zona hambat dari daun berwarna hijau muda, daun berwarna hijau tua, kulit batang, dan kulit ranting mangrove jenis Rhizophora mucronata terhadap bakteri EPEC dan S. aureus.
Manfaat Penelitian
Penelitian ini dapat memberikan informasi mengenai kandungan fitokimia, seperti tanin, saponin, dan flavonoid, kuantitatif total fenol, serta aktivitas antibakteri yang tertinggi pada daun muda, daun tua, kulit batang, atau kulit ranting Rhizophora mucronata. Hasil penelitian dapat menentukan bagian tubuh Rhizophora mucronata yang lebih efektif dijadikan bahan baku obat diare.
METODE
Waktu dan Lokasi Penelitian
3
Deskripsi Sampel
Penelitian ini menggunakan empat sampel, yaitu daun berwarna hijau muda, daun berwarna hijau tua, kulit batang, dan kulit ranting. Perbedaan karekteristik tersebut ditentukan saat pengambilan sampel. Karakteristik daun berwarna hijau muda adalah berwarna hijau muda, bertekstur lunak, rasanya sedikit pahit, keberadaannya pada dahan 1-4, dan berukuran 8-15 cm, sedangkan daun berwarna hijau tua memiliki warna hijau tua, bertekstur kaku, rasanya pahit, keberadaannya lebih dari dahan kelima, dan berukuran 13-20 cm. Karakteristik kulit batang adalah berwarna Coklat kehitaman, bertekstur keras, rasanya pahit, dan lingkar batang 7.5-35 cm, serta kulit ranting memiliki warna coklat muda, bertekstur lunak, rasanya sedikit pahit, dan lingkar batang 4-10 cm. Gambar keempat sampel terdapat pada Lampiran 1.
Alat dan Bahan
Alat yang digunakan dalam penelitian, yaitu: GPS, botol sampel, plastik strep, plastik anti panas, kamera, alat tulis, refraktometer, termometer, newtop, box sampel, timbangan, cold box, kertas, label, cutter, gunting, pH indikator, timbangan digital, oven, blender, gelas ukur, perlengkapan ekstrak refluks, corong, autoklaf, tabung erlenmeyer, jirgen, rotarievaporator, pipet tetes, mikro pipet, sudip, tabung reaksi, rak tabung reaksi, buncen, pinset, hot plat with mangnetic stirrer, botol durham, kertas cakram, jarum ose, jangka sorong, kertas saring, masker, sarung tangan, desikator, spektrofotometer, labu ukur, laptop, dan cawan petri.
Bahan yang digunakan adalah sampel daun berwarna hijau muda (DM), daun berwarna hijau tua (DT), kulit batang (KB), dan kulit ranting (KR) mangrove Rhizophora mucronata, alkohol 70%, spirtus, Nutrient Broth (NB), Trypticase Soy Agar (TSA), isolat bakteri EPEC dan S. aureus, kloramfenikol, tissue, silica gel, alumunium foil, Fecl3 1%, serbuk Mg, HCL, etanol, amil alkohol, akuades, Metanol teknis, Na2CO3, Fiolin-Ciocalteu, serta akuabides.
Tahapan Penelitian Pengambilan Sampel di Lapang
Sampel daun, kulit batang, dan kulit ranting Rhizophora mucronata yang didapatkan dimasukan kedalam trash bag, kemudian dibersihkan. Sampel mangrove dirajang dan dikeringkan dengan cara pengeringan dengan oven pada suhu 50 0C, kemudian dihaluskan dengan blender hingga menjadi serbuk.
Penentuan Kadar Air
porselin dipanaskan menggunakan oven dengan temperetur 105 ºC selama 3 jam lalu sampel diletakkan didesikator, kemudian sampel ditimbang. Sampel dipanaskan kembali dengan oven dan didinginkan sampai mencapai berat konstan. Penentuan kadar air menggunakan rumus sebagai berikut :
Kadar air = (A-B)/A x 100% Keterangan :
A = Berat sampel sebelum dioven (gr) B = Berat sampel setelah dioven (gr)
Proses Ekstrak
Ekstraksi sampel dilakukan dengan metode yang dilakukan oleh Trusheva et al. (2007). Sampel yang sudah halus sebanyak 40 gr di beri pelarut metanol teknis sebanyak 400 ml dan dimaserasi selama 24 jam. Sampel yang sudah dimaserasi disaring dan ekstrak kembali menggunakan metode refluks selama 3 jam. Hasil ekstraksi diuapkan hingga menghasilkan padatan dengan rotarievaporator, masukan ke dalam botol vial yang beratnya sudah diketahui dan terlebih dahulu hasil yang padat ditimbang danekstrakmpan dalam freezer.
Rendemen Ekstrak
Berat sampel hasil ekstrak yang diperoleh dibagi dengan berat sampel yang digunakan sebelum ektraksi untuk mengetahui persentase rendemen dari sampel. Perhitungan :
Persentase rendemen = (A/B) x 100% Keterangan :
A = Berat sampel hasil ekstrak (gr) B = Berat sampel sebelum diekstrak (gr)
Rendemen terkoreksi adalah persentase rendemen yang tidak mengandung kadar air. Berat sampel sebelum diekstrasi dikoreksi dulu dengan nilai kadar air.
Berat terkoreksi = Berat sampel x (100 - kadar air)/100
Presentase rendemen terkoreksi = (berat ekstrak /berat terkoreksi).
Kandungan Fitokimia
Uji fitokimia dilakukan untuk menentukan komponen aktif yang terdapat pada suatu sampel seperti senyawa flavonoid, saponin, dan tanin sampel daun, kulit batang, serta kulit ranting Rhizophora mucronata yang mengacu pada Harborne (1987):
Flavonoid
Sebanyak 0,05 gr sampel dilarutkan dalam 10 ml akuades dan dipanaskan hingga warna pelarut berubah. Saring sampel dan ambil filtrat, tambahkan serbuk Mg sebanyak 0.05 mg, setelah itu ditambahkan 0.1 ml HCL, 0.1 ml etanol, dan 0.05 ml amil alkohol. Hasil uji positif bila larutan berwarna merah, kuning atau jingga pada lapisan amil alkohol.
Saponin
5
kemudian dipanaskan hingga pelarut berubah warna, saring sampel dan ambil filtrat serta kocok tabung reaksi secara kuat. Hasil positif uji saponin ditunjukan dengan adanya busa yang stabil.
Tanin
Sebanyak 0.05 g sampel yang telah dipanas dengan akuades disaring dan diambil filtratnya. Tambahkan filtrat dengan FeCl3 1% sebanyak 3 tetes. Hasil uji positif jika larutan bewarna biru tua atau hijau kehitaman.
Kuantitatif Total Fenol
Penentuan kuantitatif total fenol menggunakan metode Fiolin-Ciocalteu (Negi et al. 2012). Hasil sebanyak 10 mg dilarutkan dalam larutan pada labu takar 10 ml. Ambil larutan sebanyak 2 ml dan larutkan kembali dalam larutan pada labu takar 25 ml. Ambil 2 ml larutan dan masukan kedalam tabung reaksi. Tambahkan 5 ml akuabides, 0.5 ml Fiolin-Ciocalteu, dan diamkan selama 5 menit. Tambahkan larutan Na2CO3 5% dan inkubasi selama 60 menit dalam ruangan gelap. Absorbansi larutan diukur menggunakan spektrofotometer dengan panjang gelombang 725 nm. Uji kuantitatif total fenol menggunakan standar asam galat. Total fenol diukur dengan satuan miligram (mg) asam galat ekuivalen per gram bobot ektrak kering (GAE mgg-1). Konsentrasi standar yang digunakan adalah 0.5%, 1%, 5%, 10%, dan 15%.
Kultur dan Pengenceran Bakteri
Kultur adalah memperbanyak bakteri dengan cara mengambil satu ose bakteri yang telah diremajakan dan diletakan pada media NB, serta di inkubasi selama 24 jam. Bakteri diencerkan untuk menurunkan konsentrasi bakteri dengan cara menyiapkan 10 tabung reaksi yang telah diisi 9 ml akuades steril dan diberi label 10-1 sampai 10-10. Ambil 1 ml bakteri yang berada dimedia NB kemudian masukan kedalam tabung reaksi yang berlabel 10-1 dan kocok. Ambil 1 ml cairan yang berada ditabung berlabel 10-1 kedalam tabung reaksi yang berlabel 10-2 dan begitu seterusnya hingga tabung reaksi berlabel 10-10 (Sunatmo 2009).
Uji Aktivitas Antibakteri
Metode difusi merupakan pengujian aktivitas bakteri dengan menentukan kerentanan bakteri terhadap suatu zat yang bersifat sebagai antibakteri (Madigan et al. 2003). Pembuatan media agar dengan TSA sebanyak 20 gram, kemudian masukan ke dalam botol durham dengan aqudes 500 ml, serta aduk mengunakan hot plate with magnetic strirrer sampai homogen. Sterilisasi medium agar tersebut dengan autoclave selama 15 menit pada suhu 121- 125 oC, setelah itu tuangkan agar ke cawan petri pada suhu medium 45 oC.
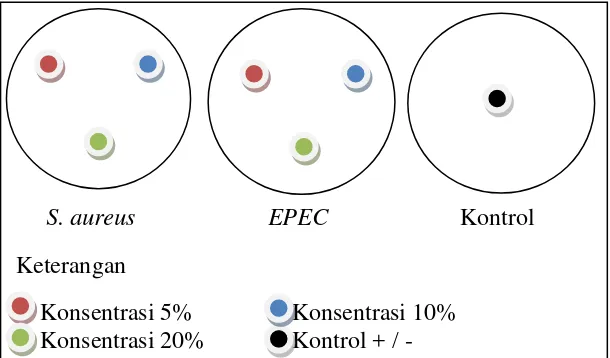
akuades. Setelah diinkubasi aktivitas antibakteri dapat terlihat dengan adanya zona hambat (zona bening) di sekitar kertas cakram, kemudian zona hambat tersebut diukur menggunakan jangka sorong. Rancangan uji zona hambat dan pengukurannya terdapat pada gambar 2.
Gambar 1 Rancangan uji zona hambat dan pengukurannya
Minimum Inhibitor Consentration (MIC)
Metode MIC yang digunakan dalam penelitian ini merupakan metode spektrofotometer yang mengacu pada Yuli (2007). MIC adalah konsentrasi minimum hambat dari suatu sampel yang mengandung zat atau senyawa antimikroorganisme. Pengujian dilakukan dengan memasukan larutan uji dengan konsentrasi 1%, 4%, 7%, dan 10% pada tabung reaksi yang berbeda dan tambahkan 1 ml bakteri EPEC. Setiap tabung diinkubasi selama 24 jam pada suhu 27 0C. Pengamatan dilakukan menggunakan spektrofotometri dengan panjang gelombang 615 nm.
Analisis Data
Rancangan penelitian digunakan adalah Rancangan Acak Faktorial (RAF) dengan empat sampel, yaitu daun muda, daun tua, kulit batang, dan kulit ranting, perlakuan perbedaan konsentrasi sampel 5%, 10%, dan 20% serta dilakukan tiga kali pengulangan . Model rancangannya:
Yijk =μ +αi + βj + (αβ)ij +εijk Keterangan :
Yijk = Respon pengamatan pada konsentrasi dan sampel yang berbeda dengan tiga kali ulangan.
7
βj = Pengaruh konsentrasi ke-j
(αβ)ij = Pengaruh interaksi antara sampel dengan konsentrasi εijk = Galat percobaan
i = Sampel (Daun berwarna hijau muda, daun berwarna hijau tua, kulit batang, dan kulit ranting)
j = Konsentrasi (5 %, 10 %, dan 20 %) k = Ulangan (1, 2, dan 3)
Rancangan ini digunakan dalam pengaruh nilai konsentrasi terhadap perbedaan kemampuan aktivitas antibakteri dari empat berbeda. Data yang diperoleh dianalisis menggunakan Analisis of Variance (ANOVA) two way dengan tingkat kepercayaan 95% dan taraf α 0.05 serta dilakukan uji lanjut dengan uji Tukey.
HASIL DAN PEMBAHASAN
Kadar Air Sampel Simplisia
Penentuan kadar air bertujuan untuk menentukan kandungan zat dalam sampel tumbuhan atau hewan sebagai persen bahan kering dan kualitas ketahanan suatu sampel dalam penyimpanan yang cukup lama (Harjadi 1993).
Tabel 1 Kadar air simplisia sampel daun berwarna hijau tua sebesar 13.50%. Kadar air yang baik tidak boleh lebih dari 10%, hal ini bertujuan mencegah tumbuhnya jamur dan bakteri pada saat penyimpanan dalam waktu tertentu (Winarno 1988).
Rendemen Ekstrak
tertentu dengan adanya pendingin balik (Depkes RI 2000). Pelarut yang digunakan adalah metanol yang bersifat universal dapat melarutkan senyawa yang bersifat polar dan nonpolar, selain itu metanol dapat menarik komponen bioaktif, seperti tanin, saponin, dan flavonoid dari tanaman. Metanol memiliki titik didih 64–65 0C (Thompson 1985). Hasil dari proses ekstrak disebut dengan rendemen.
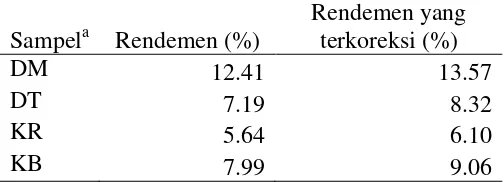
Tabel 2 Persentase rendemen terkoreksi dan tidak terkoreksi
Sampela Rendemen (%)
Hasil ekstrak sampel daun berwarna hijau muda memiliki persentase rendemen terkoreksi maupun tidak terkoreksi tertinggi, yaitu 12.41% dan 13.57%, sedangkan persentase rendemen terendah terdapat pada sampel kulit ranting dengan rendemen terkoreksi sebanyak 5.64% dan rendemen tidak terkoreksi sebanyak 6.10%. Semakin tinggi persentase rendemen menunjukan, semakin banyak senyawa organik yang terkandung pada hasil ekstrak (Parhusip 2006).
Kandungan Fitokimia
Uji fitokimia yang dilakukan pada penelitian ini meliputi uji flavonoid, saponin, dan tanin.
9
(Ajizah 2004). Mekanisme kerja flavonoid sebagai antibakteri dengan cara mendenaturasi protein sel bakteri dan merusak membran sel tanpa dapat diperbaiki lagi (Juliantina et al. 2009). Mekanisme kerja saponin sebagai antibakteri adalah mengganggu stabilitas memnbran sel bakteri yang mengakibatkan kerusakan membran sel dan menyebabkan keluarnya komponen penting dalam sel bakteri yaitu protein dan asam nukleat (Darsana et al. 2012). Hasil uji fitokimia terdapat pada Lampiran 2.
Total Fenol
Fenol merupakan salah satu kompen bioaktif yang dapat menghambat aktivitas antibakteri. Tanin, saponin, dan flavonoid merupakan komponen bioaktif yang mengandung senyawa fenol.
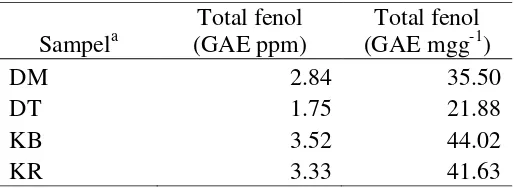
Tabel 4 Hasil uji kuantitatif total fenol
Sampela
Aktivitas Antibakteri
Pengujian aktivitas antibakteri sampel menggunakan metode kertas cakram (difusi) dengan dua bakteri penyebab diare, yaitu EPEC dan S. aureus. Setiap sampel diletakan pada kertas cakram dengan konsentrasi berbeda. Kontrol positif yang digunakan adalah kloramfenikol dan kontrol negatif menggunakan air.
a
Jenis sampel; DM: daun berwarna hijau muda, DT: daun berwarna hijau tua, KR: kulit ranting, KB: kulit batang.
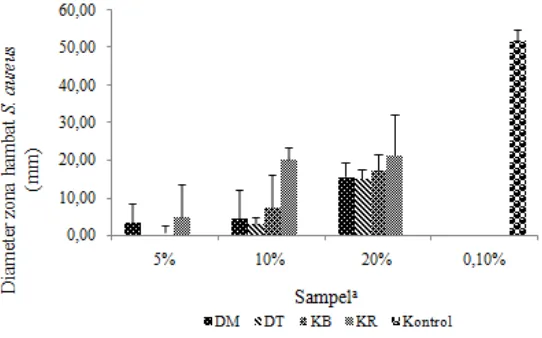
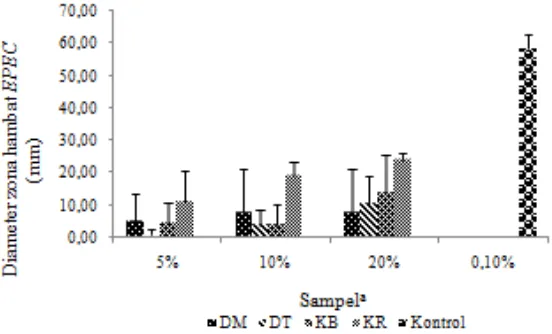
Gambar 2 Hasil uji aktivitas antibakteri empat sampel Rhizophora mucronata dengan konsentrasi berbeda terhadap bakteri S. aureus
Gambar 2 menujukan bahwa kulit ranting memiliki aktivitas antibakteri tertinggipada setiap konsentrasi terhadap bakteri S. aureus. Aktivitas antibakteri terendah pada setiap konsentrasi dimiliki oleh daun berwarna hijau tua. Konsentrasi 5% yang dimiliki oleh daun berwarna hijau tua tidak dapat menunjukan aktivitas antibakteri, karena tidak adanya zona bening.
Diameter zona hambat yang terbentuk dari kloramfenikol selaku kontrol positif dengan konsentrasi 0.1% berkisar antara 49,39-55 mm lebih besar dibandingkan dengan sampel yang memiliki konsentrasi 5%, 10%, dan 20%, sedangkan kontrol negatif tidak memiliki diameter zona hambat. Kloramfenikol merupakan salah satu antibiotik yang aktif terhadap bakteri gram positif dan negatif, serta tidak bersifat racun bagi mamalia. Kloramfenikol bekerja sebagai antibakteri dengan cara bergabung bersama subunit-subunit ribosom sehingga menganggu dalam prosesekstrakntesis protein (Pelczar dan Chan 2008). Gambar diameter zona hambat sampel terhadap bakteri S. aureus terdapat di Lampiran 4.
11
Hasil uji statistika menunjukan bahwa daun berwarna hijau muda, daun berwarna hijau tua, kulit ranting, dan kulit batang serta konsentrasi sampel 5%, 10%, dan 20% mempengaruhi diameter zona hambat bakteri S. aureus pada tingkat signifikasi 5%. Tidak ada keterkaitan antara sampel dan konsentrasi sampel terhadap diameter zona hambat bakteri S. aureus dan hasil uji ini terdapat pada Lampiran 6. Hasil uji Tukey terhadap konsentrasi menunjukan bahwa terdapat perbedaan diameter zona hambat pada sentiap konsentrasi. Hasil uji Tukey terhadap ektrak sampel menunjukan bahwa kulit batang tidak memiliki perbedaan diameter zona hambat bakteri S. aureus yang signifikan pada daun berwarna hijau tua, daun berwarna hijau muda, dan kulit ranting, sedangkan kulit ranting menunjukan adanya perbedaan yang ekstrak signifikan terhadap diameter zona hambat bakteri S. aureus dengan daun berwarna hijau muda dan daun berwarna hijau tua. Hasil uji Tukey terdapat pada Lampiran 7 dan 8.
Bakteri uji S. aureus merupakan bakteri gram positif yang bersifat patogen bagi manusia. Bakteri ini tumbuh pada makan tercemar yang dapat menimbulkan keracunan makanan. Gejala keracunan makanan tersebut ditandai dengan adanya penyakit diare. Bakteri S. aureus ini masuk kedalam tubuh manusia melalui makanan dan menetap pada bagian tubuh manusia, seperti mulut, hidung, dan tenggorokan (Pelczar dan Chan 2008).
a
Jenis sampel; DM: daun berwarna hijau muda, DT: daun berwarna hijau tua, KR: kulit ranting, KB: kulit batang.
Gambar 3 Hasil uji aktivitas antibakteri empat sampel Rhizophoramucronata dengan konsentrasi berbeda terhadap bakteri EPEC.
Gambar 3 menujukan bahwa kulit ranting memiliki aktivitas antibakteri tertinggi pada setiap konsentrasi terhadap bakteri EPEC. Aktivitas antibakteri terendah pada konsentrasi 20% dimiliki oleh daun berwarna hijau muda dengan diameter zona hambat 7.72 mm, sedangkan diameter zona hambat terkecil pada konsentrasi 10% dan 5% di miliki oleh daun berwarna hijau tua. Diameter zona hambat yang terbentuk dari kloramfenikol dengan konsentrasi 0.1% berkisar antara 54,62-63.25 mm, sedangkan kontrol negatif tidak memiliki diameter zona hambat. Gambar diameter zona hambat sampel terhadap bakteri EPEC terdapat pada Lampiran 5.
hambat bakteri EPEC pada tingkat signifikasi 5%, sedangkan konsentrasi sampel 5%, 10%, dan 20% tidak mempengaruhi diameter zona hambat bakteri EPEC pada tingkat signifikasi 5%. Tidak ada keterkaitan antara sampel dan konsentrasi sampel terhadap diameter zona hambat bakteri EPEC dan hasil uji ini terdapat pada lampiran 9. Hasil uji Tukey terhadap konsentrasi konsentrasi 10% tidak terdapat perbedaan diameter zona hambat bakteri EPEC yang signifikan pada konsentrasi 5% dan 20%, sedangkan konsentrasi 5% menunjukan adanya perbedaan yang signifikan terhadap diameter zona hambat bakteri EPEC dengan konsentrasi 20%. Hasil uji Tukey terhadap ektrak sampel menunjukan bahwa kulit batang tidak memiliki perbedaan diameter zona hambat bakteri EPEC yang ekstrak signifikan pada daun berwarna hijau berwarna hijau tua, daun berwarna hijau muda, dan kulit batang, sedangkan kulit ranting menunjukan adanya perbedaan yang signifikan terhadap diameter zona hambat bakteri S. aureus dengan daun berwarna hijau muda dan daun berwarna hijau tua. Hasil uji Tukey terdapat pada Lampiran 10 dan 11.
Bakteri uji EPEC merupakan salah satu kelompok bakteri Escherichia coli yang dapat menyebabkan diare. Bakteri ini menginfeksi jejunum dan ileum, sehingga menyebabkan penyakit diare pada manusia. Bakteri EPEC adalah bakteri gram negatif yang menginfeksi manusia melalui makanan, minuman, dan kegiatan masuknya tangan kemulut (Pelczar dan Chan 2008).
Hasil uji aktivitas antibakteri menggunakan bakteri penyebab diare, yaitu EPEC dan S. aureus terhadap daun berwarna hijau muda, daun berwarna hijau tua, kulit ranting, dan kulit batang tua Rhizophora mucronata, dapat terlihat bahwa diameter zona hambat bakteri S. aureus lebih tinggi dibandingkan bakteri EPEC. Hal ini dikarenakan bakteri S. aureus merupakan kelompok bakteri gram positif yang cenderung lebih sensitif terhadap senyawa antibakteri, karena struktur dinding sel gram positif berlapis tunggal dan kandungan lipid yang rendah (1-4%), sehingga menyebabkan antibakteri mudah masuk kedalam sel bakteri tersebut. Bakteri EPEC merupakan kelompok gram negatif yang memiliki struktur dinding sel yang berlapis tiga dan kandungan lipid yang tinggi (11-22%), sehingga kelompok bakteri ini lebih kebal terhadap antibakteri (Pelczar dan Chan 2007).
13
Minimum Inhibitor Consentration (MIC)
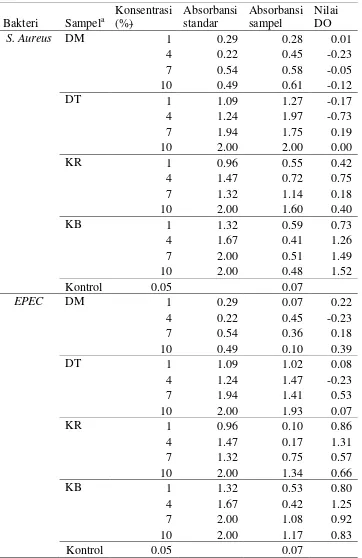
MIC bertujuan menentukan konsentrasi minimum pada sampel yang dapat menghambat aktivitas antibakteri, khusus bakteri penyebab diare.
Nilai MIC ditentukan dari nilai terendah Optical Density (OD). Pada penelitian ini terdapat nilai OD yang bernilai negatif dan positif. Nilai OD negatif yang menunjukan adanya penurunan nilai absorbansi yang berarti terjadi penurunan jumlah sel, karena cahaya yang diabsorbansi sebanding dengan banyaknya sel bakteri (Purwoko 2007). Nilai OD positif menunjukan masih adanya peningkatan nilai absorbansi yang berarti masih terdapat pertumbuhan bakteri. Absorbansi merupakan besarnya cahaya yang diserap oleh sel bakteri.
Menurut Ardiansyah (2005) semakin tinggi konsentrasi, maka semakin besar aktivitas bakteri yang dihambat. Hasil MIC pada penelitian ini tidak menunjukan seperti itu. Hal ini dapat disebabkan karena tidak semua cahaya diserap oleh sel bakteri, melainkan diserap juga oleh ekstra. Ekstrak yang digunakan dalam penelitian ini berwarna pekat yang cenderung menyerap cahaya, selain itu sel bakteri yang mati pun ikut menyerap cahaya. Menurut Purwoko (2007) metode perhitungan bakteri secara langsung seperti metode MIC mempunyai kelemahan dalam membedakan sel bakteri yang hidup dan mati. Metode lain yang dapat digunakan dalam menentukan MIC adalah cawan piringan kertas (paper disk plate) (Pelczar dan Chan 2008).
SIMPULAN DAN SARAN Simpulan
Sampel kulit ranting yang memiliki aktivitas antibakteri sangat kuat terhadap bakteri S. aureus dan EPEC yang ditunjukan dengan diameter zona hambat yang besar dibandingkan dengan ketiga sampel lain, sehingga kulit ranting merupakan sampel yang efektif dijadikan sebagai bahan baku obat diare.
Saran
Perlu dilakukan pengujian MIC dengan metode lain untuk mengetahui konsentrasi minimum hambat bakteri seperti cawan piring kertas.
DAFTAR PUSTAKA
Ajizah A. 2004. Sensitivitas Salmonella typhymurium terhadap daun jambu biji (Psidium guajava L.). Bioscientiae. 1(1): 8-31.
[AOAC].Association of Official Analytical Communities. 2005. Official Methods Of Analysis Of AOAC Internasional. Galthersburg, Marylan (USA) : AOAC Internasional.
15
Banerjee D, Chakrabarti S, Hazra AK, banerjee S, Ray J, dan Mukherjee B. 2008. Antioxidant activity and total phenolic of some angroves in Sundarbans. African Joural of BiotechnologiI. 7(6) : 807
Darsana IGO, Besung INK, Mahatmi. 2012. Potensi daun binahong (Anredera cordifolia) dalam menghambat pertumbuhan bakteri Escherichia coli in vitro. Indonesia Medicus Veterinus. 1(3) : 337-351.
Davis WW, Stout TR. 1971. Disc plate method of microbiological antibiotic assay. Applied Microbiology. 22 (4): 659-665.
[Depkes RI] Departemen Kesehatan Republik Indonesia. 2000. Parameter Standar Umum Tumbuhan Obat. Jakarta (ID): Depkes RI.
Harborne. 1987. Metode Fitokimia, Penuntun Cara Modern Menganalisis Tumbuhan. K. Padmawinata dan I. Sudiro, penerjemah; Bandung (ID): Institut Teknologi Bandung. hlm: 4-234.
Harjadi. 1993. Ilmu Kimia Amalitik Dasar. Jakarta (ID):Gramedia
Juliantina F, Citra DA, Nirwani B, Nurmasitoh T dan Bowo ET. 2009. Manfaat ekstrak sirih merah (Piper crocatum) sebagai agen anti bacterial terhadap bakteri gram positip dan gram negatif. Jurnal Kedokteran dan Kesehatan Indonesi. Jakarta. 1 : 1-10.
Kementerian Kesehatan RI. 2011. Situasi Diare di Indonesia. Jakarta(ID). Kenkes.
Madigan MTJ, Martinko M, Parker AJ. 2003. Brock biology of microorganisme, 10th ed., Prentice Hall, New Jersey.
Negi A, Sharma N, Pant R, Singh MF. 2012. Determination of total phenolic content of the stem bark of Bauhinia variegata linn.; an approach to standaridizatioan. The Pharma Research. 7(2) : 16-22.
Nurdiani R, Firdaus M, Prihanto AA. 2012. Phytochemical screening and antibacterial activity of methanol extract of mangrove plant (Rhizophora mucronata) from Porong River Estuary. Journal Basic Science and Technology. 1(2) : 27-29
Onrizal, Kusmana C, Sudarmadji. 2003. Jenis-jenis pohon mangrove di Teluk Bintuni, Papua. Bogor (ID). PT. Bintuni Utama Murni Wood Industri. Parhusip AJN. 2006. Kajian mekanisme antibakteri ekstrak andaliman
(Zanthoxylum acanthopodium, DC) terhadap bakteri patogen pangan [disertasi]. Bogor: Institut Pertanian Bogor.
Pelczar MJ, Chan ECS. 2007. Dasar-Dasar Mikrobiologi 1. Hadioetomo et al., penerjemah. Jakarta (ID): UI-Press. Terjemahan dari: Elements of Microbiology. hlm: 157-184.
Pelczar MJ, Chan ECS. 2008. Dasar-Dasar Mikrobiologi 2. Hadioetomo et al., penerjemah. Jakarta (ID): UI-Press. Terjemahan dari: Elements of Microbiology. hlm: 535-730.
Purwoko T. 2007. Fisiologi Mikroba. Jakarta (ID): Bumi Aksara
Puspitasari YE, Hartiati AM, Suprayitno E. 2012. The potency of Rhizophora mucronata leaf extract as antidiarrhea. Journal of Applied Sciences Research. 8(2) : 1180-1185.
Sahoo G, Mulla NSS, Ansari ZA, Mohandas C. 2012. Antibacterial activity of mangrove leaf extracts against human pathogent. Indian J. Pharm. Sci. 74(4) : 349
Sunatmo TI. 2009. Eksperimen Mikrobiologi Dalam Laboratorium. Jakarta (ID): Ardy Agency.hlm 61-62
Thompson EB. 1985. Drug Bioscreening. America: Graceway Publishing Company, Inc. p 40-118.
Trusheva B, Trunkova D, Bankova V. 2007. Different extraction methods of biologically active components from propolis: a preliminary study. Chemistry Central J. 7: 1-13.
Winarno F.G. 1988. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama. Yuli S. 2007. Daya Antibakteri Daun sirih (Piper betle Linn) Terhadap Bakteri
Vibrio harveyi secara in vitro. Fakultas Perikanan dan Kelautan. Universitas Airlangga. Surabaya. hlm 80.
LAMPIRAN
Lampiran 1 Dokumentasi keempat sampel yang digunakan dalam penelitian
(a) (b)
(c) Keterangan :
(a) Daun berwarna hijau tua Rhizophora mucronata. (b) Daun berwarna hijau muda Rhizophora mucronata. (c) Kulit ranting dan kulit batang Rhizophora mucronata. Lampiran 2 Dokumentasi hasil uji fitokimia
Lampiran 3 Grafik standar asam galat dalam uji kuantitatif total fenol
Rumus perhitungan :
Total fenol (ppm) (x) = (y – 0.104) / 0.131 Total fenol (mg/g) = x (v/m)
Keterangan :
y = Absorbansi sampel x = Total fenol (ppm)
19
Lampiran 4 Dokumentasi hasil uji aktivitas zona hambat bakteri S. aureus.
(a) (b)
(c) (d)
(e) Keterangan :
(a) Kulit ranting (KR) Rhizophora mucronata. (b) Kulit batang (KB) Rhizophora mucronata.
Lampiran 5 Dokumentasi hasil uji aktivitas zona hambat bakteri EPEC
(a) (b)
(c) (d)
(e) Keterangan :
(a) Kulit ranting (KR) Rhizophora mucronata. (b) Kulit batang (KB) Rhizophora mucronata.
21
Lampiran 6 Hasil analisis statistika data diameter zona hambat bakeri S.aureus terhadap empat ekstrak dengan beberapa konsentrasi.
Sumber Signifikasi
Jenis sampel ,011
Konsentrasi sampel ,000
Jenis sampel * Konsentrasi sampel ,452
Lampiran 7 Hasil analisis uji Tukey data diameter zona hambat bakeri S.aureus terhadap beberapa konsentrasi ekstrak.
Konsentrasi S.aureus terhadap ekstrak daun berwarna hijau muda, daun berwarna hijau tua, kulit batang, dan kulit ranting.
Sampela Bagian
Lampiran 9 Hasil analisis statistika data diameter zona hambat bakeri EPEC terhadap empat ekstrak dengan beberapa konsentrasi.
Sumber Signifikasi
Jenis sampel ,014
Konsentrasi sampel ,057
Lampiran 10 Hasil analisis uji tukey data diameter zona hambat bakeri EPEC terhadap beberapa konsentrasi ekstrak.
Konsentrasi Sampel
Bagian
1 2
5,00 50,697
10,00 85,092 85,092
20,00 138,586
Signifikasi ,591 ,292
Lampiran 11 Hasil analisis uji tukey data diameter zona hambat bakeri EPEC terhadap daun berwarna hijau muda, daun berwarna hijau tua, kulit batang, dan kulit ranting.
Sampela Bagian
1 2
DT 48,359
DM 67,711
KB 70,804 70,804
KR 178,959
Signifikasi ,943 ,058
a
23
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 10 Januari 1992 sebagai putri kelima dari pasangan H. Suradin (Alm) dan Hj. Karumi. Penulis merupakan lulusan dari Sekolah Menengah Atas Kornita IPB Bogor pada tahun 2010, Pendidikan Sarjana ditempuh di Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Semasa kuliah penulis aktif sebagai asisten mata kuliah Ikhtiologi pada tahun 2011-2012, asisiten mata kuliah Biologi Laut pada tahun 2012-2013, asisten mata kuliah Oseanografi Kimia pada tahun 2013-2014, dan aktif dalam organisasi Himpunan Mahasiswa Ilmu dan Teknologi Kelautan pada divisi keilmuan dan keprofesian.