PENENTUAN SIMULTAN KADAR KURKUMINOID DAN XANTORIZOL
DARI TEMU LAWAK (
Curcuma xanthorrhiza
)
MENGGUNAKAN KCKT
ARUM VITASARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Penentuan Simultan Kadar Kurkuminoid dan Xantorizol dari Temu Lawak (Curcuma xanthorrhiza) Menggunakan KCKT adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Arum Vitasari
ABSTRAK
ARUM VITASARI. Penentuan Simultan Kadar Kurkuminoid dan Xantorizol dari Temu Lawak (Curcuma xanthorrhiza) Menggunakan KCKT. Dibimbing oleh MOHAMAD RAFI dan BUDI RIZA PUTRA.
Metode yang akurat dalam analisis simultan kurkuminoid dan xantorizol telah dikembangkan menggunakan kromatografi cair kinerja tinggi. Analisis simultan dilakukan dengan sistem elusi gradien pada kolom Phenomenex-C18 (150 mm × 4.16 mm), menggunakan detektor larik diode dan fase gerak yang terdiri atas asam asetat 0.005% dan asetonitril dengan laju alir 1 mL/menit. Linearitas yang dihasilkan dari setiap analit memiliki koefisien korelasi 0.9989. Limit deteksi dan limit kuantisasi metode ini masing-masing berkisar
0.0090−0.2892 g/mL dan 0.0302−0.9640 g/mL. Ketelitian pada hari yang sama menunjukkan nilai SBR 2%. Ketepatan yang ditentukan dengan metode penambahan standar menghasilkan persen perolehan kembali berkisar antara 99.04 dan 106.12%. Uji stabilitas sampel yang dilakukan menunjukkan analit
stabil dalam larutan sampel dengan nilai SBR 0.37−2.56%. Rerata kadar
bisdemetoksikurkumin, demetoksikurkumin, kurkumin, dan xantorizol adalah masing-masing 0.50, 3.43, 7.90, dan 134.76 mg/g.
Kata kunci: Curcuma xanthorrhiza, kromatografi cair kinerja tinggi, kurkuminoid, temu lawak, xantorizol
ABSTRACT
ARUM VITASARI. Simultaneous Determination of Curcuminoids and Xanthorrhizol From Temu Lawak (Curcuma xanthorrhiza) Using High Performance Liquid Chromatography. Supervised by MOHAMAD RAFI and BUDI RIZA PUTRA.
An accurate method for the determination of curcuminoids and xanthorrhizol was developed using high-performance liquid chromatography method. The simultaneous analysis was performed with gradient elution system on Phenomenex-C18 column (150 mm × 4.16 mm), using photodiode array detector and mobile phase consisting of 0.005% acetic acid and acetonitrile with flow rate of 1 mL/min. The linearity from each analytes gave correlation coefficient above 0.9989. The limit of detection and limit of quantitation values were 0.0090−0.2892 g/mL and 0.0302−0.9640 g/mL, respectively. Intraday precision studies showed the relative standard deviation of less than 2%. Accuracy as determined by standard addition method resulted percent recovery of 99.04−106.12%. Stability test showed that analytes were stable in solution with RSD of 0.37−2.56%. The average concentration of bisdemethoxycurcumin, demethoxycurcumin, curcumin, and xanthorrhizol were 0.50, 3.43, 7.90, and 134.76 mg/g, respectively.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
ARUM VITASARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2016
PENENTUAN SIMULTAN KADAR KURKUMINOID DAN XANTORIZOL
DARI TEMU LAWAK (
Curcuma xanthorrhiza
)
NIM : G44110023
H
ll
N
�Dr Mohamad MSi
Pembimbing I
Tanggal Lulus: r1 9 JAN 2016
Disetujui oleh
Diketahui oleh
���
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’ala atas segala nikmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Penelitian yang dilaksanakan sejak bulan Maret 2015 ini diberi judul Penentuan Simultan Kadar Kurkuminoid dan Xantorizol dari Temu Lawak (Curcuma xanthorrhiza) Menggunakan KCKT.
Terima kasih penulis ucapkan kepada Bapak Dr Mohamad Rafi, MSi dan Bapak Budi Riza Putra SSi, MSi selaku pembimbing atas bimbingan, saran, dan arahannya sehingga karya ilmiah ini dapat diselesaikan. Selain itu, ucapan terima kasih juga penulis sampaikan kepada staf Laboratorium Kimia Analitik (Ibu Nunung Nuryanti, Bapak Kosasih, Bapak Eman Suherman, dan Bapak Edi Suhendar), serta staf Laboratorium Pusat Studi Biofarmaka (Laela Wulansari SSi, Taopik Ridwan SSi, Antonio Kautsar SSi, Nunuk Kurniati Nengsih SFarm, Yusuf Ibrahim, Endi Suhendi) yang telah memberikan fasilitas dan arahan selama kegiatan penelitian berlangsung.
Ungkapan cinta dan terima kasih penulis sampaikan kepada ayah, ibu, dan adik tercinta atas segala bantuan, dukungan, dan doa yang diberikan. Ucapan terima kasih juga penulis sampaikan kepada Irwan Budiarto, Vany Ratna Pertiwi, Afifia Krismi Kangerti, Afiyatina Awaliyah, Eka setiawati yang turut membantu selama penelitian berlangsung.
Semoga karya ilmiah ini bermanfaat bagi penulis dan pembaca.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
METODE 3
Bahan dan Alat 3
Prosedur 3
Kondisi Alat Kromatografi 4
Penyiapan Larutan Sampel 4
Uji Kesesuaian Sistem 5
Validasi Metode 5
HASIL DAN PEMBAHASAN 6
Isolasi Xantorizol 6
Penyiapan Larutan Sampel Temu Lawak 6
Pengoptimuman Kondisi KCKT 7
Kesesuaian Sistem (System Suitability) 11
Validasi Metode untuk Analisis Kuantitatif Kurkuminoid dan Xantorizol 12 Penentuan Kadar Kurkuminoid dan Xantorizol dalam Sampel Temu Lawak 14
SIMPULAN 14
SARAN 15
DAFTAR PUSTAKA 15
DAFTAR TABEL
1 Uji kesesuaian sistem untuk penentuan kurkuminoid dan xantorizol 11 2 Linearitas, LD, dan LK untuk analisis kuantitatif kurkuminoid 13 3 Penentuan ketelitian berdasarkan SBR (%) kadar analit dalam sampel 13 4 Kadar kurkuminoid dan xantorizol dalam sampel temu lawak 14
DAFTAR GAMBAR
1 Struktur kimia dari kurkuminoid dan xantorizol 1 2 Profil kromatogram standar kurkuminoid dengan variasi komposisi fase gerak 8 3 Profil kromatogram standar xantorizol dengan konsentrasi 170.84 g/mL 9 4 Profil kromatogram standar kurkuminoid variasi konsentrasi asam asetat 9 5 Profil kromatogram standar xantorizol variasi konsentrasi asam asetat 10
6 Profil kromatogram sampel temu lawak 11
DAFTAR LAMPIRAN
1 Diagram alir penelitian 17
2 Kromatogram KG-SM senyawa isolat yang diduga xantorizol 19 3 Spektrum massa KG-SM senyawa isolat yang diduga xantorizol 19 4 Profil kromatogram standar xantorizol 170.84 g/mL 20
5 Pengoptimuman komposisi fase gerak 20
6 Uji kesesuaian sistem kurkuminoid dan xantorizol 23
7 Linearitas kurkuminoid dan xantorizol 24
8 Penentuan LD dan LK berdasarkan S/N 26
PENDAHULUAN
Latar Belakang
Beberapa dekade terakhir penggunaan obat tradisional semakin berkembang sebagai obat alternatif untuk menyembuhkan maupun mencegah suatu penyakit. Obat herbal tradisional dalam hal ini jamu biasanya terbuat dari bahan alami seperti akar, daun, kayu, dan buah-buahan. Tanaman yang digunakan sebagai obat herbal tradisional merupakan tanaman yang memiliki metabolit bioaktif dengan efek samping yang rendah (Bahmani et al. 2014). Contoh komoditas bahan alam andalan Indonesia yang digunakan sebagai obat tradisional adalah temu lawak (Curcuma xanthorrhiza). Rimpang dari tanaman ini dapat dimanfaatkan sebagai antibakteri (Hwang et al. 2000), anticendawan (Rukayadi et al. 2006), antioksidan (Lim et al. 2005), antikanker (Cheah et al. 2009), hepatoprotektor (Devaraj et al.
2010), antimikrob (Helen et al. 2012), serta untuk mengobati penyakit Alzheimer (Mishra & Kalpana 2008).
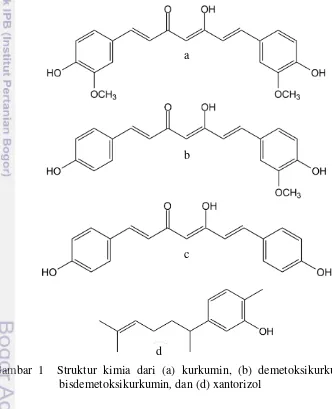
Gambar 1 Struktur kimia dari (a) kurkumin, (b) demetoksikurkumin, (c) bisdemetoksikurkumin, dan (d) xantorizol
c b a
Temu lawak merupakan tumbuhan obat yang sangat strategis di Indonesia karena memiliki banyak manfaat bagi kesehatan dan banyak digunakan dalam formula jamu. Hal ini disebabkan oleh keberadaan beberapa senyawa metabolit sekunder yang dimilikinya dengan aktivitas biologis tertentu. Kurkuminoid merupakah salah satu senyawa bioaktif yang terkandung di dalam temu lawak. Kurkumin, demetoksikurkumin, dan bisdemetoksikurkumin adalah senyawa kurkuminoid (Gambar 1) yang teridentifikasi pada temu lawak (Li et al. 2011). Selain itu temu lawak juga mengandung senyawa bioaktif lainnya yang termasuk ke dalam golongan seskuiterpen yaitu xantorizol (Gambar 1) yang tidak ditemukan pada tumbuhan genus Curcuma lainnya (Itokawa et al. 2008; Cho et al. 2011).
Saat ini kurkuminoid dan xantorizol digunakan sebagai senyawa penanda untuk kendali mutu bahan baku temu lawak. Oleh karena itu, kadar senyawa bioaktif tersebut perlu ditentukan sebagai bagian dalam proses standardisasi bahan baku maupun produk obat herbal yang mengandung temu lawak. Hal ini perlu dilakukan karena kandungan senyawa bioaktif akan bervariasi bergantung pada banyak faktor, seperti iklim, kondisi budidaya, waktu panen, pengeringan, penyimpanan, proses ekstraksi, dan pemalsuan komposisi yang disengaja atau secara kebetulan yang dapat menyebabkan variabilitas yang besar dalam bahan aktif dan akibatnya bisa membahayakan kesehatan dan keselamatan konsumen (Tistaert 2011).
Beberapa metode analisis kuantitatif dengan berbagai teknik analisis telah dikembangkan untuk menentukan kandungan kurkuminoid dan xantorizol dalam genus Curcuma. Teknik analisis yang telah banyak digunakan untuk penentuan kurkuminoid adalah spektrofotometer UV-Tampak, KCKT-ESI-SM (Karioti et al.
2011), elektroforesis kapiler (Anubala et al. 2014), UV, dan
METODE
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini antara lain standar kurkumin dengan kemurnian 97.70%, demetoksikurkumin dengan kemurnian 99%, bisdemetoksikurkumin dengan kemurnian 99.40% (Chromadex Inc. Santa Ana, CA, Amerika Serikat), standar xantorizol hasil isolasi dengan kemurnian 85.42% dikarakterisasi menggunakan KCKT, asetonitril (Merck, Darmstadt, Jerman), metanol (Merck, Darmstadt, Jerman), asam asetat (Merck, Darmstadt, Jerman), vanilin, etil asetat (Merck, Darmstadt, Jerman), heksana (Merck, Darmstadt, Jerman), pelat kromatografi lapis tipis silika gel 60 F254 (Merck, Darmstadt, Jerman), pelat kromatografi lapis tipis preparatif silika gel 60 F254 (Merck, Darmstadt, Jerman), sampel temu lawak yang berasal dari kebun biofarmaka (umur tanam 9 dan 12 bulan) dan wonogiri. Alat-alat yang digunakan adalah filter membran (0.45 m; PTFE; P/N E252, Whatman, Buckinghamshire, Inggris), kromatografi cair kinerja tinggi (KCKT) tipe LC-20A (Shimadzu, Tokyo, Jepang), KG-SM tipe QP-5050A (Shimadzu, Tokyo, Jepang), neraca analitik (Sartorius, Bradford, Jerman), sonikator (Branson, Danbury, Amerika Serikat), radas distilasi, radas penguap putar, dan alat kaca yang umum digunakan dalam laboratorium kimia.
Prosedur
Penelitian dilakukan dalam 4 tahap, yaitu tahap isolasi xantorizol, penyiapan larutan sampel, pengoptimuman metode analisis simultan, dan validasi metode. Distilasi rimpang temu lawak
Sebanyak 3 kg rimpang temu lawak segar yang telah di cuci bersih dan diiris tipis kemudian dilakukan proses distilasi selama 6 jam. Distilat yang tertampung dipisahkan menggunakan etil asetat. Semua distilat yang terkumpul kemudian diuapkan dengan penguap putar.
Fraksionasi menggunakan kromatografi lapis tipis preparatif (KLTP)
Karakterisasi menggunakan KG-SM
Isolat yang didapat dari hasil fraksionasi KLTP kemudian dikarakterisasi menggunakan KG SM (Shimadzu-QP-5050A). Kolom: HP-5 MS, 60 m × 250 m diameter internal × 0.25 mm ketebalan film. Suhu terprogram: dari 70 °C sampai 290 °C (selama 40 menit) dengan kenaikan suhu sebesar 15 °C/menit. Suhu injektor dan lubang injektor sama, yaitu 290 °C. Suhu detektor: 250 °C. Mode injeksi: split (50:1). Tekanan inlet: 18.03 psi. Gas pembawa berupa helium dengan laju alir 1mL/menit. Spektrometer Massa (SM) yang digunakan adalah energi ionisasi 70 eV, dengan mode ionisasi tumbukan elektron. Area deteksinya ialah 40-800 m/z. Setiap puncak yang muncul dalam kromatogram ion total diidentifikasi dengan menganalisis hasil spektrum massa yang terdapat pada pustaka SM.
Karakterisasi menggunakan KCKT
Isolat yang didapat dari hasil fraksionasi KLTP kemudian ditentukan kadar kemurniannya dengan KCKT. Sistem KCKT yang digunakan ialah dengan kolom C18, detektor larik diode, volume injeksi 20 L, elusi isokratik (eluen H3PO4 dan metanol) serta suhu kolom 40 °C (Nurcholis et al. 2007). Kemurnian ditentukan berdasarkan %area yang dihasilkan.
Penyiapan Larutan Standar Kurkuminoid dan Xantorizol
Larutan stok dibuat dari standar kurkumin, demetoksikurkumin, bisdemetoksikurkumin, dan xantorizol yang dilarutkan dalam metanol dengan konsentrasi 1000 g/mL. Kemudian dibuat deret standar pada masing-masing larutan dengan 6 konsentrasi berbeda dalam rentang konsentrasi 0.5−50 g/mL untuk kurkumin, demetoksikurkumin, bisdemetoksikurkumin, dan 10.68−683.36 g/mL untuk xantorizol.
Kondisi Alat Kromatografi
KCKT yang digunakan adalah tipe LC-20A (Shimadzu, Tokyo, Jepang) yang dilengkapi dengan detektor larik diode. Kolom yang digunakan adalah Phenomenex-C18 (150 mm × 4.16 mm) (Phenomenex, Torrance, Amerika Serikat). Fasa gerak terdiri dari asetonitril (A) dan asam asetat (B) dengan menggunakan elusi gradien. Kecepatan alir yang digunakan 1 mL/menit dan dideteksi pada panjang gelombang UV-tampak menggunakan detektor larik diode (DLD). Puncak kurkumin, demetoksikurkumin, bisdemetoksikurkumin, dan xantorizol akan diidentifikasi dengan membandingkan waktu retensi terhadap senyawa standar yang digunakan.
Penyiapan Larutan Sampel (Rafi et al. 2015)
Uji Kesesuaian Sistem
Larutan standar kurkumin, bisdemetoksikurkumin, demetoksikurkumin dengan konsentrasi 5 g/mL dan larutan standar xantorizol dengan konsentrasi 85.42 g/mL diinjeksikan ke dalam KCKT sebanyak 5 kali pengulangan. Waktu retensi, luas puncak, jumlah pelat teoretis, faktor kapasitas, dan faktor ikutan yang diperoleh kemudian ditentukan simpangan baku relatifnya (SBR).
Validasi Metode
Validasi metode penentuan simultan kurkuminoid dan xantorizol dilakukan dengan cara mengevaluasi linearitas kurva kalibrasi, limit deteksi (LD), limit kuantisasi (LK), presisi, akurasi, dan stabilitas. Validasi metode yang dilakukan mengacu pada kriteria yang ditetapkan oleh AOAC (2013).
Linearitas
Larutan standar bisdemetoksikurkumin, demetoksikurkumin, kurkumin dengan konsentrasi 0.5, 1, 5, 10, 25, dan 50 g/mL dan larutan standar xantorizol dengan konsentrasi 10.68, 21.37, 42.71, 85.42, 170.84, 341.68, 683.36 g/mL diinjeksikan ke dalam KCKT. Linearitas ditentukan menggunakan metode regresi kuadrat. Persamaan linearitas yang digunakan ialah y = a + bx. Peubah a
menyatakan intersep dan b adalah kemiringan garis dari deret standar yang diukur. Linearitas kurva kalibrasi dilihat dari nilai koefisien korelasi (r).
Limit Deteksi dan Limit Kuantisasi
Limit deteksi dan limit kuantisasi dihitung berdasarkan nisbah S/N (signal to noise) yang dihasilkan dari alat.
Keterulangan
Larutan sampel sebanyak 6 ulangan dibuat pada konsentrasi 25 g/mL kemudian masing-masing larutan tersebut diinjeksikan ke dalam KCKT. Luas puncak yang diperoleh kemudian ditentukan simpangan baku (SB) dan simpangan baku relatifnya (SBR).
Ketepatan
Ketepatan metode ini diuji dengan menggunakan metode penambahan standar. Larutan ekstrak temu lawak ditambahkan 1 mL larutan standar campuran bisdemetoksikurkumin, demetoksikurkumin, dan kurkumin dengan konsentrasi 0.5, 5, dan 50 g/mL dan larutan standar xantorizol dengan konsentrasi 10.68, 21.37, dan 42.75 g/mL. Masing-masing larutan dibuat tiga kali ulangan. Nilai % perolehan kembali (PK) dihitung menggunakan rumus:
% Perolehan kembali =
u a 100%
Stabilitas
Stabilitas ditentukan dengan cara menganalisis larutan sampel dengan konsentrasi 25 g/mL pada 0, 4, 8, 12, 24, dan 48 jam setelah preparasi sampel pada suhu ruang. Kadar yang diperoleh kemudian ditentukan simpangan baku (SB) dan simpangan baku relatifnya (SBR).
HASIL DAN PEMBAHASAN
Isolasi Xantorizol
Ketersediaan senyawa murni xantorizol yang terbatas menyebabkan perlu dilakukannya isolasi xantorizol sebelum melakukan pengembangan metode analisis simultan kurkuminoid dan xantorizol. Isolasi xantorizol yang dilakukan mengacu pada kondisi optimum pemisahan yang telah didapatkan oleh Herdiyanto (2014) dengan modifikasi teknik ekstraksi. Teknik ekstraksi yang digunakan pada penelitian ini adalah distilasi uap. Teknik tersebut dipilih untuk meminimalkan interferens. Minyak atsiri yang telah didapatkan dari proses ekstraksi kemudian difraksionasi lebih lanjut menggunakan kromatografi lapis tipis preparatif (KLTP). Hal tersebut dilakukan untuk mendapatkan senyawa tunggal xantorizol. Fraksi KLTP yang telah diperoleh selanjutnya dikarakterisasi menggunakan KG-SM dan KCKT.
Teknik KG-SM digunakan untuk mengetahui dugaan bobot molekul dari senyawa isolat. Berdasarkan hasil karakterisasi menggunakan KG-SM didapatkan 5 buah senyawa dalam fraksi, yang diidentifikasi berdasarkan pustaka. Xantorizol sebagai senyawa utama karena puncak xantorizol yang dihasilkan memiliki % area tertinggi. (Lampiran 2). Xantorizol teridentifikasi pada waktu retensi 13.59 menit dengan bobot molekul sebesar 218.2 g/mol (Lampiran 3) dan persen kemiripan struktur dengan pustaka sebesar 91%. Spektrum massa yang dihasilkan memiliki pola fragmentasi yang identik jika dibandingkan dengan spektrum xantorizol yang terdapat pada National Institute Standards and Technology
(NIST) (2011) sehingga dapat disimpulkan bahwa senyawa hasil isolasi adalah xantorizol. Selain dengan KG-SM, karakterisasi juga dilakukan dengan menggunakan KCKT untuk mengetahui persen kemurnian dari sampel. Berdasarkan karakterisasi menggunakan KCKT (Lampiran 4), persen kemurnian sampel diperoleh sebesar 85.42%.
Penyiapan Larutan Sampel Temu Lawak
dapat mengekstrak lebih banyak kurkuminoid dan xantorizol yang terdapat pada rimpang temu lawak.
Pengoptimuman Kondisi KCKT
Pengoptimuman kondisi untuk pemisahan kurkuminoid dan xantorizol pada KCKT dilakukan untuk menghasilkan kromatogram dengan pemisahan yang baik. Faktor terpenting yang dievaluasi dalam pengoptimuman kondisi pemisahan dan pengukuran analit target yaitu komposisi fase gerak yang digunakan. Panjang gelombang deteksi yang digunakan dipilih dari literatur yang ada yaitu 425 nm untuk kurkuminoid (Jangle & Thorat 2013; Rafi et al. 2015) dan 224 nm untuk xantorizol (Nurcholis et al. 2007). Kedua panjang gelombang dipilih karena senyawa yang dianalisis memiliki serapan yang kuat pada daerah panjang gelombang tersebut. Parameter lainnya yang dapat memengaruhi hasil suatu kromatogram adalah kecepatan alir. Kecepatan alir yang digunakan adalah 1 mL/menit. Kondisi tersebut dipilih karena dapat menghasilkan keterpisahan yang baik dalam pemisahan senyawa kurkuminoid (Rafi et al. 2015). Selanjutnya dilakukan pengoptimuman komposisi fase gerak dan konsentrasi fase gerak yang digunakan agar pemisahan analit target memiliki nilai resolusi ≥ 1.50.
Kondisi pemisahan dilakukan menggunakan kolom Phenomenex C18 dengan sistem elusi gradien. Fase diam C18 dipilih karena banyak digunakan pada pemisahan senyawa fenolik dalam beragam jenis matriks, dengan daya pemisahan yang sangat baik untuk senyawa yang berbeda dalam suatu bahan uji (Valls et al.
2009). Fase gerak yang digunakan pada sistem elusi gradien adalah asetonitril dan asam asetat. Pelarut asetonitril merupakan pelarut dengan UV-cut off yang rendah dan memiliki tekanan balik yang rendah terhadap kolom sehingga dapat menghasilkan keterpisahan yang baik dalam kromatogram. Penggunaan larutan asam asetat sebagai fase gerak juga akan meningkatkan pemisahan pada kurkuminoid sehingga resolusi dan bentuk puncak yang dihasilkan semakin baik (Cheng 2010).
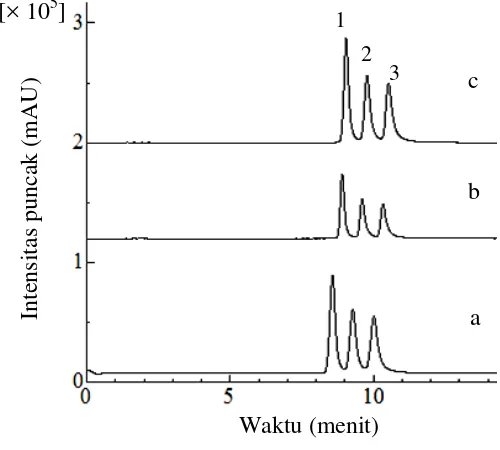
Pengoptimuman awal dilakukan secara terpisah antara standar kurkuminoid dan xantorizol untuk memudahkan identifikasi waktu retensi pada masing-masing senyawa (Lampiran 5). Komposisi fase gerak yang digunakan pada optimasi awal adalah asetonitril (A) dan asam asetat 0.005% (B) dengan perbandingan 45−80% (A) selama 30 menit. Pada kondisi tersebut (Gambar 2), resolusi puncak bisdemetoksikurkumin terhadap demetoksikurkumin sebesar 1.77 dan resolusi puncak demetoksikurkumin terhadap kurkumin sebesar 1.63.
pada masing-masing kondisi, maka kondisi 45−85% (A) selama 35 menit digunakan sebagai kondisi optimum dalam analisis kurkuminoid.
Gambar 2 Profil kromatogram standar bisdemetoksikurkumin (1), demetoksikurkumin (2), dan kurkumin (3) dengan konsentrasi masing-masing standar 5 g/mL. Fase gerak yang digunakan asetonitril dan asam asetat 0.005% pada kondisi 45−80% (A) pada menit 0−30 menit (a), 45−85% (A) pada menit 0−35 menit (b), 45−85% (A) pada menit 0−40 menit (c) dengan kecepatan alir sebesar 1 mL/menit dan dideteksi pada panjang gelombang 425 nm.
Kondisi optimum yang telah didapatkan pada analisis kurkuminoid selanjutnya digunakan untuk pemisahan xantorizol. Kromatogram standar xantorizol disajikan pada Gambar 3. Berdasarkan Gambar 3, xantorizol teretensi hingga waktu 25.60 menit dengan resolusi > 1.50. Perbedaan waktu retensi yang besar antara senyawa kurkuminoid dan xantorizol memungkinkan dilakukannya analisis simultan menggunakan komposisi tersebut karena tidak terjadi tumpang tindih puncak kromatogram masing-masing senyawa.
a b c
Waktu (menit)
1 2
3
Inte
nsit
as punc
ak (
mA
U
)
Gambar 3 Profil kromatogram standar xantorizol (4) dengan konsentrasi 170.84 g/mL. Fase gerak yang digunakan asetonitril dan asam asetat 0.005% pada kondisi 45−85% (A) pada menit 0−35 menit dengan kecepatan alir sebesar 1 mL/menit dan dideteksi pada panjang gelombang 224 nm.
Selain komposisi fase gerak juga dilakukan pengoptimuman konsentrasi asam asetat yang digunakan untuk meningkatkan sensitivitas dan keterpisahan masing-masing senyawa. Menurut Cheng (2010) penggunaan asam asetat 0.5% dapat meningkatkan keterpisahan antar puncak senyawa kurkuminoid. Sehingga pada optimasi ini dilakukan variasi konsentrasi asam asetat pada konsentrasi sebesar 0.005%, 0.05%, dan 0.5%. Gambar 4 menunjukkan bahwa resolusi antar puncak senyawa kurkuminoid meningkat 10% dengan bertambahnya konsentrasi asam asetat.
Gambar 4 Profil kromatogram standar bisdemetoksikurkumin (1), demetoksikurkumin (2), dan kurkumin (3) dengan konsentrasi masing-masing standar 5 g/mL. Fase gerak yang digunakan asetonitril dan asam asetat 0.5% (a), asetonitril dan asam asetat 0.05% (b), asetonitril dan asam asetat 0.005% (c).
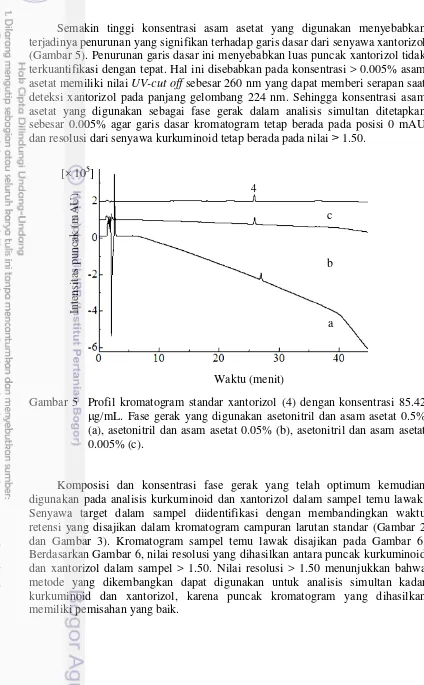
Semakin tinggi konsentrasi asam asetat yang digunakan menyebabkan terjadinya penurunan yang signifikan terhadap garis dasar dari senyawa xantorizol (Gambar 5). Penurunan garis dasar ini menyebabkan luas puncak xantorizol tidak terkuantifikasi dengan tepat. Hal ini disebabkan pada konsentrasi > 0.005% asam asetat memiliki nilai UV-cut off sebesar 260 nm yang dapat memberi serapan saat deteksi xantorizol pada panjang gelombang 224 nm. Sehingga konsentrasi asam asetat yang digunakan sebagai fase gerak dalam analisis simultan ditetapkan sebesar 0.005% agar garis dasar kromatogram tetap berada pada posisi 0 mAU dan resolusi dari senyawa kurkuminoid tetap berada pada nilai ˃ 1.50.
Gambar 5 Profil kromatogram standar xantorizol (4) dengan konsentrasi 85.42 g/mL. Fase gerak yang digunakan asetonitril dan asam asetat 0.5% (a), asetonitril dan asam asetat 0.05% (b), asetonitril dan asam asetat 0.005% (c).
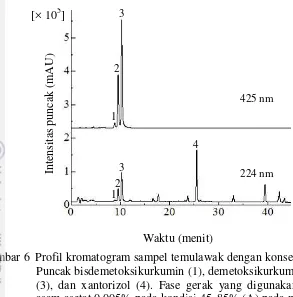
Komposisi dan konsentrasi fase gerak yang telah optimum kemudian digunakan pada analisis kurkuminoid dan xantorizol dalam sampel temu lawak. Senyawa target dalam sampel diidentifikasi dengan membandingkan waktu retensi yang disajikan dalam kromatogram campuran larutan standar (Gambar 2 dan Gambar 3). Kromatogram sampel temu lawak disajikan pada Gambar 6. Berdasarkan Gambar 6, nilai resolusi yang dihasilkan antara puncak kurkuminoid dan xantorizol dalam sampel > 1.50. Nilai resolusi > 1.50 menunjukkan bahwa metode yang dikembangkan dapat digunakan untuk analisis simultan kadar kurkuminoid dan xantorizol, karena puncak kromatogram yang dihasilkan memiliki pemisahan yang baik.
Waktu (menit)
a b c
Inte
nsit
as punc
ak (mA
U)
[× 105]
Gambar 6 Profil kromatogram sampel temulawak dengan konsentrasi 10 g/mL.
Puncak bisdemetoksikurkumin (1), demetoksikurkumin (2), kurkumin (3), dan xantorizol (4). Fase gerak yang digunakan asetonitril dan asam asetat 0.005% pada kondisi 45−85% (A) pada menit 0−35 menit dengan kecepatan alir sebesar 1 mL/menit dan dideteksi pada panjang gelombang 425 nm dan 224 nm.
Kesesuaian Sistem (System Suitability)
Kesesuaian sistem dievaluasi untuk mengetahui bahwa kinerja sistem telah memenuhi standar yang dibutuhkan. Uji kesesuaian sistem dilakukan menggunakan standar campuran kurkumin (CUR), demetoksikurkumin (DMC), bisdemetoksikurkumin (BDMC), dengan konsentrasi sebesar 5 g/mL dan 85.42 g/mL untuk xantorizol (XNT). Simpangan baku relatif (SBR) dari waktu retensi, luas puncak, faktor kapasitas, faktor ikutan, dan jumlah pelat teoretis dievaluasi untuk menentukan kesesuaian sistem. Berdasarkan Tabel 1, %SBR untuk semua parameter yang diuji pada kesesuaian sistem diketahui kurang dari 2.70%, kecuali untuk faktor kapasitas xantorizol didapatkan %SBR sebesar 3.42%. Hal ini mengindikasikan variasi yang rendah terhadap pemisahan kurkuminoid dan xantorizol.
Tabel 1 Uji kesesuaian sistem untuk penentuan kurkuminoid dan xantorizol
lanjutan Tabel 1
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Validasi Metode untuk Analisis Kuantitatif Kurkuminoid dan Xantorizol
Validasi metode untuk analisis kuantitatif kurkuminoid dan xantorizol dilakukan untuk mengonfirmasi bahwa metode yang telah dikembangkan dapat digunakan sesuai dengan tujuan yang diinginkan. Parameter yang dievaluasi dalam validasi metode meliputi linearitas, limit deteksi, limit kuantisasi, ketelitian, ketepatan, dan stabilitas. Penentuan linearitas diuji dengan cara membuat kurva hubungan antara konsentrasi standar pada sumbu x dan luas puncak pada sumbu y. Rentang konsentrasi yang digunakan adalah 0.5−50 g/mL untuk kurkumin, demetoksikurkumin, bisdemetoksikurkumin dan 10.68−683.9 g/mL untuk standar xantorizol. Tabel 2 menyajikan persamaan regresi linear dari masing-masing kurva standar. Linearitas kurva kalibrasi dinyatakan dalam koefisien korelasi (r). Berdasarkan Tabel 2, linearitas kurva yang dihasilkan lebih dari 0.9900. Hal ini menunjukkan bahwa nilai r yang dihasilkan telah memenuhi standar yang telah ditetapkan oleh AOAC (2013), yakni sebesar 0.9900. Hal ini menunjukkan bahwa metode yang digunakan dapat mengukur respon yang sebanding dengan kadar analit dalam larutan uji.
rendah menunjukkan bahwa metode yang digunakan memiliki sensitivitas yang baik. Perhitungan limit deteksi dan limit kuantisasi disajikan pada Lampiran 8.
Tabel 2 Linearitas, LD, dan LK untuk analisis kuantitatif kurkuminoid dan xantorizol
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol. bLD: limit deteksi, LK: limit kuantisasi.
Tabel 3 menyajikan data untuk parameter ketelitian, ketepatan dan stabilitas sampel. Penentuan ketelitian dilakukan sebanyak enam kali ulangan dan diukur pada hari yang sama. Ketelitian yang dilakukan merupakan kedapatulangan karena dilakukan oleh operator, instrumen, peralatan, dan laboratorium yang sama. Kedapatulangan dapat digunakan untuk mengetahui adanya galat acak yang berasal dari preparasi contoh, seperti penimbangan, ekstraksi contoh dan pembuatan larutan. Berdasarkan Tabel 3 dapat diketahui bahwa rerata %SBR yang didapatkan kurang dari nilai yang telah ditetapkan oleh AOAC, yakni 3.70%. Hal ini menunjukkan bahwa metode analisis yang digunakan memiliki ketelitian yang baik. Perhitungan ketelitian disajikan pada Lampiran 9.
Tabel 3 Penentuan ketelitian, ketepatan, dan stabilitas metode
Analita Ketelitian
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.bTiga variasi konsentrasi standar kurkuminoid (0.5; 1; 2
g/mL) dan xantorizol (10.68; 21.36; 42.71 g/mL) yang ditambahkan ke dalam larutan sampel dan masing-masing pengukuran dilakukan tiga kali ulangan. cUntuk 6 kali ulangan pada waktu 0, 4, 8, 12, 24, dan 48 jam setelah ekstraksi sampel.
metode yang digunakan dalam analisis memiliki ketepatan yang baik. Perhitungan nilai PK disajikan pada lampiran 10.
Uji stabilitas dilakukan untuk mengetahui kestabilan analit yang terdapat dalam larutan sampel. Uji stabilitas juga dapat menunjukkan keandalan suatu metode analisis dengan mempertimbangkan variasi dalam parameter metode. Stabilitas ditentukan dengan menganalisis larutan sampel pada interval waktu tertentu setelah ekstraksi. Berdasarkan Tabel 3 dapat diketahui bahwa analit stabil dalam larutan sampel dengan nilai SBR berkisar antara 0.37−2.56% untuk semua senyawa. Nilai %SBR yang lebih tinggi pada xantorizol menunjukkan bahwa analisis sampel yang mengandung xantorizol harus dilakukan sesaat setelah preparasi.
Penentuan Kadar Kurkuminoid dan Xantorizol dalam Sampel Temu Lawak
Penentuan kadar kurkuminoid dan xantorizol dilakukan pada masing-masing sampel dengan tiga kali ulangan. Sampel temu lawak yang dianalisis berasal dari kebun biofarmaka dengan umur tanam masing-masing 9 dan 12 bulan, serta sampel temu lawak yang berasal dari wonogiri. Berdasarkan Tabel 4 dapat diketahui bahwa kandungan kurkuminoid dan xantorizol tertinggi terdapat pada sampel temu lawak yang berumur 12 bulan.
Tabel 4 Kadar kurkuminoid dan xantorizol dalam sampel temu lawak Sampel temu lawak Kadar analit
a
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Perbedaan kandungan bioaktif dalam sampel dipengaruhi oleh beberapa faktor, seperti faktor genetik dan lingkungan tumbuh tanaman temu lawak (Nurcholis et al. 2012). Menurut Ferry et al. (2009), kadar kurkuminoid dan minyak atsiri optimum tercapai saat rimpang berumur 10−12 bulan.
SIMPULAN
SARAN
Fraksionasi lanjutan perlu dilakukan untuk memperoleh kemurnian senyawa yang lebih tinggi pada isolasi xantorizol. Selain itu optimasi ekstraksi juga perlu dilakukan untuk meningkatkan rendemen kurkuminoid dan xantorizol yang diperoleh.
DAFTAR PUSTAKA
Aguilar MI, Nadia O, Israel B, Andres N, Robert B. 2007. Development validation of a liquid chromatography method for quantification of xanthorrhizol in roots of Iostephane heterophylla (Cav.) Benth ex Hemsl. J AOAC Int. 90(4): 892-896.
Angelika, Gratzfeld-Hüsgen, Rainer Schuster. 2001. HPLC for Food Analysis. Jerman (DE): Agilent Technologies Company.
Anubala S, R Sekar, Nagaiah K. 2014. Development and validation of an analytical method for the separation and determination of major bioactive curcuminoids in Curcuma longa rhizomes and herbal products using non aqueous capillary electrophoresis. Talanta. 123: 10-17. doi:10.1016/j.talanta.2014.01.017.
[AOAC] Association of Official Analytical Chemistry. 2013. Guidelines for Single Laboratory Validation of Chemical Methods for Dietary Supplements and Botanicals [Internet]. [diunduh 2015 Jan 16]. Tersedia pada: http://www.eoma.aoac.org/app_k.pdf.
Bahmani M, Kourosh S, Mahmoud RK, Seyed AK, Zohre E, Mahyar J. 2014. The most common herbal medicines affecting Sarcomastigophora branches: a review study. APJTM. 7 (1): S14-S21. doi: 10.1016/S19957645(14)60198-X.
Cheah YH, Fariza JN, Rozie S, Thiam TT, Hawariah LPA, Hasnah MS, Badrul AAR, Noor RA, Zakiah I. 2009. Combined xanthorrhizol-curcumin exhibits synergistic growth inhibitory activity via apoptosis induction in human breast cancer cell MDA-MB-231. Cancer Cell Int. 9(1): 1-12. doi: 10.1186/1475-2867-9-1.
Cheng J, Kong W, Luo Y, Wang J, Wang H, Li Q, Xiao X. 2010. Development and validation of UPLC method for quality control of Curcuma linn.: Fast simultaneous quantitation of curcuminoids. J Pharm Biomed Anal. 53(1): 43-49. doi: 10.1016/j.jpba.2010.03.021.
Cho JY. Jae-Kwan H. Hyang SC. 2011. Xanthorrhizol attenuates dextran sulfate sodium-induced colitis via the modulation of the expression of inflammatory genes in mice. Life Sci. 88(19-20): 864-870. doi:10.1016/j.lfs.2011.03.007.
Ferry Y, Bambang ET, Enny R. 2009. Pengaruh intensitas cahaya dan umur panen terhadap pertumbuhan, produksi, dan kualitas hasil temu lawak di antara tanaman kelapa. Bul Littro. 20(2): 131-140.
Helen MPA, Susheela GK, Jayasree S, Nizzy AM, Rajagopal B, Jeeva S. Phytochemical characterization and antimicrobial activity of Curcuma xanthorrhiza Roxb. Asian Pac J Trop Biomed. 2(2): 637-640. doi: 10.1016/S2221-1691(12)60288-3.
Herdiyanto. 2014. Pengoptimuman metode ekstraksi dan isolasi xantorizol dari temu lawak (Curcuma xanthorrhiza Roxb.) [skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Hwang JK, JS Shim, YR Pyun. 2000. Antibacterial activity of xanthorrhizol from
Curcuma xanthorrhiza against oral pathogens. Fitoterapia. 71(3): 321-323. doi:10.1016/S0367-326X(99)00170-7.
Itokawa H, Qian S, Toshiyuki A, Susan L Morris-Natschke, Kuo-Hsiung Lee. 2008. Recent advances in the investigation of curcuminoids. Chin Med. 3(11). doi: 10.1186/1749-8546-3-11.
Jangle RD & BN Thorat. 2013. Reversed-phase high-performance liquid chromatography method for analysis of curcuminoids and curcuminoid- loaded liposome formulation. Indian J Pharm Sci. 75(1): 60-66. doi:0.4103/0250-474X.113555.
Karioti A, Elisa F, Franco FV, Anna RB. 2011. Analysis and stability of the constituents of Curcuma longa and Harpagophytum procumbens tinctures by HPLC-DAD and HPLC- ESI-MS. J Pharm Biomed Anal. 55(3) : 479-486. doi:10.1016/j.jpba.2011.02.029.
Li R, Cheng X, Min Y, Hui-Fang Li, Xing Z, De-An Guo. 2011. Qualitative and quantitative analysis of curcuminoids in herbal medicines derived from
Curcuma species. Food Chem. 126(4): 1890-1895. doi: 10.1016/j.foodchem.2010.12.014.
Lim CS, DQ Jin, H Mok, SJ Oh, JU Lee, JK Hwang, I Ha, JS Han. 2005. Antioxidant and antiinflammatory activities of xanthorrizol in hippocampal neurons and primary cultured microglia. J Neurosci Res. 82: 831-838. doi: 10.1002/jnr.20692.
Long Y, Wenpeng Z, Fang W, Zilin C. 2013. Simultaneous determination of three curcuminoids in Curcuma longa L. by high performance liquid chromatography coupled with electrochemical detection. J Pharm Anal. 4(5): 325-330. doi: 10.1016/j.jpha.2013.10.002.
Mishra S, Kalpana P. 2008. The effect of curcumin (turmeric) on Alzheimer’s disease: An overview. Ann Indian Acad Neurol. 11(1): 13-19. doi: 10.4103/0972-2327.40220.
[NIST] National Institute Standard Technology. 2011. Material Measurement Laboratory: Phenol, 5-(1,5 dimethyl-4-hexenyl)-2-methyl-, (R)-. [Internet] [diunduh 2015 September 10]. Tersedia pada: http://webbook.nist.gov/cgi/cbook.cgi?ID=C30199269&Mask=200.
Nurcholis W, Edy DP, Mono R, Latifah KD. 2012. Variasi bahan bioaktif dan bioaktivitas tiga nomor harapan temu lawak pada lokasi budidaya berbeda. J Agron Indones. 40(2): 153-159.
Rafi M, Laela W, Rudi H, Latifah KD, Lee WL, Toyohide T. 2015.
discrimination of Curcuma xanthorrhiza from Curcuma longa by high- performance liquid chromatography-diode array detector. Food Anal. Method. 8(9): 2185-2193. doi: 10.1007/s12161-015-0110-1.
Rohaimi AH, Marina SM, Sabariah I, Roziahanim M. 2012. Standardization and phytochemical studies of Curcuma xanthorrhiza. Int J Pharm Pharm Sci.
4(3): 606-610.
Rukayadi Y, Dongeun Y, JK Hwang. 2006. In vitro anticandidal activity of xanthorrhizol isolated from Curcuma xanthorrhiza Roxb. JAC. 1-4. doi:10.1093/jac/dkl132.
Tistaert C, Bieke D, Yvan VH. 2011. Chromatographic separation techniques and data handling methods for herbal fingerprints: a review. Anal Chim Acta. 690: 148-161. doi: 10.1016/j.aca.2011.02.023.
Valls J, Silvia M, M Pilar Marti, Eva B, Lluis A. 2009. Advanced separation methods of food anthocyanins, isoflavones and flavonols. J Chromatogr A.
LAMPIRAN
Lampiran 1 Diagram alir penelitian
Penyiapan Larutan Standar Sonikasi
Optimasi Kondisi Alat Kromatografi
Uji Kesesuaian Sistem
Deret standar dibuat dengan 6 konsentrasi berbeda dalam rentang konsentrasi 0.5−50 g/mL
(kurkuminoid) dan 10.68−683.36 g/mL (xantorizol)
Elusi gradien dengan pelarut: Asetonitril:Asam Asetat 0.005%
Penentuan kadar kurkuminoid dan xantorizol pada ekstrak
temu lawak
Pelarut: Metanol Nisbah bahan:pelarut 1:200 selama 60 menit
Penyiapan Larutan Sampel Isolasi Xantorizol
Validasi Metode
50 100 150 200 250 300 350 400 450 500 550 0
200000 400000 600000 800000 1000000 1200000 1400000 1600000 1800000
m/z--> Abundance
Scan 882 (13.580 min): SAMPLE 1.D\data.ms
136.1
218.2
91.1 41.1
175.2
281.1 341.1 403.1 451.0 503.5 553.2
8.00 10.00 12.00 14.00 16.00 18.00 20.00 22.00 24.00 26.00 28.00 30.00 32.00 1000000
2000000 3000000 4000000 5000000 6000000 7000000 8000000 9000000
Time--> Abundance
TIC: SAMPLE 1.D\data.ms
12.55212.61113.05013.330 13.587
Lampiran 2 Kromatogram KG-SM senyawa isolat yang diduga xantorizol
Lampiran 4 Profil kromatogram standar xantorizol 170.84 g/mL
Lampiran 5 Pengoptimuman komposisi fase gerak
a) Kromatogram standar kurkuminoid 5 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.005% (45−80%) selama 30 menit
b) Kromatogram standar kurkuminoid 5 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.005% (45−85%) selama 35 menit
Puncak Luas puncak Waktu retensi
lanjutan Lampiran 5
c) Kromatogram standar kurkuminoid 5 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.005% (45−85%) selama 40 menit
d) Kromatogram standar xantorizol 170.84 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.005% (45−85%) selama 35 menit
e) Kromatogram standar kurkuminoid 5 g/mL dengan komposisi asetonitril:asam asetat 0.005%
f) Kromatogram standar kurkuminoid 5 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.05%
lanjutan Lampiran 5
g) Kromatogram standar kurkuminoid 5 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.5%
h) Kromatogram standar xantorizol 85.42 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.005%
i) Kromatogram standar xantorizol 85.42 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.05%
j) Kromatogram standar xantorizol 85.42 g/mL dengan komposisi fase gerak asetonitril:asam asetat 0.5%
lanjutan Lampiran 5
k) Kromatogram sampel temu lawak dengan komposisi fase gerak asetonitril:asam asetat 0.005% (45−85%) selama 35 menit
Keterangan
1: Puncak bisdemetoksikurkumin 2: Puncak demetoksikurkumin 3: Puncak kurkumin
4: Puncak xantorizol
Lampiran 6 Uji kesesuaian sistem menggunakan standar kurkuminoid (5 g/mL) dan standar xantorizol (85.42 g/mL)
Lanjutan Lampiran 6
Analita Ulangan Luas puncak
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Contoh perhitungan standar bisdemetoksikurkumin (BDMC) ulangan 1:
Simpangan Baku (SB) =
0. 4
SBR (%) = SB 00 .58%
Keterangan
xi : Waktu retensi ulangan ke-i
x : Rerata waktu retensi
n : Banyaknya ulangan (n = 5)
Lampiran 7 Linearitas standar kurkuminoid dan xantorizol
Analita Konsentrasi standar
a
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Kurva kalibrasi standar bisdemetoksikurkumin (BDMC)
Kurva kalibrasi standar demetoksikurkumin (DMC)
y = 272760x - 187424
Konsentrasi bisdemetoksikurkumin (g/mL)
y = 197688x - 59747
Konsentrasi demetoksikurkumin (g/mL) Lanjutan Lampiran 7
Analita Konsentrasi standar
lanjutan Lampiran 7
Kurva kalibrasi standar kurkumin (CUR)
Kurva kalibrasi standar xantorizol (XNT)
Lampiran 8 Penentuan LD dan LK berdasarkan S/N
a
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Konsentrasi kurkumin (g/mL)
y = 5338.6x + 31255
Konsentrasi xantorizol (g/mL)
lanjutan Lampiran 8
Contoh perhitungan LD dan LK analit BDMC: LD = 3 × konsentrasi standar (
Lampiran 9 Penentuan ketelitian berdasarkan kadar masing-masing analit
a
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Contoh perhitungan bisdemetoksikurkumin (BDMC) ulangan 1:
lanjutan Lampiran 9 FP : Faktor pengenceran
Lampiran 10 Penentuan ketepatan berdasarkan perolehan kembali dan SBR (%) masing-masing analit berdasarkan kadar (g/g)
lanjutan Lampiran 10 1484571.55 42.71 103.31 a
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Contoh perhitungan BDMC dengan konsentrasi standar yang ditambahkan 0.5 g/g (ulangan 1):
Cf : Konsentrasi BDMC total setelah penambahan standar
Cu : Konsentrasi BDMC dalam sampel sebelum penambahan standar Ca : Konsentrasi standar BDMC
SB = ( - )
2 n
i
lanjutan Lampiran 10
SBR (%) = SB
100% = 2.60% Keterangan
xi : Persen perolehan kembali ulangan ke-i x : Rerata persen perolehan kembali
n : Banyaknya ulangan (n = 3)
Lampiran 11 Penentuan stabilitas sampel berdasarkan SBR (%) kadar analit
Analita Kadar (mg/g) SBR
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Contoh perhitungan analit BDMC:
SB = ( - )
Lampiran 12 Penentuan kadar kurkuminoid dan xantorizol dalam sampel temu lawak
a
Analit; BDMC: bisdemetoksikurkumin, DMC: demetoksikurkumin, CUR: kurkumin, XNT: xantorizol.
Sampel temu lawak Ulangan
lanjutan Lampiran 12
Contoh perhitungan BDMC Biofarmaka-9 bulan ulangan 1
Konsentrasi BDMC (g/mL) = (Luas puncak sampel B intersep B )
Slope B
Konsentrasi BDMC (g/mL) = (202474 87424)
272760
= 1.4377 g/mL Kadar BDMC (g/g) onsentrasi in ek
g
mL olume pengenceran(mL)
bobot sampel (g)
=
.4377 mLg 0 mL
0.0254 g
= 566.02 g/g = 0.57 mg/g Keterangan
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 28 Januari 1994 dari ayah Mujiran dan ibu Sulastri. Penulis adalah putri pertama dari dua bersaudara. Penulis lulus dari SMA Negeri 1 Cibinong pada tahun 2011 dan di tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) Undangan dan diterima di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.