ABSTRACT
EFFECTS OF CELLULASE,α–AMYLASE, AND GLUCOAMYLASE
ENZYME CONCENTRATIONS ON REDUCED SUGAR FROM SOLID CASSAVA WASTE
By
SELVIANA
Solid cassava waste, by product of tapioca industries, contains fiber and starch
which can be used as raw materials of bioethanol production. Both fiber and starch of the cassava solid waste are able to be enzymatically hydrolyzed into
reduced sugar. The fiber is hydrolyzed with cellulase and the starch is hydrolyzed with α–amylase and glucoamylase. Objectives of this research were to find out cellulase, α–amylase, and glucoamylase concentrations yielding the highest concentration of reduced sugar. To achieve the objectives, the fiber of the cassava solid waste was hydrolyzed with 5, 10, 15, 20, and 25 FPU cellulase enzyme at 40oC, pH 4,8 and 200 rpm for 20 minutes. The cassava solid waste, which has
Selviana cellulase concentration was 25 FPU and yileded 32,19 mg reduced sugar/100mL.
A combination of 1,15 µL α-amylase dan 1,10 µL glucoamylase/g the cassava waste dry weight was the best concentration of the enzymes and yielded 62,21 mg
reduced sugar/100mL.
ABSTRAK
PENGARUH KONSENTRASI ENZIM SELULASE,α–AMILASE DAN
GLUKOAMILASE TERHADAP KADAR GULA REDUKSI DARI ONGGOK
Oleh SELVIANA
Onggok, yang merupakan limbah padat industri tapioka, mengandung serat dan
pati yang dapat dijadikan sebagai bahan baku pembuatan bioetanol. Serat onggok dapat dihidrolisis dengan enzim selulase, sedangkan pati onggok dapat dihidrolisis dengan enzim α–amilase dan enzim glukoamilase. Tujuan penelitian ini yaitu untuk mendapatkan konsentrasi enzim selulase, α–amilase dan glukoamilase yang terbaik dalam menghasilkan kadar gula reduksi tertinggi dari onggok. Untuk
mencapai tujuan tersebut, serat onggok dihidrolisis dengan 5, 10, 15, 20, dan 25 FPU enzim selulase pada suhu 40oC, pH 4,8 dan goyangan 200 rpm selama 20 menit. Onggok yang telah dihidrolisis dengan enzim selulase pada konsentrasi
terbaik dihidrolisis lagi dengan 0,58; 1,15; dan 1,37 µlenzim α-amilase dan 1,1 µl enzim glukoamilase /g berat kering onggok dengan 3 kali ulangan. Setelah
Selviana bentuk tabel dan grafik, kemudian dibahas secara deskriptif. Hasil penelitian
menunjukkan bahwa konsentrasi enzim selulase terbaik yaitu 25 FPU dan menghasilkan kadar gula reduksi tertinggi, yaitu 32,19 mg/100 mL. Kombinasi
1,15 µL enzim α-amilase dan 1,1 µL enzim glukoamilase per g berat kering onggok merupakan konsentrasi terbaik untuk menghidrolisis onggok hasil hidrolisis 25 FPU enzim celulase. Gula reduksi yang dihasilkan yaitu sebanyak
62,21 mg/100 ml.
PENGARUH KONSENTRASI ENZIM SELULASE, α–AMILASE DAN GLUKOAMILASE TERHADAP KADAR GULA REDUKSI DARI
ONGGOK
Oleh SELVIANA
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA TEKNOLOGI PERTANIAN
Pada
Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
PENGARUH KONSENTRASI ENZIM SELULASE, α–AMILASE DAN GLUKOAMILASE TERHADAP KADAR GULA REDUKSI DARI
ONGGOK (Skripsi)
Oleh
SELVIANA
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
Judul Skripsi : PENGARUH KONSENTRASI ENZIM SELULASE, α–AMILASE DAN
GLUKOAMILASE TERHADAP KADAR GULA REDUKSI DARI ONGGOK
Nama Mahasiswa : Selviana
Nomor Pokok Mahasiswa : 0914051070
Program Studi : Teknologi Hasil Pertanian
Fakultas : Pertanian
MENYETUJUI 1. Komisi Pembimbing
Ir. Marniza, M.Si. Ir. Sutikno, M.Sc.,Ph.D.
NIP. 19650705 199003 2 001 NIP. 19560114 198603 1 002
2. Ketua Jurusan Teknologi Hasil Pertanian
MENGESAHKAN
1. Tim Penguji
Ketua : Ir. Marniza, M.Si. ...
Sekretaris : Ir. Sutikno, M.Sc.,Ph.D. ...
Penguji
Bukan Pembimbing : Dr. Sri Hidayati., S.T.P., M.P. ...
2. Dekan Fakultas Pertanian
Prof. Dr. Ir. Wan Abbas Zakaria, M.S. NIP 19610826 198702 1 001
RIWAYAT HIDUP
Penulis dilahirkan di Pasar Baru, Kecamatan Kota Agung Kabupaten Tanggamus pada tanggal
30 April 1990 dan merupakan anak pertama dari tiga bersaudara dari pasangan Bapak Zahruddin dan Ibu Zainah. Penulis menyelesaikan Taman Kanak-kanak di TK Islam Kuripan Kota Agung pada tahun 1996, Sekolah Dasar di SD 3 Kuripan Kota Agung pada tahun 2002, Sekolah
Lanjutan Tingkat Pertama di SLTP Negeri 1 Kota Agung pada tahun 2005 dan Sekolah Menengah Umum di SMA Negeri 1 Kota Agung pada tahun 2008.
Pada bulan Agustus tahun 2009, penulis diterima sebagai mahasiswa Jurusan Teknologi Hasil
Pertanian Fakultas Pertanian Universitas Lampung melalui jalur UM (Ujian Masuk Mandiri). Selama menjadi mahasiswa penulis aktif dalam organisasi kemahasiswaan yaitu menjadi anggota di Wirausaha Exotic Ice Cream THP periode tahun 2012 - 2013. Penulis dipercaya sebagai anggota Bidang Seminar dan Diskusi Himpunan Mahasiswa Jurusan Teknologi Hasil Pertanian Fakultas Pertanian Universitas Lampung (HMJ THP FP Unila) selama periode 2011 – 2012.
Prestasi yang pernah diraih adalah juara 1 Lomba Karya Tulis Ilmiah di HMJ THP pada tahun 2009. Pada tahun 2012 penulis melaksanakan Praktik Umum di PT. Sugar Labinta, di Desa Malangsari Kecamatan Tanjung Sari Kabupaten Lampung Selatan. Kemudian, pada tahun 2012
SANWACANA
Puji dan syukur penulis ucapkan ke hadirat Allah SWT, atas berkat dan kuasa-Nya
penulis dapat menyelesaikan skripsi ini. Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang tulus kepada:
1. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S., selaku Dekan Fakultas
Pertanian Universitas Lampung atas izin yang diberikan kepada penulis. 2. Ibu Ir. Susilawati, M.Si., selaku Ketua Jurusan Teknologi Hasil Pertanian,
Fakultas Pertanian, Universitas Lampung atas nasehat dan izin yang diberikan kepada penulis.
3. Ibu Ir. Marniza, M.Si., selaku pembimbing pertama atas kesempatan,
bimbingan, saran, nasehat, arahan, dan terutama kesabaran yang telah dicurahkan kepada penulis selama penyusunan skripsi ini.
4. Bapak Dr. Ir. Sutikno, M.Sc., selaku pembimbing kedua atas kesediaanya
memberikan bimbingan, arahan, saran dan nasehat selama penyusunan skripsi ini.
5. Ibu Dr. Sri Hidayati, S.T.P., M.P., selaku penguji atas masukan dan saran yang diberikan kepada penulis sampai selesainya skripsi ini.
6. Bapak Dr. Ir. Tanto Pratondo Utomo., selaku pembimbing akademik yang
7. Ibu Ir. Nanti Musita, M.T.A., atas kepercayaan memberikan proyek ini,
bimbingan, bantuan, arahan, dan kesabaran selama penulis menyelesaikan skripsi ini.
8. Papaku (Zahruddin), Mamaku (Zainah), Adikku Siska, Silda dan Aang olan serta keluarga besarku atas cinta, kasih sayang, do’a, dan kesabaran yang kalian curahkan kepada penulis.
9. Para karyawan di BARISTAN : Ibu Antinar, Ibu Lena, Ibu Uni, Mbak Eva O, Mbak Ira, Mbak Eva P, Mbak Via, Mbak Leni, Mbak Amel, Pak Udin, Pak
Muktar, Mas bukhori, Mas Rizki, Mas Kasman, Indah, Kandar dan lainnya yang tidak dapat saya sebutkan satu persatu terimakasih banyak atas bantuan, kebersamaan dan nasehat dalam penelitian yang telah dilakukan oleh penulis.
10. Mbak Untari, Mas Joko, Mas Midi dan Mas Hanafi dan Mbak Rini atas bantuan yang telah diberikan kepada penulis.
11. Teman-teman seperjuanganku “Angkrang Kedinginan” 2009 atas
kebersamaan, persahabatan, persaudaraan, dan semangatnya selama ini, serta kakak-kakak dan adik-adik atas kebersamaan dan persahabatan.
Penulis berharap semoga karya sederhana ini dapat bermanfaat bagi kita semua
dan diridhoi oleh Allah SWT. Amiinya roobal’alamin….
Bandar Lampung, Mei 2014 Penulis
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR... iv
I. PENDAHULUAN ... 1
A. Latar Belakang dan Masalah ... 1
B. Tujuan Penelitian ... 3
C. Kerangka Pikir ... 3
D. Hipotesis ... 6
II. TINJAUAN PUSTAKA... 7
A. Onggok ... 7
B. Kandungan Utama Onggok ... 10
1. Pati ... 10
2. Serat Kasar ... 11
C. Enzim ... 13
D. Enzim Selulase ... 14
E. Enzimα –Amilase ... 16
F. Enzim Glukoamilase ... 17
G. Gula Reduksi ... 18
III. METODE PENELITIAN ... 19
A. Tempat dan Waktu Penelitian ... 19
B. Bahan dan Alat ... 19
C. Metode Penelitian ... 20
D. Pelaksanaan Penelitian ... 21
1. Persiapan Bahan Baku ... 21
2. Penentuan Aktivitas Enzim ... 21
3. Hidrolisis secara enzimatis ... 23
a. Penentuan konsentrasi enzim selulase ... 23
b. Penentuan konsentrasi enzimα-amilase dan enzim glukoamilase ... 24
ii
1. Analisis Gula Reduksi Dengan Metode Nelson–Somogyi ... 26
1.1. Penyiapan kurva standar ... 26
1.2. Penentuan kadar gula reduksi pada contoh ... 27
1.3. Cara pembuatan reagensia ... 27
2. Analisis Kadar Serat Kasar ... 28
3. Analisis Pati ... 29
IV. HASIL DAN PEMBAHASAN... 30
A. Komposisi Onggok ... 30
B. Pengukuran Aktivitas Enzim Selulase ... ... 31
C. Hidrolisis Onggok Secara Enzimatis ... 32
1. Penentuan Konsentrasi Enzim Selulase ... 33
1.1. Kadar gula reduksi ... 33
1.2. Kadar serat onggok sisa hasil hidrolisis ... 35
1.3. Kadar pati onggok sisa hasil hidrolisis ... 36
2. Penentuan Konsentrasi Enzim α-Amilase dan Glukoamilase Setelah Penambahan Enzim Selulase ... 37
2.1. Kadar gula reduksi... 37
2.2. Kadar serat onggok sisa hasil hidrolisis ... 40
2.3. Kadar pati onggok sisa hasil hidrolisis ... 41
V. KESIMPULAN DAN SARAN ... 44
A. Kesimpulan ... 44
B. Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Tabel Halaman
1. Komposisi kimia onggok ... 8
2. Komposisi kimia onggok ... 30
3. Analisis aktivitas enzim selulase (metode Mandels, 1987) ... 52
4. Hasil analisis kadar gula reduksi kurva standar... ... 53
5. Hasil analisis kadar gula reduksi ulangan 1 ... 56
6. Hasil analisis kadar gula reduksi ulangan 2 ... ... 57
7. Hasil analisis kadar gula reduksi ulangan 3 ... ... 58
8. Hasil analisis kadar gula reduksi dan standar deviasi ... ... 59
9. Hasil analisis kadar serat kasar ulangan 1 ... 60
10. Hasil analisis kadar serat kasar ulangan 2 ... ... 61
11. Hasil analisis kadar serat kasar ulangan 3 ... ... 62
12. Hasil analisis kadar serat kasar dan standar deviasi ... ... 63
13. Hasil analisis kadar pati ulangan 1 ... 64
14. Hasil analisis kadar pati ulangan 2 ... ... 65
15. Hasil analisis kadar pati ulangan 3 ... ... 66
DAFTAR GAMBAR
Gambar Halaman
1. Onggok industri tapioka ... ... 8
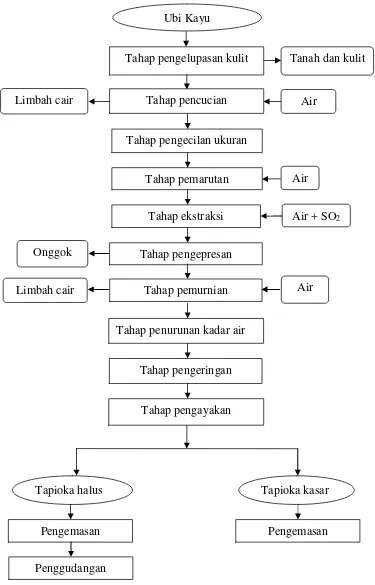
2. Diagram alir proses produksi tapioka di PT. Umas Jaya Agrotama ... 9
3. Struktur amilosa ... 10
4. Struktur amilopektin ... 11
5. Struktur selulosa ... 12
6. Struktur hemiselulosa ... 13
7. Mekanisme hidrolisis selulosa secara enzim selulase ... 15
8. Struktur glukosa (α-D-glukopiranosa) .... ... 18
9. Diagram alir persiapan bahan baku ... 21
10. Hidrolisis onggok oleh enzim selulase ... 24
11. Hasil terbaik tahap pertama dilanjutkan tahap kedua dengan penambahan konsentrasi enzim α-amilase dan enzim glukoamilase ... 25
12. Kadar gula reduksi hasil hidrolisis kertas Whatman No.1 oleh enzim selulase (SQzyme CS P) dengan berbagai pengenceran enzim selulse ... 32
13. Kadar gula reduksi hasil hidrolisis onggok dengan berbagai konsentrasi enzim selulase suhu 40°C, pH 4,8 dan goyangan 200 rpm ... 33
14. Kadar serat kasar onggok tersisa setelah onggok dihidrolisis dengan berbagai konsentrasi enzim selulase suhu 40°C, pH 4,8 dan goyangan 200 rpm ... ... 35 15. Kadar pati onggok tersisa setelah onggok dihidrolisis dengan
v
goyangan 200 rpm ... ... 37
16. Kadar gula reduksi hasil hidrolisis onggok dengan 25 FPU enzim selulase yang dilanjutkan dengan enzimα-amilase dan glukoamilase
pada berbagai konsentrasi ... 38 17. Kadar serat kasar hasil hidrolisis onggok dengan 25 FPU enzim
selulase yang dilanjutkan denganenzim α-amilase dan glukoamilase
pada berbagai konsentrasi ... 40 18. Kadar pati hasil hidrolisis onggok dengan 25 FPU enzim selulase
yang dilanjutkan denganenzim α-amilase dan glukoamilase pada
berbagai konsentrasi ... ... 42 19. Kurva standar pengukuran gula reduksi ... ... 53 20. Bahan baku onggok, enzim selulase, enzimα-amilase dan enzim
glukoamilase ... 68
21. Analisis aktivitas enzim selulase ... 69 22. Analisis kadar gula reduksi hasil hidrolisis onggok dengan 25 FPU
enzim selulase yang dilanjutkan denganα-amilase dan glukoamilase
pada berbagai konsentrasi ... 70 23. Analisis kadar serat hasil hidrolisis onggok dengan 25 FPU enzim
selulase yang dilanjutkan dengan enzimα-amilase dan glukoamilase
pada berbagai konsentrasi ... 71 24. Analisis kadar pati hasil hidrolisis onggok dengan 25 FPU enzim
selulase yang dilanjutkan dengan enzimα-amilase dan glukoamilase
I. PENDAHULUAN
A. Latar Belakang dan Masalah
Industri tapioka merupakan salah satu industri yang cukup banyak menghasilkan limbah padat berupa onggok. Onggok adalah limbah yang dihasilkan pada poses pengolahan singkong menjadi tapioka yang berupa limbah padat utama setelah
pengepresan (Abbaset al., 1985). Onggok yang dihasilkan dari proses pembuatan tapioka berkisar 5%–10% dari bobot bahan bakunya (Lamiya dan Mareta, 2010).
Jumlah onggok yang dihasilkan oleh industri tapioka dapat mencapai 30% (b/b) dari bahan baku (Djarwati dan Sukani, 1993). Jumlah onggok yang dihasilkan oleh pabrik tapioka di Provinsi Lampung yaitu 9.193.676 ton per tahun (BPS
Provinsi Lampung, 2011).
Komposisi onggok dipengaruhi oleh lokasi penanaman, umur panen, varietas ubi kayu, dan proses ekstraksi yang digunakan (Fahmi, 2008). Onggok dari industri besar mengandung 14,54% serat kasar dan 60,60% pati (Nurhayati dkk, 2006),
Menurut Supriyati (2003) komposisi onggok dari industri besar mengandung 31,6% serat dan 51,8% pati. Onggok dari industri kecil yang mengandung serat
kasar sebanyak 8,14% dan pati sebanyak 62,97% (Tjiptadi, 1982).
2
Onggok tidak dapat dikonversi secara langsung sebagai bahan baku bioetanol,
tetapi perlu hidrolisis terlebih dahulu. Hidrolisis dapat dilakukan dengan katalis asam maupun enzimatis. Hidrolisis dengan katalis asam mempunyai kelemahan,
antara lain memerlukan peralatan yang tahan korosi dan terbentuknya senyawa inhibitor seperti furfural, 5-hydroxymethylfurfural (HMF) selama proses hidrolisis asam (Millati dkk, 2002). Hidrolisis enzimatis lebih efektif dilakukan karena
katalis enzim bekerja secara spesifik sehingga hasil hidrolisis dapat dikendalikan, mencegah adanya reaksi sampingan, dan ramah lingkungan. Enzim yang
digunakan untuk menghidrolisis serat adalah enzim selulase dan enzim yang menghidrolisis pati adalah enzim α–amylase dan glukoamilase. Hasil-hasil tersebut berupa gula reduksi yang akan dikonversi oleh Saccaromyces ceriviceae untuk menghasilkan bioetanol.
Pemanfaatan onggok dari industri kecil telah diteliti oleh Silaputri (2011). Penelitian ini menghidrolisis onggok menjdi gula reduksi dengan menggunakan
berbagai konsentrasi enzim selulase. Hidrolisis pada suhu 40 °C dengan pH 4,8 selama 20 menit dan kecepatan 200 rpm menghasilkan konsentrasi enzim selulase yang optimum pada 15 FPU. Kadar gula reduksi tertinggi diperoleh sebanyak
37,273 mg/100mL.
Untuk memanfaatkan onggok dari industri besar dilakukan penelitian dengan menggunakan enzim selulase untuk menghidrolisis serat. Hidrolisis yang
3
meningkatkan kadar gula reduksi. Konsentrasi enzim selulase, α-amilase dan
glukoamilase yang terbaik untuk menghidrolisis serat kasar dan pati untuk industri besar belum diketahui. Oleh karena itu, perlu dilakukan penelitian untuk
mengetahui konsentrasi enzim selulase, α-amilase dan glukoamilase untuk mengkonversi serat kasar dan pati sehingga menghasilkan kadar gula reduksi yang tinggi.
B. Tujuan Penelitian Tujuan penelitian ini adalah
1. Mendapatkan konsentrasi enzim selulase yang menghasilkan kadar gula reduksi tertinggi dari hidrolisis serat kasar onggok.
2. Mendapatkan konsentrasi enzim α-amilase dan glukoamilase yang
menghasilkan kadar gula reduksi tertinggi dari hidrolisis pati onggok.
C. Kerangka Pemikiran
Onggok yang berasal dari industri kecil sudah diteliti sebagai bahan baku pembuatan bioetanol, sedangkan onggok yang berasal dari industri besar belum banyak diteliti sebagai bahan baku pembuatan bioetanol. Dalam pembuatan
bioetanol, serat kasar dan pati dapat dihidrolisis oleh enzim untuk menghasilkan gula reduksi. Serat dapat dihidrolisis dengan enzim selulase, sedangkan pati dapat
dihidrolisis denganenzim α–amylase dan enzim glukoamilase.
exo-1,4-β-D-4
glucanase, yang mengurai selulosa dari ujung pereduksi dan non pereduksi; dan
β–glucosidase yang mengurai selobiosa untuk menghasilkan glukosa (Ikramet al., 2005). Kondisi optimum untuk aktivitas enzim selulase adalah pada pH (tingkat
keasaman) 4,8 dan suhu 40°C (Srinorakutaraet al., 2006).
Enzimα-amilase menghidrolisis ikatan α- 1,4-glukosidik secara spesifik di bagian
dalam molekul baik amilosa maupun amilopektin pada pati. Pada amilosa aktivitas α-amilase menyebabkan pati terputus menjadi dekstrin. Dekstrin kemudian dipotong-potong lagi menjadi campuran antara maltosa dan maltotriosa.
Pada amilopektin enzim α-amilase menghidrolisis pati menjadi glukosa, maltosa
dan berbagai jenis α-limit dekstrin, yaitu oligosakarida yang terdiri dari 4 atau
lebih residu gula yang semuanya mengandung ikatan α-(1,6) (Sivaramakrishnanet al., 2006). Kondisi optimum untuk aktivitas enzim α-amilase yaitu pada pH 5,5; suhu 100°C dan kecepatan 200 rpm (Srinorakutara et al., 2006). Enzim glukoamilase dapat memecah polisakarida (pati, glikogen, dan lain-lain) pada
ikatan α-1,4 dan β-1,6 yang menghasilkan glukosa. Enzim glukoamilase dapat
memecah pati dari ujung non-pereduksi (Kambong, 2004). Kondisi optimum
untuk aktivitas enzim glukoamilase yaitu pada pH 4,5; suhu 60°C dan kecepatan 200 rpm (Srinorakutaraet al., 2006).
Kerja enzim dalam menghidrolisis substrat diantaranya dipengaruhi oleh konsentrasi enzim dan konsentrasi substrat. Semakin tinggi konsentrasi enzim
maka kecepatan reaksi akan semakin meningkat hingga pada batas konsentrasi tertentu. Hasil hidrolisis akan konstan dengan naiknya konsentrasi enzim karena
5
akan meningkat apabila konsentrasi substrat meningkat. Peningkatan kecepatan
reaksi ini akan semakin kecil hingga tercapai suatu titik batas yang pada akhirnya penambahan konsentrasi subtrat hanya akan sedikit meningkatkan kecepatan
reaksi. Hal ini disebabkan semua molekul enzim telah membentuk ikatan kompleks dengan substrat yang selanjutnya dengan kenaikan konsentrasi substrat tidak berpengaruh terhadap kecepatan reaksinya (Lehninger, 1997).
Hasil penelitan Silaputri (2011) dengan bahan baku onggok berasal dari industri kecil menunjukkan bahwa gula reduksi tertinggi dihasilkan pada konsenterasi enzim selulase (Cellulast 1,5 L) 15 FPU. Enzim selulase hanya menghidrolisis
serat sedangkan enzim selulase tidak menghidrolisis pati. Penambahan enzim α-amilase dan glukoα-amilase perlu dilakukan untuk menghidrolisis pati untuk
menghasilkan kadar gula reduksi tertinggi dari onggok. Hasil penelitian (Srinorakutara et al., 2004) menunjukkan gula reduksi tertinggi diperoleh pada konsentrasi enzim α-amilase 0,58 µl/g berat kering onggok dan enzim
glukoamilase 1,1 µl/g berat kering onggok. Berdasarkan hasil penelitian tersebut dilakukan penambahan konsentrasi enzim selulase yang digunakan adalah 5, 10, 15, 20 dan 25 FPU. Perlakuan enzim selulase yang menghasilkan kadar gula
reduksi tertinggi, dilanjutkan dengan penambahan konsentrasi enzim α-amilase 0,58; 1,15; dan 1,37 µl/g berat kering onggok dan penambahan enzim
6
D. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah
1. Konsentrasi enzim selulase 15 FPU menghasilkan kadar gula reduksi tertinggi
dari hidrolisis serat kasar onggok.
2. Konsentrasi enzimα-amilase 0,58 µL/g berat kering onggok dan glukoamilase
II. TINJAUAN PUSTAKA
A. Onggok
Onggok merupakan limbah dari industri tapioka yang berbentuk padatan yang diperoleh pada proses ekstraksi. Pada proses ekstraksi ini diperoleh suspensi pati
sebagai filtratnya dan ampas yang tertinggal sebagai onggok. Adapun komposisi kimia onggok dapat dilihat pada Tabel 1 dan penampakan onggok Gambar 1.
Komponen penting yang terdapat dalam onggok adalah pati dan serat kasar. Pati dan serat kasar yang terdapat di onggok dapat diuraikan secara enzimatis sebagai bahan baku bioetanol. Kandungan ini berbeda untuk setiap daerah tempat
tumbuh, jenis dan mutu ubi kayu, teknologi yang digunakan, dan penanganan ampas itu sendiri (Fahmi, 2008). Proses produksi industri tapioka dapat dilihat
pada Gambar 2
Pada tahun 2011, total produksi singkong di Indonesia mencapai 24.044.025 ton dengan luas lahan 1.184.696 ha, sedangkan total produksi singkong Provinsi
8
.
Gambar 1. Onggok industri tapioka Sumber : Tarmudji, 2009
Tabel 1. Komposisi kimia onggok
Komposisi kimia (%) A B C
Air 14,32 16,86 20,00
Protein 0,80 6,42 1,57
Lemak 0,25 0,25 0,26
Abu - 8,50
-Serat kasar 21,92 8,14 10,00
Pati 60,60 62,97 68,00
Sumber : a. Hendri (1999); b. Tjiptadi (1982); c. Lamiya dan Mareta (2010)
Menurut Kementrian Lingkungan Hidup (2009), industri tapioka skala besar umumnya dengan kapasitas 700 ton per hari dapat menghasilkan tapioka sebanyak
140 ton per hari dan onggok yang dihasilkan sejumlah 175 ton per hari. Berdasarkan jumlah dan kandungannya, onggok mempunyai potensi yang besar
untuk dimanfaatkan menjadi produk yang lebih bernilai, salah satunya diproduksi sebagai bioetanol. Berdasarkan perhitungan menurut Badger (2007), dari total onggok sebesar 2.174.000 ton per tahun diperoleh potensi etanol dapat mencapai
9
Gambar 2. Diagram alirproses produksi tapiokadi PT. Umas Jaya Agrotama Sumber : Prayati (2005)
Tahap pengelupasan kulit
Tahap pemarutan Tahap pengecilan ukuran
Tahap ekstraksi Tahap pencucian
Tahap pengepresan
Tahap pemurnian
Tahap penurunan kadar air
Tahap pengeringan
Tahap pengayakan Onggok
Limbah cair Limbah cair
Air Air
Air
Tapioka halus Tapioka kasar
Air + SO2 Tanah dan kulit Ubi Kayu
Pengemasan Pengemasan
10
B. Kandungan Utama Onggok
Onggok masih memiliki kandungan pati dan serat kasar karena pada saat ekstraksi tidak semua kandungan pati terikut dan tersaring bersama filtrat. Pati dan serat
kasar merupakan komponen karbohidrat dalam onggok yang masih potensial untuk dimanfaatkan.
1. Pati
Pati merupakan polimer dari glukosa yang tersusun atas ikatan α- D-glikosida.
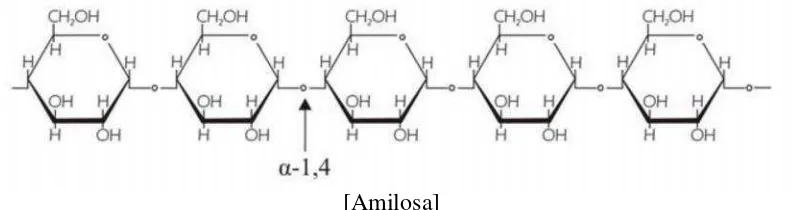
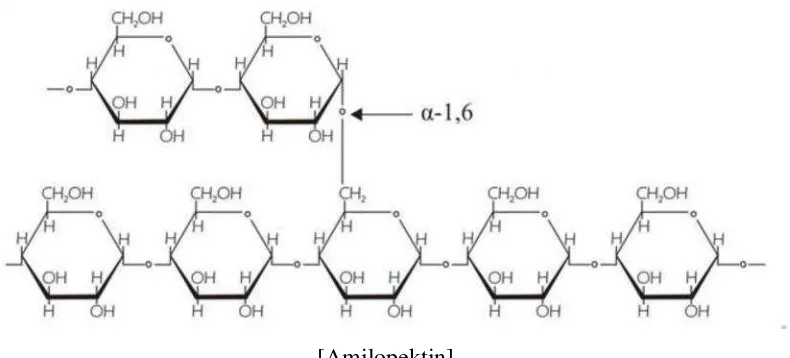
Pati terdiri dari dua komponen utama, yaitu amilosa dan amilopektin. Amilosa
merupakan polimer linear dengan ikatan α-1,4-glukosa. Amilopektin memiliki molekul yang berukuran lebih besar dari amilosa, memiliki ikatan α-1,4-glukosida dan berbentuk cabang pada ikatan α-1,6-glukosida (British Nutrition Foundation, 1990) serta pati alami biasanya mengandung amilopektin lebih banyak daripada amilosa. Butiran pati mengandung amilosa berkisar 15% - 30%, sedangkan
amilopektin berkisar antara 70% - 85% (Jane dan Chen, 1992). Perbandingan
antara amilosa dan amilopektin akan berpengaruh terhadap sifat kelarutan dan
derajat gelatinisasi pati (Jane dan Chen, 1992). Struktur amilosa dapat dilihat
pada Gambar 3 dan struktur amilopektin dapat dilihat pada Gambar 4.
[Amilosa]
11
[Amilopektin]
Gambar 4. Struktur amilopektin Sumber: Suriadi, 1985
2. Serat Kasar
Serat kasar merupakan serat tumbuhan yang tidak dapat larut dalam air. Serat
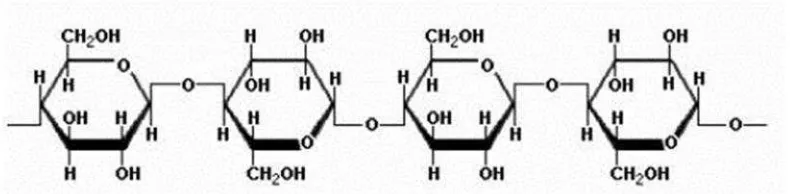
kasar yang terdapat pada onggok mengandung hemiselulosa dan selulosa yang merupakan bagian terbesar dari komponen polisakarida non pati (Arnata, 2009). Selulosa merupakan senyawa organik penyusun utama dinding sel tumbuhan.
Polimer selulosa umumnya tersusun oleh monomer-monomer anhidroglukosa atau glukopiranosa yang saling berhubungan pada posisi atom karbon 1 dan 4 oleh
ikatan β-glukosida. Selulosa termasuk homopolimer linier dengan monomer berupa D-anhidroglukosa yang saling berkaitan dengan ikatan β-1,4-glikosidik. Rumus empiris selulosa adalah (C6H10O5)ndengan n adalah jumlah satuan glukosa
yang berikatan dan berarti juga derajat polimerisasi selulosa. Selulosa murni memiliki derajat polimerisasi sekitar 14.000, namun dengan pemurnian biasanya
12
Gambar 5. Struktur selulosa Sumber : Zamora, 2011
Hemiselulosa adalah polisakarida non selulosa yang pokok, terkandung dalam
serat dengan berat molekul 4000–15.000 (Soenardi, 1976). Hemiselulosa terdapat
dalam serat dan tergolong senyawa organik. Hemiselulosa juga terdapat di dinding
sel bersamaan dengan selulosa, terutama di daerah amorf dan di dalam lamella
tengah (Soenardi, 1976). Hemiselulosa mirip dengan selulosa yang merupakan
polimer gula. Namun, berbeda dengan selulosa yang hanya tersusun dari glukosa, hemiselulosa tersusun dari bermacam-macam jenis gula. Monomer gula penyusun hemiselulosa terdiri dari monomer gula berkarbon 5 (C-5) dan 6 (C-6),
misalnya: xylosa, mannose, glukosa, galaktosa, arabinosa dan sejumlah kecil rhamnosa, asam glukoroat, asam metal glukoronat dan asam galaturonat
(Winarno, 2008). Hemiselulosa lebih mudah dihidrolisis daripada selulosa, tetapi gula C-5 lebih sulit difermentasi. Kandungan hemiselulosa di dalam biomassa lignoselulosa berkisar antara 11% hingga 37% (berat kering biomassa) (Winarno,
2008). Gambar struktur hemiselulosa disajikan dalam Gambar 6.
Perbedaan hemiselulosa dengan selulosa yaitu hemiselulosa mudah larut dalam alkali tapi sukar larut dalam asam, sedangkan selulosa adalah sebaliknya. Rantai
13
xilan, atau terdiri atas dua jenis atau lebih dari satu monomer (heteropolimer),
seperti glukomannan. Rantai molekul hemiselulosa lebih pendek daripada
selulosa(Winarno, 2008).
Gambar 6. Struktur hemiselulosa
Sumber : Fengel dan Wegener, 1995
C. Enzim
Enzim adalah suatu protein yang bertindak sebagai katalisator reaksi biologis atau
lebih sering disebut sebagai biokatalisator (Mahartantri, 2005). Menurut Winarno dan Fardianz, (1984), dengan adanya katalisator enzim suatu reaksi dapat
dipercepat kira-kira 1012 sampai 1020 kali jika dibandingkan dengan reaksi tanpa katalisator. Berdasarkan hukum Michaelis-Menten kecepatan reaksi akan meningkat seiring dengan meningkatnya konsentrasi substrat. Kecepatan reaksi
14
dimana enzim jenuh dengan substrat (Poedjiadi, 1994). Titik batas ini disebut
kecepatan maksimum (Vmax) (Lehninger, 1997).
Faktor-faktor yang mempengaruhi kerja enzim (Poedjiadi, 1994) adalah: 1. Pada suatu konsentrasi substrat tertentu, kecepatan reaksi bertambah dengan
bertambahnya konsentrasi enzim.
2. Dengan konsentrasi enzim yang tetap, perubahan substrat akan menambah
kecepatan reaksi.
3. Kenaikan suhu dapat menyebabkan denaturasi, sehingga bagian aktifnya terganggu, akibatnya konsentrasi spesifik enzim berkurang dan kecepatan
reaksinya turun.
4. Struktur ion enzim tergantung pada pH lingkungannya, enzim dapat terbentuk
ion(+) atau (-) atau bermuatan ganda (switter ion). pH dapat menyebabkan proses denaturasi yang dapat mengakibatkan menurunnya aktivitas enzim. 5. Adanya hambatanirreversibelyang disebabkan oleh terjadinya destruksi atau
modifikasi sebuah gugus fungsi atau lebih, yang terdapat pada molekul enzim. Hambatan reversibel dapat berupa hambatan bersaing dan tak bersaing.
D. Enzim Selulase
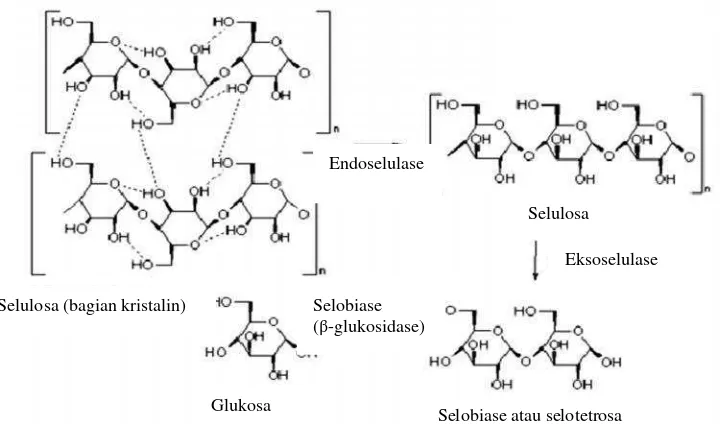
Enzim selulase dapat menghidrolisis ikatan β(1-4) pada selulosa. Hidrolisis enzim selulase merupakan hidrolisis dengan penggabungan tiga tipe enzim, yaitu
15
• Endo-1,4-β-D-glucanase (endoselulase, carboxymethylcellulase atau
CMCase), memotong ikatan rantai dalam selulosa menghasilkan
molekul-molekul selulosa yang lebih pendek.
• Exo-1,4-β-D-glucanase (cellobiohydrolase), mengurai selulosa dari ujung
pereduksi dan non pereduksi untuk menghasilkan selobiosa. • β–glucosidase (cellobiase), mengurai selobiosa menjadi glukosa.
[image:31.595.130.490.294.506.2]Mekanisme hidrolisis selulosa oleh enzim selulase disajikan pada Gambar 7.
Gambar 7. Mekanisme hidrolisis selulosa oleh enzim selulase Sumber: Anonim, 2009
Selulase diproduksi oleh fungi, bakteri, tumbuhan, dan ruminansia. Produksi komersial selulase pada umumnya menggunakan fungi atau bakteri yang telah
diisolasi. Fungi adalah mikroorganisme utama yang dapat memproduksi selulase, meskipun beberapa bakteri dan actinomycetestelah dilaporkan juga menghasilkan selulase. Fungi berfilamen seperti Tricoderma dan Aspergillus adalah penghasil selulase dan crude enzyme secara komersial. Fungi-fungi tersebut sangat efisien dalam memproduksi selulase (Ikramet al.,2005).
Endoselulase
Selulosa
Eksoselulase
Selulosa (bagian kristalin) Selobiase (β-glukosidase)
16
Hasil penelitian Samsuri et al. (2009), menunjukkan kondisi optimum inkubasi untuk aktivitas enzim selulase pada suhu 45°C - 50°C dan pH 4,8; pada pH 4,8 dan suhu 50°C (Gunam et al., 2011); dan pada pH (tingkat keasaman) 4,8 dan suhu 40°C (Srinorakutara et al., 2006).Perbedaan suhu enzim selulase biasanya karena sumber enzim yang berbeda.
E. Enzim α- Amilase
Enzim α-amilase merupakan enzim yang memutuskan ikatan glikosidik pada bagian dalam rantai pati secara acak. Enzim α-amilase hanya spesifik untuk
memutuskan atau menghidrolisis ikatan α-1,4-glikosidik tetapi mampu melewati titik percabangan (ikatan α-1,6-glikosidik) untuk memutuskan ikatan ikatan α -1,4-glikosidik disebrangnya sehingga menghasilkan isomaltase. Hasil hidrolisis pati
dan glikogen oleh α-amilase adalah oligosakarida (maltodekstrin), maltosa, dan sejumlah kecil glukosa yang mempunyai konfigurasi gula α, seperti substrat awal
(Kunamneniet al., 2005).
Mikroorganisme penghasil enzim amilase dapat berupa bakteri dan kapang. Bakteri yang dapat menghasilkan amilase diantaranyaB. Subtilis, B. licheniformis, Aspergillus sp., Bacillus sp., dan Bacillus circulans (Arcinthya, 2007). Bakteri tersebut menghasilkan amilase yang termostabil (suhu 70°C – 100°C), yaitu aktif atau bekerja dalam suhu tinggi sehingga proses hidrolisis menjadi lebih mudah
dan cepat dengan adanya bantuan panas, sehingga proses pemutusan ikatan polisakarida lebih mudah.
Mekanisme kerja α-amilase terjadi melalui dua tahap, yaitu tahap pertama adalah
17
Degradasi ini terjadi sangat cepat dan diikuti dengan menurunnya viskositas
dengan cepat pula. Tahap kedua terjadi pembentukan glukosa dan maltosa sebagai hasil akhir, dan caranya tidak acak. Pada tahap ini pembentukan relatif
sangat lambat. Keduanya merupakan kerja enzim α-amilase pada molekul amilosa saja. Pada amilopektin, kerja α-amilase akan menghasilkan glukosa,
maltosa dan berbagai jenis α-limit dekstrin, yaitu oligosakarida yang terdiri dari 4 atau lebih residu gula yang semuanya mengandung ikatan α-(1,6) (Winarno, 1997). Menurut Tjokroadikoesoemo (1986) pH optimum untuk enzim ± 6 pada
suhu optimum 60°C, pH optimum untuk α-amilase yaitu pada pH 5,5 dan suhu 100°C (Srinorakutara et al., 2006). Perbedaan suhu enzim α-amilase biasanya karena sumber enzim yang berbeda.
F. Enzim Glukoamilase
Enzim glukoamilase merupakan enzim yang mampu memecah ikatan polimer
monosakarida pada bagian luar dan menghasilkan unit-unit glukosa dari ujung non-pereduksi rantai polimer polisakarida. Enzim ini bersifat eksoamilase, yaitu memutuskan rantai pati menjadi molekul-molekul glukosa pada bagian non
pereduksi, baik pada ikatanα-1,4 dan α-1,6 glikosidik (Kearsley, 1995).
18
enzim glukoamilase berkisar 55°C - 66°C dan pH 4 - 4,5. Suhu optimum pada enzim glukoamilase berbeda disebabkan karena sumber enzim.
G. Gula Reduksi
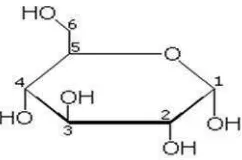
Gula reduksi merupakan monosakarida dengan enam atom C yang disebut heksosa. D-Glukosa terdiri atas gugus polialkohol dan gugus aldehid. Glukosa
memiliki struktur siklik dengan kelompok aldehid (atom kabon 1) dan gugus hidroksil (atom karbon 6) (BeMiller et al., 2008). Karbohidrat yang termasuk dalam gula reduksi adalah semua jenis monosakarida dan beberapa disakarida
yang masih memiliki gugus hidroksil, aldehid atau keton bebas pada atom C1nya (Poedjiadi, 1994).
Salah satu monosakarida yang termasuk gula reduksi adalah glukosa. Glukosa
merupakan aldehida (mengandung gugus -CHO). Lima karbon dan satu oksigennya membentuk cincin yang disebut cincin piranosa, bentuk paling stabil untuk aldosa berkabon enam. Dalam cincin ini, tiap karbon terikat pada gugus
samping hidroksil dan hidrogen kecuali atom kelimanya, yang terikat pada atom karbon keenam di luar cincin, membentuk suatu gugus CH2OH. Struktur cincin
[image:34.595.250.371.625.705.2]ini berada dalam kesetimbangan dengan bentuk yang lebih reaktif pada pH 7 (Anonim, 2009). Struktur glukosa dapat dilihat pada Gambar 8.
III. METODE PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Balai Riset dan Standarisasi Industri Bandar Lampung dan Laboratorium Analisis Hasil Pertanian, Jurusan Teknologi Hasil
Pertanian Fakultas Pertanian Universitas Lampung pada bulan Agustus sampai dengan Desember 2013.
B. Bahan dan Alat
Bahan baku utama yang digunakan yaitu onggok yang diperoleh dari PT. Umas Jaya Agrotama di Lampung Tengah, enzim α-amilase (Thermamyl 120 l), enzim
glukoamilase (Glukoamilase SAN 150 l) diperoleh dari Balai Besar Teknologi Pati (B2TP) di Sulusuban Lampung Tengah, dan enzim selulase (SQzyme CS
P-acid cellulase). Bahan kimia yang digunakan adalah Nelson A, Nelson B, arsenomolibdat, K2SO4 10%, asam sitrat, Na2Co3 anhidrat, CuSO4, natrium tio sulfat 0,1 N, alkohol 96%, air suling, asam sitrat, natrium sitrat, NaOH, HCl,
H2SO4 yang didapatkan dari Balai Riset dan Standarisasi Industri Bandar Lampung.
Alat-alat yang digunakan antara lain shaker inkubator (YIH DER, LM-570D),
20
timbangan 3 digit (Mattler M3000 Swiszerlan), shifter shaker (Endecotts EFL1
Sleve Shaker) ukuran 60 mesh, hot plate (Cimerec3), pH-meter (Eutech), penangas air, pendingin balik, aluminium foil, cawan porselin, desikator, kertas
saring, pipet bubble, serta peralatan gelas seperti corong, erlenmeyer, buret, labu ukur, pipet, cawan petri, cawan forselin, gelas ukur, beaker glass, dan tabung reaksi.
C. Metode Penelitian
Penelitian ini dilakukan dengan dua tahapan, yaitu tahap pertama adalah hidrolisis
onggok menggunakan enzim selulase yang terdiri dari 5 taraf konsentrasi (5, 10, 15, 20 dan 25 FPU) yang dilakukan sebanyak tiga kali ulangan pada suhu 40°C selama 20 menit dengan kecepatan 200 rpm. Perlakuan konsentrasi enzim
selulase pada tahap pertama tersebut dilanjutkan ke tahap kedua. Tahap kedua adalah hidrolisis pati dari sisa hidrolisis tahap pertama dengan konsentrasi enzim
α-amilase 0,58; 1,15; 1,37 µl/g berat kering onggok pada suhu 100°C, pH 5,5 dan selama 2 jam dan enzim glukoamilase 1,1 µl/g berat kering onggok pada suhu 60°C, pH 4,5 selama 24 jam dengan kecepatan 200 rpm yang dilakukan sebanyak
tiga kali ulangan. Sampel yang telah dihidrolisis dengan berbagai perlakuan tersebut kemudian dianalisis kadar gula reduksinya, kadar serat sisa hidrolisis, dan
21
D. Pelaksanaan Penelitian 1. Persiapan bahan baku
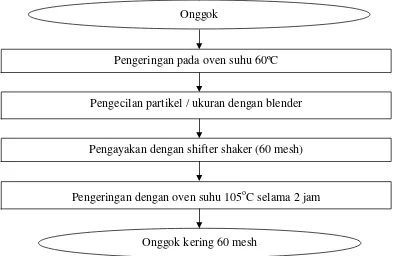
Persiapan bahan baku ditentukan dengan menggunakan metode yang mengacu
pada penelitian Silaputri (2011). Onggok dikeringkan dan dilanjutkan dengan pengecilan ukuran dengan blender dan disaring menggunakan shifter shaker ukuran 60 mesh. Bahan baku yang sudah kering dengan ukuran 60 mesh
selanjutnya dikeringkan kembali pada oven dengan suhu 105°C hingga berat konstan, dan disimpan dalam kondisi kering. Diagram alir persiapan bahan baku
[image:37.595.114.509.342.598.2]dapat dilihat pada Gambar 9.
Gambar 9. Diagram alir persiapan bahan baku Sumber : Silaputri (2011)
2. Penentuan aktivitas enzim
Penentuan aktivitas enzim selulase diuji dengan metode Mandels (1987) yang
dimodifikasi. Sebanyak 0,5 mL enzim selulase dengan pengenceran 101 – 1014 Pengeringan pada oven suhu 60ºC
Pengecilan partikel / ukuran dengan blender
Pengayakan dengan shifter shaker (60 mesh)
Pengeringan dengan oven suhu 105oC selama 2 jam Onggok
22
dicampurkan 1 mL natrium sitrat (0,05 M, pH 4,8) dan dimasukan ke dalam
tabung reaksi, serta dimasukan kertas saring Whatman No.1 dengan ukuran 1x6 cm (50 mg). Tabung reaksi yang sudah berisi enzim selulase dan buffer sitrat
diinkubasi pada suhu 50oC selama 60 menit. Setelah itu didinginkan, filtrat diukur kadar gula reduksi dengan metode Nelson-Somogyi pada panjang gelombang 540 nm. Hasil pengukuran diplotkan pada kurva standar sehingga
didapatkan kadar gula reduksi. Pengenceran enzim yang menghasilkan kadar gula reduksi sebanyak 2 mg dihitung aktivitasnya dengan persamaan Mandels (1987)
sebagai berikut.
Satuan FPU berdasarkan pada International Unit (IU) :
1 IU = 1 µmol.menit-1dari substrat yang dikonversi
= 1 µmol.menit-1dari glukosa (gula reduksi) yang terbentuk selama hidrolisis = 0,18 mg.menit-1glukosa yang diproduksi
Jumlah glukosa yang dilepaskan dalam pengujian aktivitas (FPU) pada pengenceran adalah 2 mg :
2 mg glukosa = 2/0,18 µmol
Jumlah glukosa ini telah dihasilkan oleh 0,5 mL enzim selama 60 menit, dalam
FPU:
2 mg glukosa = 2/0,18 x 0,5 x 60 µmol.menit-1.mL-1 = 0,37 µmol.menit-1.mL-1(IU.mL-1)
Oleh karena itu, perkiraan jumlah enzim (critical enzym concentration= mL.mL1) yang melepaskan 2 mg glukosa dalam FPU mengandung 0,37 unit, dan
23
FPU = 0,37
konsentrasi enzim yang melepaskan 2 mg glukosa /
3. Hidrolisis secara enzimatis
Hidrolisis onggok dilakukan secara enzimatis menggunakan enzim selulase, α -amilase dan gluko-amilase. Hidrolisis dilaksanakan secara bertahap yaitu tahap
pertama untuk menentukan konsentrasi enzim selulase yang menghasilkan kadar gula reduksi tertinggi. Setelah diperoleh hasil terbaik dari tahap pertama tersebut dilanjutkan ke tahap kedua. Tahap kedua, untuk menentukan konsentrasi enzim α
-amilase dan enzim gluko-amilase yang menghasilkan kadar gula reduksi tertinggi.
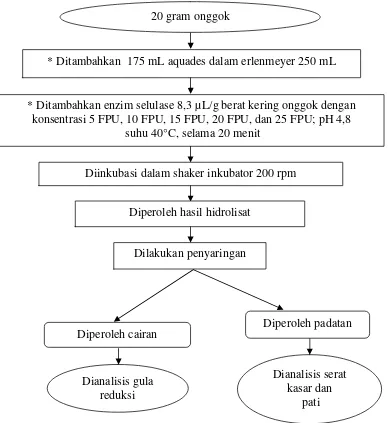
a. Penentuan konsentrasi enzim selulase
Konsentrasi enzim selulase ditentukan dengan menggunakan metode yang mengacu pada penelitian Silaputri (2011). Sebanyak 20 g onggok dimasukkan ke dalam erlenmeyer 250 mL, kemudian ditambahkan aquades volumenya 175 mL.
Enzim selulase ditambahkan sebanyak 8,3 µL/g berat kering onggok dengan konsentrasi 5, 10, 15, 20, dan 25 FPU. Campuran tersebut diinkubasi dalam
shaker inkubator pada suhu 40°C, pH 4,8 dengan goyangan 200 rpm selama 20 menit. Cairan hasil hidrolisis dianalisis gula reduksinya, sedangkan bagian padatannya dikeringkan dan dianalisis kadar serat kasar dan pati (Gambar 10).
Setelah diperoleh hasil terbaik dari tahap pertama dilanjutkan ke tahap kedua dengan penambahan konsentrasi enzim α-amilase dan enzim glukoamilase yang
24
Gambar 10. Hidrolisis onggok oleh enzim selulase
Sumber : Silaputri (2011) dan Srinorakutaraet al. (2004) yang telah dimodifikasi*
b. Penentuan konsentrasi enzimα-amilase dan enzim glukoamilase
Perlakuan terbaik pada tahap pertama dilanjutkan ke tahap kedua dengan penambahan enzim α-amilase sebanyak 0,58; 1,15; dan 1,37 µL/g berat kering
onggok pH substrat 5,5 dan diinkubasi pada waterbath suhu 100°C, goyangan 200 rpm selama 2 jam. Setelah itu, enzim glukoamilase ditambahkan sebanyak
1,1 µL/g berat kering onggok dengan pH substrat 4,5 dan diinkubasi pada shaker 20 gram onggok
* Ditambahkan 175 mL aquades dalam erlenmeyer 250 mL
Diinkubasi dalam shaker inkubator 200 rpm
* Ditambahkan enzim selulase 8,3 µL/g berat kering onggok dengan konsentrasi 5 FPU, 10 FPU, 15 FPU, 20 FPU, dan 25 FPU; pH 4,8
suhu 40°C, selama 20 menit
Dianalisis gula reduksi
Diperoleh hasil hidrolisat
Dilakukan penyaringan
Diperoleh cairan Diperoleh padatan
Dianalisis serat kasar dan
25
inkubator suhu 60°C, goyangan 200 rpm selama 24 jam. Hidrolisat yang
terbentuk disaring untuk memisahkan padatan dan cairan. Bagian padatan dikeringkan dan dianalisis kadar serat kasar dan pati. Bagian cairan dilakukan
[image:41.595.112.509.192.638.2]analisis gula reduksi (Gambar 11).
Gambar 11. Hasil terbaik tahap pertama dilanjutkan tahap kedua dengan penambahankonsentrasi enzim α-amilase dan enzim glukoamilase
Sumber : Silaputri (2011) dan Srinorakutaraet al. (2004) yang telah dimodifikasi*
Konsentrasi enzim selulase yang menghasilkan kadar gula pada tahap pertama reduksi tertinggi
* Ditambahkanenzim α-amylase 0,58; 1,15; dan 1,37 µL/g berat kering onggok pH 5,5; T 100°C, di inkubasi dalam waterbath dengan goyangan 200
rpm selama 2 jam
Dianalisis gula reduksi
Diperoleh hasil hidrolisat
Dilakukan penyaringan
Diperoleh cairan Diperoleh padatan
Ditambahkan enzim glukoamilase 1,1 µL/g berat kering onggok, pH 4,5 di inkubasi dalam shaker inkubator T 60°C dengan goyangan200 rpm
selama 24 jam
26
E. Pengamatan
Pengamatan dilakukan terhadap filtrat dan residu hasil hidrolisis onggok. Filtrat dianalisis gula reduksinya, sedangkan residunya yang telah dikeringkan dianalisis
kadar serat kasar dan pati.
1. Analisis Gula Reduksi Dengan Metode Nelson–Somogyi 1.1. Penyiapan kurva standar
Larutan glukosa standar dibuat dengan melarutkan 10 mg glukosa anhidrat dalam 100 mL aquades dan dilakukan 6 pengenceran sehingga diperoleh larutan glukosa dengan konsentrasi sebanyak 2, 4, 6, 8, dan 10 mg/100 mL. Tabung reaksi yang
bersih sebanyak 5 tabung reaksi disiapkan, masing-masing diisi dengan 1 mL larutan glukosa standar tersebut di atas. Satu tabung diisi 1 mL air suling sebagai
blanko, ditambahkan ke dalam masing-masing tabung di atas 1 mL reagensia Nelson, dan dipanaskan semua tabung pada penangas air mendidih selama 20 menit. Ambil semua tabung dan didinginkan bersama-sama dalam gelas piala
yang berisi air dingin sehingga suhu tabung mencapai 25°C. Setelah dingin 1 mL reagensia Arsenomolybdat ditambahkan dan dikocok sampai semua endapan
CuSO4 yang ada larut kembali. Setelah semua endapan CuSO4larut sempurna, 7 mL air suling ditambahkan ke dalam tabung tersebut dan kocok sampai homogen. Absorbansi masing-masing larutan tersebut ditera pada panjang gelombang 540
27
1.2. Penentuan kadar gula reduksi pada contoh
Larutan contoh yang mempunyai kadar gula reduksi sekitar 2 - 8 mg/100mL disiapkan. Pada contoh harus jernih, karena bila dijumpai larutan contoh yang
keruh atau berwarna, perlu dilakukan penjernihan terlebih dahulu dengan menggunakan Pb-asetat atau bubur Aluminium hidroksida. Larutan contoh yang jernih tersebut diambil sebanyak 1 mL dan dimasukkan ke dalam tabung reaksi
yang bersih. Reagensia Nelson sebanyak 1 mL ditambahkan kedalam tabung tersebut dan selanjutnya diperlakukan seperti pada penyiapan kurva standar di
atas. Jumlah gula reduksi dapat ditentukan berdasarkan OD larutan contoh dan dimasukkan pada kurva standar larutan glukosa.
1.3. Cara pembuatan reagensia 1. Reagensia Nelson
Reagensia Nelson A dapat dibuat dengan melarutkan 12,5 gram Natrium karbonat anhidrat, 12,5 gram garam rochelle, 10 gram natrium bikarbonat dan 100 gram
natrium sulfat anhidrat dalam 350 mL air suling. Kemudian diencerkan sampai 500 mL. Reagensia Nelson B dibuat dengan cara dilarutkan 7,5 gram CuSO4.
5H2O dalam 50 mL air suling dan ditambahkan 1 tetes asam sulfat pekat. Reagensia Nelson dibuat dengan cara dicampur 25 bagian Reagensia Nelson A dan 1 bagian Reagensia Nelson B. Pencampuran dikerjakan pada setiap hari akan
digunakan.
2. Reagensia Arsenomolybdat
Sebanyak 25 gram Ammonium molybdat dilarutkan dalam 450 mL air suling dan
28
lain 3 gram Na2HASO4. 7H2O dalam 25 mL air suling. Larutan dituang ke dalam
larutan yang pertama disimpan ke dalam botol berwarna coklat dan diinkubasi pada suhu 37°C selama 24 jam. Reagensia ini baru dapat digunakan setelah masa
inkubasi tersebut, reagensia ini berwarna kuning.
2. Analisis Kadar Serat Kasar
Sebanyak 3 gram bahan kering ditimbang dan dimasukkan ke dalam erlenmeyer
500 mL. Larutan H2SO41,25% ditambahkan 100 mL, kemudian didihkan selama 30 menit dengan menggunakan pendingin balik. NaOH 3,25% ditambahkan 200 mL dan didihkan selama 30 menit dengan menggunakan pendingin balik. Dalam
keadaan panas, campuran tersebut disaring dengan corong Bucher yang berisi kertas saring tak berabu Whatman No.1 yang telah dikeringkan dan diketahui
bobotnya. Endapan yang terdapat di dalam kertas saring dicuci dengan larutan H2SO4 1,25% panas, air panas, dan etanol 96%. Kertas saring beserta isinya diangkat, dikeringkan pada oven dengan suhu 105°C selama 2 jam lalu
didinginkan dalam desikator. Kertas saring beserta isinya ditimbang bobotnya. Selanjutnya, kertas saring tersebut diabukan, didinginkan dalam desikator dan
ditimbang bobotnya (SNI 01-2891, 1992). Kadar serat kasar ditentukan dalam rumus:
% 100 x bc
x z j Seratkasar
keterangan:
j : bobot endapan pada kertas saring setelah dioven (gram) z : bobot abu (gram)
29
3. Analisis Pati
Sampel sebanyak 3 gram dimasukkan dalam Erlenmayer 500 mL, ditambahkan 200 mL larutan HCL 3 % dan beberapa batu didih, didihkan selama 3 jam dengan
menggunakan pendingin balik dan ditambahkan 2 - 3 tetes indikator pp. Larutan NaOH 30 % didinginkan dan dinetralkan ± pH 7 lalu ditambahkan 1 tetes asam asetat 3% agar suasana larutan sedikit asam. Isi erlenmeyer dipindahkan ke dalam
labu ukur 500 mL dan ditambahkan aquades hingga tanda tera. Penyaringan dilakukan dan dipipet 10 mL ke dalam Erlenmeyer 500 mL, ditambahkan 25 mL
larutan luff (dengan pipet) dan beberapa batu didih serta 15 mL aquades, dididihkan selama 10 menit dengan menggunakan pendingin balik (dihitung dari saat mendidih dan digunakan stopwatch), kemudian didinginkan dengan bak berisis es. Selanjunya, ditambahkan 15 mL larutan KI 20% dan 25 mL H2SO4 25 % perlahan-lahan dan dititrasi dengan larutan tio 0,1 N (dengan penunjuk larutan
kanji 0.5 %). Blanko dikerjakan seperti diatas tetapi tanpa menambahkan sampel. Berat glukosa dikalikan 0,9 merupakan berat pati (SNI 01-2891, 1992).
Perhitungan :
Y x fp x 0,95
Kadar pati (%) = x 100%
bc Keterangan :
Y : glukosa yang diperoleh dari glukosa standar fp : faktor pengenceran
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan penelitian yang telah dilaksanakan, diperoleh kesimpulan sebagai
berikut:
1. Konsentrasi enzim selulase yang menghasilkan kadar gula reduksi tertinggi
(32,19 mg/100mL) yaitu 25 FPU.
2. Konsentrasi enzim α-amilase dan glukoamilase yang menghasilkan kadar gula reduksi tertinggi (62.21 mg/100 mL) yaitu secara berturut-turut 1,15 µL/g
berat kering onggok dan 1,1 µL/g berat kering onggok.
B. Saran
Disarankan untuk melakukan penelitian selanjutnya, dengan optimalisasi konsentrasi enzim selulase, enzim α-amilase, dan glukoamilase sehingga
DAFTAR PUSTAKA
Abbas, S., Halim dan S. T. Amidarmo. 1985. Limbah Tanaman Ubi kayu. Dalam : Monografi Limbah Pertanian. Kantor Mentri Muda Urusan Peningkatan Produksi Pangan. Jakarta.
Anonim. 1984. Pembuatan Sirup Glukosa dari Ampas Tapioka. Badan Penelitian dan Pengembangan Industri Semarang, Departemen Perindustrian. Semarang.
Anonim. 1998. Chemical Composition of Wood. University of Minnesota. http://ifbholz. ethz.ch/natureofwood/pc/ch/ch12.html. Diakses pada tanggal 31 Maret 2013.
Anonim. 2004. Fungal Glucoamylase for Starch Hydrolysis. http://www.deerland-enzymes. com. Tanggal akses 15 Mei 2014.
Anonim. 2007. Lampung Penghasil Ubi Terbesar. http://www.Lampungpost.com/ cetak/berita.php?id=2007050102063125. Diakses tanggal 29 Mei 2014.
Anonim. 2009. http://fisika.ub.ac.id/bss-ub/PDF%20FILES/BSS_285_1.pdf. Diakses pada tanggal 25 Februari 2013.
Ambriyanto, K. S,. 2010. Isolasi dan Karakterisasi Bakteri Aerob Pendegradasi Selulosa dari Serasah Daun Rumput Gajah (Pennisetum purpureum schaum). Skripsi. Institut Teknologi Sepuluh Nopember.
Arcinthya, R. R. 2007. Karakterisasi Ekstrak Kasar Amilase Isolat Bakteri Acinetobacter sp. dari Sumber Air Panas Guci Tegal. Skripsi. Fakultas Sains dan Teknik. UNSOED. Purwokerto.
Arnata I. W,. 2009. Pengembangan Alternatif Teknologi Bioproses Pembuatan Bioetanol Dari Ubi Kayu Menggunakan Trichoderma viride, Aspergillus nigerdan Saccharomyces cerevisiae. Tesis. Magister Sains pada Program Studi Teknologi Industri Pertanian. Institut Pertanian Bogor.
46
Badan Pusat Statistik. 2011. Data statistik tanaman pangan - ubi kayu. http://www.bDs.go.id/tnmn pgn.pht) ?eng=0. Diakses pada tanggal 05 Juli 2014.
Badger, P.C. 2007. Ethanol from cellulose : A general review. P 17-21 In : J. Janick and A. Whipkey (eds) Trenin new crop and new uses. ASHS Press, Alexandria, VA., USA.
BeMiler, J, Kelly, Srinivasan, Kirk, and Owen. 2008. Carbohydrate. Fennema’s Food Chemistry Fourth Edition. London.
British Nutrition Foundation. 1990. Complex Carbohydrates in Foods. The Repoort of The British Nutrition Foundation’s Task Force. Chapman & Hall, London: 23-32.
Chardialani, A. 2008. Studi Pemanfaatan Onggok Sebagai Bioimmobilizer Mikrooerganisme Dalam Produksi Biogas Dari Limbah Cair Industri Tapioka. Skripsi. Universitas Lampung. Bandar Lampung.
Chotineeranat, S., Pradistsuwana, C., Siritheerasas, P., and Tantratian, S. 2004. Reducing sugar production from cassava pulp using enzymes and ultrafiltration I: enzymatic hydrolyzation. J. Sci. Res. Chula. Univ., Vol. 29, No.2.
Dewan Standarisasi Nasional Indonesia. 1992. SNI 01-2891-1992 Cara Uji Makanan dan Minuman. Jakarta. 3-23 hlm.
Djarwati dan Sukani. 1993. Pengolahan Air Limbah Industri Tapioka Secara Kimia Fisika. Laporan Penelitian. Departemen Perindustrian RI. Semarang.
Fahmi, N. 2008. Pengolahan Tapioka Secara Industri. http://digilib.unimus.ac.id /files/106jtptunimus-gdl-nurulfahmi-52563.pdf. Diakses tanggal 25 Februari 2013.
Fengel, D. and G. Wengener. 1995. Kayu. Kimia, Ultrastruktur, Reaksi-reaksi. Diterjemahkan oleh Hadjono Sastrohamidjojo. Gadjah Mada University Press Cetakan Pertama. Yogykarta.
Forgaty, M. 1983. Microbial Enzymes and Biotechnology. Appl. Sci. Publ., London.
Gunam, I. W. B., I. M. Wartini, A. A. M. D. Anggreni, P. M. Suparyana. 2011. Delignifikasi ampas tebu dengan larutan natrium hidroksida sebelum proses sakaraifikasi secara enzimatis menggunakan enzim selulase kasar dariAspergillus nigerFNU 6018.J. Teknologi Indonesia, Vol. 34.
47
Ikram-ul-haq., M. M. Javed., T. S. Khan., and Z. Siddiq. 2005. Cotton saccharifying activity of cellulases produced by co-culture of Aspergillus nigerandTrichoderma viride. Res.J. Agric & Biol. Sci. 1(3): 241-245. Jane, J. L. and J. F. Chen. 1992. Effect of amylose molecular size and
amylopectin branch chain length on paste properties of starch. J. Cerea Chem.69 (1): 60-65.
Kambong, H. 2004. Evaluasi Daya Hidrolitik Enzim Glukoamilase Dari Filtrat Kultur Aspergillus niger. http://www.mipa.unej.ac.id/data/vol5no1/ hermin.pdf. Diakses pada tanggal 6 April 2013.
Kearsley, M.W. and Dziedzic. 1995. Handbook of Starch Hydrolysis Product and Their Derivates. Blackie Academic and Professional. London.
Kementrian Lingkungan Hidup. 2009. Pedoman Pengelolaan Limbah Industri Pengolahan Tapioka. Kementrian Negara Lingkungan Hidup RI. Jakarta. Kunamneni, A., Permaul, K., dan Singh, S. 2005. Amylase production in solid
state fermentation by the thermophilic fungus Thermomyces lanuginosus, Journal of Bioscience and Bioengineering.Vol. 100 (2): 168-171.
Lamiya dan Mareta. 2010. Penyiapan Bahan Baku dalam Proses Fermentasi untuk Pakan Ternak. http:// eprints.undip.ac.id/11310/1/Laporan_final_Lamiya %26Mareta.pdf. Diakses pada tanggal 30 April 2013.
Lehninger, A.L. 1997. Dasar-dasar Biokimia. Jilid I. Alih Bahasa: Maggy Thenawidjaja. Erlangga. Jakarta.
Lynd, L.R., Weimer, P.J., Van-Zyl, W.H., and Pretorius, I.S. 2002. Microbial cellulose utilization: Fundamentals and biotechnology. Microbiol. Mol. Biol. Rev. 66(3): 506-577.
Mahartantri, L., 2005. Pembuatan Glukosa Kasar dari Pati Beberapa Varietas/Klon Ubi Jalar (Ipomea batatas l.) Secara Hidrolisis Enzimatis. Skripsi. Jurusan Teknologi Hasil Pertanian. Unibraw.
Mandels, M., Andreotti R.E., and Roche C. 1987. Measurement of cellulase activities. applied chemistry division commission on biotechnology. J. Pure & Appl. Chem., Vol. 59, No. 2, pp 257—268.
Mangunwidjaja, D dan Suryani.A. 1994. Technology Bioproses, Penebar Swadaya, Jakarta.
48
Muljono, J.R., E. Gumbira_Sa’id, Hartoto. 1989. Biokonversi. Pusat Antar Universitas Bioteknologi IPB. Bogor. 243 hlm.
Nevell, T.P., and S.H. Zeronian. 1985. Cellulose Chemistry and Its Applications. Ellis Herwood United. Chicester.
Nurdianti, F. 2007. Evaluasi Aktivitas Enzim Glukoamilase dari Aspergillus oryzaeDengan Ubi Jalar dan Ubi Kayu Sebagai Substrat. Skripsi. Fakultas Sains dan Teknik Jurusan MIPA. Universitas Jenderal Soedirman. Purwokerto.
Nurhayati., O. Sjofjan., dan Koentjoko. 2006. Kualitas nutrisi campuran bungkil inti sawit dan onggok yang difermentasi menggunakan Aspergillus niger. J.indon.trop.anim.agric. 31 [3].
Poedjiadi, A. 1994. Dasar-dasar Biokimia (Edisi Revisi). UI Press. Jakarta. 476 hlm.
Prayati, P.U. 2005. Mempelajari Proses Penanganan Limbah Cair dan Limbah Padat Tapioka di PT. Umas Jaya Agrotama Lampung Tengah. Laporan Praktik Umum. Fakultas Pertanian. Universitas Lampung.
Retnowati, D.,dan R. Utanti, R. 2009. Pemanfaatan Limbah Padat Ampas Singkong dan Lindur Sebagai Bahan Baku Pembuatan Etanol. Makalah Penelitian. Universitas Diponegoro. Semarang. hlm: 2-3.
Samsuri, M., Gozan, M., Prasetya, B., and Nasikin. 2009. Enzymatic hydrolysis of lignocellulosic baggase for bioethanol production. Journal of Biotechnology Research in Tropical Region. Vol. 2, No. 2.
Silaputri, F. 2011. Produksi Glukosa Dari Onggok Singkong Dengan Optimasi Konsentrasi Enzim Selulase. Skripsi. Fakultas Pertanian. Universitas Lampung. 63 hlm.
Sivaramakrishnan, S. Gangadaran, D. Nampoothiri, K. M. Soccol, C. R. Pandey, A. 2006. α-Amylase from microbial sources – An overview on recent developments. J. Food Technology and Biotechnology. Vol. 44 (2), 173– 184.
Soenardi, B. S. F. 1976. Sifat-sifat Kimia Kayu. Cetakan ke-8. Yayasan Pembina Fakultas Kehutanan. Universitas Gajah Mada. Yogyakarta. 58 hlm.
49
Srinorakutara, T., C. Suesat., and B. Pitiyont. 2006. Approach of cassava waste pretreatments for fuel ethanol production in Thailand. Thailand Institute of Scientific and Technological Research (TISTR). Bangkok, Thailand. J. Sci. Res. Chula. Univ.,Vol. 31, No. 1.
Sudarmadji, S., Bambang, H., dan Suhardi. 1984. Prosedur Analisa untuk Bahan Makanan dan Pertanian edisi ketiga. Liberty. Yogyakarta. 137 hlm.
Supriyati. 2003. Onggok terfermentasi dan pemanfaatannya dalam ransum ayam ras pedaging.JITV8(3): 146-150.
Suriadi. 1985. Mempelajari Pengaruh Dosis Enzim Alfa Amilase dan Amiloglukosidase Pada Proses Pembuatan Sirup Glukosa dari Tepung Talas (Colocasia esculeenta(L) Schott). Skripsi. IPB. Bogor.
Taherzadeh, M.J., and Karimi, K. 2007. Acid-based hydrolysis processes for ethanol from lignocellulosic materials : A review. BioResources 2 (3) : 472-499.
Tarmudji. 2009. Onggok Lampung. http://onggok lampung.multiply.com/journal. Diakses pada tanggal 25 Februari 2013.
Teugjas, H. and Valjamae, P. 2013. Product inhibition of cellulases studied with14 C-labeled cellulose substrates.J. Biotechnology for Biofuels. Vol:6. Hal:104.
Tjiptadi. 1982. Telaah Pembuatan Glukosa dan Sifat Limbah Cairnya dengan Bahan Ubi Kayu secara Hidrolisa Asam dalam Rangka Meningkatkan Teknik Pengolahannya. Tesis. Program Pascasarjana, Institut Pertanian Bogor. Bogor. 152 hlm.
Tjokroadikoesoemo, P. S. 1986. HFS dari Industri Ubi Kayu dan Lainnya. Gramedia. Jakarta. 229 hlm.
Usman, M. 2011. Evaluasi Kinerja Cigar (Covered in the Ground Anaerobic Reactor) Di Industri Tapioka Rakyat. Skripsi. Fakultas Pertanian. Universitas Lampung.
Winarno, F.G dan Fardianz, S. 1984. Biofermentasi dan Biosintesa Protein. Penerbit Angkasa. Bandung.
Whitaker, J.R. 1996. Enzymes. Di dalam O.R. Fennema (ed). Food Chemistry. Third edition. Marcell Dekker, Inc., New York and Basel.
Winarno, F.G. 1997. Kimia Pangan dan Gizi. PT. Gramedia Pustaka Utama. Jakarta. 253 hlm.
50
Woiciechowski, A. L., Nitsche, S., Pandey, A., Ricardo, C., 2002. Acid and enzymatic hydrolysis to recover reducing sugars from cassava bagasse: an economic study.J. Braz. Arch. Biol. Technol.45, 393-400.
Xiao Z, Zhang X, Gregg DJ and Saddler JN. 2004. Effects of sugar inhibition on cellulases and beta-glucosidase during enzymatic hydrolysis of softwood substrates.J. Biochem Biotechnol. Vol:26. Hal 113-116.
Yunianta, T. Sulistyo, Apriliastuti, T. Estiasih, S. N. Wulan. 2010. Hidrolisis secara sinergis pati garut (Marantha arundinaceae L.) oleh enzim α -amilase, gluko-amilase, dan pullulanase untuk produksi sirup glukosa. J. Teknologi PertanianVol. 11 (2) : 78–86.